Bài viết QUẢN LÝ HUYẾT ĐỘNG TRONG CẤP CỨU THẦN KINH – tải file PDF Tại đây.
Tác giả: Ths. BS Hồ Hoàng Kim
Giới thiệu
Các trường hợp khẩn cấp về thần kinh là phổ biến và thường xuyên tàn phế. Ở Châu Âu, hàng triệu người mỗi năm bị tổn thương thần kinh trung ương cấp tính, hoặc chấn thương hoặc không chấn thương, với tỷ lệ tử vong đáng kể và tàn tật lâu dài [1]. Mục tiêu chính của điều trị y khoa trong các trường hợp khẩn cấp cứu thần kinh là ngăn ngừa sự phát triển của các tổn thương não thứ phát [2]. Trong bối cảnh này, quản lý huyết động tối ưu là rất quan trọng để tối ưu hóa quá trình tưới máu não và oxy. Lựa chọn cẩn thận liệu pháp truyền dịch và điều chỉnh huyết áp là nền tảng của liệu pháp điều trị ở bệnh nhân tổn thương não cấp tính. Trong chương này, chúng tôi sẽ xem xét các bằng chứng sinh lý học, các hướng dẫn hiện tại và các điều tra lâm sàng gần đây nhất về quản lý dịch và huyết động học ở những bệnh nhân bị bệnh thần kinh.
Quản lý dịch truyền
Ngày càng nhiều tài liệu cho thấy việc quản lý dịch truyền thường quy có thể ảnh hưởng đến kết quả lâm sàng ở những bệnh nhân bị bệnh nặng nói chung [3]. Hầu hết các tài liệu hiện tại về quản lý dịch truyền ở bệnh nhân tổn thương não tập trung vào SAH và TBI. Tuy nhiên, bác sĩ lâm sàng không nên đánh giá thấp tầm quan trọng của việc quản lý dịch truyền thích hợp trong các trường hợp cấp cứu thần kinh khác, chẳng hạn như đột quỵ hoặc tổn thương não sau thiếu oxy. Những bệnh nhân chấn thương sọ não có một số đặc điểm khác biệt so với những bệnh nhân nặng nói chung. Thứ nhất, khoang sọ có cấu trúc giới hạn đặc thù về thể tích, hạn chế rất nhiều để phù nề được phép diễn ra mà không ảnh hưởng đến chức năng cơ quan. Thứ hai, do cấu trúc hàng rào máu não chuyên biệt, ở những bệnh nhân bị bệnh nặng về thần kinh, tác dụng cục bộ của dịch truyền có tầm quan trọng lớn hơn nhiều so với tuần hoàn hệ thống ngoại vi. Thứ ba, rối loạn điện giải và thẩm thấu liên quan đến tổn thương chính yếu ban đầu và việc sử dụng liệu pháp tăng thẩm thấu có thể ảnh hưởng đáng kể đến sự chuyển dịch dịch từ trong lòng mạch sang khoang kẽ nhu mô não và tác động lên huyết động não.
Các xem xét khía cạnh sinh lý bệnh.
Huyết tương và dịch kẽ nhu não và dịch não tủy (CSF) có độ thẩm thấu ngang nhau trong các điều kiện sinh lý (tức là 288 ± 5 mOsmol/ kg). Trong tuần hoàn não, nước và chất tan chuyển từ nội mạch ra ngoại mạch được điều hòa bởi hàng rào máu não (BBB). Đơn vị cơ bản BBB góp phần tạo nên cái gọi là đơn vị mạch máu thần kinh, bao gồm các tế bào nội mô mạch máu não, các tế bào màng xung quanh, lớp màng đáy, tế bào hình sao quanh mạch và các tế bào thần kinh chức năng [4]. Nước có thể di chuyển tự do qua BBB, nhưng các điểm nối chặt chẽ giữa các tế bào nội mô ngăn cản sự di chuyển của chất tan, trái ngược với những gì xảy ra trong tuần hoàn ngoại vi. Do đó, trong tuần hoàn ngoại vi hệ thống, động lực chính để di chuyển nước qua thành mao mạch là áp suất thủy tĩnh, các chuyển động ròng của nước trong não xảy ra chủ yếu để đáp ứng với sự khác biệt về thẩm thấu qua BBB. Cơ chế như vậy được cho là để ngăn ngừa sự hình thành phù nề trong trường hợp thay đổi thể tích nội mạch và làm cho việc truyền một lượng lớn dịch đẳng trương (có độ thẩm thấu tương đương với huyết tương) có thể thực hiện được mà không ảnh hưởng đến cân bằng nội môi của não [5]. Tuy nhiên, điều này khiến não bị dịch chuyển nước đột ngột trong trường hợp truyền dịch không đẳng trương. Cụ thể, dịch nhược trương gây ra sự dịch chuyển nước từ không gian nội mạch sang không gian kẽ – từ đó cân bằng với không gian nội bào – trong khi dịch ưu trương gây ra sự dịch chuyển nước từ não (cả không gian nội bào và mô kẽ) đến khoang nội mạch, để tái tạo cân bằng gradient thẩm thấu. Gradient thẩm thấu được phục hồi trong vài phút, nhưng thời gian cân bằng 1/2 thay đổi tùy thuộc vào tỷ lệ mao mạch: mô, tính toàn vẹn của BBB và các đặc điểm của dịch nhược trương hoặc ưu trương. Mặc dù cơ chế này có thể có lợi trong các điều kiện cụ thể (đặc biệt là trong trường hợp dùng liệu pháp tăng thẩm thấu do tăng huyết áp nội sọ), nên tránh những thay đổi cấp tính về nồng độ thẩm thấu bất cứ khi nào có thể [6]. Tế bào thần kinh đệm và tế bào thần kinh có thể chủ động bù trừ dịch chuyển nước tự do do dao động lực keo huyết tương và bình thường hóa thể tích nội bào, nhưng cơ chế này phụ thuộc năng lượng và khả năng bù đắp hạn chế. Hơn nữa, không thể dễ dàng xác định được tính toàn vẹn về giải phẫu và chức năng của BBB ở bệnh nhân chấn thương não: trong trường hợp hàng rào máu não bị phá vỡ hoặc suy giảm nguồn năng lượng của não, khả năng duy trì cân bằng nội môi dịch và điện giải bị tổn hại.
Tiêu điểm.
Sự xuất hiện của phù trong não có thể được phân loại dựa trên cơ chế nội môi thất bại: trong trường hợp suy giảm ATP và / hoặc rối loạn chức năng ty thể, nước và chất hòa tan chuyển vào tế bào, do đó xác định phù trong tế bào thần kinh và tế bào hình sao (phù nhiễm độc tế bào); Sự phá vỡ các điểm nối chặt chẽ của nội mạc dẫn đến sự chuyển dịch nước và chất tan từ khoảng không gian trong lòng mạch đến các khoang kẽ (phù mạch máu). Sự kết hợp của hai cơ chế này dẫn đến phù ion hóa: trong trường hợp phù do nhiễm độc tế bào, giảm thẩm thấu ở mô kẽ quyết định sự bù trừ sự dịch chuyển chất tan và nước chuyển từ khoang mạch đến mô kẽ qua BBB nguyên vẹn.
=> Đọc thêm: Hướng dẫn xử trí Chấn thương sọ não (TBI) và tăng áp lực nội sọ (ICP).
Dịch truyền trong thực hành lâm sàng
Có sự đồng thuận rộng rãi rằng một thể tích nội mạch đủ để duy trì tưới máu não và cung cấp oxy đầy đủ nên được cung cấp trong giai đoạn cấp tính của tổn thương não. Đồng thời, cần chú ý đến số lượng và đặc điểm vật lý của dịch truyền.
Nhiều bao nhiêu?
Nói chung, nhắm mục tiêu giảm thể tích tuần hoàn được khuyến cáo trong các trường hợp cấp cứu về thần kinh. Suy giảm thể tích nội mạch thường gặp trong đột quỵ cấp tính, đặc biệt ở bệnh nhân người lớn tuổi [7]. Các hướng dẫn của Hiệp hội Tim mạch Hoa Kỳ/ Hiệp hội Đột quỵ Hoa Kỳ (AHA/ ASA) khuyến cáo điều chỉnh tình trạng giảm thể tích tuần hoàn ở bệnh nhân đột quỵ do thiếu máu cục bộ cấp tính bất kể sự hiện diện của tình trạng phù não [8]. Quản lý dịch truyền của bệnh nhân xuất huyết trong nhu mô (IPH) và chấn thương sọ não (TBI) không được thảo luận trong các hướng dẫn gần đây nhất của AHA/ ASA và Tổ chức Chấn thương Não, ngoại trừ trường hợp cần điều trị tăng áp lực thẩm thấu [8, 9]. Các hướng dẫn hiện hành đặc biệt khuyến cáo để đảm bảo tưới máu cơ quan và não đầy đủ trong các chấn thương tủy sống và hội chứng sau ngừng tim [10, 11]. Trong xuất huyết dưới nhện (SAH), tăng thể tích tuần hoàn là một phần của liệu pháp tăng huyết động truyền thống (hoặc liệu pháp triple-H), bao gồm làm loãng máu, mở rộng thể tích (“tăng thể tích máu”) và tăng huyết áp [12]. Chiến lược này được cho là làm tăng CBF thông qua các cơ chế khác nhau, chủ yếu là tăng cung lượng tim và huyết áp động mạch thông qua các thay đổi trong lưu biến máu. Hiệu quả của liệu pháp Triple- H đã bị nghi ngờ bởi các tài liệu gần đây trên cơ sở góc nhìn sinh lý học (pha loãng máu dẫn đến giảm hematocrit, do đó giảm khả năng cung cấp oxy), quan sát lâm sàng (mở rộng thể tích góp phần tăng huyết áp một cách khiêm tốn so với thuốc vận mạch được sử dụng) và quan sát tỷ lệ biến chứng cao hơn ở những bệnh nhân được điều trị bằng phương pháp mở rộng thể tích “siêu bình thường” [13, 14]. Các hướng dẫn của AHA/ ASA khuyến cáo rằng nên tránh mở rộng (tăng) thể tích bất thường ở bệnh nhân SAH, đặc biệt là trong trường hợp không có chứng co thắt mạch được chẩn đoán [15], và Hiệp hội Chăm sóc tích cực thần kinh khuyên không nên sử dụng tích cực dịch truyền trong SAH, bất kể sự hiện diện của co thắt mạch [ 16]. Do đó, duy trì thể tích máu và gây tăng huyết áp là chiến lược ưu tiên hiện nay trong trường hợp SAH phức tạp do thiếu máu não chậm (DCI) [17]. Thật không may, các chỉ dẫn chính xác về cách quản lý bệnh nhân bị bệnh thần kinh sau vài giờ đầu còn thiếu. Các mô hình được nghiên cứu nhiều nhất là SAH và TBI, nơi kết quả từ các nghiên cứu tiền cứu và hồi cứu mâu thuẫn nhau và cân bằng dịch cả dương tính và âm tính đều có liên quan đến kết quả xấu hơn.
Thành phần dịch
Các dịch tinh thể đẳng trương thường được khuyến cáo để duy trì và quản lý huyết động ở bệnh nhân chấn thương não cấp tính [8, 15, 16]. Một số hướng dẫn [15] khuyên rõ ràng không nên sử dụng các dịch truyền nhược trương. Tuy nhiên, định nghĩa đẳng trương cần phải phân tích sâu. Các định nghĩa đúng về độ thẩm thấu, độ thẩm thấu và trương lực nên được áp dụng cho thành phần dịch truyền: “độ thẩm thấu – osmolarity” biểu thị tổng của tất cả các hạt có khả năng phân ly (tính bằng mOsmol/ L); “Osmolality” đại diện cho số chất tan có hoạt động thẩm thấu (tính bằng mOsmol/ kg); “Tonicity – trương lực” là số đo của gradient áp suất thẩm thấu giữa hai dung dịch. Trương lực dịch là một chức năng của độ thẩm thấu và, không giống như độ thẩm thấu, chỉ bị ảnh hưởng bởi các chất hòa tan không thể vượt qua màng nội mô (tức là đối với não, BBB). Do đó, các biến liên quan về mặt lâm sàng là độ thẩm thấu và trương lực chứ không phải tính thẩm thấu: ví dụ, các dung dịch “iso-osmolar” có thể có trương lực khác nhau (Bảng 35.1). Một loại dịch có thể được coi là đẳng trương khi độ thẩm thấu của nó tiếp cận với chất được đo vào huyết tương; do đó nó không xác định sự chuyển dịch của nước vào hoặc ra não ngay cả khi được sử dụng với một lượng lớn. Dịch đẳng trương được thương mại hóa dưới dạng dung dịch muối (NaCl 0,9%) hoặc dung dịch “cân bằng”, ở đó sự cân bằng được thấy ở thành phần điện giải gần với huyết tương [18]. Trong SAH, việc sử dụng các dung dịch cân bằng hơn không thua kém việc sử dụng NaCl 0,9% trong việc tránh hạ natri máu và giảm tính thẩm thấu của huyết tương [19]. Ringer’s lactate và Ringer’s acetate là nhược trương ngay cả khi độ thẩm thấu của chúng gần với độ thẩm thấu của huyết tương; do đó nên tránh dùng chúng ở những bệnh nhân bị chấn thương sọ não cấp tính. Dung dịch dextrose là chất đẳng trương trong ống nghiệm nhưng nhược trương sau khi được truyền, vì glucose sẽ được chuyển hóa nhanh chóng, do đó cũng nên tránh dùng ở bệnh nhân chấn thương não. Các dung môi ưu trương thường được dành để điều trị cấp cứu tăng áp lực nội sọ cấp tính. Chất keo tổng hợp có thể đẳng trương (ví dụ Tetraspan 6%), nhược trương (ví dụ Gelafundin 4%) hoặc hơi ưu trương (ví dụ HES 6%). Dung dịch albumin người có nồng độ thấp (ví dụ: dung dịch albumin 4% và 5%) có tính nhược trương. Cơ sở lý luận của việc sử dụng chất keo ở bệnh nhân chấn thương não nằm ở sự thật là protein huyết tương đóng góp tới 80% vào áp suất thẩm thấu. Tuy nhiên, tính toàn vẹn của BBB phải được giả định để chất keo phát huy tác dụng của chúng. Hơn nữa, không nên bỏ qua sự khác biệt về trương lực giữa các chất tinh thể và chất keo cụ thể. Trong nghiên cứu SAFE [20], ví dụ, NaCl 0,9% và dung dịch albumin người 4% được so sánh trong một nhóm nhỏ bệnh nhân TBI, và việc sử dụng chất keo có liên quan đến kết quả tồi tệ hơn trong 28 ngày. Tuy nhiên, albumin của người 4% là nhược trương so với huyết tương; do đó kết quả này nên được hiểu là một hiệu ứng tiêu cực do dịch truyền gây ra hơn là so sánh giữa chất tinh thể và chất keo. Do đó, albumin cũng có liên quan đến việc cải thiện kết cục hoặc không có thêm các tác dụng phụ sau SAH hoặc đột quỵ do thiếu máu cục bộ [21-23]. Một số nghiên cứu lâm sàng điều tra các liệu pháp điều trị dịch truyền khác nhau trong các tình trạng thần kinh cấp tính hiện đã được đăng ký 7 nghiên cứu trên clinicaltrials.gov và sẽ cung cấp thêm các phát hiện chất lượng cao về vấn đề này trong tương lai tiếp theo.
Quản lý huyết áp
Quản lý huyết áp (HA) trong các trường hợp cấp cứu về thần kinh là một thách thức: cả HA quá mức và dưới mức điều chỉnh đều có liên quan đến việc tăng tỷ lệ mắc bệnh và tử vong sau TBI [24]. Các hướng dẫn hiện tại dựa trên một số nghiên cứu lâm sàng ngẫu nhiên và ý kiến chuyên gia. Dựa trên quan sát lâm sàng, có thể xác định hai giai đoạn liên quan đến quản lý HA sau chấn thương sọ não cấp tính: giai đoạn sớm, cấp cứu (từ vài phút đến vài giờ sau chấn thương) và giai đoạn chăm sóc đặc biệt (từ vài giờ đến vài ngày sau đó). Ngay sau khi xảy ra biến cố thần kinh, quản lý HA cần tính đến sinh lý bệnh của hệ thần kinh trung ương và loại tổn thương: ví dụ, ở những bệnh nhân xuất huyết nội sọ (ICH) và xuất huyết dưới nhện do phình động mạch (SAH), cần chú ý để ngăn ngừa sự tiến triển của xuất huyết; ở những bệnh nhân bị đột quỵ do thiếu máu cục bộ cấp tính (AIS), cần đảm bảo tưới máu cho vùng xám có nguy cơ thiếu máu cục bộ đồng thời tính đến nguy cơ chuyển dạng xuất huyết, đặc biệt là sau khi tiêm thuốc tiêu sợi huyết tĩnh mạch; ở bệnh nhân TBI và hội chứng sau ngừng tim, việc điều chỉnh HA cần tập trung vào việc đảm bảo tưới máu não đầy đủ vì phù não sớm hình thành. Một khi tổn thương nội sọ tương đối ổn định, việc quản lý HA cần tập trung vào việc tìm kiếm sự cân bằng thích hợp giữa nguy cơ giảm tưới máu (và thiếu máu cục bộ sau đó) và nguy cơ ứ huyết và tổn thương hàng rào máu não và tế bào sau đó.
Các xem xét các sinh lý bệnh
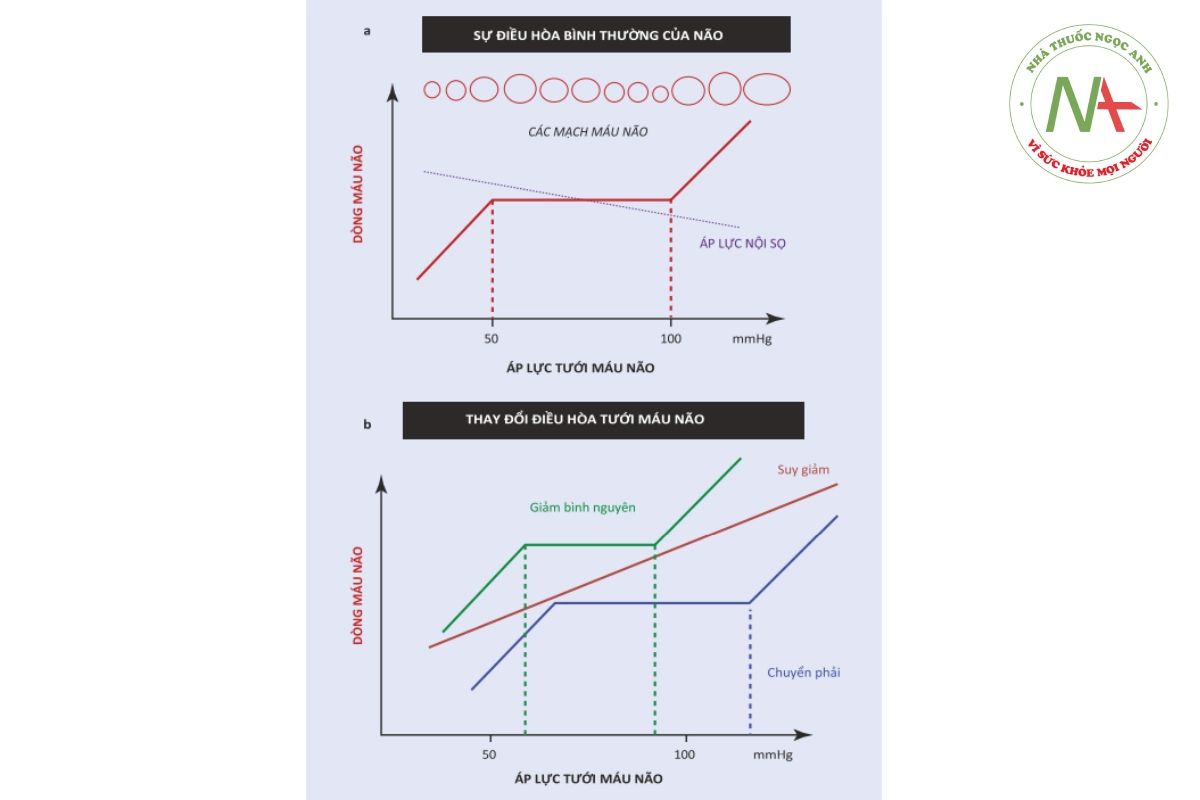
Áp lực tưới máu não (CPP) được xác định bằng chênh áp lực qua tuần hoàn não (AP) và sức cản (R) qua giường mạch não theo phương trình: CPP = AP / R. Độ chênh áp suất được định nghĩa là huyết áp động mạch trung bình (MAP) – áp lực nội sọ (ICP) hoặc MAP – áp lực tĩnh mạch cảnh (JVP), tùy theo giá trị nào cao hơn. Đối với các mục đích thực tế, khi ICP và JVP nằm trong phạm vi sinh lý, CPP được coi là tương đương với MAP. Theo phương trình Hagen-Poiseuille (R = 8pL / nr4), bán kính của mạch máu ảnh hưởng đến điện trở (R) theo hệ số bốn: những thay đổi nhỏ trong đường kính lòng mạch có ảnh hưởng lớn đến CBF [25]. Những thay đổi về đường kính của các tiểu động mạch não cỡ trung bình có thể thấy trong các tình trạng bệnh lý như co thắt mạch hoặc hẹp nội sọ: mạch co lại (giảm đường kính), do đó làm tăng R và làm suy giảm lưu lượng máu, có thể gây thiếu máu cục bộ. Ngược lại, sự giãn nở của mạch (tăng đường kính) dẫn đến tăng lưu lượng máu não (tăng ứ huyết). Tình trạng đầu tiên thường gặp sau SAH, trong khi tình trạng thứ hai thường gặp sau TBI, trong đó ứ huyết do giãn mạch không kiểm soát có thể góp phần gây phù não và ICP cao. Trong điều kiện sinh lý, kích thước của các tiểu động mạch não cỡ trung bình là không đổi, trong khi các tiểu động mạch não nhỏ có thể liên tục thay đổi đường kính của chúng. Khả năng nội tại của tiểu động mạch não làm thay đổi kích thước của chúng để duy trì lưu lượng máu não không đổi (CBF) bất chấp sự thay đổi huyết áp được gọi là “tự điều hòa não” [26]: trong trường hợp CPP tăng, các tiểu động mạch nhỏ co lại để tăng R và giữ cho tỷ số không đổi; ngược lại trong trường hợp CPP giảm, các tiểu động mạch nhỏ giãn ra để giảm sức cản (Hình 35.1a). Theo truyền thống, cơ chế này được cho là có tác dụng đối với CPP trong khoảng 50-150 mmHg: trong phạm vi này, CBF được duy trì không đổi ở khoảng 50 mL/ 100g mô não/ phút; trên và dưới giới hạn này, quá trình tự điều chỉnh bị mất và CBF trở nên phụ thuộc trực tiếp vào CPP, do đó phụ thuộc vào MAP (Hình 35.1b). Dưới giới hạn dưới của quá trình tự điều hòa não, sự giãn mạch tối đa đạt được: đối với giá trị MAP thấp hơn, các mạch nhỏ xẹp lại một cách thụ động và CBF trở nên tỷ lệ thuận với MAP. Sự sụt giảm CBF ban đầu được bù đắp bằng sự gia tăng chiết xuất oxy từ hemoglobin, nhưng đối với CBF dưới 18-20 mL/100g/ phút, cơ chế bù trừ này không thành công và xuất hiện tổn thương do thiếu máu cục bộ. Khi MAP đạt đến giới hạn trên của quá trình tự điều hòa, sự co mạch là tối đa và các mạch máu nhỏ của não không thể giảm kích thước của chúng nữa, vì vậy chúng sẽ giãn ra một cách thụ động với sự gia tăng tiếp theo của CBF và thể tích máu. Trong trường hợp suy giảm khả năng tự điều hòa của não, CBF thay đổi tuyến tính với MAP. Phạm vi hiệu quả tự điều hòa của não có thể bị ảnh hưởng bởi một số yếu tố, chẳng hạn như các bệnh đi kèm mãn tính hoặc có khả năng là sự thay đổi của từng cá nhân. Ở bệnh nhân đái tháo đường, cơ chế tự điều tiết của não thường bị suy giảm sớm trong thời gian mắc bệnh [27], trong khi ở bệnh nhân tăng huyết áp mãn tính, phạm vi hiệu quả được chuyển sang bên phải, do đó những bệnh nhân này chịu đựng tốt hơn áp lực động mạch thấp hơn [28]. Ở những bệnh nhân bị tổn thương não nghiêm trọng, đường cong tự điều hòa của não có thể bị dịch chuyển sang phải, phạm vi của MAP trong đó hiệu quả của quá trình tự điều hòa của não có thể bị giảm hoặc có thể bị mất hoàn toàn. Sự tự điều hòa của não được biết là bị suy giảm trong hầu hết các tình trạng thần kinh cấp tính, chẳng hạn như TBI, SAH, đột quỵ do thiếu máu cục bộ và hội chứng sau ngừng tim [29-31]. Mỗi bệnh nhân có thể khác nhau về đường cong cơ bản của cơ chế tự điều hòa não và tình trạng suy giảm chức năng sau chấn thương. Do đó, không có quy tắc chung nào có thể được áp dụng một cách an toàn cho mọi bệnh nhân về quản lý HA. Mỗi bệnh nhân có thể có một “CPP tối ưu”, tức là một phạm vi MAP cụ thể mà quá trình tự điều hòa ở não là hiệu quả nhất và lưu lượng máu não là tối ưu. Trong một hội nghị đồng thuận gần đây [32], tác động điều trị tiềm năng của việc điều chỉnh huyết áp động mạch đã được thảo luận nhiều.
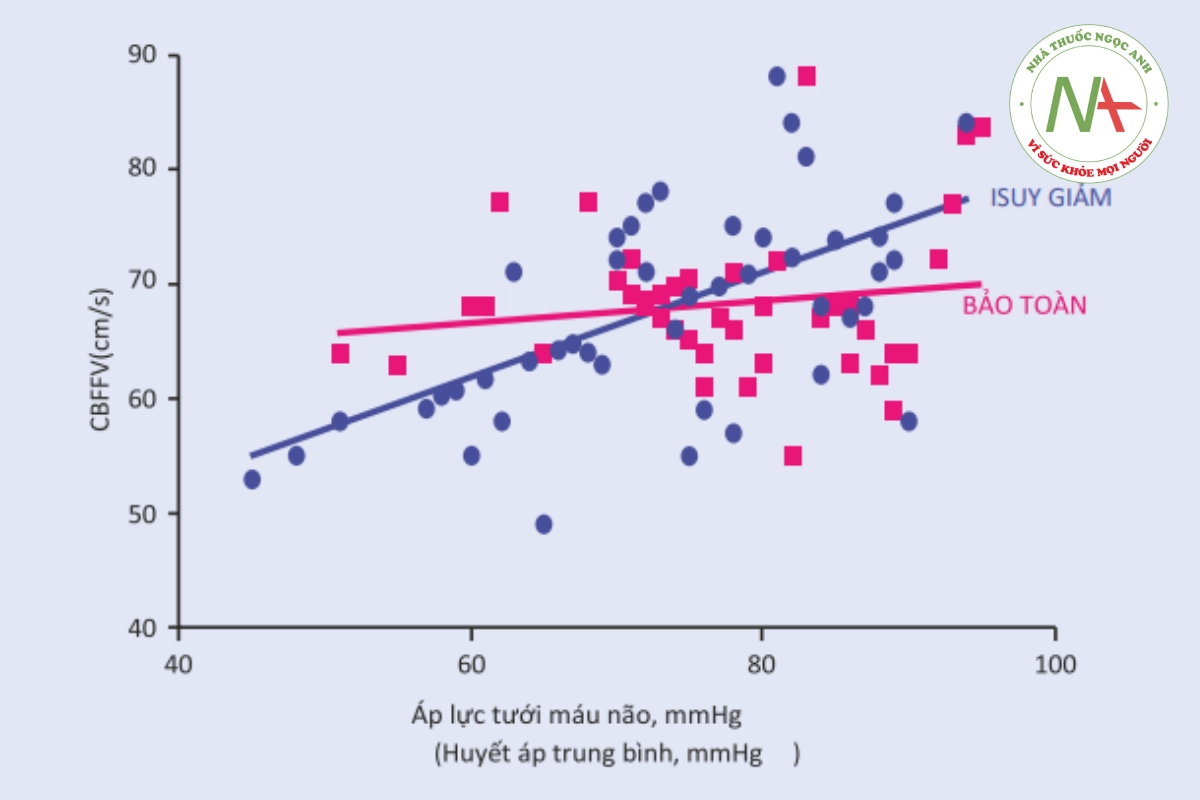
Quá trình tự điều hòa của não có thể được theo dõi tại giường theo nhiều cách. Mỗi và mọi kỹ thuật dựa trên thực tế là nếu quá trình tự điều hòa của não còn nguyên vẹn, thì CBF phải không đổi trong trường hợp có điều chỉnh trong MAP. Mối quan hệ này được phản ánh bằng hệ số tương quan giữa hai biến: nếu chúng có quan hệ trực tiếp với nhau thì hệ số tương quan là số dương; nếu chúng liên quan nghịch thì hệ số tương quan là âm; Nếu không có mối quan hệ nào giữa cả hai, hệ số tương quan là 0. Trong trường hợp tự điều chỉnh nguyên vẹn, hệ số tương quan giữa CBF và MAP phải bằng 0. Trong thực hành lâm sàng, hệ số tương quan từ âm đến 0,3 được chấp nhận là điểm đánh dấu của nguyên vẹn tự điều tiết não. Đối với hệ số tương quan trên 0,3, các điều chỉnh CBF được coi là song song với các điều chỉnh của MAP, tức là quá trình tự điều hòa của não không thành công. CBF không thể dễ dàng đo cạnh giường, nhưng có những chất thay thế có thể được sử dụng để thay thế. Ví dụ, chỉ số phản ứng áp suất (PRx) tính toán hệ số tương quan giữa MAP và ICP [32]: các điều chỉnh về kích thước mạch xác định các thay đổi tỷ lệ trong thể tích máu não, điều này được phản ánh bằng cách điều chỉnh trong ICP. Trong điều kiện sinh lý, khi MAP giảm, mạch máu não giãn ra; do đó ICP tăng lên. Trong trường hợp này PRx sẽ âm hoặc gần bằng 0 (Hình 35.2). Ngược lại, trong trường hợp tự điều hòa không hiệu quả, các sửa đổi trong ICP theo sau các điều chỉnh trong MAP và PRx là dương tính. Các nghiên cứu lâm sàng, chủ yếu ở TBI, đã khám phá những lợi ích tiềm năng của việc điều khiển MAP, đặc biệt nhắm mục tiêu PRx gần bằng 0 [33, 34]. Thao tác dựa trên PRx đối với MAP có liên quan đến kết quả thuận lợi sau TBI nặng [34]. Tuy nhiên, những kết quả đầy hứa hẹn này vẫn chưa được xác nhận một cách nhất quán và PRx cần tính toán phép đo ICP xâm lấn. Quá trình oxy hóa mô hoặc vận tốc dòng máu là những thông số thay thế sẵn có khác cho CBF [32]. Oxy mô não (PbtO2) có thể được đo trực tiếp bằng cách sử dụng một đầu dò trong nhu mô hoặc gián tiếp bằng quang phổ cận hồng ngoại (NIRS), trong khi vận tốc dòng máu (FV) trong các động mạch nội sọ có thể được đánh giá không xâm lấn bằng cách sử dụng xuyên sọ Doppler. Mối tương quan giữa MAP và PbtO2 được gọi là chỉ số phản ứng oxy (ORx); hệ số tương quan giữa CPP và FV được gọi là chỉ số dòng chảy trung bình (Mx); hệ số tương quan giữa MAP và FV được gọi là chỉ số lưu lượng động mạch trung bình (Mxa); và hệ số tương quan giữa MAP và hàm lượng oxy mô có nguồn gốc từ NIRS được gọi là chỉ số oxy hóa mô (TOx) [32]. Các chỉ số tự điều hòa của não tương quan với kết cuộc về TBI, SAH, đột quỵ do thiếu máu cục bộ và ICH [34-37]. Tuy nhiên, theo dõi quá trình tự điều hòa không nhất thiết có nghĩa là liệu pháp tốt hơn và liệu các chiến lược nhằm mục đích tối ưu hóa tưới máu não (ví dụ: liệu pháp tối ưu có hướng dẫn CPP) có cải thiện kết quả hay không vẫn chưa chắc chắn. Cập nhật mới nhất về hướng dẫn của Tổ chức Chấn thương Não trên bệnh nhân TBI thừa nhận rằng tình trạng tự điều hòa của não có thể có vai trò trong các quyết định lâm sàng về CPP mục tiêu, nhưng không có liệu pháp cụ thể nào để cải thiện quá trình tự điều hòa của não được nêu lên [9].
Điều chỉnh huyết áp trong thực hanh lâm sang
ICH. Nguy cơ chính trong xuất huyết nội sọ là sự tiến triển của khối máu tụ, xảy ra ở khoảng 30% bệnh nhân và có liên quan đến tỷ lệ tử vong (với mức độ tăng 5% nguy cơ tử vong cho mỗi 10% tăng trưởng thể tích máu tụ) và kết cục thần kinh tồi tệ hơn [38] . Mặc dù các tổn thương thiếu máu cục bộ nhỏ – mà căn nguyên và ý nghĩa lâm sàng vẫn chưa được xác định – đã được xác định trong hình ảnh cộng hưởng từ (MRI) sau ICH, các nghiên cứu hình ảnh thần kinh nâng cao cho thấy không có thiếu máu cục bộ đáng kể trong bối cảnh này [39]. Thông thường nhất, sự tiến triển của khối máu tụ xảy ra trong 3 giờ đầu tiên sau biến cố, nhưng nguy cơ vẫn tăng cao trong 24 giờ đầu tiên [40]. Các yếu tố nguy cơ đối với sự mở rộng của khối máu tụ bao gồm điều trị chống huyết khối, kích thước khối máu tụ lớn và thoát mạch cản quang trên hình ảnh CT ban đầu (cái gọi là dấu hiệu spot sign). Một số nghiên cứu đã phát hiện ra rằng huyết áp tâm thu tăng cao tại thời điểm nhập viện có liên quan đến sự mở rộng khối máu tụ [40, 41]. Tăng huyết áp thoáng qua thường xuyên xảy ra trong những giờ đầu tiên sau ICH do nhiều yếu tố, bao gồm stress, đau, tăng ICP hoặc tăng huyết áp động mạch mãn tính. Đáp ứng tăng huyết áp cấp tính ở bệnh nhân ICH được định nghĩa là huyết áp tâm thu (HATT)> 140 mm Hg hoặc huyết áp tâm trương (HATTr)> 90 mm Hg trên các bản ghi được thực hiện hơn 5 phút trong vòng 24 giờ đầu tiên kể từ khi bắt đầu các triệu chứng [42 ]. Nó đã được chứng minh rằng huyết áp tâm thu (SBP) có sự thay đổi cao hơn và lớn hơn so với huyết áp tâm trương hoặc huyết áp động mạch trung bình trong 24 giờ đầu tiên sau ICH [40]; do đó HATT được coi là dấu hiệu liên quan của tăng huyết áp cấp tính ở bệnh nhân ICH. Người ta đã công nhận rằng việc điều chỉnh sớm phản ứng tăng huyết áp có thể có lợi; một số nghiên cứu đã khảo sát tính an toàn và lợi thế tiềm năng của việc hạ huyết áp sớm sau ICH. Các nghiên cứu trên động vật cho thấy không có sự giảm lưu lượng máu não khu vực khi điều chỉnh HA [43]; những dữ liệu này đã được xác nhận trong bối cảnh lâm sàng bởi Intracerebral Haemorrhage Acutely Decreasing Arterial Pressure Trial (ICH-ADAPT). Mặt khác, việc giảm huyết áp tâm thu nhẹ đã được chứng minh là có hiệu quả trong việc giảm sự mở rộng của khối máu tụ, trong khi hạ huyết áp tích cực (> 10%) lại có hại cho kết quả thần kinh [44]. Hai thử nghiệm ngẫu nhiên có đối chứng ngẫu nhiên về giảm huyết áp tích cực đa trung tâm (INTERACT và INTERACT- II) đã thu nhận được 3243 bệnh nhân có ICH nhỏ (thể tích khối máu cơ bản trung bình trong INTERACT-II là 11 mL) trong đó điều trị hạ huyết áp tích cực được lên kế hoạch bắt đầu ngay trong 1 giờ và tiếp tục trong 7 ngày. Trong cả hai thử nghiệm, việc hạ HA sớm, tích cực xuống < 140 mmHg không liên quan đến việc tăng tỷ lệ tử vong hoặc tỷ lệ biến cố bất lợi nghiêm trọng [45, 46]. INTERACT cho thấy sự giảm tỷ lệ mở rộng và INTERACT-II cho thấy sự giảm sự phát triển tương đối của khối máu tụ với việc hạ huyết áp tâm thu. Thử nghiệm INTERACT- II lớn (2839 bệnh nhân) cho thấy một kết quả tốt hơn và xu hướng giảm tử vong và kết quả thần kinh tốt hơn ở nhóm hạ HA tích cực (HATT < 140 mmHg) so với nhóm chứng (HATTr < 180 mmHg). Tuy nhiên, hơn 30% bệnh nhân trong nhóm điều trị tích cực không đạt được mục tiêu HATT và điều này có thể ảnh hưởng đến kết quả tiêu cực về kết quả. Thử nghiệm ngẫu nhiên có đối chứng đa trung tâm ATACH-II gần đây cho thấy hạ HA < 140 mmHg không liên quan đến khả năng sống sót hoặc kết quả thần kinh tốt hơn và thay vào đó nó liên quan đến tỷ lệ suy thận cao hơn [47]. Tuy nhiên, ATACH-II và INTERACT-II khác nhau ở nhiều khía cạnh, chẳng hạn như HA trung bình khi đến khoa cấp cứu (cao hơn trong thử nghiệm ATACH-II), thuốc dùng để kiểm soát HA, thời gian điều trị (4 giờ so với 6 h trong INTERACT) và HA trung bình đạt được ở nhóm điều trị tích cực (130 mmHg so với 146 mmHg trong các thử nghiệm INTERACT). Hướng dẫn của ASA/ AHA đề nghị hạ HATT cấp tính xuống 140 mmHg ở bệnh nhân ICH có HATT 150-220 mmHg (nếu không có chống chỉ định giảm HA; loại I; mức bằng chứng A) [48]. Tổ chức Đột quỵ Châu Âu (ESO) đồng ý về mục tiêu HA nhưng nhận thấy khuyến nghị này chỉ được hỗ trợ bởi các bằng chứng vừa phải. Điều trị hạ huyết áp của bệnh nhân ICH vẫn chưa chắc chắn. Với bằng chứng, chúng tôi đề xuất một cách tiếp cận thận trọng và chúng tôi khuyên không nên giảm HA nhanh chóng và/ hoặc cực độ (Hình 35.3). Nên kiểm soát HA tích cực để giảm HATT xuống 140-160 mmHg trong vòng 6 giờ đầu tiên. Việc sử dụng các thuốc hạ huyết áp tác dụng ngắn qua đường tĩnh mạch, chẳng hạn như labetalol, urapidil hoặc nicardipine, nên kết hợp với các liệu pháp uống để tránh các biến thiên huyết áp rộng ở những bệnh nhân này.
Tai biến mạch máu não cấp do thiếu máu cục bộ – AIS. Cách tiếp cận quản lý HA trong đột quỵ do thiếu máu cục bộ cấp tính vốn đã khác với cách tiếp cận trong ICH. Hầu hết các cơn đột quỵ là do thiếu máu cục bộ khu trú, thường liên quan đến một mạch máu duy nhất. Các tế bào bị ảnh hưởng tỷ lệ thuận với khoảng cách từ mạch bị tắc: các tế bào gần mạch bị tắc không tiếp cận được với tuần hoàn bàng hệ, do đó sẽ bị ảnh hưởng nhiều nhất; các tế bào ở xa mạch liên quan hơn sẽ nhận được một số tưới máu từ các mạch phụ và có thể phục hồi nếu lưu lượng máu được phục hồi kịp thời. Điều này đại diện cho “vùng tranh tối tranh sáng”. Trong đột quỵ, đoạn xa của mạch bị tắc nghẽn, áp lực tưới máu thấp và các mạch bị giãn ra. Do cơ chế tự điều hòa của não bị suy giảm, lưu lượng máu trong các mạch bị giãn này phụ thuộc vào MAP. Điều này là một thách thức đối với bác sĩ, người phải đảm bảo tưới máu đầy đủ trong khi tránh nguy cơ xuất huyết chuyển dạng trong mô bị tổn thương. Có một mối quan hệ hình chữ U giữa huyết áp tâm thu lúc ban đầu và lúc nhập viện và kết quả ở bệnh nhân AIS: cả huyết áp tâm thu tăng (> 200 mmHg) và thấp (<120 mmHg) đều có liên quan đến tử vong, kết cục thần kinh kém và các biến chứng như hội chứng mạch vành cấp tính hoặc tái phát đột quỵ [49]. Đáng chú ý, mối quan hệ như vậy được chuyển sang bên phải ở bệnh nhân tăng huyết áp mãn tính [50]. Không có dữ liệu từ các thử nghiệm ngẫu nhiên có đối chứng được thiết kế đặc biệt để hướng dẫn quản lý HA trong giai đoạn cấp tính của đột quỵ do thiếu máu cục bộ (tức là 24 giờ đầu tiên). Cao huyết áp thường gặp trong bối cảnh này vì tăng huyết áp mãn tính thường ảnh hưởng đến bệnh nhân đột quỵ và phản ứng giao cảm với biến cố thần kinh cấp tính. Sự gia tăng này thường thoáng qua và hết trong vòng 10 ngày kể từ khi sự kiện xảy ra. Đối với những bệnh nhân bị đột quỵ do thiếu máu cục bộ cấp tính không được điều trị bằng liệu pháp làm tan huyết khối, hầu hết các hướng dẫn đồng thuận khuyến cáo không nên điều trị HA trong giai đoạn cấp trừ khi tăng huyết áp đến cực điểm (HATT > 220 mmHg hoặc HATTr > 120 mmHg), hoặc bệnh nhân bị thiếu máu cục bộ do bệnh mạch vành hoạt động, suy tim, bóc tách động mạch chủ, bệnh não do tăng huyết áp, suy thận cấp hoặc tiền sản giật [8]. Khi điều trị được chỉ định, nên thận trọng hạ HA khoảng 15% trong 24 giờ đầu tiên sau khi khởi phát đột quỵ. Hướng dẫn của AHA/ ASA khuyến cáo nhắm mục tiêu HATT < 185 mmHg và HATTr < 110 mmHg trước khi thực hiện tiêu huyết khối tĩnh mạch. HA phải được giữ ở mức tối đa 180/105 mmHg trong ít nhất 24 giờ sau đó [8]. Không có khuyến nghị chính xác về kiểm soát HA ở bệnh nhân được điều trị nội mạch được đưa ra trong các hướng dẫn gần đây nhất, nhưng chúng tôi đề nghị kiểm soát HA ít nhất bằng ngưỡng tương đương với tiêu huyết khối, tức là HATT < 160- 180 mmHg và HATTr < 100 mmHg. Mục tiêu HA tối ưu trong trường hợp chuyển dạng xuất huyết hoặc mở rộng khối máu tụ sau khi tái tưới máu với tiêu huyết khối hoặc phẫu thuật cắt huyết khối hiện vẫn chưa chắc chắn và cần được thảo luận theo từng trường hợp cụ thể. Các hướng dẫn thừa nhận rằng thuốc vận mạch có thể được sử dụng để cải thiện lưu lượng máu não trong một số trường hợp hiếm hoi khi hạ huyết áp toàn thân gây suy giảm chức năng thần kinh, nhưng điều này hiếm khi được thực hiện trong thực hành lâm sàng ở bệnh nhân đột quỵ. Bắt đầu lại thuốc điều trị tăng huyết áp 24 giờ sau khi khởi phát đột quỵ là hợp lý ở những bệnh nhân có bệnh tăng huyết áp từ trước đã ổn định về thần kinh [8]. Giảm HA nên thận trọng ở những bệnh nhân bị hẹp động mạch lớn ngoài sọ hoặc nội sọ (tức là hơn 7-14 ngày sau đột quỵ do thiếu máu cục bộ), vì có thể cần tăng huyết áp ở một mức độ nào đó để duy trì lưu lượng máu não đầy đủ.
Xuất huyết dưới nhện do phình động mạch – SAH. Tái xuất huyết là một nguy cơ chính sau SAH phình động mạch, đặc biệt là trong 2-12 giờ đầu tiên [15]. Tái xuất huyết túi phình liên quan đến tỷ lệ tử vong và tiên lượng xấu về thần kinh. Các yếu tố nguy cơ bao gồm thời gian điều trị túi phình lâu hơn, tình trạng thần kinh xấu hơn khi nhập viện, mất ý thức ban đầu, đau đầu nhiều trước đó, kích thước túi phình lớn hơn và có thể HATT > 160 mmHg. Các hướng dẫn của AHA/ ASA đề nghị rằng giữa thời điểm khởi phát SAH phình mạch và phá vỡ túi phình, nên kiểm soát HA bằng thuốc có thể chuẩn độ nhanh để cân bằng nguy cơ đột quỵ, tái xuất huyết liên quan đến tăng huyết áp và duy trì áp lực tưới máu não (khuyến cáo loại I), có thể đến HATT < 160 mmHg (Khuyến cáo loại II). Tuy nhiên, khả năng tăng áp lực nội sọ (ICP) và tác động tiềm tàng đến tưới máu não cần được đánh giá để xác định các mục tiêu huyết động. Trong trường hợp DCI, liệu pháp đầu tay bao gồm tăng dần MAP, trừ khi huyết áp tăng ở mức ban đầu hoặc rối loạn chức năng tim đáng kể được chẩn đoán (khuyến cáo loại I) [15]. HA mục tiêu nên được lựa chọn dựa trên HA ban đầu của bệnh nhân. Nói chung, HATT 160-180 hoặc MAP 100-110 mmHg được coi là thích hợp. Ở những bệnh nhân có triệu chứng được khám lâm sàng đáng tin cậy, mục tiêu là giải quyết các triệu chứng. Ở những bệnh nhân phân nhóm nặng có ICP được theo dõi, CPP nên được nhắm mục tiêu và hiệu quả của điều trị nên được đánh giá bằng theo dõi đa phương thức (PbtO2, EEG, v.v.). HA/ CPP nên được tăng lên từng bước, đánh giá hiệu quả của việc điều trị trong khoảng 30 phút trước khi tiếp tục leo thang. Các hướng dẫn hiện tại không đề xuất mục tiêu HATT / MAP hoặc CPP tối đa, nhưng cần xem xét các tác động có hại của tăng huyết áp trên các cơ quan khác và bắt buộc phải theo dõi lâm sàng chặt chẽ các biến chứng như suy tim. Giới hạn CPP khoảng 120 mmHg hoặc MAP khoảng 140 mmHg có thể được coi là hợp lý. Norepinephrine, dopamine và phenylephrine đều đã được chứng minh là có hiệu quả trong việc cải thiện CBF và / hoặc oxy hóa não [51, 52]. Chúng tôi đề nghị sử dụng norepinephrine như là phương pháp điều trị đầu tay vì có thể dự đoán được mức tăng HA và tần suất nhịp tim nhanh thấp. Điều trị nên được tiếp tục trong ít nhất 24-48 giờ và sau đó giảm leo thang theo dõi từ từ để tái phát tình trạng thiếu hụt thần kinh lâm sàng hoặc các thay đổi trong theo dõi đa phương thức.
Chấn thương sọ não – TBI. Tụt huyết áp đã được biết là có liên quan đến kết quả xấu hơn ở bệnh nhân TBI kể từ ít nhất ba thập kỷ [51]. Tụt huyết áp có thể gây bất lợi theo một số cách: nếu quá trình tự điều hòa ở não vẫn còn nguyên vẹn, thì sự giảm huyết áp tâm thu sẽ kích hoạt sự giãn mạch của giường mạch não, sau đó làm tăng thể tích máu não và ICP; nếu cơ chế tự điều hòa của não bị thay đổi, HA thấp có thể gây thiếu máu não. Cần lưu ý mối quan hệ như vậy giữa khả năng tự điều chỉnh của não, HA và CPP khi điều chỉnh HA ở bệnh nhân TBI. Ngưỡng HA thích hợp ở bệnh nhân TBI vẫn chưa chắc chắn. Các hướng dẫn hiện tại của Tổ chức Chấn thương Não xác định các ngưỡng khác nhau theo độ tuổi: HATT nên được giữ > 100 mmHg ở bệnh nhân 50-69 tuổi và > 110 mmHg ở bệnh nhân 15-49 hoặc trên 70 tuổi (khuyến cáo cấp III) [9] . Tương tự, áp lực tưới máu não > 60 mmHg nên được nhắm mục tiêu cho bệnh nhân theo dõi ICP. Gần đây, một phân tích thứ cấp về dữ liệu thu được từ nghiên cứu EPIC đang diễn ra đã được công bố [53]. Nghiên cứu EPIC là một thử nghiệm lâm sàng trước sau khi được thiết kế để đánh giá việc chăm sóc trước khi nhập viện cho những bệnh nhân mắc bệnh TBI nặng. Một phân tích thứ cấp đã được thực hiện trên đoàn hệ trước can thiệp (3844 bệnh nhân) cho thấy mối liên hệ tuyến tính giữa huyết áp tâm thu thấp nhất trước khi nhập viện và tỷ lệ tử vong (được điều chỉnh theo mức độ nghiêm trọng của chấn thương) đối với HATT trong khoảng 40-120 mmHg. Bệnh nhân có HA ban đầu < 40 mmHg hoặc> 120 mmHg không được đưa vào phân tích. Những kết quả này gợi ý rằng ngưỡng HA để cải thiện kết cục ở bệnh nhân TBI có thể cao tới 120 mmHg và hạ huyết áp có ý nghĩa lâm sàng có thể xảy ra đối với các giá trị được chấp nhận hiện nay. Hơn nữa, kết quả này làm cơ sở cho những khó khăn để xác định ngưỡng cho một tham số liên tục như BP, cũng như xem xét các cơ chế xen kẽ làm trung gian cho CPP. Thuốc vận mạch (norepinephrine hoặc phenylephrine) có thể được sử dụng để đạt được HA mục tiêu. Ở những bệnh nhân được theo dõi áp lực nội sọ, việc theo dõi quá trình tự điều hòa và/ hoặc oxy của não có thể được sử dụng như một thông tin phụ để hướng dẫn liệu pháp huyết động, như được mô tả ở trên trong chương này
Tiêu điểm (Hình. 35.3)
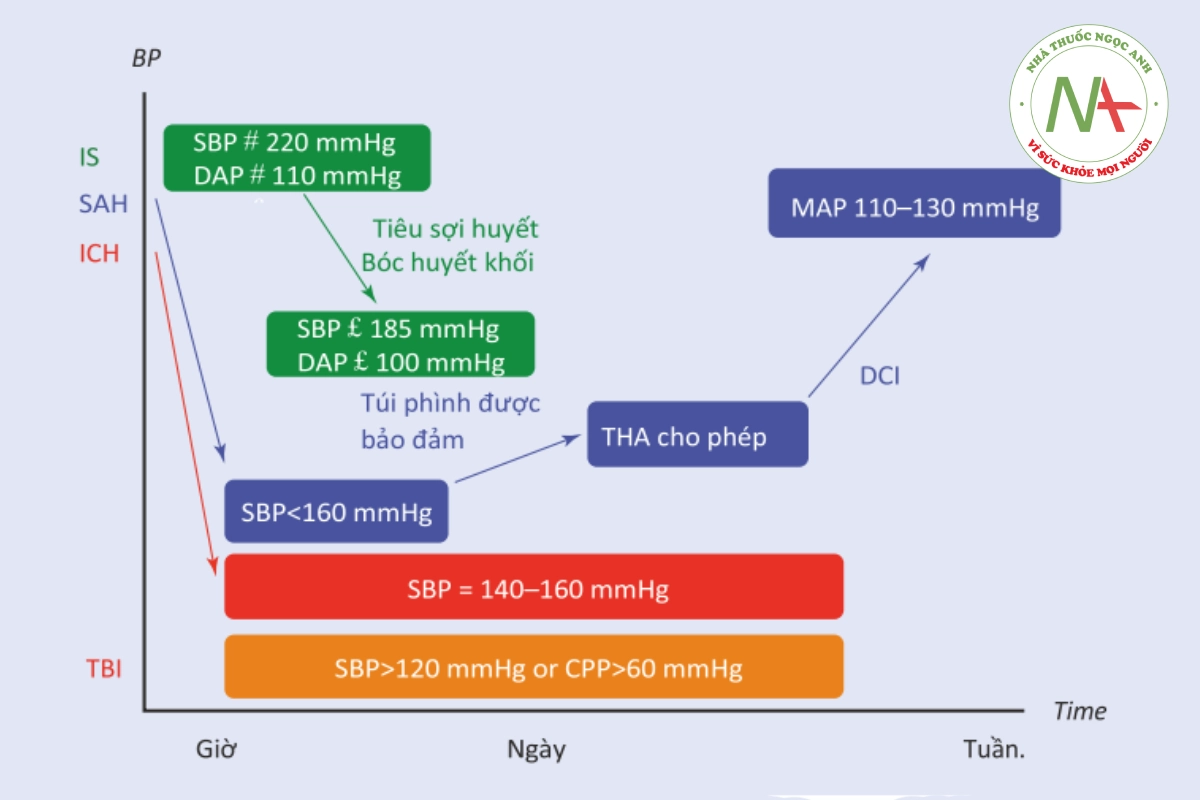
khối. Trong trường hợp xuất huyết trong não (ICH, màu đỏ), nên kiểm soát nhanh HATT khoảng 140-160 mmHg kể từ giai đoạn đầu sau khi nhập viện được khuyến cáo. Ở những bệnh nhân bị xuất huyết dưới nhện (SAH, màu xanh lam), huyết áp phải được kiểm soát cho đến khi túi phình được bảo vệ, sau đó cho phép các giá trị cao hơn của áp lực động mạch trung bình; trong trường hợp thiếu máu não trì, tăng huyết áp gây ra vẫn là liệu pháp đầu tay. Sau chấn thương sọ não (TBI, hoặc Ở bệnh nhân ICH) HATT ban đầu nên giảm khoảng 140-160 mmHg, trừ khi tình trạng thần kinh xấu đi hoặc dấu hiệu tăng áp lực nội sọ.
Ở những bệnh nhân SAH, huyết áp tâm thu ban đầu nên được giữ dưới 160 mmHg trước khi túi phình được bảo vệ. Sau đó, một cách tiếp cận tự do hơn được khuyến nghị. Liệu pháp đầu tay của DCI bao gồm tăng MAP để đảo ngược tình trạng thiếu hụt lâm sàng hoặc cải thiện quá trình cung cấp oxy / tưới máu não.
Ở những bệnh nhân bị đột quỵ cấp, nên duy trì HATT > 220 mmHg hoặc HATTr > 120 mmHg. Trong trường hợp tiêu huyết khối hoặc phẫu thuật cắt huyết khối nội mạch, HATT < 185 mmHg và HATTr < 110 mmHg có liên quan đến ít biến cố xuất huyết hơn.
Ở bệnh nhân TBI, HATT phải được giữ ít nhất > 100 mmHg và lý tưởng là > 110- 120 mmHg hoặc CPP > 60 mmHg khi theo dõi ICP, yêu cầu tối thiểu về huyết áp tâm thu hoặc huyết áp tưới máu não (CPP).
=> Tham khảo: Tiếp cận ngất: Kiến thức nền tảng, chẩn đoán và hướng điều trị.
Các kết luận
Liệu pháp huyết động trong các trường hợp khẩn cấp về thần kinh có thể là một thách thức. Thay thế dịch đẳng trương nhắm mục tiêu ổn định thể tích tuần hoàn nên được ưu tiên. Việc điều chỉnh HA là hết sức quan trọng trong cả giai đoạn sớm và giai đoạn muộn sau tổn thương sọ não cấp, nhằm hạn chế tiến triển của bệnh và ngăn ngừa chấn thương sọ não thứ phát. Ở những bệnh nhân xuất huyết nội sọ (ICH) và xuất huyết dưới nhện do phình động mạch (SAH), cần chú ý ngăn ngừa sự tiến triển của xuất huyết; ở những bệnh nhân bị đột quỵ do thiếu máu cục bộ cấp tính, nên đảm bảo tưới máu cho vùng tranh tối tranh sáng do thiếu máu cục bộ đồng thời tính đến nguy cơ chuyển dạng xuất huyết; ở bệnh nhân TBI, việc điều chỉnh HA cần tập trung vào việc đảm bảo tưới máu não đầy đủ. Một khi tổn thương nội sọ tương đối ổn định, việc quản lý HA cần tập trung vào việc tìm kiếm sự cân bằng thích hợp giữa nguy cơ giảm tưới máu (và thiếu máu cục bộ sau đó) và nguy cơ ứng máu và tổn thương tế bào sau đó. Trong bối cảnh này, điều chỉnh HA là một thực hành thường quy trong ICU, với mục tiêu chính là tối ưu hóa tưới máu não. Thao tác BP nên được điều chỉnh theo nhu cầu cụ thể của từng cá nhân. Cơ chế tự điều hòa của não là một trong những cơ chế sinh lý quan trọng nhất giúp bảo vệ não khỏi tình trạng giảm hoặc tăng tưới máu. Cơ chế tự điều hòa của não thường bị thay đổi và có liên quan đến kết cục sau tổn thương não cấp tính. Theo dõi quá trình tự điều hòa của não có thể giúp xác định phạm vi MAP trong đó tưới máu não là tối ưu. Quản lý huyết áp và áp lực tưới máu não trong đơn vị hồi sức thần kinh đã phát triển theo hướng mô hình trị liệu cá nhân hóa.
Thông tin cốt lõi
Thiếu các chỉ định cụ thể về quản lý thể tích ở những bệnh nhân bị bệnh nặng thần kinh. Tuy nhiên, ở bệnh nhân bị bệnh nặng thần kinh, không nên bỏ qua khả năng không đủ thể tích tuần hoàn, và cần đánh giá cẩn thận sự đầy đủ thể tích trong lòng mạch để ngăn ngừa tổn thương sọ não thứ phát và suy đa cơ quan.
Theo dõi huyết động đầy đủ nên được xem xét khi cần thiết để hướng dẫn đánh giá và quản lý thể tích nội mạch thích hợp, đặc biệt để tránh giảm thể tích hoặc tăng thể tích máu. Tăng thể tích “siêu bình thường” trong trường hợp co thắt mạch trong SAH phức tạp do DCI không còn được khuyến khích.
Quản lý thể tích nội mạch bằng dịch tinh thể đẳng trương như NaCl 0,9% hoặc các dung dịch cân bằng được khuyến cáo trong các trường hợp cấp cứu thần kinh.
Nên tránh truyền dịch nhược trương, trong khi sử dụng dịch truyền ưu trương nên dành cho các chỉ định cụ thể (như trong tăng huyết áp nội sọ). Khi kê đơn điều trị dịch truyền, bác sĩ lâm sàng nên biết về trương lực trong vivo của dịch truyền được sử dụng. Không khuyến cáo sử dụng có hệ thống dung dịch keo trong các trường hợp khẩn cấp về thần kinh.
Các mục tiêu huyết áp khác nhau giữa các dạng tổn thương não khác nhau và giữa giai đoạn đầu và giai đoạn cuối của quá trình xử trí của bệnh nhân.
Việc cá nhân hóa các mục tiêu huyết áp có thể đạt được bằng cách sử dụng các công cụ theo dõi tiên tiến, chẳng hạn như oxy hóa não hoặc đánh giá quá trình tự điều hòa của não. Tuy nhiên, không có dữ liệu về tác động của các chiến lược như vậy đối với kết quả của bệnh nhân.
Tài liệu tham khảo
- Roozenbeek B, Maas AI, Menon DK. Changing patterns in the epidemiology of traumatic brain injury. Nat Rev Neurol. 2013;9(4):231—6.
- Gruenbaum SE, Zlotnik A, Gruenbaum BF, Hersey D, Bilotta F. Pharmacologic neuroprotection for functional outcomes after traumatic brain injury: a systematic review of the clinical literature. CNS Drugs. 2016;30(9):791-806.
- Bednarczyk JM, Fridfinnson JA, Kumar A, Blanchard L, Rabbani R, Bell D, Funk D, Turgeon AF, Abou- Setta AM, Zarychanski R. Incorporating dynamic assessment of fluid responsiveness into goal- directed therapy: a systematic review and meta-analysis. Crit Care Med. 2017;45(9):1538-45.
- Robertson DS. The physical chemistry of brain and neural cell membranes: an overview. Neurochem Res. 2010;35(5):681-7.
- Kimelberg HK. Water homeostasis in the brain: basic concepts. Neuroscience. 2004;129(4):851-60. Review.
- Saw MM, Chamberlain J, Barr M, Morgan MP, Burnett JR, Ho KM. Differential disruption of blood-b rain barrier in severe traumatic brain injury. Neurocrit Care. 2014;20(2):209-16.
- Rodriguez GJ, Cordina SM, Vazquez G, Suri MF, Kirmani JF, Ezzeddine MA, Qureshi AI. The hydration influence on the risk of stroke (THIRST) study. Neurocrit Care. 2009;10(2): 187- 94.
- Powers WJ, Rabinstein AA, Ackerson T, Adeoye OM, Bambakidis NC, Becker K, Biller J, Brown M, Demaerschalk BM, Hoh B, Jauch EC, Kidwell CS, Leslie-Mazwi TM, Ovbiagele B, Scott PA, Sheth KN, Southerland AM, Summers DV, Tirschwell DL, American Heart Association Stroke Council. 2018 guidelines for the early management of patients with acute ischemic stroke: a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 2018;49:e46- 99.
- Carney N, Totten AM, O’Reilly C, Ullman JS, Hawryluk GW, Bell MJ, Bratton SL, Chesnut R, Harris OA, Kissoon N, Rubiano AM, Shutter L, Tasker RC, Vavilala MS, Wilberger J, Wright DW, Ghajar J. Guidelines for the management of severe traumatic brain injury, fourth edition. Neurosurgery. 2017;80(1):6-15.
- Callaway CW, Donnino MW, Fink EL, Geocadin RG, Golan E, Kern KB, Leary M, Meurer WJ, Peberdy MA, Thompson TM, Zimmerman JL. Part 8: post-cardiac arrest care: 2015 American Heart Association guidelines update for cardiopulmonary resuscitation and emergency cardiovascular care. Circulation. 2015;132(18 Suppl 2):S465-82.
- Martin Ginis KA, van der Scheer JW, Latimer-Cheung AE, Barrow A, Bourne C, Carruthers P, Bernardi M, Ditor DS, Gaudet S, de Groot S, Hayes KC, Hicks AL, Leicht CA, Lexell J, Macaluso S, Manns PJ, McBride CB, Noonan VK, Pomerleau P, Rimmer JH, Shaw RB, Smith B, Smith KM, Steeves JD, Tussler D, West CR, Wolfe DL, Goosey-Tolfrey VL. Evidence- based scientific exercise guidelines for adults with spinal cord injury: an update and a new guideline. Spinal Cord. 2018;56:308-21.
- Dabus G, Nogueira RG. Current options for the management of aneurysmal subarachnoid hemorrhage- induced cerebral vasospasm: a comprehensive review of the literature. Interv Neurol. 2013;2(1):30-51.
- Sen J, Belli A, Albon H, Morgan L, Petzold A, Kitchen N. Triple-H therapy in the management of aneurysmal subarachnoid haemorrhage. Lancet Neurol. 2003;2(10):614-21.
- Egge A, Waterloo K, Sj0holm H, Solberg T, Ingebrigtsen T, Romner B. Prophylactic hyperdynamic postoperative fluid therapy after aneurysmal subarachnoid hemorrhage: a clinical, prospective, randomized, controlled study. Neurosurgery. 2001;49(3):593-605.
- Connolly ES Jr, Rabinstein AA, Carhuapoma JR, Derdeyn CP, Dion J, Higashida RT, Hoh BL, Kirkness CJ, Naidech AM, Ogilvy CS, Patel AB, Thompson BG, Vespa P, American Heart Association Stroke Council; Council on Cardiovascular Radiology and Intervention; Council on Cardiovascular Nursing; Council on Cardiovascular Surgery and Anesthesia; Council on Clinical Cardiology. Guidelines for the management of aneurysmal subarachnoid hemorrhage: a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 2012;43(6):1711-37.
- Diringer MN, Bleck TP, Claude Hemphill J 3rd, Menon D, Shutter L, Vespa P, Bruder N, Connolly ES Jr, Citerio G, Gress D, Hănggi D, Hoh BL, Lanzino G, Le Roux P, Rabinstein A, Schmutzhard E, Stocchetti N, Suarez JI, Treggiari M, Tseng MY, Vergouwen MD, Wolf S, Zipfel G, Neurocritical Care Society. Critical care management of patients following aneurysmal subarachnoid hemorrhage: recommendations from the Neurocritical Care Society’s Multidisciplinary Consensus Conference. Neurocrit Care. 2011;15(2):211-40.
- Muench E, Horn P, Bauhuf C, Roth H, Philipps M, Hermann P, Quintel M, Schmiedek P, Vajkoczy P. Effects of hypervolemia and hypertension on regional cerebral blood flow, intracranial pressure, and brain tissue oxygenation after subarachnoid hemorrhage. Crit Care Med. 2007;35(8):1844-51.
- Varrier M, Ostermann M. Fluid composition and clinical effects. Crit Care Clin. 2015;31(4):823-37.
- Lehmann L, Bendel S, Uehlinger DE, Takala J, Schafer M, Reinert M, Jakob SM. Randomized, double- blind trial of the effect of fluid composition on electrolyte, acid-base, and fluid homeostasis in patients early after subarachnoid hemorrhage. Neurocrit Care. 2013;18(1):5- 12.
- Cooper DJ, Myburgh J, Heritier S, Finfer S, Bellomo R, Billot L, Murray L, Vallance S, SAFE- TBI Investigators; Australian and New Zealand Intensive Care Society Clinical Trials Group. Albumin resuscitation for traumatic brain injury: is intracranial hypertension the cause of increased mortality? J Neurotrauma. 2013;30(7):512-8.
- Palesch YY, Hill MD, Ryckborst KJ, Tamariz D, Ginsberg MD. The ALIAS Pilot Trial: a dose- escalation and safety study of albumin therapy for acute ischemic stroke–II: neurologic outcome and efficacy analysis. Stroke. 2006;37(8):2107-14.
- Kuwabara K, Fushimi K, Matsuda S, Ishikawa KB, Horiguchi H, Fujimori K. Association of early post- procedure hemodynamic management with the outcomes of subarachnoid hemorrhage patients. J Neurol. 2013;260(3):820-31.
- Suarez JI, Shannon L, Zaidat OO, Suri MF, Singh G, Lynch G, Selman WR. Effect of human albumin administration on clinical outcome and hospital cost in patients with subarachnoid hemorrhage. J Neurosurg. 2004;100(4):585-90.
- Maas AI, Murray GD, Roozenbeek B, Lingsma HF, Butcher I, McHugh GS, Weir J, Lu J, Steyerberg EW, International Mission on Prognosis Analysis of Clinical Trials in Traumatic Brain Injury (IMPACT) Study Group. Advancing care for traumatic brain injury: findings from the IMPACT studies and perspectives on future research. Lancet Neurol. 2013;12(12):1200- 10.
- Powers WJ. Cerebral hemodynamics in ischemic cerebrovascular disease. Ann Neurol. 1991;29(3):231-40.
- Meng L, Hou W, Chui J, Han R, Gelb AW. Cardiac output and cerebral blood flow: the integrated regulation of brain perfusion in adult humans. Anesthesiology. 2015;123(5):1198- 208.
- Pallas F, Larson DF. Cerebral blood flow in the diabetic patient. Perfusion. 1996;11(5):363- 70.
- McBryde FD, Malpas SC, Paton JF. Intracranial mechanisms for preserving brain blood flow in health and disease. Acta Physiol (Oxf). 2017;219(1):274-87.
- Liu X, Donnelly J, Czosnyka M, Aries MJH, Brady K, Cardim D, Robba C, Cabeleira M, Kim DJ, Haubrich C, Hutchinson PJ, Smielewski P. Cerebrovascular pressure reactivity monitoring using wavelet analysis in traumatic brain injury patients: A retrospective study. PLoS Med. 2017;14(7):e1002348.
- Budohoski KP, Czosnyka M, Smielewski P, Varsos GV, Kasprowicz M, Brady KM, Pickard JD, Kirkpatrick PJ. Monitoring cerebral autoregulation after subarachnoid hemorrhage. Acta Neurochir Suppl. 2016;122:199-203.
- Sekhon MS, Smielewski P, Bhate TD, Brasher PM, Foster D, Menon DK, Gupta AK, Czosnyka M, Henderson WR, Gin K, Wong G, Griesdale DE. Using the relationship between brain tissue regional saturation of oxygen and mean arterial pressure to determine the optimal mean arterial pressure in patients following cardiac arrest: a pilot proof-of-concept study. Resuscitation. 2016;106:120-5.
- Czosnyka M, Miller C, Participants in the International Multidisciplinary Consensus Conference on Multimodality Monitoring. Monitoring of cerebral autoregulation. Neurocrit Care. 2014;21(Suppl 2):S95-102.
- Howells T, Elf K, Jones PA, Ronne-Engstrỏm E, Piper I, Nilsson P, Andrews P, Enblad P. Pressure reactivity as a guide in the treatment of cerebral perfusion pressure in patients with brain trauma. J Neurosurg. 2005;102(2):311-7.
- Steiner LA, Czosnyka M, Piechnik SK, Smielewski P, Chatfield D, Menon DK, Pickard JD. Continuous monitoring of cerebrovascular pressure reactivity allows determination of optimal cerebral perfusion pressure in patients with traumatic brain injury. Crit Care Med. 2002;30(4):733-8.
- Jaeger M, Soehle M, Schuhmann MU, Meixensberger J. Clinical significance of impaired cerebrovascular autoregulation after severe aneurysmal subarachnoid hemorrhage. Stroke. 2012;43(8):2097-101.
- Reinhard M, Rutsch S, Lambeck J, Wihler C, Czosnyka M, Weiller C, Hetzel A. Dynamic cerebral autoregulation associates with infarct size and outcome after ischemic stroke. Acta Neurol Scand. 2012;125(3):156-62.
- Reinhard M, Neunhoeffer F, Gerds TA, Niesen WD, Buttler KJ, Timmer J, Schmidt B, Czosnyka M, Weiller C, Hetzel A. Secondary decline of cerebral autoregulation is associated with worse outcome after intracerebral hemorrhage. Intensive Care Med. 2010;36(2):264-71.
- Rodriguez-Luna D, Rubiera M, Ribo M, Coscojuela P, Pineiro S, Pagola J, Hernandez- Guillamon M, Ibarra B, Romero F, Alvarez-Sabin J, Montaner J, Molina CA. Ultraearly hematoma growth predicts poor outcome after acute intracerebral hemorrhage. Neurology. 2011;77(17):1599-604.
- Gould B, McCourt R, Asdaghi N, Dowlatshahi D, Jeerakathil T, Kate M, Coutts SB, Hill MD, Demchuk AM, Shuaib A, Emery D, Butcher K, ICH ADAPT Investigators. Autoregulation of cerebral blood flow is preserved in primary intracerebral hemorrhage. Stroke. 2013;44(6):1726-8.
- Kazui S, Naritomi H, Yamamoto H, Sawada T, Yamaguchi T. Enlargement of spontaneous intracerebral hemorrhage. Incidence and time course. Stroke. 1996;27(10):1783-7.
- Fujii Y, Takeuchi S, Sasaki O, Minakawa T, Tanaka R. Multivariate analysis of predictors of hematoma enlargement in spontaneous intracerebral hemorrhage. Stroke. 1998;29(6): 1160-6.
- Qureshi AI. Acute hypertensive response in patients with stroke: pathophysiology and management. Circulation. 2008;118(2):176-87.
- Qureshi AI, Wilson DA, Hanley DF, Traystman RJ. Pharmacologic reduction of mean arterial pressure does not adversely affect regional cerebral blood flow and intracranial pressure in experimental intracerebral hemorrhage. Crit Care Med. 1999;27(5):965-71.
- Christensen MC, Morris S, Vallejo-Torres L, Vincent C, Mayer SA. Neurological impairment among survivors of intracerebral hemorrhage: the FAST trial. Neurocrit Care. 2012;16(2):224- 31.
- Anderson CS, Huang Y, Wang JG, Arima H, Neal B, Peng B, et al. Intensive blood pressure reduction in acute cerebral haemorrhage trial (INTERACT): a randomised pilot trial. Lancet Neurol. 2008;7: 391-9.
- Anderson CS, Heeley E, Huang Y, Wang J, Stapf C, Delcourt C, et al. Rapid blood-pressure lowering in patients with acute intracerebral hemorrhage. N Engl J Med. 2013;368:2355-65.
- Qureshi AI, Palesch YY, Barsan WG, Hanley DF, Hsu CY, Martin RL, et al. Intensive blood- pressure lowering in patients with acute cerebral hemorrhage. N Engl J Med. 2016;375:1033- 43.
- Hemphill JC 3rd, Greenberg SM, Anderson CS, Becker K, Bendok BR, Cushman M, et al. Guidelines for the management of spontaneous intracerebral hemorrhage: a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 2015;46:2032-60.
- Leonardi-Bee J, Bath PM, Phillips SJ, Sandercock PA, IST Collaborative Group. Blood pressure and clinical outcomes in the International Stroke Trial. Stroke. 2002;33(5):1315-20.
- Okumura K, Ohya Y, Maehara A, Wakugami K, Iseki K, Takishita S. Effects of blood pressure levels on case fatality after acute stroke. J Hypertens. 2005;23(6): 1217-23.
- Rose JC, Mayer SA. Optimizing blood pressure in neurological emergencies. Neurocrit Care. 2004;1(3):287-99.
- Chesnut RM, Marshall LF, Klauber MR, Blunt BA, Baldwin N, Eisenberg HM, et al. The role of secondary brain injury in determining outcome from severe head injury. J Trauma. 1993;34:216-22.
- Spaite DW, Hu C, Bobrow BJ, Chikani V, Sherrill D, Barnhart B, Gaither JB, Denninghoff KR, Viscusi C, Mullins T, Adelson PD. Mortality and prehospital blood pressure in patients with major traumatic brain injury: implications for the hypotension threshold. JAMA Surg. 2017;152(4):360-8.

