Sofosbuvir

Danh pháp
Tên chung quốc tế
Tên danh pháp theo IUPAC
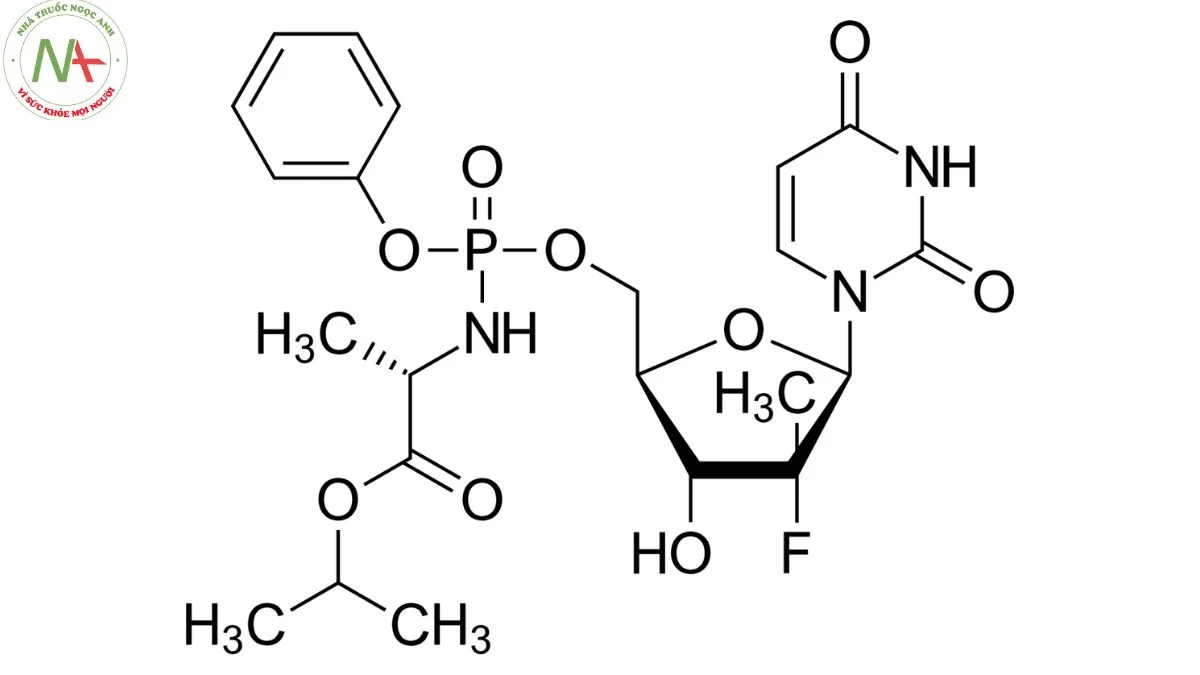
propan-2-yl (2S)-2-[[[(2R,3R,4R,5R)-5-(2,4-dioxopyrimidin-1-yl)-4-fluoro-3-hydroxy-4-methyloxolan-2-yl]methoxy-phenoxyphosphoryl]amino]propanoate
Nhóm thuốc
Thuốc kháng Virus
Mã ATC
J – Kháng khuẩn tác dụng toàn thân
J05 – Thuốc chống Virus dùng toàn thân
J05A – Thuốc chống Virus trực tiếp
J05AX – Thuốc kháng Virus khác
J05AX15 – Sofosbuvir
Mã UNII
WJ6CA3ZU8B
Mã CAS
1190307-88-0
Cấu trúc phân tử
Công thức phân tử
C22H29FN3O9P
Phân tử lượng
529.5 g/mol
Cấu trúc phân tử
Sofosbuvir là một liên hợp nucleotide được sử dụng kết hợp với ledipasvir. Nó là một este L-alanyl, một este phosphoramidate, một liên hợp nucleotide, một hợp chất organofluorine và một este isopropyl.
Các tính chất phân tử
Số liên kết hydro cho: 3
Số liên kết hydro nhận: 11
Số liên kết có thể xoay: 11
Diện tích bề mặt tôpô: 153Ų
Số lượng nguyên tử nặng: 36
Các tính chất đặc trưng
Tỷ trọng riêng: 1.4±0.1 g/cm3
Độ tan trong nước: 105 mg/L ở 25 °C
Hằng số phân ly pKa: 9.3
Chu kì bán hủy: 0,4 giờ
Khả năng liên kết với Protein huyết tương: 61-65%
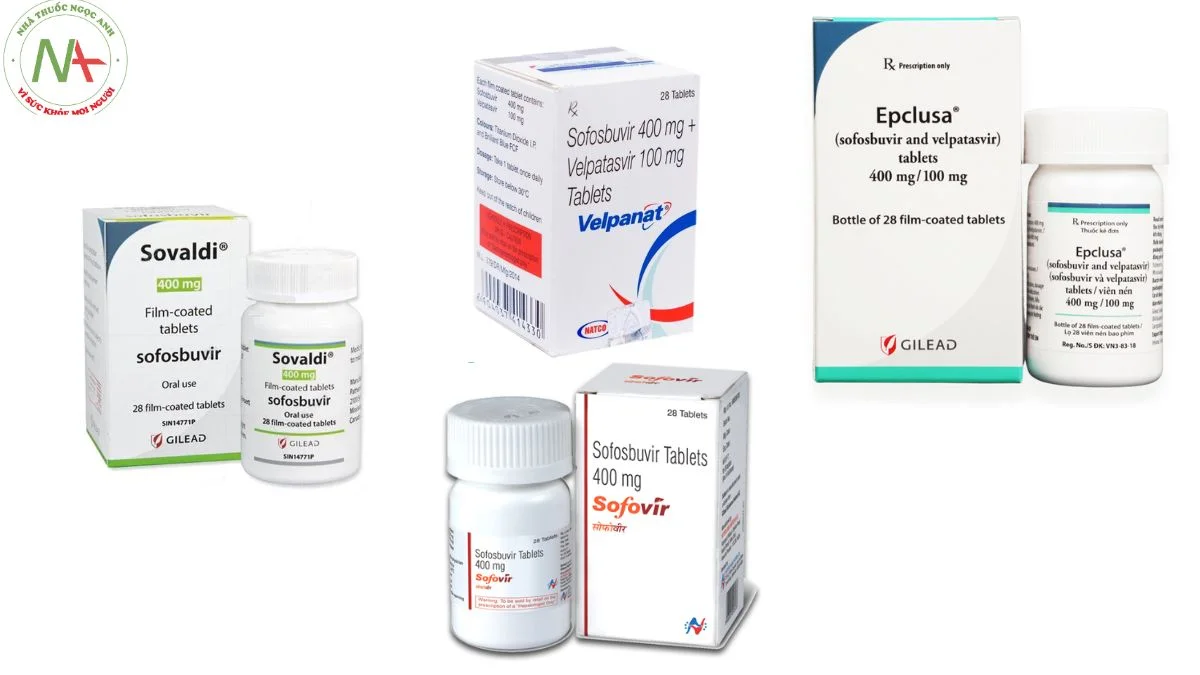
Dạng bào chế
Viên nén: 200 mg, Sofosbuvir 400 mg
Viên pellet: 150 mg
Độ ổn định và điều kiện bảo quản
Sofosbuvir cần được bảo quản ở nhiệt độ phòng, từ 20°C đến 25°C. Tránh ánh sáng trực tiếp và nhiệt độ cực nóng hoặc cực lạnh.
Nguồn gốc
Sofosbuvir, một trong những bước tiến quan trọng trong cuộc chiến chống viêm gan C (HCV), được khám phá bởi Michael Sofia từ Pharmasset vào năm 2007. Sau năm năm nghiên cứu và phát triển, vào năm 2010, loại thuốc này đã được thử nghiệm lần đầu trên con người.
Sự quan tâm đối với Sofosbuvir không ngừng gia tăng và vào năm 2011, Gilead Sciences đã thực hiện một bước quyết định quan trọng khi mua lại Pharmasset với một số tiền khoảng 11 tỷ USD.
Quy trình đăng ký Thuốc mới đã được tiến hành bởi Gilead Sciences cho sự kết hợp Sofosbuvir và ribavirin vào tháng 4 năm 2013. Kết quả là vào tháng 10 cùng năm, Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) đã chính thức công nhận nó là một liệu pháp đột phá.
Cuối cùng, vào tháng 12 năm 2013, FDA đã phê duyệt sử dụng Sofosbuvir kết hợp với ribavirin trong liệu pháp kép qua đường uống cho kiểu gen HCV 2 và 3. Đồng thời, những người mắc kiểu gen HCV 1 và 4 và chưa từng trải qua liệu pháp được điều trị bằng tiêm pegylated interferon (pegIFN) và ribavirin ba lần.
Hai tháng trước đó, FDA đã phê duyệt một loại thuốc khác, simeprevir, để điều trị viêm gan C, mở ra cơ hội cho nhiều phương pháp điều trị mới.
Năm 2014 đánh dấu một bước tiến quan trọng khác khi thuốc kết hợp liều cố định Sofosbuvir/ledipasvir, có khả năng ức chế NS5A của virus HCV, đã được chấp nhận và đạt tình trạng đột phá.
Trước khi có Sofosbuvir, các phương pháp điều trị viêm gan C bao gồm chế độ điều trị dựa trên interferon kéo dài từ 6 đến 12 tháng. Đây là một phương pháp mang lại tỷ lệ khỏi bệnh từ 70% trở xuống và đồng thời gắn liền với nhiều tác dụng phụ nghiêm trọng, bao gồm thiếu máu, trầm cảm, phát ban nặng, buồn nôn, tiêu chảy và mệt mỏi.
Trong quá trình phát triển lâm sàng của Sofosbuvir, sự hóng chờ của bác sĩ và bệnh nhân đã nở rộ. Cuối cùng, việc ra mắt Sofosbuvir tại Hoa Kỳ đã diễn ra nhanh chóng và được xem là một trong những bước tiến quan trọng nhất trong lịch sử chống viêm gan C.
Dược lý và cơ chế hoạt động
Được xem là một loại thuốc chống viêm gan C tác động trực tiếp (DAA), Sofosbuvir thực sự là một trong những công cụ quan trọng trong cuộc chiến chống lại virus viêm gan C (HCV).
Sofosbuvir hoạt động bằng cách ức chế RNA polymerase phụ thuộc RNA HCV NS5B, một loại enzyme quan trọng trong quá trình nhân lên của virus HCV. Sau khi được dùng vào cơ thể, Sofosbuvir trải qua một quá trình chuyển hóa nội bào để trở thành một dạng triphosphate tương tự uridine, được gọi là GS-461203, với hoạt tính dược lý. Điều này cho phép nó kết hợp với RNA của HCV bởi NS5B polymerase và hoạt động như một chất kết thúc chuỗi, ngăn chặn virus HCV sao chép thêm vật liệu di truyền của mình.
Một điểm đáng chú ý là ở liều gấp ba lần so với liều khuyến cáo, Sofosbuvir không có tác động kéo dài QTc đến mức độ có ý nghĩa lâm sàng. Điều này là một thông tin quan trọng về tính an toàn của thuốc khi được sử dụng trong điều trị.
Ứng dụng trong y học
Ứng dụng của Sofosbuvir trong lĩnh vực y học đã mang lại sự thay đổi đáng kể trong cuộc chiến chống lại viêm gan C. Năm 2016, Hiệp hội Nghiên cứu Bệnh Gan Hoa Kỳ và Hiệp hội Bệnh Truyền nhiễm Hoa Kỳ đã cùng công bố những khuyến nghị quan trọng liên quan đến điều trị bệnh này.
Theo khuyến nghị này, Sofosbuvir được áp dụng như một phần quan trọng của phác đồ điều trị bậc một đối với các kiểu gen HCV 1, 2, 3, 4, 5 và 6. Nó cũng đóng vai trò quan trọng trong một số phương pháp điều trị bậc hai. Sự kết hợp giữa Sofosbuvir/velpatasvir được đề xuất cho hầu hết các kiểu gen với tỷ lệ chữa khỏi lớn hơn 90% và thậm chí gần 100% trong hầu hết các trường hợp. Thời gian điều trị thường kéo dài 12 tuần.
Sofosbuvir cũng có thể được kết hợp với các loại thuốc khác và thời gian điều trị có thể kéo dài tùy thuộc vào tình hình cụ thể, kiểu gen của virus và quyết định dựa trên hiệu quả chi phí.
Ví dụ, để điều trị nhiễm gan C kiểu gen 1, 4, 5 và 6, Sofosbuvir có thể kết hợp với thuốc ức chế virus NS5A ledipasvir. Trong trường hợp kiểu gen 2 và 3, Sofosbuvir có thể kết hợp với daclatasvir. Đối với bệnh nhân có xơ gan hoặc cần ghép gan, ribavirin có thể được sử dụng dựa trên cân nặng.
Phác đồ điều trị dựa trên Sofosbuvir đã đem lại tỷ lệ chữa khỏi cao hơn, giảm tác dụng phụ và rút ngắn thời gian điều trị so với các phương pháp trước đây. Sofosbuvir đã giúp rất nhiều người được điều trị mà không phải chịu sự khó chịu từ peginterferon, một thành phần chính của các phương pháp điều trị trước đây với các tác dụng phụ nghiêm trọng.
Với những người đã không thành công trong việc điều trị bằng các phương pháp trước đó, việc sử dụng lại Sofosbuvir kết hợp với ledipasvir hoặc daclatasvir, có hoặc không có ribavirin dựa trên cân nặng, là một lựa chọn khả thi. Quyết định về thời gian điều trị lại phụ thuộc vào nhiều yếu tố, bao gồm loại thuốc được sử dụng, tình trạng gan của bệnh nhân và sự phân loại của tổn thương gan.
Dược động học
Hấp thu
Khi được dùng qua đường uống, thuốc này đạt nồng độ tối đa trong huyết tương sau khoảng 0,5 đến 2 giờ, với nồng độ tối đa (Cmax) đạt mức 567 ng/mL.
Phân bố
Khối lượng phân phối của Sofosbuvir vẫn chưa có thông tin cụ thể. Tuy nhiên, Sofosbuvir kết hợp với protein huyết tương người khoảng 61-65%.
Chuyển hóa
Các nghiên cứu in vitro trên microsome gan người đã chỉ ra rằng Sofosbuvir là chất nền hiệu quả cho Cathepsin A (Cat A) và carboxyl esterase 1 (CES1). Sofosbuvir trải qua sự phân cắt bởi Cat A và CES1, sau đó tiếp tục qua các bước kích hoạt bao gồm loại bỏ axit amin bằng protein liên kết nucleotide histidine triad nucleotide 1 (HINT1) và phosphoryl hóa bằng uridine monophosphate-cytidine monophosphate (UMP-CMP) kinase và nucleoside diphosphate (NDP) kinase. Dữ liệu in vitro cho thấy Sofosbuvir (S-diastereomer) được thủy phân tốt hơn bởi Cat A, trong khi CES1 không thể hiện tính chọn lọc lập thể.
Thải trừ
Sự thải trừ của Sofosbuvir xảy ra thông qua ba đường: qua nước tiểu (80%), qua phân (14%) và qua hô hấp (2,5%), với đào thải chủ yếu thông qua thận. Tuy nhiên, độ thanh thải chính xác của Sofosbuvir vẫn chưa được xác định. Thời gian bán hủy cuối cùng của thuốc là khoảng 0,4 giờ.
Phương pháp sản xuất
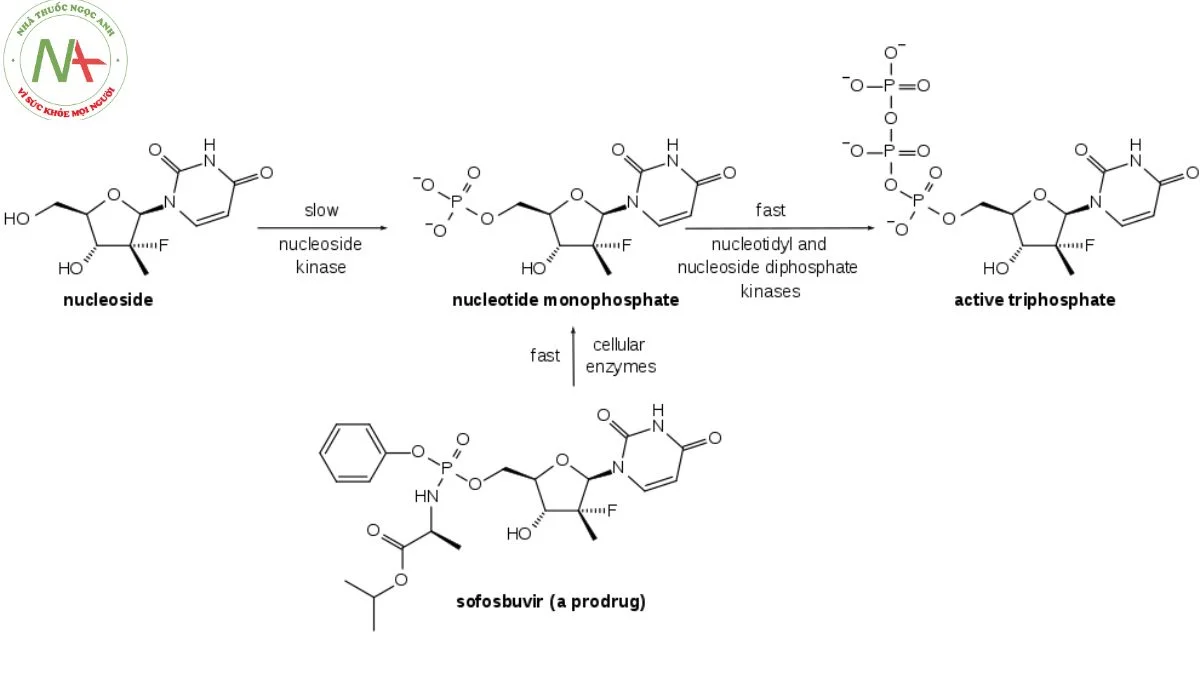
Trước khi Sofosbuvir xuất hiện, đã có nhiều loại chất tương tự nucleoside được xem xét là tiềm năng trong việc điều trị bệnh viêm gan C. Tuy nhiên, chúng đã cho thấy hiệu quả tương đối thấp. Hiệu quả thấp này một phần bởi vì quá trình bổ sung enzyme cho nhóm phosphate đầu tiên trong ba nhóm phosphate của triphosphate diễn ra chậm.
Sự thiết kế đặc biệt của Sofosbuvir dựa trên phương pháp ProTide đã giải quyết vấn đề này. Thay vì đợi quá trình bổ sung enzyme chậm chạp, Sofosbuvir đã tích hợp sẵn nhóm phosphate đầu tiên vào cấu trúc của thuốc trong quá trình tổng hợp. Các nhóm bổ sung được gắn vào phốt pho, tạm thời che giấu hai điện tích âm của nhóm phốt phát, giúp thuốc có khả năng xâm nhập vào tế bào bị nhiễm bệnh một cách hiệu quả. Điều này đã tạo điều kiện thuận lợi cho việc tiếp tục điều trị. Protein NS5B, một RNA polymerase phụ thuộc RNA quan trọng đối với chu kỳ sinh sản của virus, đóng vai trò quan trọng trong quá trình này.
Độc tính ở người
Sofosbuvir, khi sử dụng độc lập, thường không gây ra độc tính đáng kể. Các phản ứng phụ phổ biến nhất thường bao gồm cảm giác đau đầu và mệt mỏi.
Một điểm đáng chú ý là đã có báo cáo về việc sử dụng một liều siêu cao của Sofosbuvir lên đến 1200 mg đối với 59 người khỏe mạnh mà không ghi nhận tác dụng không mong muốn nào ở mức liều này. Các tác dụng phụ, khi sử dụng liều này, có tần suất và mức độ nghiêm trọng tương tự như những tác dụng phụ được báo cáo trong nhóm điều trị bằng giả dược và Sofosbuvir 400 mg.
Một điểm tích cực là Sofosbuvir không gây ra hiện tượng quang sai nhiễm sắc thể khi sử dụng tế bào lympho trong máu ngoại vi của con người.
Tính an toàn
Hiện chưa có đủ dữ liệu về con người để xác định liệu Sofosbuvir có gây nguy cơ cho thai kỳ hay không. Tuy nhiên, cần lưu ý rằng ribavirin, một loại thuốc thường được sử dụng kết hợp với Sofosbuvir để điều trị viêm gan C, đã được FDA xếp vào loại X (chống chỉ định trong thai kỳ) đối với phụ nữ mang thai.
Phụ nữ mang thai bị viêm gan C và sử dụng ribavirin đã gây ra một số trường hợp thai nhi bị dị tật bẩm sinh và tử vong. Vì vậy, khuyến nghị tránh kết hợp Sofosbuvir và ribavirin ở phụ nữ mang thai và đối tác nam của họ để giảm nguy cơ các tác động có hại cho thai nhi do ribavirin gây ra.
Đối với phụ nữ có khả năng mang thai, nên thực hiện kiểm tra thai 2 tháng trước khi bắt đầu điều trị kết hợp Sofosbuvir, ribavirin và peginterferon, và tiếp tục kiểm tra hàng tháng trong suốt thời gian điều trị và sáu tháng sau để giảm nguy cơ gây hại cho thai nhi trong trường hợp vô tình mang thai.
Sofosbuvir chưa được nghiên cứu kỹ về tác động đối với trẻ sơ sinh khi mẹ của họ đang điều trị nhiễm viêm gan C. Mặc dù đã có một trường hợp trẻ sơ sinh được bú sữa mẹ trong 3 tuần và không có bất thường về phát triển, nhưng cần cẩn trọng và thận trọng khi đưa ra quyết định. Nếu người mẹ chỉ sử dụng Sofosbuvir hoặc Sofosbuvir kết hợp với ledipasvir, thì không có lý do để ngừng cho con bú. Một số nguồn khuyến nghị không nên cho con bú khi sử dụng Sofosbuvir kết hợp với ribavirin.
Viêm gan C không lây truyền qua sữa mẹ và sữa mẹ đã được chứng minh có tác dụng làm bất hoạt virus viêm gan C (HCV). Tuy nhiên, Trung tâm Kiểm soát Bệnh tật (CDC) khuyến cáo các bà mẹ nhiễm HCV cân nhắc việc ngừng cho con bú nếu núm vú bị nứt hoặc chảy máu. Hiện chưa rõ liệu cảnh báo này có áp dụng cho những bà mẹ đang điều trị viêm gan C hay không.
Trẻ sơ sinh có mẹ nhiễm HCV nên được xét nghiệm để kiểm tra viêm gan C, vì kháng thể của mẹ có thể hiện diện trong 18 tháng đầu đời và trước khi trẻ phát triển khả năng miễn dịch. Xét nghiệm axit nucleic được khuyến khích trong trường hợp này.
Tương tác với thuốc khác
Không nên kết hợp sử dụng Sofosbuvir cùng với amiodarone, do có nguy cơ gây ra nhịp tim chậm bất thường.
Sofosbuvir tương tác với P-glycoprotein, một protein vận chuyển có vai trò trong việc đưa thuốc và các chất khác từ tế bào biểu mô ruột trở lại ruột. Vì vậy, các chất kích thích P-glycoprotein ruột, như rifampicin và St. John’s wort, có thể làm giảm quá trình hấp thu của sofosbuvir.
Ngoài ra, việc sử dụng sofosbuvir đồng thời với các loại thuốc như thuốc chống co giật (carbamazepine, phenytoin, phenobarbital, oxcarbazepine), thuốc chống vi khuẩn (rifampin, rifabutin, rifapentine) và thuốc ức chế protease HIV tipranavir và ritonavir có thể làm giảm nồng độ sofosbuvir. Do đó, không khuyến khích việc sử dụng chúng đồng thời.
Sự tương tác giữa sofosbuvir và một số loại thuốc khác như ciclosporin, darunavir/ritonavir, efavirenz, emtricitabine, methadone, raltegraver, rilpivirine, tacrolimus hoặc tenofovir disoproxil đã được nghiên cứu trong các thử nghiệm lâm sàng và không yêu cầu điều chỉnh liều cho bất kỳ loại thuốc nào trong danh sách này.
Lưu ý khi sử dụng Sofosbuvir
Khi sử dụng Sofosbuvir độc lập, không có chống chỉ định cụ thể nào. Tuy nhiên, khi kết hợp với ribavirin hoặc peginterferon alfa/ribavirin hoặc các loại thuốc khác, các chống chỉ định áp dụng cho các thuốc này sẽ áp dụng cho cả sofosbuvir.
Nếu bạn từng mắc bệnh viêm gan B, lưu ý rằng tình trạng này có thể tiến triển hoặc tồi tệ hơn trong quá trình sử dụng hoặc sau khi ngừng sử dụng sofosbuvir. Do đó, bạn có thể cần thường xuyên kiểm tra chức năng gan trong vài tháng.
Sofosbuvir thường được sử dụng kết hợp với các loại thuốc khác nên hãy đọc hướng dẫn sử dụng của từng loại thuốc hoặc hướng dẫn dành cho bệnh nhân được cung cấp cùng mỗi loại thuốc trong liệu pháp kết hợp. Đừng thay đổi liều lượng hoặc lịch dùng thuốc mà không có lời khuyên từ bác sĩ.
Lưu ý rằng nhịp tim chậm và cần thiết phải đặt máy tạo nhịp tim đã được báo cáo khi amiodarone được sử dụng kết hợp với sofosbuvir và một số loại thuốc điều trị viêm gan C khác. Các biến chứng này có thể gây tử vong và thường xảy ra trong vòng hai tuần sau khi bắt đầu điều trị viêm gan C. Nếu bạn đang sử dụng amiodarone trong quá trình điều trị viêm gan C và có bất kỳ dấu hiệu nào như đau ngực, lú lẫn, chói mắt, ngất xỉu hoặc sắp ngất, sự mất trí, khó thở, mệt mỏi hoặc suy nhược, hãy liên hệ ngay với bác sĩ.
Cuối cùng, không có thông tin cho thấy sofosbuvir ngăn chặn sự lây lan của các bệnh như viêm gan qua đường máu hoặc quan hệ tình dục. Do đó, khi quan hệ tình dục, luôn sử dụng bao cao su latex hoặc polyurethane. Hãy tránh chia sẻ kim tiêm hoặc bất kỳ vật dụng cá nhân nào như bàn đánh răng hoặc dao cạo râu với người khác.
Một vài nghiên cứu của Sofosbuvir trong Y học
Phân tích tổng hợp về hiệu quả và độ an toàn của sofosbuvir trong điều trị nhiễm virus viêm gan C
Đặt vấn đề: Nhiễm virus viêm gan C là một vấn đề sức khỏe toàn cầu và là một trong những nguyên nhân hàng đầu gây xơ gan và ung thư biểu mô tế bào gan. Gần đây, sofosbuvir đã được đưa vào kho vũ khí trị liệu chống lại loại virus này, từ đó mở đường cho chế độ điều trị bằng đường uống.
Mục đích của tổng quan Nghiên cứu này nhằm mục đích phân tích một cách có hệ thống hiệu quả và độ an toàn của sofosbuvir trong điều trị nhiễm virus viêm gan C.
Phương pháp: Việc tìm kiếm cơ sở dữ liệu PubMed và EMBASE được tiến hành bằng cách sử dụng “sofosbuvir” làm thuật ngữ tìm kiếm. Các nghiên cứu lâm sàng Giai đoạn III được lấy từ hai cơ sở dữ liệu và tài nguyên được đăng trên các trang web Drug@FDA và ClinicTrials.gov đã được đánh giá dựa trên kết quả phân tích hiệu quả và độ an toàn của thuốc.
Kết quả: Tám nghiên cứu lâm sàng giai đoạn III so sánh hiệu quả và độ an toàn của sofosbuvir.
Khi sofosbuvir thay thế peginterferon đã được sử dụng trong phác đồ tiêu chuẩn trước đó, đã đạt được đáp ứng virus bền vững vượt trội, được xác định bằng tải lượng RNA của virus thấp hơn giới hạn định lượng dưới 12 tuần sau khi ngừng điều trị (74,3 so với 66,7%, p). < 0,05).
Phản ứng thậm chí còn được cải thiện nhiều hơn (90,8 so với 66,7%, p < 0,0001) khi sofosbuvir được sử dụng như một liệu pháp bổ sung cho chế độ điều trị tiêu chuẩn.
Tỷ lệ chênh lệch tổng thể đạt được đáp ứng ở nhóm dùng sofosbuvir trong 8 nghiên cứu lâm sàng cao hơn 3,66 lần (KTC 95% 3,00-4,46) so với nhóm dùng phác đồ tiêu chuẩn.
Trong 8 nghiên cứu lâm sàng, các tác dụng phụ đã được quan sát thấy ở 83,61 và 87,22% bệnh nhân dùng sofosbuvir và không dùng sofosbuvir, trong đó các tác dụng phụ thường gặp nhất là các triệu chứng nhẹ ở hệ thần kinh trung ương như mệt mỏi, nhức đầu và suy nhược.
Kết luận: Sofosbuvir an toàn và hiệu quả trong điều trị nhiễm virus viêm gan C kiểu gen 1, 2, 3 hoặc 4. Tuy nhiên, việc thiếu đáp ứng virus kéo dài ngoài thời gian nghiên cứu và những lo ngại về an toàn lâu dài cần được giải quyết trong các nghiên cứu trong tương lai.
Tài liệu tham khảo
- Drugbank, Sofosbuvir, truy cập ngày 24 tháng 9 năm 2023.
- Yang, H. J., Ryoo, J. Y., & Yoo, B. K. (2015). Meta-analysis of the efficacy and safety of sofosbuvir for the treatment of hepatitis C virus infection. International journal of clinical pharmacy, 37(5), 698–708. https://doi.org/10.1007/s11096-015-0144-x
- Pubchem, Sofosbuvir, truy cập ngày 24 tháng 9 năm 2023.
- Bộ Y Tế (2012), Dược thư quốc gia Việt Nam, Nhà xuất bản Y học, Hà Nội
Xuất xứ: Ấn Độ
Xuất xứ: Việt Nam
Xuất xứ: Ấn Độ
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Ấn Độ
Xuất xứ: Canada
Xuất xứ: Việt Nam
Xuất xứ: Ấn Độ
Xuất xứ: Việt Nam
Xuất xứ: Ấn Độ
Xuất xứ: Ấn Độ