Hóa sinh
Hóa học Protid: Danh pháp, cấu trúc, vai trò, phân loại và các tính chất
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
nhathuocngocanh.com – Bài viết Hóa học Protid: Danh pháp, cấu trúc, vai trò, phân loại và các tính chất
ĐẠI CƯƠNG
– Là đại phân tử, do các acid amin nối với nhau bằng liên kết peptide.
- Một trong ba nhóm chất sinh học chính của cơ thể.
- Cấu tạo từ nguyên tố’ C, H, O, N, đôi khi có S, P.
- 3 nhóm phân tử gồm acid amin, peptide và Pr được gọi chung là
- Chức năng:
+ Xây dựng – bảo vệ.
+ Xúc tác phản ứng.
+ Vận chuyển các chất.
+ Dinh dưỡng – dự trữ.
+ Điều hòa…
ACID AMIN
Cấu tạo
Công thức
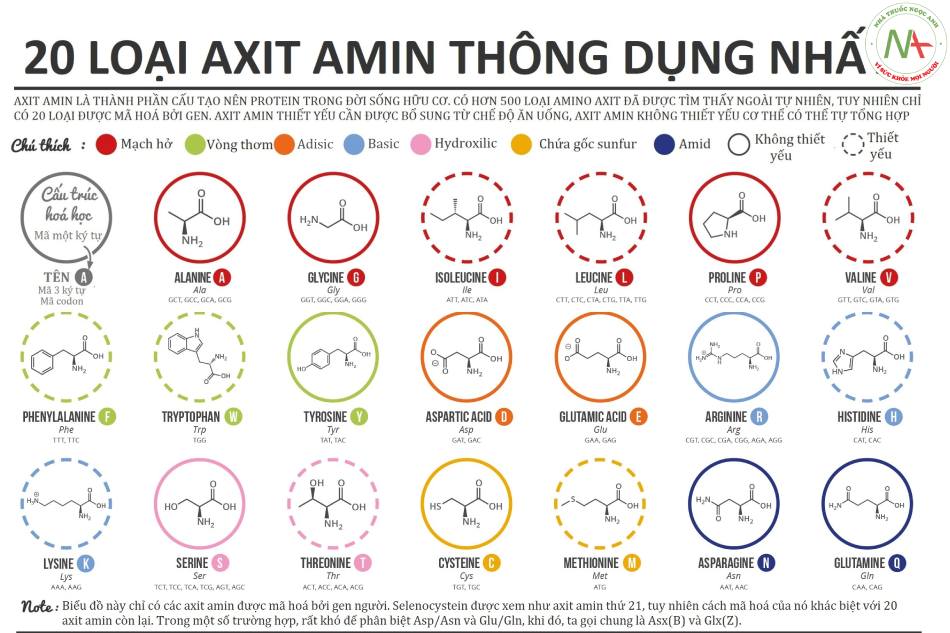
- Trong tự nhiên có trên 300 loại acid amin, nhưng trong cơ thể ĐV có vú có khoảng 20 loại acid amin thường gặp và một số dẫn xuất của các acid amin này.
- Công thức thường gặp là 1 nhóm amin -NH2 và 1 nhóm carboxyl -COOH cùng gắn vào 1 nguyên tử C, thường là C thứ hai từ đầu carboxyl -COOH (Ca) => Gọi là a-acid amin.
- Các acid amin khác nhau ở gốc R- (chuỗi bên R-) về cấu trúc, kích thước, điện tích,…
- 20 loại acid amin thường gặp đều là a-acid amin.
- Chuỗi bên R- quan trọng trong hình thành cấu trúc Pr(cysteine tạo cầu nối disulfua cysterin S-S-cysteine), tham gia các nhóm trung tâm hoạt động của enzyme (nhân imidazole của histidine).
- Dẫn xuất acid amin gồm dẫn xuất của a-acid amin và các acid amin khác (không phải a).
- Các dẫn xuất này chủ yếu tham gia vào quá trình chuyển hóa, cấu tạo các Pr đặc biệt.
VD: 4-hydroxyproline và 5-hydroxylysine tham gia cấu tạo collagen.
Methyllysine tham gia cấu tạo myosin ở mô cơ (hình bên). Selenocysteine tham gia hoạt hóa men trong tổng hợp Pr.
Tên gọi và ký hiệu
Như bảng 20 acid amin thường gặp.
Vai trò
- Chức năng chính: Đơn vị cấu tạo của Pr.
- Chức năng khác:
- Tham gia cấu trúc tế bào.
- Hormone, các chất điều hòa.
- Xúc tác.
- Chất dẫn truyền thần kinh.
Phân loại
Dựa vào tính chất phân cực và tích điện:
| Không phân cực | Phân cực và không tích điện | Phân cực và tích điện | |
| m (nhóm carboxyl) | Dương (nhóm amin) | ||
| Leucine Isoleucine
Alanine Phenylalanine Valine Methionine Trytophan Glycine Proline Tyrosine |
Serine
Asparagine Glutamine Threonine Cysteine |
Aspartate Glutamate | Histidine
Arginine Lysine |
– Tính phân cực và tích điện của mạch bên thể hiện vai trò của acid amin trong peptide.
| Acid amin có mạch bên kỵ nước | Acid amin có mạch bên ưa nước |
| – Không tương tác với môi trường nước.
– Chiếm phần lớn bề mặt phía trong Pr. – Không bị ion hóa, không tạo liên kết hydro. |
– Tương tác với môi trường nước (liên kết hydro).
– Chiếm phần lớn bề mặt phía ngoài Pr. – Có mặt ở các trung tâm hoạt động của enzyme. |
Dựa vào cấu trúc gốc R-:
| R là mạch thẳng | R chứa nhân thơm | |||||
| Hydrocarbon | Nhóm OH | Chứa S | Nhóm base | Nhóm acid và amid của nó | Đồng vòng | Dị vòng |
| Glycine
Alanine Valine Leucine Isoleucine |
Serine
Threonine Tyrosine |
Cysteine Methionine | Arginine Lysine Histidine | Aspartate Asparagine Glutamate Glutamine | Tyrosine
Phenylalanine |
Histidine
Trytophan Proline |
Một số dẫn xuất acid amin thường gặp:
| Dẫn xuất acid amin | Vai trò |
| 4- hydroxyproline
5-hydroxylysine |
Thành phần của collagen. |
| Methyllysine | Thành phần của myosin. |
| Demosine (4 Lys) | Thành phần của elastin. |
| y-carboxyglutamate | Thành phần của prothrombin. |
| Selenocysteine | Tham gia hoạt hóa men trong tổng hợp Pr. |
| Cystine (dicysteine) | Cấu trúc Pr. |
| Monoiodotyrosin
Diiodotyrosin |
Tiền chất của hormone tuyến giáp. |
| Ornithine và Citruline | Sản phẩm trung gian của quá trình ure. |
Hóa học lập thể của acid amin
Nhắc lại tính quang hoạt:
- Là khả năng làm quay mặt phẳng ánh sáng phân cực sang trái hoặc phải.
- Được biểu hiện bởi góc quay đặc hiệu cho mỗi chất.
- Góc quay phụ thuộc pH dung dịch và độ dài ánh sáng đơn sắc.
- Muốn có tính quang hoạt, phân tử phải có ít nhất 1 C bất đối xứng (C*).
Tính quang hoạt của acid amin:
- Trong 20 loại acid amin thường gặp (trừ glycine) đều có C* nên đều có tính quang hoạt => Có đồng phân quang học.
Nhắc lại công thức:
Số đồng phân quang học = 2n (với n = số C* trong phân tử)
- Threonine và isoleucine có 2 C*, còn lại đa số các acid amin thường gặp có 1 C*.
- Cấu hình D- hoặc L- do sự sắp xếp của 4 nhóm nguyên tử của C :
+ Nếu -NH2 của C* ở bên trái sườn C: Đồng phân dạng L-.
+ Nếu -NH2 của C* ở bên phải sườn C: Đồng phân dạng D-.
- Các acid amin thường gặp trong cơ thể ĐV có vú là L-acid amin.
- D-acid amin chỉ gặp ở thành tế bào một số’ VSV.
Dược lý:
- Một số’ thuốc dẫn xuất từ L-acid amin sẽ ghi thêm chữ “L-” trước tên.
VD: L-DOPA (Levodopa) điều trị Parkinson là dẫn xuất của L-tyrosine.
Levothyrox điều trị nhược giáp là 1 dẫn xuất khác của L-tyrosine.
Các dạng điện tích của acid amin
Các dạng điện tích
- Các acid amin mang ít nhất 2 nhóm acid yếu: 1 COOH và 1 NH3+.
- Trong dung dịch, acid amin có thể phân ly như sau:
R-COOH —>> R-COO- + H+
R-NH3+ —>>> R-NH2 + H+
- R-NH3+ và R-COOH đại điện cho chức acid, còn R-NH2 và R-COO– là những base liên hợp.
- Acid amin có thể tích điện âm hoặc dương tùy theo pH môi trường:
+ Nếu pH kiềm: Acid amin phân ly như acid, trở thành ion âm.
+ Nếu pH acid: Acid amin phân ly như base, trở thành ion dương.
pHi
- Khi hòa tan acid amin vào dung dịch, do có tính lưỡng tính => Tạo cân bằng giữa 3 dạng điện tích theo tỷ lệ khác nhau tùy thuộc pH dung dịch.
Định nghĩa: pHi (pH đẳng điện) là pH mà ở đó dạng ion lưỡng cực chiếm đa số’, cation và anion bằng nhau (chiếm ít nhất) => Điện tích lúc này sẽ bằng 0, phân tử acid amin không di chuyển trong điện trường.
Cách tính pHi
- Xét phản ứng: HA < = = > A– + H+ với HA là 1 acid yếu, với độ mạnh là pKa.
Theo phương trình Handerson-Hasselbach:
Ka = [H+][A−]/[HA] => pKa = pH – log10([A−]/[HA])
– Khi [A–] = [HA] => pKa = pH.
Công thức tính trị số pHi:
pHi = (pK1 + pK2)/2 (với pK1, pK2 là 2 dạng điện tích ở 2 bên lưỡng cực) Ta có các trường hợp sau:
pHi của monoamino dicarboxylic acid: Lấy dạng trung hòa điện tích làm mốc, rồi lấy trung bình cộng 2 trị số’ gần dạng trung hòa nhất.
VD: pHi theo hình bên là:
pHi của monoamino monocarboxylic acid: Như công thức trên.
pHi của diamino monocarboxylic acid: Tương tự với monoamino dicarboxylic acid.
Tính chất của acid amin
Tính chất vật lý
- Có khả năng ion hóa => Tan trong dung môi phân cực, dễ tan khi gố’c R- nhỏ.
- Có vị ngọt kiểu đường (glycine, serine,…), kiểu đạm (sodium glutamate).
- Có tính triền quang (tính quang hoạt, đã đề cập ở trên).
- Có khả năng thay đổi tính ion hóa (đã đề cập ở trên).
- Tất cả acid amin đều hấp thụ ánh sáng ở vùng tia hồng ngoại, trừ Phe, Tyr và Trp ở vùng tia cực tím => Nồng độ Pr tót nhất ở bước sóng 280 I
Tính chất hóa học
Phản ứng do nhóm a-amin:
Gốc R- có nhiều nhóm chức hóa học khác nhau
= > Phản ứng đặc biệt giúp nhận biết 1 số’ acid amin.
VD: Phản ứng tạo muối với acid vô cơ.
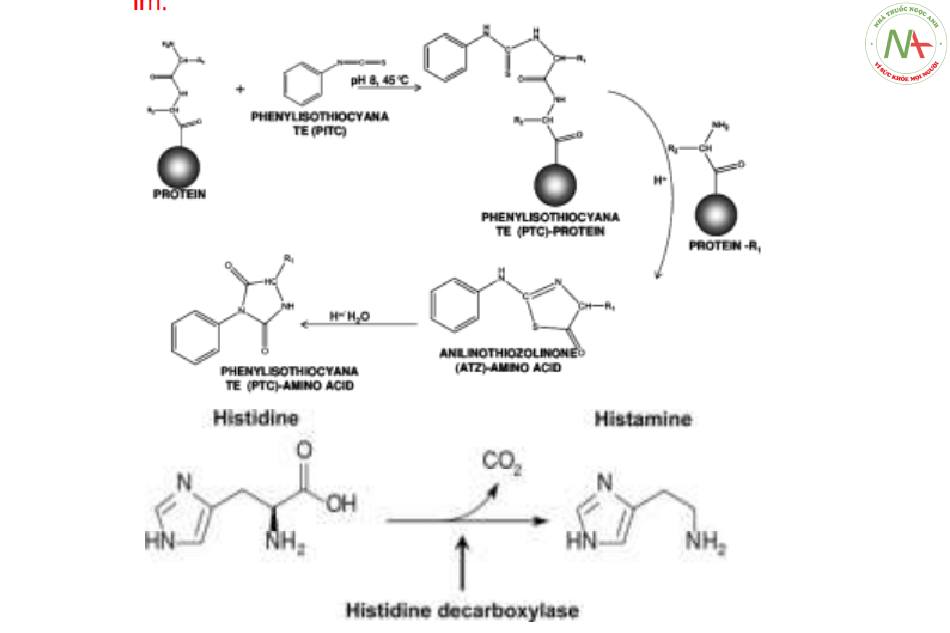
Phản ứng với DNP (phản ứng Sanger).
Phản ứng với phenylisothiocyanat (PITC)
(phản ứng Edman).
Phản ứng do nhóm a-carboxyl:
VD: Phản ứng tạo muối với base.
Phản ứng khử gốc carboxyl.
- Các gốc R- khác nhau cho phản ứng khác nhau.
Phản ứng tạo liên kết peptide:
- Phản ứng giữa nhóm a-amin của acid amin này với nhóm a-carboxyl của acid amin kế cận, loại 1 phân tử nước => Tạo liên kết peptide.
- Liên kết peptide là liên kết cơ bản và quan trọng nhất trong phân tử Pr.
Phản ứng Ninhydrin:
- Dung dịch Pr, peptide hoặc acid amin khi đun nóng với ninhydrin cho ra màu xanh tím (trừ proline và hydroxyproline cho phức màu vàng).
- Dùng để nhận biết acid amin bằng phương pháp sắc ký.
Phân tích hỗn hợp acid amin
- Ta có thể tóm tắt các phương pháp này thành bảng sau:
| Trước kia | Hiện nay |
| Phương pháp sắc ký trên giấy (Ninhydrin).
Phương pháp dùng phản ứng đặc hiệu với gốc R-. |
Phương pháp sắc ký cột trao đổi. Phương pháp phân tích quang phổ khối. |
PEPTIDE
Cấu tạo
- Là các acid amin nối lại với nhau bằng liên kết peptide.
- Mỗi chuỗi peptide đều có nhóm a-carboxyl và a-amin tự do ở 2 đầu.
- Peptide có n acid amin thì có (n-1) liên kết peptide.
- Có trọng lượng phân tử < 6000 kDa.
- Tồn tại trong cơ thể dưới 2 dạng:
+ Sản phẩm thủy phân dang dở của Pr lớn hơn (gelatin là sản phẩm thủy phân của collagen).
+ Phân tử độc lập có hoạt tính sinh học (insulin, glucagon,…).
Danh pháp
| Theo số lượng | acid amin trong phân tử: |
| Tiếp đầu ngữ chỉ số’ lượng (di-,tri-,tetr-,…) + peptide |
- Nếu phân tử có dưới 10 acid amin: Gọi là oligopeptide
- Nếu phân tử có trên 10 acid amin: Gọi là polypeptide
- Mang tính tương đối.
Theo hệ thống danh pháp hóa hữu cơ:
- Thể hiện rõ số’ lượng và loại acid amin trong phân tử peptide.
- Đọc từ trái qua phải, bắt đầu từ đầu tận amin và kết thúc ở đầu tận carboxyl.
- Có 2 cách đọc:
+ Thêm đuôi “-yl” ở tên acid amin, VD: H2N – Seryl – Glycyl – Tyrosyl – Alanyl – COOH.
+ Viết tắt bằng 3 chữ cái đầu, VD: Ser-Gly-Tyr-Ala.
Theo tên riêng:
- Dùng cho 1 số’ peptide quan trọng, có hoạt tính sinh học.
VD: Glucagon (29 acid amin), insulin (51 acid amin),…
Một số lưu ý khác:
- Cách biểu thị thành phần, thứ tự acid amin trong peptide như sau:
VD: Seryl – Alanyl -Methionyl – Valyl – Glycyl (theo cách thêm đuôi “-yl”).
Ser – Ala – Met – Val – Gly (theo cách viết tắt 3 chữ đầu). SAMVG (theo cách viết tắt 1 chữ đầu (ít phổ biến)).
– Đoạn chưa xác định được thứ tự trong peptide sẽ được viết trong ngoặc đơn. VD: Ser – Gly – (Ala, Gly, Tyr) – Pro – Cys.
Tính chất
– Do được cấu tạo từ acid amin => Peptide có tính tích điện âm hoặc dương tùy pH môi trường hòa tan.
– Có thể phân loại hỗn hợp peptide bằng điện di hoặc miễn dịch sắc ký.
Phản ứng Biuret:
Các peptide có > 3aa cho phản ứng màu (+) => Giúp xác định liên kết peptide, định lượng Pr.
- Biuret là hợp chất được tạo thành khi đun nóng ure ở nhiệt độ cao.
- Trong môi trường kiềm, Biuret tác dụng với ion Cu2+ cho phức chất màu hồng tím, đậm độ tỷ lệ thuận với nồng độ của liên kết peptide.
Một số peptide có đặc tính sinh học quan trọng:
| Tên | Số’ acid amin và trình tự (nếu có) | Công dụng |
| Bradykinin | 9 acid amin.
Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe-Arg. |
Hạ huyết áp, tăng phản ứng tự vệ, giảm đau. |
| Glutathion | 3 acid amin.
y-glutamyl – cysterinyl – glycyl. |
Tham gia vào hệ thống oxy hóa-khử. |
| Vasopressin | 9 acid amin. | Tăng huyết áp. |
| Oxytocin | 9 acid amin. | Tăng co bóp tử cung. |
| Insulin | 51 acid amin, gồm 2 chuỗi 30 và 21 acid amin. | Hạ đường huyết. |
| Glucagon | 29 acid amin. | Tăng đường huyết. |
Phân tích thành phần và xác định trình tự acid amin trong chuỗi polypeptide:
Có 3 phương pháp chính:
+ Phân tích quang phổ khối (mass spectrometry).
+ Phản ứng thoái hóa Edman (Edman degradation reaction).
+ Suy ra từ trình tự bộ ba mã hóa (DNA hoặc mRNA).
2 phương pháp sau rất tốn kém => Sử dụng phân tích quang phổ khối.
PROTEIN
Đại cương
– Là 1 hay nhiều chuỗi polypeptide kết hợp lại, có phân tử lượng rất lớn.
– Khi thuỷ phân hoàn toàn => acid amin, không hoàn toàn => peptide.
Phân loại
Theo thành phần hóa học :
- Thuần (chỉ acid amin): albumin, globulin.
- Tạp (acid amin + nhóm ngoại): glucoprotein, lipoprotein.
Theo tính tan:
- Albumin (tan trong nước, dd muối).
- Globulin (tan trong dd muối).
Theo tính chất vật lý:
- Tỷ trọng (VLDL, LDL,…).
- Điện di Pr huyết thanh (a1, a2, p và Y globulin).
Theo hình dạng:
- Protein cầu: insulin, albumin, globulin.
- Protein sợi: keratin, myosin.
Theo chức năng: Pr cấu trúc, Pr vận chuyển.
Cấu trúc của Pr
Cấu hình không gian
- Mạch chính gồm vô số’ liên kết đơn.
- Sự quay tự do của các liên kết => Tạo ra nhiều cấu hình trong không gian.
- Mỗi Pr chỉ có 1 cấu hình không gian riêng biệt => Chức năng sinh lý đặc hiệu.
- Yếu tố quyết định cấu hình không gian gồm:
+ Thành phần và trật tự sắp xếp các acid amin.
+ Dạng cis-trans của liên kết peptide.
+ Sự tham gia của các loại liên kết khác.
Các loại liên kết trong Pr
- Bao gồm 5 loại liên kết sau:
+ 2 liên kết chính: Liên kết peptide và liên kết disulfua.
+ 3 liên kết phụ: Liên kết hydro, liên kết ion và
liên kết giữa các nhóm không phân cực.
Liên kết peptide:
- Là liên kết cơ bản nhất, tạo trục chính cho cấu trúc bậc 1 của phân tử Pr.
- Xét theo nguyên tắc:
+ Pr bậc 1: Liên kết peptide là liên kết đơn.
+ Pr bậc 2: Liên kết peptide là liên kết đôi, do hiện tượng cộng hưởng.
- Khi hệ liên hợp cân bằng, cả liên kết C-N và C-O đều có 50% đặc tính của liên kết đôi.
- Có tính chất của liên kết đôi, giúp hạn chế sự quay tự do của nhóm nguyên tử quanh liên kết.
- Trong mọi phân tử Pr, liên kết peptide là O nhóm COO- ở vị trí trans với H nhóm -NH, trừ vị trí có proline.
- Trong chuỗi polypeptide có proline, khoảng 6% liên kết peptide ở dạng cis.
- Các nguyên tử nhóm peptide đều nằm trên 1 mặt phẳng.
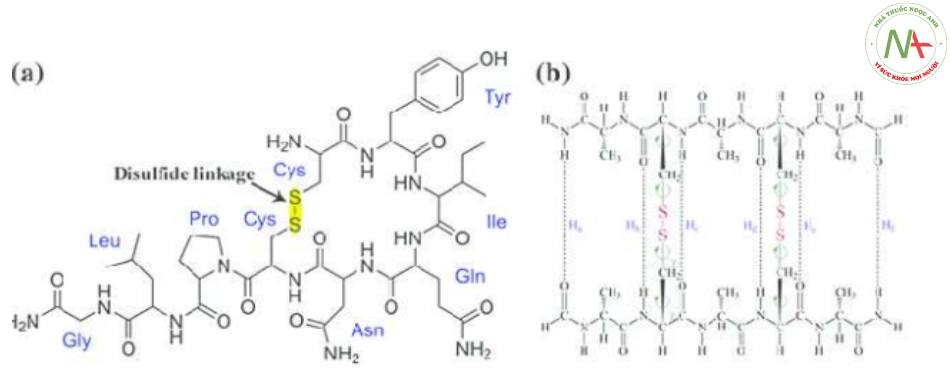
Liên kết disulfua:
- Là liên kết tạo thành giữa 2 nhóm -CH2-SH của 2 phân tử cysteine gần nhau trong cùng 1 chuỗi polypeptide (nội chuỗi) hoặc 2 chuỗi (liên chuỗi peptide).
- Vai trò quan trọng trong việc duy trì cấu trúc bậc 3 của protein => Càng nhiều cầu nối thì càng bền vững.
– Pr của tóc, lông, móng, sừng,… chứa 12% cysteine.
Liên kết hydro:
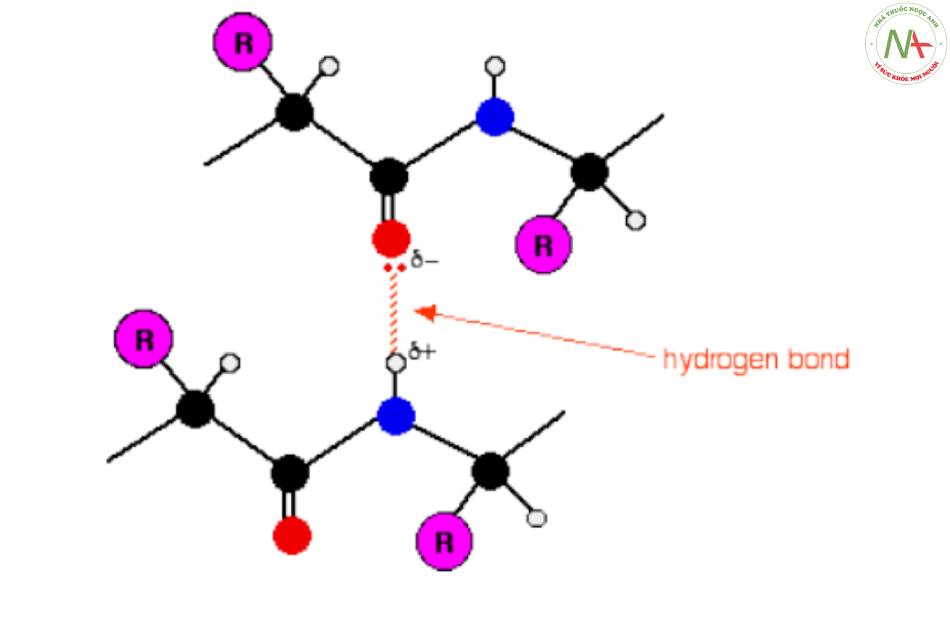
- Là lực hút tĩnh điện giữa H (thuộc nhóm Imino – NH) thừa điện tích (+) và O (thuộc nhóm carbonyl – CO) thừa điện tích (-).
- Là liên kết yếu, nhưng có số’ lượng nhiều nhất.
- Giữ vai trò quan trọng trong việc ổn định cấu trúc bậc 2 Pr.
- Góp phần tạo nên tính linh hoạt của Pr khi tương tác với các phân tử khác.
Liên kết ion: Là lực hút tĩnh điện giữa các nhóm
NH3+ của acid amin diamin và các nhóm COO– của acid amin dicarboxyl.
Liên kết giữa các nhóm không phân cực: Là lực Vander-Walls.
Các bậc cấu trúc của Pr
Cấu trúc bậc 1
- Do các acid amin nối nhau bằng liên kết peptide.
- Trình tự acid amin: đầu tận amin đến đầu tận carboxyl.
- Quyết định hình dạng lập thể và tính chất Pr.
- Sai lệch trình tự sắp xếp => Có thể biến đổi cấu trúc, tính chất Pr.
Cấu trúc bậc 2
- Do chuỗi polypeptide xoắn lại, liên kết hydro đóng vai trò quan trọng.
- Có 3 mô hình cấu trúc bậc 2:
Cấu trúc xoắn (a-helix):
- Xoắn quanh 1 trục tưởng tượng.
- Đường kính vòng xoắn và góc xoắn đặc trưng.
- Các acid amin kỵ nước quay vào trong, acid amin ưa nước quay ra ngoài.
Cấu trúc gấp nếp (fi-pleated sheet):
- Gấp khúc từng đoạn, có hình zigzag.
- Bền do liên kết hydro giữa các chuỗi polypeptide bậc 1 xa nhau.
- Song song với chuỗi polypeptide kế bên cùng chiều và đối song với chuỗi polypeptid kế bên khác chiều.
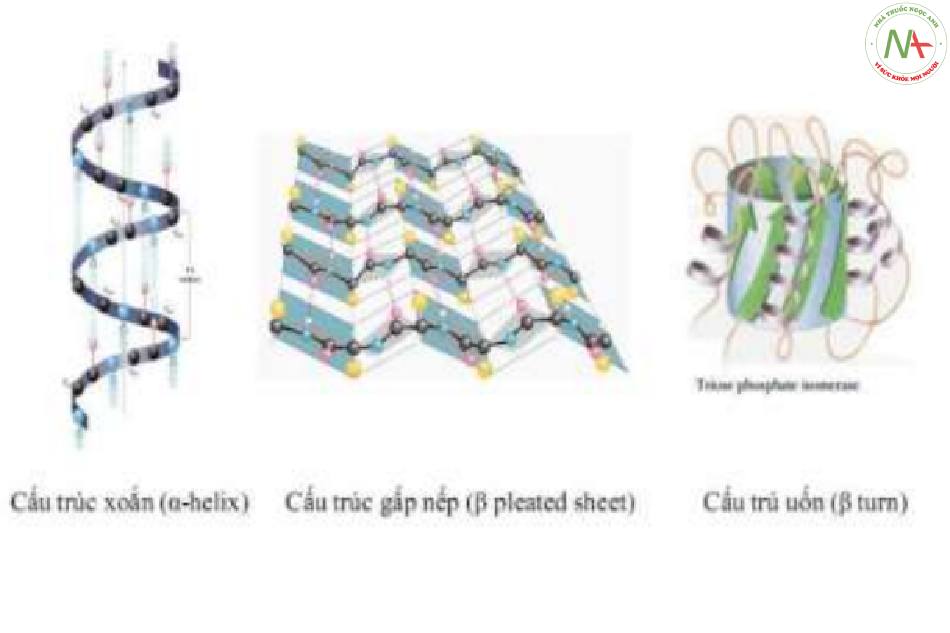
Cấu trúc uốn (fi-turn): Cho phép cấu trúc xoắn và cấu trúc gấp nếp sắp xếp side-by-side.
Cấu trúc bậc 3
- Do chuỗi polypeptid xoắn cuộn, gấp khúc (cấu trúc 3 chiều) với sự tham gia của liên kết disulfur.
- Có vai trò quyết định đối với hoạt tính và chức năng Pr.
- Một số Pr chỉ cần đến cấu trúc bậc 3 đã có chức năng sinh lý.
VD: Myoglobin, triose phosphate isomerase,..
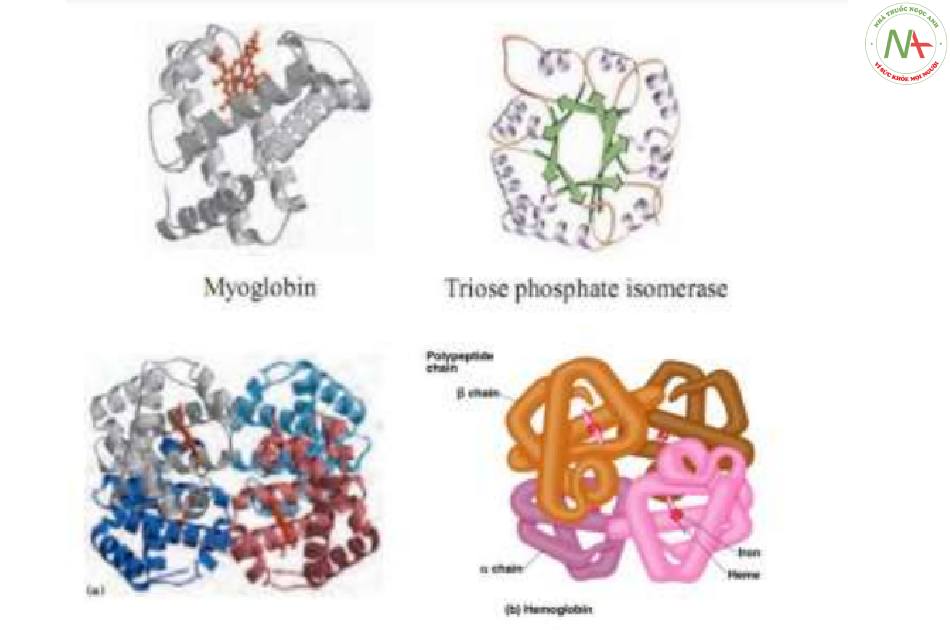
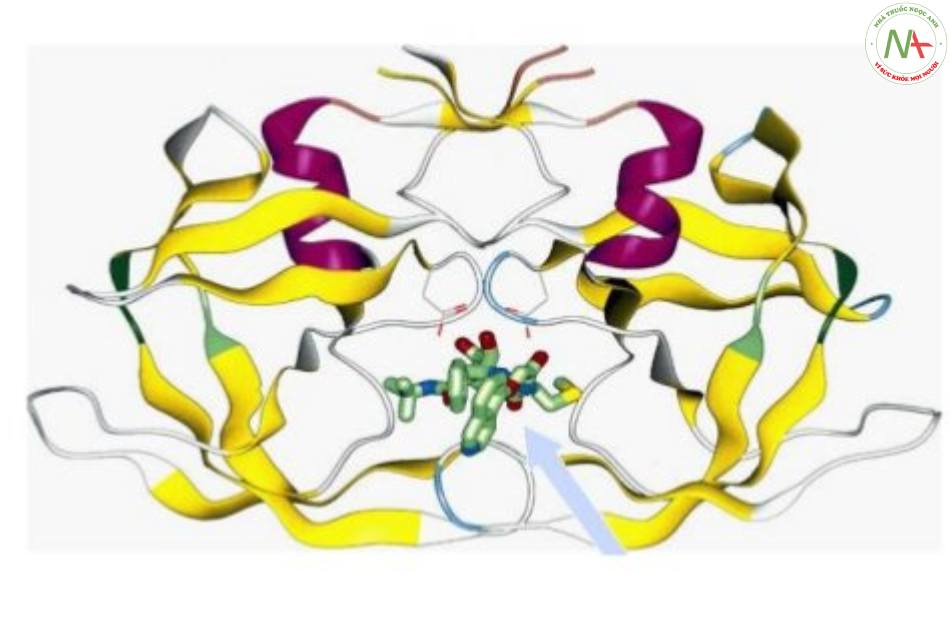
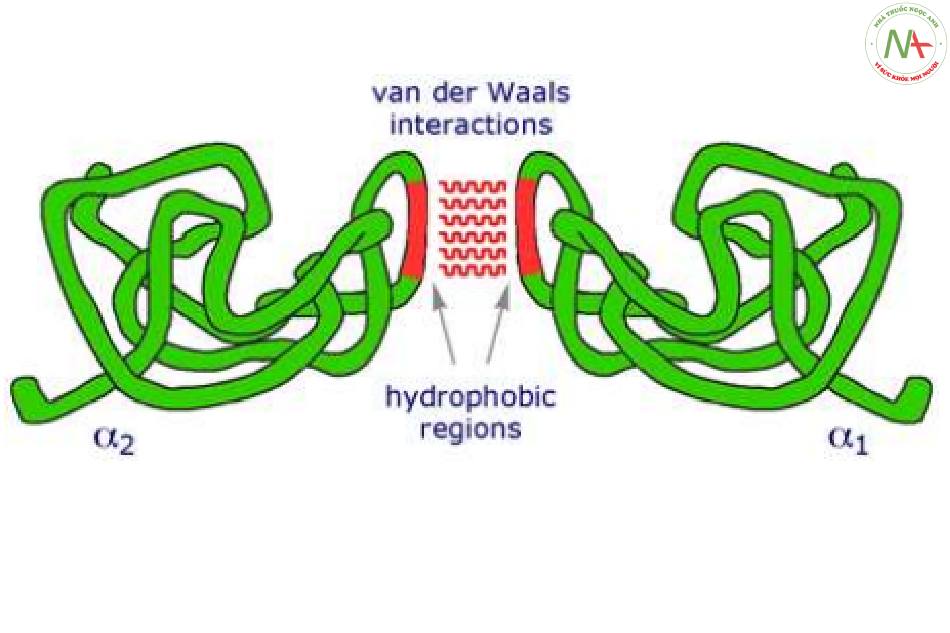
Cấu trúc bậc 4
- Do các cấu trúc bậc 3 kết hợp lại thành một phân tử.
- Giúp giảm thiểu kích thước của Pr.
- Tạo ra cấu hình không gian thích hợp của Pr thực hiện chức năng sinh lý.
CHỨC NĂNG PROTEIN TRONG CƠ THỂ NGƯỜI
| Loại Pr | Chức năng | Ví dụ |
| Pr cấu trúc | Cấu trúc, nâng đỡ | Collagen và elastin (mô liên kết, dây chằng, gân). Keratin (da, lông, móng). |
| Pr enzym | Xúc tác sinh học: tăng nhanh, chọn lọc các phản ứng sinh hóa | Amylase nước bọt: Phân giải tinh bột.
Pepsin dạ dày: Phân giải Pr thức ăn. Alcohol dehydrogenase ở gan: Chuyển hóa rượu. |
| Pr hormone | Điều hòa hoạt động sinh lý bằng kích thích hoặc ức chế hoạt động gen (hoặc Pr) khác | Insulin và glucagon của tụy: Điều hòa glucose máu. Pr kìm hãm hoặc kích thích khối u.
Erythropoietin kích thích sự tạo hồng cầu. |
| Pr vận chuyển | Vận chuyển các chất | Hemoglobin trong hồng cầu vận chuyển O2 từ phổi theo máu đi nuôi tế bào.
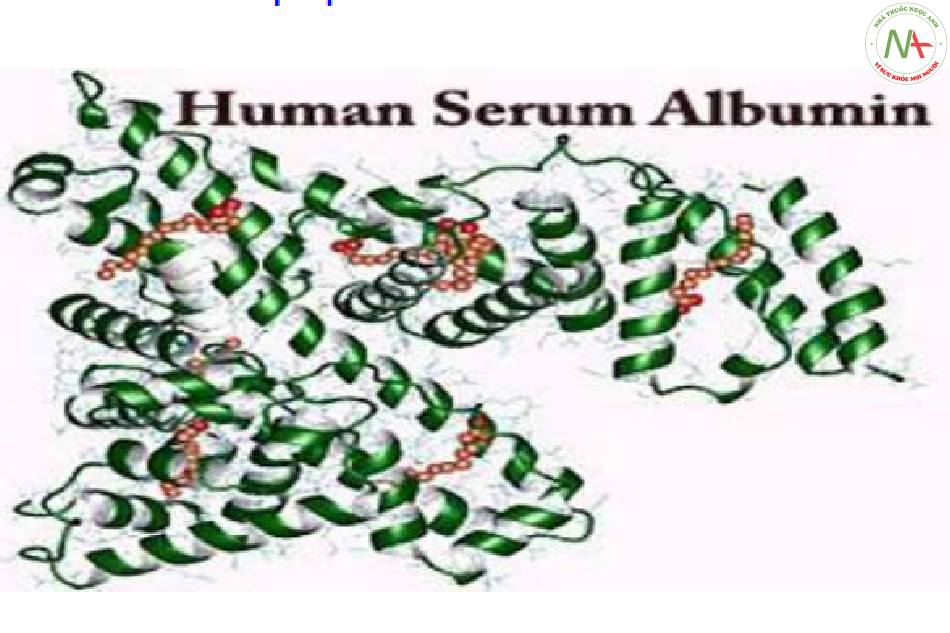
Pr vận chuyển glucose (GLUT) vận chuyển đường trong máu. Pr vận chuyển kim loại như transferrin (vận chuyển sắt), ceruloplasmin (vận chuyển đồng). Albumin vận chuyển bilirubin gián tiếp. |
| Pr vận động | Chức năng vận động của tế bào và cơ thể | Actin, myosin trong vận động cơ. |
| Pr thụ quan | Cảm nhận, đáp ứng các kích thích của môi
trường |
Thụ quan màng của tế bào thần kinh để tiết ra chất trung gian thần kinh và truyền tín hiệu. |
| Pr dự trữ | Dự trữ chất dinh dưỡng | Albumin lòng trắng trứng: Nguồn cung cấp acid amin cho phôi phát triển.
Casein trong sữa mẹ: Nguồn cung cấp đạm cho con. Ferritin: Pr dự trữ sắt. |
| Pr “nâng đỡ” | Vai trò chính trong con đường truyền tín hiệu nội bào: Kết hợp Pr, định vị phức hợp và phối hợp con đường điều hòa ngược âm và dương tính,… | |
| Pr bảo vệ | Bảo vệ cơ thể trước tình trạng tổn thương, sự xâm nhập của kháng nguyên lạ | Các loại kháng thể (immunoglobulin, Ig).
Các yếu tố đông máu (Pr) như thrombin, fibrinogen,.. Pr kháng đông. |
- Ngoài ra, 1 số Pr tổng hợp như aspartame (49 dipeptid tổng hợp) được sử dụng chất ngọt nhân tạo.
TÍNH CHẤT CỦA PROTEIN
Áp suất keo
- Pr hòa tan trong nước, tạo dung dịch keo với đường kính tiểu phân 1nm<d<10nm.
- Pr khuếch tán chậm trong dung dịch, không qua được màng thẩm tích.
- Dung dịch keo có áp suất thẩm thấu (áp suất keo) thấp hơn áp suất thẩm thấu của dung dịch bình thường => Đóng vai trò quan trọng trong vận chuyển nước cùng các chất qua thành mạch.
Sự thẩm tích
- Khi cho dung dịch Pr vào 1 túi làm bằng màng bán thấm rồi nhúng vào nước (dung dịch đẳng trương) thì các phân tử nhỏ (như NaCl) sẽ thoát ra được, còn Pr thì không => Sự thẩm tích, màng bán thấm lúc này gọi là màng thẩm tích.
Ứng dung:
- Trong thí nghiệm sinh hóa: Loại muối ra khỏi dung dịch Pr.
- Trong lâm sàng: Thẩm phân phúc mạc, “chạy” thận nhân tạo,..
Tính acid-base và sự tích điện
Có tính lưỡng tính, trong dd có 3 dạng ion.
Tùy pH của môi trường so với pHi, điện tích của protein thay đổi:
+ Nếu pH > pHi: Pr tích điện âm và đi về cực (+) trong điện trường.
+ Nếu pH < pHi: Pr tích điện dương và đi về cực (-) trong điện trường.
Không dùng công thức tính pHi của acid amin để tính pHi của Pr vì Pr quá phức tạp.
Ứng dụng: Phân tách Pr bằng phương pháp điện di (trong nghiên cứu và chẩn đoán lâm sàng).
Tính tan
Khi cho vào nước, các tiểu phân Pr hình thành lớp áo nước và Pr tích điện cùng dấu sẽ đẩy nhau => Giúp Pr hòa tan, dung dịch keo bền vững.
Các yếu tố ảnh hưởng đến tính tan của Pr:
Nhiệt độ:
- Từ 0 -> 400C: Độ tan tăng khi nhiệt độ tăng.
- Từ 45 -> 700C: Độ tan giảm do Pr có sự biến tính.
pH dung dich hòa tan:
- Độ tan thấp nhất khi pH = pHi.
- Độ tan tăng khi pH > pHi hoặc pH < pHi.
– Nguyên nhân: Do lực đẩy tĩnh điện làm tăng độ tan.
Dung môi: Ethanol, aceton làm giảm độ tan của Pr (giảm mức hydrate hóa các nhóm ion hóa của Pr).
Nồng độ muối:
- Nồng độ muối thấp làm tăng độ tan của Pr do muối làm dãn rộng bề mặt Pr, dễ tạo lớp áo nước (Hiện tượng tăng hòa tan nhờ muối (salting in)).
- Nồng độ muối cao làm giảm độ tan của Pr do tăng hydrate hóa giữa muối và lớp áo nước của Pr (Hiện tượng kết tủa nhờ muối (salting out)).
= > Có thể loại muối khỏi dung dịch Pr bằng:
+ Tủa globulin bằng muối amoni sulfate bán bão hòa.
+ Tủa albumin bằng muối amoni sulfate bão hòa.
Tính kỵ nước của mạch bên acid amin: Acid amin kỵ nước nằm gần nhau làm giảm độ tan Pr.
Sự biến tính
- Là sự mất cấu trúc không gian 3 chiều của Pr do bị phá hủy liên kết hydro, liên kết muối,… nối trong polypeptid hoặc các chuỗi polypeptid với nhau.
- Khi đó, cấu trúc Pr đảo lộn, sự hydrat hóa giảm, độ tan giảm và dễ kết tủa.
- Pr lúc này sẽ mất tính chất sinh học và dễ bị tiêu hóa hơn.
- Sự biến tính không làm đứt liên kết peptide => Không phải là sự thủy phân.
- Các loại tác nhân gây biến tính là nhiệt độ, tia X, tia cực tím, acid/base, kim loại nặng,.
- Có 2 loại biến tính:
Biến tính thuận nghịch: Sau khi loại bỏ tác nhân gây biến tính, Pr trở lại trạng thái ban đầu (VD: ribonuclease).
Biến tính không thuận nghịch: Sau khi loại bỏ tác nhân gây biến tính, Pr không trở lại trạng thái ban đầu (VD: oval albumin trong trứng gà).
Ứng dụng: Đề phòng sự biến tính Pr trong thực hành, thao tác nhiệt độ lạnh, đảm bảo pH môi trường, loại bỏ các Pr không quan tâm (chiết xuất, tinh chế Pr,..).
CÁC PHƯƠNG PHÁP NGHIÊN CỨU PROTEIN
Gồm có ly tâm, điện di, sắc ký lỏng, phương pháp miễn dịch, sử dụng đồng vị phóng xạ, đo mật độ quang, các phương pháp hóa học, phân tích trình tự gen,..