Sản xuất Dược phẩm
Công nghệ nano là gì? Ưu, nhược điểm của công nghệ nano
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Tác giả: PGS.TS. Nguyễn Ngọc Chiến, ThS. Hồ Hoàng Nhân
Bài viết Công nghệ nano là gì? Ưu, nhược điểm của công nghệ nano được trích trong chương 1 sách Công nghệ nano và ứng dụng trong sản xuất thuốc – Bộ môn Công nghiệp Dược – Trường Đại học Dược Hà Nội.
MỤC TIÊU HỌC TẬP
- Trình bày được ưu, nhược điểm, cách phân loại của tiểu phân nano và đặc điểm của từng loại.
- Trình bày và phân tích được một số đặc điểm dược động học của tiểu phân nano.
- Phân tích được một sổ vai trò của công nghệ nano trong dược phẩm.
- Phân tích được độc tính của tiểu phân nano.
1. GIỚI THIỆU VỀ CÔNG NGHỆ NANO
Công nghệ nano là ngành khoa học thực hiện việc nghiên cứu và ứng dụng các vật liệu có kích thước cực nhỏ (10 đến 1000 nm) dựa vào tính chất khác biệt của vật liệu khi ở kích thước này và có thể ứng dụng cho tất cả các lĩnh vực khác nhau như vật lý, hóa học, sinh học, y học,… Theo ủy ban Châu Âu (European Commission), vật liệu nano được định nghĩa là các vật liệu có nguồn gốc tự nhiên, hay tổng hợp chứa các tiểu phân ở trạng thái không gắn kết hoặc phức hợp hoặc kết tụ, trong đó bằng hoặc nhiều hơn 50 % sô lượng tiểu phân phân bố theo kiểu số lượng (number size distribution) trong khoảng kích thước từ 1-100 nm. Với mục đích sử dụng, Tổ chức khoa học Châu Âu (European Science Foundation) mở rộng khái niệm nano trong y học cho các tiểu phân có kích thước đến hàng trăm nanomét, khái niệm này phù hợp hơn với định nghĩa của tiểu phân nano dùng để đưa thuốc đến nơi tác dụng.
Công nghệ nano dược hình thành trên cơ sở áp dụng thành tựu của công nghệ nano nói chung vào lĩnh vực nghiên cứu chế tạo các tiểu phân nano dược phẩm, các hệ mang thuốc nano hoặc các thiết bị nano dùng trong chân đoán và điều tri bệnh.
Trong ngành dược, việc sử dụng các hệ thống mang thuốc ở kích thước nano có thể đem đến một liệu pháp điều trị khả thi nhờ vào tính đặc hiệu hoặc tác dụng tại đích kết hợp với việc giải phóng thuốc tối ưu, từ đó giúp tăng cường tác dụng dược lý đồng thơi giảm tác dụng phụ có hại in vivo của thuốc.
Các dược phẩm nano (nanopharmaceuticals) được định nghĩa là các phức hợp có kích thước nano, đơn giản như là các tiểu phân nano, nhũ tương nano, phức hơp polyme, hoặc phức tạp hơn như các hệ đa thành phần kích thước nano có chứa thuốc, protein hoặc gen, các phối tử hướng đích và các tín hiệu để có thể phát hiện trên thử nghiệm in vitro hoặc in vivo.
Kể từ khi liposome được mô tả lần đầu tiên vào những năm 1960 và được đề xuất làm hệ vận chuyển thuốc trong điều trị bệnh, công nghệ nano đã có một tác động đáng kể đến sự phát triển của các hệ vận chuyển thuốc. Rất nhiều các vật liệu và thiết bị nano hữu cơ, vô cơ khác nhau đã được sử dụng làm các hệ vận chuyển để phát triển các phương thức điều trị hiệu quả. Cho đến nay, đã có hơn 24 sản phẩm điều trị dựa trên công nghệ nano được FDA chấp nhận dùng trên lâm sàng và nhiều sản phẩm khác vẫn đang trong quá trình thử nghiệm lâm sàng trong đó phần lớn là các sản phẩm thuộc thế hệ 1 – thế hệ gồm các hệ vận chuyển không hướng đích (như liposome và các nano polyme).
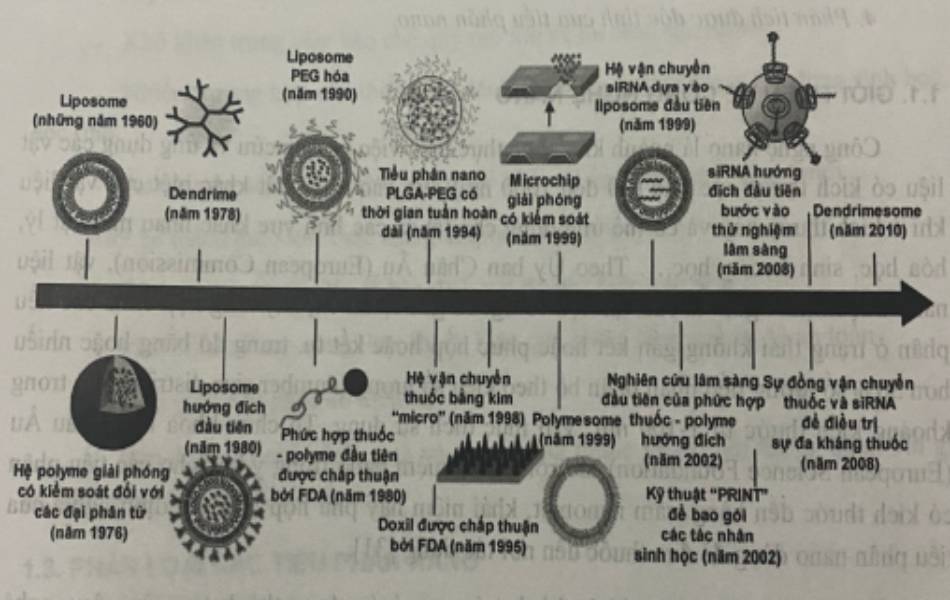
2. ƯU, NHƯỢC ĐIẾM VÀ THÁCH THỨC CỦA CÁC TIỂU PHÂN NANO
2.1. Ưu điểm
Các hệ mang thuốc nano đóng vai trò là “bình chứa” các tác nhân bên trong bảo vệ tác nhân điều trị khỏi môi trường bên ngoài và môi trường sinh học của cơ thề.
Tăng cường khả năng xâm nhập tế bào và quá trình thoát ra khỏi mao mạch.
Nâng cao khả năng hấp thu thuốc vào các khối u hoặc vị trí mà thuốc tác dụng.
Giảm được việc tương tác với các tế bào lành dẫn đến giảm tác dụng không mong muốn (ADR).
Giảm sự thải trừ của thận.
Bề mặt lớn trên một tỉ lệ thể tích giúp thuận lợi cho các thay đổi hóa học ở bề mặt.
Tăng độ tan của dược chất ít tan.
Tăng sinh khả dụng của các thuốc nói chung, đặc biệt các tác nhân chống ung thư.
Cho phép kiểm soát tốt hơn về thời gian và sự phân bố của các thuốc trong cơ thể.
2.2. Nhược điểm và thách thức
Khó khăn trong việc bào chế quy mô lớn và ồn định sản phẩm.
Nhiều trường hợp cần thiết phải đánh giá lại sinh khả dụng, tác dụng sinh học, độc tính.
Ảnh hưởng tới môi trường do có thể phải sử dụng quá mức dung môi.
Một số thách thức lớn khác cần giải quyết, bao gồm:
- Định hướng thuốc đến tế bào đích với độ đặc hiệu cao nhất.
- Phát triển những công thức thuốc hiệu quả nhằm tăng cường độ an toàn.
- Đơn giản hóa phác đồ điều trị.
- Bảo đảm chi phí – hiệu quả và chất lượng thuốc trong mối tương quan với giá cả, việc nâng quy mô sản xuất.
3. PHÂN LOẠI CÁC TIỂU PHÂN NANO
Có nhiều cách phân loại các tiểu phân nano khác nhau, bao gồm:
- Dựa vào cấu trúc nano và tá dược sử dụng.
- Dựa vào tương tác giữa tiểu phân nano và hệ sinh học.
3.1. Phân loại dựa vào cấu trúc tiểu phân nano và tá dược sử dụng
Dựa vào cấu trúc và tá dược sử dụng, hệ mang thuốc ở kích thước nanomét có thể phân loại gồm:
Nano vô cơ: nano kim loại như nano vàng, bạc và nano không phải kim loại như nano carbon (quantum dot, fulleren,…), nano silica.
Nano hữu cơ:
– Nano tinh thể: thường chỉ gồm dược chất, không có giá mang, chỉ có tá dược tránh kết tụ, bao gồm nano tinh thể dạng vô định hình và nano tinh thể dạng kết tinh,
– Hệ mang thuốc kích thước nano mét (Hệ mang thuốc nano)
- Dạng cốt:
- Nano polyme: là các hệ mang thuốc sử dụng polyme làm giá mang dược chất, bao gồm nano polyme thân dầu, nano polyme thân nước.>
- Nano lipid: là các hệ mang thuốc sử dụng các lipid làm giá mang dược chất, bao gồm nano lipid rắn và hệ mang lipid có cấu trúc nano.
- Dạng nhân-Vỏ:
- Nano polyme: bao gồm nano polyme thân dầu dạng nhân-vỏ và
polymesome. - Nano lipid: bao gồm liposome và nano lipid dạng nhân-vỏ.

Ngoài ra đối với hệ mang thuốc nano có thể được phân loại như sau:
- Nano polyme
- Nano lipid
- Nano polyme-lipid và nano lipid-polyme: là các hệ mang thuốc sử dụng cả polyme và lipid làm giá mang dược chất.
- Dendrime: là các đại phân tử có cấu trúc nhánh được tông hợp với cấu trúc hóa học bao gồm một nhân khởi đầu và nhiều lớp nhánh có các nhóm cuối hoạt động, cấu trúc đặc biệt này của dendrime cho phép nó có thể mang nhiều loại thuốc khác nhau thông qua các gắn kết hóa trị hoặc được bao gói trong các khoang rỗng của nhân thông qua các tương tác thân dầu, liên kết hydro, hoặc liên kết hóa học.
- Liposome: là một hệ mang thuốc gồm một hay nhiều lớp đồng trục được tạo thành từ các cấu trúc màng lipid kép của các phân tử lipid lưỡng tính tự nhiên hay tổng hợp.
3.2. Phân loại dựa trên tương tác giữa tiểu phân nano và hệ sinh học
Dựa trên những tương tác giữa tiểu phân nano và hệ sinh học (gọi là tương tác nano-bio) có thể phân loại thành 3 thế hệ nano như sau:
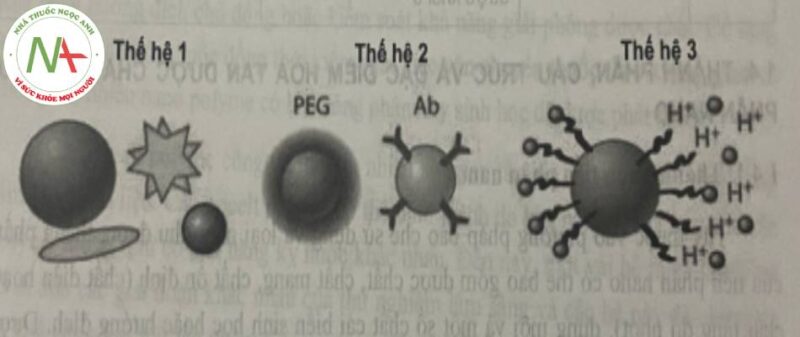
Thế hệ thứ nhất bao gồm các tiểu phân nano cổ điển không cải biến đặc tính bề mặt, không có khả năng tránh thực bào, thời gian tuần hoàn ngắn, được bào chế bằng các nguyên liệu đơn có sẵn nhằm chứng minh khả năng tiềm tàng của 1 hệ đưa thuốc mới như tính tương thích sinh học, khả năng hấp thu bởi tế bào và độc tính.
Thế hệ thứ hai bao gồm các tiểu phân nano có bề mặt được cải biến, với 2 đặc trưng quan trọng: có tính chất lần tránh thực bào và hướng đích thụ động; nhằm cải thiện độ ổn định, tăng thời gian tuần hoàn và tăng tính hướng đích trong các hệ sinh học.
Thế hệ thứ ba chuyển mô hình thiết kế từ các tiểu phân nano có tính ổn định cao sang các tiểu phân nano “thông minh”, hướng đích chủ động, sử dụng các tín hiệu sinh học, vật lý, hóa học trong môi trường đích để kích hoạt giải phóng thuốc nhằm đạt được tác dụng tại đích tối ưu.
Bảng 1. Đặc trưng và thách thức sinh học của các thế hệ nano
| Thế hệ 1 | Thế hệ 2 | Thế hệ 3 | |
| Đặc trưng | Thiết kế, bào chế dễ
Cải thiện độ tan Tương thích sinh học |
Tối đa hóa vận chuyển thuốc
Có tính chất ẩn (thụ động) Hướng đích bị động là chính |
Đáp ứng theo môi trường
Có tính linh động Sử dụng các tín hiệu sinh học hoặc nhân tạo để kích hoạt giải phóng thuốc Có khả năng chẩn đoán trị |
| Thách thức sinh học | Không ổn định
Bị thanh thải bởi hệ đại thực bào đơn nhân (MPS) Tính hướng đích thấp |
Quá trình phụ thuốc vào hiệu ứng lưu giữ và tăng thấm tăng cường (EPR)
Không có kháng nguyên chung Tính hướng đích chủ động không tối đa Dưới 10% liều thuốc đến được khối u |
Đang được xác định |
4. THÀNH PHẦN, CẤU TRÚC VÀ ĐẶC ĐIỂM HÒA TAN DƯỢC CHẤT TỪ TIỂU PHÂN NANO
4.1. Thành phần tiểu phân nano
Tùy thuộc vào phương pháp bào chế sử dụng và loại nano thu được, thành phần của tiểu phân nano có thể bao gồm dược chất, chất mang, chất ổn đinh (chất diện hoạt, chất tăng độ nhớt), dung môi và một số chất cải biến sinh học hoặc hướng đích. Dược chất thường là chất có hoạt tính sinh học mạnh, nhưng độ tan kém. Cũng có trường hợp có thể sử dụng dược chất tan trong nước.
4.2. Cấu trúc một số tiểu phân nano
Trong khuôn khổ sách này, chúng tôi chỉ tập trung vào nano polyme, nano lipid và nano tinh thể. Đối với liposome, vi nhũ tương người đọc có thể tham khảo sách tiếng Việt “Kỹ thuật nano và liposome ứng dụng trong dược phẩm, mỹ phẩm” đã xuất bản. Đối với dendrime, người đọc tham khảo tài liệu khác.
4.2.1. Nano tinh thể
Nano tinh thể gồm các dược chất rất ít tan trong nước, thường được bào chế ở dưới dạng bột hay hỗn dịch bằng phương pháp giảm kích thước tiểu phân (top-down). Các nano tinh thể bao gồm 100% dược chất, không có chất mang. Hỗn dịch nano sau khi phân tán trong môi trường lỏng (như nước, PEG,…) cần được duy trì ổn định bằng chất diện hoạt hoặc các chất ổn định có bản chất polyme. Chúng có thể có cấu trúc kết tinh hoặc vô đinh hình.
4.2.2. Nano polyme
Nano polyme là các hệ mang thuốc sử dụng polyme làm giá mang dược chất, có cấu trúc dạng siêu vi nang hay siêu vi cầu. Cấu trúc siêu vi nang là cấu trúc nhân vỏ, cấu trúc siêu vi cầu là cấu trúc dạng cốt, trong đó dược chất phân tán đều trong siêu vi cầu. Thực tế khó phân biệt siêu vi nang hoặc siêu vi cầu. Trong cấu trúc này, dược chất hòa tan hoặc phân tán dạng phân tử hoặc tinh thể nano trong polyme, cũng có thể dược chất liên kết cộng trị với polyme. Các polyme sử dụng bào chế nano polyme gồm các polyme tự nhiên hay tổng hợp. Trong đó có cả các loại phân hủy sinh học, tương hợp với cơ thể sống.
Phức hợp dược chất và polyme đã có những tác động lâm sàng đáng kể nhờ việc tăng cường hiệu quả và phân liều của những thuốc đã biết. Tuy nhiên, hiệu suất nano hóa thuốc vẫn còn hạn chế do thiếu vị trí liên hợp trên phân tử polyme và phần lớn thiếu khả năng hướng đích chủ động hoặc kiểm soát khả năng giải phóng dược chất. Để tăng hiệu suất nano hóa thuốc đồng thời kiểm soát việc vận chuyển thuốc theo không gian và thời gian, nhiều nano polyme có khả năng phân hủy sinh học đã được phát triển.
Các micell polyme cũng đã thu hút nhiều sự quan tâm do có tiềm năng ứng dụng làm các hệ trị liệu. Các micell polyme có thể hình thành do khả năng tự kết hợp của các polyme lưỡng tính có khả năng kỵ nước khác nhau. Đến nay, một vài hệ micell polyme đã đi đến các giai đoạn khác nhau của thử nghiệm lâm sàng và các hệ này đã chứng tỏ có khả năng lưu giữ tác nhân điều trị tại vị trí đích và làm giảm tác dụng không mong muốn của các tác nhân này.
Ngoài ra, việc kết hợp các nano polyme với các phức hợp hướng đích cũng giúp kiểm soát quá trình vận chuyển thuốc theo không gian và thời gian. Điều này có thể làm tăng cường hơn nữa hiệu quả điều trị và giảm tác dụng không mong muốn của chúng.
4.2.3. Nano lipid
Nano hpid là các hệ mang thuốc sử dụng các lipid làm giá mang dược chất, có cấu trúc dạng siêu vi nang hay siêu vi cầu. Nano lipid gồm các loại khác nhau, tùy loại tá dược sử dụng.
a. Tiểu phân nano lipid rắn (solid lipid nanoparticles-SLN gọi tắt là nano lipid rắn)
Có cấu tạo gồm 2 phần: phần lõi rắn là dược chất hòa tan hoặc phân tán trong môi trường lipid rắn, phần vỏ bao quanh lõi lipid rắn, là lớp chất diện hoạt (đầu sơ nước của phân tử chất diện hoạt gắn với phần lõi lipid, đầu thân nước hướng ra ngoài).
SLN được phát triển từ những năm đầu thập niên 90. SLN có thể coi là hệ đưa thuôc nhân tạo so với các hệ đưa thuốc truyền thống như nhũ tương lipid, liposome. SLN kết hợp các ưu điểm và đồng thời cũng khắc phục các nhược điểm của hệ chất mang dạng keo kể trên như độ ổn định, khả năng bảo vệ và dung hợp dược chất, khả năng dung nạp tốt. Đồng thời, SLN cũng giúp cải thiện sinh khả dụng của thuốc, kiểm soát duy trì giải phóng các dược chất. SLN cấu tạo từ 0,1-30% lipid rắn, phân tán trong một dung dịch nước và được ổn định với 0,5-5% chất diện hoạt. SLN có hàm lượng thuốc thường thấp, tuy nhiên có trường hợp lên tới 25%, và có độ ổn đinh tốt.
Ngoài ra, dược chất dễ bị thoát ra khỏi tiểu phân do sự biến đổi vật lý trong quá trình bảo quản.
b. Hệ mang lipid cấu trúc nano (nanostructured lipid carriers, NLC)
Để khắc phục các nhược điểm của nano lipid rắn (hiện tượng tống thuốc ra ngoài khi lipid kết tinh ở dạng β, tỷ lệ phân tán trong pha nước cao nhất chỉ khoảng 30%), hệ mang lipid cấu trúc nano đã ra đời với việc sử dụng đồng thời cả lipid dạng lỏng phối hợp cùng với lipid dạng rắn. Vì sự khác nhau trong cấu trúc, hai dạng lipid này không thể trộn lẫn hoàn toàn để tạo tinh thể, tạo nhiều khe hở (khoảng giữa các chuỗi acid béo triglycerid) để chứa dược chất bên trong. Có thể phối hợp lipid dạng rắn với lipid dạng lỏng ở tỷ lệ từ 70:30 đến 99,9:0,1. Sự có mặt của lipid lỏng sẽ làm giảm nhiệt độ nóng chảy của hỗn hợp so với lipid rắn. Nồng độ của hệ trong pha phân tán có thể lên đến 95% (cao hơn hẳn so với nano lipid rắn). NLC có cấu tạo gồm một lớp chất diện hoạt bao quanh lõi lipid chứa hỗn hợp lipid rắn-lỏng, thường có kích thước 100-500 nm. NLC nano hoá dược chất cao hơn SLN do phần lớn các dược chất có khả năng hòa tan trong lipid lỏng cao hơn dạng rắn. Vì vậy, hệ NLC hạn chế được tình trạng đẩy dược chất ra khỏi tiểu phân, kiểm soát được tốc độ giải phóng dược chất tốt hơn, và được coi là thế hệ hai của SLN. Ví dụ acid stearic là lipid rắn được kết hợp với lipid lỏng là acid oleic với các tỉ lệ khác nhau để bào chế NLC. NLC cho các tiểu phân có kích thước nhỏ hơn và bề mặt của các tiểu phân nano có hình dạng cầu hơn so với các công thức SLN chỉ chứa lipid rắn. Hiệu suất nano hóa và tỷ lệ dược chất nano hóa có xu hướng tăng khi tăng lượng acid oleic (Fu-Qiang Hu và cộng sự). Các thử nghiệm in cho thấy hệ NLC có tỉ lệ giải phóng thuốc cao ở giai đoạn đầu và duy trì ổn định kéo dài ở giai đoạn sau có thể kiểm soát được tỉ lệ giải phóng thuốc bằng cách điều chỉnh nồng độ lipid lòng trong công thức.
Dựa vào cấu trúc khung xốp bên trong, NLC được chia làm 3 dạng: dạng kết tinh không hoàn toàn, dạng vô định hình, và dạng nhũ tương kép. Hệ NLC được ứng dụng nhiều trong dược phẩm cũng như mỹ phẩm.
c. Hệ liên hợp dược chất và lipid
Hệ liên hợp dược chât – lipid được hình thành bằng cách tạo muối (với các acid béo) hoặc tạo các dẫn xuất ester hoặc ether. Sau đó, hệ được nhũ hóa với dung dịch chất diện hoạt thân nước để tạo các tiểu phân nano.
4.2.4. Nano polyme-lipid
Nano polyme-lipid là hệ mang thuốc kết hợp các ưu điểm của hệ mang thuốc liposome và nano polyme, trong đó các lipid và các polyme được đồng thời sử dụng. Những thành công của nano liposome và polyme đã dẫn đến sự ra đời của tiểu phân nano lai polyme-lipid, do vậy cho đến nay, một vài nano polyme-lipid đẵ được phát triển.
Ví dụ như các tiểu phân polyme được bao bởi lipid gồm nhân acid poly (lactic-co- glycolic) (PLGA), vỏ polyethylen glycol (PEG) và một lớp lipid ở lớp giữa đã được bào chế và đánh giá các đặc tính. Nhân PLGA có thể mang các thuốc ít tan trong nước trong khi vỏ PEG giúp làm giảm khả năng tích tụ sinh học (biofouling) và tăng thời gian tuần hoàn. Lớp lipid nằm ở giữa nhân PLGA và vỏ PEG đóng vai trò như một hàng rào phân tử giúp tăng cường khả năng lưu giữ và kéo dài thời gian giải phóng thuốc từ nhân polyme. Ở một ví dụ khác, nano PLGA bao gói bởi liposome (hay được gọi là tế bào nano – “nanocell”) đã được phát triển qua nhiều bước với hướng điều trị ung thư. Trong đó, nhân là phức hợp PLGA-doxorubicin, còn vỏ lipid nhiều lớp chứa tác nhân chống sự tăng sinh combretastatin.
Nano lai polyme-lipid đã kết hợp được tính toàn vẹn cấu trúc cao, đặc tính dễ điều chỉnh, khả năng dễ cải thiện đặc tính bề mặt của phần polyme và tính tương thích sinh học tuyệt vời, tính sinh miễn dịch thấp, độc tính thấp của phần lipid.
Ở nano lai, các lipid có thể làm chậm sự thấm nước và giảm đáng kể sự phân hủy các nano lai, làm kéo dài quá trình giải phóng dược chất. Ngoài ra, lớp bao lipid bên ngoài lớp polyme mô phỏng giống như giao diện của lớp bề mặt sinh học, trong khi đó các polyme đảm bảo sự ổn định cơ học, giúp dễ điều chỉnh tính chất bề mặt cho các tiểu phân.
4.3. Đặc điểm hòa tan dược chất từ tiểu phân nano
Dựa vào cấu trúc và tá dược sử dụng, tiểu phân nano có thể được phân loại gồm nano tinh thể, hệ mang thuốc nano (nano polyme, nano lipid và nano lai polyme-lipid/lipid-polyme và các loại khác). Mỗi loại tiểu phân nano có tốc độ hòa tan và mức độ hòa tan dược chất khác nhau.
Đối với nano polyme, nano lipid và nano lai polyme-lipid/lipid-polyme, tốc độ và mức độ hòa tan dược chất có thể được kiểm soát khác nhau tùy thuộc vào cấu trúc và tá dược sử dụng. Trong môi trường hòa tan, dược chất phân tử và nano tinh thể khuếch tán ra bên ngoài tiểu phân nano. Quá trình hòa tan tiếp tục xảy ra đối với nano tinh thể. Tốc độ hòa tan dược chất phụ thuộc nhiều quá trình hòa tan và khuếch tán dược chất phân tử, đồng thời phụ thuộc cả vào quá trình khuếch tán nano tinh thể và tốc độ phân hủy của chất mang. Mức độ hòa tan hay độ tan của dược chất tăng ở các tiểu phân kích thước dưới 1000 nm do kích thước tiểu phân dược chất giảm mạnh.
Đối với nano tinh thể,việc giảm đến kích thước nano dẫn đến tăng tốc độ và mức độ hòa tan dược chất. Bàn luận dưới đây liên quan đến nano tinh thể.
Đối với tốc độ hòa tan, dựa vào phương trình Noyes-Whitney ta có:
dc/dt = D.A.(Cs – Cx)/h [1]
Trong đó, dc/dt: tốc độ hòa tan; D: hệ số khuếch tán; h: bề dày của lớp khuếch tán; A: diện tích bề mặt tiếp xúc của các tiểu phân; Cs, Cx: làn lượt là độ tan, nông độ của chất tan.
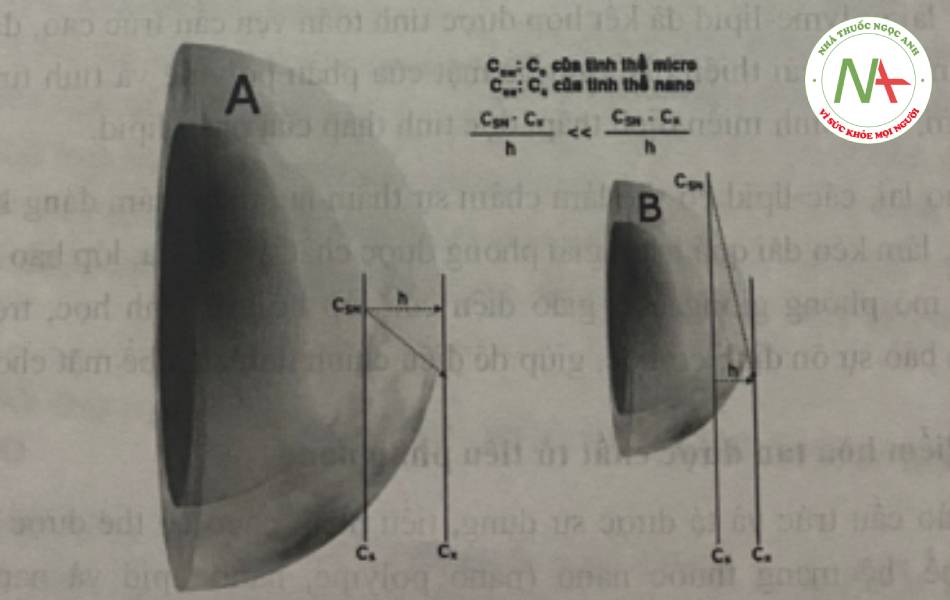
Dựa vào phương trình [1] cho thấy, việc giảm kích thước tiểu phân dẫn đến việc tăng diện tích bề mặt sẽ làm tăng tốc độ hòa tan. Ngoài ra, tốc độ hòa tan tăng còn do dc/dt tỉ lệ thuận với gradient nồng độ (Cs-Cx)/h và việc tăng hấp thu theo cơ chế khuếch tán thụ động do tăng gradient nồng độ chất tan giữa thành ruột và trong máu.
Đối với độ tan của dược chất, mối quan hệ giữa kích thước tiểu phân và độ tan phức tạp hơn. Độ tan của dược chất phụ thuộc vào đặc tính lý hóa của dược chất, môi trường hòa tan, nhiệt độ và áp suất. Nhưng điều này chỉ đúng với tiểu phân dược chất có kích thước micron trở lên. Với tiểu phân dược chất kích thước dưới 1 μm, độ tan phụ thuộc vào kích thước tiểu phân (KTTP), độ tan dược chất được giải thích theo phương trình Ostwald-Freundlich như sau:
log( Cs/Cα) = 2σV/2,303 RTρr [2]
Trong đó, Cs là độ tan của tiểu phân kích thước nhỏ (dưới 1000 nm), Cα độ tan của tiểu phân kích thước micron trở lên, σ: sức căng bề mặt, V thể tích mol, R là hằng số khí, T là nhiệt độ tuyệt đối, ρ tỷ trọng tiểu phân, r là bán kính tiểu phân.
Theo phương trình [2], độ tan của dược chất tăng khi KTTP giảm, cần nhấn mạnh là điều này chỉ áp dụng với các tiểu phân nhỏ hơn 1-2 μm, đặc biệt tiểu phân kích thước nhỏ hơn 200 nm.
Ngoài ra, đối với dạng nano tinh thể, dược chất có thể ở trạng thái vô định hình. Trạng thái vô định hình có nhiềụ ưu điểm như độ tan lớn hơn so với dược chất ở dạng kết tinh. Vì thế, các nano tinh thể dược chất ở dạng vô định hình sẽ có độ tan lớn hơn so với các nano tinh thể dạng kết tinh có cùng kích thước. Do đó, để đạt được độ tan lớn nhất, việc kết hợp được đồng thời kích thước nano và dạng vô định hình là điều vô cùng lý tưởng. Tuy nhiên, để có thể ứng dụng trong ngành dược, điều tiên quyết đó là cần phải duy trì được trạng thái vô định hình của dược chất trong suốt thời hạn sử dụng của sản phẩm.
5. MỘT SỐ ĐẶC ĐIỂM SINH DƯỢC HỌC VÀ DƯỢC ĐỘNG HỌC CỦA TIỂU PHÂN NANO
Đặc điểm dược động học của tiểu phân nano từ các dạng thuốc khác nhau bao gồm hấp thu, phân bố, chuyển hóa và thải trừ có thể có sự thay đổi khác biệt so với dạng thuốc truyền thống chứa dược chất không ờ dạng nano hóa.
5.1. Đặc điểm sinh dược học chung của các tiểu phân nanno
Như đã đề cập trong phần phân loại, có rất nhiều dạng thuốc chứa tinh thể nano hoặc hệ mang thuốc nano. Trong hệ mang thuốc nano, dược chất được bao gói trong các chất mang như dendrime, liposome, nano polyme, nano lipid, nano lai lipid-polyme/polyme-lipid. Hệ mang thuốc nano thường có nhiều ưu điểm như khả năng vận chuyển thuốc đặc hiệu, độ ổn định cao, khả năng thấm qua màng sinh học cao, sinh khả dụng được tăng cường, và tác dụng kéo dài. Bằng cách thay đổi các đặc tính sinh dược học của các chất tiềm năng dùng làm thuốc mới, việc bào chế các dạng thuốc chứa hệ mang thuốc nano có thể là một giải pháp hứa hẹn để giữ vững các đặc tính của thuốc. Các đặc tính lý hóa của các tiểu phân nano như KTTP, điện thế bề mặt và khả năng thân dầu sẽ ảnh hưởng đến đặc tính hấp thu qua màng sinh học của chúng. Các tiểu phân nano có kích thước nhỏ thường có khả năng hấp thu thông qua các nang của biểu mô cao hơn so với các tiểu phân có kích thước lớn. Các tiểu phân nano có thể đi vào tế bào thông qua quá trình nội thực bào như nhập bào qua trung gian caveola và clathrin, ẩm bào. Ngược lại, các tiểu phân lớn hơn có thể bị opsonin hóa nhanh (các protein có khả năng bám dính vào vật ngoại lai hay tế bào giúp chúng dễ bị nhận diện bởi quá trình thực bào) và loại khỏi hệ tuần hoàn thông qua các đại thực bào của hệ lưới nội mô.
Trong việc thiết kế công thức của tiểu phân nano, cần thiết làm giảm thiểu khả năng opsonin hóa và kéo dài thời gian tuần hoàn của các tiểu phân nano. Điều này có thể đạt được bằng cách bao bề mặt của tiểu phân nano bằng các polyme hoặc chất diện hoạt thân nước và/hoặc thiết kế công thức tiểu phân nano với các đồng polyme phân hủy sinh học có thêm các phần thân nước như polyethylen glycol, poloxame, poloxamin và polysorbat.
Các tiểu phân nano có điện thế bề mặt dương có thể tương tác với điện thế âm của mucin do chứa các hợp phân acid sialic và đường, dẫn đến việc tăng cường quá trình vận chuyển qua màng tế bào và quá trình nội bào nhờ các tế bào biểu mô.
Việc “chức năng hóa” bề mặt tiểu phân nano với các chất tăng cuờng tính thấm qua màng hoặc các phức hợp có khả năng gắn kết với các thụ thể trên màng tế bào có thể thúc đấy khả nặng vận chuyển qua màng tế bào của các thuốc được bao gói. Ngoài khả năng vận chuyển qua màng tế bào, các thuốc kích thước nano được bao gói hay liên kết với các polyme bám dính sinh học hoặc các chất tạo phức chelat có thể giúp tăng cường khả năng vận chuyển liên bào của các thuốc thông qua việc điều hòa các khe hở hẹp giữa các tế bào. Việc cải biến bề mặt (surface modification) của các tiểu phân nano với các protein đặc hiệu, các kháng thể và các phân tử sinh học khác có thể được sử dụng để thiết kế các thuốc có tác dụng chọn lọc trên các mô cụ thể. Ngoài ra cũng có thể sử dụng các thành phần trong công thức có khả năng nhạy cảm với các tín hiệu vi môi trường bên trong (như nhạy cảm với pH, nhạy cảm với enzym) hay các tín hiệu ngoại cảnh (như từ trường, ánh sáng). Các giải pháp này giúp tăng cường khả năng điều trị và giảm tác dụng không mong muốn của các thuốc điều trị ung thư vốn là các thuốc độc tê bào thường có cửa sổ điều trị hẹp.
Bảng 2. Đặc điểm sinh dược học của một số dạng thuốc có kích thước nano
| Dạng thuốc nano | Đặc điểm sinh dược học |
| Dendrime | Ưu điểm:
– Khả năng thấm qua màng cao – Kiểm soát giải phóng – Khả năng vận chuyển thuốc đặc hiệu – Làm tăng độ tan của dược chất Nhược điểm: – Hạn chế đường sử dụng |
| Nano tinh thể | Ưu điểm:
– Tăng tác dụng toàn thân – Khả năng lưu giữ cao ở lớp màng nhầy – Thích hợp nhiều đường dùng khác nhau Nhược điểm: – Khả năng duy trì giải phóng thấp |
| Nano liqid | Ưu điểm:
– Khả năng phân hủy sinh học và được chuyển hóa nhờ các men như lipase, esterase. – Tác dụng toàn thân kéo dài – Khả năng vận chuyển thuốc đặc hiệu – Khả năng tích lũy tại các khối u Nhược điểm: – Đào thải nhanh bởi hệ lưới nội mô (RES) – Hạn chế đường sử dụng |
| Micell | Ưu điểm:
– Khả năng thấm qua màng cao – Làm tăng độ tan của dược chất – Tăng tác dụng toàn thân Nhược điểm: Khả năng duy trì giải phóng thấp |
| Nano polyme | Ưu điểm:
– Quá trình giải phóng in vivo ổn định – Tác dụng kéo dài Nhược điểm: – Cần hạn chế khả năng giải phóng ồ ạt ban đầu – Hạn chế đường sử dụng |
Quá trình chuyển hóa dược chất từ tiểu phân nano và chuyển hóa bản thân tiểu phân nano tương đối phức tạp so với quá trình chuyển hóa các phân tử dược chất vì sự khác nhau trong cấu trúc của nó. Ví dụ như các tiểu phân nano có thể bao gồm các phôi tử trên bề mặt như PEG hay các chuỗi acid amin dạng L, hoặc chúng có thể bao gồm các kim loại, carbon, các polyme bên trong nhân. Khi các tiểu phân nano đi đến gan để được chuyển hóa thì các phối tử liên kết với các tiểu phân này sẽ được chuyển hóa cùng. Tuy nhiên, con đường chuyền hóa chính xác của chúng vẫn còn chưa được biết. Nhiều quá trình chuyển hóa khác nhau có thể xảy ra đối với từng loại tiểu phân nano khác nhau, do vậy, việc hiểu biết đầy đủ về các cơ chế này đóng vai trò quan trọng trong việc phát triển công thức cũng như đảm bảo độ an toàn của sản phẩm.
Đối với quá trình thải trừ, cơ quan thải trừ chính là thận, tuy nhiên, quá trình thải trừ còn có thể xảy ra qua đường mật, mồ hôi, nước bọt, không khí thở hoặc sữa. Các đặc tính của tiểu phân nano thường được tối ưu để đào thải tiểu phân nano khỏi cơ thể mà không gây bất cứ một độc tính nào, các đặc tính này bao gồm chất mang, KTTP, hình dạng, điện thế và hóa học bề mặt. Các tiểu phân nano có kích thước dưới 8 nm thường chịu quá trình đào thải qua thận và bài tiết qua nước tiểu. Trong khi đó, khả năng lọc qua thận giảm do có liên quan đến sự hấp phụ các protein huyết tương trên bề mặt các tiểu phân nano mang điện tích hoặc do có sự tương tác với thành phần tích điện trên thành mao mạch của cầu thận.
Ngoài quá trình thải trừ ở thận, một số tiểu phân còn được đào thải ờ gan thông qua quá trình bài tiết mật vào đường ruột và thải trừ qua phân. Các đại thực bào Kupffer trong hệ lưới nội mô sẽ bắt giữ các tiểu phân không mong muốn trong máu và là vị trí chính của quá trinh chuyển hóa. Hoặc các tiểu phân cũng có thể bị dị hóa thông qua các tế bào gan. Từ đó, các tiểu phân bị giữ bởi các tế bào gan sẽ đi vào mật và bị bắt giữ bởi các tế bào Kupffer, sẽ chịu quá trình phân hủy bởi tế bào. Các tiểu phân chịu sự thải trừ qua gan thường có kích thước từ 10-20 nm. Đồng thời, quá trinh đào thải các tiểu phân cũng có thể được thực hiện qua trung gian hệ thống bổ thể như các protein opsonin, giúp tăng cường sự bắt giữ ở gan.
5.2. Đặc điểm dược động học tiểu phân nano dùng theo đường uống
Tiểu phân nano có trong các dạng thuốc dùng theo đường uống thường là nano tinh thể, cũng có thể là các tiểu phân nano khác. Đối với các dạng thuốc chứa các tiểu phân nano dùng theo đường uống, sinh khả dụng thường tăng, ổn đinh không phụ thuộcn vào bữa ăn và thể hiện dược động học tuyến tính ví dụ như Lipanthyl Supra NT 145mg (chứa nano tinh thể fenofibrat). Quá trình hấp thu tăng do mức độ và tốc độ hòa tan dược chất tăng. Đặc biệt, kích thước nano có thể làm tăng tính thấm của dược chất qua thành ruột do tiểu phân kích thước dưới 100 nm có thể được hấp thu qua khe kẽ liên bào, các tiểu phân nano kích thước vài nm, có thể đi qua các kênh nước (water channel). Các tiểu phân nano còn có thể bảo vệ dược chất khỏi điều kiện bất lợi trong đường tiêu hóa, do vậy làm giảm sự phân hủy dược chất. Việc này cũng làm tăng hấp thu dược chất. Khi tuần hoàn trong máu dưới dạng phân tử, phân tử dược chất được phân bố, chuyển hóa và thải trừ tương tự dược chất hấp thu từ thuốc uống chứa dược chất kích thước micron.
Cụ thể, đối với thuốc dùng đường uống, quá trình hấp thu qua lớp biểu mô của đường ruột có thể diễn ra theo hai cơ chế sau:
- Con đường liên bào: các tiểu phân có kích thước dưới 1 nm có thể không đi qua theo con đường này bởi vì các khe hở hẹp giữa các tế bào biểu mô. Tuy nhiên, các khe hở liên bào này có thể mở thuận nghịch đủ lớn để cho các tiểu phân nano đi qua bằng cách dùng các chất tăng cường sự hấp thu bao gồm các polyme ion dương hay ion âm và các phức chelat calci như chitosan, acid polyacrylic và acid ethylenediaminetetraacetic (EDTA). Nếu chúng có kích thước lớn hơn 20 nm, các tiểu phân nano cần phải rã ra đủ nhỏ để giải phóng thuốc và đi qua các khe hở này.
- Con đường xuyên bào: các tiểu phân nano có thể tránh quá trình chuyển hóa qua gan lần đầu, theo cơ chế này, chúng có thể đi qua các tế bào đường ruột hoặc tế bào M của mảng Peyer (Peyer’s patches). Sự vận chuyển này đạt được bằng quá trình thực bào (phagocytosis), quá trình đại ẩm bào (marcopinocytosis), nội thực bào qua trung gian của clathrin hay caveola. Các tiểu phân có kích thước dưới 200 nm có thể bị nội thực bào qua trung gian của clathrin, trong khi đó, các tiểu phân có kích thước lớn hơn có thể bị bắt giữ bởi các túi caveola. Một số con đường thực bào khác vẫn đang được tiếp tục tìm hiểu và hiện vẫn chưa được phân loại rõ ràng.
Quá trình hấp thu thuốc qua đường tiêu hóa vào vòng tuần hoàn chung phụ thuộc vào nhiều yếu tố như KTTP, điện tích bề mặt, độ ổn định của tiểu phân nano, thời gian lưu của tiểu phân nano tại vị trí hấp thu và các thành phần trong đường tiêu hóa. Để thuốc tạo ra được hiệu quả và thực hiện mục đích của nó thì thuốc cần đến được vị trí tác dụng. Để thực hiện được điều này, thuốc cần đi qua được các hàng rào sinh lý như các hàng rào của tế bào, thể dịch và màng nhầy. Do đó, việc dùng các tiểu phân nhỏ có kích thước nano có thể tăng cường việc đưa thuốc vào tế bào và khả năng ẩm bào, cũng như xâm nhập vào các khối u, tích lũy và giải phóng thuốc vào các khối u. Như đã đề cập, các yếu tố như KTTP, thế zeta, các phối tử hướng đích, thành phần công thức đóng vai trò quan trọng trong việc phân bố các tiểu phân nano trong cơ thể. Ngoài ra, các quá trình khác như quá trình opsonin hóa, khả năng đi qua khe hở của niêm mạc, hiện tượng tăng tính thấm và lưu giữ (EPR – Enhanced permiability and retention) cũng ảnh hưởng đến sự phân bố của các tiểu phân nano.
5.3. Đặc điểm dược động học tiểu phân nano dùng theo đường tiêm
Hỗn dịch tiểu phân nano dùng theo đường tiêm là hỗn dịch của nano tinh thể và hỗn dịch hệ mang thuốc nano. Tất cả các tiểu phân nano đều có thể dùng theo đường tiêm nếu đáp ứng được các yêu cầu của thuốc tiêm. Hỗn dịch nano có thể được tiêm bắp, tiêm dưới da, trong phúc mạc ruột hay tiêm tĩnh mạch.
Sau khi tiêm tĩnh mạch, tiểu phân nano trực tiếp tuần hoàn trong máu, sự phân bố của tiểu phân có thể xảy ra theo hai hướng là thanh thải bằng thực bào và phân bố đến cơ quan, tổ chức:
– Thanh thải bằng thực bào:
Hệ thống thực bào trong cơ thể coi tiểu phân như một vật thể lạ và tiến hành thanh thải theo cơ chế bảo vệ của cơ thể. Sau khi thực bào, tiểu phân được đưa về gan, lách…
Như vậy, có thể lợi dụng cơ chế thực bào để chủ động đưa thuốc tới gan, lách, phổi… và tăng cường ái lực với thụ thể trên thực bào đơn nhân bằng các phối tử có ái lực. Mặt khác, tổ chức u, viêm là những nơi có quá trình thực bào xảy ra mạnh nhất trở thành cơ quan đích của tiểu phân.
Để tránh thực bào, tăng cường phân bố đến các tổ chức cần phải:
- Ngụy trang tiểu phân nhằm tránh sự nhận diện của tế bào lympho: bao tiểu phân với các polyme thân nước như PEG, khi đó PEG hên kết đồng hóa trị với các tiểu phân như nano albumin, nano PLGA…
- Biến tinh bề mặt tiểu phân để ngăn cản quá trình thực bào: tạo ra cấu trúc cồng kềnh hoặc bao chất diện hoạt.
- Bao tiểu phân băng các tác nhân phân giải màng lysosome
Phân bố đến cơ quan, tổ chức:
Các tiểu phân không bị thực bào, dễ dàng đi qua thành mạch mao quản để phân bố tiếp đến các cơ quan, tổ chức trong cơ thể đặc biệt là các tổ chức u, viêm do tính thấm tăng lên.
Sau khi qua thành mạch, tùy theo cấu trúc và kích thước, tiểu phân nano đươc phân bố ở 3 mức độ khác nhau:
- Tới cơ quan đích: gan, lách, phôi…
- Tới nhóm tế bào đặc biệt (viêm, ung thư, đại thực bào…)
- Tới nội bào: do có kích thước ở mức độ phân tử hoặc kích thước nhỏ hơn khe hở liên bào và nhiều liên kết lỏng lẻo trên màng tế bào, nên tiểu phân nano có khả năng xuyên qua màng tế bào vào nội bào. Nếu kích thước lớn hơn, hệ được vận chuyển bằng cơ chế thực bào hoặc tương hợp với màng tế bào.
Sau khi tiêm bắp, tiêm dưới da hay trong phúc mạc ruột, hỗn dịch tiểu phân nano được hấp thu vào máu dưới dạng phân tử và tiểu phân nano. Quá trình phân bố tiểu phân nano theo hướng trên. Thời gian lưu của tiểu phân nano, đặc biệt tiểu phân nano có cấu trúc đặc biệt, khác xa với phân tử thuốc khi tuần hoàn trong máu. Từ cấu trúc của hệ mang thuốc nano, phân tử dược chất được giải phóng và tham gia vào vòng tuần hoàn, phân bố, chuyển hóa thải trừ tương tự như phân tử dược chất được hấp thu từ các dạng thuôc thường quy. Đồng thời, bản thân tiểu phân nano được vận chuyển, phân bố đến các mô nếu không bị nhận diện bởi hệ thống đại thực bào đơn nhân. Tại các mô, tiểu phân nano có thể giải phóng dược chất gây tác dụng sinh học.
5.4. Đặc điểm dược động học tiểu phân nano dùng theo đường khác
Đối với đường phổi, khả năng đưa các tiểu phân vào đường hô hấp phụ thuộc vào đường kính khí động học trung bình khối lượng (MMAD – a mass median aerodynamic diameter) của các tiểu phân được hít vào và khả năng khuếch tán của chúng vào toàn bộ đường hô hấp bắt đầu từ mũi đến các phế nang. Các tiểu phân sẽ bị làm ẩm và tương tác với bề mặt bên trong của phổi để đi qua phổi vào hệ bạch huyết thông qua sự bắt giữ bởi các đại thực bào và vào tuần hoàn chung để đi đến các cơ quan khác. Ngoài ra, quá trình hấp thu còn phụ thuộc vào các đặc tính lý hóa khác của tiểu nhân và đặc tính giải phẫu của đường hô hấp.
Quá trình vận chuyển thuốc qua da giúp đưa các thành phần có tác dụng trị liệu qua da và vào tuần hoàn chung, Các tiểu phân nano cũng hiện đang được sử dụng để điều trị các bệnh ngoài da, giúp tăng cường khả năng lưu giữ và kiểm soát giải phóng của dược chất. Các tiểu phần này có khả năng đi qua lớp sừng rào cản thông qua các con đường như qua tuyến mồ hôi, lỗ chân lông, hoặc đi vào trong tế bào (đối với các tiểu phân nhỏ). Khả năng thấm của các tiểu phân qua da phụ thuộc vào một số yếu tố như KTTP, đặc tính bề mặt của tiểu phân, nhiệt độ bề mặt da, lượng mồ hôi,…
Ngoài ra, một số đặc điểm dược động học của các tiểu phân nano qua các đường dùng khác nhau còn được trình bày trong các phần tiếp theo.
6. VAI TRÒ CỦA CÔNG NGHỆ NANO TRONG DƯỢC PHẨM
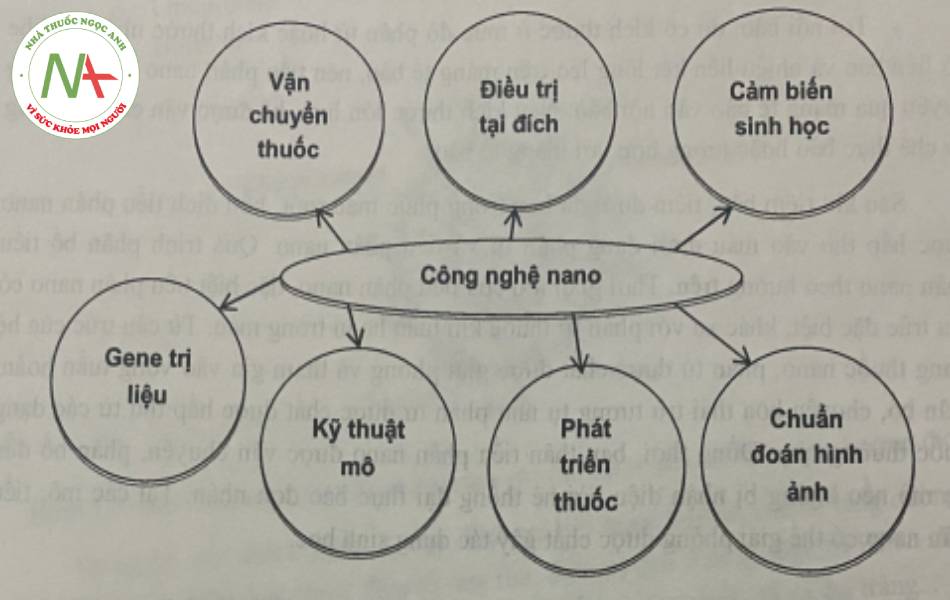
6.1. Vận chuyển thuốc
Tiểu phân nano có thể ứng dụng trong vận chuyển thuốc nhằm:
- Nâng cao hiệu quả điều trị và giảm tác dụng bất lợi.
- Tạo ra các phép điều trị mới.
- Phục vụ công tác nghiên cứu các hoạt chất có khả năng làm thuốc mà chưa được nghiên cửu đầy đù.
Ví dụ: Abrego và cộng sự đã bào chế nano PLGA chứa pranoprofen dùng cho nhãn khoa dưới dạng hydrogel. Công thức hydrogel chứa pranoprofen có các đặc tính các tác dụng chống viêm và giảm đau của thuốc, do đó có thể góp phần nâng cao sự tuân thủ của bệnh nhân.
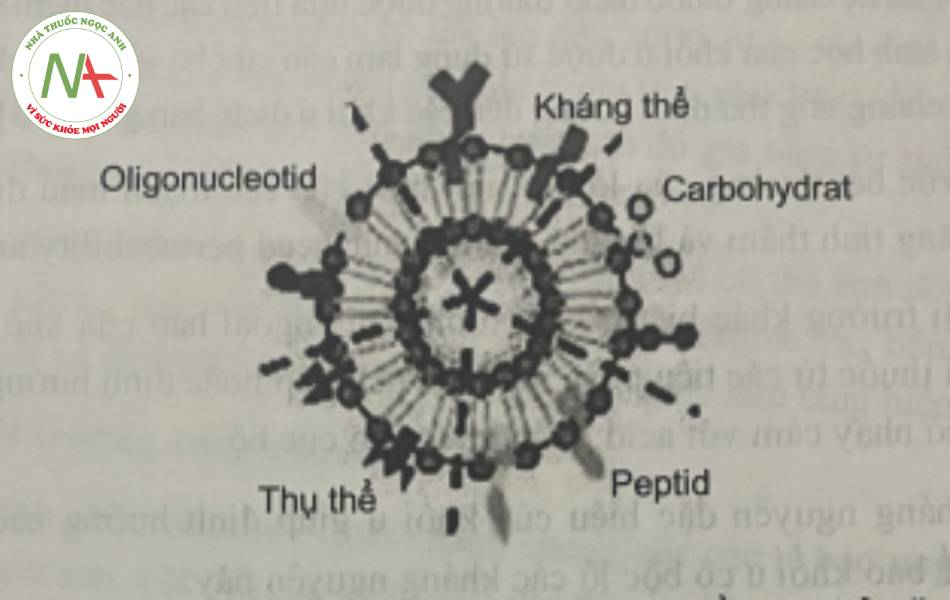
6.2. Điều trị tại đích
Việc đưa thuốc tới tổ chức bị bệnh được thực hiện bằng cách sử dụng các hợp phân có khả năng hướng đích như:
- Kháng thể
- Protein
- Lipoprotein
- Hormon
- Các phần tử mang điện tích
- Polysaccharid
- Các phối tử có khối lượng phân tử thấp
Trong đó, các nhóm thuốc thường được ưu tiên trong nghiên cứu để tăng cường tác dụng điều trị tại đích bao gồm: điều trị ung thư, điều trị tiểu đường, điều trị HIV – AIDS, thuốc vào hàng rào máu não, thuốc cần lưu giữ trên niêm mạc mắt, da và đại tràng…
6.2.1. Điều trị bệnh ung thư
Cùng với sự phát triển của các ngành khoa học khác, trong vài thập kỷ qua, ngành Dược trên thế giới đã vận dụng những thành quả của khoa học nano nói chung vào lĩnh vực nghiên cứu phát triển các dạng thuốc mới, từ đó tạo ra cuộc cách mạng cho ra đời các hệ phân phối thuốc mới nhằm khắc phục những hạn chế của các dược chất và dạng thuốc truyền thống trong điều trị các bệnh khó điều trị như ung thư, HIV, bệnh về gen,… Ứng dụng công nghệ nano để điều trị bệnh ung thư là một bước tiến trong ngành dược, do việc tăng sinh khả dụng và đưa thuốc tới đích.
Bệnh ung thư là một thách thức của y học cho đến ngày nay. Bất chấp những nỗ lực và nhiều tiến bộ trong suốt 30 năm qua, việc kiểm soát bệnh ung thư vẫn còn những hạn chế. Các hóa chất mới thường bị hạn chế sử dụng do độc tính cao hoặc do hiệu quả thấp. Do vậy, việc tăng nồng độ thuốc tại tế bào ung thư và quá trình phân phối thuốc sẽ tiếp tục đóng vai trò quan trọng trong việc tạo ra những tác nhân an toàn và hiệu quả. Việc phân phối thuốc có thể được điều chỉnh bằng cách thay đổi đường sử dụng hoặc thay đổi thiết kế công thức thuốc .
Trong công nghệ dược phẩm, công nghệ nano đã được ứng dụng để làm tăng khả năng hấp thu của thuốc qua đó làm tăng hiệu quả điều trị. Các tiểu phân nano có thể giải phóng thuốc tại đích tác dụng với liều lượng và khoảng thời gian như dự kiến, đặc biệt với các tế bào khối u, kết quả là làm tăng hiệu quả điều trị và giảm thiểu độc tính cho cơ thể người bệnh.
Việc thiết kế hệ mang thuốc nano thường được dựa trên các đặc điểm sinh học của khối u. Ba đặc điểm sinh học của khối u được sử dụng làm căn cứ cho việc thiết kế tiểu phân nano chứa các thuốc chóng ung thư định hướng đến các khối u đích, bao gồm:
- Cấu trúc bất thường của lớp lót nội mạc của các mạch máu đi qua khối u dẫn đến hiệu ứng tăng tính thấm và lưu giữ (EPR – enhanced permeability and retention).
- Vi môi trường khác biệt ở khối u như: pH ngoại bào của khối u thấp hơn cho phép phân phối thuốc từ các tiểu phân nano tại pH thấp hoặc định hướng các khối u đích của các thuốc có nhạy cảm với acid; thân nhiệt cao cục bộ,…
- Các kháng nguyên đặc hiệu của khối u giúp định hướng các tiểu phân nano thuốc đến các tế bào khối u có bộc lộ các kháng nguyên này.
Hiệu ứng tăng tính thấm và lưu giữ
Sự phát triển nhanh của các khối u rắn tiến triển cùng với sự tăng sinh quá mức của chúng, hai quá trình này được điều khiển bởi một hệ thống phức tạp các yếu tố tiết ra bởi các tê bào khôi u. Dâu hiệu phân biệt của quá trình tưới mao mạch và sự dẫn lưu của khối u là sự không lành lặn của lớp nội mạc mao mạch và sự giảm dẫn lưu bạch huyết.
Trái ngược với mao mạch của các mô bình thường, mao mạch của khối u bất thường ở hình dạng và cấu trúc; mao mạch mới thiếu lớp cơ mềm mại hay cứng cáp do đó chúng có các khoang rộng hơn và dễ bị rò rỉ và khúc khuỷu. Một trong những chức năng chính của hệ bạch huyết đó là cung cấp con đường để loại bỏ các protein và tiểu phân ngoài mao mạch, bạch cầu. Trong khi đó, các khối u như trên lại ít có dòng chảy bạch huyết đi qua hơn do áp suất ở bên trong nhân khối u cao hơn áp suất ở ngoại biên. Sự bất bình thường kép của mao mạch bị rò rỉ và sự giảm dẫn lưu của hạch bạch huyết dẫn đến hiệu ứng EPR hay hiệu ứng ở đó các đại phân tử kích thước dưới micromét như protein hay hệ mang thuốc nano dễ dàng tích tụ và lưu giữ tại vùng khối u.
Hiệu ứng EPR có bốn điểm đặc trưng chủ yếu bao gồm: phụ thuộc vào kích thước của phân tử hay tiêu phân; là kiểu hướng đích thụ động; có độ chọn lọc kém; bị ảnh hưởng bởi thời gian tuân hoàn của hệ mang thuốc, với thời gian tuần hoàn kéo dài sẽ làm tăng khả năng phân phối thuốc đến khối u đích.
Khe hở liên bào thành mạch khối u được ước tính cỡ khoảng từ 400-600 nm (hay 300-700 nm [6], thậm chí từ 100 nm-2 μm tùy thuộc loại khối u. Hiệu ứng EPR xảy ra đối với bất kỳ một đại phân tử có khả năng tương thích sinh học nào lớn hơn 40kDa và thậm chí lớn hơn 800kDa hoặc lớn như vi khuẩn. Các hệ mang thuốc như micell, liposome nhũ tương nano, nano polyme, nano lipid và dendrime chứa các thuốc ung thư với kích thước tiểu phân trung bình khoảng 200nm hay nhỏ hơn là điêu kiện lý tưởng đối với hiệu ứng EPR. Thông qua quá trình này, nồng độ thuốc trong khối u tăng lên so với nồng độ thuốc trong các mô khỏe mạnh. Sự khác biệt về hiệu ứng EPR được ghi lại thông qua tỉ lệ giữa nồng độ thuốc trong khối u so với trong máu, binh thường từ 10-30, tuy nhiên có trường hợp có thể lên đến 2000. Việc thay đổi đặc tính bề mặt của tiểu phân nano như gắn các chuỗi polyme trung tính như PEG có thể làm tăng thời gian tuần hoàn trong máu của các tiểu phân nano, từ đó gia tăng sự tích tụ của chúng trong các khói u thông qua hiệu ứng EPR.
Cuối cùng, một vài yếu tố sinh lý học bệnh học có thể làm tăng hiệu ứng EPR bao gồm oxyd nitric, một vài prostaglandin và TNF. Ngoài ra, bệnh tăng huyết áp do angiotensin II và nitroglycerin có thể được sử dụng để làm tăng hiệu ứng EPR.
Vi môi trường xung quanh khối u
Quá trình phân chia một cách nhanh chóng của các tế bào ung thư đòi hỏi một tốc độ chuyển hóa cao. pH của các mô bệnh lý như các khu vực quanh vị trí viêm, nhiễm trùng, nhồi máu và ung thư khác biệt so với pH tại các mô thường. Ở mô thường, pH giữ giá trị hằng định bằng 7,4 như pH của máu trong khi pH nội bào bằng 7,2. Ngược lại, ở phần lớn các khối u, sự chênh lệch giá trị pH này bị đảo ngược giá trị tương ứng ở mô thường. Mặc dù giá trị pH ngoại bào có thể thay đổi phụ thuộc thể tích, loại và đặc tính khối u (như di căn hay không di căn), trong hơn 80% trường họp, giá trị này thường nhỏ hơn 7,2. Thực tế trong một số vùng khối u, giá trị pH ngoại bào có thể thấp đến 6,5. Điều này có liên quan đến quá trình thủy phân glucose nhằm duy trì đủ chất dinh dưỡng và oxy ở các khối u dẫn đến môi trường hơi acid của chúng.
Sự khác nhau của giá trị pH ngoại bào giữa mô thường và mô của khối u tạo cơ hội để đưa thuốc đến các khối u đích bằng cách sử dụng các thuốc chống ung thư hoặc hệ mang thuốc nhạy cảm với vùng pH thấp. Sự chênh lệch giá trị pH bị đảo ngược của khối u tạo điều kiện giúp tích tụ các thuốc có tính acid nhẹ. Dưới điều kiện acid nhẹ, thuốc sẽ tích tụ trong khối u vì những hệ mang thuốc sẽ tăng cường sự giải phóng thuốc từ các hệ liên kết hoặc bê mặt của chúng sẽ không bền và các chuỗi polyme tách ra, dẫn đến sự tích tụ chọn lọc của thuốc tại các khối u. Các liên kết nhạy cảm với pH càng làm tăng cường sự mất ổn định của chúng tại vùng pH thấp như các liên kết orthoeste hay acylhydrazon.
Ngoài ra, hiện tượng thân nhiệt cao có liên quan đến nhiều trường hợp bệnh lý như ung thư buồng trứng ở người. Các hệ polyme nhạy cảm với nhiệt chứa các polyme có nhiệt độ dung dịch tới hạn thấp (LCST – Low critical solution temperature) và chúng sẽ có khuynh hướng kết tụ lại khi nhiệt độ lớn hem LCST ở trong khối u với sự giải phóng đồng thời lượng thuốc bao gói. Sự quá nhiệt cục bộ tại khối u có thể được thực hiện băng cách siêu âm hoặc biện pháp nhiệt quang.
Hơn thế nữa, các tế bào ung thư có thể tiết ra và giải phóng các men riêng biệt như các men matrix metalloproteinase (MMPs) liên quan đến sự di chuyển và cơ chế tồn tại của chúng. Như trường hợp của dạng gắn với albumin của doxorubicin liên hợp với một chuỗi octapeptid đặc hiệu MMP-2 giữa thuốc và chất mang được quan sát thấy rằng bị cắt đứt một cách hiệu quả và đặc hiệu trong một nghiên cứu in vitro.
Quá trình hướng đích thụ động còn có thể sử dụng đặc điểm bề mặt của nano như điện tích để hướng đích đến các khối u. Các tế bào ung thư có đặc tính điện tích bề mặt âm tương đối cao hơn tế bào bình thường, do đó tạo điều kiện cho các tiểu phân nano tích điện dương có khả năng gắn vào. Khả năng hướng đích của các tiểu phân nano tích điện dương có thể đạt được bằng tương tác tĩnh điện với các nhóm phospholipid tích điện âm được bộc lộ ở tế bào biểu mô của khối u. Và độc tính tế bào của nano polyme phụ thuộc nhiều vào quá trình nội bào và quá trình khu trú bên trong tế bào của các tiểu phân nano, điều này bị chi phối bởi bản chất tích điện bề mặt của các tiểu phân. Ví dụ, các tiểu phân nano tích điện dương được tìm thấy có hiệu quả trong việc vận chuyển ARN can thiệp (siRNA) để ức chế gen mục tiêu trong tế bào ung thư đồng thời cũng làm tăng nhạy cảm của các tế bào ung thư đối với paclitaxel từ đó làm tăng cường hoạt tính chống ung thư.
Các kháng nguyên đặc hiệu của khối u
Sau khi đi vào hệ tuần hoàn, chỉ một phần nhỏ thuốc được đưa đến vị trì khối u. Việc bao gói các hóa chất trị ung thư vào các hệ mang thuốc giúp làm tăng phần trăm thuốc tại vị trí khối u và giảm độc tính đối với các mô khỏe thông qua hiệu ứng EPR.
Năm 1975, các kháng thể đơn dòng đã được tìm thấy có khả năng gắn với các kháng nguyên đặc hiệu của khối u. Kể từ đó, một số điều trị ung thư hướng đích sử dụng kháng thể đã được chấp nhận bởi cơ quan quản lý dược phẩm và thực phẩm Mỹ (FDA). Khi các trường hợp này có thể phân biệt được tế bào thường và tế bào ung thư, chúng có thể được đưa vào các hệ mang thuốc để tăng tính chọn lọc và hướng đích tế bào.
Việc hướng đích thông qua hiệu ứng EPR có thể được tăng cường bằng cách kết hợp các phôi tử bê mặt như kháng thể đơn dòng, peptid và protein vào các tiểu phân nano để đạt được tác dụng hướng đích.
Tương tự, các thụ thê được tiết quá mức ở các tế bào khối u như transferin và folat cùng với hiệu ứng EPR có thê làm tăng khả năng đưa tiểu phân nano vào trong tế bào đích và làm tăng nồng độ thuốc nội bào. Cơ chế đưa thuốc vào nội bào của transferin đều tượng tự đối với tế bào thường và tế bào ung thư. Tuy nhiên, tế bào ung thư bộc lộ nhiều thụ thể transferin nhiều hơn so với tế bào thường, dẫn đến sự tích tụ thuốc vào trong tế bào của khối u cao hơn.
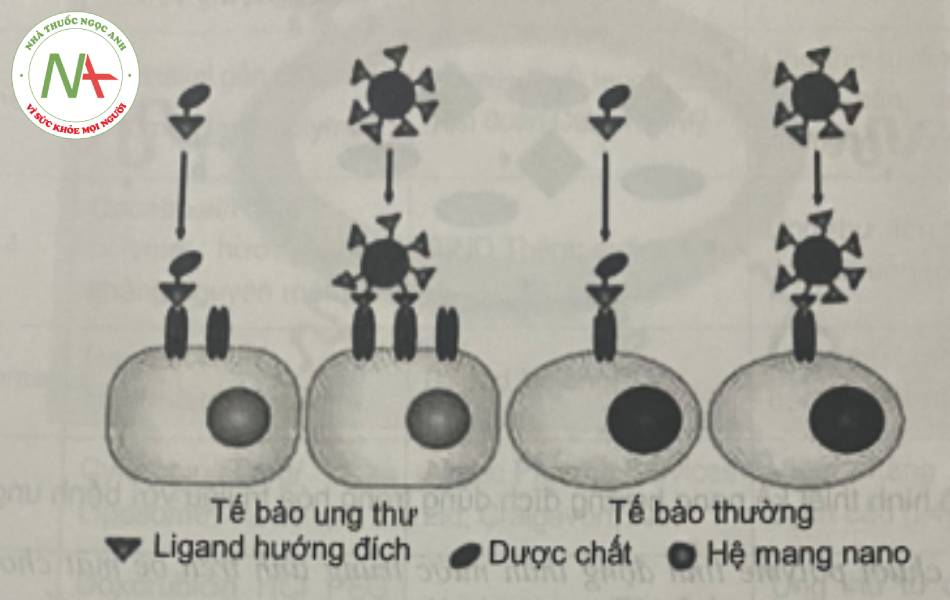
Một hướng khác để hướng đích các transferin là dùng các kháng thể có khả năng gắn với các thụ thể của transferin. Tương tự, các thụ thể folat cũng được sử dụng để hướng đích các tiểu phân nano vào tế bào khối u. Acid folic được kết hợp với thuốc hoặc được gắn trên bề mặt của hệ mang thuốc. Một trong hai kiểu kết hợp này đều làm tăng khả năng hướng đích và đưa thuốc vào tế bào thông qua thụ thể folat được bộc lộ quá mức trên các tế bào khối u.
Một phương pháp khác liên quan đến các peptid thâm nhập tế bào (CPP – Cell penetrating peptides). Ví dụ như protein hoạt hóa phiên mã hoạt hóa chéo từ HIV-1 là TAT peptid và iRGD peptid có chứa một chuỗi arginin-glycin-aspartat và cùng kéo về khối u bằng cách gắn kết ban đầu với các αv integrin được bộc lộ đặc hiệu trên lớp nội mạc của mao mạch khối u. Các CPP kết hợp với bề mặt các liposome và các tiểu phân nano khác đã được sử dụng để tăng khả năng xâm nhập khối u của nhiều thuốc khác nhau.
Lý tưởng hơn, việc kết hợp cả ba yếu tố sinh học này (hiệu ứng EPR, sự đáp ứng với pH, nhiệt độ và các phôi tử đặc hiệu của khối u) có thể tăng tối đa hiệu quả và chỉ số điều trị của các thuốc ung thư. Tuy nhiên, khả năng này rất khó để thực hiện được. Ví dụ, một hệ mang thuốc nhạy cảm với pH có tác dụng hướng đích được phát triển bằng cách sử dụng các liposome PEG hóa và các micell sử dụng PEG- phosphatidylethanolamin: trong điều kiện bình thường được bảo vệ bởi các chuỗi PEG ngăn có khả năng bị chia cắt do pH và chứa thêm một kháng thể đơn dòng gắn với bề mặt chất mang thông qua một chuỗi PEG dài hơn không bị chia cắt.
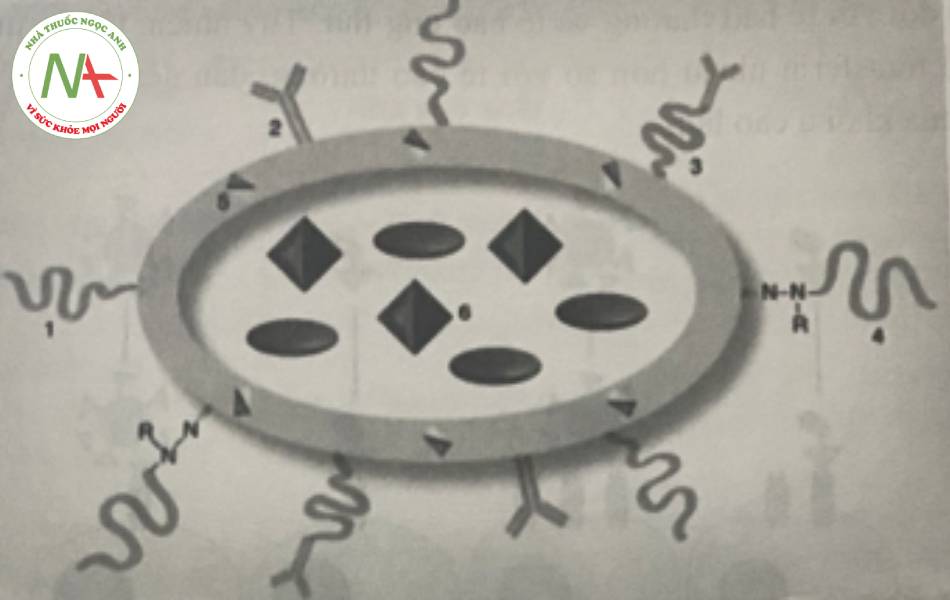
(1) các chuỗi polyme linh động thân nước trung tính trên bề mặt cho quá trình tuần hoàn dài hơn; (3) phần hướng đích ở ngoại biên; (4) và/hoặc cầu noi có thể bị cắt bỏ bởi pH; (2 & 5) phần hướng đích bổ sung hoặc phần tăng khả năng xâm nhập tế bào trên bề mặt và (6) dược chất hoặc các chất chẩn đoán hình ảnh
Ví dụ, Bai và Liu (2014) đã bào chế tiểu phân nano PLGA-PEG chứa cisplatin gắn kháng thể đơn dòng của thụ thể CD44 bằng kỹ thuật phun điện trường. Hỗn dịch thu được cho thấy khả năng hướng đích hiệu quả hơn trên các dòng tế bào ung thư buồng trứng (có sự tăng tiết thụ thể CD44) như CP70 và SKOV-3 trong vòng 6 giờ dùng thuốc so với cisplatin tự do và tiểu phân không gắn kháng thể.
Ngoài ra, hệ mang thuốc nano có ưu điểm hơn dạng thuốc tự do thông qua quá trình ức chế lại sự đề kháng thuốc của các tế bào ung thư. Mặc dù các thuốc có khả năng ức chế bơm tháo rỗng để hạn chế khả năng đề kháng thuốc đã được phát triển, tuy nhiên vẫn còn những hạn chế nhất định. Do đó, các tiểu phân nano đã được thiết kế nhằm sử dụng hiệu ứng EPR để thoát khỏi thành mạch máu của khối u, để hướng đích các thụ thể trên bề mặt của các tế bào khối u và để đi vào tế bào khối u thông qua quá trình nội thực bào trước khi giải phóng thuốc bên trong. Phương pháp này cho phép đưa một nồng độ thuốc cao trong nội bào giúp vượt qua sự đề kháng thuốc thông qua quá trình bơm tháo rỗng của các P-glycoprotein của tế bào khối u.
Sau đây là một số chế phẩm bào chế dưới dạng nano trên thị trường.
Bảng 3. Một số chế phẩm nang sử dụng trong điều trị bệnh ung thư
| Chế phẩm | Dược chất/Hàm lượng/Dạng nano | Nhà sản xuất | Chỉ định |
| Abraxane | Paclitaxel gắn albumin/ 100mg/Nano polyme | Abraxis BioSdence, LLC, Tập đoàn Celgene, Mỹ | Ung thư tuyến tụy, ung thư vú di căn, ung thư phồi không tế bào nhỏ |
| BIND-014 | Docetaxel/Nano polyme hướng đích kháng nguyên màng | BIND Therapeutics, Mỹ | Ung thư tiền liệt tuyến giai đoạn muộn (pha II) |
| DaunoXome | Daunorubicin citrat /50mg/liposome | Gilead Science, Mỹ | Ung thư mô liên kết ở Ị bệnh nhân AIDS |
| DepoCyt | Cytarabin/50mg/Liposome | Almac Pharma Services Ltd, Craigavon, Anh | Viêm màng não ở bệnh bạch cầu |
| Doxil/Caelyx | Doxorubicin HCI PEG hóa/20mg/10 ml hoặc 50mg/25ml/Liposome | Alza/Janssen, Tập đoàn Johnson Johnson, Mỹ | Ung thư tử cung, ung thư vú, ung thư mô Hên kết do Ị AIDS, đa u tủy |
| Genexol-PM | Paclitaxel/30- lOOmg/micell polyme PEG-PLA | Samyang, Hàn Quốc | Ung thư vú, ung thư phổi, ung thư tử cung |
| Mepact | Mifamurtld/4mg/Liposome | Takeda Italia Farmaceutid SpA, Cerano, Ý | Ung thư xương không di căn |
| Myocet | Doxorubicin HCI/50m g/Liposome | Sopherion Therapeutics, Mỹ | Ung thư vú di căn |
| Onco-TCS/Marqibo | Vincristin sulfat/5mg/Liposome | Inex/Talon Therapeutics, Mỹ | Bệnh bạch cầu tăng lymphô bào cấp tính |
| Onivyde | Irinotecan PEG hóa/43mg/10ml/Liposome | Merrimack, Mỹ | Ung thư tụy di căn |
| Vyxeos | Daunorubicin+Cytarabi n/44+100mg/Liposome | Jazz Pharma, Cộng hòa Ireland | Ung thư bạch cầu dòng tủy cấp tính |
6.2.2. Bào chế thuốc hướng đích khác
Tiểu phân nano có thể đuợc ứng dụng để bào chế thuốc thấm vào não. Đối với các thuốc dùng qua hàng rào máu não, khi các tác nhân ngoại lai (như nano polyme hay lipid rắn) tiếp xúc với huyết tương hay huyết thanh thì các protein sẽ hấp phụ trên bề mặt của chúng, đồng thời sẽ chịu trách nhiệm cho sự tương tác với hàng rào máu não và quá trình nội bào tiếp theo ví dụ như sự hấp phụ Apoliporotein E hoặc B lên bề mặt nano được bao bởi polysorbat 80. Ngoài polysorbat 80 thì việc bao với polysorbat 20, 40, 60 và poloxame 188 cũng cho thấy khả năng đưa thuốc đến não của các tiểu phân nano này. Do đó, đặc tính bề mặt của các tiểu phân đóng vai trò quan trọng cho khả năng đưa thuốc đến não như việc cải biến đặc tính bề mặt cho thấy hiệu quả trên mô hình in vivo trong việc đưa thuốc đến não như liposome được PEG hóa hoặc gắn các phức hợp hướng đích như gắn với folat, peptid TAT (transactivator of transcription),….
6.3. Gen trị liệu
Các polyme mang điện tích dương đã cho thấy rất có tiềm năng trong liệu pháp gen dựa trên khả năng nội thực bào của hệ mang thuốc chứa các polyme này được gắn kết sinh học với gen hoặc các phân tử sinh học khác. Các nano polyme này có khả năng phân hủy sinh học tốt, độc tính thấp, hoạt hóa quá trình giải phóng acid nucleic và hiệu quả truyền gen tương đối cao.
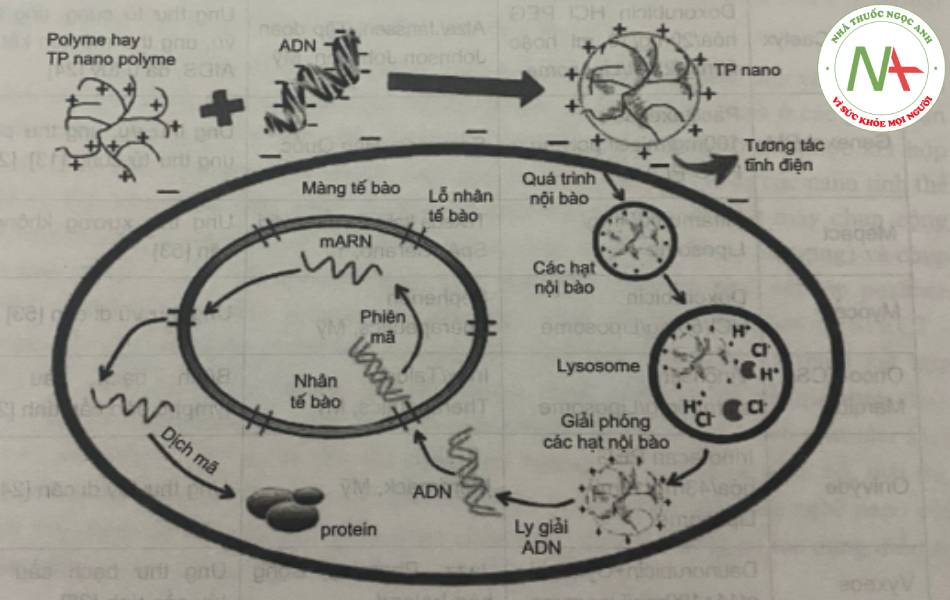
Do đó, nhiều loại polyme được khảo sát để mang gen như chilosan, polyethylenimin (PEI), polylysin, este polyamin,… các cấu tử mang điện tích dương, các đơn vị giúp thoát khỏi cơ quan tế bào (organelle-escape units) và các phần phân hủy sinh học đều rất cần thiết đối với hệ vận chuyển gen dựa trên polyme. Phần lớn các polyme mang điện dương này bắt nguồn từ các polyamin. Chúng không những bảo vệ ADN khỏi bị phân hủy mà còn thúc đẩy quá trình nội thực bào bởi các màng thực bào. Đồng thời các nano polyme có khả năng phân hủy. Quá trình phân hủy này cần thiết trong việc giúp các hệ chất mang giải phóng ADN khi phức hợp đi vào trong tế bào chất. Ngoài ra, các đơn vị giúp thoát khỏi cơ quan tế bào là một trong các yếu tố then chốt ảnh hưởng đến hiệu quả truyền gen.
6.4. Các vai trò khác
Ngoài các vai trò trên, công nghệ nano còn được sử dụng trong thiết kế các cảm biến sinh học để có thể phát hiện nhanh và cùng một lúc nhiều chất chỉ điểm sinh học (biomarker) của các bệnh lý với độ nhạy cao và lượng mẫu nhỏ. Sự ra đời của cảm biến sinh học, ống nano carbon, thiết bị nano bằng polyme, và các chíp sinh học với độ tin cậy và độ nhạy cao giúp phát hiện sớm các bệnh lý nguy hiểm đến tính mạng như ung thư, tim mạch,… ngoài ra, hệ thống lab-on-chip chứa các vật liệu cảm biến mới hoặc các cảm biến dựa trên chip sinh học cũng đã và đang được phát triển nhằm đem đến hiệu quả tốt hơn trong chẩn đoán và điều trị bệnh tật.
Đồng thời, công nghệ nano còn có vai trò trong chẩn đoán hình ảnh với việc cung cấp một giải pháp nhanh, ít xâm lấn, chính xác hơn để chẩn đoán bệnh ở các giai đoạn sớm cũng như giám sát tiến trình của bệnh. Các tiểu phân nano có thể được kết hợp hoặc đánh dấu bằng các phân tử nhỏ, hoặc các ion phức, kim loại hoặc các nano tinh thể để có thể được phát hiện bằng các thiết bị chẩn đoán hình ảnh như máy chụp cộng hưởng từ (MRI – magnetic resonance imaging), chụp X-quang (X-ray imaging) và chụp vi tính cắt lớp (CT – computed tomography imaging), chụp xạ hình cắt lớp positron (PET – positron emission tomography imaging), chụp cắt lớp đơn photon (SPECT – PET/CT, SPECT/CT. Ví dụ: các tiểu phân nano vàng, chấm lượng tử (quantum dot), tiểu phân nano oxyd sắt từ, phức hợp của gadolinium. Trong đó, các tính chất như kích thước, đặc tính bề mặt là các tiêu chí chính ảnh hưởng đến khả năng phân bố, thải trừ, hoặc nhận diện bởi đại thực bào của các tiểu phân nano. Ngoài ra, công nghệ nano còn được ứng dụng để bào chế tiểu phân nano chứa đồng thời tác nhân có tác dụng điều trị và tác nhân có tác dụng chẩn đoán (theranostic nanoparticles).
Ngoài ra, việc sử dụng công nghệ nano còn được tìm thấy trong kỹ thuật tạo mô
như việc thiết kế và tạo ra các khung giá đỡ có khả năng tương thích sinh học hay các mô có thể sử dụng để cấy ghép vào cơ thể. Trong quá trình phát triển thuốc, công nghệ nano ra đời đã tạo ra cuộc cách mạng làm thay đổi việc thiết kế công thức của các dạng thuốc, giúp tạo ra các thế hệ thuốc mới với nhiều ưu điểm đã trình bày ở trên như có thể giúp tăng sinh khả dụng và giảm độc tính của các công thức/hoạt chất đã được sử dụng trước đây trong điều trị bệnh.
7. ĐỘC TÍNH CỦA TIỂU PHÂN NANO
Cùng với nhiều vai trò và ưu điểm của các tiểu phân nano, việc sử dụng ngày càng tăng các vật liệu nano cũng đi kèm với các yếu tố liên quan đến độ an toàn của chúng. Do các đặc tính sinh học và dược động học của thuốc từ tinh thể nano và hệ mang thuốc nano thay đổi, độc tính của thuốc và hệ mang thuốc nano cũng có thể thay đổi, ví dụ như hệ mang thuốc nano cải biến bề mặt bằng polyethylen glycol giúp hệ mang thuốc nano tuần hoàn trong máu lâu, nhưng lại dẫn đến lắng đọng hệ tại các đầu chi, dẫn đến hoại tử các đầu chi. Ví dụ: thuốc điều trị ung thư doxorubicin phân bố ở tủy xương và các tế bào cơ tim, gây ức chế tủy xương và độc tính đối với tim. Tuy nhiên, khi thuốc này được bao gói trong liposome được PEG hóa thì chất mang giúp bảo vệ thuốc không phân bố tại tủy xương và mô tim, giúp làm giảm sự ức chế tủy xương và độc tính đối với tim. Tuy nhiên, liposome được PEG hóa lại gây tích tụ thuốc tại da và dẫn đến một độc tính khác là hội chứng tay-chân và viêm da (vết ban đỏ mất cảm giác ở lòng bàn tay-bàn chân – palmar-plantar erythrodysesthesia). Trong khi đó, nếu sử dụng chất mang là cyanoacrylat thì doxorubicin lại gây độc tính trên thận.
Nêu các tiêu phân nano không có khả năng phân hủy sinh học hay có sự phân hủy sinh học quá lâu thì sự tích lũy tiểu phân ở các cơ quan tổ chức, ví dụ gan và lách, có thể dẫn đến độc tính và tăng tác dụng không mong muốn tại các tổ chức này. Hai yếu tố được sử dụng để đánh giá nguy cơ ảnh hưởng bất lợi của các vật liệu nano đối với sức khỏe con người đó là yếu tố phơi nhiễm và khả năng gây độc của chúng. Khi không bị phơi nhiễm thì yếu tố nguy cơ sẽ bị loại trừ mà không cần xem xét đến tính độc của chúng.
Các tiểu phẫn nano được xem như các hóa chất và được kiểm soát theo quy định về đăng ký, đánh giá, thẩm quyền và giới hạn về hóa chất của Liên minh Châu Âu (REACH) và đặt dưới hoạt động kiểm soát các chất độc hại của Mỹ. Một vài sáng kiến quốc tế cũng đang tiến hành để đảm bảo việc sản xuất an toàn và giảm tác động đến môi trường của các sản phẩm dựa trên công nghệ nano. Ví dụ, tổ chức quốc tế về tiêu chuẩn hóa (ISO) và tổ chức hợp tác và phát triển kinh tế (OCED) đang tham gia vào các vấn đề an toàn của công nghệ nano bằng việc cung cấp các tiêu chuẩn để đánh giá vật liệu nano. Tổ chức OECD đã thành lập bộ phận chuyên trách về các vật liệu nano được sản xuất. Bộ phận này điều hành một vài dự án với mục đích nhằm tìm hiểu đặc tính và các nguy cơ tiềm ẩn của vật liệu nano. Mỹ và Canada đã có sáng kiến hợp tác điều hành một hội đồng hợp tác pháp lý (RCC). Hội đồng RCC nỗ lực kiểm soát vấn đề an toàn môi trường của vật liệu nano và trong các lĩnh vực ứng dụng công nghệ nano bao gồm trong y học và trong các lĩnh vực khác. Tiểu phân nano ứng dụng trong y học hoặc làm các bộ phận của dụng cụ y tế được kiểm soát theo khung pháp lý của Cục Quản lý Thực phẩm và Dược phẩm Mỹ (FDA) và Cơ quan Y tế Châu Âu (EMA) đối với các thuốc có khối lượng phân tử thấp hoặc các chế phẩm công nghệ sinh học. Các công thức chứa hệ mang thuốc nano và một thuốc có khối lượng phân tử thấp hoặc sản phẩm sinh học (như protein hoặc kháng thể có khả năng trị liệu) được xem như sản phẩm kết hợp và được xem xét bởi Văn phòng về sản phẩm kết họp của Mỹ.
Độc tính do tiểu phân nano là một chủ đề rộng liên quan đến môi trường, nghề nghiệp và an toàn sức khỏe. Một vài dạng độc tính do vật liệu nano xuất phát từ các đường phơi nhiễm chung như đường qua da, đường hô hấp, đường tiêu hóa, và đường toàn thân có thể gặp phải. Việc đánh giá độc tính do tiểu phân nano dựa trên vài yếu tố cơ bản như (1) mục đích sử dụng, (2) đường sử dụng hoặc phơi nhiễm, (3) liều lượng và số lần dùng, (4) xem xét đến khả năng phân bố toàn thân hoặc đánh giá độc tính toàn thân thậm chí khi đường sử dụng không phải là đường tiêm tĩnh mạch, (5) sử dụng các mô hình phù họp nhất và có độ nhạy tốt nhất, (6) xem xét vấn đề chuyển hóa của tiêu phân nano, (7) nhận thức rõ các độc tính trường diễn và độc tính cấp. Việc đánh giá kết hợp đa chiều về các vật liệu nano sẽ đinh hướng được các ứng dụng của chúng trong y học, và giúp có cái nhìn sâu sắc về sự hình thành của các dấu hiệu độc tính trong các ứng dụng khác nhau của chúng. Đồng thời, việc công nhận về sự an toàn của các vật liệu nano đối với bệnh nhân cũng cần kết họp với việc đề cao khía cạnh an toàn môi trường và nghề nghiệp. Việc họp tác giữa những lĩnh vực này sẽ đảm bảo sự tác động tối thiểu lên sức khỏe của bệnh nhân, cũng như môi trường và sức khỏe của nhân viên sản xuất và xử lý các vật liệu nano.
Như vậy, các chế phẩm chứa tiểu phân nano cần được đánh giá độc tính như là một thuốc mới để đảm bảo an toàn, hiệu quả của thuốc trong chẩn đoán hay điều trị bệnh.
Câu hỏi lượng giá
- Trình bày những ưu, nhược điểm của tiểu phân nano.
- Dựa vào cách phân loại, trình bày các đặc điểm của từng tiểu phân nano.
- Phân tích một số vai trò của công nghệ nano trong dược phẩm.
- Trình bày các yếu tố cơ bản cần xem xét khi đánh giá độc tính của tiểu phân nano. Cho ví dụ.