Bệnh thần kinh
Cấp cứu hô hấp trong các bệnh lý thần kinh
Bài viết Cấp cứu hô hấp trong các bệnh lý thần kinh – Tải file PDF Tại đây.
Giuseppe Vita, Tiziana Mongini, Fabrizio Racca, Paolo
Ruggeri, Antonio Versaci, Andrea Vianello, và Gian Luca Vita
Biên dịch: Ths.Bs Phạm Hoàng Thiên
Group “Cập nhật Kiến thức Y khoa”
Giới thiệu
Nhiều bệnh thần kinh có thể gây suy hô hấp cấp tính (ARF) do suy giảm các trung tâm kiểm soát hô hấp hành não, tủy sống cổ hoặc ngực, tế bào thần kinh vận động, dây thần kinh ngoại biên, tiếp hợp thần kinh cơ hoặc cơ xương. Giảm oxy máu và/hoặc tăng CO2 máu có thể là một biến chứng của các bệnh mạch máu não, khối u não, chấn thương đầu hoặc cột sống, và các bệnh truyền nhiễm, viêm hoặc thoái hóa của hệ thần kinh trung ương, do tác dụng trực tiếp của chúng hoặc khởi phát các biến chứng như viêm phế quản-viêm phổi, phù phổi hoặc tràn khí màng phổi do chấn thương [1].
Suy hô hấp (RF) cũng thường có thể xảy ra ở những bệnh nhân mắc các bệnh thần kinh cơ cấp tính hoặc mạn tính như hội chứng Guillain-Barré (GBS), xơ cứng cột bên teo cơ (ALS), nhược cơ (MG), teo cơ tủy sống (SMA), loạn dưỡng cơ Duchenne (DMD), viêm đa cơ hoặc viêm da cơ. Trong những trường hợp này, yếu cơ hoành và cơ liên sườn, hoặc các biến chứng hô hấp đồng thời, do rối loạn chức năng hầu họng với hít phải dịch tiết, thức ăn và/hoặc chất lỏng liên quan đến ho không hiệu quả có thể dẫn đến cấp cứu hô hấp [2]. Trong tất cả các tình trạng này, suy hô hấp làm tăng gánh nặng của bệnh lý có từ trước và tỷ lệ tử vong của nó.
Cấp cứu hô hấp cấp có thể xảy ra trong các bệnh lý thần kinh khi khởi phát hoặc thường xuyên hơn trong quá trình bệnh mạn tính của họ và trong trường hợp này là ở nhà, sau khi đến trực tiếp phòng cấp cứu (ER) hoặc trong khi nằm viện để kiểm tra theo dõi. Ngoài ra, thời gian sống sót lâu hơn của bệnh nhân mắc các bệnh thần kinh cơ di truyền như SMA và DMD đã làm tăng nhu cầu giải quyết các vấn đề của sự chuyển đổi từ chăm sóc sức khỏe nhi khoa sang người lớn, với chấn động não ngay cả đối với những gì liên quan đến cấp cứu hô hấp [3, 4].
Sinh bệnh học của ARF
Suy hô hấp là một hội chứng trong đó hệ hô hấp thất bại trong một hoặc cả hai chức năng trao đổi khí của nó: oxy hóa và loại bỏ carbon dioxide (CO2). Theo cơ chế gây bệnh, RF có thể được phân biệt thành hai loại khác nhau:
- RF loại 1 hay giảm oxy máu, được đặc trưng bởi nguồn cung cấp oxy giảm (còn được gọi làsuy phổi)
- RF loại 2 hay tăng CO2 máu, được đặc trưng bởi sự ứ bất thường của CO2 (còn được gọi là suy bơm)
Ở những bệnh nhân bị các rối loạn thần kinh, khởi phát của ARF chủ yếu là do suy bơm: trong tình trạng như vậy, bơm thông khí, ví dụ tổng bộ máy giải phẫu và chức năng cho phép thông khí bình thường của phổi, bao gồm các cấu trúc khác nhau, từ vỏ não đến cơ hô hấp, không cung cấp thông khí phế nang đầy đủ [5 ].
Suy bơm có thể là do sự mất cân bằng giữa sự giảm khả năng của các cơ hít vào và tăng tải trọng cơ học lên cơ hô hấp: tình trạng này là điều kiện tiên quyết cho sự xuất hiện của mệt mỏi cơ hô hấp, từ đó dẫn đến giảm thông khí phổi và ứ CO2. Thật vậy, phản ứng thích nghi của cơ hô hấp đối với sự xuất hiện của mệt mỏi cơ bao gồm giảm lượng nỗ lực của cơ. Trên thực tế, các trung tâm kiểm soát hô hấp thiết lập lại kiểu hình hô hấp bằng cách rút ngắn thời gian của giai đoạn hít vào (Ti ) và giảm giá trị của tỷ Ti/Ttot (tức là tỷ số giữa thời gian của giai đoạn hít vào và tổng thời gian của chu kỳ hô hấp). Kiểu hình hô hấp được điều chỉnh nhất thiết phải dẫn đến giảm thông khí phế nang, vì việc rút ngắn thời gian hít vào làm giảm thể tích khí lưu thông, tức là lượng khí được thông khí đến phổi trong một lần thở.
Yếu cơ hô hấp, dẫn đến giảm khả năng tạo áp lực, làm tăng tỷ số giữa áp lực màng phổi âm trong khi thở yên tĩnh và áp lực màng phổi âm tối đa, có xu hướng xảy ra mệt mỏi và suy cơ hô hấp. Theo đó, đã có báo cáo rằng lượng CO2 ứ lại tương quan trực tiếp với mức độ nghiêm trọng của yếu cơ hô hấp, được đánh giá bằng thước đo áp lực hít vào tối đa (MIP) ở miệng [6, 7]. Mối liên quan này đã được chứng minh ở những bệnh nhân bị bệnh bại liệt cấp tính và / hoặc chấn thương các đoạn tủy cổ hoàn toàn, C1–C3, dẫn đến việc mất huy động một phần hoặc toàn bộ các sợi cơ hoành. Trong trường hợp này, RF có thể trở nên không thể đảo ngược hoặc dẫn đến phục hồi một phần chức năng thông khí có thể được duy trì ngay cả trong vài năm [8].
Ở những bệnh nhân bị loạn dưỡng cơ Duchenne, ARF có thể làm trầm trọng thêm tình trạng suy hô hấp mạn tính vốn có (CRF), có thể nặng lên do các yếu tố thúc đẩy bao gồm viêm phổi, nhiễm trùng đường hô hấp trên lành tính và suy tim sung huyết, cũng như liệu pháp oxy không thích hợp hoặc tình trạng suy dinh dưỡng nghiêm trọng.
Việc xác minh tình trạng tăng khí CO2 máu do hỏng bơm nhất thiết cần phải áp dụng hỗ trợ thông khí
Suy phổi có thể do nhiễm trùng đường hô hấp với sự cản trở của nhầy phế quản và/ hoặc đợt hít phải, dẫn đến sự tiến triển của xẹp phổi hoặc căng phồng phổi không thích hợp. Trong cả hai trường hợp, sự thay đổi tỷ lệ thông khí/tưới máu (tỷ V/Q) có thể xảy ra: thực sự, thông khí khu vực bị giảm, liên quan đến lưu lượng máu, đến điểm mà PO2 (PaO2) phế nang giảm và máu động mạch từ vùng phổi bị giảm thông khí cho thấy độ bão hòa oxyhaemoglobin giảm. Giảm oxy máu do bất tương xứng V/Q có thể được điều chỉnh bằng cách tăng hạn chế phân suất O2 hít vào bằng cách sử dụng oxy bổ sung: tuy nhiên, chiến lược trị liệu này nên được sử dụng hết sức thận trọng và cần theo dõi bệnh nhân cẩn thận, vì nó có thể gây ra suy trung tâm thông khí và ứ CO2 cấp tính.
Suy giảm hệ thống thần kinh tự động có thể góp phần khởi phát các biến chứng hô hấp trong các bệnh khác nhau bao gồm đột quỵ, chấn thương sọ não, chấn thương tủy sống, xơ cứng rải rác, uốn ván, ngộ độc botulism và GBS. Một vai trò quan trọng được thực hiện bởi một cơn bão giao cảm với giảm trương lực phế vị, giảm tác dụng giãn phế quản của thuốc kháng cholinergic, và giảm đáp ứng thông khí với tình trạng thiếu oxy và tăng CO2 máu có thể do sự truyền gián đoạn của các thụ thể cảm nhận cơ học của xoang động mạch chủ và động mạch cảnh [9].
Sinh bệnh học của các biến chứng hô hấp
Bảng 15.1 Các bệnh về thần kinh và cơ chế gây bệnh gây biến chứng hô hấp
| Bệnh | Cơ chế gây bệnh | Biến chứng hô hấp |
| Đột quỵ [10–13] | • Thay đổi kiểm soát hô hấp
• Giảm sức mạnh và sức chịu đựng tối đa của cơ hít vào và thở ra tự chủ. • Cơ học thành ngực kém hiệu quả • Sự cảnh giác thay đổi • Ho không hiệu quả |
• Kiểu thở ataxic hoặc cluster
• Kiểu thở Cheyne-Stokes • Nhiễm trùng phổi (thường gặp ở 1/3) với nguy cơ tử vong cao gấp ba lần trong 30 ngày đầu tiên, kéo dài thời gian nằm viện và sự hiện diện của các kết cục nghiêm trọng hơn khi xuất viện |
| Trạng thái động kinh co giật cơ [14] | • Trạng thái động kinh
• Thuốc đã sử dụng |
• Tần số ARF: khoảng 80%
• Viêm phổi hít • Phù phổi |
| Chấn thương đầu [15, 16] | • Mất trương lực cơ hầu họng
• Mất phản xạ nuốt và ho • Kiểm soát hô hấp bị tổn hại |
• ARF: thiếu oxy máu và tăng CO2 máu |
| Chấn thương tủy sống [17– 19] | • Liệt cơ hoành (chấn thương C3–C5)
• Liệt các cơ liên sườn được dùng cho việc hít vào (tổn thương T1–T12) • Liệt cơ liên sườn và cơ bụng dùng cho thở ra (tổn thương T5– T12) • Hiệu quả ho kém • Tăng tiết phế quản và co thắt phế quản (tăng trương lực phế vị do tổn thương giao cảm ở mức C8–L2) |
• Có thể xấu đi trong 5 ngày đầu tiên với nhu cầu đặt nội khí quản
• Trong 67% tổn thương cổ, khởi phát xẹp phổi (36%), viêm phổi (31%), suy hô hấp (23%) • Phù phổi |
| Bệnh đa xơ cứng rải rác [20] | • Rối loạn chức năng hành tủy với chứng khó nuốt
• Thay đổi điều khiển hô hấp trung tâm • Rối loạn hô hấp trong khi ngủ |
• Phù phổi do thần kinh
• Nhiễm trùng huyết • ARF |
| Viêm não [21] | • Phản xạ nôn kém
• Tích lũy dịch tiết • Chứng khó nuốt |
• Viêm phổi hít
• Suy hô hấp |
| Bệnh Parkinson [22–25] | • Giảm độ giãn nở thành ngực do độ cứng
(rigidity) nghiêm trọng • Giảm vận động và rối loạn vận động đường thở trên • Rối loạn nuốt • Ho yếu • Tắc nghẽn đường thở trên (UAO) |
• Khó thở và đau ngực
• Thở rít do UAO • Rối loạn chức năng hô hấp hạn chế • Viêm phổi hít |
| Mất điều hòa [26–28] | • Giảm khả năng làm sạch đường thở
• Ho yếu • Chứng khó nuốt • Tắc nghẽn đường thở trên |
• Rối loạn chức năng hô hấp hạn chế
• Viêm phổi hít |
| Uốn ván và ngộ độc thịt [29] | • Xấu đi nhanh chóng nếu không được điều trị bằng Ig và được hỗ trợ trong đơn vị chăm sóc đặc biệt (ICU) | • Suy hô hấp 100% |
| Bệnh thần kinh
cơ [3, 30–33] |
• Yếu cơ hoành, liên sườn, ngực, cơ bậc thang, cơ ức đòn chũm
• Có thể có sự hiện diện của vẹo cột sống • Rối loạn nuốt • Ho không hiệu quả |
• Suy hô hấp hạn chế • Viêm phổi hít |
Bảng 15.2 cho thấy các bệnh thần kinh cơ phát triển suy hô hấp tiến triển mạn tính ở tuổi vị thành niên hoặc người lớn. Nếu bạn đang làm việc tại khoa cấp cứu hoặc bất kỳ cơ sở cấp cứu nào và bạn gặp bệnh nhân bị RF tăng khí cacbonic máu, bạn nên luôn cố gắng thu thập thông tin chi tiết về loại bệnh đã được chẩn đoán hoặc nghi ngờ, vì tiên lượng và điều trị có thể rất khác nhau.
Bảng 15.2 Các bệnh thần kinh cơ với suy hô hấp tiến triển mạn tính
Không thể tránh khỏi
Teo cơ tủy sống loại 1
Loạn dưỡng cơ Duchenne (DMD)
Bệnh xơ cứng cột teo cơ bên (ALS)
Một số loạn dưỡng cơ vòng đai gốc chi khởi phát ở tuổi vị thành niên (ví dụ như sarcoglycanopathies)
Một số bệnh cơ di truyền với suy hô hấp sớm
Thường
Teo cơ tủy sống loại 2
Loạn dưỡng trương lực cơ loại 1 (DM1)
Bệnh Pompe khởi phát muộn (LOPD) Hội chứng Guillain-Barré (GBS)
Nhược cơ (MG)
Loạn dưỡng cơ mặt vai cánh tay – Facioscapulohumeral (FSHD)
Loạn dưỡng cơ bẩm sinh (ví dụ: Ullrich CMD)
Loạn dưỡng cơ vòng đai gốc chi (ví dụ: bệnh calpainopathy, FKRP) Một số bệnh cơ bẩm sinh (ví dụ: centronuclear myopathy) Hội chứng nhược cơ bẩm sinh
Thỉnh thoảng
Loạn dưỡng cơ Becker (BMD)
Bệnh đa dây thần kinh di truyền (CMT1B, 4)
Bệnh lý cơ viêm
Teo cơ tủy sống loại 3
Một số bệnh cơ bẩm sinh
Bệnh cơ Ty thể
Hiếm
Loạn dưỡng cơ mắt-họng
Bệnh Charcot-Marie-Tooth (CMT)
CIDP (bệnh viêm đa dây thần kinh hủy myeline mạn tính)
Bảng 15.3 Các bệnh thần kinh cơ ở người lớn có thể biểu hiện với suy hô hấp cấp tính
- Nhược cơ
- ALS
- Bệnh Pompe
- Loạn trương lực cơ loại 1
- Bệnh cơ myofibrillary
- Hiếm gặp khác (ví dụ: loạn dưỡng vòng đai gốc chi loại 2I)
Ngoài ra, vì một số bệnh nhân mắc bệnh thần kinh cơ có thể bị suy hô hấp cấp tính hoặc bán cấp khi khởi phát, trước khi xuất hiện các dấu hiệu vận động rõ ràng (ví dụ: bệnh nhân đi bộ mắc bệnh Pompe mà chưa được chẩn đoán), cần thực hiện chẩn đoán phân biệt để xác định các dạng có thể hưởng lợi từ điều trị đặc hiệu (Bảng 15.3).
Quản lý và điều trị lâm sàng
Suy hô hấp cấp tính trong các bệnh thần kinh tiến triển mạn tính (Đợt cấp trên nền suy hô hấp mạn)
Rối loạn vận động
Hầu hết các bệnh nhân mắc bệnh Parkinson, những người phát triển ARF cần hỗ trợ thở máy, cần đặt nội khí quản để bảo vệ đường thở khỏi nguy cơ hít sặc. Khi nhập cấp cứu, bệnh nhân không hiếm khi có biểu hiện thở rít thanh quản do liệt dây thanh âm và loạn trương lực thanh quản; trong tình huống này, đặt NKQ trở nên khó khăn và cần hỗ trợ nội soi phế quản [34]. Cai thở máy có thể kéo dài do sự xuất hiện của các biến chứng hô hấp (ví dụ viêm phổi liên quan đến thở máy) [35]. Trong một số trường hợp, sự tái phát của thở rít thanh quản cho thấy sự cần thiết phải phẫu thuật mở khí quản.
Các ca bệnh lẻ tẻ của giật cơ (myoclonus) liên quan đến viêm não tủy tiến triển đã được báo cáo là nguyên nhân có thể gây ra ARF, do suy giảm thông khí và nuốt. Họ có thể cần đặt nội khí quản và thở máy xâm lấn (IMV) [36].
Ở những bệnh nhân mắc bệnh Huntington, viêm phổi hít là nguyên nhân hàng đầu gây tử vong (trong khoảng 70% trường hợp) và có liên quan đến chứng khó nuốt nặng. Vì lý do này, trong trường hợp ARF, điều cần thiết là phải sử dụng IMV, để bảo vệ đường thở [37].
Bệnh thần kinh cơ mạn tính với sự tiến triển chậm
■ Các bệnh thần kinh cơ tiến triển chậm thường gặp các vấn đề về hô hấp nhất là DMD, SMA, ALS và loạn trương lực cơ loại 1 (DM1).
■ Các cơ chế chính của các vấn đề hô hấp tiềm ẩn như sau:
□ Sự yếu kém của các cơ hít vào, dẫn đến giảm thông khí phế nang và CRF tăng khí cacbonic máu, ban đầu chỉ vào ban đêm, và muộn hơn, khi bệnh tiến triển là trong cả ngày.
□ Sự yếu kém của các cơ thở ra gây ra, đặc biệt là khi liên quan đến yếu cơ hít vào, ho không hiệu quả với sự tích tụ dịch tiết phế quản và nguy cơ nhiễm trùng đường thở cao [38–40]. Nguy cơ phát triển CRF tăng hơn nữa nếu có liên quan đến rối loạn chức năng nghiêm trọng của cơ bulbar, dẫn đến chứng khó nuốt và nguy cơ hít sặc (thường gặp hơn ở SMA và ALS). Sự hiện diện của vẹo cột sống nghiêm trọng, phát triển chủ yếu trong các bệnh thần kinh cơ dẫn đến mất dáng đi trước tuổi trưởng thành, là một yếu tố nguy cơ quan trọng khác cho sự phát triển của CRF [41]. Tất cả bệnh nhân thần kinh cơ có dung tích sống gắng sức (FVC) dưới 50% giá trị dự đoán đều có nguy cơ phát triển CRF về đêm và hiệu quả ho kém [42].
■ Ở những bệnh nhân đã phức tạp do CRF, một biến cố gian phát (intercurrent) cấp tính, thậm chí ở mức độ nhỏ, có thể dẫn đến đợt kịch phát CRF (Bảng 15.4). Tuy nhiên, có khả năng những bệnh nhân này có thể phức tạp bởi ARF, ngay cả trước khi họ phát triển CRF, đặc biệt nếu họ có FVC dưới 50% giá trị dự đoán. Nhiễm trùng đường hô hấp trên và dưới là những nguyên nhân thường gặp nhất của ARF.
■ Nhiễm trùng đường hô hấp gây ra sự gia tăng dịch tiết phế quản, với sự hiện diện của ho kém, dẫn đến sự cản trở của đường thở và sự hình thành các nút nhầy, xác định giảm oxy máu do sự thay đổi chậm của tỷ lệ thông khí/tưới máu và tăng cường hoạt động cơ bắp. Tăng công hô hấp làm quá tải các cơ hít vào vốn đã bị suy yếu do bệnh thần kinh hiện có, dẫn đến tăng khí cacbonic máu cấp tính hoặc làm trầm trọng thêm tình trạng tăng cacbonic máu mạn tính.
Bảng 15.4 Nguyên nhân gây suy hô hấp cấp tính ở bệnh nhân mắc các bệnh thần kinh cơ tiến triển
| Nguyên nhân phổ biến nhất | Nhiễm trùng đường hô hấp trên (cúm, hội chứng parainfluenza, viêm phế quản do vi khuẩn cấp tính) |
| Nguyên nhân thường gặp | Viêm phổi cộng đồng (ở bệnh nhân tại nhà)
Viêm phổi liên quan đến thực hành chăm sóc (tại các cơ sở chăm sóc dài hạn) Viêm phổi do hít sặc (cần được xem xét, đặc biệt là khi có chứng khó nuốt nặng) Xẹp phổi |
| Nguyên nhân hiếm gặp | Phù phổi do tim (ở bệnh nhân mắc bệnh cơ tim liên quan)
Tràn khí màng phổi Thuyên tắc mỡ (được xem xét ở những bệnh nhân có biến chứng do gãy xương) Quá liều thuốc (thuốc làm giảm sức mạnh cơ bắp hoặc trung tâm hô hấp như benzodiazepin, opioid, thuốc gây mê, v.v.) Thuyên tắc phổi Lỗ rò khí quản-thực quản và khí quản động mạch (ở bệnh nhân mở khí quản) Chướng dạ dày và/hoặc đại tràng nặng |
■ Việc sử dụng thông khí không xâm lấn (NIV), hỗ trợ ho thủ công (tức là sử dụng các thao tác huy động phổi với túi Ambu liên quan đến lực đẩy ngực-bụng) hoặc insufflatorexsufflator cơ học (còn được gọi là máy ho) và việc sử dụng kháng sinh sớm là tiêu chuẩn chăm sóc trong trường hợp nhiễm trùng đường thở, cả ở nhà [43–47] và trong bệnh viện [39, 48–51].
■ Các đợt bùng phát hô hấp có nguồn gốc nhiễm trùng có thể được điều trị tại nhà nếu bệnh nhân và người nhà của họ đã được đào tạo về cách sử dụng các phác đồ quản lý ARF tại nhà, bao gồm sử dụng NIV, chăm sóc ho, theo dõi SpO2 và sử dụng kháng sinh sớm. Các phác đồ này cũng phải xác định rõ ràng khi nào nên cho bệnh nhân nhập viện, phải được điều chỉnh cho phù hợp với thực tế tổ chức địa phương và phải bao gồm sự tham gia của bác sĩ đến thăm bệnh nhân tại nhà.
Những bệnh nhân có FVC dưới 50% giá trị dự đoán hoặc những người đã nhập viện thường xuyên do đợt cấp hô hấp trong năm ngoái có thể được xem xét cho những phác đồ như vậy. Nếu điều trị tại nhà không thành công, bệnh nhân phải nhập viện tại một phòng bệnh nơi bác sĩ có mặt 24 giờ / ngày và nơi có thiết bị và số lượng y tá phù hợp để đảm bảo theo dõi đầy đủ các thông số quan trọng.
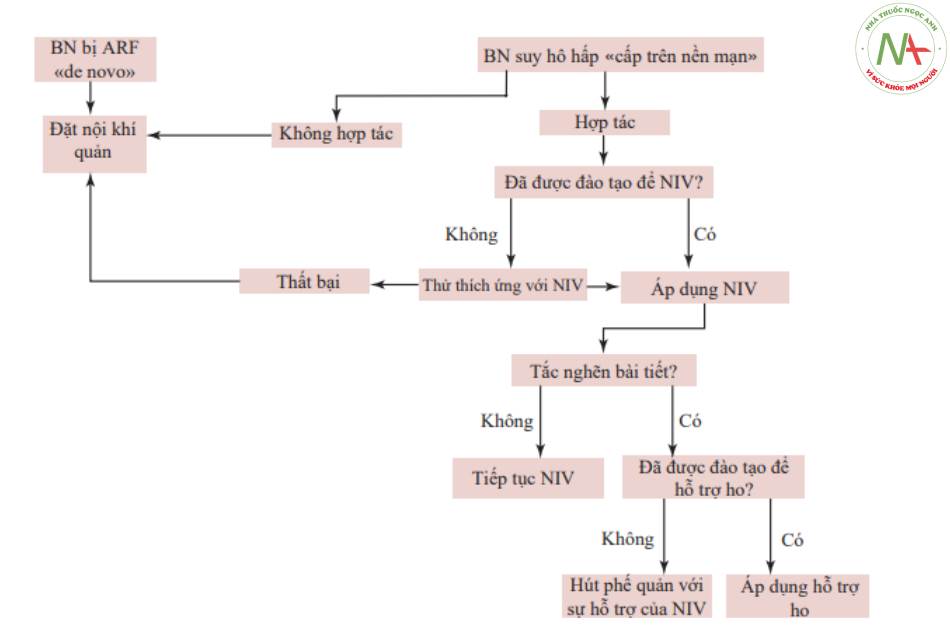
■ Nếu bệnh nhân có chỉ số SaO2 < 95% hoặc tăng CO2 máu mất bù (pH < 7,35 với PCO2 > 45 mmHg), bệnh nhân cần được thở máy, tốt nhất là theo cách không xâm lấn và, khi có sự gia tăng dịch tiết phế quản, cần được điều trị kịp thời bằng cách hỗ trợ ho thủ công hoặc cơ học [48–50]. Thay vào đó, nếu có ít nhất một tiêu chí chống chỉ định NIV (Bảng 15.5), thì phải xem xét đặt nội khí quản ngay lập tức.
■ Không bao giờ nên sử dụng O2 trừ khi liên quan đến việc sử dụng thông khí không xâm lấn và theo dõi CO2.
■ Chụp X-quang ngực nên được thực hiện càng sớm càng tốt để đánh giá sự hiện diện của viêm phổi hoặc xẹp phổi. Hơn nữa, nếu không có nguyên nhân nhiễm trùng rõ ràng, cần loại trừ các nguyên nhân ARF không nhiễm trùng (tràn khí màng phổi, thuyên tắc phổi, thuyên tắc mỡ). Ở những bệnh nhân bị bệnh cơ phức tạp bởi bệnh cơ tim (Bảng 15.6), siêu âm tim cũng cần được thực hiện để loại trừ khả năng phù phổi do tim. Nếu X-quang ngực không chứng minh được hình ảnh lâm sàng của ARF, cần chụp CT ngực để loại trừ tràn khí màng phổi thành trước không thể nhìn thấy trên X-quang. Nếu ngay cả chụp CT ngực cũng không cho thấy bất kỳ nguyên nhân nào gây ra ARF, nên dùng chất cản quang để loại trừ thuyên tắc phổi.
■ Hiệu quả của NIV và ho thủ công hoặc bằng máy cần được đánh giá bằng phân tích khí máu động mạch (ABG) trong vòng 1-2 giờ sau khi bắt đầu NIV. Nếu nhiễm toan hô hấp mất bù nặng hoặc các dấu hiệu lâm sàng của tình trạng mất bù hô hấp nặng vẫn tồn tại (khó thở dai dẳng, nhịp tim và/hoặc nhịp hô hấp cao, sử dụng các cơ hô hấp phụ, độ giãn nở kém của lồng ngực), sự thất bại của NIV nên được xem xét.
Bảng 15.5 Chống chỉ định với thông khí không xâm lấn
- Bệnh nhân bất tỉnh hoặc bất hợp tác
- Kích động tâm lý
- Khó nuốt nghiêm trọng
- Dịch tiết phế quản không được kiểm soát bằng kỹ thuật ho
- Giảm oxy máu nặng (PaO 2 <60 mmHg với FiO2 >0,6)
- Tràn khí màng phổi chưa được dẫn lưu
- Cùng tồn tại của suy hai cơ quan khác
Bảng 15.6 Các bệnh thần kinh cơ phức tạp do bệnh cơ tim
| Bệnh | Biến chứng tim |
| Bệnh dystrophinopathies (DMD, BMD) | Bệnh cơ tim giãn (thường gặp hơn), rối loạn dẫn truyền và rối loạn nhịp tim |
| Loạn dưỡng cơ vòng đai gốc chi (hiếm) | Rối loạn dẫn truyền và rối loạn nhịp tim (thường gặp hơn), bệnh cơ tim giãn |
| Loạn dưỡng cơ | |
| Loạn dưỡng cơ EmeryDreifuss | |
| Bệnh cơ myofibrillary | Rối loạn dẫn truyền và rối loạn nhịp tim (thường gặp hơn), bệnh cơ tim phì đại, bệnh cơ tim chưa biệt hóa (noncompacted myocardium), bệnh cơ tim giãn |
| Bệnh cơ ty thể | |
| Bệnh Pompe
(glycogenosis loại II) |
Bệnh cơ tim phì đại ở dạng trẻ sơ sinh |
| Bệnh cơ dự trữ lipid | Bệnh cơ tim giãn, bệnh cơ tim phì đại |
■ Nếu các thành viên gia đình hoặc người chăm sóc được đào tạo về sử dụng máy thở và chăm sóc ho, sự hiện diện liên tục của họ bên giường bệnh nhân trong suốt quá trình nhập viện là rất quan trọng đối với sự thành công của phương pháp tiếp cận không xâm lấn.
■ Nếu điều trị không xâm lấn (NIV và hỗ trợ ho) thất bại, đặt nội khí quản là cần thiết. Trong những trường hợp như vậy, việc kiểm soát đường thở khó có thể xảy ra phải được đánh giá cẩn thận. Trong trường hợp này, điều quan trọng là phải tiến hành đặt nội khí quản dưới sự kiểm soát tương đối việc cung cấp oxy, tránh đặt nội khí quản cho bệnh nhân khi có tình trạng thiếu oxy máu nặng, và ưu tiên dưới sự hướng dẫn của nội soi phế quản.
■ Ngay sau khi quá trình cấp tính dẫn đến đặt nội khí quản được giải quyết, bệnh nhân có thể được cai máy thở, giảm FiO2 và sử dụng máy ho để giải quyết tình trạng mất bão hòa do cản trở đường thở bởi dịch tiết phế quản. Ngay sau khi rút ống, NIV kết hợp với máy ho nên được áp dụng [52, 53]. Phẫu thuật mở khí quản có thể được cân nhắc sau nhiều thử nghiệm cai máy không thành công.
Bảng 15.7 Các chiến lược can thiệp ở bệnh nhân mắc bệnh thần kinh tiến triển mạn tính và RF “cấp tính trên mạn tính”
| Bệnh | Dấu hiệu lâm sàng | Thủ tục |
| Bệnh
Parkinson |
• Thở rít thanh quản
• Liệt dây thanh âm • Loạn trương lực thanh quản |
• Cân nhắc đặt nội khí quản hoặc chăm sóc giảm nhẹ
• Đối với lần cai máy tiếp theo, chú ý đến các biến chứng hô hấp • Nếu triệu chứng và dấu hiệu dai dẳng, mở khí quản được chỉ định |
| Bệnh Huntington | • Chứng khó nuốt
• Viêm phổi hít |
• Đặt nội khí quản |
| DMD
SMA ALS DM1 Các bệnh thần kinh cơ khác |
• Nếu ho không hiệu quả, trong trường hợp nhiễm trùng đường hô hấp trên hoặc dưới, nguy cơ ứ lại dịch tiết phế quản
• Nếu khó nuốt, nguy cơ viêm phổi hít • Nếu FVC < 50%, nguy cơ ARF tăng lên • ARF nếu SaO2 < 95% và/hoặc pH < 7,35 với PCO2 > 45 mmHg Kết hợp với bất kỳ vấn đề nào sau đây: – Tích lũy dịch tiết phế quản – Khó thở – Nhịp tim và/hoặc nhịp thở cao |
• NIV và phân tích ABG trong vòng 1–2 giờ
• Hỗ trợ ho bằng tay (túi Ambu, máy ho) • Theo dõi SpO2 • Sử dụng kháng sinh sớm • Nếu chống chỉ định NIV (Bảng 15.5), đặt nội khí quản • Không bao giờ sử dụng O2 trừ khi kết hợp với với NIV và theo dõi CO2 • Siêu âm tim để loại trừ phù phổi do tim • Chụp CT ngực (tràn khí màng phổi không nhìn thấy khi chụp Xquang hoặc thuyên tắc phổi?) • Nếu NIV không hiệu quả, đặt nội khí quản |
Bảng 15.7 Tóm tắt các dấu hiệu lâm sàng và thủ thuật cần được thực hiện ở bệnh nhân mắc bệnh thần kinh mạn tính và ARF.
Suy hô hấp cấp tiến triển nhanh
Đột quỵ
Điều trị ARF liên quan đến đột quỵ thường yêu cầu đặt nội khí quản và IMV. Trên thực tế, suy giảm khả năng kiểm soát thông khí do tổn thương não thường liên quan đến việc mất trương lực cơ hầu họng, phản xạ ho và nuốt, các tình trạng ảnh hưởng đến khả năng bảo vệ đường thở và tăng nguy cơ hít sặc [54]. Cái sau có thể trở nên trầm trọng hơn bởi sự thay đổi trạng thái ý thức đồng thời. Các biến chứng khác có thể làm tổn hại chức năng hô hấp, bao gồm viêm phổi , thuyên tắc phổi, và phù phổi. Vì lý do này, bệnh nhân đột quỵ phát triển ARF cần theo dõi chặt chẽ tim-hô hấp để phát hiện những thay đổi đột ngột trong tình trạng lâm sàng ở giai đoạn đầu.
Tỷ lệ tử vong của bệnh nhân cần đặt nội khí quản cao: chỉ 50% sống sót sau 30 ngày và 30% sau 1 năm [55].
Các yếu tố dự đoán tăng nguy cơ tử vong bao gồm điểm số thấp của Thang điểm Glasgow và mất phản xạ đồng tử tại thời điểm đặt NKQ. Bệnh nhân sống sót thường hồi phục với quyền tự chủ chức năng tốt và khả năng thường xuyên thực hiện các hoạt động sinh hoạt hàng ngày trong hai phần ba trường hợp. Bệnh nhân đặt nội khí quản có nguy cơ cao bị viêm phổi do vi khuẩn cư trú (colonization) của vòm họng hoặc nhiễm bẩn (contamination) bởi thiết bị và/hoặc nhân viên chăm sóc.
Trạng thái động kinh co giật cơ
Đặt nội khí quản đường miệng và thông khí cơ học cho phép duy trì oxy và CO2 bình thường và sử dụng thuốc gây mê tĩnh mạch để điều trị động kinh. Hơn nữa, chúng ngăn ngừa hít sặc phổi [14].
Việc trì hoãn đặt nội khí quản có liên quan đến tăng tỷ lệ tử vong [56]. Do đó, đặt nội khí quản chỉ có thể được tránh nếu sự phục hồi ý thức là nhanh chóng.
Chấn thương đầu nghiêm trọng
Trong chấn thương đầu nghiêm trọng (Thang điểm Glasgow dưới 9), để giảm tỷ lệ tàn tật và tử vong, ưu tiên hàng đầu là tránh tổn thương não thứ phát bị gây ra bởi không chỉ do hạ huyết áp động mạch và tăng áp lực nội sọ mà còn do giảm oxy máu và tăng khí cacbonic máu.
Vì mục đích này, bệnh nhân phải được đặt nội khí quản và phải đặt IMV để duy trì tình trạng CO2 và O2 bình thường. Đặt nội khí quản cũng cho phép bệnh nhân được an thần, giảm áp lực nội sọ và ngăn ngừa hít sặc phổi [57].
Chấn thương tủy sống
Ở những bệnh nhân có tổn thương hoàn toàn trên C5, đặt NKQ và IMV là luôn luôn cần thiết, trong khi ở những bệnh nhân có tổn thương không hoàn toàn và tổn thương dưới C5, có thể tránh đặt nội khí quản. Ở những bệnh nhân thứ hai, để đánh giá nhu cầu chăm sóc thông khí xâm lấn hoặc không xâm lấn, điều cần thiết là phải theo dõi không chỉ SpO2 mà còn cả CO2, dung tích sống và MIP [58].
Liệt cơ hoành
■ Bệnh dây thần kinh hoành có thể dẫn đến liệt cơ hoành và rối loạn chức năng hô hấp ở các mức độ khác nhau.
■ Liệt cơ hoành một bên thường không có triệu chứng và thường bị nghi ngờ khi thỉnh thoảng có dấu hiệu elevated hemidiaphragm (vòm hoành nâng cao). Nó có thể gây khó thở khi gắng sức hoặc ở tư thế nằm ngửa, đặc biệt là khi có chướng bụng đồng thời (béo phì hoặc mang thai) hoặc bệnh lý phổi hay tim mạch đồng thời [59].
■ Liệt cơ hoành hai bên dẫn đến khó thở khi nằm và giảm thông khí về đêm mạn tính và có thể phức tạp do ARF tăng CO2 máu. Nó có thể được chẩn đoán với sự hiện diện của việc giảm 30% dung tích sống còn với giả định ở tư thế nằm ngửa [60].
Bệnh thần kinh cơ tiến triển nhanh chóng
Trong trường hợp cơn khủng hoảng nhược cơ (myasthenic crisis), sự khởi phát của ARF thứ phát do hỏng bơm là một trường hợp phổ biến, mặc dù các giá trị của FVC và áp lực miệng tối đa (maximal mouth pressures) vẫn có thể đủ trong các tình trạng lâm sàng ổn định. ARF phát sinh từ sự kết hợp của thay đổi dẫn truyền ở vùng tiếp giáp thần kinh cơ, ức chế trung tâm hô hấp và giảm sức chịu đựng của cơ [5]. Khởi phát ARF có thể bị thúc đẩy bởi nhiễm trùng đường hô hấp sự xuất hiện của bệnh cơ do glucocorticoid gây ra, sự tổn thương cụ thể của cơ hành tủy, hoặc di chứng của phẫu thuật cắt bỏ tuyến giáp trước đó.
Trong hội chứng Guillain-Barré, sự khử myelin của các sợi thần kinh ngoại biên có thể làm thay đổi sự dẫn truyền các kích thích ly tâm đến các cơ hô hấp và hành tủy; kết quả là, 20–30% bệnh nhân cần hỗ trợ thở máy [32]. Cơ hoành có liên quan cụ thể, như được ghi nhận bởi sự sụt giảm rõ rệt giá trị FVC sau khi chuyển từ tư thế thẳng đứng sang nằm ngửa.
Trong trường hợp các bệnh thần kinh cơ phát triển nhanh chóng, việc xác định kịp thời những bệnh nhân cần thở máy trở nên cần thiết để tránh các biến chứng tiềm ẩn liên quan đến đặt nội khí quản khẩn cấp. Nhu cầu về MV có thể xảy ra ở những bệnh nhân có bệnh tiến triển nhanh, rối loạn chức năng hành tủy (đặc trưng bởi loạn vận ngôn, khó nuốt hoặc ho không hiệu quả), yếu cơ mặt hai bên hoặc rối loạn thần kinh tự động. Để hỗ trợ cho quyết định đặt nội khí quản, quy tắc 20/30/40 đã được đề xuất: theo quy tắc này, thủ thuật được khuyến cáo ở những bệnh nhân cho thấy: FVC < 20 ml/kg; MIP < −30 cmH2O; áp lực thở ra tối đa (MEP) < 40 cmH2O [5]. Các chỉ số khác về nhu cầu cấp thiết đối với IMV và bảo vệ đường thở bao gồm không có khả năng nâng đầu và sự phát triển nhanh chóng của ARF (trong vòng 1 tuần).
Liên quan đến các phương thức hỗ trợ thông khí, cần lưu ý rằng, ngoại trừ một số bệnh nhân bị cơn khủng hoảng nhược cơ ở giai đoạn đầu, việc áp dụng NIV có vai trò rất hạn chế, do không có khả năng loại bỏ dịch tiết phế quản. Mặt khác, sau khi đặt nội khí quản, bệnh nhân có nguy cơ cao bị biến chứng phổi, bao gồm viêm phổi liên quan đến thở máy: sự xuất hiện của nó có liên quan đến tuổi cao, nồng độ bicarbonat huyết thanh thấp và thời gian đặt nội khí quản kéo dài. Mở khí quản sớm được khuyến cáo cho dù thời gian đặt NKQ kéo dài có được dự kiến hay không.
Bảng 15.8 tóm tắt các dấu hiệu và thủ thuật lâm sàng sẽ được thực hiện ở bệnh nhân ARF trong các bệnh thần kinh tiến triển nhanh.
Bảng 15.8 Các chiến lược can thiệp ở bệnh nhân ARF trong các bệnh thần kinh tiến triển nhanh
| Bệnh | Dấu hiệu lâm sàng | Can thiệp |
| Đột quỵ | Mất phản xạ ho, khó nuốt nặng, GCS < 9 liên quan với ARF | Cân nhắc đặt nội khí quản và thở máy hoặc chăm sóc giảm nhẹ |
| Trạng thái động kinh co giật cơ | Nếu phục hồi ý thức không nhanh chóng | Cân nhắc đặt nội khí quản và thở máy |
| Chấn thương đầu nghiêm trọng | Nếu GCS <9 | Cân nhắc đặt nội khí quản và thở máy |
| Chấn thương tủy sống | Nếu tổn thương hoàn toàn trên C5 | Đặt nội khí quản và thở máy |
| Bệnh cơ hoặc bệnh đa dây thần kinh trng bệnh nặng (bệnh nhân nằm ICU) | Liệt mềm với sự phụ thuộc kéo dài vào máy
thở |
Thúc đẩy vận động sớm, tránh sử dụng thuốc chẹn thần kinh cơ và steroid kéo dài, tránh thông khí có kiểm soát kéo dài |
| Rối loạn chức năng cơ hoành do máy thở | Sự phụ thuộc kéo dài vào máy thở | Tránh thông khí có kiểm soát kéo dài ; tránh trong quá trình thông khí được hỗ trợ :
– Quạt không đồng bộ – Thở máy quá mức hoặc dưới nhu cầu |
| Liệt cơ hoành | Nếu mức giảm của FVC lớn hơn 30% ở tư thế nằm ngửa so với FVC được đo ở tư thế ngồi | Xem xét NIV |
| Nhược cơ, GBS | Nếu FVC <20 ml/kg;
MIP <−30 cm H2O; MEP < 40 cm H2O; khó nuốt nghiêm trọng |
Cân nhắc đặt nội khí quản và thở máy |
Tài liệu tham khảo
- Rabinstein AA, Wijdicks EF. Warning signs of imminent respiratory failure in neurological patients. Semin Neurol. 2003;23:97–104.
- Boentert M, Wenninger S, Sansone VA. Respiratory involvement in neuromuscular disorders. Curr Opin Neurol. 2017;30:529–37.
- Finkel RS, Mercuri E, Meyer OH, et al. Diagnosis and management of spinal muscular atrophy: part 2: pulmonary and acute care; medications, supplements and immunizations; other organ systems; and ethics. Neuromuscul Disord. 2018;28:197–207.
- Messina S, Vita GL. Clinical management of Duchenne muscular dystrophy: the state of the art. Neurol Sci. 2018;39:1837–45.
- Mehta S. Neuromuscular disease causing acute respiratory failure. Respir Care. 2006;51:1016–21.
- De Troyer A, Pride NB. The respiratory system in neuromuscular disorders. In: Roussos C, Macklem PT, editors. The thorax. New york: Marcel Dekker; 1985. p. 1089–121. RESPIRATORy EMERGENCIES IN NEUROLOGICAL DISEASES
- Annane D, Quera-Salva MA, Lofaso F, et al. Mechanisms underlying effects of nocturnal ventilation on daytime blood gases in neuromuscular diseases. Eur Respir J. 1999;13:157–62.
- Biering-Sorensen M, Biering-Sorensen F. Tracheostomy in spinal cord injured: frequency and follow-up. Paraplegia. 1992;30:656–60.
- Mazzeo AT, La Monaca E, Di Leo R, Vita G, Santamaria LB. Heart rate variability: a diagnostic and prognostic tool in anesthesia and intensive care. Acta Anaesthesiol Scand. 2011;55:797–811.
- Pollock RD, Rafferty GF, Moxham J, Kalra L. Respiratory muscle strength and training in stroke and neurology: a systematic review. Int J Stroke. 2013;8:124–30.
- Lima IN, Fregonezi GA, Melo R, et al. Acute effects of volume- oriented incentive spirometry on chest wall volumes in patients after a stroke. Respir Care. 2014;59:1101–7.
- Chapman C, Morgan P, Cadilhac DA, Purvis T, Andrew NE. Risk factors for the development of chest infections in acute stroke: a systematic review. Top Stroke Rehabil. 2018;25:445–58.
- Menezes KK, Nascimento LR, Avelino PR, Alvarenga MTM, TeixeiraSalmela LF. Efficacy of interventions to improve respiratory function after stroke. Respir Care. 2018;63:920–33.
- Brophy GM, Bell R, Claassen J, et al., Neurocritical Care Society Status Epilepticus Guideline Writing Committee. Guidelines for the evaluation and management of status epilepticus. Neurocrit Care. 2012;17:3–23.
- Ostermann RC, Joestl J, Tiefenboeck TM, Lang N, Platzer P, Hofbauer M. Risk factors predicting prognosis and outcome of elderly patients with isolated traumatic brain injury. J Orthop Surg Res. 2018;13:277.
- Krishnamoorthy V, Hough CL, Vavilala MS, et al. Tracheostomy after severe acute brain injury: trends and variability in the USA. Neurocrit Care. 2019;30:546–54.
- Jackson AB, Groomers TE. Incidence of respiratory complications following SCI. Arch Phys Med Rehabil. 1994;75:270–5.
- Berlly M, Shem K. Respiratory management during the first five days after spinal cord injury. J Spinal Cord Med. 2007;30:309–18.
- Zakrasek EC, Nielson JL, Kosarchuk JJ, Crew JD, Ferguson AR, McKenna SL. Pulmonary outcomes following specialized respiratory management for acute cervical spinal cord injury: a retrospective analysis. Spinal Cord. 2017;55:559–65.
- Tzelepis GE, McCool FD. Respiratory dysfunction in multiple sclerosis. Respir Med. 2015;109:671–9.
- Britton PN, Eastwood K, Paterson B, et al. Consensus guidelines for the investigation and management of encephalitis in adults and children in Australia and New Zealand. Intern Med J. 2015;45:563–76.
- Herer B, Arnulf I, Housset B. Effects of levodopa on pulmonary function in Parkinson’s disease. Chest. 2001;119:387–93.
- Shill H, Stacy M. Respiratory complications of Parkinson’s disease. Semin Respir Crit Care Med. 2002;23:261–5.
- Simons JA. Swallowing dysfunctions in Parkinson’s disease. Int Rev Neurobiol. 2017;134:1207–38.
- Torsney KM, Forsyth D. Respiratory dysfunction in Parkinson’s disease. J R Coll Physicians Edinb. 2017;47:35–9.
- Sriranjini SJ, Pal PK, Krishna N, Sathyaprabha TN. Subclinical pulmonary dysfunction in spinocerebellar ataxias 1, 2 and 3. Acta Neurol Scand. 2010;122:323–8.
- McGrath-Morrow SA, Gower WA, Rothblum-Oviatt C, et al. Evaluation and management of pulmonary disease in ataxia-telangiectasia. Pediatr Pulmonol. 2010;45:847–59.
- Bhatt JM, Bush A, van Gerven M, et al. ERS statement on the multidisciplinary respiratory management of ataxia telangiectasia. Eur Respir Rev. 2015;24:565–81.
- Witoonpanich R, Vichayanrat E, Tantisiriwit K, et al. Survival analysis for respiratory failure in patients with food-borne botulism. Clin Toxicol (Phila). 2010;48:177–83.
- Pfeffer G, Povitz M, Gibson GJ, Chinnery PF. Diagnosis of muscle diseases presenting with early respiratory failure. J Neurol. 2015;262:1101–14.
- de Carvalho M, Swash M, Pinto S. Diaphragmatic neurophysiology and respiratory markers in ALS. Front Neurol. 2019;10:143.
- Green C, Baker T, Subramaniam A. Predictors of respiratory failure in patients with Guillain-Barré syndrome: a systematic review and meta-analysis. Med J Aust. 2018;208:181–8.
- Howard RS. Respiratory failure because of neuromuscular disease. Curr Opin Neurol. 2016;29:592–601.
- Brown LK. Respiratory dysfunction in Parkinson’s disease. Clin Chest Med. 1994;15:715–27.
- Su CM, Kung CT, Chen FC, et al. Manifestations and outcomes of patients with Parkinson’s disease and serious infection in the emergency department. Biomed Res Int. 2018;2018:6014896, eCollection 2018. https://doi.org/10.1155/2018/6014896.
- Degeneffe A, Dagonnier M, D’hondt A, Elosegi JA. A case report of rigidity and recurrent lower limb myoclonus: progressive encephalomyelitis rigidity and myoclonus syndrome, a chameleon. BMC Neurol. 2018;18:173.
- Heemskerk A, Roos RA. Aspiration pneumonia and death in Huntington’s disease. PLoS Curr. 2012;4:RRN1293. RESPIRATORy EMERGENCIES IN NEUROLOGICAL DISEASES
- Poponick JM, Jacobs I, Supinski G, DiMarco AF. Effect of upper respiratory tract infection in patients with neuromuscular disease. Am J Respir Crit Care Med. 1997;156(2 Pt 1):659–64.
- Racca F, Del Sorbo L, Mongini T, Vianello A, Ranieri VM. Respiratory management of acute respiratory failure in neuromuscular diseases. Minerva Anestesiol. 2010;76:51–62.
- Hull J, Aniapravan R, Chan E, et al. British Thoracic Society guideline for respiratory management of children with neuromuscular weakness. Thorax. 2012;67(Suppl. 1):i1–40.
- Sansone VA, Racca F, Ottonello G, et al. 1st Italian SMA Family Association Consensus Meeting: management and recommendations for respiratory involvement in spinal muscular atrophy (SMA) types I-III. Rome, Italy, 30-31 January 2015. Neuromuscul Disord. 2015;25:979–89.
- Birnkrant DJ, Bushby K, Bann CM, et al. Diagnosis and management of Duchenne muscular dystrophy, part 3: primary care, emergency management, psychosocial care, and transitions of care across the lifespan. Lancet Neurol. 2018;17:445–55.
- Bach JR, Ishikawa y, Kim H. Prevention of pulmonary morbidity for patients with Duchenne muscular dystrophy. Chest. 1997;112:1024–8.
- Tzeng AC, Bach JR. Prevention of pulmonary morbidity for patients with neuromuscular disease. Chest. 2000;118:1390–6.
- Finder JD, Birnkrant D, Carl J, et al. Respiratory care of the patient with Duchenne muscular dystrophy: ATS consensus statement. Am J Respir Crit Care Med. 2004;170:456–65.
- Sancho J, Servera E. Noninvasive ventilation for patients with neuromuscular disease and acute respiratory failure. Chest. 2008;133: 314–5.
- Vianello A, Savoia F, Pipitone E, et al. “Hospital at home” for neuromuscular disease patients with respiratory tract infection: a pilot study. Respir Care. 2013;58:2061–8.
- Vianello A, Bevilacqua M, Arcaro G, Gallan F, Serra E. Non-invasive ventilatory approach to treatment of acute respiratory failure in neuromuscular disorders. A comparison with endotracheal intubation. Intensive Care Med. 2000;26:384–90.
- Servera E, Sancho J, Zafra MJ, Català A, Vergara P, Marın J. Alternatives to endotracheal intubation for patients with neuromuscular diseases. Am J Phys Med Rehabil. 2005;84:851–7.
- Vianello A, Corrado A, Arcaro G, et al. Mechanical insufflation- exsufflation improves outcomes for neuromuscular disease patients with respiratory tract infections. Am J Phys Med Rehabil. 2005;84: 83–8.
- Chatwin M, Toussaint M, Gonçalves MR, et al. Airway clearance techniques in neuromuscular disorders: A state of the art review. Respir Med. 2018;136:98–110.
- Bach JR, Gonçalves MR, Hamdani I, Winck JC. Extubation of patients with neuromuscular weakness: a new management paradigm. Chest. 2010;137:1033–9.
- Vianello A, Arcaro G, Braccioni F, et al. Prevention of extubation failure in high-risk patients with neuromuscular disease. J Crit Care. 2011;26:517–24.
- Zazulia AR. Critical care management of acute ischemic stroke. Contin Lifelong Learning Neurol. 2009;15:68–82.
- Milhaud D, Popp J, Thouvenot E, Heroum C, Bonafé A. Mechanical ventilation in ischemic stroke. J Stroke Cerebrovasc Dis. 2004;4:183–8.
- Vohra TT, Miller JB, Nicholas KS, et al. Endotracheal intubation in patients treated for prehospital status epilepticus. Neurocrit Care. 2015;23:33–43.
- Seder DB, Riker RR, Jagoda A, Smith WS, Weingart SD. Emergency neurological life support: airway, ventilation, and sedation. Neurocrit Care. 2012;17(Suppl.1):S4–20.
- Como JJ, Sutton ER, McCunn M, et al. Characterizing the need for mechanical ventilation following cervical spinal cord injury with neurologic deficit. J Trauma. 2005;59:912–6.
- Baltzan MA, Scott AS, Wolkove N. Unilateral hemidiaphragm weakness is associated with positional hypoxemia in REM sleep. J Clin Sleep Med. 2012;8:51–8.
- Armstrong JD. Dysfunction of the diaphragm. N Engl J Med. 2012;366: 2036–7.