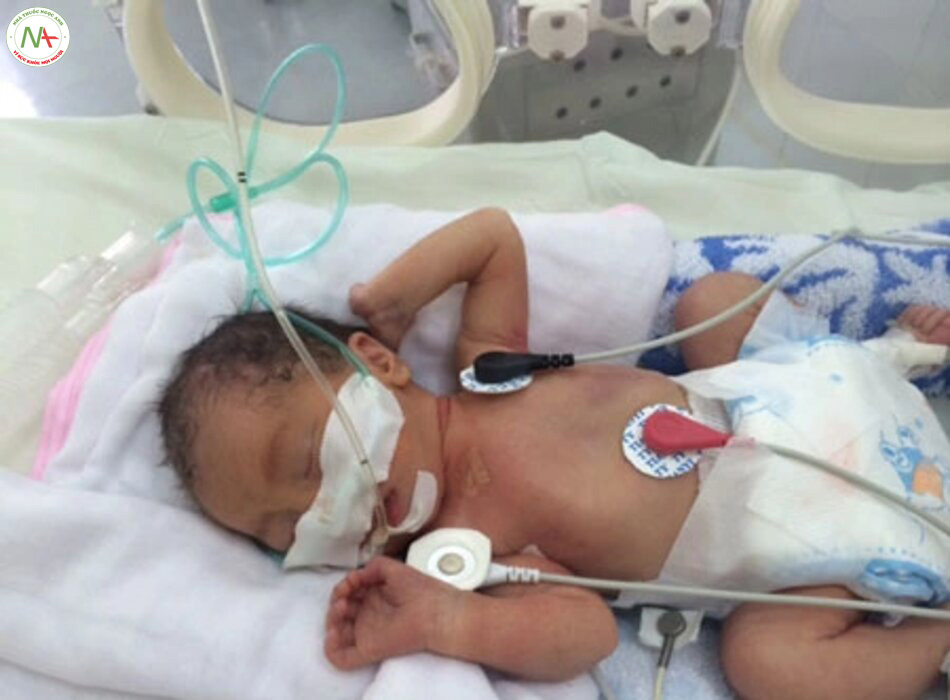
Bệnh hô hấp
Cai máy thở và rút nội khí quản trong thông khí hỗ trợ cho trẻ sơ sinh
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
nhathuocngocanh.com – Bài viết Cai máy thở và rút nội khí quản trong thông khí hỗ trợ cho trẻ sơ sinh của tác giả Wissam Shalish, Guilherme Sant’ Anna và Martin Keszler được biên dịch bởi Thạc sĩ – Bác sĩ Đặng Thanh Tuấn công tác tại Khoa Hồi sức ngoại – Bệnh viện Nhi đồng I.
Nội dung chính
- Mặc dù có sự đồng thuận chung rằng cai máy thở hỗ trợ và rút nội khí quản sớm nhất là điều đáng mong đợi, nhưng có rất ít ý kiến tán thành về cách cai máy thở tốt nhất hoặc bối cảnh chỉ định rút nội khí quản. Cả việc rút nội khí quản sớm dẫn đến thất bại và cần đặt lại nội khí quản, cũng như thời gian thở máy kéo dài không cần thiết, đều có thể gây ra hậu quả bất lợi.
- Mặc dù đã có nhiều cố gắng, nhưng không có chỉ số được đề xuất nào về mức độ sẵn sàng rút nội khí quản chịu được sự thử thách của thời gian, do đó, hiện vẫn còn tồn tại nhiều cách thực hành cai máy thở hết sức khác biệt.
- Việc bổ sung phân tích động lực học của các tín hiệu tim mạch vào các thử nghiệm thở tự phát có thể nâng cao giá trị dự đoán của chúng đối với sự sản sàng rút nội khí quản.
Giới thiệu
Mặc dù là một can thiệp cứu sống, nhưng thở máy (mechanical ventilation – MV) lại liên quan đến nhiều biến chứng (Hộp 26.1); do đó, việc cai máy thở kịp thời và an toàn trở thành nhiệm vụ quan trọng, cấp thiết. Tuy nhiên, quá trình ngừng MV ở trẻ sơ sinh mới chào đời mắc bệnh phổi nặng và trẻ sinh cực non vẫn còn là một thách thức lớn, chưa kể nhiều phương thức hỗ trợ hô hấp hiện đang được sử dụng khiến việc này trở nên phức tạp hơn. Chưa có sự đồng thuận về cách phù hợp nhất để cai máy thở cho trẻ sơ sinh và việc xử trí phần lớn vẫn mang tính chủ quan, tùy thuộc vào thực tiễn của cơ sở chăm sóc và quá trình đào tạo hoặc sở thích của từng cá nhân. Không may là, hệ thống kiến thức về cai máy thở và đánh giá mức độ sẵn sàng rút ống nội khí quản ở trẻ sơ sinh vẫn tồn tại nhiều lỗ hổng kiến thức quan trọng, dẫn đến những thay đổi đáng kể trong thực hành rút nội khí quản trên toàn thế giới. Trong chương này, chúng tôi cung cấp một đánh giá toàn diện về chủ đề này và một số khuyến cáo dựa trên bằng chứng, nhằm mục đích hướng dẫn thực hành lâm sàng cai máy thở, đánh giá mức độ sẵn sàng rút nội khí quản, cũng như xử trí sau rút nội khí quản.
Cai hỗ trợ hô hấp
Cai máy thở là quá trình giảm số lượng hỗ trợ thông khí, bệnh nhân dần chiếm tỷ lệ lớn hơn trong tổng thể công thông khí. Như đã đề cập ở Chương 19, cai máy thở và rút nội khí quản sớm nhất có thể là một trong những mục tiêu ưu tiền của hỗ trợ hô hấp cơ học. Ngoài mục tiêu rõ ràng là giảm tổn thương phổi liên quan đến máy thở, cai máy thở sớm sẽ giảm nguy cơ nhiễm trùng huyết bệnh viên, giảm sự khó chịu của bệnh nhân và nhu cầu an thần, giảm thiểu sự phát triển nỗi sợ ăn uống đi kèm với các khó khăn khi cho ăn tiếp theo, đồng thời tạo điều kiện gắn kết cha mẹ và chăm sóc phát triển phù hợp. Do đó, ngay sau khi tình trạng của bệnh nhân đã ổn định và tình trạng rối loạn hô hấp cơ bản dẫn đến việc khởi động quá trình thở máy bắt đầu được cải thiện, thì nên bắt đầu cai máy thở. Cách tiếp cận này khác với cách làm trước đây (và vẫn tồn tại ở một số trung tâm), khi bệnh nhân được dùng thuốc an thần nặng. hay thậm chí là thuốc liệt cơ trong giai đoạn cấp tính của bệnh, và việc cai máy thở không bắt đầu cho đến khi đáp ứng một số tiêu chí cai máy thở tùy ý. Những ngày đầu của thông khí cơ học (mechanical ventilation – MV) cho trẻ sơ sinh đã tồn tại một thực tế phổ biến là tiếp tục thông khí cơ học cho trẻ sơ sinh đến khi trẻ đạt được cân nặng tùy ý 1 kg. Phương thức thực hành này đã bị loại bỏ từ lâu, dựa trên giả định rằng trẻ sinh non nhỏ sẽ tiêu tốn quá nhiều năng lượng để thở và không có khả năng rút được nội khí quản. Khái niệm này phần lớn liên quan đến việc thực hành rút nội khí quản cho trẻ sinh non chuyển sang mũ chụp oxy (oxygen hood) thay vì áp lực đường thở dương liên tục (CPAP).
Ngày nay, với những cải tiến đáng kể trong việc cung cấp hỗ trợ hô hấp không xâm lấn, một số trẻ cực non tháng đã ổn định thành công mà không cần MV sau khi sinh; trong khi đó, nhiều trẻ cần MV có thể được rút nội khí quản trong vòng vài ngày và phát triển mạnh. Những trẻ sơ sinh vẫn phụ thuộc vào máy thở sau tuần đầu tiên của cuộc đời có nguy cơ mắc chứng loạn sản phế quản phổi (BPD) cao hơn nhiều.
Có nhiều phương thức hỗ trợ hô hấp xâm lấn khác nhau được sử dụng ở trẻ sơ sinh, và cơ chế cai máy thở cụ thể xét trên quy mô lớn là một chức năng của phương thức hỗ trợ đang được sử dụng.
Các loại MV cơ bản gồm có: (1) Thông khi kiểm soát áp lực, (2) thông khí kiểm soát thể tích hoặc mục tiêu thể tích, và (3) thông khí tần số cao Quá trình cai máy thở cơ bản đối với các chế độ đồng bộ có kiểm soát áp lực khác nhau được mô tả ở Chương 20; các bước cơ bản để thông khí kiểm soát áp lực và HFV được tóm tắt trong Bảng 26.1. Phần thảo luận chi tiết về cai máy. thở, sử dụng thông khí mục tiêu thể tích có trong Chương 22. Dữ liệu có sẵn ủng hộ việc ưu tiên sử dụng: (1) Bất kỳ chế độ thông khí đồng bộ nào thay vì thông khí bắt buộc ngắt quãng (IMV) không đồng bộ, (2) chế độ hỗ trợ từng nhịp thở tự phát qua IMV đồng bộ hóa (SIMV), và (3) nhắm mục tiêu thể tích qua thông khí có kiểm soát áp lực. (HFV).
Sau đây là một số khái niệm quan trọng cần ghi nhớ, nhằm tạo điều kiện thuận lợi cho quá trình cai máy thở:
- Cai máy thở quá chậm có thể nguy hiểm hơn so với cai máy thở quá nhanh, vì nó có thể gây tổn thương phổi quá mức và giảm CO2 máu.
- Cần cố gắng cai máy thở trong ngày, không cai trong các ca trực.
- Khi quá trình trao đổi khí đạt yêu cầu và công hô hấp không quá mức, nên tiến hành cai máy thở.
- Thông khí mục tiêu thể tích giải quyết hiệu quả các khái niệm từ (1) đến (3) bằng cách giảm áp lực trong thời gian thực để cải thiện cơ học phổi và nỗ lực của bệnh nhân.
Các cài đặt thông khí để xem xét sự sẵn sàng rút nội khí quản ở trẻ từ 2 tuần tuổi trở xuống được trình bày ở Hộp 26.2. Những yếu tố này phản ánh sự đồng thuận chung và dựa trên các giá trị được dùng làm tiêu chuẩn rút nội khi quản trong nhiều thử nghiệm ngẫu nhiên có đối chứng (RCT), nhưng không dựa trên dữ liệu cứng. Trẻ sơ sinh lớn hơn, trưởng thành hơn thường có thể được rút nội khí quản từ các thông số cao hơn.
| Bảng 26.1 Các chiến lược cai máy thở cơ bản với chế độ kiểm soát áp lực và thông khí tần số cao (HFV) | |||
| Kết quả mong muốn | Tác động: SIMV | Tác động: AC hoặc PSV | Tác động: HFV |
| ↑ PaCO2 | ↓ PIP, tần số | ↓ PIP | ↓ Amplitude |
| ↓ PaO2 | ↓ FiO2, PEEP | ↓ FiO2, PEEP | ↓ FiO2, MAP |
AC trợ giúp-kiểm soát, FiO2′ nồng độ oxy trong khi hít vào, HFV, thông khi tần số cao, MAP, áp lực đường thở trung bình; PEEP áp lực dương cuối thì thở ra. PIP, áp lực bơm phòng đình; PSV, thông khi hỗ trợ áp lực, SIMV, thông khi bắt buộc ngắt quang đồng bộ.
| Hộp 26.2 Các cài đặt máy thở tại thời điểm rút ống nên cân nhắc cho trẻ sơ sinh từ 2 tuần tuổi trở xuống |
Thông khí thông thường (AC, SIMV, PSV)
Thông khi mục tiêu thể tích (VTV) (thể tích khí lưu thông được đo ở ống nội khí quản)
Thông khí dao động tần số cao (HFOV)
Thông khi phản lực tần số cao (HFIV)
|
Trẻ lớn hơn có thể được rút nói khi quân khi có áp lực hoặc thể tích khi lưu thông cao hơn. Chỉ nên rút nội khí quản nếu bệnh nhân không xuất hiện tình trạng khó thở nhanh hoặc tầng công thở.
AC, trợ giúp-kiểm soát; BW, trọng lượng sơ sinh, MAP, áp lực đường thủ trung bình, FiO2′ nồng độ oxy trong khi hít vào, PEEP, áp lực dương cuối thì thò ra; PIP ap luc bom phòng đình; PSV, thông khí hỗ trợ áp lực, SIMV, thông khi bắt buộc ngắt quãng đồng bộ.
Cai máy thở trên thông khí kiểm soát lực
Với SIMV, quá trình cai máy thở được hoàn thành bằng cách giảm cả áp lực bơm phóng đinh (peak inflation pressure – PIP) lẫn tần số thở máy. Không nên giảm mạnh tần số cho đến khi PIP giảm xuống giá trị tương đối thấp (20 cm H,O), điều này cho thầy độ giãn nở của phối được cải thiện. Sự thay đổi PIP không chỉ nên được hướng dẫn bởi các giá trị khí máu, mà còn dựa trên việc theo dõi thể tích khi lưu thông (V,) thở ra, miễn là nó được đo chính xác tại cửa đường thở. Giảm tần số SIMV trong khi độ giãn nở của phổi vẫn còn thấp có khả năng gây ra nhịp thở cao và dẫn đến thở nhanh nông tự phát, điều này không hiệu quả, đòi hỏi PIP cao (và do đó V, quá lớn) đối với nhịp bơm phóng của SIMV tần số thấp, nhằm duy trì thông khí phút phế nang đầy đủ. Ở trẻ non tháng nhỏ, nên bổ sung thêm hỗ trợ áp lực (PS) khi tần số SIMV giảm xuống dưới 30 lần/phút. Trong một nghiên cứu, việc kết hợp SIMV + PS giúp cai máy thở nhanh hơn nhờ hỗ trợ hô hấp cơ học so với SIMV đơn thuần ở trẻ sơ sinh cực nhẹ cân (extremely low birth weight – ELBW) và giảm đáng kể công thở. Nếu sử dụng SIMV mà không có PS, thì không nên giảm tần số xuống dưới mức 15 bơm phồng mỗi phút. Không có nghiên cứu nào công bố phương pháp cai máy thở tốt nhất từ SIMV + PS. Có vẻ hợp lý khi giảm dần tần số SIMV xuống 10, đồng thời giảm PIP khi cần để tránh V, quá mức và duy trì PS ở mức vừa đủ để đạt được V. chấp nhận được đối với nhịp thở tự phát, thường là 4 đến 5 mL/kg.
Với thông khí trợ giúp-kiểm soát (AC) và PS ở chế độ độc lập, mỗi nhịp thở tự phát được hỗ trợ, nhưng trẻ sơ sinh kiểm soát tần số thở (cũng như thời gian hít vào trong trường hợp PS). Do đó, việc giảm tần số cài đặt, yếu tố chỉ đóng vai trò dự phòng trong trường hợp ngưng thở, không gây tác động thực sự lên việc giảm hỗ trợ máy thở. Việc cai máy thở được hoàn thành bằng cách hạ thấp mức PIP hoặc PS và chuyển dần công thở cho trẻ sơ sinh. Trong một khoảng thời gian ngắn vài giờ ngay trước khi rút nội khí quản, việc giảm tần số dự phòng xuống 20 bơm phồng/phút có thể hợp lý, giúp nhận biết rõ hơn bất kỳ nỗ lực hô hấp nào có thể đã bị che giấu bởi tần số dự phòng thông thường. AC với tư cách là một chế độ cai máy thở đã được nghiên cứu nghiêm túc hơn so với PS, với bằng chứng cho thấy chế độ này cung cấp thể tích khí lưu thông đồng nhất hơn, giảm công thở và rút ngắn thời gian cai máy thở so với SIMV. Dữ liệu gần đây cũng cho thấy rằng: AC có thể dẫn đến công thở thấp hơn so wi SIMV + PS, đặc biệt là ở những bệnh nhân non nớt nhất. Mặc dù thông khí P5 có thể đem lại những lợi ích tương tự như AC, nhưng có rất ít bằng chứng để hướng dẫn sử dụng chế độ này trong giai đoạn cai máy thở. Trên thực tế, ở những trẻ sinh non nhỏ nhất với hằng số thời gian rất ngắn, tần số hô hấp vốn nhanh, thời gian hit vào ngắn về mặt lý thuyết có thể dẫn đến áp lực đường thở trung bình thấp hơn (MAP) và mất huy động phối.
Cai máy thở trên thông khí tần số cao (HFV)
Nhiều bác sĩ lâm sàng cảm thấy thoải mái hơn khi thay đổi từ HFV sang các chế độ thông thường trước khi rút nội khí quản, với tiến để rằng có thể hình dung rõ hơn trung khu hô hấp và kiểu thở của trẻ sơ sinh. Mặc dù đã nói vậy, nhưng rút nội khí quản trực tiếp từ cả thông khí phản lực lẫn thông khí dao động không chỉ được chứng minh là khả thi, mà còn có thể thực sự đáng mong đợi. Clark và cộng sự báo cáo rằng: Trẻ sơ sinh vẫn được thở máy dao động tấn số cao (HFOV) cho đến khi rút nội khí quản có tỷ lệ BPD thấp hơn so với trẻ thở máy thông thường, nhưng trẻ sơ sinh được đổi sang áp dụng SIMV sau 72 giờ dùng HFOV dường như không được hưởng lợi như nhau. Tương tự, thử nghiệm HFOV lớn của Courtney và cộng sự, trong đó yêu cầu trẻ phải duy trì HFOV trong 14 ngày hoặc cho đến khi rút nội khí quản, báo cáo rằng tỷ lệ BPD thấp hơn và thời gian thở máy ngắn hơn so với thông khí thông thường. Trong khi đó, một nghiên cứu so sánh được công bố trên cùng số báo New England Journal of Medicine (Tạp chí Y học New England), cho phép chuyển đổi sớm từ HFOV sang thông khi thông thường, lại không cho thấy lợi ích nào như vậy. Cách giảm hỗ trợ HFOV được dựa trên dữ liệu và kinh nghiệm thực nghiệm, với không nhiều bằng chứng thực nghiệm để hướng dẫn bác sĩ lâm sàng. Với các chế độ HFOV truyền thống, cả biên độ áp lực lẫn MAP đều giảm dần khi dung nạp được, trước là giảm thông khí phút, sau là tránh giãn nở quá mức khi độ giãn nở của phổi và oxygen hóa được cải thiện. Tuy nhiên, khi sử dụng HFOV với đảm bảo thể tích, chỉ cần cai MAP vì biên độ áp lực sẽ tự động giảm (xem Chương 24 để biết thêm thông tin chi tiết). Không có ý kiến đóng thuận rõ ràng về cài đặt “rút nội khí quản trong HFOV nhưng nhìn chung, cần xem xét rút nội khí quản khi MAP ở mức 8 cm H O trở xuống, với FiO, từ 30% trở xuống. Không nên giảm tần số xuống như một phương tiện để giảm hồ trợ trong khi HFOV, bởi vì VT được phân phối tăng lên khi tần số giảm trong HFOV, do đó việc giảm tần số máy thở có tác dụng ngược lại so với khi thờ máy thông thường. Một số bác sĩ lâm sàng tăng tần số HFOV như một cách giảm VT gián tiếp, nhưng hưởng tiếp cận làm cho quá trình thông khí kém hiệu quả hơn này có vẻ lạ thường và không có băng chứng ủng hộ cụ thể. Tuy nhiên, khi sử dụng HFOV + đảm bảo thể tích, sự thay đổi tần số có tác dụng tương tự như với thông khí thông thường, vì VT được giữ không đổi.
Cai máy thở khi thông khí phản lực tần số cao (HFJV) gần giống với phương pháp thở máy thông thường hơn, trong đó áp lực đình và áp lực trung binh giảm dần. Phương tiện chính để giảm hỗ trợ là thông qua giảm biên độ áp lực, tức độ chênh giữa PIP và áp lực dương cuối thì thở ra (PEEP). Với cả thông khí phản lực lẫn thông khí dao động, khi quá trình hỗ trợ được giảm xuống đủ để cho phép nhiễm toan hô hấp nhẹ thì sẽ quan sát được nhịp thở tự phát khi trẻ bắt đầu tiếp nhận nhiều nỗ lực hô hấp hơn. Khi có nỗ lực tự phát tốt và các cài đặt được đánh giá là đủ thấp, nên thử rút nội khí quản.
Chiến lược chung để dễ dàng cai máy thở
Tăng CO2 máu cho phép
Tăng CO2 máu cho phép (permissive hypercarbia) là một chiến lược thông khi chấp nhận mức PaCO2 cao hơn bình thường (từ 45 đến 65 mm Hg), miễn là pH từ 7,20 trở lên, đồng thời sử dụng tần số và/hoặc VT thấp hơn. Chiến lược này có thể làm giảm tổn thương cho phổi đang phát triển thông qua nhiều cơ chế, bao gồm: Loại bỏ CO2 hiệu quả hơn, sự phù hợp thông khí-tưới máu tốt hơn, ổn định (hoặc tăng) trung khu hô hấp và cải thiện cung lượng tim. Tăng CO2 máu cho phép dường như là một chiến lược hiệu quả, cho phép tiếp tục sử dụng các biện pháp hỗ trợ không xâm lấn và tránh MV. Cách tiếp cận này, mặc dù đã được thực hành rộng rãi, nhưng thực tế đã không được đánh giá trực tiếp như một biện pháp can thiệp riêng lẻ trong các thử nghiệm ngẫu nhiên. Tuy vậy, cách tiếp cận này thường được chấp nhận là phù hợp và là một phân quan trọng của một số thử nghiệm lớn so sánh các chiến lược xử trí tại phòng sinh khác nhau. Hiện vẫn chưa rõ liệu việc tăng CO2 máu cho phép có hiệu quả trong việc cai máy thở hay không. Mariani và cộng sự đã chỉ ra rằng Trong một thử nghiệm thí điểm ngẫu nhiên đơn trung tâm, khi tiến hành so sanh PaCO2 mục tiêu ở mức 35 đến 45 mm Hg với PaCO2 mục tiêu ở mức 45 đến 55 mm Hg trong 96 giờ đầu tiên của cuộc đời, thời lượng MV ngắn hơn, và BPD có xu hướng giảm. Một thử nghiệm đa trung tâm tiếp theo nhằm tới một mức độ tăng CO2 máu cao hơn đã không thể tái lập những kết quả nghiên cứu này, có thể bởi vì khác với nghiên cứu thí điểm, không thể đạt được sự tách biệt rõ ràng giữa hai nhánh.
Thử nghiệm lớn nhất kết hợp tăng CO2 máu cho phép như một phần của chiến lược tránh MV, đẩy nhanh rút nội khí quản trước và trong 14 ngày đầu tiên của MV là Thử nghiệm ngẫu nhiên với surfactant, áp lực dương và oxygen hóa (Surfactant, Positive Pressure, and Oxygenation Randomized Trial – SUPPORT). Nghiên cứu so sánh một chiến lược đặt nội khí quản và sử dụng surfactant thông thường để áp dụng chủ yếu hỗ trợ không xâm lấn trong phòng sinh cùng với tăng CO2 máu cho phép. PCO2 mục tiêu vượt quá mức 65 mm Hg với pH trên 7,20 ở nhóm được chỉ định hỗ trợ không xâm lấn; trong khi đó, PCO2 mục tiêu ở dưới mức 50 mm Hg với pH trên 7,30 ở nhóm đặt nội khí quản thường quy. Mặc dù không tìm thấy sự khác biệt về kết cục chính của BPD/tử vong, song các phân tích phân nhóm và nhóm phụ cho thấy rằng: Tỷ lệ tử vong ở trẻ có tuổi thai (GA) từ 24 đến 25 tuần giảm, tỷ lệ bổ sung MV và surfactant thấp hơn, thời gian MV ngắn hơn và ít sử dụng corticosteroid sau khi sinh hơn cho BPD trong nhóm hỗ trợ không xâm lấn. Tuy nhiên, một phân tích thứ cấp về dữ liệu từ SUPPORT đã báo cáo về nguy cơ gia tăng các kết quả bất lợi, bao gốm xuất huyết não thất (intraventricular hemorrhage – IVH) nặng và tử vong, với cả mức PaCO2 cao lẫn PaCO2 dao động lên xuống. Một thử nghiệm đơn trung tâm chỉ tập trung vào tăng CD, máu cho phép đã tuyển chọn 65 trẻ sơ sinh từ 23 đến 28 tuần tuổi thai nhận MV trong vòng 6 giờ sau sinh. Trẻ sơ sinh được chọn ngẫu nhiên để đạt được mục tiêu PaCO2 là 55 đến 65 mm Hg, hoặc 15 đến 45 mm Hg trong tuần đầu tiên của cuộc đời. Thử nghiệm đã bị dừng lại sớm sau khi thu nhận khoảng một phần ba cỡ mầu. dự kiến, vì kết quả nghiên cứu liên quan đến tăng CO. máu cho phép có liên quan đến xu hướng tử vong cao hơn và tỷ lệ suy giảm phát triển thần kinh cao hơn, với kết quả tổng hợp gia tăng đáng kể là suy giảm tâm thần hoặc tử vong
Tỉnh đến thời điểm viết bài này, thử nghiệm ngẫu nhiên gần đây nhất về chủ đề trên là thử nghiệm Tăng CO2 cho phép ở trẻ sơ sinh cực kỳ nhẹ cần (Permissive Hypercapnia in Extremely Low Birthweight Infants – PHELBI), so sánh tăng CO2 máu với các mục tiêu PCO2 truyền thống hơn. Nhóm mục tiêu cao nhằm đến các giá trị PaCO2 từ 55 đến 65 mm Hg vào các ngày sau sinh 1 đến 3, 60 đến 70 mm Hg vào các ngày 4 đến 6, và 65 đến 75 mm Hg vào các ngày 7 đến 14; nhóm đối chứng nhắm đến các giá trị PaCO2 từ 40 đến 50 mm Hg vào ngày 1 đến ngày 3, 45 đến 55 mm Hg vào ngày 4 đến ngày 6, và 50 đến 60 mm Hg vào ngày 7 đến ngày 14. Thử nghiệm đã được dừng lại sau khi từ phân tích tạm thời cho thấy rõ rằng xác suất lợi ích từ sự can thiệp là rất nhỏ. Cuối cùng, 359 trẻ sơ sinh có trọng lượng sơ sinh từ 400 đến 1.000 g đã được phân tích. Tỷ lệ kết quả tổng hợp của BPD hoặc tử vong ở nhóm tăng CO2 máu so với nhóm đối chứng (36% so với 30%; P = 0,18), tử vong (14% so với 11%; P = 0,32), và độ III đến IV IVH (15% so với 12%; P = 0,30) cho thấy các xu hướng không nghiêm trọng có lợi cho nhóm đối chứng. Ngoài ra, không có sự khác biệt giữa các nhóm về thời gian cai máy thở. Cũng như các thử nghiệm ngẫu nhiên trước đó, PaCO2 ở nhóm tăng CO2 máu, mặc dù cao hơn so với nhóm đối chứng nhưng nhìn chung vẫn thấp hơn phạm vi mục tiêu, bất chấp thực tế là trẻ sơ sinh được cài đặt máy thở thấp hơn đáng kể để đạt được các mục tiêu đó. Điều này làm nổi bật hạn chế thực tế của việc nhắm vào tình trạng nhiễm toan hô hấp nghiêm trọng ở trẻ sơ sinh không được an thần nặng hoặc liệt cơ; trung khu hô hấp của chính trẻ sẽ gây ra tăng nỗ lực hô hấp tự phát, có thể làm giảm PaCO2 xuống dưới phạm vi mục tiêu, đồng thời gây ra thở nhanh, rút lõm ngực và có thể kích động cần dùng thuốc an thần. Bởi vì trẻ sinh non có sức mạnh và sức bền cơ bắp hạn chế, nên nỗ lực bình thường hóa độ pH của chúng thường không liên tục, dẫn đến sự biến đổi lớn về PCO2 được chứng minh là một yếu tố dự báo chính xác tình trạng IVH nặng. Do đã kết hợp các kết quả của thử nghiệm PHELBI với các nghiên cứu quan sát cho thấy rằng: Giá trị PaCO2 trên 60 đến 65 mm Hg trong vài ngày đầu tiên của cuộc đời có liên quan đến tăng nguy cơ IVH nghiêm trọng (đặc biệt là khi các thay đổi xảy ra nhanh); có vẻ như việc nhằm mục tiêu tăng CO2 máu cho nhép rõ rệt không có lợi và trên thực tế có thể gây hại. Thay vào đó, tăng CO2 máu cho phép ở mức độ nhẹ tương tự như nhánh kiểm soát của thử nghiệm PHELBI được dựa trên các nguyên tắc sinh lý học lành mạnh và thường được chấp nhận là an toàn, có thể giúp giảm nhu cầu (và thời gian) MV hiệu quả.
Giảm oxy máu cho phép
Các mục tiêu oxy hóa ít tích cực hơn đã được đưa vào chăm sóc sơ sinh mà không có lợi ích của các thử nghiệm ngẫu nhiên lớn, nhằm nỗ lực giảm stress oxy hóa cũng như các tác động có hại lên phổi và các cơ quan khác. Các nghiên cứu quan sát ban đầu gợi ý rằng: Mục tiêu bão hòa oxy thấp hơn có liên quan đến ít bệnh võng mạc do sinh non hơn, ít bệnh phổi mãn tính hơn và cai máy thở nhanh hơn. Một loạt các nghiên cứu đang cố gắng xác định độ bão hòa mục tiêu tối ưu được đo bằng phép đo độ bão hòa oxy mạch này (SpO2) đã đặt ra nghi vấn về tính an toàn của phương pháp tiếp cận giảm oxy máu cho phép này. Năm thử nghiệm với thiết kế tương tự và kết quả tổng hợp được xác định trước về tử vong/tàn tật ở thời điểm GA điều chỉnh từ 18 đến 24 tháng đã được thực hiện, nhằm so sánh hai phạm vi bão hòa oxy khác nhau (cao, 91%–95% và thấp, 85%–89%). Một phân tích gộp theo kế hoạch khách quan về dữ liệu bệnh nhân riêng lẻ từ 4.965 trẻ dưới 28 tuần tuổi thai tham gia vào các thử nghiệm này đã được hoàn thành và công bố gần đây. Mặc dù trẻ được phần ngẫu nhiên vào nhóm mục tiêu độ bão hòa oxy thấp có giảm nguy cơ tương đối (relative risk – RR) của bệnh lý võng mạc do sinh non (RR 0,74 [95% khoảng tin cậy (CI) 0,63–0,86)) và bổ sung oxy ở tuổi 36 tuần sau kỳ kinh cuối (RR 0,81 (95% CI 0,74–0,90]), song điều này xảy ra thì phải đánh đối với việc gia tăng nguy cơ tử vong (RR 1,17 [95% CI 1,04–1,31]) và viêm ruột hoại tử nặng (RR 1,33 [95% CI 1,10–1,61]) so với nhóm mục tiêu bão hòa oxy cao. Mặc dù vẫn còn nhiều câu hỏi chưa được giải đáp, song nhờ kết quả của nỗ lực mạnh mẽ trên mà người ta đã đưa ra gợi ý rằng: Nên nâng mục tiêu SpO lên từ 91% đến 95% ở trẻ có GA dưới 28 tuần cho đến 36 tuần tuổi sau khi kỳ kinh cuối. Do đó, giảm oxy máu cho phép dường như không phải là một chiến lược phù hợp để đẩy nhanh quá trình cai máy thở.
Quy trình cai máy
Sự sẵn có của nhiều loại máy thở và chế độ thở, kết hợp với sự đa dạng về nên tảng đào tạo của các bác sĩ sơ sinh, đã góp phần tạo nên các phương pháp tiếp cận khác nhau trong cùng một trung tâm và giữa các trung tâm. Sự thay đổi như vậy không chỉ gây hại cho bệnh nhân (và gia đình bệnh nhân), mà còn gây hại cho các nhà cung cấp dịch vụ chăm sóc sức khỏe, các học viên và nơi làm việc nói chung. Một giải pháp để hài hòa các phương pháp thực hành, đồng thời giảm tải những thay đổi không cần thiết là phát triển và thực hiện các quy trình thông khí do bác sĩ lâm sàng, y tá và/hoặc nhà trị liệu hô hấp kiểm soát. Ở người lớn, việc sử dụng chế độ cai máy thở theo phác đồ đã được chứng minh là có thể đẩy nhanh quá trình cai máy thở, giảm tổng thể thời gian MV và giảm chi phí. Tương tự, một số thử nghiệm liên quan đến bệnh nhân trong cơ sở chăm sóc đặc biệt dành cho trẻ em đã chỉ ra những lợi ích của việc cai máy thở theo phác đồ. Ngược lại, mặc dù không có RCT lớn nào đánh giá tính hữu ích của các phương pháp cai máy thở đối với trẻ sơ sinh, song đã có một số bằng chứng ủng hộ các quy trình cai máy thở hiện sẵn. Trong một nghiên cứu hồi cứu, Hermeto và cộng sự đã chứng minh sự suy giảm đáng kể thời gian cai máy thở và thời gian MV ở trẻ sinh non (cân nặng sơ sinh ≤ 1.250 g) sau khi thực hiện một phác đồ điều trị bằng liệu pháp hô hấp. Ngoài ra, một RCT nhỏ triển khai năm 2002 cho thấy: Các y tá giàu kinh nghiệm tại đơn vị chăm sóc đặc biệt dành cho trẻ sơ sinh (NICU) đã cai máy thở cho trẻ hiệu quả hơn so với các bác sĩ được đào tạo bài bản, từ đó gợi ý một hướng đi tiềm năng khác để phát triển các quy trình tạo điều kiện thuận lợi cho việc cai máy thở. Vì vậy, mặc dù thiếu bằng chứng chắc chắn, song các quy trình cai máy thở dường như đóng góp một vai trò có lợi cho trẻ sinh non. Trên thực tế, đã có 30% đến 40% NICU trên khắp thế giới áp dụng các quy trình cai máy thở tại các đơn vị tương ứng của họ.
Liệu pháp phụ trợ
Các liệu pháp phụ trợ là những can thiệp được thiết kế để giúp trẻ sinh non duy trị quá trình trao đổi khí cũng như nỗ lực bộ hấp đầy đủ trong suốt thời kỳ cai máy thở và sau khi rút nội khí quản. Một vài trong số những liệu pháp này đã được nghiên cứu bởi các RCT lớn; trong khi đó, hiện vẫn chưa có bằng chứng rõ ràng ủng hộ hoặc bác bỏ việc sử dụng những liệu pháp còn lại. Độc giả có thể tham khảo nội dung thảo luận đầy đủ hơn về các liệu pháp dùng thuốc ở Chương 32 trong ấn bản gốc của cuốn sách này.
Caffeine
Khi cho trẻ nhận MV uống caffeine, việc cai máy thở diễn ra nhanh hơn, cả thời gian MV lẫn BPD đều giảm, đồng thời kết quả phát triển thần kinh được cải thiện ở trẻ từ 18 đến 22 tháng tuổi. Liều lượng thích hợp nhất vẫn chưa được xác định rõ và rất khác nhau giữa các trung tâm, nhưng thử nghiệm lớn Caffeine đối với ngưng thở trẻ sinh non (Caffeine for Apnea of Prematurity – CAP) đã sử dụng liều nạp caffeine citrate là 20 mg/kg, sau đó là liều duy trì 5 mg/kg/ngày mỗi ngày một lần (với khả năng tăng liều lên 10 mg/kg/ngày, nếu vẫn còn ngưng thở). Ngoài ra, độ tuổi thích hợp nhất để bắt đầu sử dụng caffein ở trẻ thở máy cũng chưa được thiết lập rõ ràng. Mặc dù một số trung tâm chỉ thích bắt đầu sử dụng caffein xung quanh khoảng thời gian rút nội khí quản, nhưng ngày càng nhiều bác sĩ lâm sàng muốn bắt đầu dùng thuốc này ngay sau khi sinh. Sở dĩ như vậy là vì bằng chứng từ các nghiên cứu thuần tập hối cứu cho thấy dùng caffeine sớm có thể liên quan đến thời gian MV ngắn hơn và cải thiện kết quả lâu dài. Tuy nhiên, một thử nghiệm gần đây đã giải quyết câu hỏi này bằng cách đánh giá tác động của caffeine sớm đối với thời gian cai máy thở ở trẻ sinh non cần MV. Trẻ sơ sinh được phân nhóm ngẫu nhiên để nhận caffein sớm hoặc giả dược trong 5 ngày đầu đời, và nhóm dùng giả được sau đó nhận một liểu caffein mù trước khi rút nội khí quản. Do phản tích tạm thời ở 75% trẻ ghi danh cho thấy xu hướng gia tăng tỷ lệ tử vong ở nhóm dùng caffein sớm (P = 0,22), nên chỉ có 83 trong số 110 trẻ sinh non dự định được đăng ký. Việc bắt đầu sử dụng caffein sớm không làm giảm thời gian cai máy thở hoặc tổng thời gian MV, không ảnh hưởng đến tỷ lệ BPD, và có liên quan đến xu hướng không có ý nghĩa đối với việc tăng tỷ lệ tử vong trước. khi xuất viện, nhưng không có sự khác biệt về kết quả tổng hợp của BPD nặng hoặc tử vong. Thống kê không đủ sức thuyết phục và một số vấn đề mất cần bảng cơ bản trong nghiên cứu này đã ngăn cản các kết luận có tính xác thực, nhưng nghiên cứu cho thấy rằng cần hết sức thận trọng khi bắt đầu sử dụng. caffein sớm ở trẻ sơ sinh thở máy.
Thuốc lợi tiểu
Nhập nhiều dịch và giảm cân hạn chế trong 10 ngày đầu sau sinh có liên quan đến tăng nguy cơ tử vong hoặc BPD ở trẻ sinh non. Một phân tích gộp về đối tượng này kết luận rằng: Lượng nước hạn chế làm giảm nguy cơ còn ống động mạch (patent ductus arteriosus – PDA) và viêm ruột hoại tử với xu hướng giảm nguy cơ BPD, xuất huyết nội sọ và tử vong. Những phát hiện này hẳn nhiên khiến các bác sĩ lâm sàng phải xem xét các liệu pháp giúp giải quyết tình trạng quá tải dịch như một phương thức cải thiện chức năng phổi và giảm nhu cấu hỗ trợ hô hấp. Tuy nhiên, thuốc lợi tiểu đã được chứng minh là vô hiệu trong điều trị giai đoạn cấp tính của hội chứng suy hô hấp (RDS), mặc dù bệnh có liên quan rõ ràng với tình trạng giữ nước. Furosemide là thuốc lợi tiểu được sử dụng phổ biến nhất ở trẻ sơ sinh. Furosemide làm giảm nước mô kẽ phối và cải thiện cơ học phổi trong thời gian ngắn, do đó thường được sử dụng ở trẻ sơ sinh khó cai máy thở, đặc biệt là khi có bằng chứng về quá tải dịch. Tuy nhiên, điều quan trọng là phải thừa nhận thực trạng thiếu bằng chứng khách quan về hiệu quả của nó trong cấp tính và lâu dài. Trong một phân tích thứ cấp từ một nghiên cứu quan sát tiền cứu đa trung tâm (Chương trình Sinh non và Kết quả Hô hấp (Prematurity and Respiratory Outcomes Program – PROP]), trẻ sơ sinh cực non bắt đầu dùng loại thuốc lợi tiểu bất kỳ có xác suất cần đến mức hỗ trợ hô hấp cao hơn đáng kể so với trẻ sơ sinh không tiếp xúc trong 7 ngày đầu sau khi bắt đầu dùng thuốc. Do bản chất không được ngẫu nhiên hóa của can thiệp, có thể nhận thức rằng nhu cầu bắt đầu điều trị bằng thuốc lợi tiểu là một dấu hiệu cho thấy tình trạng bệnh nặng hơn. Ngược lại, một nghiên cứu thuần tập hồi cứu gần đây trên gần 40.000 trẻ sinh non cho thấy mối liên quan giữa việc tiếp xúc nhiều hơn với furosemide và giảm nguy cơ BPD. Tuy nhiên, vẫn thu có RCT nào đánh giá tác động của thuốc lợi tiểu quai đối với việc cai máy. nhà cùng cán lưu ý rằng, furosemide kích thích thận tổng hợp prostaglandin Em một chất làm giãn mạnh ông động mạch, do đó nên sử dụng thận trọng trong những ngày đầu sau sinh.
Đóng ống động mạch
Doing máu từ trái sang phải đi qua PDA rộng có thể gây phủ phổi và giảm độ gần nở của phổi. PDA từ trung bình đến lớn có liên quan đến tình trạng gia tăng tỷ lệ tử vong và bệnh tật (bao gồm cả BPD) ở trẻ sinh non cần MV kéo dài trong đó khó cai máy thở thường được cho là do “PDA quan trọng về mặt huyết động”. Mặc dù điều trị PDA tích cực (thuốc và/hoặc phẫu thuật) được sử dụng thường xuyên như một phương tiện tạo điều kiện thuận lợi cho việc cai máy, song cách thực hành như vậy ngày càng bị nghi vấn, sau khi một số phần tích RCT riêng lẻ và phân tích gộp cho thấy rằng điều trị PDA dự phòng hoặc chọn lọc không có tác động đối với việc ngăn ngừa BPD. Thực tế là, đóng PDA cả nội khoa lẫn phẫu thuật đều có những rủi ro liên quan đáng kể, đó là việc đóng PDA tự phát thường xảy ra mà không cần can thiệp, trong khi các phân tích gộp không tìm thấy sự khác biệt về tỷ lệ tử vong hoặc bệnh tật trong các RCT so sánh xử trí PDA tích cực và bảo tồn, tất cả đều ủng hộ thêm cho một cách tiếp cận thận trọng hơn. Một nhóm trẻ sinh non có nguy cơ được chọn lọc có thể sẽ được hưởng lợi từ điều trị PDA để tạo điều kiện cho việc cai máy thở; không may là, việc xác định và nhắm mục tiêu chính xác những trẻ này vẫn còn là một vấn đề chưa được giải quyết.
Tránh dùng thuốc an thần thường quy
Ở trẻ sinh non, hiện chưa có đủ bằng chứng khoa học để khuyến cáo sử dụng thường quy thuốc gây nghiện ở trẻ sơ sinh được điều trị MV. Trong thử nghiệm ngẫu nhiên đa trung tâm lớn nhất thuộc loại này, việc sử dụng morphin tiềm ngắt quãng có liên quan độc lập với việc tăng tỷ lệ IVH và rò rỉ khi, cũng như kéo dài thêm thời gian MV, CPAP qua mũi và liệu pháp oxy. Trong một nghiên cứu quan sát khác, việc sử dụng morphin cho trước, hoặc không áp dụng các biện pháp giảm đau cụ thể cho từng bệnh nhân có liên quan đến việc kéo dài thời gian điều trị bằng MV và nhập viện. Trong nghiên cứu đó, việc thực hiện một quy trình thoải mái theo hướng điều dưỡng kiểm soát đã làm giảm đáng kể kiểu sử dụng morphin không tiêu chuẩn này. Ngoài ra, việc sử dụng. morphin cho trẻ sinh non được thở máy có liên quan đến những thay đổi hành vì thân kinh tinh vi trong thời thơ ấu. Do đó, không thể khuyến cáo sử dụng. morphin giảm đau/an thần thường quy, vì rõ ràng nó làm giảm khả năng cái hỗ trợ hô hấp và có thể gây hại lâu dài. Ở bệnh nhân không đủ liệu pháp điều trị bằng thuốc, một giải pháp thay thế hấp dẫn là dexmedetomidine, một chất chủ vận thụ thể adrenergic alpha-2 chọn lọc cao, có cả tác dụng giảm đau lần an thần. Mặc dù dexmedetomidine dường như không ảnh hưởng đến trung khu hô hấp và không kéo dài MV so với opioid, song dữ liệu an toàn lâu dài vẫn còn thiếu. Do đó, cũng nên tránh sử dụng dexmedetomidine thường quy.
Hỗ trợ dinh dưỡng
Hỗ trợ dinh dưỡng đầy đủ đóng vai trò rất quan trọng đối với bất kỳ bệnh nhân nào được chăm sóc đặc biệt. Dinh dưỡng có mối quan hệ phụ thuộc lẫn nhau với sự tăng trưởng và phát triển của phổi, đồng thời đóng một vai trò quan trọng trong việc phòng ngừa và xử trí BPD. Hầu hết trẻ sinh non mắc BPD mức độ trung bình hoặc nặng đều bị suy giảm tăng trưởng, nguyên nhân chủ yếu là vì lượng dinh dưỡng ở dưới mức tối ưu, do đó có thể làm trầm trọng thêm BPD, ảnh hưởng đến việc sửa chữa và tăng trưởng của phổi. Thật vậy, tỷ lệ hạn chế tăng trưởng ngoài tử cung cao đã được mô tả ở trẻ sinh non bị bệnh nặng. Do đó, nên bắt đầu xử trí dinh dưỡng đầy đủ cho những trẻ này ngay sau khi sinh, nhằm tăng cường khả năng thông khí khi cai máy thở, sửa chữa và tăng trưởng phổi, nhờ vậy cuối cùng có thể giảm thiểu các bệnh về đường hô hấp.
Vật lý trị liệu lồng ngực
Vật lý trị liệu lồng ngực, chẳng hạn như gõ và rung, sau đó là hút, ở trẻ nhận MV đã được đánh giá trong một nghiên cứu tổng quan hệ thống cập nhật vào năm 2008. Tổng cộng ba thử nghiệm với 106 trẻ đã được đưa vào nghiên cứu, trong đó kết quả phân tích xác định không đủ bằng chứng để đánh giá đầy đủ hiệu quả và/hoặc tác dụng phụ của liệu pháp này.
Corticosteroid toàn thân
Phân tích gộp Cochrane được cập nhật gần đây nhất kết luận rằng: Việc sử dụng dexamethasone sớm sau khi sinh (trước 8 ngày tuổi) tạo điều kiện cho việc cai máy thở, giảm nguy cơ mắc BPD ở trẻ sinh non nhưng cũng làm tăng nguy cơ biến chứng ngắn hạn và di chứng thần kinh lâu dài. Ngược lại, dự phòng sớm bằng hydrocortisone liều thấp dường như cải thiện tỷ lệ sống sót không có BPD mà không ảnh hưởng đến kết quả phát triển thần kinh ở trẻ 2 tuổi, nhưng nó cũng làm tăng nguy cơ thủng đường tiêu hóa và nhiễm trùng huyết khởi phát muộn. Dữ liệu về vai trò của dự phòng hydrocortisone khi cai máy thở hiện không có sản. Bằng chứng cho việc sử dụng corticosteroid muộn hơn sau khi sinh (ngoài 7 ngày tuổi) được tóm tắt trong phân tích gộp Cochrane gần đây nhất kết luận rằng: Dexamethasone cũng tạo điều kiện cho trẻ cai máy thở sớm hơn, giảm BPD và giảm tỷ lệ tử vong ở 28 ngày tuổi mà không ảnh hưởng đáng kể đến kết quả phát triển thần kinh lâu dài. Tỷ lệ bại não (cerebral palsy – CP) có xu hướng cao hơn, nhưng điều này được bù trừ bởi xu hướng giảm tỷ lệ tử vong trước khi theo dõi. Năm 2005, một phân tích hồi quy của một số RCT đã chứng minh rằng: Nguy cơ tử vong hoặc CP gây ra bởi dexamethasone sau khi sinh giảm, do nguy cơ dự kiến của BPD tăng. Một bản cập nhật của phân tích này vào năm 2014 cho kết quả không thay đổi khi bổ sung thêm nhiều nghiên cứu, nhưng lại cho thấy khoảng tin cậy (confidence interval – CI) hẹp hơn chút. Dựa trên bằng chứng này, các bác sĩ lâm sàng nên sử dụng các phương trình dự đoán hoặc dữ liệu địa phương của riêng chúng, giúp xác định những trẻ có nguy cơ cao nhất có thể được hưởng lợi ích thực tế từ việc điều trị bằng corticosteroid sau sinh liên quan đến khả năng sống sót mà không có CP Không may là, thời gian và liều dùng dexamethasone tối ưu khi được cung cấp sau tuần đầu tiên của cuộc đời hiện vẫn chưa rõ ràng. Trong một thử nghiệm gần đây, lựa chọn ngẫu nhiên những trẻ có nguy cơ cao từ 27 tuần tuổi trở xuống, yêu cầu cài đặt cao về MV trong khoảng từ ngày 10 đến ngày 21 của cuộc đời đến liệu trình dexamethasone 42 ngày (liểu tích lũy 8 mg/kg) so với các liệu trình 9 ngày lặp lại khi cần thiết (liều tích lũy 2,6 mg/kg/liệu trình), trẻ ở nhóm dùng liều cao được cai máy thở nhanh hơn, có thời gian MV ngắn hơn, cũng như tỷ lệ sống sót nguyên vẹn cao hơn ở 7 tuổi. Nghiên cứu này cũng có quan điểm rằng: Trẻ sơ sinh có nguy cơ cao nhất. bị các biến chứng lâu dài có thể được hưởng lợi một cách có chọn lọc từ tổng liệu và thời gian dùng dexamethasone lớn hơn. Trái ngược với dexamethaso dữ liệu liên quan đến hiệu quả và độ an toàn của hydrocortisone khi được sử dụng sau tuần đầu tiên của cuộc đời hiếm hoi hơn và chỉ mới bắt đầu xuất hiện. Trong thử nghiệm hydrocortisone có hệ thống gần đây để ngăn ngừa loạn sản phế quản phổi ở trẻ sinh non (SToP-BPĐ), hydrocortisone bắt đầu được dùng từ 7 đến 14 ngày sau khi sinh đã tạo điều kiện thuận lợi cho việc rút nổi khí quản, đồng thời có liên quan đến việc giảm đáng kể tỷ lệ tử vong ở tuần thứ 36 nhưng không ảnh hưởng đến kết quả chính của tử vong/BPD ở tuần thứ 36. Việc theo dõi kết quả phát triển thần kinh của nhóm nghiên cứu đang được tiến hành. Ngoài ra, một thử nghiệm ngẫu nhiên lớn khác, thực hiện bởi Mạng lưới Nghiên cứu Trẻ sơ sinh (Neonatal Research Network) thuộc Viện Sức khỏe Trẻ em và Phát triển Con người Quốc gia (National Institute of Child Health and Human Development – NICHD) đã đánh giá tính an toàn và hiệu quả của hydrocortisone được sử dụng từ 14 đến 28 ngày tuổi trong việc hỗ trợ cai máy thở và giảm BPD. Kết quả thử nghiệm cho thấy rằng. Có nhiều trẻ sơ sinh thuộc nhóm dùng hydrocortisone được rút nội khí quản trong quá trình điều trị hơn so với nhóm giả dược, nhưng điều này không làm giảm đáng kể kết cục chính của BPD ở tuần thứ 36. Không có bằng chứng cho thấy tác dụng phụ đối với sự phát triển thần kinh.
Corticosteroid dạng hít
Steroid dạng hít từ lâu đã được sử dụng trong xử trí trẻ sinh non trên MV. Các báo cáo đã công bố cho thấy việc sử dụng steroid dạng hít tương đối cao và hay thay đổi ở trẻ sinh non mắc BPD, mặc dù không có đủ bằng chứng ủng hộ việc sử dụng chúng một cách thường quy, cho dù được dùng để dự phòng hay sau tuần đầu tiên của cuộc đời. Trong thử nghiệm đa trung tâm lớn nhất từ châu Âu (NEUROSIS), 863 trẻ cực non tháng được chọn ngẫu nhiên để hít budesonide hoặc giả dược trong vòng 24 giờ đầu sau sinh. Trẻ sơ sinh nhận được budesonide dạng hít có tỷ lệ đặt lại ống nội khí quản và BPD thấp hơn đáng kể, nhưng tỷ lệ tử vong của chúng cao hơn đảng kể khi theo dõi 2 năm. Dựa trên những kết quả liên quan đến dài hạn, lợi ích phổi ngắn hạn do steroid dạng hít mang lại không thể biện minh cho việc sử dụng thường xuyên chất này để cai máy thở. Việc sử dụng surfactant như một phương tiện để đưa steroid trực tiếp vào khí quản gần đây đã nổi lên như một giải pháp thay thế cho corticosteroid dạng hít và đường toàn thân. Cách thực hành này, được báo cáo lần đầu trong một thử nghiệm thì điểm của Yeh và các đồng nghiệp vào năm 2008, sau đó được tải xác nhận trong một thử nghiệm lớn hơn nhưng vẫn chưa đủ sức thuyết phục vào năm 2016, cho thấy kết quả đẩy hứa hẹn về việc giảm đáng kể thời gian cai máy, BPD và tổng hợp tử vong/BPD. Theo văn bản này, hai RCT đa trung tâm lớn đang được tiến hành, nhằm đánh giá tính an toàn cũng như hiệu quả của việc kết hợp surfactant và budesonide, so với chỉ dùng surfactant, trong việc ngăn ngừa nguy cơ BPD ở trẻ sơ sinh non tháng (thử nghiệm Budesonide ở Trẻ sơ sinh [Budesonide in Babies – BIB], ClinicalTrials.gov Identifier: NCT04545866, và thử nghiệm Phòng ngừa Bệnh phổi, Sử dụng Surfactant + Steroid (Preventing Lung Disease Using Surfactant + Steroid – PLUSS), Cơ quan Đăng ký Thử nghiệm Lâm sàng Úc New Zealand; ACTRN12617000322336).
Đánh giá sẵn sàng rút ống
Không có bằng chứng rõ ràng để hướng dẫn thực hành rút ống. Quyết định rút ống thường dựa trên đánh giá lâm sàng của bác sĩ chịu trách nhiệm, phần lớn dựa vào quá trình đào tạo chuyên môn và kinh nghiệm cá nhân, đồng thời tính đến các yếu tố như: Nhân khẩu học của trẻ sơ sinh (tuổi thai và cân nặng lúc sinh), điều kiện trước khi đặt ống nội khí quản (tuổi sau sinh, cân nặng và bất kỳ bệnh đi kèm nào khác), trao đổi khí (pH và pCO2), và các thông số thông khí (MAP và FiO2). Mặc dù hầu hết các bác sĩ lâm sàng đều cố gắng rút nội khí quản ngay khi trẻ đạt được huyết động ổn định và “cải đặt thông khí tối thiếu”, nhưng nhiều bác sĩ khác lại dựa vào các triết lý khác nhau về thời điểm rút nội khí quản tối ưu. Ví dụ, một số bác sĩ đã áp dụng phương pháp rút nội khí quản ngay sau khi dùng surfactant; trong khi đó, những bác sĩ khác vẫn ủng hộ việc trì hoãn rút nội khí quản cho đến khi trẻ trưởng thành hơn hoặc đạt đến ngưỡng cân nặng cao hơn, bất kể tình trạng lâm sàng của trẻ. Tham chỉ gần đây, một số bác sĩ đã đặt câu hỏi về ý tưởng rút ống nội khí quan trọng vòng 72 giờ đầu tiên sau sinh với tiến để rằng: Một nỗ lực thất bại có thể gây ra bất ổn lâm sàng, do đó làm tăng nguy cơ IVH trong giai đoạn chuyển tiếp sau. sinh mong manh này.
Có thể dự đoán được rằng, những đánh giá chủ quan về mức độ sẵn sàng rút nội khi quản như trên dẫn đến những thay đổi đáng kể trong thực tế, kéo theo đó là kết quả rút nội khí quản rất khác nhau giữa các đơn vị. Tỷ lệ rút nổi khí quản thành công được báo cáo nằm trong khoảng từ 30% đến 70% ở trẻ ELBW, và cao tới 80% đến 86% trong một số nhóm bao gồm trẻ sinh non lớn hơn. Trẻ phát triển không ổn định lâm sàng sau khi rút nội khí quản (ngưng thở nặng, giảm oxy máu và/hoặc tăng CO2 máu) và yêu cầu đặt lại ống nội khi quản đối mặt với nguy cơ và sự khó chịu đáng kể, có thể làm tình trạng hô hấp của trẻ xấu đi vì xẹp phổi. Bản thân việc đặt lại nội khí quản đã là một thách thức về mặt kỹ thuật và có thể đi kèm với các tác dụng nghiêm trọng ngoài ý muốn, bao gồm: Nhịp tim chậm, tăng CO2 máu, thay đổi lưu lượng máu não và oxygen hóa, hạ huyết áp và cần phải ép ngực. Tuy nhiên, cũng cần lưu ý rằng số lượng trẻ sơ sinh bị tụt nội khí quản không chủ ý là tương đối lớn và vẫn được rút nội khí quản thành công sau đó. Những trẻ này có thể đã tiếp xúc với MV và bị tổn thương phổi liên quan đến máy thở lâu hơn mức cần thiết. MV kéo dài rõ ràng là không lành tính; ở khi đấu chó non tháng, MV trong 5 ngày dẫn đến mức độ chấn thương não nhiều hơn so với chỉ 1 ngày thở máy. Dựa trên dữ liệu từ Mạng lưới nghiên cứu Trẻ sơ sinh NICHD, Walsh và cộng sự nhận định rằng: Mỗi tuần bổ sung MV có liên quan đến sự gia tăng đang kể khả năng suy giảm phát triển thần kinh. Những phát hiện đó đã được tái khẳng định trong các nhóm nghiên cứu hiện đại hơn, cho thấy rằng: Việc tiếp xúc với MV kéo dài không chỉ làm tăng tỷ lệ suy giảm phát triển thần kinh ở trẻ 18 đến 24 tháng, mà còn tăng cả tỷ lệ tử vong và một số bệnh tật, bao gồm BPD, tăng áp động mạch phổi, và bệnh võng mạc nặng do sinh non. Ngoài ra, ống nội khí quản hoạt động như một dị vật, nhanh chóng trở thành nơi khu trú và hoạt động như một cánh cổng giúp mầm bệnh xâm nhập, làm tăng nguy cơ viêm phổi do thở máy và nhiễm trùng huyết khởi phát muộn. Rõ ràng, cả với nội khí quản sớm lẫn kéo dài MV không cần thiết đều là những biện pháp không mong muốn. Vì những lý do đó, việc xác định mức độ sẵn sàng rút nội khi quân kịp thời và chính xác là rất quan trọng, giúp giảm thiểu thời lượng MV, đồng thời tối đa hóa cơ hội thành công.
Không may là, có rất ít dữ liệu chất lượng cao đáng chú ý để hướng dẫn bác sẽ làm sàng những cách cai máy thở hỗ trợ hô hấp tối ưu, cũng như đánh giá sự sẵn sàng rút ống nội khí quản của trẻ sơ sinh. Nhiều nỗ lực phát triển các công cụ dự đoán mức độ sẵn sàng rút nội khí quản đã được đánh giá và được xem xét trong phần này.
Chỉ số dự đoán lâm sàng
Trong những năm qua, nhiều nghiên cứu đã cố gắng xác định các dấu hiệu lâm sàng của sự sẵn sàng rút ống nội khí quản ở trẻ sơ sinh non tháng. Trẻ được rút ống nội khí quản thành công có xu hướng có tuổi thai (GA) và cần nặng cao hơn đáng kể (lúc sinh và khi rút ống), ít mắc bệnh phổi nặng hơn trong 24 giờ đâu đời, đồng thời có nhu cầu oxy thấp hơn tại thời điểm rút ống so với trẻ thất bại rút ống. Tuy nhiên, những kết quả này không phải lúc nào cũng nhất quán giữa các nghiên cứu và ngay cả khi chúng có ý nghĩa thống kê, thì vẫn tổn tại sự trùng lặp đáng kể giữa các nhóm thành công và thất bại. Kết quả là, việc xác định ngưỡng giới hạn cho từng biến số lâm sàng trở nên rất khó khăn mà tại đó, kết quả rút nội khí quản có thể được dự đoán chính xác. Tuy nhiên, một số nghiên cứu đã cố gắng phát triển các mô hình dự đoán mức độ sẵn sàng rút nội khí quản bằng cách sử dụng các biến lâm sàng, sử dụng các phương pháp truyền thống như hồi quy logistic đa biển, hoặc phương pháp học máy phức tạp hơn (mạng nơ-ron nhân tạo, phân loại Bayes, cây quyết định và máy vectơ hỗ trợ). Nhìn chung, các mô hình dự đoán này có độ chính xác từ thấp đến trung bình trong việc phân loại kết quả rút nội khí quản khi so sánh với đánh giá lâm sàng đơn thuần, hoặc không bao giờ được xác nhận và nhân rộng trong một nhóm nghiên cứu tiềm năng thứ hai. Đồng thời, những kết quả này còn khẳng định: Việc sử dụng một số biến số lâm sàng để xác định mức độ sản sàng rút nội khí quản không có khả năng bắt chước quá trình ra quyết định phức tạp cần đến đánh giá làm sàng của chuyên gia. Bên cạnh đó, các kết quả nghiên cứu ngụ ý rằng: Chỉ riêng các biến số lâm sàng là không đủ để nắm bắt lý do tại sao trẻ rút nội khí quản thành công hay thất bại. Do đó, việc sử dụng thêm các xét nghiệm dự báo sinh lý và/hoặc lâm sàng, bổ sung cho đánh giá lâm sàng, có vẻ hợp lý khi đánh giá mức độ sẵn sàng rút nội khí quản.
Thử nghiệm độ sẵn sàng rút ống
Các xét nghiệm sẵn sàng rút nội khí quản thường được thực hiện trong một thời gian ngắn với CPAP nội khí quản (endotracheal CPAP – ET CPAP), hoặc hiếm hơn là khi ngắt kết nối tạm thời với máy thở, trong khi bệnh nhân tự thở bằng ống nội khí quản mà không cần máy thở hỗ trợ. Trong thử thách áp đặt này, các thông số sinh lý và/hoặc lâm sàng khác nhau được đo hoặc theo dõi, nhằm đánh giá xem liệu trẻ sơ sinh có thể duy trì nhịp thở thành công sau khi rút nội khí quản mà không cần sự trợ giúp của máy thở hay không. Các thông số sinh lý bao gồm các phép đo khác nhau về cơ học phổi, sức mạnh cơ hô hấp và kiểu thở; trong khi đó, các thông số lâm sàng liên quan đến việc đánh giá bệnh nhân tại giường bệnh để tìm các dấu hiệu bất ổn lâm sàng (ví dụ: ngưng thở, tụt độ bão hòa, nhịp tim chậm, tăng công thở hoặc tăng nhu cầu oxy). Một nghiên cứu tổng quan hệ thống và phân tích gộp gần đây đã mô tả các yếu tố dự báo mức độ sẵn sàng rút ống được đánh giá ở trẻ sinh non, đồng thời xác định độ chính xác của chúng. Các đánh giá dao động trong khoảng thời gian từ vài giây đến 24 giờ, cung cấp mức PEEP từ 0 đến 6 cm HẠO, cũng như đo một số thông số lâm sàng và sinh lý khác nhau. Tổng số 31 thử nghiệm khả năng sẵn sàng rút ống đã được xác định, cho thấy khả năng tổng thể tốt để xác định các lần rút ống thành công (độ nhạy cao), nhưng khả năng phát hiện thất bại thấp (độ đặc hiệu thấp). Do đó, không có thử nghiệm sẵn sàng rút ống nào được đánh giá độ chính xác một cách thuyết phục có đủ sức mạnh hoặc giá trị ngoại tại để chứng minh cho việc để xuất ứng dụng chúng vào thực hành làm sàng. Hộp 26.3 liệt kê các thử nghiệm sẵn sàng rút ống khác nhau được đánh giá ở trẻ sinh non, sẽ được xem xét lại sau.
| Hộp 26.3 Các thông số sinh lý và lâm sàng được đánh giá trong các thử nghiệm sẵn sàng rút ống ở trẻ sinh non |
| Các thông số sinh lý
Chức năng phổi
Sức mạnh cơ hô hấp
Các kiểu thở
Hành vi hô hấp
Các thông số làm sáng
|
Thăm khám thực thể
Đo nhịp thờ, V., thông khí phút và chỉ số thở nhanh nóng (rapid shallow breathing index) là những thông số sinh lý được đánh giá rộng rãi nhất ở trẻ non tháng. Mặc dù các phép do nhất định liên quan đến thông khí phút có sự khác biệt đáng kể giữa trẻ rút nội khí quản thành công và thất bại, song sự trùng lập đáng kể giữa các nhóm đã hạn chế độ chính xác tổng thể của chúng. Nhìn chung, các thử nghiệm liên quan đến thông khí phút có độ nhạy tổng hợp là 84% (95% CI, 77%-90%) và độ đặc hiệu tổng hợp là 71% (95% CL,57%. 83%). Trong RCT duy nhất thuộc loại này, trẻ được rút nội khí quản dựa trên kiểm tra thông khí phút, rút nội khí quản nhanh hơn, nhưng cũng có tỷ lệ đất lại ống nội khí quản cao hơn so với trẻ rút nội khí quản chỉ dựa trên đánh giá lâm sàng. Các phép đo vẽ độ giãn nở cũng như sức cản của phổi và hệ hô hấp, dung tích cặn chức năng và thể tích phổi đã được nghiên cứu nhưng không cho thấy sự cải thiện về khả năng xác định rút nội khí quản thành công. Ngoài ra, hầu hết các nghiên cứu này đã được thực hiện từ lâu và có thể không còn áp dụng cho thực hành lâm sàng hiện tại. Cuối cùng, các phép đo chức năng cơ hoành và cơ hô hấp đã cho thấy một số hứa hẹn trong việc phân biệt trẻ rút nội khí quản thành công hay thất bại. Tuy nhiên, trong các nghiên cứu gần đây hơn, các dấu hiệu về sức mạnh cơ hô hấp chỉ có độ chính xác trung bình trong việc dự đoán rút nội khí quản thành công ở trẻ sinh non và không tốt hơn chi số GA hoặc cân nặng sơ sinh,
Đánh giá lâm sàng
Các đánh giá lâm sàng được thực hiện trong ET CPAP, còn được gọi là thử nghiệm ET CPAP, từ lâu đã được dùng để đánh giá mức độ sẵn sàng rút ống nội khí quản ở nhiều nhóm quần thể, nhưng số lượng nghiên cứu ở trẻ sơ sinh còn ít. Một số RCT ban đầu được thực hiện cách đây hơn 20 năm đã sử dụng các thử nghiệm ET CPAP từ 6 đến 24 giờ; một phân tích gộp của các nghiên cứu đó kết luận rằng: Trẻ sinh non nên được rút nội khí quản trực tiếp từ các cài đặt thông số thở máy thấp mà không cần thử nghiệm ET CPAP, bởi về sau sẽ làm tăng nguy cơ mất huy động phổi mà không cải thiện được kết quả rút nội khí quản. Theo thời gian, các thử nghiệm ET CPAP tiếp tục được nghiên cứu nhưng thời gian dần rút ngắn hơn, nhằm giảm thiểu nguy cơ tác dụng phụ. Ngày nay, các thử nghiệm ET CPAP ngắn này, vốn hay được gọi là thử nghiệm thử tự phát (spontaneous breathing trial — SBT), thường được thực hiện bằng cách cho bệnh nhân thở qua ống nội khí quản với PEEP (có hoặc không có PS) từ 3 đến 30 phút trong khi được theo dõi các ngưỡng không ổn định về lâm sàng. Trên thực tế, trong số tất cả các yếu tố dự đoán được đánh giá cho đến nay, các SBT đã đạt được nhiều sức hút nhất trong thực hành lâm sàng, do chúng rất dễ thực hiện tại giường bệnh và không cần thêm thiết bị hoặc các phép đo phức tạp. Tuy nhiên, như đã nêu rõ trong một cuộc khảo sát quốc tế, các SBT được thực hiện bằng cách sử dụng thời lượng kiểm tra có thể thay đổi rộng rãi, mức PEEP và xác định đạt/không đạt của SBT. Dựa trên kết quả của phân tích gộp, các SBT chỉ được đánh giá trong hai nghiên cứu chẩn đoán nhỏ, cho thấy độ nhạy tổng hợp là 95% (95% CI, 87%–99%) và độ đặc hiệu tổng hợp là 62% (95% C1, 38%–82%), giúp dự đoán rút nội khí quản thành công ở trẻ sinh non. Nghiên cứu duy nhất đánh giá tác động của SBT hàng ngày như một phần của thực hành cơ sở thường quy cho thấy rằng: Trẻ được rút nội khí quản từ các cài đặt thông số thở máy cao hơn, nhưng có thời gian cai máy thở và tỷ lệ thất bại khi rút ống tương tự so với nhóm chứng trước đây. Gần đây hơn, trong một phân tích thứ cấp từ một nghiên cứu quan sát đa trung tâm lớn, tính an toàn và độ chính xác của SBT 5 phút được đánh giá trong một nhóm gồm 259 trẻ cực non tháng được coi là đã sẵn sàng để rút nội khí quản. Gần 60% trẻ phát triển các dấu hiệu bất ổn lâm sàng trong quá trình ghi ET CPAP kéo dài 5 phút. Ngoài ra, sau khi đánh giá hơn 40.000 sự kết hợp khác nhau của các biến cố lâm sàng để xác định SBT đạt/không đạt, tất cả các kết quả xác định đều có độ chính xác thấp trong việc dự đoán rút nội khí quản thành công so với chỉ đánh giá lâm sàng đơn thuần. Nhìn chung, không có SBT nào được đánh giá cho đến nay chứng minh được tính ưu việt đầy tính thuyết phục so với chỉ đánh giá lâm sàng đơn thuần, cả về mặt thúc đẩy cai máy thở nhanh hay giảm tỷ lệ thất bại trong rút nội khí quản. Do đó, các SBT hiện không thể được khuyến cáo như một phần của việc ứng dụng thường quy để đánh giá mức độ sẵn sàng rút nội khí quản ở trẻ sinh non. Một số khía cạnh của SBT, chẳng hạn như mức PEEP tối ưu được sử dụng, thời gian thử nghiệm và xác định SBT đạt hay không đạt, hiện vẫn chưa rõ ràng và cần được nghiên cứu thêm.
Phân tích động của các tín hiệu sinh lý trước khi rút nói khi quản Một số biến số sinh lý thể hiện nhịp điệu cần thiết cho sự sống. Phân tích sử thay đổi của tín hiệu sinh học cũng đã được sử dụng để dự đoán kết quả làm sáng. Ở người lớn, các biến thiên về nhịp tim và hô hấp đã được chứng minh là những yếu tố dự báo tốt về khả năng cai máy thở và sự sẵn sàng rút nội khí quản. Ở trẻ sinh non, những thử nghiệm về động học của các tín hiệu sinh lý, đặc biệt là sử dụng sự thay đổi nhịp tim, ngày càng được ưu tiên cho việc dự đoán hoặc tiên lượng các bệnh nguy kịch sau này, chẳng hạn như nhiễm trùng huyết, bệnh não do thiếu oxy và tử vong. Một số nghiên cứu cũng đã đánh giá tính hữu ích của việc phân tích tín hiệu tim mạch trong việc dự đoán tình trạng sẵn sàng rút nội khí quản ở trẻ sinh non. Trong một nhóm thuần tập trẻ sinh non có cần nặng lúc sinh từ 1.250 g trở xuống và trải qua lần rút nội khí quân đầu tiên, các phép đo biến thiên hô hấp trong thời gian ET CPAP 3 phút, khi được sử dụng kết hợp với SBT thành công, giúp dự đoán chính xác hơn tình trạng thất bại rút nội khí quản so với chỉ dùng SBT đơn thuần. Ở một nhóm trẻ sinh non khác, các phân tích riêng biệt về biến thiên nhịp tim và hô hấp được tính toán trong SBT 3 phút cho thấy khả năng dự đoán tốt, giúp phân biệt kết quả rút nội khí quản thành công và thất bại. Sử dụng cùng một nhóm thuần tập này, đồng thời áp dụng phương pháp máy vectơ hỗ trợ, một phân tích gộp và phức tạp hơn về tình trạng biến thiên của tim mạch đã được thực hiện. Kết quả cho thấy khả năng xác định 80% trẻ sinh non tiếp tục thất bại trong lần rút nội khí quản đầu tiên. Sau những kết quả đầy hứa hẹn này, một nghiên cứu hợp tác tiền cứu đa trung tâm lớn đã được triển khai, nhằm mục đích phát triển một công cụ dự đoán tự động mức độ sẵn sàng rút nội khí quản (nghiên cứu APEX), sử dụng các phương pháp học máy kết hợp thông tin lâm sàng với các số liệu về hành vi hô hấp của tim mạch thu được từ việc phân tích các tín hiệu tim và hô hấp ở trẻ sinh cực non (Clinicaltrials.gov – NCT01909947). Trẻ sơ sinh được APEX phân loại là “thành công” có xác suất rút nội khí quản thành công được cải thiện so với đánh giá lâm sàng (giá trị dự đoán dương là 94%). Tuy nhiên, điều này phải đánh đổi với khả năng bị kéo dài thời gian thông khi ở một số trẻ được phân loại là “thất bại”, dù trên thực tế những trẻ này đã được rút nội khí quản thành công sau đánh giá APEX (Shalish và cộng sự, Pediatric RÚT Academic Societies Meeting, 2019).
Tóm lại, không có phương pháp tiếp cận đơn lẻ nào được áp dụng trước. khi ngắt kết nối với MV đã được chứng minh một cách thuyết phục để cải thiện việc đánh giá mức độ sẵn sàng rút ống nội khí quản, hoặc giảm tỷ lệ thất bại rút ống ở nhóm dân số cực kỳ non tháng. Do đó, nhu cầu cải thiện khả năng của bác sĩ lâm sàng trong việc dự đoán chính xác tình trạng sẵn sàng rút nội khí quản ở những trẻ này cần được tiếp tục điều tra thêm.
Xử trí sau khi rút ống nội khí quản
Một số hình thức tạo áp lực căng đường thở phải luôn được áp dụng trong ít nhất 24 giờ sau khi rút nội khí quản. Đối với trẻ sơ sinh chưa trưởng thành, thời gian này nên kéo dài lâu hơn nữa. Việc sử dụng CPAP sau khi rút nội khi quản ở trẻ sinh non đã được chứng minh là làm giảm thất bại khi rút nội khi quản so với mũ chụp đầu (headbox) hoặc mũ chụp oxy (oxygen hood). Cơ sở lý luận của việc sử dụng áp lực căng liên quan đến khung xương sườn giãn nở quá mức của trẻ sơ sinh ELBW, vốn không thể duy trì dung tích căn chức năng đầy đủ. Trẻ sinh non thường sử dụng thở rên (grunting) như một phương tiện để tạo ra áp lực căng bên trong; tuy nhiên, sau khi được đặt nội khí quản một thời gian, dây thanh quản của trẻ sơ sinh sẽ bị phù nề, khiến việc thở nên không hiệu quả.
Các phương thức không xâm lấn được sử dụng phổ biến nhất để cung cấp áp lực căng là CPAP thông khi áp lực dương ngắt quãng qua mũi (NIPP), và ở một mức độ thấp hơn là liệu pháp oxy lưu lượng cao qua ống thông mũi (HFNC) được làm ấm và ẩm (Hộp 26,4). Thông tin chi tiết về các liệu pháp trên được cung cấp ở Chương 18 của cuốn sách này. Ngoài ra, một số liệu pháp phụ trợ có thể hữu ích trong giai đoạn sau rút nội khí quản (xem Hộp 26,4).
| Hộp 26.4 Các thành phần chính của xử trí sau rút nội khí quản |
Hỗ trợ hô hấp
Liệu pháp điều trị phụ trợ
|
Liệu pháp phụ trợ
Caffeine
Như đã thảo luận từ trước, caffeine đã trở thành một liệu pháp phổ biến trong xử trí trẻ sinh non gặp các vấn đề về hô hấp sau kết quả tích cực của các RCH Về giai đoạn sau rút nội khí quản, một phân tích gộp của Cochrane đã ghi nhân tình trạng giảm đáng kể nguy cơ rút nội khí quản thất bại (RR 0,48: 95% C1 0,32–0,71) đối với trẻ sơ sinh tiếp xúc với methylxanthine. Do đó, ở trẻ sinh non có nguy cơ ngưng thở khi sinh non, hầu như luôn luôn sử dụng caffeine trước khi rút nội khí quản, nếu liệu pháp này chưa được bắt đầu trước đó. Liêu tối ưu để rút nội khí quản thành công có thể cao hơn liều tiêu chuẩn được sử dụng cho cơn ngưng thở, nhưng bằng chứng tổng thể không có tính thuyết phục. Dựa trên một phân tích gộp gần đây so sánh liều cao (liều nạp > 20 mẹ kg và liều duy trì > 10 mg/kg/ngày) với liều tiêu chuẩn của caffeine citrate sau rút nội khí quản, tổng cộng sáu RCT đã được đưa vào. Trẻ sơ sinh trong chế độ dùng liều cao giảm đáng kể số lần thất bại khi rút nội khí quản (18% so với 36%; RR 0,51; 95% CI 0,36–0,71), ít ngưng thở hơn, thời gian MV ngắn hơn và ít BPD hơn so với trẻ ở chế độ dùng thuốc tiêu chuẩn. Tuy nhiên, số lượng nghiên cứu hạn chế, sự khác biệt rộng rãi về đặc điểm dân số và chế độ dùng thuốc, cũng như thực trạng không có dữ liệu an toàn lâu dài đã ngăn cản việc khuyến cáo sử dụng thường quy caffeine liều cao để rút nội khí quản. Bên cạnh đã cafeine không phải là không có tác dụng phụ. Caffeine có liên quan đến nhịp tim nhanh, lợi tiểu, tăng tốc độ chuyển hóa và trào ngược dạ dày-thực quân (có thể do giảm vận tốc lưu lượng máu ở ruột, giảm trương lực cơ vòng thực quản dưới và làm chậm quá trình làm rỗng dạ dày). Ngoài ra, caffeine hiểu cao sớm có liên quan đến tăng gánh nặng do co giật và tăng nguy cơ chân thương tiểu não kèm theo các bất thường khi khám thần kinh ở độ tuổi tương đương đủ tháng. Do đó, caffeine liều cao nên dành cho những trẻ có nguy cơ rát nội khí quản thất bại cao nhất sau khi cân nhắc cẩn thận các nguy cơ, lợi ích và nên giữ trong khoảng thời gian cần thiết ngắn nhất.
Racemic epinephrine dạng khí dung và dexamethasone
Racemic epinephrine dạng khí dung thường được dùng để điều trị phù nề đường thở cấp tính sau rút ống nội khí quản ở trẻ sơ sinh. Mặc dù kinh nghiệm giai thoại và các nghiên cứu ngắn hạn ủng hộ việc sử dụng nó, nhưng phản tích gộp của Cochrane không xác định được bất kỳ nghiên cứu ngẫu nhiên nào đánh giá kết quả lâm sàng quan trọng. Có một số ít bằng chứng rõ ràng tương tự ủng hộ budesonide khí dung, nhưng ứng dụng phổ biến cho chỉ định này phần lớn dựa trên kinh nghiệm giai thoại.
Corticosteroid sau sinh để phòng ngừa và điều trị thở rít sau rút ống
Hai nghiên cứu (xuất bản năm 1989 và 1992) đã kiểm tra việc sử dụng dexamethasone tiêm tĩnh mạch để phòng ngừa thở rít sau rút nội khí quản ở trẻ sơ sinh. Một phân tích gộp cho thấy rằng: Các kết quả không đồng nhất, không có sự giảm đáng kể có ý nghĩa thống kê tổng thể trong thở rít sau rút nội khí quản (RR 0,42; 95% CI 0,07–2,32). Một trong số những nghiên cứu này, trong đó một nhóm trẻ sơ sinh chọn lọc có nguy cơ cao đã được điều trị bằng nhiều liều steroid trong khoảng thời gian rút nội khí quản, cho thấy sự giảm thở rít đáng kể. Cả hai nghiên cứu đều không có đủ năng lực thống kê để đánh giá đúng nhu cầu đặt lại nội khí quản, một kết quả đáng được đánh giá trong các cuộc điều tra thêm. Mặc dù có dữ liệu tương đương, song việc sử dụng một đợt ngắn corticosteroid liều thấp đã trở nên khá phổ biến, phần lớn dựa trên kinh nghiệm giai thoại có lợi. Vì corticosteroid có những tác dụng phụ quan trọng, nên cần thận trọng khi dự phòng liệu pháp này cho những trẻ đã được đặt nội khi quản trong thời gian dài, những trẻ có tiền sử bị chấn thương hoặc đặt nổi khí quản nhiều lần, hoặc những trẻ trước đó đã thất bại khi rút nội khí quản do phù nề dưới thanh môn.
Vật lý trị liệu hô hấp
Bốn RCT nhỏ đã đánh giá tác động của vật lý trị liệu hô hấp tích cực, gỗ thành ngực và rung, sau đó là hút dịch hầu họng, trong giai đoạn sau rút ống nội khi quản. Một đánh giá có hệ thống về các thử nghiệm này cho thấy hiện trạng thiểu bằng chứng rõ ràng ủng hộ việc sử dụng liệu pháp này. Tuy nhiên, vật lý trị liệu ngực thường xuyên được thực hiện sau mỗi 1 đến 2 giờ có liên quan đến việc giảm nhu cầu đặt lại nội khí quản trong vòng 24 giờ đầu tiên sau rút nội khí quản. Không giảm tỷ lệ xẹp phổi thùy sau rút ống nội khí quản, cũng như không có đủ thông tin để đánh giá các kết quả quan trọng trong ngắn hạn và dài hạn, bao gồm cả các tác dụng phụ. Cần thận trọng khi giải thích bất kỳ tác dụng tích cực khả dĩ nào của liệu pháp này, bởi các nghiên cứu đều đã cũ và thu nhận một số lượng nhỏ trẻ sơ sinh lớn hơn, trưởng thành hơn và cho thấy kết quả không nhất quán qua các thử nghiệm.
Thất bại rút ống
Khi đánh giá xem một trẻ sơ sinh đã sẵn sàng để rút nội khí quản hay chưa. vấn đề quan trọng trước tiên là phải xác định chính xác điều gì được coi là xác định khả năng thành công hay thất bại của rút nội khí quản có ý nghĩa làm sàng. Dựa trên tài liệu, thất bại rút ống nội khí quản đã được xác định bằng cách sử dụng các tiêu chí lâm sàng cụ thể, hoặc bằng nhận thức nhu cầu đặt lại ống nội khí quản trong một khoảng thời gian quan sát nhất định. Hầu hết các nghiên cứu đều báo cáo tỷ lệ thất bại khi rút nội khí quản trong một khung thời gian duy nhất sau khi rút nội khí quản, thường dao động từ 24 đến 72 giờ nhưng đôi khi lên đến 1 tuần sau rút nội khí quản. Tuy nhiên, việc tăng cường sử dụng hỗ trợ hô hấp không xâm lấn tích cực trong thời gian sau rút nội khi quản càng làm phức tạp thêm việc giải thích khung thời gian thất bại rút ống bởi vì nó có thể đơn giản là trì hoãn thất bại. Báo cáo không thống nhất về thất bại rút ống giữa các nghiên cứu gây khó khăn cho việc so sánh hiệu quả của các thử nghiệm sẵn sàng rút ống khác nhau, hoặc so sánh kết quả rút ống giữa các nghiên cứu. Ngoài ra, sự thiếu đồng thuận về các định nghĩa thất bại rút ống gây khó khăn cho việc xác định tỷ lệ thất bại có thể chấp nhận được đối với các GA khác nhau, cũng như việc hiểu rõ hơn về các rủi ro liên quan đến lỗi. Các yếu tố nguy cơ chính dẫn đến thất bại rút ống nội khí quản ở trẻ sơ sinh được trình bày trong Hộp 26.5.
| Hộp 26.5 Các yếu tố nguy cơ gây thất bại sau rút nội khí quản ở trẻ sơ sinh |
Chung
Trẻ non tháng
|
Trong dân số trẻ sơ sinh cực kỳ non tháng, số lượng tài liệu ngày càng tăng trong những năm gần đây đã nâng cao hiểu biết của chúng ta về mức độ và ý nghĩa làm sàng của thất bại rút ống nội khí quản. Đầu tiên, tái đặt ống nội khí quản trong quần thể này là một hiện tượng động, xảy ra vì nhiều lý do khác nhau trong suốt quá trình nhập viện và sau 72 giờ kể từ khi rút ống nội khi quản. Trong một nghiên cứu thuẫn tập lớn về trẻ cực non tháng được theo dõi dọc từ khi rút nội khí quản theo kế hoạch đầu tiên cho đến khi ra khỏi NICU, tỷ lệ đặt lại nội khí quản tăng lên đáng kể theo thời gian sau rút nội khí quản, từ 15% sau 72 giờ lên 27% sau 7 ngày và 47% tính đến lúc xuất viện. Các lý do phổ biến nhất đã được nêu rõ cho việc đặt lại nội khí quản là ngưng thở và nhịp tim chậm (ở 65% trẻ sơ sinh), sau đó là tăng nhu cầu oxy và tăng công thở (tương ứng ở 35% và 29% trẻ sơ sinh). Đặt lại nội khí quản trong 7 ngày đầu sau rút nội khi quản chủ yếu liên quan đến hô hấp; trong khi đó, tái đặt nội khí quản do các chẩn đoán không liên quan đến hô hấp (như nhiễm trùng huyết, hoặc viêm ruột hoại tử) thường xảy ra sau tuần đầu tiên sau khi rút nội khí quản. Như vậy, nghiên cứu này cho thấy rõ rằng: Khung thời gian thường được sử dụng từ 24 đến 72 giờ để xác định thất bại rút nội khí quản đánh giá thấp sự xuất hiện thực sự của việc đặt lại ống nội khí quản liên quan đến hô hấp. Ngoài ra, rõ ràng là không có cửa sổ quan sát đơn lẻ nào có thể nắm bắt chính xác các mô hình thực sự của việc tái đặt nội khí quản trong bất kỳ nhóm thuần tập nhất định nào. Vì những lý do đó, nên việc bảo cáo tỷ lệ thất bại khi rút ống nội khi quản trong quần thể này như một chuỗi liên tục được ưa dùng hơn, sử dụng đô thị phân phối tích lũy, trong ít nhất 7 ngày đầu tiên sau khi rút ống nội khí quản.
Bất chấp những gợi ý trước đó, một câu hỏi trọng tâm vẫn là: Liệu thất bại rút ống có góp phần làm tăng bệnh tật và tử vong không, hay đây chỉ đơn giản là một dấu hiệu cho thấy mức độ nghiêm trọng của bệnh cơ bản. Từ các tài liệu dành cho người lớn và trẻ em, có một số bằng chứng cho thấy thất bại rút ống, đặt lại ống nội khí quản hoặc kéo dài MV ảnh hưởng xấu đến khả năng sống sót không phụ thuộc vào mức độ nghiêm trọng của bệnh cơ bản. Ở trẻ sơ sinh cực non tháng, bốn nghiên cứu đã nỗ lực cung cấp một số thông tin chỉ bày về vấn đề này, nhưng với các phương pháp và kết quả khác nhau. Đầu tiên, Ansen và cộng sự đánh giá hỏi cứu trong một nhóm thuần tập gồm 3.343 trẻ EBW xem liệu số lần đặt lại, được thực hiện vào bất kỳ khoảng thời gian nào sau khi rút nội khí quản, có làm tăng nguy cơ BPD, bổ sung O2 khi xuất viện, mở khí quản và tử vong hay không. Sau khi điều chỉnh các yếu tố gây nhiễu và bao gồm tổng thời gian MV, chi tiếp xúc với ba hoặc trên ba lần đặt lại mới có thể làm tăng nguy cơ BPD một cách độc lập ở những người sống sót. Manley và cộng sự, cũng như Chawla và cộng sự, đã thực hiện các phân tích thứ cấp của hai RCT, trong đó họ đánh giá kết quả liên quan đến thất bại rút ống, được xác định là cần đặt lại nội khí quản tương ứng trong vòng 7 ngày và 5 ngày. Sau khi điều chỉnh các yếu tố gây nhiễu nhưng không bao gồm tổng thời gian MV, thất bai rút ống liên quan đến tình trạng gia tăng đáng kể nguy cơ tử vong, BPD, cùng với đó là thời gian điều trị oxy, hỗ trợ hô hấp và nhập viện lâu hơn. Trong phân tích thứ cấp gần đây nhất từ một nghiên cứu tiến cứu, mối quan hệ giữa đặt lại ống nội khí quản ở các khoảng thời gian khác nhau sau khi rút nội khi quản và kết quả tổng hợp của tử vong/BPD ở trẻ cực non tháng đã được phân tích. Sau khi điều chỉnh các yếu tố gây nhiễu, việc đặt lại ống nội khí quản vào bất kỳ khung thời gian nào giữa 24 giờ và 3 tuần sau rút nội khí quản có liên quan đến tình trạng tăng tỷ lệ tử vong/BPD, độc lập với thời gian tích lũy của MV. Điều thú vị là, đặt lại nội khí quản trong 48 giờ đầu tiên có liên quan đến tỷ lệ tử vong/BPD cao hơn không tương xứng với bất kỳ cửa sổ quan sát nào khác. Ngoài ra, nhu cầu đặt lại nội khí quản có liên quan đến việc tiếp xúc với MV thêm 12 ngày, bản thân nó có mối liên hệ độc lập với tình trạng gia tăng tử vong/BPD. Như vậy, tổng kết từ bốn nghiên cứu hiện có cho thấy: Mặc dù nhu cầu đặt lại ống nội khí quản dường như làm tăng nguy cơ tử vong và bệnh tật đường hô hấp ở trẻ cực non tháng, song nó có thể chủ yếu là do kéo dài thời gian phơi nhiễm MV kèm theo đặt lại ống nội khí quản. Tuy nhiên, kết quả từ nghiên cứu mới nhất chỉ ra rằng: Việc đặt lại ống nội khí quản xảy ra trong vòng 48 giờ kể từ khi rút nội khí quản có thể dẫn đến nguy cơ biến chứng độc lập cao nhất, và do đó nên là mục tiêu ưu tiên trong các nghiên cứu rút nội khí quản trong tương lai. Và tương lai sẽ cần có các thử nghiệm đa trung tâm lớn hơn, được thiết kế hiệu quả để làm rõ thêm vấn đề này. Trong lúc chờ đợi. chúng ta phải tiếp tục nỗ lực rút nội khí quản càng sớm càng tốt, đồng thời có gắng tối ưu hóa cơ hội thành công. Bất chấp những nỗ lực đó, trẻ sơ sinh non tháng sẽ thường xuyên phải đặt lại nội khí quản. Do đó, cả hai biện pháp can thiệp đều cần được lên kế hoạch cẩn thận, cũng như thực hiện trong điều kiện được kiểm soát tốt bởi những người giàu kinh nghiệm nhất.
Kết luận
Cai máy thở từ thông khí xâm lấn và rút nội khí quản liền sau đó tiếp tục là những vấn đề thách thức cần được nghiên cứu thêm. Bằng chứng hiện có chỉ ra rằng: Rút ống nội khí quản sớm là điều được mong đợi, nhưng khả năng dự đoán mức độ hỗ trợ để giúp thực hiện quá trình này một cách an toàn vẫn còn hạn chế, đặc biệt là ở trẻ sơ sinh non tháng. Có bằng chứng mạnh mẽ cho thấy thông khí mục tiêu thể tích (VTV) giúp thúc đẩy quá trình cai máy thở. Cũng có những ý kiến ủng hộ mạnh mẽ đối với việc sử dụng caffeine và áp lực căng đường thở sau khi rút nội khí quản. Bằng chứng về các biện pháp cai máy thở và rút ống nội khí quản khác có hiệu quả xác minh kém hơn. Các công cụ cải tiến giúp dự đoán khả năng thành công của rút nội khí quản ở nhóm đối tượng dễ bị tổn thương này hiện đang được khám phá, nhằm mục tiêu giảm thất bại khi rút nội khí quản và nhu cầu đặt lại nội khí quản sau đó.