nhathuocngocanh.com – Bài viết Các nguy hiểm của tăng oxy mô được biên dịch bởi bác sĩ Đặng Thanh Tuấn – Bệnh viện Nhi Đồng 1. Để tải link PDF của bài viết, xin vui lòng click vào link ở đây.
Tóm tắt
Độc tính của oxy (O2) vẫn là một mối quan tâm, đặc biệt là đối với phổi. Điều này chủ yếu liên quan đến việc sản xuất quá mức các loại oxy phản ứng (ROS, reactive oxygen species). Bổ sung O2, tức là nồng độ O2 trong khí hít vào (FIO2)> 0,21 có thể gây tăng oxy máu (hyperoxaemia) (tức là PaO2 > 100 mmHg) và sau đó, tăng oxy mô hyperoxia) (tăng nồng độ O2 trong mô), do đó tăng hình thành ROS. Ở đây, chúng tôi xem xét sinh lý bệnh của ngộ độc O2 và tác hại tiềm ẩn của O2 bổ sung trong các tình trạng ICU khác nhau. Cơ sở bằng chứng hiện tại cho thấy nên tránh PaO2 > 300 mmHg (40 kPa), nhưng vẫn chưa chắc chắn liệu có “mức tối ưu” có thể thay đổi đối với các tình trạng lâm sàng nhất định hay không. Vì PaO2 ngay cả trên mức sinh lý vừa phải có thể liên quan đến các tác dụng phụ có hại, nên hiện tại nên chuẩn độ O2 để duy trì PaO2 trong giới hạn bình thường, tránh cả giảm oxy máu và tăng oxy máu quá mức.
Bối cảnh
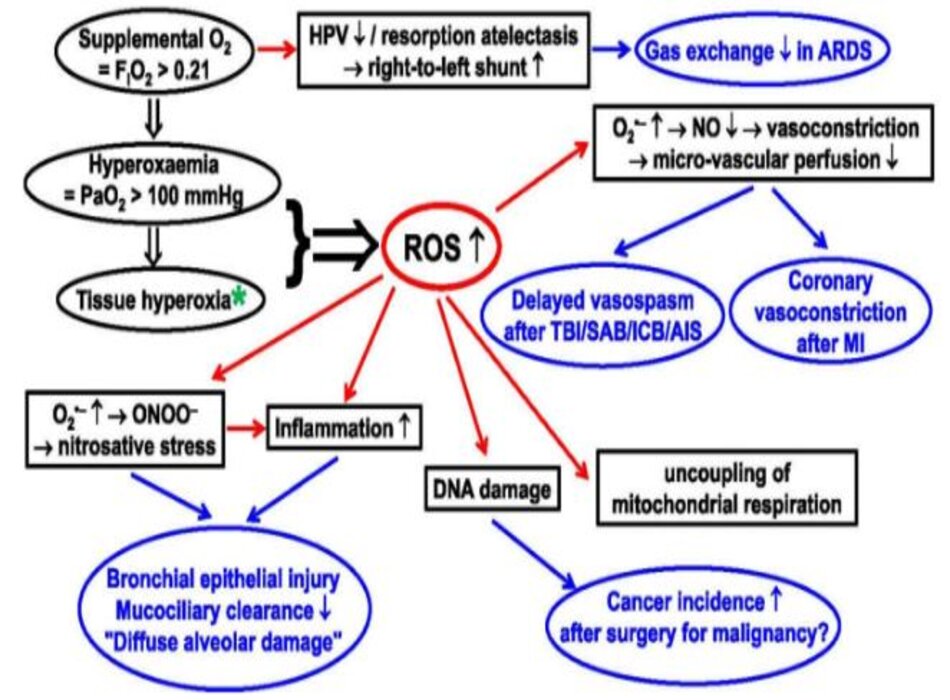
Kể từ khi được phát hiện [1,2,3], oxy (O2) đã được coi là “bạn và thù” [4]. Nó rất quan trọng đối với hô hấp hiếu khí trong ti thể, tuy nhiên hô hấp ti thể cũng tạo ra các loại oxy phản ứng (ROS) [5], sản xuất trong số đó liên quan đến nồng độ O2 [6,7,8]. O2 bổ sung, tức là nồng độ O2 trong khí hít vào (FIO2)> 0,21, có thể gây tăng oxy máu (PO2 động mạch> 100 mmHg) và sau đó tăng hình thành ROS [9,10,11]. Điều này đặc biệt rõ ràng trong quá trình thiếu máu cục bộ/tái tưới máu (I/R, ischaemia/reperfusion) và/hoặc giảm oxy mô/tái oxygen hóa [6,7,8]. ROS cũng giống như “Janus-head” như O2: ROS rất quan trọng để bảo vệ vật chủ, và cũng độc hại [12]. Do đó, ngộ độc O2, đặc biệt là phổi, là một vấn đề đáng quan tâm [13,14,15], và liều lượng tối ưu vẫn chưa rõ ràng trong chăm sóc quan trọng. Bài tổng quan này thảo luận về những tác hại tiềm ẩn của O2 trong các bệnh nền nặng khác nhau. Hình 1 tóm tắt những nguy cơ có thể xảy ra của chứng tăng oxy máu, nêu bật các cơ chế sinh lý bệnh và tác động của chúng đối với các tình trạng bệnh cụ thể. Các nghiên cứu lâm sàng quan trọng nhất được liệt kê trong Bảng 1; “Tệp bổ sung 1” hiển thị danh sách nghiên cứu đầy đủ.
- Hình 1 Tác hại tiềm tàng của chứng tăng oxy máu. AIS: Đột quỵ do thiếu máu cục bộ cấp tính; MI: Nhồi máu cơ tim; ARDS: Hội chứng suy hô hấp cấp; HPV: co mạch phổi do giảm oxy máu; ICB: chảy máu nội sọ; NO nitric oxit; ONOO‒ peroxynitrit; O2‒ anion superoxit; ROS: Các loại oxy phản ứng; SAB: Chảy máu dưới màng nhện; TBI: chấn thương sọ não. * Lưu ý rằng trong khi tăng oxy và tăng oxy máu được xác định rõ ràng là FIO2 > 0,21 và PaO2 > 100 mmHg tương ứng, không có ngưỡng chung cho “tăng oxy máu ở mô”, vì PO2 của mô bình thường phụ thuộc vào tưới máu vi tuần hoàn và chuyển hóa tương ứng. hoạt động. Tuy nhiên, đáng chú ý là mức PO2 thấp từ 0,3 – 0,7 mmHg là đủ cho hoạt động chính xác của chuỗi hô hấp ty thể [17, 162]
Bảng 1 Các đặc điểm chính của các nghiên cứu được thảo luận trong văn bản.
| Tên nghiên cứu | Thiêt kế/cỡ mẫu | Bối cảnh | Thông số oxygen hóa | Các phát hiện chính | Ref |
| IOTA | Phân tích tổng | ICU tổng quát | “Bảo tồn” so với “Tự do”, tức | Nguy cơ tử vong cao hơn | 38 |
| hợp/25 RCT, n = | là mục tiêu thấp so với mục | (nguy cơ tương đối 1,21 | |||
| 16.037 | tiêu cao theo thiết kế nghiên cứu cá nhân | [KTC 95% 1,0–1,43]) với
chiến lược O2 “tự do” (SpO2 đường cơ sở trung bình 96% [IQR 96–98%]) |
|||
| ICU-ROX | RCT đa trung tâm/n
= 965 |
ICU tổng quát; MV | “Bảo tồn” (FIO2 thấp nhất có thể giữ SpO2 từ 91 đến 97%) so với “Thông thường” (không giới hạn) | Không có sự khác biệt giữa số ngày không thở máy ở ngày 28 và tỷ lệ tử vong
ngày 90/180 |
39 |
| PROSPERO | Phân tích tổng hợp + Phân tích tuần tự thử nghiệm/36 RCT, n = 20,166 | ICU tổng quát | “Thấp” so với “Cao”, tức là mục tiêu thấp hơn so với mục tiêu cao hơn theo thiết kế nghiên cứu cá nhân | Không có sự khác biệt về tỷ lệ tử vong hoặc tỷ lệ mắc bệnh | 42 |
| O2-ICU | RCT đa trung tâm/n
= 400 |
ICU tổng quát; thời gian lưu trú ICU > 2 ngày; ≥ 2 tiêu chí SIRS | Mục tiêu oxy: PaO2 8–12 so với 14–18 kPa (≈ 60–90 so với 105–135 mmHg) | Không có sự khác biệt về điểm SOFA; giới hạn: PaO2
<mục tiêu trong nhóm “oxy hóa bình thường cao” |
43 |
| LOCO2 | RCT đa trung tâm/n
= 205 |
Hội chứng suy hô hấp cấp tiến triển | “Bảo tồn” (PaO2 55–70 mmHg, SpO2 88–92%) so với “Tự do” (PaO2 90–105 mmHg, SpO2 ≥ 96%) cho đến ngày thứ 7 | Ngừng sớm vì tỷ lệ tử vong cao hơn ở nhóm “Bảo tồn” (ngày 28: 34,3 so với 26,5%;
ngày 90: 44,4 so với 30,4%); giới hạn:> 50% bệnh nhân có PaO2> mức trên |
63 |
| HOT-ICU | RCT đa trung tâm/n
= 2,888 |
ICU tổng quát; SHH giảm oxy máu cấp tính | “Thấp” (PaO2≈60 ± 7,5
mmHg) so với “Cao” (PaO2≈90 ± 7,5 mmHg) |
Không có sự khác biệt trong tỷ lệ tử vong trong ngày 90 | 64 |
| LUNG SAFE | Nghiên cứu phụ của nghiên cứu đoàn hệ đa trung tâm, tiền cứu,/n = 2,005 | Hội chứng suy hô hấp cấp tiến triển | Hiện diện “tăng oxy máu” ngày 1 PaO2> 100 mmHg), “duy trì” (ngày 1 và ngày 2) hoặc “quá mức” O2 (FIO2 ≥ 0,6 + PaO2> 100 mmHg) | 30% tăng oxy máu ngày 1, 12% “tăng oxy máu kéo dài”, 20% “quá nhiều O2” | 65 |
| IMPACT | Hồi cứu đa trung tâm/n = 16.326 | Hồi sức tim phổi; ABG trong vòng 24 giờ | PaO2 <60 (“thiếu oxy máu”), 60–300 (“oxy máu bình thường”), ≥ 300 mmHg (“tăng oxy máu”) | PaO2 ≥ 300 mmHg tử vong cao hơn đáng kể 63% (CI: 60–66) so với
oxy bình thường 45% [CI43-48]) so với thiếu oxy (57 [CI56-59]%) |
68 |
| HYPER2S | RCT đa trung tâm/n
= 442 |
Sốc nhiễm trùng trong vòng 6 giờ đầu tiên; MV | FIO2 = 1,0 trong 24 giờ đầu tiên so với “điều trị tiêu chuẩn” | Ngừng an toàn sớm cho tỷ lệ tử vong cao hơn với “FIO2 = 1,0” (ngày 28: 43
so với 35%, p = 0,12; ngày 90: 48 so với 42%, p = 0,16); số ngày không có máy thở thấp hơn, các tác dụng phụ nghiêm trọng hơn mặc dù SOFA thấp hơn ở ngày thứ 7 |
75 |
| HYPER2S | Phân tích hậu kỳ của RCT đa trung tâm/n= 393 | Sốc nhiễm trùng trong vòng 6 giờ đầu tiên theo Sepsis-3; MV | FIO2 = 1,0 trong 24 giờ đầu tiên so với “điều trị tiêu chuẩn” | Tỷ lệ tử vong cao hơn với “FIO2 = 1,0” và lactate> 2
mmol/L (ngày 28: 57 so với 44%); không có tác dụng lactate ≤ 2 mmol/L |
76 |
| ICU-ROX | Phân tích hậu kỳ của RCT đa trung tâm/n
= 251 |
Nhiễm trùng huyết; MV | “Bảo tồn” (FIO2 thấp nhất có thể giữ SpO2 từ 91 đến 97%) so với “Thông thường” (không giới hạn) | Tỷ lệ tử vong ngày 90 “Bảo tồn” 36,2 so với “Thông thường” 29,2% (p = 0,24); “… Ước tính điểm về hiệu quả điều trị luôn được ưu tiên cho liệu pháp O2 thông thường…” | 77 |
| Đa trung tâm, hồi cứu/n = 1,116 | TBI; MV | PaO2 <10,0 kPa (≈ <75 mmHg) hoặc 10,0–13,3 kPa (≈ 75-100mmHg) hoặc PaO2> 13,3 kPa (≈> 100 mmHg) | PaO2> 13,3 kPa không liên quan đến kết quả | 86 | |
| Hồi cứu đa trung tâm/n = 2,894 | MV; 19% AIS,
32% SAB, 49% ICB |
PaO2 <60, 60–300 hoặc ≥ 300mmHg | PaO2 ≥ 300 mmHg tử vong khi nhập viện 57 so với 46/47% (p <0,001) | 87 | |
| Hồi cứu đa trung tâm/n = 432 | SAB; MV | 24 giờ TWA PaO2: “thấp”/“trung bình”/“cao” (<97,5/97,5–150 /> 150mmHg) | TWA-PaO2: người sống sót 118 (IQR90-155) so với
người không sống sót 137 (IQR104-167) mmHg (p <001); phân tích đa biến không có mối quan hệ giữa TWA-PaO2 và kết quả |
91 | |
| SO2S | RCT đa trung tâm/n
= 7.635 |
AIS | Liên tục (2-3L/phút) so với O2 mũi về đêm so với kiểm soát | Không có sự khác biệt về tỷ lệ tử vong và kết cục thần kinh | 92 |
| Hồi cứu đa trung tâm/n = 24.148 | TBI; MV | PaO2 50 mmHg-gia tăng; tăng nồng độ PaO2> 300 mmHg | Không có mối liên quan nào giữa PaO2 và tử vong ngoại trừ PaO2 <60 mmHg và GCS> 12 | 93 | |
| Hồi cứu đa trung tâm/n = 3,699 | TBI; MV | PaO2 <60, 60–300 so với PaO2 ≥ 300 mmHg | Không có mối liên quan nào PaO2 ≥ 300 mmHg so với GOSE <5 ở 6 tháng | 95 | |
| Hồi cứu trung tâm đơn/n = 688 | ED; MV,
normoxia (PaO2 60-120 mmHg) vào ICU ngày 1 |
Giảm oxy máu/ oxy máu bình thường/tăng oxy máu PaO2 <60, 60–120,> 120 mmHg | Tăng oxy máu chiếm 43%; tử vong 29,7 so với 19,4 (oxy bình thường) và 13,2 (thiếu oxy)% (p = 0,021 so với oxy bình thường) | 109 | |
| Hồi cứu đa trung tâm/n = 3,464 | Đa chấn thương; ICU trong vòng 24 giờ | Bệnh nhân-giờ với SpO2 90– 96% (“nomoxia”) so với> 96% (“tăng oxy máu”); hyperoxia trong 10% – FIO2 tăng dần cho đến d3 và d4-7 | Tăng nguy cơ tử vong với FIO2 cao hơn trong thời kỳ tăng oxy máu | 114 | |
| IMPACT | Hậu kỳ của hồi cứu đa trung tâm/n = 4,459 | Hồi sức tim phổi; ABG trong 24 giờ | PaO2 cao nhất 24 giờ ICU | Tăng 100 mmHg PaO2-tăng 24% nguy cơ tử vong (OR1,24 [CI1,18–1,31]) | 121 |
| Tiền cứu đa trung tâm/n = 280 | Hồi sức tim phổi; hạ thân nhiệt trị liệu | PaO2> 300 mmHg 1 hoặc 6 giờ sau ROSC | 3% (OR1,03 [CI1,02–1,05])
tăng nguy cơ dẫn đến kết cục thần kinh kém trong thời gian tăng oxy 1 giờ |
124 | |
| Hồi cứu đa trung tâm/n = 12.108 | Hồi sức tim phổi; hạ thân nhiệt trị liệu | PaO2 ≥ 300 mmHg trong vòng 24 giờ | PaO2 ≥ 300 mmHg tử vong 59 (CI56-61)% so với 47 (CI45-50% (60-300 mmHg)/58 (CI57-58)% (<60 mmHg) | 125 | |
| FINNRESUS CI | Triển vọng đa trung tâm/n = 409 | CPR khi xuất viện | PaO2 <75 (“thấp”), 75–150 (“trung bình”), 150–225 (“trung gian”), PaO2> 225 mmHg (“cao”) | Không có mối liên quan giữa tăng oxy và kết cục thần kinh | 126 |
| TTM | Phân tích hậu kỳ về RCT đa trung tâm/n
= 869 |
CPR ngoài bệnh viện; hạ thân nhiệt trị liệu | PaO2, TWA PaO2 37 giờ sau ROSC; PaO2> 40 kPa (≈PaO2>
300 mmHg), 8 ≤ PaO2 ≤ 40 (≈60 ≤ PaO2 ≤ 300 mmHg), PaO2 <8 kPa (≈PaO2 <60 mmHg) |
Không liên quan đến kết cục thần kinh 6 tháng | 129 |
| Phân tích tổng hợp/7 RCT, n = 429 | CPR | Mục tiêu O2 “cao hơn” (“tự do”) so với “thấp hơn” (“thận trọng”) | Tỷ lệ tử vong 50% tự do so với 41% Bảo tồn, p = 0,04 | 130 | |
| ICU-ROX | Phân tích post hoc về RCT đa trung tâm/n = 166 | “Suspected hypoxic ischaemic encephalopath y”; MV | “Bảo tồn” (FIO2 thấp nhất có thể 91 ≤ SpO2 <97%) so với “Thông thường” (không giới hạn) | Ngày 180: tỷ lệ tử vong 43% thận trọng so với 59% “bình thường” (p = 0,15); “Kết quả thần kinh không thuận lợi” 55% thận trọng so với 68% bình thường (p = 0,15) | 134 |
| DETO2X- SWEDEHEA RT | RCT đa trung tâm/n = 6629 | AMI | 6L/phút O2 6-12 giờ | Không ảnh hưởng đến kết quả 1 năm | 138 |
| Liệu pháp oxy trong hội chứng mạch vành cấp tính | RCT đa trung tâm bắt chéo/n = 40,872 | ACS | 6-8L/phút O2 so với SpO2 90– 95% | Không ảnh hưởng đến tỷ lệ tử vong trong 30 ngày | 140 |
| PROXI | RCT đa trung tâm/n = 1,386 | Phẫu thuật mở bụng chương trình/cấp cứu | FIO2 0,8 so với 0,3 cho đến 2 giờ sau mổ | FIO2 0,8 19,1% so với FIO2
0,3 20,1% SSI (p = 0,64) |
143 |
| Oxy bổ sung trong phẫu thuật đại trực tràng | Tiền cứu trung tâm đơn/n = 5,749 | Phẫu thuật ruột già> 2 giờ | FIO2 = 0,8 so với 0,3 mỗi 2 tuần xen kẽ nghiên cứu can thiệp | 30d-SSI FIO2 = 0,8 10,8 so
với 11,0% (p = 0,85) |
144 |
| FiO2 trong phẫu thuật và các biến chứng hô hấp sau phẫu thuật | Hồi cứu đa trung tâm/n = 79,322 | Phẫu thuật tổng quát | Nhóm phân vị FIO2 0,31, 0,41, 0,52, 0,79 | Mối liên quan phụ thuộc vào liều lượng FIO2 so với ngày thứ 7 “Tổng hợp các biến chứng hô hấp chính” và tỷ lệ tử vong trong ngày 30 so với ngày thứ 7 | 151 |
| Phân tích tổng hợp của WHO/12 RCT, n = 5,976 | Phẫu thuật tổng quát | FIO2 0,8 so với 0,30–0,35 | FIO2 = 0,8 làm giảm nguy cơ SSI so với 0,30–0,35 (OR0,80 [CI0,64–0,99], p =
0,043): chỉ gây mê toàn thân với đặt nội khí quản |
153 | |
| RCT trung tâm đơn/n = 210 | Mổ ruột thừa | FIO2 = 0,8 so với 0,30 cho đến 2 giờ sau mổ | FIO2 = 0,8 SSI 5,6 so với
13,6% (p = 0,04); thời gian nằm viện 2,51 so với 2,92 (p = 0,01) |
156 | |
| Tổng quan về oxy chu phẫu Cochrane | Phân tích tổng hợp/10 RCT, n = 1,458 | Phẫu thuật tổng quát | FIO2 “cao hơn” so với “thấp hơn” | Rủi ro tác dụng phụ nghiêm trọng “cao hơn” so với “thấp hơn” FIO2 “bằng chứng rất thấp” | 157 |
| Phân tích tổng hợp/12 thử nghiệm, n = 28,984 | ICU tổng quát; MV | FIO2 “thấp” so với “cao” (theo định nghĩa của các tác giả) | FIO2 “cao”; không ảnh hưởng đến viêm phổi, ARDS, thời gian MV; FIO2 ≥ 0,8 tăng nguy cơ: xẹp phổi | 158 |
Sinh lý bệnh
Oxy thường tồn tại dưới dạng phân tử hai-nguyên tử (O2); hai nguyên tử của nó liên kết với nhau thông qua các liên kết đơn để lại hai electron chưa ghép đôi. O2 thực hiện các hành động của nó thông qua các electron không ghép đôi này hoạt động như các gốc. ROS thậm chí còn là các phân tử phản ứng mạnh hơn được hình thành thông qua sự tiếp nhận điện tử của oxy (ví dụ: superoxide, peroxide và hydroxyl anion).
Hơn 90% lượng O2 tiêu thụ được sử dụng bởi ti thể, chủ yếu để sản xuất ATP (quá trình phosphoryl hóa oxy hóa), nhưng cũng để sinh nhiệt thông qua quá trình tách rời và sản xuất superoxide. O2 là chất nhận điện tử cuối cùng ở phức hợp IV của chuỗi vận chuyển điện tử (ETC), bị khử thành nước trong quá trình này. Đối với mỗi mol glucose được chuyển hóa, hô hấp kỵ khí (đường phân) chỉ tạo ra 2 mol ATP so với khoảng 28–30 từ quá trình phosphoryl hóa oxy hóa. Về sức khỏe, 1–3% lượng O2 tiêu thụ của ty thể được sử dụng ở phức hợp ETC I và III để tạo ra superoxide, một phân tử tín hiệu quan trọng [16]. Superoxide cần thiết cho các quá trình enzyme, ví dụ: oxydaza (xúc tác phản ứng oxy hóa-khử) và oxygenaza (kết hợp oxy vào chất nền). Các tế bào miễn dịch được kích hoạt sử dụng O2 để sản xuất ROS ngoài ti thể: NADPH oxidase tạo ra superoxide (“bùng nổ hô hấp”) để thực bào. Trừ khi bị choáng bởi quá trình sản xuất quá mức ROS, khả năng chống oxy hóa (ví dụ: superoxide dismutase, glutathione, thioredoxin) ngăn ngừa tổn thương oxy hóa đối với DNA, protein và lipid và quá trình chết tế bào sau đó.
O2 cũng ảnh hưởng đến phản ứng viêm. Các mô hình thực nghiệm và các nghiên cứu tình nguyện viên và bệnh nhân chứng minh rằng tăng oxy máu (và giảm oxy máu) có thể gây ra các phản ứng tiền viên và chống viêm, với cả bảo vệ và di chứng có hại [17]. Oxy cao áp được sử dụng để hỗ trợ chữa lành vết thương và điều trị chứng hoại thư do khí, nhưng có thể gây ngộ độc thần kinh. Cho dù đáp ứng với tăng oxy máu liên quan đến mức độ và/hoặc thời gian của nó, các loại tế bào cụ thể, tình trạng viêm nền hoặc các yếu tố khác vẫn chưa chắc chắn; rõ ràng, ngộ độc O2 có thể được gây ra do không có bệnh lý cơ bản, các cơ quan chủ yếu là phổi, não và mắt.
Độc tính với phổi được Lorrain Smith mô tả lần đầu tiên: O2 tinh khiết ở áp suất cao gây ra viêm phổi (inflammatory pneumonitis) [18]. Ở áp suất khí quyển, viêm phổi đã được nhìn thấy sau nhiều ngày ở các động vật linh trưởng không phải người thở 60–100% O2 [19,20,21]. Sau khi ban đầu ảnh hưởng đến đường thở (viêm khí quản) với giảm thanh thải niêm mạc [22], nhu mô phổi sẽ bị ảnh hưởng. Ở người, điều này xảy ra đặc biệt khi PO2 hít vào được tăng cường đáng kể trong môi trường cao áp. Than phiền ban đầu là đau ngực sau thành ngực, sau đó ho và khó thở do viêm phổi phát triển kèm theo phù phổi và bóng phổi X quang lan tỏa. Ở những người tình nguyện khỏe mạnh thở 98-100% O2, cơn đau ngực bắt đầu sau 14 giờ, ho và khó thở từ 30 đến 74 giờ [22]. Do rửa trôi nitơ [23], cũng có thể xảy ra xẹp phổi ở những vùng phổi có tỷ lệ thông khí/tưới máu thấp [24].
Cơ chế và sự khởi phát của ngộ độc O2 cao áp so với áp lực bình thường có giống nhau hay không vẫn chưa rõ ràng. Tổn thương phổi tăng nhanh do tăng oxy máu, nhưng tính chất ít gây viêm hơn và được thúc đẩy bởi một thành phần sinh thần kinh có thể bị ngăn chặn bằng cách ức chế tổng hợp nitric oxide tế bào thần kinh hoặc chuyển đổi dây thần kinh phế vị [25]. Tác dụng hiệp đồng có thể có đối với ngộ độc O2 của bệnh lý phổi cơ bản được đặc trưng kém, đặc biệt là ở mức độ vừa phải của tăng oxy máu gây ra cho bệnh nhân. Tuy nhiên, điều này đã được công nhận rõ ràng với độc tính của bleomycin khi tăng oxy hóa nhẹ có thể gây hại [26].
Độc tính thần kinh đã được mô tả hơn một thế kỷ trước [27]: 3Atm O2 tạo ra co giật và tử vong. Co giật hoặc ngất xảy ra sau 40 phút ở 4Atm O2 và trong vòng 5 phút ở 7Atm [28]. Điều này thường xảy ra trước các triệu chứng nhẹ hơn như nhìn đường hầm, ù tai, co giật, lú lẫn và chóng mặt. Tuy nhiên, tác động của nồng độ cao O2 áp suất bình thường đối với độc tính thần kinh là không rõ ràng.
Sản xuất ROS của ty thể tăng lên khi thiếu hụt hoặc dư thừa O2, nhưng đặc biệt là khi dư thừa O2 (hyperoxia). Điều này có thể xảy ra trong nhiễm trùng huyết và/hoặc chấn thương I/R, tức là toàn bộ cơ thể (ví dụ như hồi sức sau ngừng tim hoặc xuất huyết nặng), hoặc ở cơ quan cụ thể (ví dụ như tái thông mạch sau nhồi máu cơ tim hoặc đột quỵ). Một chấn thương tương tự có thể gây ra bởi tình trạng giảm oxy máu cấp sau đó là điều chỉnh nhanh chóng (giảm oxy máu/tái oxygen hóa-chấn thương). Tác động của chấn thương tái tưới máu có thể nghiêm trọng như tổn thương do thiếu máu cục bộ. Mặc dù các nghiên cứu tiền lâm sàng và lâm sàng không nhất quán [29,30,31], tổn thương tái tưới máu thường trầm trọng hơn do tăng oxy máu. Hiệu ứng tăng oxy có thể trầm trọng hơn do axit hóa các mô thiếu oxy; đường cong phân ly oxyhaemoglobin dịch chuyển sang phải của máu (lại) đi vào mô thiếu oxy làm tăng giải phóng O2, sau đó tăng sản xuất superoxide [31].
Về mặt điện học, cơ thể không tiến hóa để đối phó với căng thẳng O2 ở mô cao. Các mô không chuyển hóa đầy đủ, ví dụ: do chất độc hoặc tắt (“ngủ đông”) để phản ứng với giảm tưới máu, giảm sử dụng O2. Như một phản ứng bảo vệ bình thường, các tín hiệu phản hồi tiêu cực làm giảm lưu lượng máu cục bộ bằng cách co mạch để giảm thiểu sự tích tụ O2 tại chỗ và độc tính sau đó. Do đó, tăng oxy máu cấp tính gây co mạch, làm giảm lưu lượng máu tại chỗ [32], đặc biệt ở mạch máu não và mạch vành [5,6,7]. Sự co mạch này một phần liên quan đến việc giảm giải phóng oxit nitric (NO) từ liên kết S-nitrosohaemoglobin [33]. Sự co thắt mạch đã được chứng minh ở những bệnh nhân có và không có bệnh mạch vành, khi O2 bổ sung làm giảm cung lượng tim và lưu lượng máu xoang vành [34, 35]. Co giật liên quan đến nhiễm độc O2 thần kinh xảy ra với sự giãn mạch nghịch lý trong quá trình tăng oxy máu cao áp [6].
Bệnh nhân ICU tổng quát
Thử nghiệm Oxy-ICU là nghiên cứu lớn đầu tiên đề xuất tác hại quan trọng về mặt lâm sàng do sử dụng O2 tự do trong dân số ICU nói chung [36]. RCT đơn trung tâm này bao gồm 480 bệnh nhân dự kiến sẽ ở lại ICU trong ít nhất 72 giờ. Tỷ lệ tử vong do ICU là 20,2% với điều trị thông thường và 11,6% với liệu pháp O2 bảo tồn. Khoảng hai phần ba số bệnh nhân bao gồm được thở máy lúc ban đầu, khoảng một phần ba bị sốc và tình trạng bệnh tương đối thấp. Sự khác biệt có ý nghĩa thống kê mặc dù nghiên cứu đã bị dừng sớm sau một phân tích tạm thời không có kế hoạch trước, và mức độ của hiệu quả điều trị được báo cáo lớn hơn so với giả thuyết [36]. Do có nhiều cơ chế tử vong ở bệnh nhân ICU [37], tỷ lệ tử vong cao như vậy trong một quần thể bệnh nhân ICU không đồng nhất khó có thể là do liều lượng liệu pháp O2 được sử dụng. Tuy nhiên, thử nghiệm Oxygen-ICU [37] đã nhấn mạnh sự cần thiết phải điều tra thêm.
Sau đó, tổng quan hệ thống và phân tích tổng hợp IOTA [38] báo cáo rằng việc sử dụng O2 thận trọng ở người lớn bị bệnh nặng đã làm giảm đáng kể tỷ lệ tử vong khi nhập viện. Mặc dù những phát hiện này phù hợp với thử nghiệm Oxygen-ICU [36], chúng chỉ cung cấp bằng chứng có độ chắc chắn thấp: Thứ nhất, thử nghiệm Oxygen-ICU [36] đóng góp 32% trọng lượng vào phân tích tỷ lệ tử vong. Thứ hai, các tình trạng chủ yếu là nhồi máu cơ tim cấp tính và đột quỵ, và một loạt các phác đồ O2 đã được thử nghiệm để phân tích chỉ cung cấp bằng chứng gián tiếp về chế độ O2 tối ưu cho bệnh nhân trong ICU. Thứ ba, ước tính hiệu quả điều trị tử vong tổng thể không chính xác. Cuối cùng, một đánh giá hệ thống cập nhật và phân tích tổng hợp không tìm thấy bằng chứng về lợi ích hoặc tác hại khi so sánh các chiến lược cung cấp oxy cao hơn và thấp hơn ở người lớn bị bệnh nặng [39].
Thử nghiệm ICU-ROX ngẫu nhiên đa trung tâm cho thấy liệu pháp O2 bảo tồn không ảnh hưởng đáng kể đến điểm cuối chính là số ngày sống và không phải thở máy (những ngày không thở máy) so với liệu pháp O2 thông thường (tự do) [40]. Nhìn chung, 32,2% bệnh nhân điều trị bảo tồn và 29,7% bệnh nhân thở O2 thông thường tử vong tại bệnh viện. Trong khi những phát hiện này cung cấp một số đảm bảo cho các bác sĩ lâm sàng về sự an toàn của việc sử dụng O2 tự do xảy ra trong thực hành tiêu chuẩn, chúng không loại trừ những ảnh hưởng quan trọng về mặt lâm sàng của các phác đồ O2 được thử nghiệm đối với nguy cơ tử vong. Thật vậy, dựa trên sự phân bố dữ liệu, có 46% khả năng rằng liệu pháp O2 bảo tồn làm tăng tỷ lệ tử vong tuyệt đối hơn 1,5% điểm và 19% khả năng rằng liệu pháp O2 bảo tồn làm giảm tỷ lệ tử vong tuyệt đối hơn 1,5% điểm [41, 42]. Cuối cùng, một RCT gần đây được tiến hành ở những bệnh nhân ICU đáp ứng các tiêu chí về hội chứng phản ứng viêm toàn thân, không tìm thấy sự khác biệt đáng kể giữa mục tiêu oxy bình thường cao và bình thường thấp đối với rối loạn chức năng cơ quan không hô hấp trong 14 ngày đầu tiên, hoặc tỷ lệ tử vong trong ngày 90 [ 43]. Theo đó, liều lượng O2 thích hợp nhất để cung cấp cho bệnh nhân ICU người lớn vẫn chưa chắc chắn.
Hội chứng suy hô hấp cấp tiến triển
Các bác sĩ lâm sàng nên điều chỉnh liệu pháp O2 để tránh cả giảm oxy máu và tăng oxy máu. Trong khi tác hại của tình trạng thiếu oxy mô được hiểu rõ ràng [44], việc điều chỉnh quá mức dẫn đến tăng oxy mô và cũng có thể có hại. Tăng oxy mô làm tổn thương phổi do sản xuất ROS, gây ra stress oxy hóa với tác dụng gây viêm và gây độc tế bào [35, 45, 46]. Hậu quả sinh lý bệnh bao gồm co mạch động mạch [35, 47,48,49], “rò rỉ” mao mạch phế nang và thậm chí tạo sợi [50, 51]. Các bác sĩ lâm sàng sử dụng FIO2 cao hơn mức cần thiết để điều chỉnh tình trạng thiếu oxy ở người bệnh nặng [52], có thể để tránh tình trạng thiếu oxy mô (ẩn) [53, 54], để cung cấp một “chất đệm” nếu tình trạng lâm sàng xấu đi nhanh chóng xảy ra, hoặc do hậu quả của tăng oxy máu là được coi là ít nghiêm trọng hơn. Việc thiếu các mục tiêu được xác định rõ ràng cho PaO2 và/hoặc SaO2 cũng là một vấn đề. Các thử nghiệm của Mạng lưới ARDS nhắm mục tiêu PaO2 là 55-80 mmHg [55], trong khi Hiệp hội
Lồng ngực Anh Quốc đề xuất SpO2 mục tiêu là 94–98% ở những bệnh nhân bị bệnh nặng [56].
Trong ARDS, khả năng tăng oxy máu ảnh hưởng đến kết quả phức tạp hơn nữa do mức độ nghiêm trọng của suy giảm trao đổi khí. Cụ thể, tăng oxy máu cực độ (tức là PaO2> 300 mmHg), liên quan đến tác hại ở các quần thể bệnh nặng khác, là không thể đạt được trong ARDS (xem Bảng 1). Tuy nhiên, tình trạng tăng oxy máu vừa phải là có thể xảy ra và cũng có thể có hại [57]. Hơn nữa, FIO2 cao có thể làm tổn thương trực tiếp phổi [58], khiến phổi nhạy cảm với tổn thương tiếp theo [59], ảnh hưởng xấu đến phản ứng miễn dịch bẩm sinh [60], và làm trầm trọng thêm tổn thương do thông khí gây ra [61, 62]. Do đó cần phân biệt giữa tăng oxy máu và sử dụng FIO2 cao khi đánh giá ảnh hưởng của tăng oxy máu trên phổi.
Thử nghiệm LOCO2 gần đây trong ARDS đã bị dừng sớm vì những lo ngại về tính an toàn và vô ích liên quan đến thiếu máu cục bộ mạc treo ở nhóm O2 bảo tồn. Hơn nữa, tỷ lệ tử vong trong 90 ngày cao hơn đáng kể ở những bệnh nhân được điều trị bằng O2 bảo tồn [63]. Thử nghiệm HOT-ICU nghiên cứu bệnh nhân ICU bị suy hô hấp cấp giảm oxy máu và không tìm thấy sự khác biệt về tỷ lệ tử vong trong 90 ngày giữa mục tiêu PaO2 tự do và bảo tồn [64]. Trong nghiên cứu đoàn hệ quan sát LUNG SAFE, cả tình trạng tăng oxy máu toàn thân và sử dụng quá nhiều FIO2 đều phổ biến, trong đó tình trạng tăng oxy máu nhanh (30% bệnh nhân) phổ biến hơn giảm oxy máu ở giai đoạn đầu ARDS [65]. Hai phần ba số bệnh nhân này được điều trị bằng liệu pháp O2 dư thừa. Giảm oxy máu dường như không được sử dụng làm “chất đệm” ở những bệnh nhân không ổn định: tần suất tương tự ở những bệnh nhân bị sốc. Trong khi một tỷ lệ tương tự bệnh nhân tăng nồng độ huyết thanh vào ngày thứ 2, việc sử dụng FIO2 cao hơn đã giảm. Cả tăng oxy máu và sử dụng quá nhiều O2 hầu hết chỉ là thoáng qua, mặc dù tình trạng tăng oxy máu kéo dài nhiều hơn. Chắc chắn rằng không có mối liên hệ nào được tìm thấy giữa mức độ và thời gian tăng oxy máu, hoặc sử dụng quá nhiều O2 và tỷ lệ tử vong trong ARDS sớm.
Trong khi những phát hiện này tương phản với những phát hiện trong các nhóm ICU khác, một yếu tố phân biệt chính là giảm khả năng tăng oxy quá mức ở bệnh nhân ARDS. Khả năng gây hại do tăng oxy máu dường như liên quan đến mức độ nghiêm trọng của tăng oxy máu [54, 61, 66, 67]; những người có chức năng phổi tương đối được bảo tồn có nguy cơ cao nhất [68]. Tuy nhiên, không tìm thấy mối liên hệ giữa liều lượng và đáp ứng giữa PaO2 và tỷ lệ tử vong [67]. Do đó, nghịch lý là bệnh nhân ARDS có thể ít rủi ro hơn vì họ không thể đạt được mức độ tăng oxy máu cực độ. Một nghiên cứu quan sát gần đây cho thấy mối quan hệ hình chữ U giữa PaO2 và tỷ lệ tử vong ở bệnh nhân ARDS; bệnh nhân có PaO2 tính theo thời gian là 93,8-105 mmHg có nguy cơ tử vong thấp nhất [69]. Điều thú vị là phạm vi này gần giống với phạm vi PaO2 mục tiêu “tự do” được nhắm mục tiêu trong LOCO2 [63]. Do đó, vẫn còn nhiều điều cần tìm hiểu về cách nhắm mục tiêu tối ưu của PaO2 ở bệnh nhân ARDS.
Nhiễm trùng huyết và sốc nhiễm trùng
Về mặt lý thuyết, tăng oxy máu có thể giúp ích cho bệnh nhân nhiễm trùng do tác dụng co mạch của nó, chống lại sự hạ huyết áp [6,7,8], và tác dụng kháng khuẩn của O2 [70, 71]. Tuy nhiên, tăng oxy máu không ảnh hưởng đến cung lượng tim ở bệnh nhân nhiễm trùng huyết [72]. Số ngày có PaO2> 120 mmHg là một yếu tố nguy cơ độc lập của viêm phổi liên quan đến thở máy (VAP) [73]; tuy nhiên, những bệnh nhân này có các yếu tố nguy cơ khác, ví dụ: thường xuyên sử dụng thuốc ức chế bơm proton và thuốc an thần, tỷ lệ sốc tuần hoàn cao hơn với tốc độ truyền catecholamine kéo dài và cao hơn, và truyền nhiều hồng cầu hơn. Trong một nghiên cứu quan sát trên bệnh nhân VAP, cùng một nhóm báo cáo rằng tăng oxy máu không ảnh hưởng đến tỷ lệ tử vong [74]. HYPER2S RCT [75] so sánh liệu pháp tiêu chuẩn với 100% O2 trong 24 giờ đầu tiên sau khi chẩn đoán sốc nhiễm trùng. Mặc dù điểm SOFA thấp hơn đáng kể ở ngày thứ 7, thử nghiệm đã bị dừng sớm do tỷ lệ tử vong cao hơn, mặc dù không có ý nghĩa thống kê ở nhóm tăng oxy ở Ngày 28 và Ngày 90. Nhóm tăng oxy hóa có các tác dụng phụ nghiêm trọng hơn đáng kể, bao gồm cả điểm yếu mắc phải do ICU (p = 0,06). Một phân tích hậu kỳ dựa trên tiêu chuẩn Sepsis-3 cho thấy tỷ lệ tử vong ngày 28 tăng ở bệnh nhân tăng lactat huyết> 2 mmol/L (p = 0,054), nhưng không tăng với mức lactate bình thường [76]. Các tác giả suy đoán rằng sự gia tăng liên quan đến tăng oxy máu liên quan đến khả năng cung cấp O2 trong mô có thể dẫn đến sản xuất ROS dư thừa và do đó, gây tổn thương mô liên quan đến stress oxy hóa.
Giả thuyết ngược lại, tức là làm giảm tổn thương mô do stress oxy hóa bằng cách giảm tiếp xúc với O2 cũng không ảnh hưởng có lợi đến kết quả ở bệnh nhân nhiễm trùng. Một phân tích hậu kỳ về thử nghiệm ICU-ROX [40] của nhóm thuần tập nhiễm trùng cho thấy không có sự khác biệt có ý nghĩa thống kê đối với những ngày không thở máy hoặc tử vong ngày 90 ở nhóm “bảo tồn” khi so sánh với thở ôxy “thông thường” [77] . Các ước tính điểm về hiệu quả điều trị thậm chí còn được ưu tiên hơn cả. Do đó, có vẻ hợp lý để tránh PaO2> 100-120 mmHg do những hậu quả có thể có của nồng độ O2 trong mô dư thừa khi có sự suy giảm liên quan đến nhiễm trùng huyết của quá trình khai thác O2 tế bào [78].
Chấn thương sọ não cấp tính
Tăng FIO2 ở bệnh nhân chấn thương não cấp tính, cùng với các can thiệp lâm sàng khác [79], có thể cải thiện PO2 (PbtO2) mô não [80, 81]. Ảnh hưởng của tăng oxy máu áp suất bình thường ít có ý nghĩa hơn ở các vùng não lớn giảm tưới máu [82], nhưng lại có liên quan nhiều ở các vùng nhu động nhỏ [83]. Hơn nữa, FIO2 gia tăng làm tăng độc tính trên não trong chấn thương sọ não nặng (TBI) [84]. Mối liên quan của tăng oxy máu với kết cục thậm chí còn gây tranh cãi. Sau khi bị TBI, cả giảm oxy máu và tăng oxy máu [85] hoặc không [86] có liên quan độc lập với kết cục xấu hơn. Trong hai nghiên cứu hồi cứu, bao gồm một quần thể hỗn hợp bệnh nhân chấn thương não, tăng oxy máu, được định nghĩa là PaO2> 300 mmHg [87] hoặc> 120 mmHg [88], có liên quan đến tăng tỷ lệ tử vong trong bệnh viện và kết cục thần kinh kém, ngay cả sau khi điều chỉnh cho những yếu tố gây nhiễu. Bệnh nhân xuất huyết dưới nhện tiếp xúc với mức PaO2 cao hơn cũng có nhiều khả năng bị co thắt mạch não hơn [89, 90]; tuy nhiên, một phân tích hồi cứu bệnh nhân cần thở máy không tìm thấy bất kỳ mối liên quan nào giữa PaO2 tính theo thời gian và kết quả [91]. Các nghiên cứu về đột quỵ do thiếu máu cục bộ cấp tính nói chung [92], và trong một nhóm nhỏ cần thở máy [93], không tìm thấy mối liên quan giữa kết cục và PaO2 trong vòng 24 giờ đầu tiên. Ngay cả tình trạng tăng oxy máu sớm (PaO2> 300 mmHg) cũng không ảnh hưởng đến tỷ lệ tử vong ở bệnh nhân TBI thở máy, bất chấp mức độ nghiêm trọng khi nhập viện [94, 95]. Cuối cùng, PaO2≈150-250 mmHg trong vòng 24 giờ đầu tiên sau TBI có liên quan đến kết quả chức năng lâu dài tốt hơn sau TBI [96]; tuy nhiên, nghiên cứu đã loại trừ bệnh nhân đã chết. Tăng oxy máu áp suất bình thường kết hợp với tiêu huyết khối tĩnh mạch có liên quan đến kết quả thần kinh thuận lợi hơn so với tiêu huyết khối đơn thuần sau đột quỵ do thiếu máu cục bộ [97].
Các nghiên cứu tiền cứu đã đánh giá tác dụng của tăng oxy máu có mục tiêu sau chấn thương não cấp tính: Các nghiên cứu nhỏ ở bệnh nhân đột quỵ thiếu máu cục bộ cấp tính không đủ điều kiện để làm tan huyết khối cho thấy cải thiện lâm sàng thoáng qua và kích thước ổ nhồi máu nhỏ hơn với O2 lưu lượng cao [98, 99] hoặc không có tác dụng của tăng oxy máu áp suất bình thường [100]. Trong một RCT nhỏ ở bệnh nhân TBI được thở máy, FIO2 = 0,8 (so với 0,5) cải thiện kết cục thần kinh 6 tháng [101], nhưng kết luận nên được thận trọng do lo ngại về phương pháp. Tiếp xúc với FIO2 = 0,7 hoặc 0,4 trong tối đa 14 ngày sau khi TBI không ảnh hưởng đến các dấu hiệu của căng thẳng oxy hóa hoặc viêm cũng như kết quả thần kinh [102]. Cuối cùng, Thử nghiệm Oxy Trị liệu bình áp trong Thiếu máu não Đột quỵ cấp (NCT00414726) đã bị tạm dừng sớm sau khi đưa vào 85/240 bệnh nhân vì tỷ lệ tử vong cao hơn trong nhóm O2 lưu lượng cao, mặc dù hầu hết các trường hợp tử vong xảy ra sau khi ngừng thuốc sớm. hỗ trợ sự sống.
Nó vẫn còn mở trong chấn thương não cấp tính, cho dù chứng tăng oxy máu và tăng oxy máu có mục tiêu có ảnh hưởng đến chức năng não và phục hồi thần kinh hay không. Các mục tiêu PaO2 tối ưu, quần thể nghiên cứu và các dạng chấn thương não cụ thể hiện vẫn chưa được biết.
Chấn thương và xuất huyết
Bổ sung được sử dụng vì việc tăng lượng O2 hòa tan vật lý trong quá trình giảm vận chuyển O2 do mất máu liên quan đến việc giảm vận chuyển O2 được cho là có thể trả nợ O2 ở mô nhanh hơn [103]. Mặc dù có đặc tính co mạch [6,7,8], thông khí với 100% O2 trong quá trình xuất huyết thực nghiệm đã cải thiện PO2 của mô [104] và rối loạn chức năng cơ quan giảm độc lực [105, 106]. Tuy nhiên, PaO2> 100 mmHg có thể tăng cường sự hình thành ROS [9,10,11], đặc biệt là trong quá trình I/R và/hoặc tình trạng thiếu oxy/tái oxy hóa, ví dụ: hồi sức sau chấn thương và xuất huyết [6,7,8].
Một nghiên cứu hồi cứu gần đây trên những bệnh nhân được gây mê khẩn cấp trước khi nhập viện đã chứng minh rằng tình trạng tăng oxy máu xuất hiện ở hầu hết bệnh nhân khi đến bệnh viện, tuy nhiên không liên quan đến kết cục [107]. Dữ liệu lâm sàng về tác động của tăng oxy máu đối với tỷ lệ mắc bệnh và tử vong vẫn không rõ ràng. Không thấy mối liên quan nào giữa tỷ lệ tử vong và PaO2 trong 24 giờ đầu tiên (Điểm mức độ nghiêm trọng thương tật trung bình ISS = 29) [108]. Một nghiên cứu quan sát khác ghi nhận rằng 44,5% bệnh nhân thở máy trong khoa cấp cứu bị tăng oxy máu, nhóm thuần tập này có tỷ lệ tử vong ngày 28 cao hơn [109]. Từ một cơ quan đăng ký chấn thương ở Pháp (ISS trung bình = 16), phân tích đơn biến cho thấy rằng PaO2 nhập viện> 150 mmHg trùng với tỷ lệ tử vong cao hơn, tuy nhiên, việc so khớp điểm xu hướng mang lại kết quả ngược lại, cụ thể là mức PaO2 siêu sinh lý có liên quan đến tỷ lệ tử vong thấp hơn đáng kể [ 110]. Tỷ lệ tử vong ngày 28 thấp hơn và ít viêm phổi bệnh viện hơn được thấy ở những bệnh nhân sớm sau chấn thương ngực thẳng [111]. Một phân tích trên 864.340 bệnh nhân chấn thương (ISS trung bình = 9) đã điều tra tác động của O2 bổ sung trong ED; trong cả ba loại bệnh nhân được xác định trước theo SpO2 tăng dần, O2 bổ sung có liên quan đến tỷ lệ mắc và tử vong do ARDS cao hơn đáng kể [112]. Một phân tích hồi cứu bệnh nhân có ISS ≥ 16 đã nghiên cứu tác động của PaO2 ≥ 300 mmHg trong quá trình hồi sức [113]; trong khi thời gian nằm ICU kéo dài được thấy ở những bệnh nhân không được đặt nội khí quản trong ED, không có tác dụng nào được thấy ở nhóm bệnh nhân nặng hơn của những bệnh nhân thở máy. Cuối cùng, một nghiên cứu đa trung tâm hồi cứu về bệnh nhân chấn thương cho thấy SpO2> 96% trong bảy ngày đầu tiên là phổ biến; nguy cơ tử vong được điều chỉnh cao hơn với FIO2 lớn hơn [114]. Hiện đang tuyển dụng “Chiến lược-Tránh-dư thừa-oxy-cho-bệnh nhân nghiêm trọng-bệnh tật- chấn thương (SAVE-O2)” (NCT04534959) sẽ giải quyết bất kỳ mối quan hệ nhân quả nào giữa chứng tăng oxy máu và kết cục.
Mặc dù việc bổ sung O2 là thực hành phổ biến ở những bệnh nhân bị mất máu rõ rệt, không có mục tiêu tối ưu cho PaO2.
Hồi sinh tim phổi và nhồi máu cơ tim
Trong thời gian ngừng tim, PbtO2 giảm nhanh chóng đến mức gần bằng không [115]. Với hồi sức tim phổi (CPR), PbtO2 tăng chậm, do áp lực tưới máu não đạt được [116]. Các hướng dẫn khuyến nghị thông khí với 100% O2 mặc dù chưa có nghiên cứu lâm sàng nào so sánh điều này với FIO2 thấp hơn [117]. Dữ liệu quan sát cho thấy mối liên quan giữa PaO2 cao hơn trong quá trình hô hấp nhân tạo và khả năng trở lại của tuần hoàn tự phát (ROSC), khả năng sống sót và kết cục thần kinh cao hơn [118, 119]. Sau khi ROSC nồng độ PO2 trong máu và não tăng lên; hầu hết, điều này dường như không thể tránh khỏi vì không thể chuẩn độ FIO2 trong quá trình hô hấp nhân tạo [120]. Do mối liên hệ giữa tăng oxy máu và sự hình thành ROS, người ta rất quan tâm đến việc đánh giá xem việc tránh tăng oxy máu trong giai đoạn sau bắt giữ có thể giảm thiểu chấn thương não hay không. Các kết quả mâu thuẫn nhau, hoặc cho thấy mối liên quan giữa tăng oxy và kết cục kém [68,121,122,123,124], hoặc không [125,126,127,128,129]. Các thử nghiệm ngẫu nhiên nhỏ hơn và phân tích nhóm nhỏ từ các thử nghiệm lớn hơn cũng đã được thực hiện [130]. Nhìn chung, bằng chứng cho thấy rằng các mục tiêu O2 thấp hơn chứ không phải cao hơn đều có lợi, mặc dù bất kỳ điểm ngọt nào cho PaO2 tối ưu vẫn chưa được biết [131]. Thử nghiệm thí điểm COMACARE so sánh các mục tiêu PaO2 khác nhau và không tìm thấy sự khác biệt trong hai dấu ấn sinh học chấn thương não [132, 133]. Một phân tích nhóm phụ của nghiên cứu ICU-ROX cho thấy kết quả cải thiện ở những bệnh nhân hạn chế so với những bệnh nhân được điều trị bằng O2 tự do có nguy cơ chấn thương não do thiếu oxy [134]. Các phát hiện trái ngược được thấy trong một nhóm phụ của thử nghiệm HOT-ICU [64]. Các nguyên tắc hiện tại khuyên bạn nên nhắm mục tiêu oxy máu bình thường. Bằng chứng cho thấy một dấu hiệu có hại và quan trọng là không có dấu hiệu có lợi từ tăng oxy máu; do đó, điều này nên tránh [135].
Sử dụng O2 bổ sung đã được thực hành tiêu chuẩn trong nhiều thập kỷ trong nhồi máu cơ tim cấp tính (AMI) [136]. Các nghiên cứu vẫn đề xuất các tác dụng phụ bao gồm co mạch vành [137]. Một số nghiên cứu lớn đã chỉ ra tác hại hoặc thiếu lợi ích từ việc sử dụng bổ sung O2 ở những bệnh nhân không bị giảm oxy máu [138, 139]. Một thử nghiệm nhóm lớn ngẫu nhiên có đối chứng với> 40.000 bệnh nhân hội chứng vành cấp (bao gồm cả bệnh nhân AMI) không tìm thấy lợi ích khi sử dụng O2 bổ sung nói chung, nhưng bằng chứng không thuyết phục ở bệnh nhân AMI có ST chênh lên [140]. Điều quan trọng là những thử nghiệm này bao gồm những bệnh nhân không bị giảm oxy máu [138, 140]. Mặc dù thiếu bằng chứng chất lượng cao, nhưng cần thận trọng để tránh giảm oxy máu (SaO2 <90%) ở bệnh nhân AMI.
Tăng oxy chu phẫu
Các thử nghiệm điều trị tăng oxy trong phẫu thuật chủ yếu được thực hiện trong phẫu thuật tự chọn để ngăn ngừa nhiễm trùng vết mổ thông qua việc tăng oxy hóa mô [141, 142]. Sự nhiệt tình ban đầu được theo sau bởi các thử nghiệm lớn hơn với tần suất biến chứng vết thương tương tự với FiO2 = 0,80 so với 0,30 chu phẫu [143, 144]. Mối quan tâm đã được nâng cao bởi thời gian sống không bị ung thư ngắn hơn ở những bệnh nhân được cung cấp FiO2 = 0,80 [145, 146]. FIO2 cao hơn được sử dụng để đảm bảo đủ hoặc trong một số trường hợp, oxy hóa nội tạng cao hơn mức bình thường, mặc dù có rất ít bằng chứng về lợi ích.
Cả quá trình oxy hóa trước và FIO2 cao trong mổ đều có thể gây xẹp phổi tái hấp thu [147], đặc biệt ở những bệnh nhân mắc bệnh kèm theo phổi, vì bản thân gây mê toàn thân làm giảm dung tích cặn chức năng và gây đóng đường thở [148]. Vì sự không phù hợp thông khí-tưới máu và shunt góp phần làm suy giảm oxy, do đó sử dụng FIO2 = 0,30–0,35 được coi là bình thường trong khi gây mê toàn thân [149, 150]. FIO2 ≥ 0,80 gây ra xẹp phổi đáng kể trong quá trình tiền oxy hóa, nhưng điều này có thể được loại bỏ bằng cách điều động tuyển dụng sau đó là 5-10 cmH2O PEEP [14], điều này rõ ràng là không phổ biến. Nếu không điều chỉnh được tình trạng xẹp phổi như vậy có thể gây ra việc sử dụng quá nhiều FIO2 chu phẫu. Trong một nghiên cứu quan sát lớn [151], FIO2 cao trong mổ phụ thuộc vào liều lượng có liên quan đến các biến chứng phổi lớn và tử vong sau khi điều chỉnh tất cả các yếu tố nguy cơ liên quan. Mối liên quan này vẫn chưa được xác nhận trong RCTs [152].
Dựa trên phân tích nhóm phụ trong một tổng quan hệ thống, Tổ chức Y tế Thế giới đề xuất sử dụng FIO2 = 0,80 ở tất cả bệnh nhân được đặt nội khí quản để ngăn ngừa nhiễm trùng vết mổ sau mổ [153]. Điều này đã gây ra cuộc thảo luận gây tranh cãi [154, 155]. Hầu hết các bằng chứng về rủi ro và lợi ích của tăng oxy máu trong khi phẫu thuật cấp cứu phát sinh từ RCT của 385 thủ thuật mổ mở ổ bụng và 210 ca mổ ruột thừa [143, 156]. Trong khi nhiễm trùng vết mổ giảm đáng kể với FIO2 = 0,80 trong nghiên cứu cắt ruột thừa, tần suất nhiễm trùng vết mổ, các tác dụng phụ nghiêm trọng và tỷ lệ tử vong không khác nhau trong thử nghiệm phẫu thuật mở bụng [156, 157].
Bệnh nhân cấp tính chu phẫu cần được điều trị cẩn thận liên quan đến tình trạng bệnh lý đang diễn ra của họ; hầu hết các bằng chứng hiện tại cho thấy sự an toàn cao nhất với phép chuẩn độ O2 thành oxy máu bình thường.
Kết luận
Các bằng chứng hiện tại cho thấy PaO2> 300mmmHg nên tránh ở hầu hết bệnh nhân ICU. Vẫn chưa chắc chắn liệu có mục tiêu PaO2 “điểm tốt nhất” hay không, mục tiêu này có thể thay đổi đối với các tình trạng lâm sàng nhất định. Đánh giá hệ thống bằng cách sử dụng phân tích tuần tự thử nghiệm để xem xét nguy cơ sai lệch cao so với thấp không tìm thấy tác dụng (bao gồm tất cả bệnh nhân [39]) hoặc tăng tỷ lệ tử vong (chỉ bao gồm bệnh nhân ICU [157]) từ các mục tiêu oxy cao hơn. Bằng chứng chắc chắn là thấp với khả năng tăng nguy cơ tử vong tương đối lên 15%. Hiện đang tuyển dụng “Mega-Randomized-Registry-Trial-Comparing-Conservative-vs- Liberal-Oxygenation (thử nghiệm Mega-ROX)” (CTG1920-01) trong 40.000 bệnh nhân sẽ cung cấp bất kỳ “PaO2 mục tiêu lý tưởng” nào: Thử nghiệm kiểm tra giả thuyết rằng mục tiêu bảo tồn so với mục tiêu O2 tự do làm giảm tỷ lệ tử vong 1,5% ở bệnh nhân ICU người lớn, được thở máy, tức là cứ 100.000 bệnh nhân được điều trị thì có 1.500 người được cứu sống. Vì cả liệu pháp O2 tự do và bảo tồn có thể là tốt nhất cho một số bệnh nhân nhất định, một số thử nghiệm song song sẽ đánh giá các giả thuyết được chỉ định trước ở các bệnh nhân thuần tập cụ thể kèm theo các tính toán công suất riêng biệt. Ví dụ, dự đoán sự không đồng nhất của đáp ứng điều trị, ở bệnh nhân nhiễm trùng huyết hoặc bệnh nhân có bệnh lý não cấp tính (trừ chấn thương não do thiếu oxy), thử nghiệm sẽ kiểm tra giả thuyết ngược lại rằng O2 tự do (chứ không phải bảo tồn) sẽ làm giảm tỷ lệ tử vong. Cuối cùng, thiết kế thử nghiệm không thể loại trừ rằng đối với một số phân nhóm bệnh nhân, một cửa sổ tiếp xúc O2 khác là phù hợp nhất.
Cho đến nay, cần thận trọng khi nhắm mục tiêu các giá trị PaO2 trong giới hạn bình thường, tức là chuẩn độ PaO2 cẩn thận để tránh cả giảm oxy máu và tăng oxy máu quá mức [158], đặc biệt là không có dấu hiệu sinh học hữu ích về mặt lâm sàng của độc tính O2 và dữ liệu về ảnh hưởng của tăng oxy máu đối với các dấu hiệu của ứng suất oxy hóa là tương đương [10, 159,160,161].