Bệnh huyết học
Bệnh não liên quan nhiễm trùng huyết: từ mê sảng đến mất trí nhớ
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Bài viết Bệnh não liên quan nhiễm trùng huyết: từ mê sảng đến mất trí nhớ – Tải file PDF Tại đây.
Dịch: Bs. Hoàng Nam.
Tồng quan: Nhiễm trùng huyết là nguyên nhân chính gây tử vong trong đơn vị chăm sóc đặc biệt trên toàn thế giới. Giai đoạn cấp của nhiễm trùng huyết thường đi kèm bệnh não liên quan nhiễm trùng huyết, làm tăng tỷ lệ tử vong. Hơn nữa, trong giai đoạn mạn, hơn 50% bệnh nhân sống sót mắc phải các bệnh liên quan nhận thức nghiêm trọng và lâu dài ảnh hưởng chất lượng cuộc sống hàng ngày và tăng gánh nặng nặng nề cho người chăm sóc bệnh nhân. Do có nhiều bệnh nhân sống sót sau nhiễm trùng huyết, những bệnh kéo dài ngày càng có liên quan. Mặc dù tỷ lệ mắc cao và lâm sàng phù hợp, cơ chế bệnh sinh của các giai đoạn cấp và mạn tính của bệnh não liên quan nhiễm trùng huyết vẫn chưa được hiểu đầy đủ và chưa có chiến lược điều trị cụ thể. Ở đây, chúng tôi đánh giá bệnh não liên quan nhiễm trùng huyết từ biểu hiện lâm sàng ban đầu đến suy giảm nhận thức lâu dài trên bệnh nhân sống sót qua nhiễm trùng huyết và tóm tắt các cơ chế bệnh học tiềm năng góp phần vào tiến triển của bệnh não liên quan nhiễm trùng huyết.
Từ khóa: nhiễm trùng huyết (NTH), rối loạn chức năng não, SAE (bệnh não liên quan nhiễm trùng huyết), mê sảng, suy giảm nhận thức, sinh lý bệnh, di chứng lâu dài.
Giới thiệu
NTH là bệnh đe dọa tính mạng và gồm nhiều yếu tố với tỷ lệ mắc liên tục tăng trong những thập kỷ qua từ 300 đến 1000 ca NTH trên tổng số 100.000 bệnh nhân mỗi năm tại Hoa Kỳ. Tỷ lệ mắc chung trên thế giới khoảng 31 triệu ca NTH mỗi năm.
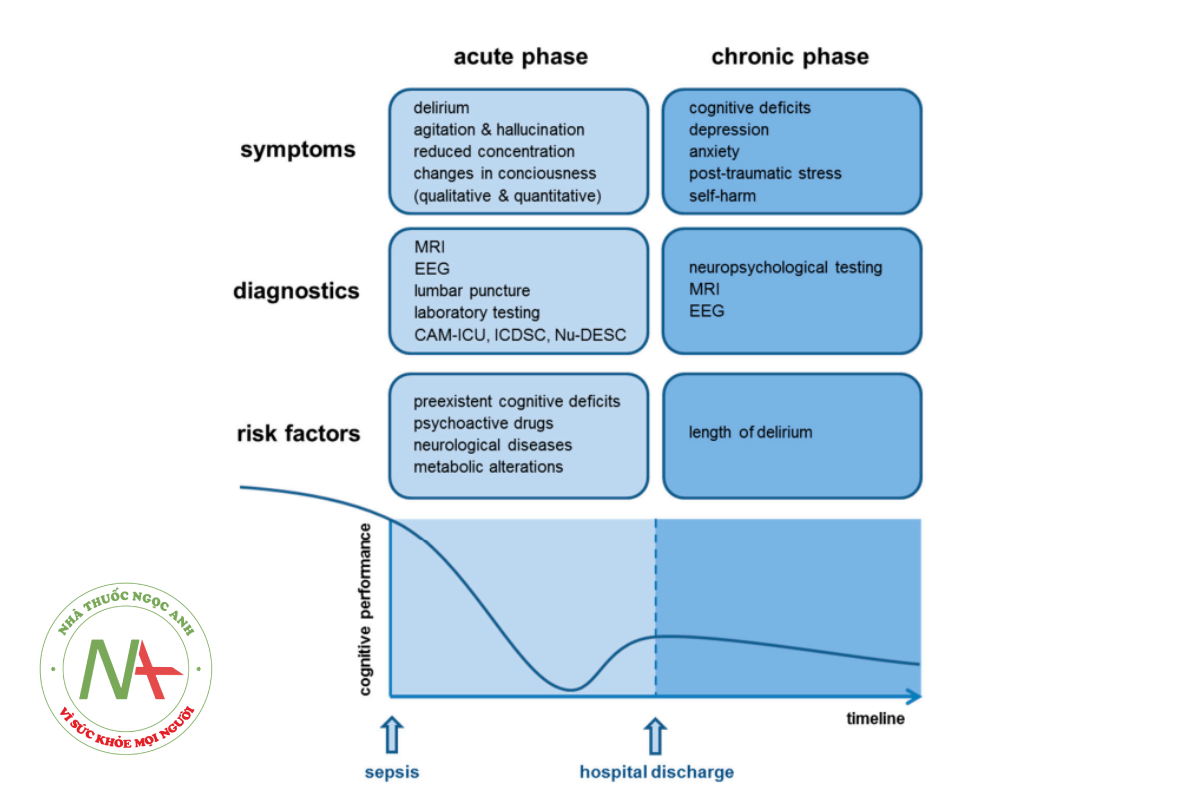
Bệnh não liên quan nhiễm trùng huyết (SAE) là một trong các biến chứng thường gặp nhất trong giai đoạn cấp và giai đoạn sau NTH sống sót. SAE là rối loạn chức năng não khuếch tán do phản ứng của vật chủ bị rối loạn điều hòa và không có nhiễm trùng thần kinh trung ương trực tiếp. Triệu chứng của SAE có thể xuất hiện trước cả khi tiêu chuẩn NTH chẩn đoán đầy đủ. Các triệu chứng trong giai đoạn cấp gồm từ trạng thái mệt mỏi và mê sảng đến hôn mê và có thể làm suy giảm nhận thức lâu dài. Vì SAE là một chẩn đoán loại trừ, các nguyên nhân khác của bệnh não (như thay đổi chuyển hóa, ngộ độc thuốc, tổn thương cấu trúc não, biến chứng mạch máu não, viêm não và tình trạng động kinh không co giật) cần phải loại trừ trên bệnh nhân NTH. Từ quan điểm lâm sàng, diễn tiến của SAE có thể chia làm giai đoạn cấp và mạn tính.
Giai đoạn cấp của SAE – Mê sảng
Giai đoạn cấp của SAE đặc trưng bởi các triệu chứng của mê sảng với những thay đổi cấp (hay bán cấp) trên ý thức của bệnh nhân. Trong số đó, triệu chứng gồm kích động, ảo giác, giảm tập trung và thay đổi chu kỳ thức-ngủ. Dựa trên độ nặng của bệnh, bệnh nhân có thể ngủ gà hoặc thậm chí hôn mê. Các biểu hiện thần kinh và tâm thần tương tự có thể thấy trên bệnh não do bệnh nguyên khác, như bệnh não do suy tạng, nhiễm độc hay thiếu vitamin. Tuy nhiên, trên bệnh não do suy tạng hay thiếu vitamin, một số triệu chứng khác có thể xuất hiện như suy tư thế vận động hoặc mất điều hòa và rối loạn cử động mắt. Bệnh nhân có đặc điểm bệnh não xuất hiện triệu chứng bổ sung như vậy nên được đánh giá lâm sàng vì có thể chi ra bệnh nguyên do chuyển hóa, như bệnh não gan, tăng ure máu hoặc thiếu vitamin [6,7].
Trong phân tích hồi cứu gần đây của lượng lớn cơ sở dữ liệu đa trung tâm, tỷ lệ mắc bệnh não liên quan NTH cao hơn trên bệnh nhân NTH có suy giảm nhận thức từ trước, sử dụng lâu dài các thuốc gây tác động thần kinh, bệnh thần kinh và thay đổi chuyển hóa trong NTH (như hạ đường huyết, tăng đường huyết, tăng anhidric cacbonic máu, hạ natri máu) [8]. Tuy nhiên, nghiên cứu này có những giới hạn, bao gồm định nghĩa của SAE, dựa trên thang điểm hôn mê của bệnh nhân (GCS) khi nhập ICU. Do đó, không thể đưa ra một định nghĩa rõ ràng về mối quan hệ giữa tiến triển SAE và các yếu tố nguy cơ có thể xảy ra [8].
Những nghiên cứu trước đây gợi ý mối liên quan giữa SAE và tỷ lệ tử vong trên bệnh nhân NTH bằng cách nhấn mạnh tỷ lệ tử vong >60% ở những bệnh nhân này [9]. Thậm chí thay đổi nhỏ về tình trạng tâm thần (GCS từ 13-14) dường như cũng có khả năng tiên lượng kết cục xấu hơn trong NTH [8]. Mê sảng do SAE tương quan với tiến triển rối loạn nhận thức kéo dài sau khi xuất viện [10-13]. Cần lưu ý là cho đến nay, độ dài cơn mê sảng là yếu tố nguy cơ duy nhất đã được chứng minh trong tiến triển rối loạn chức năng nhận thức kéo dài và cũng có thể liên quan giảm thể tích não [10,12,14,15]. Đối lập với điều này, thở máy, giảm oxy máu, thuốc an thần, hạ huyết áp trong phẫu thuật và sử dụng thuốc giảm đau lại không liên quan đến rối loạn chức năng nhận thức kéo dài [16-20]. Tuy nhiên, hầu hết các nghiên cứu đề cập trước đây đều không phân biệt giữa những người sống sót sau NTH và những người sống sót sau bệnh nguy kịch nói chung. Do đó, không có tuyên bố sau cùng được thống nhất về các yếu tố nguy cơ chính xác góp phần vào kết cục giảm nhận thức thần kinh trên bệnh nhân NTH.
=> Đọc thêm: Xuất huyết dưới màng cứng là gì? Nguyên nhân? Triệu chứng? Điều trị?.
Giai đoạn mạn của SAE – mất trí nhớ
Do tỷ lệ mắc NTH ngày càng tăng và tỷ lệ tử vong giảm, số người sống sót sau NTH tăng dần đều. Ngoài ra, khả năng sống sót sau NTH thường đi kèm suy giảm nhận thức kéo dài [21-24]. Hơn 1/2 bệnh nhân sống sót sau NTH bị rối loạn nhận thức chủ yếu về trí nhớ nói chung, khả năng chú ý, lời nói lưu loát và chức năng kiểm soát hành vi sau xuất viện [14]. Một tỷ lệ lớn bệnh nhân rối loạn chức năng nhận thức thậm chí có thể đưa đến Alzheimer nhẹ (suy giảm nhận thức nhẹ, MCI) [15]. Ngoài rối loạn chức năng nhận thức, tỷ lệ mắc các rối loạn tâm thần như trầm cảm, lo âu, rố loạn căng thẳng sau chấn thương và có xu hướng tự làm đau bản thân trên những người NTH thì cao hơn dân số chung [25,26]. Do đó, tương tự các bệnh nhân sống sót sau bệnh nguy kịch, bệnh nhân sống sót sau NTH giảm chất lượng sống rõ rệt [27]. Mặc dù đã hiểu rõ các hậu quả lâu dài của NTH, cho đến nay vẫn chưa có điều trị hay đề xuất điều trị trong các hướng dẫn lâm sàng.
Hơn nữa, rối loạn nhận thức thần kinh và di chứng lâu dài sau bệnh hiểm nghèo gây ra gánh năng lớn cho hệ thống chăm sóc sức khỏe vì chi phí kinh tế xã hội cao [28]. Những chi phí này tăng do tăng nguy cơ nhập viện nhiều lần, phải ở trong viện dưỡng lão, giảm khả năng làm việc của những người thân chăm sóc và tử vong sớm [22,29,30].
Dịch tễ
SAE là nguyên nhân thường gặp nhất gây bệnh não trong ICU trên toàn thế giới [3], gây tử vong hơn 50% trong quá trình nhiễm trùng huyết [8,9]. Người ta chứng minh du khuẩn làm tăng tỷ lệ SAE lên 70%. Bệnh nhân suy thận, suy gan hay suy đa cơ quan thường bị ảnh hưởng hơn bệnh nhân nhiễm trùng huyết không có biến chứng cơ quan khác [9]. Tỷ lệ tử vong trên bệnh nhân nhiễm trùng huyết có SAE tăng từ 26% đến 49% và liên quan giá trị cao hơn của GCS, đánh giá suy cơ quan tiến triển (SOFA) và thang điểm APACHE II [8,31,32].
Khi xuất viện, hầu hết 45% bệnh nhân sống sót sau nhiễm trùng huyết có triệu chứng rối loạn chức năng nhận thức kéo dài [15]. Tuy nlúên, một đánh giá chính xác về tỷ lệ mắc , sự phổ biến và tỷ lệ tử vong bị hạn chế do thiếu định nghĩa tiêu chuẩn chẩn đoán SAE trong các nghiên cứu này và dựa vào biểu hiện lâm sàng của SAE. Cầncó nghiên cứu đoàn hệ theo thờigian để làm sáng tỏ định nghĩa SAE nhằm giải đáp các bất ổn hiện nay.
Sinh lý bệnh
Theo định nghĩa SAE, nhiễm trùng hệ thần kinh trung ương cấp tính phải được loại trừ khi muốn chẩn đoán SAE. Dó đó, SAE được xem như hậu quả của phản ứng vật chủ bị rối loạn điều hòa do nhiễm trùng thần kinh nặng. Cho đến nay, sinh lý bệnh và cơ chế phân tử cơ bản dẫn đến SAE chưa hoàn toàn hiểu rõ. Bệnh căn của SAE do nhiều yếu tố và một số cơ chế gây bệnh có thể xảy ra song song nhau, tác động lẫn nhau và đóng góp mức độ khác nhau trong tiến tricn SAE [3]. Những yếu tố này có thể là tổn thương thiếu máu cục bộ/xuất huyết, tổn thương hàng rào máu não (BBB), quá trình viêm thần kinh, như kích hoạt microglia và astrogliosis, những thay đổi trong mật độ cột sống tiếp hợp thần kinh và rối loạn chức năng chất dẫn truyền thần kinh (Hình 1). Không có yếu tố nào trong số này bắt buộc gây SAE.
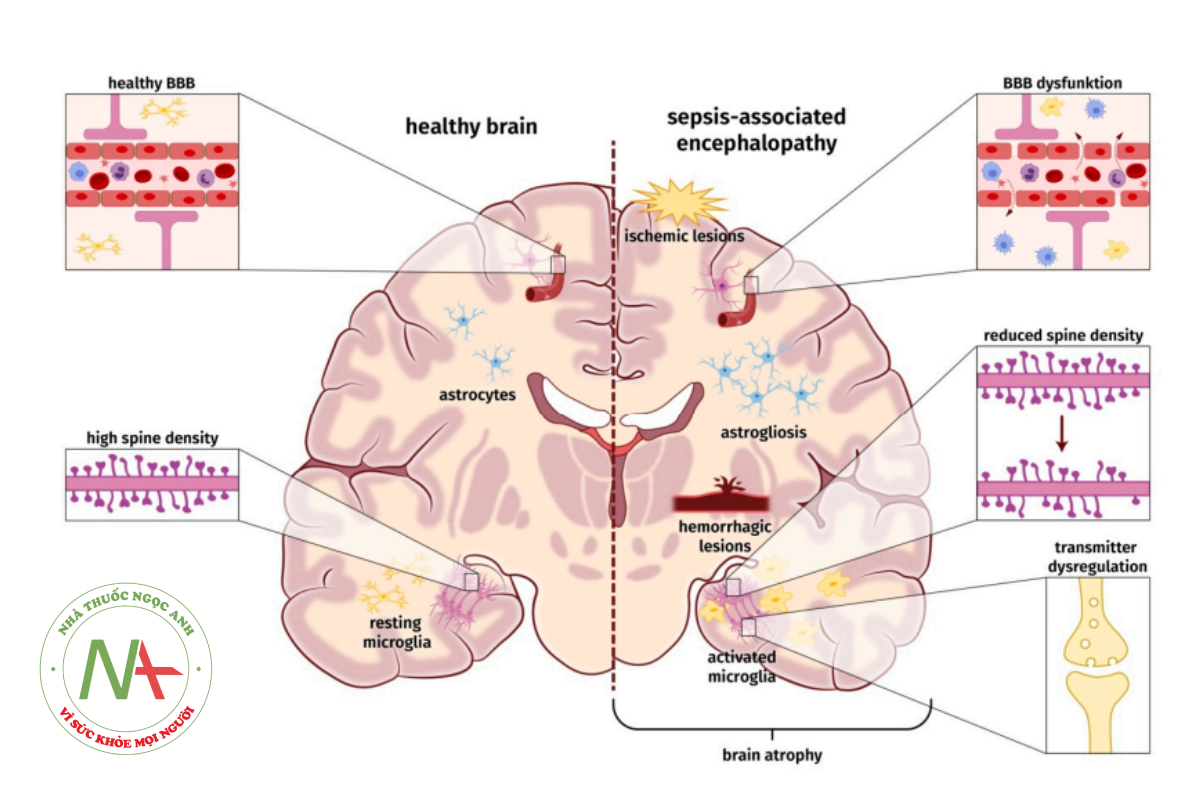
Tổn thương não do thiếu máu cục bộ và xuất huyết
Nhiễm trùng huyết làm suy giảm cả tuần hoàn lớn và vi tuần hoàn trong não. Hình chụp MRI phân tích sau khi khám nghiệm tử thi bệnh nhân nhiễm trùng huyết và trên động vật xác định các vùng lớn và rất nhỏ do tổn thương thiếu máu cục bộ và xuất huyết [33,34]. Các đợt hạ huyết áp lúc nhiễm trùng huyết và shock nhiễm trùng dẫn đến giảm tưới máu não – đã được chi ra trong nhiều nghiên cứu lâm sàng [35,36]. Ngoài ra, rối loạn hoạt động hệ mạch máu và rối loạn tự điều hòa động mạch não cũng góp phần giảm tưới máu não [35,37]. về mặt sinh lý, cơ chế tự điều hòa não kiểm soát tưới máu não liên tục bằng cách điều chinh co động mạch não. Rối loạn chức năng nội mô khi bị nhiễm trùng huyết làm máu đến não không ổn định, đặc biệt khi huyết áp dao động. Gần 50% bệnh nhân nhiễm trùng huyết có SAE bị rối loạn tự điều hòa [38].
Tuy nhiên, giới hạn của nghiên cứu này là đánh giá tưới máu ở động mạch trong não, trong khi các rối loạn trong vi tuần hoàn không được đánh giá [38]. Những nghiên cứu gần đây trên cừu cho thấy vi tuần hoàn não giảm khi bị shock nhiễm trùng huyết làm giảm oxy não [39]. Ngoài ra, rối loạn đông máu có thể góp phần làm tắc nghẽn mao mạch, dẫn đến thiếu oxy thần kinh và chết tế bào theo chương trình [40].
Suy giảm hàng rào máu – não và viêm thần kinh
Trong tình trạng sinh lý, hàng rào máu não duy trì môi trường ngoại bào liên tục cho phép chức năng thần kinh diễn ra bình thường [41,42]. Hàng rào máu não gồm các tế bào nội mô, tế bào hình sao, pericyte (tế bào chất nền ngoại bào bao quanh mao mạch) tạo nên một đường phân chia rõ ràng giữa nhu mô não và tuần hoàn não [41]. Nhiễm trùng huyết làm giảm đáp ứng tự điều hòa của vật chủ, các cytokine tiền viêm như TNF-Ơ và IL-1P, sẽ kích hoạt các tế bào nội mô. Dan đến sản xuất các loại oxy phản ứng (ROS) và sẽ làm tăng tính thấm nội mô [40,43]. Ngoài ra, hoạt hóa tế bào nội mô tạo điều kiện biểu hiện các protein kết dính. Những protein này tạo điều kiện cho cho các tế bào miễn dịch hoạt hóa thông qua hàng rào máu não bị suy giảm đi vào hệ thần kinh trung ương (CNS) [41,44]. Do tăng giải phóng các loại oxy phản ứng (ROS) cũng gây tổn hại các đại phân tử của hàng rào máu não, làm rối loạn chức năng ty thể và kích hoạt enzym matrixmetalloproteases (MMPs). Hậu quả là suy giảm hàng rào máu não và các tế bào thường trú trong não như tế bào hình sao và microglia (tế bào thần kinh) có thể bị kích hoạt. Tế bào thần kinh giữ vai trò đảm bảo cân bằng nội mô trong não [45]. Trong tình trạng sinh lý, tế bào hình sao làm trung gian cho hàng loạt các chức năng điều hòa quan trọng trong hệ thần kinh trung ương (CNS), gồm điều hòa trương lực, chuyển hóa các chất dẫn truyền thần kinh, cân bằng dịch, tạo tế bào thần kinh mới và duy trì tính mềm dẻo của synap [46]. Sau này việc tiết tế bào hình sao có thể kiểm soát các yếu tố điều chỉnh synape, như hevin, SPARC và TNF-Ơ [47-49]. Các nghiên cứu thực nghiệm đều mô tả một cách nhất quán hoạt hóa tế bào hình sao làm rối loạn tự điều hòa đáp ứng miễn dịch trong đợt SAE [4,45]. Các tế bào này giải phóng các chất trung gian tiền viêm và ROS làm trầm trọng thêm sự suy giảm hàng rào máu não. Tại những khu vực riêng biệt, gọi là các cơ quan quanh não thất, hàng rào máu não bị rò rỉ sinh lý và tạo điều kiện thuận lợi vượt qua các cytokine để vào hệ thàn kinh trung ương (CNS).
Microglia là tế bào đơn nhân thường trú trong não của hệ thống miễn dịch bẩm sinh, đóng vai trò quan trọng bảo vệ não tránh tổn thương tế bào thần kinh. Trong trạng thái nghỉ, microglia giữ vai trò sinh lý cần thiết, có chức năng giám sát không viêm và điều hòa các gai tiếp hợp trong quá trình phát triển và cũng tham gia vào điều chinh tính mềm dẻo của synape [50,51]. Microglia hoạt hóa trong đợt nhiễm trùng huyết và có thể góp phần làm chức năng thần kinh không ổn định và mất gai đuôi trong tế bào thần kinh hình tháp hồi hải mã [52-54]. Ngày càng có nhiều bằng chứng chi ra hoạt hóa microglia có thể do sự vận chuyển các tế bào đơn nhân ngoại vi tránh hàng rào máu não và làm hoạt hóa lâu dài microglia thường trú sau khi NTH [55,56].
Rối loạn điều hòa chất dân truyền thần kinh
Nhiều chất dẫn truyền thần kinh được nói đến là góp phần phát triển và duy trì SAE. Hầu hết nghiên cứu đến nay đều làm nổi bật sự rối loạn điều hòa con đường cholinergic, nhưng các nghiên cứu thực nghiệm cũng cho thấy các tổn hại trên con đường acid gamma-aminobutyric, norepinephrine, serotonin và dopamine [57,58]. Sự phóng thích cytokine ồ ạt trong nhiễm trùng huyết có thể gây ra rối loạn điều hòa dẫn truyền thần kinh trong nhiễm trùng huyết thực nghiệm [59]. Nhờ kết quả của các nghiên cứu thực nghiệm và các quan sát từ thực tiễn lâm sàng cho thấy thuốc kháng cholinergic làm trầm trọng thêm tình trạng mê sảng [60], người ta đã công nhận con đường tác động cholinergic có thể gây mê sảng trên bệnh nhân năng [57]. Tuy nhiên, một nghiên cứu mù đôi có đối chứng giả dược cho thấy điều trị bệnh nhân ICU bằng rivastigmine – một thuốc ức chế cholinesterase – thậm chí làm mê sảng lâu hơn và tăng tỷ lệ tử vong, dẫn đến chấm dứt sớm nghiên cứu [61]. Mặc dù nghiên cứu này không được thiết kế nhằm tìm ra ảnh hưởng của rivastigmine trên bệnh nhân SAE, kết quả cho thấy thuốc ức chế cholinesterase không có lợi ích trên bệnh nhân nhiễm trùng huyết.
Một nghiên cứu trước đây phát hiện ra giảm nồng độ tyrosine, tryptophan và phenylalanine (amino acid cần thiết cho sự tổng hợp chất dẫn truyền thần kinh) trong huyết tương bệnh nhân nhiễm trùng huyết [62]. Tuy nhiên, vẫn chưa rõ những dữ liệu quan sát được ở trên và một phần gây tranh cãi liên quan sự phát triển SAE.
Những phát hiện bệnh thần kinh
Thông tin quan trọng về sinh lý bệnh SAE có thể thu được từ nghiên cứu khám nghiệm tử thi. Khám nghiệm tử thi trên 12 bệnh nhân bệnh não và nhiễm khuẩn cho thấy các vi áp xe não lan tỏa (trong 8 bệnh nhân) và tăng tế bào hình sao và tế bào microglia trong vỏ não (trong 4 bệnh nhân) [63]. Tuy nhiên, cần lưu ý sự tồn tại các áp xe (hay vi áp xe) trong não nên được xem là viêm não nhiễm trùng hơn là SAE. Ngoài ra, nhồi máu não, ban xuất huyết não, xuất huyết nhiều chất trắng nhỏ và phân hủy myelin cầu não trung tâm đã được mô tả [63]. Một phân tích não sau khi khám nghiệm khác trên 23 bệnh nhân tử vong do sốc nhiễm trùng huyết cho thấy xuất huyết (26%), dấu hiệu tăng đông máu (9%), vi áp xe (9%), bệnh não trắng đa ổ hoại tử (9%) và tổn thương thiếu máu cục bộ (100%). Thiếu máu cục bộ tác động phần lớn ở vùng trung tâm tự trị [33]. Một nghiên cứu đoàn hệ theo thời gian bằng khám nghiệm tử thi cho thấy tăng chết tế bào theo chương trình của tế bào thần kinh và thần kinh đệm trong trung tâm tự trị, như nhân trên thị và cận não thất, hạch hạnh nhân não, nhân lục (locus coeruleus) và nhân tự trị tủy. Các tổn thương có thể được kích hoạt bởi tổng hợp NO cảm ứng [64]. Trong phân tích tử thi khác trên 3 bệnh nhân tử vong do sốc nhiễm trùng huyết, các tổn thương rõ rệt của cầu não và tổn thương điển hình của bệnh não trắng hoại tử đa ổ đã được mô tả [65].
Liên quan đến microglia, một nghiên cứu bệnh chứng chi ra sự tăng microglia trong chất xám [53]. Một nghiên cứu tiền cứu sau khi khám nghiệm tử thi cho thấy có tăng CD-68 microglia dương tính trong hạch, hồi hải mã và tiểu não so với những bệnh nhân tử vong do các bệnh khác [66]. Ngược lại, trong nghiên cứu khác sau khi khám nghiệm tử thi, microglia hoạt hóa trong chất trắng rõ rệt hơn chất xám [67].
Phương pháp chẩn đoán
SAE là chẩn đoán loại trừ, một loạt các xét nghiệm chẩn đoán phải được thực hiện để chắc chắc đã loại trừ các bệnh não nguyên phát [5] (hình 2). Vì SAE giai đoạn cấp phát triển trong suốt quá trình bệnh cấp tính và nhiễm trùng, chẩn đoán SAE thường trì hoãn do biến chứng nhiễm trùng huyết (hạ oxy máu, rối loạn điện giải, suy gan và suy thận) hoặc dùng thuốc giảm đau.
Hình ảnh não
Chụp cắt lớp vi tính thường qui (CT) và chụp cộng hưởng từ thường qui (MRI) hầu như sử dụng thường xuyên để khảo sát hình ảnh não. Trên những bệnh nhân nặng, CT não chủ yếu để loại trừ phù não trong não và tổn thương thiếu máu cục bộ hoặc xuất huyết não. Tuy nhiên, ngoại trừ tổn thương xuất huyết não, MRI có độ nhạy cao hơn phát hiện các thương tổn cấu trúc và vì thế ưu tiên chụp hình não [68].
Bất kể triệu chứng nặng. trong 52% bệnh nhân SAE, hình ảnh não không có gì đáng chú ý, đặc biệt trong giai đoạn cấp. Hình ảnh bệnh lý thường không đặc trưng cũng như xuất hiện ở các bệnh lý khác không liên quan nhiễm trùng huyết [4]. Trong nghiên cứu quan sát tiền cứu, MRI trong giai đoạn cấp của SAE xác định tổn thương thiếu máu cục bộ não (29%) – là bệnh lý phổ biến nhất [34]. Những thương tổn này hiển thị trên hình ảnh cộng hưởng từ khuếch tán và phù nhiễm độc tế bào thường gây ra bởi thiếu oxy máu hay phù mạch và có thể suy giảm tuần hoàn (như suy giảm tuần hoàn lớn và tuần hoàn nhỏ) [68]. Ngoài ra, đột quị thiếu máu cục bộ có liên quan độc lập với tăng tỷ lệ tử vong và kết cục thần kinh nghèo nàn [34]. Trong khoảng 21% bệnh nhân nhiễm trùng huyết, bệnh não trắng có thể tìm thấy trên MRI, có thể là dấu hiệu rò rỉ hàng rào máu não [34]. Tuy nhiên trong nghiên cứu này, chi những bệnh nhân được lựa chọn có đầy đủ tiêu chuẩn sốc nhiễm trùng huyết và biểu hiện các triệu chứng thần kinh nặng (hôn mê, mê sảng, rối loạn thần kinh khu trú hoặc co giật) là được đưa vào.
Không có thông tin về những thương tổn phổ biến trên MRI ở bệnh nhân nhiễm trùng huyết đã khỏi hoặc không có triệu chứng thần kinh. Trong vài trường hợp, có thể thấy các dấu hiệu của hội chứng bệnh não sau hồi phụ [69]. Trong một nghiên cứu tiền cứu gần đây hình não trên MRI, những bệnh nhân sống sót sau nhiễm trùng huyết bị teo não toàn bộ hoặc một phần, nổi bật là hồi hải mã lên tới 12 tháng sau xuất viện. Dựa trên kích cỡ mẫu giới hạn, tuyên bố chung về mức độ teo và tần suất của SAE bị hạn chế [12].
Điện não đồ
Một loạt trường hợp và nghiên cứu nhỏ mô tả tần suất thay đổi những bất thường trên điện não đồ (EEG) (dao động từ 12% đến 100%), như sự xuất hiện sóng theta và delta [34,60,70]. Phạm vi cao về bằng chứng bất thường điện não đồ EEG dựa trên kích cỡ mẫu nhỏ và tính không đồng nhất của quần thể nghiên cứu. Những bất thường nghiêm trọng trên EEG qua phóng điện theo chu kỳ và nhịp điệu (như sóng ba pha, hoạt động nhịp delta ngắt quãng phía trước, phóng điện định kỳ nói chung) có thể cho biết SAE năng. Đôi khi ghi nhận phóng điện dạng động kinh, lệch bên theo chu kỳ, lệch độc lập 2 bên [34,60,70,71]. Trên bệnh nhân nhiễm trùng huyết có du khuẩn huyết nhưng không phát hiện dấu hiệu suy giảm nhận thức, 50% trường hợp có thể phát hiện các bất thường trên EEG [70]. Do đó, điện não đồ như là công cụ không xâm lấn hữu hiệu để đánh giá mức độ nghiêm trọng của SAE, bởi vì EEG phản ánh mức độ bệnh não nói chung. Sự vắng mặt của điều biến điện não đồ, sóng nền chiếm ưu thế delta và phóng điện theo chu kỳ có thể là yếu tố tiên lượng độc lập tỷ lệ mắc và cũng có thể liên quan sự xuất hiện mê sảng trên bệnh nhân nhiễm trùng huyết [72,73]. Ngoài ra, co giật xuất hiện trên gần 10%-20% bệnh nhân nhiễm trùng huyết, thường gặp nhất là động kinh không co giật [71,72]. Tại thời điểm này các cơn co giật nên được điều trị bằng thuốc chống co giật, vì chúng làm trầm trọng thêm kết cục ở bệnh nhân nặng [74].
Xét nghiệm dịch não tủy
Đáng ngạc nhiên là có rất ít nghiên cứu đánh giá dấu ấn sinh học dịch não tùy (CSF) liên quan đến chẩn đoán và dự phòng hậu quả lâu dài của SAE. Xét nghiệm dịch não tủy thường quy bị hạn chế để loại trừ các bệnh căn khác của bệnh não, như viêm màng não và viêm não. Các phát hiện trên SAE chi giới hạn ở tăng nhẹ protein như dấu hiệu viêm khu trú của suy hàng rào máu não (BBB) mà không có tổng hợp globulin miễn dịch nội tùy đặc biệt.
Xét nghiệm máu
Do có nhiều biến chứng trên bệnh nhân SAE, xét nghiệm thường quy rất cần thiết, gồm xét nghiệm tế bào máu toàn phần, ion đồ và thông số chức năng cơ quan để phát hiện các yếu tố nguy cơ có thể xảy ra [8]. Cho đến nay không có dấu ấn sinh học để dự phòng hoặc xác định SAE. Trong vài nghiên cứu, có thể phát hiện tăng enolase đặc hiệu thần kinh (NSE) và S100b trong huyết tương lần lượt trên 53% và 42% bệnh nhân nhiễm trùng huyết [75]. S100b là dấu ấn tổn thương tế bào thần kinh đệm, trong khi đó NSE là dấu ấn tổn thương tế bào thần kinh. Nồng độ huyết tương của các dấu ấn này cũng liên quan tổn thương não và suy giảm thần kinh [75,76]. Tuy nhiên, sàng lọc S100b và NSE để chẩn đoán SAE hoặc sử dụng để tiên lượng thì không được khuyến cáo vì các kết quả mâu thuẫn nhau. Các nghiên cứu gần đây chi ra tăng độ nhạy và độ đặc hiệu khi phát hiện tăng sợi thần kinh trung gian (neurofilaments), đặc biệt chuỗi sáng neurofilaments (NFL light chain), trong các đợt SAE [77]. Neurofilaments là những ptotein cấu trúc cần thiết trong các thần kinh chủ yếu nằm ở tế bào chất theo trục. Để đáp ứng với tổn thương thần kinh, nồng độ chuỗi sáng NFL trong huyết tương tăng cũng như dịch não tùy và có thể đo bằng cách công nghệ mảng đơn phân tử (SiMoA) [78]. Đánh giá mức huyết tương trong dịch não tủy của chuỗi sáng NFL hiện nay để chẩn đoán, tiên lượng và theo dõi trong nhiều bệnh thần kinh.[79,80]. Những kết quả đầy hứa hẹn của nồng độ huyết tương chuỗi sáng NFL trong nhiễm trùng huyết và giá trị dự đoán của SAE cần được đánh giá trong tương lai. Sẽ rất thú vị nếu các thay đổi này có liên quan phát triển của rối loạn nhận thức SAE giai đoạn muộn.
Các xét nghiệm sàng lọc mê sảng trong SAE cấp tính
Phát hiện sớm mê sảng cực kỳ quan trọng vì mê sảng có thể là triệu chứng đầu tiên và thậm chí có trước cả tiêu chuẩn nhiễm trùng huyết đầy đủ [3]. Trong điều trị SAE, điều cần thiết là điều trị nhanh và phù hợp nhiễm trùng nền, kiểm soát rối loạn chức năng tạng và những thay đổi chuyển hóa.
Có nhiều xét nghiệm tầm soát sẵn có phát hiện mê sảng dựa trên tình trạng bệnh nhân. Trong đơn vị chăm sóc đặc biệt, hầu như khuyến cáo sử dụng CAM-ICU [81] hoặc bảng kiểm mê sảng chăm sóc đặc biệt (ICDSC) [82]. Độ đặc hiệu của CAM-ICU là 0.97 và độ nhạy là 0.79 [83]. Nếu nghi ngờ mê sảng, ICDSC có thể dùng làm công cụ sàng lọc vì có độ nhạy cao hơn (0.99), CAM-ICU có thể làm thêm để xác định mê sảng [83].
Trên những bệnh nhân ít nặng hơn, phương tiện đánh giá lẫn lộn (CAM) [84] được coi như tiêu chuẩn vàng. Có 2 phiên bản sửa đổi của CAM: 3D-CAM (độ nhạy 0.95; độ đặc hiệu 0.94) [85], được làm trong 3 phút và CAM-S, đánh giá bổ sung độ nhạy mê sảng [86].
Ngoài ra, có thể dùng bảng điểm sàng lọc mê sảng điều dưỡng (Nu-DESC) [87] hay xét nghiệm 4 AT [88] để phát hiện mê sảng. Mặc dù nhiều xét nghiệm tầm soát có sẵn, xét nghiệm mê sảng thường qui trên lâm sàng vẫn không được ứng dụng thường xuyên. Chi có 27% bệnh nhân ICU được tầm soát thường xuyên với công cụ sàng lọc mê sảng được xác nhận [89]. Tỷ lệ này thậm chí thấp hơn cả những bệnh nhân ít nặng hơn trong khu khám bệnh thông thường. Do mê sảng giảm hoạt động có thể bị bỏ qua nếu không được tầm soát thường xuyên, cần phải nâng cao nhận thức và theo dõi chặt chẽ hơn.
Liệu pháp điều trị
Điều trị dùng thuốc
Mặc dù nhiều chiến lược điều tri dùng thuốc được nghiên cứu trong nhiều thập kỷ qua, vẫn không có bằng chứng dựa trên quan điểm điều trị dùng thuốc chứng minh thuyết phục về mê sảng trong SAE [90]. Vì thế, trong lâm sàng thường qui, không có khuyến cáo đặc hiệu được công bố về tiêu chuẩn điều trị bằng thuốc. Cho đến nay, mê sảng có biểu hiện trong giai đoạn cấp SAE chưa rõ ràng, liệu có nên dùng thêm các thuốc như thuốc chống loạn thần [91]. Trong thử nghiệm ngẫu nhiên, mù đôi, có đối chứng với giả dược, thường dùng thuốc chống loạn thần như haloperidol và ziprasidone, không thể rút ngắn những ngày không mê sảng so với giả dược trên bệnh nhân ICU [92]. Điều này được xác nhận trên một đánh giá hệ thống gần đây cho thấy sử dụng các thuốc chống loạn thần hiệu lực cao như haloperidol hoặc thuốc chống loạn thần thế hệ hai, không có lợi ích về mặc tử vong, mê sảng năng, kéo dài thời gian nằm viện hoặc chức năng nhận thức trong mê sảng [93].
Cần điều trị nhanh chóng và hiệu quả SAE về nhiễm trùng nền, kiểm soát rối loạn chức năng tạng và các thay đổi chuyển hóa (như hạ đường huyết, tăng đường huyết, tăng CO2 máu, tăng natri máu), không thể bỏ qua mê sảng biểu hiện đầu tiên trong nhiễm trùng huyết. Ngoài ra, nhiều thuốc dùng trong ICU cho thấy tác dụng phụ độc thần kinh có thể gây ra hoặc duy trì mê sảng. Các thuốc này gồm kháng cholinergic, histaminergic hoặc thuốc hướng thần [94]. Những chiến lược dùng thuốc thận trọng và không dùng thuốc nên bổ trợ điều tri mê sảng, điều này được đánh giá trong nghiên cứu đoàn hệ nhỏ. Nếu được, hãy tránh dùng benzodiazepines và opioids, vì chúng là yếu tố nguy cơ độc lập gây SAE cấp trong ICU [8]. Hơn nữa, trong phân tích phân nhóm, dexmedetomidine chủ vận alpha-2 cho thấy những lợi ích đáng kể liên quan các ngày không mê sảng, rút ngắn thở máy và giảm tỷ lệ tử vong trên bệnh nhân nhiễm trùng huyết so với lorazepam [95]. Tuy nhiên, những kết quả này không thể lập lại trên lâm sàng ngẫu nhiên đa trung tâm [96]. Một thử nghiệm ngẫu nhiên có đối chứng đánh giá lợi ích sử dụng chủ vận alpha-2 (tương ứng dexmedetomidine và clonidine) trên bệnh nhân thở máy so với sử dụng propofol (NCT03653832). Ngoài ra, có bằng chứng bắt đầu với statin trên bệnh nhân nhiễm trùng huyết có thể làm giảm nguy cơ mê sảng hàng ngày, trong khi, dừng điều trị statin trước đó có thể tăng nguy cơ mê sảng [97,98].
Điều trị không dùng thuốc
Cho đến nay không có các lựa chọn thuốc hiệu quả, chiến lược điều tri không dùng thuốc trở nên quan trọng và được thực hiện trên bệnh nhân ICU và những bệnh nhân nhiễm trùng huyết ít nặng hơn. Bao gồm các qui trình nghiêm ngặt về giấc ngủ, liệu pháp vận động với kích thích nhận thức, sử dụng kính và máy trợ thính, vận động sớm, cũng như các thiết bị để định hướng như đồng hồ, tivi, ảnh và liệu pháp âm nhạc [99-101].
Tồng kết
Sự phát triển của SAE là biến chứng cấp tính và thường xuyên của rối loạn điều hòa đáp ứng vật chủ trong nhiễm trùng huyết giai đoạn cấp, thường dẫn đến mất khả năng nhận thức kéo dài trên bệnh nhân sống sót sau nhiễm trùng huyết. Điều này nhấn mạnh tầm quan trọng về tầm soát sớm mê sảng hoặc các triệu chứng SAE khác với nhân viên y tế được đào tạo. Đặc biệt quan trọng vì SAE có thể báo trước các dấu hiệu lâm sàng nhiễm trùng huyết và điều trị sớm giúp cải thiện kết cục nhận thức thần kinh. Ngoài tập trung kiểm soát nguồn nhiễm trùng và điều trị kháng sinh, cần xác định các yếu tố nguy cơ có thể gây ra mê sảng. Cho đến nay, chưa có thuốc đặc hiệu điều trị mê sảng, nhu cầu cấp thiết cần phải phát triển, đánh giá và thực hiện những liệu pháp hiệu quả điều trị SAE.
Các nghiên cứu thực nghiệm trong tương lai và lâm sàng nên tập trung ở cả giai đoạn SAE cấp và mạn tính. Chúng tôi phải tiến hành nghiên cứu thực nghiệm và lâm sàng để làm sáng tỏ sinh lý bệnh phức tạp và cơ chế phân tử trong giai đoạn SAE cấp và mạn nhằm phát triển các quan niệm dự phòng mới và đặc hiệu điều trị SAE.
Đánh giá vai trò của hoạt hóa tế bào thần kinh và sự phá vỡ hàng rào máu não (BBB) trong SAE có thể đặc biệt hứa hẹn, vì có khả năng can thiệp trúng đích lên sự phát triển trong giai đoạn SAE cấp. về mặt lâm sàng, cần thiết lặp các dấu ấn sinh học có giá tri, như sử dụng mức độ huyết tương của chuỗi ánh sáng NFL trong giai đoạn cấp hoặc các thủ thuật hình ảnh nhằm tiên lượng rối loạn nhận thức thần kinh muộn. Ở giai đoạn sau cấp, những tác động của rèn luyện nhận thức cá nhân hóa cần được kiểm tra. Do đó, nhu cầu cấp thiết các thử nghiệm lâm sàng tiền cứu và có đối chứng bệnh nhân SAE để mở rộng kiến thức kinh nghiệm hướng tới các can thiệp dựa trên bằng chứng.
=> Tham khảo: Trạng thái tăng đông máu trong hồi sức cấp cứu.
References
- Fleischmann, C.; Scherag, A.; Adhikari, N.K.; Hartog, C.S.; Tsaganos, T.; Schlattmann, P.; Angus, D.C.; Reinhart, K.; International Forum of Acute Care Trialists. Assessment of Global Incidence and Mortality of Hospital-treated Sepsis. Current Estimates and Limitations. J. Respir. Crit. Care Med. 2016,193, 259-272. [CrossRef] [PubMed]
- Kempker, J.A.; Martin, G.S. The Changing Epidemiology and Definitions of Sepsis. Chest Med. 2016, 37,165-179. [CrossRef] [PubMed]
- Gofton, T.E.; Young, G.B. Sepsis-associated encephalopathy. Rev. Neurol. 2012, 8, 557-566. [CrossRef] [PubMed]
- Heming, ; Mazeraud, A.; Verdonk, F.; Bozza, F.A.; Chretien, F.; Sharshar, T. Neuroanatomy of sepsis-associated encephalopathy. Crit. Care 2017, 21, 65. [CrossRef]
- lacobone, E.; Bailly-Salin, J.; Polito, A.; Friedman, D.; Stevens,D.; Sharshar, T. Sepsis-associated encephalopathy and its differential diagnosis. Crit. Care Med. 2009, 37, S331-S336. [CrossRef]
- Vilstrup, H.; Amodio, P.; Bajaj, J.; Cordoba, J.; Ferenci, P.; Mullen, K.D.; Weissenborn, K.; Wong, P. Hepatic encephalopathy in chronic liver disease: 2014 Practice Guideline by the American Association for the Study of Liver Diseases and the European Association for the Study of the Liver. Hepatology 2014, 60, 715-735. [CrossRef]
- Baumgaertel, M.W.; Kraemer, M.; Berlit, P. Neurologic complications of acute and chronic renal disease. Clin. Neurol. 2014,119, 383-393. [CrossRef]
- Sonneville, R.; de Montmollin, E.; Poujade, J.; Garrouste-Orgeas, M.; Souweine, B.; Darmon, M.; Mariotte, E.; Argaud, L.; Barbier, F.; Goldgran-Toledano, D.; et al. Potentially modifiable factors contributing to sepsis-associated encephalopathy. Intensive Care Med. 2017, 43,1075-1084. [CrossRef]
- Eidelman, L.A.; Putterman, D.; Putterman, C.; Sprung, C.L. The spectrum of septic encephalopathy. Definitions, etiologies, and mortalities. JAMA 1996, 275, 470-473. [CrossRef]
- Pandharipande, P.P.; Girard, T.D.; Jackson, J.C.; Morandi, A.; Thompson, J.L.; Pun, B.T.; Brummel, N.E.; Hughes, C.G.; Vasilevskis, E.E.; Shintani, A.K.; et al. Long-term cognitive impairment after critical illness. Engl. J. Med. 2013, 369,1306-1316. [CrossRef]
- Girard, T.D.; Jackson, J.C.; Pandharipande, P.P; Pun, B.T.; Thompson, J.L.; Shintani, A.K.; Gordon, S.M.; Canonico, A.E.; Dittus, R.S.; Bernard, G.R.; et al. Delirium as a predictor of long-term cognitive impairment in survivors of critical illness. Care Med. 2010, 38,1513-1520. [CrossRef] [PubMed]
- Gunther, M.L.; Morandi, A.; Krauskopf, E.; Pandharipande, P.; Girard, T.D.; Jackson, C.; Thompson, J.; Shintani, A.K.; Geevarghese, S.; Miller, R.R., III; et al. The association between brain volumes, delirium duration, and cognitive outcomes in intensive care unit survivors: The VISIONS cohort magnetic resonance imaging study. Crit. Care Med. 2012, 40, 2022-2032. [CrossRef] [PubMed]
- Hope, A.A.; Morrison, R.S.; Du, Q.; Wallenstein, S.; Nelson, J.E. Risk factors for long-term brain dysfunction after chronic critical illness. Am. Thorac. Soc. 2013,10, 315-323. [CrossRef]
- Iwashyna, T.J.; Ely, E.W.; Smith, D.M.; Langa, K.M. Long-term cognitive impairment and functional disability among survivors of severe sepsis. JAMA 2010, 304,1787-1794. [CrossRef] [PubMed]
- Annane, D.; Sharshar, T. Cognitive decline after sepsis. Lancet Respir. Med. 2015, 3, 61-69. [CrossRef]
- de Azevedo, J.R.; Montenegro, W.S.; Rodrigues, D.P.; Souza, S.C.; Araujo, V.F.; de Paula, M.P.; Prazeres, P.H.; da Luz Leitao, A.; Mendonca, A.V. Long-term cognitive outcomes among unselected ventilated and non-ventilated ICU patients. Intensive Care 2017, 5,18. [CrossRef]
- Jackson, J.C.; Girard, T.D.; Gordon, S.M.; Thompson, J.L.; Shintani, A.K.; Thomason, J.W.; Pun, B.T.; Canonico, A.E.; Dunn, J.G.; Bernard, G.R.; et al. Long-term cognitive and psychological outcomes in the awakening and breathing controlled trial. J. Respir. Crit. Care Med. 2010,182,183-191. [CrossRef]
- Needham, D.M.; Dinglas, V.D.; Morris, P.E.; Jackson, J.C.; Hough, C.L.; Mendez-Tellez, P.A.; Wozniak, A.W.; Colantuoni, E.; Ely, E.W.; Rice, T.W.; et al. Physical and cognitive performance of patients with acute lung injury 1 year after initial trophic versus full enteral feeding. EDEN trial follow-up. J. Respir. Crit. Care Med. 2013,188,567-576. [CrossRef]
- Rothenhausler, H.B.; Ehrentraut, S.; Stoll, C.; Schelling, G.; Kapfhammer, H.P. The relationship between cognitive performance and employment and health status in long-term survivors of the acute respiratory distress syndrome: Results of an exploratory study. Hosp. Psychiatry 2001, 23, 90-96. [CrossRef]
- Sakusic, A.; O’Horo, J.C.; Dziadzko, M.; Volha, D.; Ali, R.; Singh, T.D.; Kashyap, R.; Farrell, A.M.; Fryer, J.D.; Petersen, R.; et al. Potentially Modifiable Risk Factors for Long-Term Cognitive Impairment After Critical Illness: A Systematic Review. Mayo Clin. Proc. 2018, 93, 68-82. [CrossRef]
- Semmler, A.; Widmann, C.N.; Okulla, T.; Urbach, H.; Kaiser, M.; Widman, G.; Mormann, F.; Weide, J.; Fliessbach, K.; Hoeft, A.; et al. Persistent cognitive impairment, hippocampal atrophy and EEG changes in sepsis survivors. Neurol. Neurosurg. Psychiatry 2013, 84, 62-69. [CrossRef]
- Prescott, H.C. Variation in Postsepsis Readmission Patterns: A Cohort Study of Veterans Affairs Beneficiaries. Am. Thorac. Soc. 2017,14, 230-237. [CrossRef] [PubMed]
- Iwashyna, T.J.; Speelmon, E.C. Advancing a Third Revolution in Critical Care. J. Respir. Crit. Care Med. 2016,194, 782-783. [CrossRef] [PubMed]
- Kaukonen, K.M.; Bailey, M.; Suzuki, S.; Pilcher, D.; Bellomo, R. Mortality related to severe sepsis and septic shock among critically ill patients in Australia and New Zealand, 2000-2012. JAMA 2014, 311,1308-1316. [CrossRef] [PubMed]
- Wintermann, G.B.; Brunkhorst, F.M.; Petrowski, K.; Strauss, B.; Oehmichen, F.; Pohl, M.; Rosendahl, J. Stress disorders following prolonged critical illness in survivors of severe sepsis. Care Med. 2015,43,1213-1222. [CrossRef]
- Lund-Sorensen, H.; Benros, M.E.; Madsen, T.; Sorensen, H.J.; Eaton, W.W.; Postolache, T.T.; Nordentoft, M.; Erlangsen, A. A Nationwide Cohort Study of the Association Between Hospitalization With Infection and Risk of Death by Suicide. JAMA Psychiatry 2016, 73, 912-919. [CrossRef]
- Korosec Jagodic, H.; Jagodic, K.; Podbregar, M. Long-term outcome and quality of life of patients treated in surgical intensive care: A comparison between sepsis and trauma. Care 2006,10, R134. [CrossRef]
- Langa, K.M.; Chernew, M.E.; Kabeto, M.U.; Herzog, A.R.; Ofstedal, M.B.; Willis, R.J.; Wallace, R.B.; Mucha, L.M.; Straus, W.L.; Fendrick, A.M. National estimates of the quantity and cost of informal caregiving for the elderly with dementia. Gen. Intern. Med. 2001,16, 770-778. [CrossRef]
- Prescott, H.C.; Langa, K.M.; Liu, V.; Escobar, G.J.; Iwashyna, TJ. Increased 1-year healthcare use in survivors of severe sepsis. J. Respir. Crit. Care Med. 2014,190, 62-69. [CrossRef]
- Angus, D.C. The lingering consequences of sepsis: A hidden public health disaster? JAMA 2010, 304, 1833-1834. [CrossRef]
- Sprung, C.L.; Peduzzi, P.N.; Shatney, C.H.; Schein, R.M.; Wilson, M.F.; Sheagren, J.N.; Hinshaw, L.B. Impact of encephalopathy on mortality in the sepsis syndrome. The Veterans Administration Systemic Sepsis Cooperative Study Group. Care Med. 1990,18,801-806. [CrossRef] [PubMed]
- Zhang, L.N.; Wang, X.T.; Ai, Y.H.; Guo, Q.L.; Huang, L.; Liu, Z.Y.; Yao, B. Epidemiological features and risk factors of sepsis-associated encephalopathy in intensive care unit patients: 2008-2011. Med. J. 2012, 125, 828-831. [PubMed]
- Sharshar, T.; Annane, D.; de la Grandmaison, G.L.; Brouland, J.P.; Hopkinson, N.S.; Francoise, G. The neuropathology of septic shock. Brain Pathol. 2004,14, 21-33. [CrossRef]
- Polito, A.; Eischwald, F.; Maho, A.L.; Polito, A.; Azabou, E.; Annane, D.; Chretien, F.; Stevens, R.D.; Carlier, R.; Sharshar, T. Pattern of brain injury in the acute setting of human septic shock. Care 2013, 17, R204. [CrossRef] [PubMed]
- Pfister, D.; Siegemund, M.; Dell-Kuster, S.; Smielewski, P.; Ruegg, S.; Strebel, S.P.; Marsch, S.C.; Pargger, H.; Steiner, L.A. Cerebral perfusion in sepsis-associated delirium. Care 2008,12, R63. [CrossRef] [PubMed]
- Goodson, C.M.; Rosenblatt, K.; Rivera-Lara, L.; Nyquist, P.; Hogue, C.W. Cerebral Blood Flow Autoregulation in Sepsis for the Intensivist: Why Its Monitoring May Be the Future of Individualized Care. Intensive Care Med. 2018, 33, 63-73. [CrossRef]
- Hotchkiss, R.S.; Moldawer, L.L.; Opal, S.M.; Reinhart, K.; Turnbull, I.R.; Vincent, J.L. Sepsis and septic shock. Rev. Dis. Primers 2016, 2,16045. [CrossRef]
- Crippa, I.A.; Subira, C.; Vincent, J.L.; Fernandez, R.F.; Hernandez, S.C.; Cavicchi, F.Z.; Creteur, J.; Taccone, F.S. Impaired cerebral autoregulation is associated with brain dysfunction in patients with sepsis. Care 2018, 22, 327. [CrossRef]
- Taccone, F.S.; Su, F.; De Deyne, C.; Abdellhai, A.; Pierrakos, C.; He, X.; Donadello, K.; Dewitte, O.; Vincent, J.L.; De Backer, D. Sepsis is associated with altered cerebral microcirculation and tissue hypoxia in experimental peritonitis. Care Med. 2014, 42, e114-e122. [CrossRef]
- Sharshar, T.; Polito, A.; Checinski, A.; Stevens, R.D. Septic-associated encephalopathy—Everything starts at a microlevel. Care 2010,14,199. [CrossRef]
- Nwafor, D.C.; Brichacek, A.L.; Mohammad, A.S.; Griffith, J.; Lucke-Wold, B.P.; Benkovic, S.A.; Geldenhuys, W.J.; Lockman, P.R.; Brown, C.M. Targeting the Blood-Brain Barrier to Prevent Sepsis-Associated Cognitive Impairment. Cent. Nerv. Syst. Dis. 2019,11. [CrossRef] [PubMed]
- Abbott, N.J.; Patabendige, A.A.; Dolman, D.E.; Yusof, S.R.; Begley, D.J. Structure and function of the blood-brain barrier. Dis. 2010, 37,13-25. [CrossRef] [PubMed]
- Handa, O.; Stephen, J.; Cepinskas, G. Role of endothelial nitric oxide synthase-derived nitric oxide in activation and dysfunction of cerebrovascular endothelial cells during early onsets of sepsis. J. Physiol. Heart Circ. Physiol. 2008,295, H1712-H1719. [CrossRef] [PubMed]
- Kuperberg, S.J.; Wadgaonkar, R. Sepsis-Associated Encephalopathy: The Blood-Brain Barrier and the Sphingolipid Rheostat. Immunol. 2017, 8, 597. [CrossRef] [PubMed]
- Shulyatnikova, T.; Verkhratsky, A. Astroglia in Sepsis Associated Encephalopathy. Res. 2019. [CrossRef] [PubMed]
- Verkhratsky, A.; Nedergaard, M. Physiology of Astroglia. Rev. 2018, 98, 239-389. [CrossRef]
- Allen, N.J.; Eroglu, C. Cell Biology of Astrocyte-Synapse Interactions. Neuron 2017, 96, 697-708. [CrossRef]
- Singh, S.K.; Stogsdill, J.A.; Pulimood, N.S.; Dingsdale, H.; Kim, Y.H.; Pilaz, L.J.; Kim, I.H.; Manhaes, A.C.; Rodrigues, W.S., Jr.; Pamukcu, A.; et al. Astrocytes Assemble Thalamocortical Synapses by Bridging NRX1alpha and NL1 via Hevin. Cell 2016,164,183-196. [CrossRef]
- Jones, E.V.; Bernardinelli, Y.; Tse, Y.C.; Chierzi, S.; Wong, T.P.; Murai, K.K. Astrocytes control glutamate receptor levels at developing synapses through SPARC-beta-integrin interactions. Neurosci. Off. J. Soc. Neurosci. 2011, 31, 4154-4165. [CrossRef]
- Li, Q.; Barres, B.A. Microglia and macrophages in brain homeostasis and disease. Rev. Immunol. 2018, 18, 225-242. [CrossRef]
- Kettenmann, H.; Kirchhoff, F.; Verkhratsky, A. Microglia: New roles for the synaptic stripper. Neuron 2013, 77,10-18. [CrossRef] [PubMed]
- Michels, M.; Sonai, B.; Dal-Pizzol, F Polarization of microglia and its role in bacterial sepsis. Neuroimmunol. 2017, 303, 90-98. [CrossRef] [PubMed]
- Lemstra, A.W.; Groen in’t Woud, J.C.; Hoozemans, J.J.; van Haastert, E.S.; Rozemuller, A.J.; Eikelenboom, P.; van Gool, W.A. Microglia activation in sepsis: A case-control study. Neuroinflammation 2007,4,4. [CrossRef] [PubMed]
- Zhong, J.; Guo, C.; Hou, W.; Shen, N.; Miao, C. Effects of MFHAS1 on cognitive impairment and dendritic pathology in the hippocampus of septic rats. Life Sci. 2019,235,116822. [CrossRef] [PubMed]
- Trzeciak, A.; Lerman, Y.V.; Kim, T.H.; Kim, M.R.; Mai, N.; Halterman, M.W.; Kim, M. Long-Term Microgliosis Driven by Acute Systemic Inflammation. Immunol. 2019, 203, 2979-2989. [CrossRef] [PubMed]
- Andonegui, G.; Zelinski, E.L.; Schubert, C.L.; Knight, D.; Craig, L.A.; Winston, B.W.; Spanswick, S.C.; Petri, B.; Jenne, C.N.; Sutherland, J.C.; et al. Targeting inflammatory monocytes in sepsis-associated encephalopathy and long-term cognitive impairment. JCI Insight 2018, 3. [CrossRef]
- van Gool, W.A.; van de Beek, D.; Eikelenboom, P. Systemic infection and delirium: When cytokines and acetylcholine collide. Lancet 2010, 375, 773-775. [CrossRef]
- Semmler, A.; Frisch, C.; Debeir, T.; Ramanathan, M.; Okulla, T.; Klockgether, T.; Heneka, M.T. Long-term cognitive impairment, neuronal loss and reduced cortical cholinergic innervation after recovery from sepsis in a rodent model. Neurol. 2007, 204, 733-740. [CrossRef]
- Zhai, Q.; Lai, D.; Cui, P.; Zhou, R.; Chen, Q.; Hou, J.; Su, Y.; Pan, L.; Ye, H.; Zhao, J.W.; et al. Selective Activation of Basal Forebrain Cholinergic Neurons Attenuates Polymicrobial Sepsis-Induced Inflammation via the Cholinergic Anti-Inflammatory Pathway. Care Med. 2017, 45, e1075-e1082. [CrossRef]
- Osuchowski, M.F.; Ayala, A.; Bahrami, S.; Bauer, M.; Boros, M.; Cavaillon, J.M.; Chaudry, I.H.; Coopersmith, C.M.; Deutschman, C.S.; Drechsler, S.; et al. Minimum Quality Threshold in Pre-Clinical Sepsis Studies (MQTiPSS): An International Expert Consensus Initiative for Improvement of Animal Modeling in Sepsis. Shock 2018, 50, 377-380. [CrossRef]
- van Eijk, M.M.; Roes, K.C.; Honing, M.L.; Kuiper, M.A.; Karakus, A.; van der Jagt, M.; Spronk, P.E.; van Gool, W.A.; van der Mast, R.C.; Kesecioglu, J.; et al. Effect of rivastigmine as an adjunct to usual care with haloperidol on duration of delirium and mortality in critically ill patients: A multicentre, double-blind, placebo-controlled randomised trial. Lancet 2010, 376,1829-1837. [CrossRef]
- Basler, T.; Meier-Hellmann, A.; Bredle, D.; Reinhart, K. Amino acid imbalance early in septic encephalopathy. Intensive Care Med. 2002, 28, 293-298. [CrossRef]
- Jackson, A.C.; Gilbert, J.J.; Young, G.B.; Bolton, C.F. The encephalopathy of sepsis. J. Neurol. Sci. 1985,12, 303-307. [CrossRef]
- Sharshar, T.; Gray, F.; Lorin de la Grandmaison, G.; Hopkinson, N.S.; Ross, E.; Dorandeu, A.; Orlikowski, D.; Raphael, J.C.; Gajdos, P.; Annane, D. Apoptosis of neurons in cardiovascular autonomic centres triggered by inducible nitric oxide synthase after death from septic shock. Lancet 2003, 362,1799-1805. [CrossRef]
- Sharshar, T.; Gray, F.; Poron, F.; Raphael, J.C.; Gajdos, P.; Annane, D. Multifocal necrotizing leukoencephalopathy in septic shock. Care Med. 2002, 30,2371-2375. [CrossRef]
- Westhoff, D.; Engelen-Lee, J.Y.; Hoogland, I.C.M.; Aronica, E.M.A.; van Westerloo, D.J.; van de Beek, D.; van Gool, W.A. Systemic infection and microglia activation: A prospective postmortem study in sepsis patients. Ageing IA 2019,16,18. [CrossRef]
- Zrzavy, T.; Hoftberger, R.; Berger, T.; Rauschka, H.; Butovsky, O.; Weiner, H.; Lassmann, H. Pro-inflammatory activation of microglia in the brain of patients with sepsis. Appl. Neurobiol. 2019, 45, 278-290. [CrossRef]
- Stubbs, D.J.; Yamamoto, A.K.; Menon, D.K. Imaging in sepsis-associated encephalopathy—Insights and opportunities. Rev. Neurol. 2013, 9,551-561. [CrossRef]
- Bartynski, W.S.; Boardman, J.F.; Zeigler, Z.R.; Shadduck, R.K.; Lister, J. Posterior reversible encephalopathy syndrome in infection, sepsis, and shock. J. Neuroradiol. 2006, 27, 2179-2190.
- Young, G.B.; Bolton, C.F.; Archibald, Y.M.; Austin, T.W.; Wells, G.A. The electroencephalogram in sepsis-associated encephalopathy. Clin. Neurophysiol. Off. Publ. Am. Electroencephalogr. Soc. 1992,9,145-152. [CrossRef]
- Hosokawa, K.; Gaspard, N.; Su, F.; Oddo, M.; Vincent, J.L.; Taccone, F.S. Clinical neurophysiological assessment of sepsis-associated brain dysfunction: A systematic review. Care 2014,18, 674. [CrossRef] [PubMed]
- Azabou, E.; Magalhaes, E.; Braconnier, A.; Yahiaoui, L.; Moneger, G.; Heming, N.; Annane, D.; Mantz, J.; Chretien, F.; Durand, M.C.; et al. Early Standard Electroencephalogram Abnormalities Predict Mortality in Septic Intensive Care Unit Patients. PLoS ONE 2015,10, [CrossRef] [PubMed]
- Nielsen, R.M.; Urdanibia-Centelles, O.; Vedel-Larsen, E.; Thomsen, K.J.; Moller, K.; Olsen, K.S.; Lauritsen, A.O.; Eddelien, H.S.; Lauritzen, M.; Benedek, K. Continuous EEG Monitoring in a Consecutive Patient Cohort with Sepsis and Delirium. Care 2019. [CrossRef] [PubMed]
- Kurtz, P.; Gaspard, N.; Wahl, A.S.; Bauer, R.M.; Hirsch, L.J.; Wunsch, H.; Claassen, J. Continuous electroencephalography in a surgical intensive care unit. Intensive Care Med. 2014, 40, 228-234. [CrossRef]
- Nguyen, D.N.; Spapen, H.; Su, F.; Schiettecatte, J.; Shi, L.; Hachimi-Idrissi, S.; Huyghens, L. Elevated serum levels of S-100beta protein and neuron-specific enolase are associated with brain injury in patients with severe sepsis and septic shock. Care Med. 2006, 34,1967-1974. [CrossRef]
- Anderson, B.J.; Reilly, J.P.; Shashaty, M.G.S.; Palakshappa, J.A.; Wysoczanski, A.; Dunn, T.G.; Kazi, A.; Tommasini, A.; Mikkelsen, M.E.; Schweickert, W.D.; et al. Admission plasma levels of the neuronal injury marker neuron-specific enolase are associated with mortality and delirium in sepsis. Crit. Care 2016, 36,18-23. [CrossRef]
- Ehler, J.; Petzold, A.; Wittstock, M.; Kolbaske, S.; Gloger, M.; Henschel, J.; Heslegrave, A.; Zetterberg, H.; Lunn, M.P.; Rommer, P.S.; et al. The prognostic value of neurofilament levels in patients with sepsis-associated encephalopathy—A prospective, pilot observational study. PLoS ONE 2019,14, [CrossRef]
- Shahim, P; Zetterberg, H.; Tegner, Y.; Blennow, K. Serum neurofilament light as a biomarker for mild traumatic brain injury in contact sports. Neurology 2017, 88,1788-1794. [CrossRef]
- Lu, C.H.; Macdonald-Wallis, C.; Gray, E.; Pearce, N.; Petzold, A.; Norgren, N.; Giovannoni, G.; Fratta, P; Sidle, K.; Fish, M.; et al. Neurofilament light chain: A prognostic biomarker in amyotrophic lateral sclerosis. Neurology 2015, 84, 2247-2257. [CrossRef]
- Kuhle, J.; Nourbakhsh, B.; Grant, D.; Morant, S.; Barro, C.; Yaldizli, O.; Pelletier, D.; Giovannoni, G.; Waubant, E.; Gnanapavan, S. Serum neurofilament is associated with progression of brain atrophy and disability in early MS. Neurology 2017, 88, 826-831. [CrossRef]
- Ely, E.W.; Margolin, R.; Francis, J.; May, L.; Truman, B.; Dittus, R.; Speroff, T.; Gautam, S.; Bernard, G.R.; Inouye, S.K. Evaluation of delirium in critically ill patients: Validation of the Confusion Assessment Method for the Intensive Care Unit (CAM-ICU). Care Med. 2001, 29,1370-1379. [CrossRef]
- Bergeron, N.; Dubois, M.J.; Dumont, M.; Dial, S.; Skrobik, Y. Intensive Care Delirium Screening Checklist: Evaluation of a new screening tool. Intensive Care Med. 2001, 27, 859-864. [CrossRef]
- Luetz, A.; Heymann, A.; Radtke, F.M.; Chenitir, C.; Neuhaus, U.; Nachtigall, I.; von Dossow, V.; Marz, S.; Eggers, V.; Heinz, A.; et al. Different assessment tools for intensive care unit delirium: Which score to use? Care Med. 2010, 38,409-418. [CrossRef]
- Inouye, S.K.; van Dyck, C.H.; Alessi, C.A.; Balkin, S.; Siegal, A.P.; Horwitz, R.I. Clarifying confusion: The confusion assessment method. A new method for detection of delirium. Intern. Med. 1990, 113, 941-948. [CrossRef]
- Marcantonio, E.R.; Ngo, L.H.; O’Connor, M.; Jones, R.N.; Crane, P.K.; Metzger, E.D.; Inouye, S.K. 3D-CAM: Derivation and validation of a 3-minute diagnostic interview for CAM-defined delirium: A cross-sectional diagnostic test study. Intern. Med. 2014,161, 554-561. [CrossRef]
- Inouye, S.K.; Kosar, C.M.; Tommet, D.; Schmitt, E.M.; Puelle, M.R.; Saczynski, J.S.; Marcantonio, E.R.; Jones, R.N. The CAM-S: Development and validation of a new scoring system for delirium severity in 2 cohorts. Intern. Med. 2014,160, 526-533. [CrossRef]
- Gaudreau, J.D.; Gagnon, P.; Harel, F.; Tremblay, A.; Roy, M.A. Fast, systematic, and continuous delirium assessment in hospitalized patients: The nursing delirium screening scale. Pain Symptom Manag. 2005, 29, 368-375. [CrossRef]
- Bellelli, G.; Morandi, A.; Davis, D.H.; Mazzola, P.; Turco, R.; Gentile, S.; Ryan, T.; Cash, H.; Guerini, F.; Torpilliesi, T.; et al. Validation of the 4AT, a new instrument for rapid delirium screening: A study in 234 hospitalised older people. Age Ageing 2014, 43, 496-502. [CrossRef]
- Luetz, A.; Balzer, F.; Radtke, F.M.; Jones, C.; Citerio, G.; Walder, B.; Weiss, B.; Wernecke, K.D.; Spies, C. Delirium, sedation and analgesia in the intensive care unit: A multinational, two-part survey among intensivists. PLoS ONE 2014, 9, e110935. [CrossRef]
- Barr, J.; Fraser, G.L.; Puntillo, K.; Ely, E.W.; Gelinas, C.; Dasta, J.F.; Davidson, J.E.; Devlin, J.W.; Kress, J.P.; Joffe, A.M.; et al. Clinical practice guidelines for the management of pain, agitation, and delirium in adult patients in the intensive care unit. Care Med. 2013, 41, 263-306. [CrossRef]
- Girard, T.D.; Thompson, J.L.; Pandharipande, P.P.; Brummel, N.E.; Jackson, J.C.; Patel, M.B.; Hughes, C.G.; Chandrasekhar, R.; Pun, B.T.; Boehm, L.M.; et al. Clinical phenotypes of delirium during critical illness and severity of subsequent long-term cognitive impairment: A prospective cohort study. Lance Respir. Med. 2018, 6, 213-222. [CrossRef]
- Girard, T.D.; Exline, M.C.; Carson, S.S.; Hough, C.L.; Rock, P.; Gong, M.N.; Douglas, I.S.; Malhotra, A.; Owens, R.L.; Feinstein, D.J.; et al. Haloperidol and Ziprasidone for Treatment of Delirium in Critical Illness. Engl. J. Med. 2018, 379, 2506-2516. [CrossRef]
- Nikooie, R.; Neufeld, K.J.; Oh, E.S.; Wilson, L.M.; Zhang, A.; Robinson, K.A.; Needham, D.M. Antipsychotics for Treating Delirium in Hospitalized Adults: A Systematic Review. Intern. Med. 2019. [CrossRef]
- Campbell, N.; Boustani, M.; Limbil, T.; Ott, C.; Fox, C.; Maidment, I.; Schubert, C.C.; Munger, S.; Fick, D.; Miller, D.; et al. The cognitive impact of anticholinergics: A clinical review. Interv. Aging 2009,4,225-233.
- Pandharipande, P.P.; Sanders, R.D.; Girard, T.D.; McGrane, S.; Thompson, J.L.; Shintani, A.K.; Herr, D.L.; Maze, M.; Ely, E.W. Effect of dexmedetomidine versus lorazepam on outcome in patients with sepsis: An a priori-designed analysis of the MENDS randomized controlled trial. Care 2010,14, R38. [CrossRef]
- Kawazoe, Y.; Miyamoto, K.; Morimoto, T.; Yamamoto, T.; Fuke, A.; Hashimoto, A.; Koami, H.; Beppu, S.; Katayama, Y.; Itoh, M.; et al. Effect of Dexmedetomidine on Mortality and Ventilator-Free Days in Patients Requiring Mechanical Ventilation With Sepsis: A Randomized Clinical Trial. JAMA 2017, 317, 1321-1328. [CrossRef]
- Morandi, A.; Hughes, C.G.; Thompson, J.L.; Pandharipande, P.P.; Shintani, A.K.; Vasilevskis, E.E.; Han, J.H.; Jackson, J.C.; Laskowitz, D.T.; Bernard, G.R.; et al. Statins and delirium during critical illness: A multicenter, prospective cohort study. Care Med. 2014, 42,1899-1909. [CrossRef]
- Lee, C.C.; Lee, M.G.; Hsu, T.C.; Porta, L.; Chang, S.S.; Yo, C.H.; Tsai, K.C.; Lee, M. A Population-Based Cohort Study on the Drug-Specific Effect of Statins on Sepsis Outcome. Chest 2018,153, 805-815. [CrossRef]
- Schweickert, W.D.; Pohlman, M.C.; Pohlman, A.S.; Nigos, C.; Pawlik, A.J.; Esbrook, C.L.; Spears, L.; Miller, M.; Franczyk, M.; Deprizio, D.; et al. Early physical and occupational therapy in mechanically ventilated, critically ill patients: A randomised controlled trial. Lancet 2009, 373,1874-1882. [CrossRef]
- Brummel, N.E.; Girard, T.D.; Ely, E.W.; Pandharipande, P.P.; Morandi, A.; Hughes, C.G.; Graves, A.J.; Shintani, A.; Murphy, E.; Work, B.; et al. Feasibility and safety of early combined cognitive and physical therapy for critically ill medical and surgical patients: The Activity and Cognitive Therapy in ICU (ACT-ICU) trial. Intensive Care Med. 2014, 40, 370-379. [CrossRef]
- Ke, L.; Wang, J.; Ma, Z.; Chen, B.; Wang, L.; Gong, J.; Wang, R. Non-pharmacological Treatment of Intensive Care Unit Delirium. J. Nurs. Sci. 2019, 8,119-128. [CrossRef]