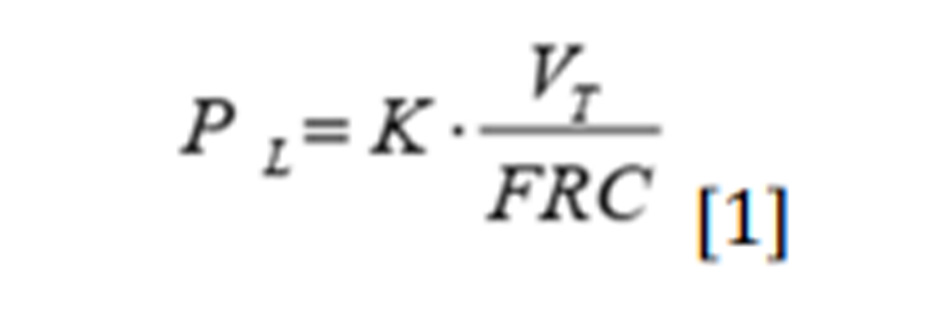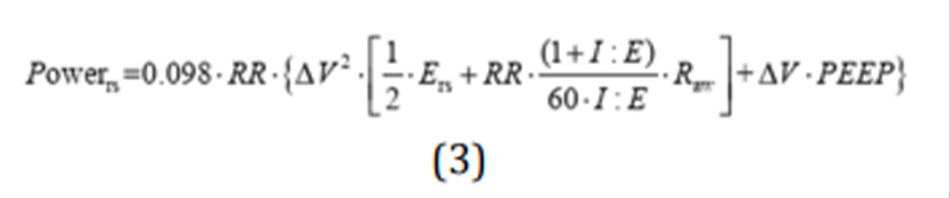Bệnh hô hấp
Áp suất truyền động và sức mạnh cơ học mục tiêu mới cho VILI phòng ngừa
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Để tải bài viết Áp suất truyền động và sức mạnh cơ học mục tiêu mới cho VILI phòng ngừa PDF mời các bạn click vào link ở đây.
Driving pressure and mechanical power: new targets for VILI prevention
Các tác giả: Tommaso Tonetti, Francesco Vasques, Francesca Rapetti, Giorgia Maiolo, Francesca Collino, Federica Romitti, Luigi Camporota, Massimo Cressoni, Paolo Cadringher, Michael Quintel, and Luciano Gattinoni
Dịch: BS. Đặng Thanh Tuấn
Tóm tắt
Một số yếu tố đã được công nhận là có thể gây ra tổn thương phổi do máy thở (VILI). Đầu tiên là áp lực (do đó là ‘barotrauma’), sau đó là thể tích (do đó là ‘volutrauma’), cuối cùng là sự đóng mở theo chu kỳ của các đơn vị phổi (‘atelectrauma’). Người ta ít chú ý đến tần số hô hấp và lưu lượng, mặc dù cả lý thuyết và bằng chứng thực nghiệm đều cho rằng chúng có vai trò quan trọng trong việc tạo ra VILI. Tổn thương ban đầu đối với nhu mô phổi nhất thiết là do cơ học và nó có thể biểu hiện như sự biến dạng không sinh lý của chất nền ngoại bào và/hoặc như những vết đứt gãy vi mô trong hyaluronan, có thể là polyme dễ vỡ nhất được nhúng trong chất nền. Thứ tự cường độ của năng lượng cần thiết để phá vỡ liên kết phân tử giữa hyaluronan và protein liên kết là 1,12 × 10- 16 Joules (J), cao hơn 70–90% so với năng lượng trung bình được cung cấp bởi một hơi thở 1L, giả sử phổi có độ đàn hồi 10 cmH2O/L (0,5 J). Với sự phân bố thống kê chuẩn của sức mạnh liên kết, một số polyme sẽ tiếp xúc với năng lượng đủ lớn để phá vỡ mỗi chu kỳ. Cả sự biến dạng chất nền ngoại bào và sự đứt gãy polyme đều dẫn đến hiện tượng viêm tăng tính thấm mao mạch kèm theo phù nề nếu lưu lượng máu phổi đủ. Phân tích trung gian của các nghiên cứu về thể tích khí lưu thông cao so với thấp và PEEP cho thấy rằng áp lực đẩy, hơn là thể tích khí lưu thông, là yếu tố dự báo tốt nhất về VILI, do tỷ lệ tử vong tăng lên. Điều này không có gì đáng ngạc nhiên, vì cả thể tích khí lưu thông và độ đàn hồi của hệ hô hấp (dẫn đến áp lực đẩy) có thể góp phần độc lập vào tỷ lệ tử vong. Đối với cùng một áp lực đẩy đàn hồi là một yếu tố dự báo tương tự như áp lực cao nguyên hoặc thể tích khí lưu thông. Áp lực đẩy là một trong những thành phần của năng lượng cơ học, cũng bao gồm tần số hô hấp, lưu lượng và PEEP. Việc tìm ra ngưỡng năng lượng cơ học sẽ giúp đơn giản hóa đáng kể việc đánh giá và phòng ngừa VILI.
Giới thiệu
Thở máy đã được công nhận là nguyên nhân gây tổn thương phổi kể từ khi nó được giới thiệu, mặc dù thuật ngữ tổn thương phổi do máy thở (VILI) đã được đưa ra vào năm 1993 (1).
Trong Hình 1, chúng tôi cho thấy sự phát triển của VILI kể từ mô tả đầu tiên của nó. Như đã trình bày, thuật ngữ này có xu hướng phản ánh nguyên nhân của chấn thương hơn là ảnh hưởng của nó. Thật vậy, các tác động có thể từ gãy vi mô đến vỡ quá mức, từ sản xuất cytokine có đến khúm các bạch cầu, từ tính thấm bị thay đổi đến xuất huyết trong phế nang. Do đó, dưới thuật ngữ VILI, chúng ta có thể bao gồm các cơ chế sinh lý bệnh khác nhau, mỗi cơ chế có những con đường khác nhau, cuối cùng dẫn đến những biểu hiện có thể khác nhau. Trong bài báo này, chúng tôi muốn thảo luận về nguyên nhân của VILI, cách chúng ảnh hưởng đến cấu trúc phổi và hậu quả của chúng. Một trọng tâm cụ thể sẽ được dành cho các vai trò tương ứng của áp lực đẩy và của năng lượng cơ học đối với sự hình thành và tồn tại của VILI.
Nguyên nhân đã nhận biết của VILI
Áp lực
Áp lực quá cao dẫn đến vỡ đại thể nhu mô phổi là nguyên nhân đầu tiên được công nhận của chấn thương phổi do thở máy và được gọi là chấn thương khí áp (barotrauma) (2). Điều này bao gồm tràn khí màng phổi, tràn khí trung thất, khí thũng dưới da (6-9) và thuyên tắc khí (10). Vào đầu những năm 1970, khi thông khí kiểm soát thể tích chủ yếu được sử dụng và mục tiêu thông khí là giữ PaCO2 ở mức bình thường, tràn khí màng phổi xảy ra thường xuyên đến mức đặt ống dẫn lưu ngực hai bên dự phòng để ngăn ngừa tử vong do tràn khí màng phổi có áp lực đột ngột (11). Nỗi sợ hãi lớn nhất của thở máy không phải là áp lực, mà là FiO2 cao, đến mức oxy hóa qua màng ngoài cơ thể (ECMO) trong thử nghiệm ngẫu nhiên có đối chứng đầu tiên được áp dụng để giảm thiểu FiO2 (12). Tuy nhiên, theo thời gian, tầm quan trọng của barotrauma trở nên nổi bật. Mức độ áp lực được coi là có hại vẫn chưa được xác định cho đến khi có dữ liệu thử nghiệm ARMA (13), điều này cho thấy rằng giá trị 30 cmH2O của áp lực đường thở là giá trị tối đa có thể chịu được khi thở máy (14).
Tuy nhiên, chúng tôi tin rằng việc sử dụng một con số duy nhất để xác định các mối nguy hiểm có thể xảy ra là quá đơn giản, vì nó có thể dẫn đến việc vận hành không đủ áp lực cho một số bệnh nhân và gây áp lực quá mức cho những người khác. Vì nguyên nhân gây ra VILI không phải là áp lực tác động lên đường thở mà là áp lực lên phổi (tức là áp lực xuyên phổi), nên ngưỡng áp lực phải là một giá trị của áp lực xuyên phổi chứ không phải của áp lực đường thở. Trên thực tế, mối quan hệ giữa áp lực đường thở và áp lực xuyên phổi ở một bệnh nhân là hoàn toàn tuyến tính (15). Tuy nhiên, điều quan trọng là độ dốc của mối quan hệ đó, bằng tỷ lệ giữa độ đàn hồi của phổi và tổng độ đàn hồi của hệ thống hô hấp (EL/Etot), trung bình là 0,7 trong dân số, nhưng dao động từ 0,2 đến 0,8 (16). Nếu chúng ta coi là một ngưỡng có thể có đối với VILI là một giá trị của áp lực xuyên phổi mà tại đó một số đơn vị phổi được bơm căng hoàn toàn (nghĩa là, trong đó các sợi collagen của chất nền ngoại bào bị căng phồng hoàn toàn), thì giá trị tham chiếu là 21 cmH2O có thể được xác định bằng thực nghiệm (17). Ở một bệnh nhân trung bình (EL/Etot = 0,7), giá trị áp lực xuyên phổi này tương đương với áp lực đường thở 30 cmH2O. Tuy nhiên, ở một bệnh nhân có EL/Etot = 0,8, áp lực đường thở là 30 cmH2O sẽ dẫn đến áp lực xuyên phổi cuối thì hít vào là 24 cmH2O, tương ứng với thể tích phổi gần bằng tổng dung tích phổi. Ngược lại, ở một bệnh nhân mà tỷ lệ EL/Etot thấp đến 0,2 (ví dụ, béo phì hoặc mang thai), cùng một áp lực đường thở bình nguyên là 30 cmH2O sẽ tương ứng với một áp lực xuyên phổi chỉ 6 cmH2O, có thể liên quan đến xẹp phổi và giảm oxy máu. Trên thực tế, ngưỡng áp lực đường thở cố định là 30 cmH2O trong một số trường hợp có thể dẫn đến hỗ trợ ngoài cơ thể không phù hợp (18), điều này có thể tránh được nếu đo áp lực xuyên phổi (19). Do đó, áp lực bình nguyên có một ý nghĩa khi nó được xem xét trong bối cảnh của kết quả là áp lực xuyên phổi.
Thể tích
Sự tập trung vào tầm quan trọng của thể tích trong quá trình hình thành VILI chủ yếu là do Dreyfuss và các đồng nghiệp — trong một loạt các thử nghiệm nơi thành ngực được bao bọc để tăng tính đàn hồi — đã chỉ ra rằng để VILI xảy ra, điều quan trọng là thể tích khí lưu thông được sử dụng, không phụ thuộc vào áp lực (nghĩa là, thể tích thấp không gây ra bất kỳ tổn thương nào ngay cả khi có áp lực cao ở chuột được quấn ngực, trong khi thể tích lớn thì có) (3). Cuộc thảo luận kéo dài giữa những người ủng hộ volutrauma chống lại những người ủng hộ barotrauma sẽ mất đi bất kỳ ý nghĩa nào nếu chúng ta đề cập đến áp lực xuyên phổi, thay vì áp lực đường thở, và strain (tức là thể tích khí lưu thông bình thường hóa thể tích nghỉ của phổi), thay vì thể tích khí lưu thông. Thật vậy, mối quan hệ sau đây đúng:
hay là:
Stress = Độ đàn hồi đặc hiệu x Strain [2]
Trong đó PL là áp lực xuyên phổi, VT là thể tích khí lưu thông, FRC là thể tích phổi ở áp lực khí quyển, k là độ đàn hồi đặc hiệu của phổi.
Từ mối quan hệ trên, rõ ràng là volutrauma, do strain quá mức, được kết nối chặt chẽ với barotrauma, gây ra bởi stress quá mức, là hằng số tỷ lệ với độ đàn hồi đặc hiệu (~ 12 cmH2O). Mối quan hệ này giải thích cho tất cả các kết quả mà Dreyfuss thu được trên chuột quấn ngực, một thao tác ảnh hưởng sâu sắc đến mối quan hệ áp lực đường thở-xuyên phổi. Tuy nhiên, sự liên quan lâm sàng của thể tích khí lưu thông đã được chứng minh chắc chắn qua kết quả của thử nghiệm ARMA (13), trong đó thể tích khí lưu thông cao hơn có liên quan đến tỷ lệ tử vong cao hơn gần 10% so với thể tích khí lưu thông thấp hơn (12 so với 6 mL/kg PBW) .
Xẹp phổi chu kỳ
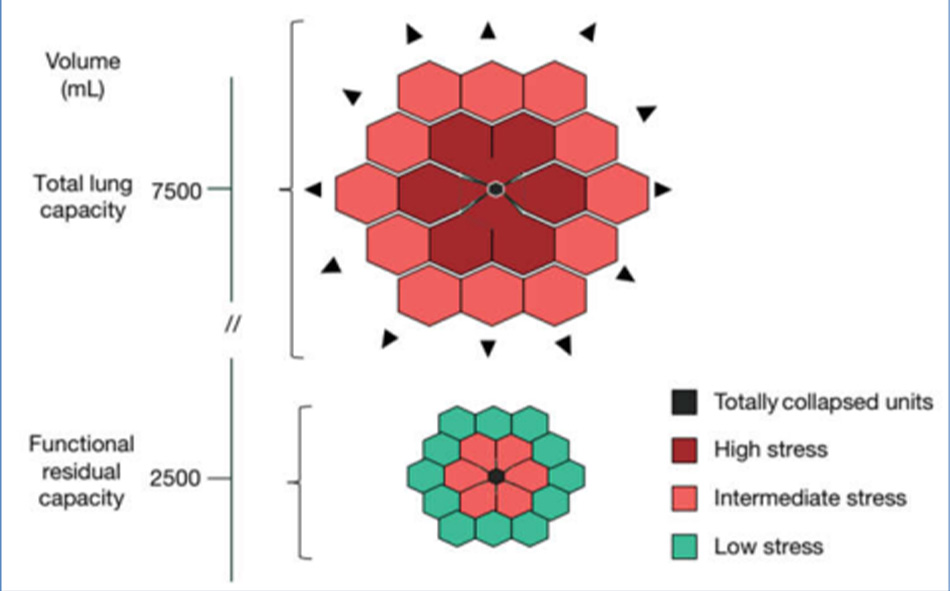
Khái niệm xẹp phổi được đưa ra bởi Arthur Slutsky và nhóm của ông, sau khi quan sát thấy sự gia tăng mạnh mẽ của các cytokine gây viêm trong các thí nghiệm in vivo trên chuột, khi phổi được phép xẹp xuống và phồng lên theo chu kỳ (4). Cơ sở lý thuyết về tổn thương do đóng và mở trong chu kỳ thở có thể được tìm thấy trong Mead et al. (20), người đã thảo luận về sự phân bố stress và strain trong một nhu mô phổi không đồng nhất. Sự đóng mở theo chu kỳ thể hiện đường tiệm cận của hiện tượng này, cũng có thể được tìm thấy ở mức độ thấp hơn giữa hai cấu trúc phổi liền kề có độ đàn hồi khác nhau. Một cách tiếp cận đơn giản đối với mô hình Mead được trình bày trong Hình 2. Về lý thuyết, giả sử rằng tỷ lệ thể tích giữa một đơn vị được mở rộng hoàn toàn và một đơn vị bị xẹp hoàn toàn là 10 so với 1, tỷ lệ bề mặt tương ứng, mà stress đề cập đến, sẽ là (10/1)2/3 = 4,64. Con số này đại diện cho hệ số nhân của áp lực xuyên phổi tại mặt phân cách giữa hai đơn vị. Theo đó, áp lực xuyên phổi 30 cmH2O (dẫn đến tổng dung tích phổi) cục bộ dẫn đến áp lực xuyên phổi (căng thẳng) bằng 30 × 4,64 = 139,2 cmH2O. Tuy nhiên, cần phải lưu ý rằng giá trị này hoàn toàn là lý thuyết và không phải thực nghiệm. Thật vậy, khi chúng tôi ước tính bằng cách chụp CT phân bố sai stress và strain, chúng tôi nhận thấy rằng hệ số nhân lên trong một phổi không đồng nhất về mặt bệnh lý là khoảng 2 trong khoảng 40% nhu mô phổi thông khí (21). Điều này có nghĩa là áp lực xuyên phổi 15 cmH2O có thể cao tại chỗ tới 30 cmH2O, tức là quá đủ để đạt dung tích phổi tối đa, một giới hạn vật lý đối với sự giãn nở của phổi với tác động tàn phá có thể xảy ra (17).
Lưu lượng
Tác động có thể có của lưu lượng khí quá nhiều đối với tổn thương phổi ít được chú ý hơn so với các yếu tố được liệt kê cho đến nay. Tuy nhiên, cả những cân nhắc về mặt lý thuyết (22,23) và bằng chứng thực nghiệm (24) đều cho thấy rằng trong quá trình thở máy, tầm quan trọng của lưu lượng không thể bị bỏ qua. Thật vậy, lưu lượng có thể được coi là tốc độ mà một dòng khí đi vào phổi. Vì nhu mô phổi gần như hoạt động như một cơ quan đàn hồi, tỷ lệ strain càng cao, thì sức cản phát triển bên trong chất nền ngoại bào càng lớn. Quá trình này cần năng lượng, tỷ lệ với tốc độ strain và được tiêu tán vào nhu mô phổi. Mặc dù đây là sự đơn giản hóa quá mức của các hiện tượng xảy ra trên khắp nhu mô phổi, nó giải thích hợp lý cho các quan sát thực nghiệm. Khi năng lượng tiêu tán vào nhu mô phổi được đo khi sự thay đổi áp lực sau khi luồng thở vào bị gián đoạn đột ngột (hiện tượng gọi là ‘thư giãn do stress) (25), người ta nhận thấy rằng năng lượng tiêu tán tăng theo nhịp thở và tính không đồng nhất của phổi. (26). Do đó, một strain phổi nhất định có thể dẫn đến tổn thương phổi hoặc không tùy thuộc vào tốc độ phát triển của nó. Thật không may, chúng tôi không biết chính xác liệu có tồn tại ngưỡng lưu lượng có hại hay không, nhưng dù sao thì điều này cũng nên được xem xét trong khuôn khổ các nguyên nhân có thể có khác của VILI.
Tần số hô hấp
Ảnh hưởng của tần số hô hấp lên VILI rõ ràng bằng trực giác đến mức thật đáng ngạc nhiên khi nhận ra rằng người ta đã ít chú ý đến nó như thế nào. Không nghi ngờ gì nữa, nếu một lượng khí lưu thông nhất định là nguy hiểm với tần số 15 bpm, thì người ta có thể nghĩ rằng nó sẽ nguy hiểm hơn ở tần số 30 bpm. Thật vậy, ảnh hưởng của tần số hô hấp lên VILI đã được mô tả trên động vật thí nghiệm (27,28). Đặc biệt, khi chúng tôi áp dụng một strain lớn hơn 2, luôn dẫn đến tử vong khi cung cấp ở tần số 15 bpm, chúng tôi nhận thấy thiếu tác dụng gây thương tích nếu phân phối ở 3 hoặc 6 bpm (29). Sự liên quan của tần số hô hấp nhấn mạnh một tình huống có thể xảy ra khác: thực sự, tương tự với sự mệt mỏi của vật liệu, có thể thiệt hại chỉ xảy ra sau khi một số chu kỳ stress và strain nhất định đã được phân phối và tạo ra trong phổi (tức là VILI dưới mức stress cho đến lúc vỡ cần thời gian).
Tương tác giữa máy thở và nhu mô phổi
Tương tác cơ học
Tất cả các yếu tố nêu trên có thể dẫn đến VILI, nhưng điều đáng bàn là đâu là cơ sở vật lý và sinh học cho VILI.
Vật lý
Cơ sở vật lý của VILI được đại diện bởi một phổ rộng có thể có những tổn thương, bắt đầu từ sự biến dạng quá mức của chất nền ngoại bào, đến những vết nứt vi mô trong cấu trúc của nó, cho đến sự đứt gãy căng thẳng. Một trong những tổn thương thể chất này có thể gây ra phản ứng viêm, ở mức độ khác nhau. Tuy nhiên, việc định lượng các quá trình này còn thiếu một cách đáng ngạc nhiên. Theo trực giác, dưới một ngưỡng nhất định, stress và strain được dung nạp tốt trong khi, trình tự “biến dạng không sinh lý học – đứt gãy vi mô – đứt gãy do stress” phát triển. Mỗi quá trình này đòi hỏi lượng năng lượng ngày càng tăng. Hyaluronan, khác với collagen và elastin, có thể đại diện cho một trong những cấu trúc chịu tải yếu hơn của chất nền ngoại bào trong phổi. Mặc dù, chúng ta không biết ‘lượng tử’ năng lượng đủ để phá vỡ các liên kết phân tử của phân tử như vậy, thứ tự cường độ của nó không khác lắm so với lực cần thiết để phá vỡ liên kết phân tử giữa axit hyaluronic và protein liên kết của nó, trung bình ~ (40 ± 11) × 10-12 Newton (30). Với độ dịch chuyển 2,8 × 10-6 m, ‘lượng tử’ năng lượng sẽ là ~ 1,12 × 10-16 J. Ở trọng lượng phân tử trung bình của hyaluronans là 2.500 kDa, nếu chúng ta chấp nhận cho con người một lượng hyaluronan là ~ 0,1 × 10-6 g/g mô phổi (31), chúng ta có thể suy đoán về mối quan hệ giữa năng lượng đầu vào (từ máy thở) và khả năng bị vỡ phân tử. Năng lượng mỗi hơi thở ~ 0,5 J sẽ tương ứng với lượng năng lượng/phân tử trung bình từ 10% đến 30% năng lượng cần thiết để phá vỡ (‘lượng tử’ năng lượng được đề cập ở trên). Giả sử rằng năng lượng cần thiết để phá vỡ các phân tử hyaluronan tuân theo một phân bố thống kê chuẩn, rất có thể một vài phân tử có thể bị vỡ ở mọi chu kỳ và chúng sẽ được sửa chữa (31). Nếu năng lượng/phân tử tăng lên, do lượng năng lượng được phân phối lớn hơn hoặc do sự phân bố lực không hợp lý do tính không đồng nhất tăng lên, tốc độ đứt gãy sẽ tăng lên. Nếu tỷ lệ gãy vượt quá khả năng phục hồi sinh lý, VILI theo thời gian sẽ biểu hiện.
Sinh học
Mặc dù tác nhân gây ra VILI nhất thiết phải là cơ học về bản chất, phản ứng viêm sau biến dạng quá mức hoặc gãy vi mô đóng một vai trò quan trọng. Phản ứng đầu tiên là sản xuất các cytokine, có nguồn gốc từ các tế bào biểu mô bị biến dạng bất thường hoặc từ các đoạn hyaluronan sẽ kích hoạt phản ứng viêm qua trung gian thụ thể số (TLR) (32,33). Một khi phản ứng viêm được kích hoạt hoàn toàn, hậu quả là những hậu quả điển hình: tăng tính thấm thành mạch, di chuyển tế bào viêm, tăng kết dính tiểu cầu, kích hoạt con đường yếu tố mô, v.v. Tất cả những quá trình này dẫn đến sự tái cấu trúc sâu sắc chất nền ngoại bào, tăng sự suy thoái của nó và duy trì kích thích viêm. Mặt khác, cần phải nhắc rằng phản ứng viêm cũng cần thiết để thúc đẩy quá trình sửa chữa phổi, mà cơ chế và các tương tác có thể xảy ra với thở máy cho đến nay phần lớn vẫn chưa được biết đến.
Các biểu hiện tổn thương
Rò rỉ khí
VILI có những biểu hiện vĩ mô và vi mô khác nhau. Các biểu hiện đầu tiên được nhận biết của VILI là khi vỡ do stress, dẫn đến khí xâm nhập vào các khoang khác nhau. Những biểu hiện này phụ thuộc vào sự tương tác giữa thông khí và nhu mô phổi. Mặc dù chúng tôi đã quan sát thấy sự xuất hiện của tràn khí màng phổi trong thời gian phổi nghỉ ngơi hoàn toàn trong ECMO do hoại tử mô, VILI phổ biến nhất xảy ra ở những vùng phổi ‘khỏe mạnh’ hơn vẫn có thể được thông khí. Những vùng này bằng cách nào đó được bảo vệ khỏi VILI vì thiếu chất hoạt động bề mặt và xơ hóa sớm. Sự hiện diện của hai yếu tố này, đối với một áp lực nhất định, dẫn đến strain thấp hơn. Tuy nhiên, bệnh lý phổi chắc chắn xác định hai tình trạng khác làm tăng khả năng bị VILI: giảm kích thước phổi và tính không đồng nhất của phổi.
Thay đổi tính thấm và phù nề mô kẽ
Nếu stress và strain tăng cao đến mức gây ra hiện tượng stress tại chỗ vỡ, thì khí rò rỉ sẽ ngay lập tức theo sau mà không có bất kỳ đặc điểm vi mô nào khác. Tuy nhiên, nếu stress và strain tăng cao về mặt bệnh lý nhưng không đủ để gây vỡ phế nang, thì các biểu hiện quan sát được chủ yếu liên quan đến đợt viêm. Tuy nhiên, để điều này xảy ra, cần phải có thời gian. Ở động vật được thở máy ở 15 bpm với thể tích khí lưu thông lớn hơn gấp đôi FRC (tức là strain phổi lớn hơn 2), chúng tôi quan sát thấy những tổn thương đầu tiên chỉ sau vài giờ (Hình 3). Những tổn thương này là những chấm nhỏ có mật độ CT tăng lên dọc theo màng phổi tạng (yếu tố tăng căng thẳng). Sau khi chúng xuất hiện, quá trình tăng tốc theo cấp số nhân để hoàn thành tình trạng xẹp/phù phổi giai đoạn cuối thở ra.
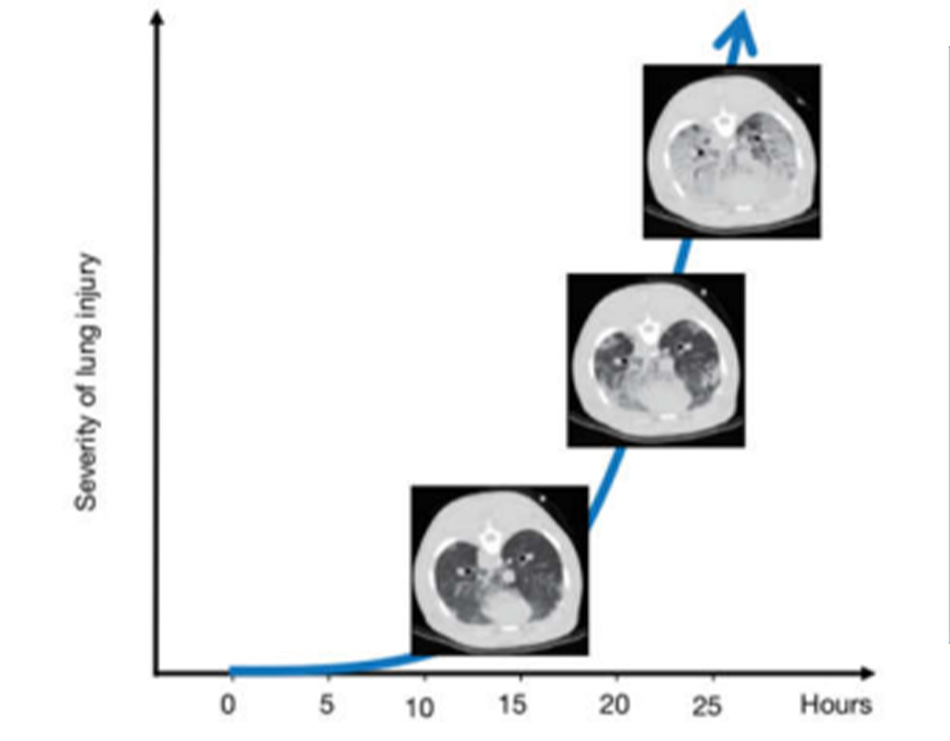
Thật thú vị, những thay đổi phổi liên quan đến VILI này hoàn toàn có thể được huy động trong quá trình hít vào (34). Những quan sát này phù hợp với chuỗi các sự kiện sau: (I) các kích thích cơ học gây viêm thông qua các vết gãy và biến dạng vi mô; (II) tính thấm của mao mạch tăng lên khi phù mô kẽ; (III) các đơn vị phổi bị nén nhưng có thể huy động được. Rõ ràng là có thể quan sát thấy các hiện tượng đi kèm khác như vi mao mạch bị vỡ và thành phế nang/mao mạch bị vỡ (35). Tuy nhiên, cần phải lưu ý rằng để phù xảy ra, ngay cả khi có tăng tính thấm của mao mạch, cần phải cung cấp đủ lưu lượng máu. Do đó, giảm cung lượng tim do PEEP cao, có thể làm giảm sự hình thành phù nề. Chúng tôi tự hỏi liệu một số “tác dụng bảo vệ” của PEEP có thể chỉ đơn giản là do ngăn ngừa các biểu hiện của tổn thương (tức là phù nề) chứ không phải do chính tổn thương (viêm và tính thấm bị thay đổi).
‘Lối vào mới’
Áp lực đẩy
Áp lực đẩy (tức là áp lực bình nguyên trừ PEEP) hiện được coi là yếu tố dự báo tốt nhất của VILI ở bệnh nhân ARDS (36) cũng như ở bệnh nhân được gây mê toàn thân, trong đó tỷ lệ biến chứng phổi có liên quan đến mức áp lực đẩy cao hơn (37). Thật không may, mặc dù rất thời thượng, bằng chứng đằng sau áp lực đẩy tốt nhất là gián tiếp và bắt nguồn từ các mô hình thống kê của các nghiên cứu hồi cứu. Thật vậy, cần lưu ý rằng:
* Bằng chứng ban đầu ủng hộ áp lực đẩy — như một nhân tố trung gian của tử vong — bắt nguồn từ một loạt các nghiên cứu được phân tích hồi cứu thông qua một quy trình thống kê rất phức tạp (tức là phân tích trung gian). Phân tích trung gian ‘nhân quả’ đa cấp độ của dữ liệu thử nghiệm riêng lẻ cho thấy rằng việc giảm áp lực đẩy ngẫu nhiên là một biến độc lập (trung gian) liên quan đến tỷ lệ sống sót. Mặc dù cả ngẫu nhiên (tức là phân bổ cho nhóm điều trị VT thấp hơn) và sự thay đổi chất trung gian (giảm áp lực đẩy) đều có ảnh hưởng đáng kể đến tỷ lệ sống sót, khi được phân tích cùng nhau, chỉ giảm áp lực đẩy – không phải ngẫu nhiên – giải thích một cách độc lập lợi ích tồn tại (hòa giải hoàn toàn). Nói cách khác, việc giảm áp lực đẩy ‘làm trung gian’ hầu hết các tác động do ngẫu nhiên hóa với tỷ lệ sống sót vượt quá tác dụng chính của việc phân bổ nhóm điều trị.
Tuy nhiên, ‘dàn xếp nhân quả’ không thiết lập mối liên hệ nhân quả trực tiếp giữa việc thiết lập áp lực đẩy cụ thể và kết quả, vì áp lực đẩy được kết hợp toán học với thể tích khí lưu thông và độ đàn hồi. Do đó, sự thay đổi về độ đàn hồi, có thể xảy ra sau một cuộc can thiệp, cho thấy sự thay đổi trong cơ học phổi vượt qua việc thiết lập một giá trị cụ thể của áp lực đẩy. Khi áp lực bình nguyên, thể tích khí lưu thông và PEEP được đặt trong phạm vi hẹp của hệ thống thông khí bảo vệ, áp lực đẩy có thể không mang lại bất kỳ lợi thế nào so với các chỉ số của cơ học phổi như độ đàn hồi, độ giãn nở hoặc áp lực bình nguyên như được chỉ ra gần đây bởi Guerin et al. (38). Thật vậy, độc lập với các số liệu thống kê phức tạp, mối liên hệ tốt nhất giữa kết quả và áp lực tác động thay vì thể tích khí lưu thông/kg IBW là hiển nhiên khi xem xét mối quan hệ giữa hai biến số:
∆P = VT × E
Như đã trình bày, ảnh hưởng của áp lực điều khiển đến kết quả có thể do tính đàn hồi (mức độ nghiêm trọng của bệnh) hoặc thể tích khí lưu thông (mức độ strain).
* Hạn chế lớn của việc sử dụng áp lực đẩy một cách riêng biệt là nó không tính đến vai trò của PEEP. Ví dụ, mức “an toàn” về mặt lý thuyết của áp lực đẩy là 12 cmH2O có thể trở nên có hại nếu PEEP là 20 hoặc 0 cmH2O, tùy thuộc vào tình trạng lâm sàng. Cuối cùng, đối với các thông số cơ học khác, điều cần lưu ý là áp lực đẩy nên được quy về phổi chứ không phải hệ thống hô hấp.
Năng lượng cơ học
Trong một loạt các thí nghiệm trên động vật khỏe mạnh, chúng tôi phát hiện ra rằng một strain được coi là gây chết người (tức là lớn hơn 2) chỉ gây tử vong khi được cung cấp với tần số 15 nhịp thở mỗi phút (39), nhưng không gây ra nếu được cung cấp với tần số từ 3 đến 6 bpm (29). Ngoài ra, chúng tôi nhận thấy rằng strain theo chu kỳ thở liên quan nhiều đến chấn thương hơn là strain tĩnh (40). Hơn nữa, chúng tôi nhận thấy rằng, đối với cùng một thể tích khí lưu thông, tốc độ cung cấp của nó (tức là lưu lượng) cũng là một yếu tố có thể xác định của VILI (24). Với những dữ liệu thực nghiệm này, chúng tôi nhận ra rằng nguyên nhân của VILI có thể được mô tả như một thực thể vật lý duy nhất (tức là năng lượng cơ học), kết hợp thể tích, áp lực, lưu lượng và tần số hô hấp (22). Thật vậy, nếu chúng ta xem xét phương trình cổ điển của chuyển động (41), định lượng tất cả các áp lực khác nhau có trong hệ hô hấp tại bất kỳ thời điểm nào, và chúng ta nhân tổng áp lực đó với sự thay đổi thể tích phổi và tần số, chúng ta thu được phương trình năng lượng cơ học như sau:
Trong đó 0,098 là hệ số chuyển đổi từ L × cmH2O thành J, RR là tần số thông khí, Ers là độ đàn hồi của hệ hô hấp, I:E là tỷ số giữa thời gian hít vào và thở ra, Raw là sức cản đường thở, ∆V là thể tích khí lưu thông. Theo đó, ở một đối tượng bình thường thở ở tần số 15 bpm, với thể tích khí lưu thông là 0,5 L với I:E là 1:1, độ đàn hồi của hệ thống hô hấp bình thường là 10 cmH2O/L và Raw là 10 cmH2O/L/s ở 0 PEEP, năng lượng cơ học tính bằng J/phút bằng 3,675.
Để hiểu đầy đủ về phương trình này, sẽ hữu ích khi xem xét từng thành phần riêng biệt, bắt đầu từ phương trình chuyển động:
P = Ers ∙ ∆V + Raw ∙ F + PEEP [4]
Trong đó P là áp lực trong hệ hô hấp tại bất kỳ thời điểm nào, Ers là tổng sức đàn hồi của hệ hô hấp, ∆V là thể tích khí lưu thông, Raw là sức cản đường thở, F là lưu lượng và PEEP là áp lực dương cuối thì thở ra.
Như được hiển thị, tất cả các thành phần của VILI được thể hiện:
• Tích số Ers × ∆V, là áp lực cần thiết để vượt qua các lực đàn hồi của toàn bộ hệ hô hấp, không gì khác chính là áp lực đẩy mà chúng ta đã thảo luận ở trên;
• Tích số Raw × F là áp lực cần thiết để di chuyển khí bên trong hệ thống hô hấp;
• PEEP là áp lực tạo ra độ giãn tĩnh cơ bản của các sợi phổi.
Mức độ liên quan của mỗi thành phần là rõ ràng ngay lập tức khi kiểm tra biểu diễn đồ thị của phương trình năng lượng (Phương trình 3 và Hình 4). Sự ra đời của lưu lượng trong phương trình này cũng như sự ra đời của PEEP đáng được thảo luận. Thật vậy, áp lực do lưu lượng thường được coi là phân tán hoàn toàn trong đường thở, trong khi áp lực khi thở ra thường được coi là bảo vệ và không được tính đến năng lượng tính toán trong quá trình thở theo chu kỳ.
Lưu lượng
Mặc dù năng lượng liên kết với lưu lượng chủ yếu bị tiêu tán trong suốt đường thở, tốc độ lưu lượng ảnh hưởng đến sự thư giãn do stress (tức là sự thay đổi áp lực khi duy trì thể tích không đổi) (25). Sự thư giãn do stress là do hiện tượng lệch trục có thể xảy ra và năng lượng bị tiêu tán khắp nhu mô do lực cắt vào chất nền ngoại bào. Vì vậy, chúng tôi cho rằng không thể bỏ qua thành phần lưu lượng.
PEEP
PEEP theo truyền thống được coi là bảo vệ chống lại VILI và niềm tin này bắt nguồn từ những quan sát đầu tiên của Webb và Tierney (42). Tuy nhiên, tác dụng bảo vệ của PEEP chủ yếu biểu hiện khi nó liên quan đến sự giảm thể tích khí lưu thông. Vai trò quan trọng của PEEP đối với năng lượng cơ học sẽ trở nên rõ ràng hơn nếu chúng ta xem xét các đặc tính vật lý của một hệ thống đàn hồi. Lực cần thiết để kéo dài một kết cấu đàn hồi tỷ lệ thuận với mức độ dịch chuyển, như được chỉ ra bởi định luật Hook:
F = k ∙ x [5]
Trong đó F là lực, x là độ dời và k là hằng số liên quan đến các đặc tính nội tại của hệ. Từ đó, rõ ràng rằng lực (và năng lượng) cần thiết để dịch chuyển một vật thể đàn hồi (phổi) phụ thuộc chặt chẽ vào mức độ dịch chuyển từ trạng thái nghỉ (FRC) đã có lúc ban đầu (ở cuối thì thở ra). Do đó, mức PEEP được áp dụng nhân với thể tích khí lưu thông (xem Hình 4) thể hiện mức năng lượng cần thiết để tạo ra thể tích khí lưu thông. Thực tế, năng lượng không phải là tích của sự biến thiên của áp lực nhân với sự thay đổi thể tích, mà là tích của áp lực tuyệt đối nhân với sự thay đổi của thể tích. Đây là lý do tại sao việc đưa PEEP vào phương trình năng lượng là đúng.
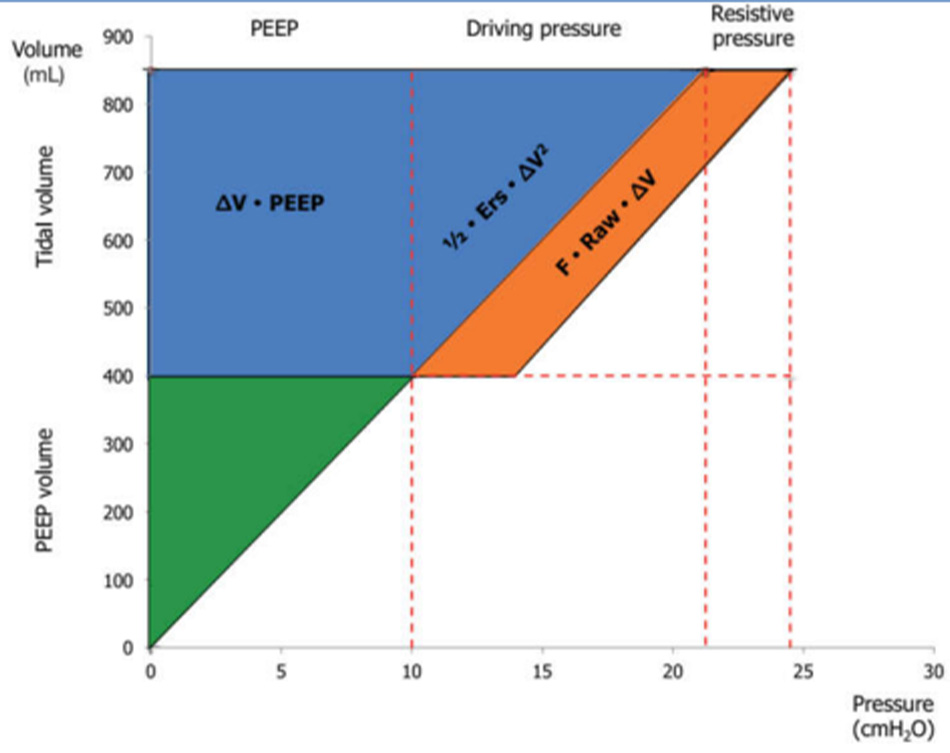
Một thách thức quan trọng đối với việc ứng dụng năng lượng cơ học là nó cần phải được điều chỉnh để giải thích cho sự khác biệt về kích thước phổi, mức độ không đồng nhất và sự phân bố cục bộ của stress và strain. Nói cách khác, cùng một năng lượng cơ học có thể tạo ra các tác động khác nhau đối với phổi khỏe mạnh hoặc bị thương.
Kết luận
Sự khác biệt giữa việc sử dụng áp lực đẩy hoặc năng lượng cơ học làm yếu tố dự báo hoặc đánh dấu tiềm năng của VILI là hiển nhiên về mặt toán học, sinh lý học và khái niệm vì áp lực đẩy chỉ là một trong những trường hợp của VILI được bao gồm trong phương trình năng lượng cơ học. Tuy nhiên, ứng dụng lâm sàng của cả năng lượng cơ học và áp lực đẩy đều thiếu bằng chứng trực tiếp. Điều cần thiết là một cách để bình thường hóa năng lượng cơ học đối với kích thước phổi và mức độ không đồng nhất. Một ngưỡng năng lượng cơ học có thể hướng dẫn cách sử dụng thở máy thích hợp hoặc áp dụng phương pháp hỗ trợ hô hấp ngoài cơ thể.
Xem thêm:
Thông khí không xâm lấn trong bệnh phổi tắc nghẽn mãn tính
Tiêu cơ vân và Tổn thương thận cấp
Những tranh cãi về liệu pháp điều trị ngoài cơ thể không do thận trên bệnh nhân COVID-19 nguy kịch.