Bệnh da liễu
Vai trò cơ chế của Probiotics trong cải thiện sức khỏe làn da
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Nhà thuốc Ngọc Anh – Chủ đề: Vai trò cơ chế của Probiotics trong cải thiện sức khỏe làn da.
Cập nhật file pdf tại đây
Tác giả: Garima Sharma, Garima Khanna, Pratibha Sharma, Parneet Kaur Deol và Indu Pal Kaur.
Biên dịch: Bs. Trương Tấn Minh Vũ.
Tóm tắt
Da là một hệ sinh thái gồm số lượng lớn các vi sinh vật, và sự tương tác động của da với hệ sinh vật này làm cho da có các đặc tính hàng rào trên nó. Các yếu tố gây stress ngày nay như ô nhiễm, lựa chọn chế độ ăn uống và những thay đổi về miễn dịch và nội tiết tố, cũng có thể dẫn đến bệnh, bao gồm nhiễm trùng. Steroid và/hoặc thuốc kháng sinh thường được sử dụng để điều trị bệnh nói sau. Tuy nhiên, chi phí điều trị, các tác dụng phụ và sự phổ biến của tình trạng kháng thuốc kháng sinh đòi hỏi phải sử dụng các lựa chọn thay thế tự nhiên và ít tốn kém hơn. Điều trị bằng probiotic bôi tại chỗ có thể giúp kiểm soát bệnh và điều chỉnh hệ vi sinh vật trên da, theo các nghiên cứu lâm sàng và thực nghiệm. Trục Ruột – Da, hiện nay là một sự thật đã được chứng minh rõ ràng, cho thấy rằng hệ vi khuẩn đường ruột khỏe mạnh là rất quan trọng đối với tình trạng da bình thường và khỏe mạnh, và việc bổ sung probiotic qua đường uống có thể giúp kiểm soát các rối loạn viêm da như mụn trứng cá. Mặt khác, việc thay đổi trực tiếp hệ vi sinh vật trên da bằng cách điều trị bằng probiotic bôi tại chỗ có thể đưa tới những hệ quả sâu rộng. Probiotic có nhiều chức năng khác nhau, bao gồm tạo ra các hợp chất chống vi khuẩn, ngăn chặn sự xâm nhập của mầm bệnh và kích hoạt hệ thống miễn dịch, cũng như khả năng xâm nhập trên bề mặt da. Chương này thảo luận về các cơ chế khác nhau mà qua đó probiotic tạo ra tác dụng có lợi của chúng cùng với tác động của chúng trong các rối loạn da khác nhau. Việc đưa các vi sinh vật có lợi này đến da là thách thức lớn. Duy trì khả năng tồn tại của probiotic trong quá trình sản xuất và bảo quản; lưu giữ trên da trong thời gian đủ dài; và sự phát triển của chúng trên bề mặt da sau khi bôi là những thách thức lớn về công thức cần được khắc phục.
Giới thiệu
Da, cơ quan lớn nhất và phức tạp nhất của cơ thể, là độc nhất theo nhiều cách. Da tạo thành một lớp bảo vệ không chỉ giữ mọi thứ ở đúng vị trí mà còn bảo vệ chúng khỏi các kích thích bên ngoài như không khí, nước, nhiệt, vi sinh vật gây bệnh và các chất độc hại khác. Da cũng giúp cầm máu, bảo vệ miễn dịch, nhận cảm giác, và sản xuất nhiều hợp chất thiết yếu gồm vitamin, collagen, ceramide và mucin.
Hơn nữa, da cũng được coi là nơi cung cấp các môi trường sống đa dạng cho vô số vi sinh vật (vi khuẩn, nấm, virus và động vật chân đốt) hình thành nên hệ vi sinh vật trên da người (Rosenthal et al. 2011; Grice và Segre 2011). Ở bất kỳ cá nhân nào, thành phần vi sinh vật trên da rất không đồng nhất và phụ thuộc vào vi môi trường tại chỗ của vùng da cụ thể. Quá trình xâm chiếm được thúc đẩy bởi môi trường sinh thái của bề mặt da, rất thay đổi tùy thuộc vào vị trí địa hình, các yếu tố nội sinh vật chủ và các yếu tố ngoại sinh môi trường (Grice và Segre 2011). Hệ vi sinh vật bình thường của da tương đối ổn định, với các chi cụ thể (Witting et al. 2015) có thể hỗ trợ vật chủ, gây hại vật chủ hoặc tồn tại dưới dạng hội sinh. Tuy nhiên, sự cân bằng mong manh cùng tồn tại giữa vật chủ (da) và quần thể vi sinh vật. Sự phá vỡ cân bằng từ bất kỳ bên nào cũng có thể dẫn đến rối loạn hoặc nhiễm trùng da (Chiller và cộng sự 2001). Các yếu tố như ô nhiễm, căng thẳng, thói quen ăn uống, miễn dịch và thay đổi nội tiết tố có thể làm nghiêng cán cân hướng về các bệnh hoặc nhiễm trùng với cường độ khác nhau.
Probiotics như là thuốc cho các bệnh da
Da tạo thành một giao diện tri giác giữa cơ thể và môi trường. Nghiên cứu gần đây cho thấy da và hệ vi sinh của nó tương tác chặt chẽ ở các cấp độ miễn dịch, sinh học và vật lý. Điều này kiểm soát các chức năng của hàng rào da (Amara và Shibl 2015). Tăng cường hàng rào bảo vệ da là rất quan trọng trong các bệnh liên quan đến da khác nhau như viêm da cơ địa dị ứng, da khô hoặc lão hóa. Người ta đã báo cáo rằng sức khỏe của da có liên quan trực tiếp đến cân bằng nội môi của ruột. Đặc điểm của hệ vi sinh đường ruột chủ yếu phụ thuộc vào sự thay đổi chế độ ăn uống của từng cá nhân. Lối sống hiện đại đang gây ra tác động có hại đến hệ sinh thái đường ruột và do đó ảnh hưởng đến hệ vi sinh đường ruột. Sự thay đổi phi tuyến tính này trong hệ vi sinh đường ruột là một trong những lý do chính làm tăng tính nhạy cảm đến các bệnh ngoài da (Singh et al. 2019).
Probiotics là “vi sinh vật sống, khi được sử dụng với lượng vừa đủ, sẽ mang lại lợi ích sức khỏe cho vật chủ.” Probiotics đang nổi lên như những ứng cử viên tiềm năng trong lĩnh vực sức khỏe làn da. Chúng được sử dụng để duy trì sức khỏe làn da nói chung, để điều trị các bệnh da khác nhau vì lợi ích chống lão hóa của chúng và có hiệu quả cao mà không gây ra bất kỳ tác dụng phụ nào cho bệnh nhân (Roudsari et al. 2015). Hình 2.1 mô tả các tình trạng da mà probiotic đóng vai trò đầy hứa hẹn.
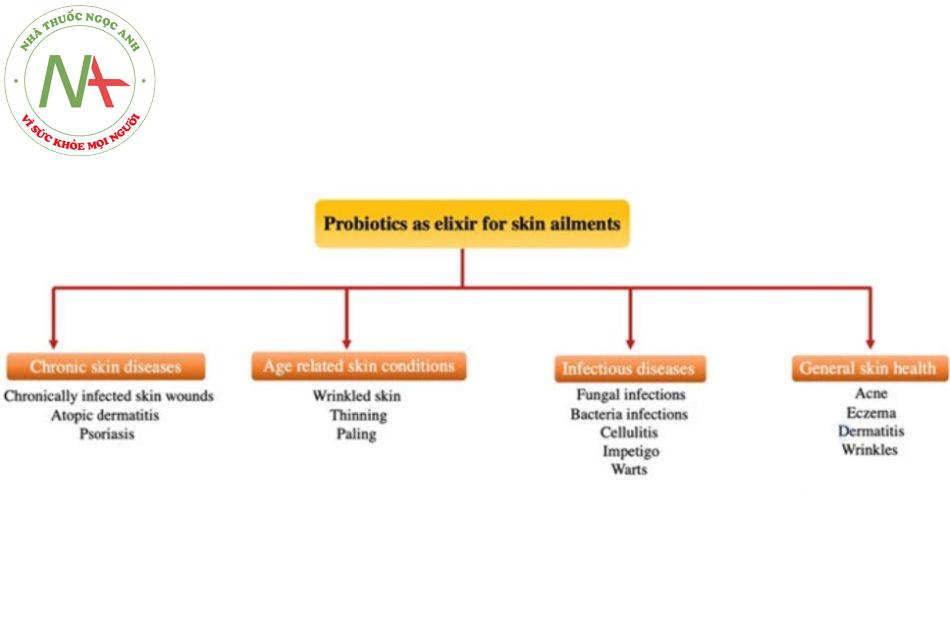
Bệnh da mãn tính
- Các bệnh da mãn tính thường không thể chữa khỏi hoặc rất khó chữa và ảnh hưởng đến chất lượng cuộc sống của bệnh nhân. Những bệnh nhân mắc các bệnh này có mức độ hài lòng về tâm lý và xã hội thấp hơn. Các bệnh da mãn tính được thảo luận nhiều nhất là vết thương da bị nhiễm trùng mãn tính, viêm da cơ địa dị ứng (AD) và bệnh vẩy nến. Những bệnh này đi kèm với nhiều hạn chế về thể chất và tâm lý trong cuộc sống hàng ngày (Evers et al. 2008).
- Các vết thương trên da bị nhiễm trùng mãn tính là nguyên nhân cơ bản gây ra bệnh tật và tử vong dưới dạng vết thương chậm lành. Chúng ảnh hưởng lớn đến chất lượng cuộc sống của bệnh nhân và dẫn đến chi phí chăm sóc sức khỏe lớn. Nguyên nhân chính khiến vết thương chậm lành được cho là do kháng sinh không hiệu quả do nhiễm trùng kháng thuốc. Tổ chức The Organisation for Economic Cooperation and Development đã nêu vai trò đầy hứa hẹn của probiotic như một liệu pháp thay thế sử dụng kháng sinh cho các vết thương da mãn tính. Probiotics giải phóng các phân tử có hoạt tính sinh học ức chế sự phát triển của mầm bệnh và can thiệp vào hệ thống cảm ứng đại diện của mầm bệnh (Fijan và cộng sự 2019).
- Viêm da cơ địa dị ứng (AD) là một bệnh da dị ứng mãn tính thường đi kèm với các bệnh dị ứng khác như hen suyễn và viêm mũi dị ứng. Biểu hiện của tình trạng này là da khô, đỏ và ngứa theo phân bố điển hình với các đợt bùng phát thường xuyên (Kapoor et al. 2008). Probiotics được báo cáo là liệu pháp tiềm năng và hiệu quả để điều trị AD. Probiotics dẫn đến việc giảm viêm bằng cách ức chế nồng độ của INF γ, IL-4 và tế bào Th17 trong các tế bào T CD4 ở lách và làm tăng sự biểu hiện của IL-10 và các cytokine liên quan đến tế bào T điều hoà trong các hạch bạch huyết mạc treo. Probiotics cũng ức chế sự trưởng thành của các tế bào đuôi gai và do đó ức chế các tế bào T chưa biệt hóa thành tế bào Th2, là nguyên nhân gây ra tình trạng viêm trên da (Rather et al. 2016).
- Bệnh vẩy nến là một trong những bệnh viêm da mãn tính được thảo luận nhiều. Nó có liên quan đến tăng sản tế bào sừng biểu bì và kích hoạt quá mức tế bào miễn dịch biểu bì. Mức độ nghiêm trọng của bệnh và sự điều chỉnh của tình trạng viêm có liên quan trực tiếp đến da và hệ vi sinh đường ruột tại chỗ (Hsu et al. 2020). Probiotics tăng cường chức năng rào cản của biểu mô và điều chỉnh các phản ứng miễn dịch bẩm sinh và thích ứng của vật chủ. Lactobacillus kết hợp với biotin đã được sử dụng thành công trong điều trị bệnh vẩy nến thể mủ (Vijayashankar và Raghunath 2012).
- Rosacea là một bệnh viêm da mãn tính, tái phát, có liên quan đến việc kích hoạt bất thường các phản ứng miễn dịch, rối loạn chức năng mạch máu và thay đổi nổi bật tính thấm hàng rào. Trong tình trạng này, hàng rào bảo vệ da bị suy giảm và các triệu chứng sẽ cải thiện khi hàng rào bảo vệ da được củng cố. Probiotic được thấy là cải thiện hàng rào bảo vệ da và ảnh hưởng đến quá trình hydrat hóa da và mất nước qua biểu bì. Probiotic làm tăng nồng độ TGF-β trong huyết thanh và do đó có khả năng đóng một vai trò quan trọng trong sự toàn vẹn của da (Kober và Bowe 2015).
Tình trạng da liên quan đến tuổi tác
Chỉ số rõ ràng nhất của sự lão hóa là chất lượng của làn da. Da trải qua một số thay đổi rõ khi lão hóa như da mỏng đi, nhợt màu và nhiều nếp nhăn hơn. Có thể xuất hiện các mảng da khô, đốm sắc tố, bầm tím và xuất huyết dưới da. Xã hội chúng ta có tâm lý chung là coi trọng làn da tươi trẻ và khỏe mạnh. Cũng tồn tại một giả định phổ biến rằng những người lớn tuổi không bận tâm về vẻ ngoài làn da của họ. Nhưng quan sát cho thấy rằng tình trạng da là một vấn đề quan trọng đối với bất kỳ lứa tuổi nào. Nó có thể được gọi là yếu tố “nhìn đẹp, cảm thấy dễ chịu” một cách thích hợp (Cowdell 2010; Akazaki et al. 2002; Al-Nuaimi et al. 2014).
Các lý do được gán cho lão hóa da là thay đổi hệ vi sinh da, thay đổi độ pH của da, thay đổi thành phần lipid của lớp sừng, stress oxy hóa, thay đổi phản ứng miễn dịch và giảm mức độ collagen. Probiotics được báo cáo giải quyết tất cả những vấn đề này và thậm chí có thể điều chỉnh phản ứng miễn dịch toàn thân bằng cách điều chỉnh việc giải phóng các cytokine có thể ảnh hưởng tích cực đến cân bằng nội môi của da (Farage et al. 2010).
Một số probiotic được báo cáo là làm tăng mức độ ceramide trong lớp sừng của người khỏe mạnh và bệnh nhân viêm da cơ địa dị ứng. Ceramide là phân tử giữ nước chính cho lớp sừng của da. Mức độ ceramide tăng lên giúp cải thiện việc giảm sự mất nước, làm săn chắc và căng mọng làn da. Tiềm năng này của probiotic phù hợp trong việc quản lý các thay đổi sinh lý bệnh của da, bao gồm cả lão hóa (Jensen và cộng sự 2005).
Mụn trứng cá là một trong những bệnh ngoài da phổ biến nhất, ảnh hưởng lớn ở thanh thiếu niên. Các yếu tố chính gây ra bệnh này là tăng sừng hóa, bít tắc các nang bã nhờn, sự xâm chiếm của vi sinh vật trong tuyến bã nhờn và kích thích tuyến bã tiết ra bởi nội tiết tố androgen. Các chủng Lactobacillus khác nhau đã được báo cáo là có tiềm năng điều trị mụn trứng cá. Probiotics đã được báo cáo là có thể trực tiếp ngăn chặn P. acnes bằng cách tạo ra các protein kháng khuẩn (Kober và Bowe 2015).
Bệnh truyền nhiễm
Bất kỳ bệnh nhiễm trùng da nào do bất kỳ vi sinh vật nào gây ra đều được coi là một loại bệnh truyền nhiễm ngoài da. Về mức độ nghiêm trọng, chúng có thể lành tính để đe dọa tính mạng dựa trên loại mầm bệnh liên quan. Loại mầm bệnh, lớp da bị nhiễm trùng và tình trạng sức khỏe của bệnh nhân tạo nên biểu hiện lâm sàng tổng thể của bệnh. Một số bệnh truyền nhiễm phổ biến nhưng phổ biến nhất là viêm mô tế bào, chốc, mụn cóc và nhiễm nấm. Việc lựa chọn phương pháp điều trị chủ yếu phụ thuộc vào tác nhân gây bệnh. Nhiều loại mầm bệnh độc lực là nguyên nhân gây ra các bệnh truyền nhiễm ngoài da, nhưng Staphylococcus aureus kháng methicillin (MRSA) được báo cáo là tác nhân gây bệnh chính (Dawson et al. 2012).
Một số chủng Lactobacillus và Bifidobacterium được báo cáo là có thể ức chế sự phát triển in vitro của các chủng S. aureus và MRSA trên lâm sàng. Các tác động được báo cáo là qua trung gian tiết axit hoặc chất ức chế giống bacteriocin và loại trừ do cạnh tranh trực tiếp tế bào (Sikorska và Smoragiewicz 2013).
Ngay cả cơ chế chính xác của probiotics trong lĩnh vực bệnh truyền nhiễm vẫn chưa được rõ ràng, nhưng đã có rất nhiều điểm nghiên cứu được báo cáo. Probiotic tạo ra lactase và các hợp chất kháng khuẩn và do đó đối kháng với các mầm bệnh; chúng cũng cạnh tranh với mầm bệnh về chất dinh dưỡng và yếu tố tăng trưởng cũng như các vị trí gắn kết và thụ thể của mầm bệnh. Một số hoạt động bằng cách kích thích các tế bào điều hòa miễn dịch. Điểm hấp dẫn chính là chúng rất ít bị các chủng vi sinh vật đề kháng. Vì vậy, probiotic nói chung là những ứng cử viên đầy hứa hẹn để điều trị các bệnh da truyền nhiễm (Amara và Shibl 2015).
Sức khỏe da tổng quát
Da trải qua nhiều tác động vật lý, hóa học và môi trường mỗi ngày. Một số yếu tố chính ảnh hưởng đến da thường xuyên là ô nhiễm, bức xạ tia cực tím, nhiệt độ nóng và lạnh, độ ẩm, căng thẳng tâm lý và / hoặc chế độ ăn uống thiếu chất. Những điều này hoàn toàn ảnh hưởng đến hệ vi sinh vật hiện diện trên da và do đó ảnh hưởng đến chất lượng của da. Da trở nên xỉn màu và kém hấp dẫn về mặt xã hội. Nếu những yếu tố này tiếp tục ảnh hưởng đến da trong thời gian dài, một số bệnh về da như mụn trứng cá, chàm, viêm da, nếp nhăn có thể xuất hiện. Một khi bất kỳ bệnh mãn tính nào trở nên phổ biến trên lớp da, rất khó để thoát khỏi tình trạng đó. Vì vậy, người ta luôn khuyên rằng hãy chăm sóc sức khỏe làn da (Roudsari et al. 2015). Nhiều báo cáo nghiên cứu đã báo cáo rằng tình trạng da có liên quan trực tiếp đến cân bằng nội môi của ruột. Vì vậy, probiotic trở thành mục tiêu tiềm năng để duy trì sức khỏe làn da vì chúng là ứng cử viên hàng đầu để quản lý cân bằng nội môi đường ruột (Singh et al. 2019).
Probiotics hoặc cộng đồng vi sinh vật được báo cáo là có tác động rất lớn đến sức khỏe tổng thể của con người. Việc tiêu thụ chúng duy trì làn da bình thường và hệ vi sinh đường ruột tự nhiên và cũng ngăn ngừa sự xâm nhập hoặc phát triển của vi sinh gây bệnh (Amara và Shibl 2015). Trong tình trạng bị bệnh, hệ sinh thái vi sinh vật trên da bị thay đổi. Probiotics giúp phục hồi và do đó duy trì một làn da khỏe mạnh (Bustamante et al. 2020).
Cơ chế hoạt động
Các tác động gián tiếp từ đường uống (Trục Ruột-Da và Trục Ruột-não-Da)
Tương tác chéo giữa ruột và da (Sự thay đổi ở vi khuẩn đường ruột có thể ảnh hưởng đến da)
Rối loạn sinh học đường ruột có một vai trò quan trọng trong việc biểu hiện một số rối loạn da, như vẩy nến, viêm da cơ địa dị ứng, gàu, trứng cá đỏ, mụn trứng cá và ung thư da (Pessemier et al. 2021). Cơ chế chính xác mà hệ vi sinh vật đường ruột tham gia vào quá trình cân bằng nội môi ở da vẫn chưa được biết đầy đủ và được báo cáo là có liên quan đến tác dụng điều hòa của sinh vật hội sinh đường ruột đối với khả năng miễn dịch toàn thân (Salem et al. 2018).
Hệ vi sinh vật là bộ phận điều chỉnh quan trọng đối với hệ thống miễn dịch, vì nó nhằm mục đích duy trì cân bằng nội môi bằng cách giao tiếp với các mô và cơ quan theo cách hai chiều. Do đó, rối loạn vi khuẩn ở da và / hoặc hệ vi sinh vật đường ruột có liên quan đến phản ứng miễn dịch bị thay đổi, thúc đẩy sự phát triển của các bệnh về da, chẳng hạn như viêm da cơ địa dị ứng, bệnh vẩy nến, mụn trứng cá, gàu và thậm chí là ung thư da. Ở đây, chúng ta tập trung vào các mối liên hệ giữa hệ vi sinh vật, chế độ ăn uống, chất chuyển hóa và phản ứng miễn dịch trong các bệnh lý về da. Cần mở rộng hiểu biết về da và hệ vi sinh vật đường ruột bao gồm các cơ chế nền tảng để làm sáng tỏ sự tham gia của vi sinh vật trong các bệnh ngoài da ở người và phát triển các phương pháp điều trị mới.
(a) Cạnh tranh về các thành phần trong chế độ ăn uống (như chất nền tăng trưởng): Việc nuôi cấy probiotic khi được sử dụng sẽ điều chỉnh hệ vi sinh vật và / hoặc thay đổi các thuộc tính trao đổi chất thông qua việc cạnh tranh các chất dinh dưỡng. Gordon và các đồng nghiệp đã thực hiện các vi phiên mã để làm sáng tỏ những thay đổi trong ruột chuột khi sử dụng probiotic (Sonnenburg et al. 2006). Một sự thay đổi trong biểu hiện di truyền của các chất diệt khuẩn đã được quan sát thấy ở những con chuột không có mầm bệnh khi sử dụng Lactobacillus casei. Các probiotic cạnh tranh chất nền sẵn có và thay đổi mô hình sử dụng carbohydrate (O’Toole và Cooney 2008).
(b) Chuyển đổi sinh học của đường thành các sản phẩm lên men có đặc tính ức chế: L. plantarum lên men đường thành rượu có tác dụng kháng khuẩn (Hedberg et al. 2008). Sự chuyển đổi sinh học của đường thông qua quá trình lên men thành rượu dẫn đến sản xuất các sản phẩm kháng khuẩn có đặc tính ức chế giúp chống lại các sinh vật gây bệnh.
(c) Tiết ra các chất kháng khuẩn như bacteriocin có tác dụng đối kháng trực tiếp với mầm bệnh: Sức khỏe da của vật chủ bị ảnh hưởng bởi hệ vi sinh vật hội sinh giúp bảo vệ khỏi một loạt các sinh vật lây nhiễm. Bacteriocin được tạo ra bởi các hệ vi sinh vật hội sinh này được tổng hợp bởi các ribosome và bền với nhiệt. Chúng đóng vai trò là các protein kháng khuẩn có khả năng ức chế vi khuẩn lây nhiễm trên diện rộng cũng như hẹp (O’Sullivan et al. 2019). Có một mối liên hệ chặt chẽ giữa hệ vi sinh vật và cân bằng nội môi niêm mạc của vật chủ. Probiotics trình diện các yếu tố vi khuẩn liên quan đến việc tiêu diệt các tác nhân lây nhiễm, giúp tăng cường sức khỏe. Các thành phần có trọng lượng phân tử thấp này bao gồm các axit hữu cơ, cụ thể là axit lactic và axit axetic, và các chất kháng khuẩn như bacteriocin. Các ví dụ phổ biến về bacteriocin bao gồm lactacin B được sản xuất bởi Lactobacillus acidophilus và plantaricin được sản xuất bởi Lactobacillus plantarum. Các axit hữu cơ và các hợp chất bacteriocin đã được chứng minh là thành công trong việc ức chế vi khuẩn gram âm như Helicobacter pylori (Maldonado Galdeano et al. 2019). Trong các mô hình chuột bị suy giảm miễn dịch, một tác nhân bacteriocin được sản xuất bởi Bifidobacterium bifidum, cụ thể là bifidocin B, được báo cáo là có thể ức chế nhiễm trùng do Salmonella typhimurium gây ra (Matsumoto et al. 2008).
(d) Cạnh tranh loại trừ ở các vị trí liên kết: cạnh tranh loại trừ đối với vi khuẩn gây bệnh có thể đạt được bằng cách cạnh tranh trực tiếp hoặc gián tiếp về chất dinh dưỡng. Các phối tử bề mặt có trong probiotic cạnh tranh với mầm bệnh ở các vị trí bám vào. Hơn nữa, probiotic cũng tăng cường khả năng miễn dịch của vật chủ, hỗ trợ sức đề kháng chống lại các sinh vật gây bệnh (Callaway et al. 2008). Sự xâm chiếm của probiotic tạo ra các phân tử axit béo chuỗi ngắn. Các hợp chất nằm trên bề mặt vi khuẩn hoạt động như một phối tử gắn vào các thụ thể của biểu mô ruột vật chủ. Phần đính kèm này trải qua một loạt các con đường tín hiệu (Monteagudo-Mera et al. 2019). Lactobacillus rhamnosus hoạt động bằng cách cạnh tranh loại trừ với Enterococcus faecium chống lại vi khuẩn enterococci kháng vancomycin (Tytgat et al. 2016). Sự cản trở cấu trúc tạo điều kiện thuận lợi cho việc cạnh tranh loại trừ Escherichia coli, Salmonella typhimurium và Yersinia pseudotuber tuberculosis bởi Lactobacillus acidophilus (Coconnier et al. 1993). Các dạng bất hoạt do nhiệt của các chủng Lactobacillus reuteri thành công trong việc cạnh tranh và do đó thay thế các mầm bệnh được chọn. Tuy nhiên, sự ức chế này phụ thuộc vào dòng với LR6 có đặc tính ức chế cao nhất đối với Listeria monocytogenes và Enterococcus faecalis (Singh và cộng sự 2017).
(e) Xâm chiếm và bám dính vào ruột kết và củng cố chức năng hàng rào của niêm mạc ruột giúp kiểm soát nhiễm trùng đường ruột và dị ứng thực phẩm: Hàng rào biểu mô thích hợp trong việc chống lại sự tấn công của vi khuẩn cũng như ngăn chặn sự phổ biến của chúng vào các mô sâu hơn. Hàng rào bị phá vỡ dẫn đến tình trạng viêm và mất khả năng chống chịu với hệ vi sinh vật. Việc sử dụng probiotic góp phần tạo ra một hàng rào biểu mô khỏe mạnh bằng cách giảm tính thấm của tế bào. Các probiotic này cung cấp khả năng phòng thủ chống lại các sinh vật lây nhiễm (Ohland và Macnaughton 2010). Sự phiên mã của mucin MUC3 do Lactobacillus tạo ra giúp tăng cường bảo vệ biểu mô vốn là mục tiêu chính của các sinh vật gây bệnh (Mack et al. 2003). Lactobacillus fermentum ME-3 là một probiotic có chức năng kép chống lại vi khuẩn và stress oxy hóa. Nó có thể làm giảm vi khuẩn gram âm cũng như Enterococci và Staphylococcus aureus. Viên nang chứa ME-3 đã được thử nghiệm về hiệu quả của chúng trong cả nghiên cứu lâm sàng mù đôi ngẫu nhiên có đối chứng với giả dược và ngẫu nhiên đối chứng với giả dược. Kết quả cho thấy lợi ích trong việc duy trì sức khỏe hệ vi sinh vật đường ruột (Mikelsaar và Zilmer 2009). Một nghiên cứu khác trên dòng tế bào ruột HT-29 báo cáo rằng Lactobacillus plantarum tương tác với các tế bào đuôi gai của ruột non và ảnh hưởng đến phản ứng của tế bào T cũng như sự chuyển vị của NF-κB p65 trong biểu mô. Sử dụng probiotic giúp tăng cường sức khỏe hàng rào bằng cách sắp xếp lại cấu trúc protein của các điểm nối tight junction hướng tới các đường dẫn tín hiệu thụ thể toll-like có trong ruột (Zhai và cộng sự 2016). MUC2 mucin và cytokine ảnh hưởng đến hệ thống miễn dịch của thành ruột. Trong một nghiên cứu khác, Lactobacillus acidophilus A4 được báo cáo là có tác dụng điều hòa MUC2 mucin và cytokine và đã thành công trong việc ức chế sự bám dính của Escherichia coli (Kim và cộng sự 2008).
(f) Giảm viêm tăng cường hoạt động miễn dịch không đặc hiệu của bạch cầu hạt trong máu: Lactobacillus casei làm giảm viêm da bằng cách ảnh hưởng đến cả protein đặc hiệu và hapten đặc hiệu tế bào T CD4 +. Việc giảm tuyển dụng các tế bào T CD4 trong da được quan sát thấy trong giai đoạn có triệu chứng của rối loạn da. Điều trị bằng probiotic ở chuột nhạy cảm với hapten giúp tăng cường sự hiện diện của FoxP3 + T-reg và tổng hợp IL-10 bởi tế bào T điều hòa CD4 + CD25 + trong các hạch bạch huyết của da (Hacini-Rachinel et al. 2009). Bacteroides fragilis polysaccharide A tạo ra phản ứng qua trung gian IL-10 trong tế bào T của vết cắt. Bằng cách này, ngăn chặn sự tiến hóa của các tế bào TH17 có chức năng ngăn chặn sự biến dạng trong thành ruột (Cristofori et al. 2021). Lactobacillus reuteri 100–23 thúc đẩy cảm ứng các cytokine chống viêm, cụ thể là IL-10. Các cytokine tiền viêm bị ức chế bởi các yếu tố hòa tan có nguồn gốc từ Lactobacillus reuteri. Chủng K12 của Streptococcus salivarius ức chế tổng hợp cytokine tiền viêm IL-8 trong tế bào sừng và tế bào biểu mô bằng cách ức chế con đường NK-kappa B (Kober và Bowe 2015).
Phục hồi và hydrat hóa hàng rào da bị tổn thương
Biểu bì của động vật có vú có khả năng tự đổi mới trong thời gian nội môi bị gián đoạn và khi có bất kỳ tổn thương nào. Lớp biểu bì phân tầng thực hiện điều này bằng cách bảo tồn các tế bào có thể trải qua quá trình nguyên phân để trở nên hoạt động. Nguồn gốc của hàng rào này bắt nguồn từ tử cung và tiếp tục tái lập bất cứ khi nào muốn (Segre 2006). Trong điều kiện bình thường, vết thương sẽ kích thích giải phóng cytokine và tăng trưởng tế bào sừng. Tế bào lympho T tiếp cận vùng da bị tổn thương. Ngược lại, khi da bị tổn thương, phục hồi hàng rào không thành công và da sẽ bị viêm. Nếu không có phục hồi hàng rào, độ ẩm cân bằng nội môi sẽ sụp đổ dẫn đến rối loạn trầm trọng hơn vì các chất gây dị ứng và hóa chất tiếp tục thâm nhập sâu hơn vào da. Hơn nữa, đã có một liên kết gen được thiết lập đối với các rối loạn viêm như bệnh vẩy nến và viêm da dị ứng trên nhiễm sắc thể, tạo điều kiện thuận lợi cho việc xây dựng và điều chỉnh hàng rào. Liên kết bộ gen cần duy trì chức năng hàng rào để chống lại các rối loạn viêm. Phục hồi chức năng rào cản có thể hỗ trợ trong các rối loạn viêm khác nhau (Segre 2006). Một nghiên cứu khác của Horii năm 2014 báo cáo rằng việc uống Lactobacillus brevis ở động vật gặm nhấm về cơ bản làm giảm đáng kể sự mất độ ẩm bằng cách tăng cường sản xuất serotonin thông qua tế bào enterochromaffin nằm trong ruột. Serotonin làm giảm sản lượng giao cảm động mạch và mặt khác, tăng cường lưu lượng máu qua da (Horii et al. 2014). Sử dụng probiotics bôi tại chỗ hoặc đường uống có thể tạo điều kiện phục hồi hàng rào.
Điều chỉnh cân bằng nội môi của da
Cân bằng nội môi ở da ảnh hưởng đến phản ứng viêm và các thành phần tế bào sinh miễn dịch. Hệ sinh vật da có vai trò thích hợp trong việc duy trì cân bằng nội môi của da. Tuy nhiên, sự cân bằng nội môi này thay đổi thường xuyên và phụ thuộc vào nhiều yếu tố như chế độ ăn uống, tập thể dục, thuốc, phẫu thuật, sức khỏe tâm thần, điều kiện khí hậu và sức khỏe thể chất. Các loài ưu thế của mọi vùng trên da là duy nhất cho vị trí của nó. Các loài chịu ảnh hưởng bởi độ ẩm gồm Staphylococcus và Corynebacterium. Ngược lại, vi khuẩn Propionibacterium phát triển trong điều kiện nhiều bã nhờn. Probiotics cũng hỗ trợ điều chỉnh phản ứng miễn dịch hệ thống liên quan đến việc kích thích giải phóng cytokine ảnh hưởng đến việc điều chỉnh cân bằng nội môi của da. Vi khuẩn hội sinh cư trú trên da bảo vệ khỏi Staphylococcus aureus bằng cách tăng sản xuất peptide kháng khuẩn. Ngoài ra, đối với bệnh viêm da cơ địa dị ứng, những vi khuẩn này tăng cường ceramide thường trú trên da, cải thiện ban đỏ và vảy da, do đó, làm giảm vi khuẩn gây bệnh và duy trì cân bằng nội môi của da (Knackstedt et al. 2020). Da của chúng ta thường xuyên tiếp xúc với các loại oxy phản ứng có nguồn gốc từ các yếu tố môi trường chủ yếu là bức xạ UV và các quá trình trao đổi chất khác. Những loại này là những chất có khả năng gây ung thư, và do đó, sự sẵn có của các sản phẩm chống oxy hóa sẽ hạn chế sự mất cân bằng và phục hồi cân bằng nội môi của da. Cutibacterium acnes tiết ra một loại protein gọi là RoxP có khả năng chống oxy hóa. Nó cũng đã được chứng minh là cung cấp vi khuẩn cư trú trên da người (Andersson et al. 2019). Bên cạnh đó, probiotics cũng cải thiện phản ứng miễn dịch toàn thân bằng cách điều chỉnh việc giải phóng các cytokine duy trì cân bằng nội môi của da (Farage et al. 2010).
Giảm viêm da
Viêm da được biểu hiện bằng chất P đóng vai trò là chất trung gian chính để tăng cường phản ứng viêm và tiết bã nhờn dư thừa. Gueniche và cộng sự báo cáo rằng Lactobacillus paracasei có thể điều chỉnh cân bằng nội môi miễn dịch của da. Họ đã quan sát thấy sự giảm nồng độ chất P cùng với tăng cường sự giãn nở của các mạch máu và sự suy giảm của các tế bào mast. Tất cả những yếu tố này đã góp phần thiết lập cân bằng nội môi ở da (Gueniche và cộng sự 2010). Một nhóm khác đánh giá phản ứng sinh miễn dịch của Lactobacillus casei trong bệnh viêm da. Sự điều hòa phản ứng viêm da có đặc điểm là giảm tế bào T tác động CD8 + do đó làm giảm mức độ nghiêm trọng của bệnh (Chapat và cộng sự 2004). Trong mụn trứng cá, quá trình peroxy hóa lipid rất cao, thay đổi theo cơ địa. Điều này tạo ra nhu cầu về chất chống oxy hóa để thiết lập cân bằng nội môi. Probiotics đường uống làm giảm stress có nguồn gốc từ quá trình oxy hóa. Cơ chế này điều chỉnh việc sản xuất các phân tử trung gian gây viêm, cụ thể là cytokine và interleukin alpha (Bowe và Logan 2011). Một sinh vật khác là Streptococcus salivarius hiện diện như một thành phần bình thường của hệ vi sinh vật miệng. Nó đã được thấy giải phóng một chất giống như bacteriocin có tác dụng ức chế chống lại Staphylococcus epidermidis, Propionibacterium acnes và Staphylococcus aureus gây rối loạn da. Chất giống bacteriocin có khả năng ức chế trực tiếp stress do viêm và do đó có thể được chứng minh là một liệu pháp kháng khuẩn hiệu quả (Oh et al. 2006).
Cải thiện sự phát triển của lông, tóc
Khi cho chuột cái dùng sữa chua hoặc vi khuẩn đã được tinh chế, sự cải thiện về sức khỏe của lông đã được quan sát thấy trong một nghiên cứu trong đó tác dụng có lợi là do tiêu thụ vi khuẩn hiện diện tự nhiên trong sữa chua, cụ thể là Lactobacillus reuteri (Levkovich et al. 2013). Một nghiên cứu in vivo khác trên những con chuột sử dụng Lactobacillus reuteri cho thấy rằng làn da khỏe mạnh hơn, có sự hình thành nang lông liên tục và tăng cường sự phát triển của lông là do các thành phần không phải protein, bền với nhiệt có nguồn gốc từ vi khuẩn. Các thành phần này thành công trong việc ức chế TNF-α chịu trách nhiệm cho cản trở sự phát triển của tóc qua trung gian viêm (Lee et al. 2016).
Giảm phản ứng của mô ngoại vi với stress
Sử dụng probiotics được báo cáo là làm giảm stress liên quan đến cảm ứng viêm da thần kinh, do đó cải thiện các phản ứng mô ngoại vi. Các bằng chứng khoa học cho thấy điều biến sinh miễn dịch tại chỗ cũng như toàn thân. Vi khuẩn và các chất chuyển hóa của chúng can thiệp vào các con đường nội tiết thần kinh ảnh hưởng đến các phản ứng qua trung gian stress trên da. Việc sử dụng Lactobacillus helveticus cho động vật gặm nhấm đã hỗ trợ lợi ích sức khỏe của probiotic được đề xuất và dẫn đến làm giảm mức corticosterone và hormone vỏ thượng thận gây tổn thương mô khi bị stress (Sarkar et al. 2016). Trong mô hình chuột, Lactobacillus reuteri được chứng minh là có tác dụng giảm viêm do căng thẳng (Mu et al. 2018). Lactobacilli trong ruột đã được chứng minh là kích thích sự tổng hợp các hợp chất hoạt động thần kinh, cụ thể là catecholamine và axit gamma-aminobutyric. Giảm nồng độ cortisol được quan sát thấy trong nước tiểu của người và chuột khi sử dụng các sản phẩm bao gồm Lactobacillus helveticus và Bifidobacterium longum. Kết quả là, việc giảm phản ứng với stress cũng được quan sát thấy (Lukic et al. 2017).
Ảnh hưởng trực tiếp đến ứng dụng bôi ngoài da
Ức chế mầm bệnh bằng cách cạnh tranh loại trừ
Greenberg là người đầu tiên sử dụng thuật ngữ “cạnh tranh loại trừ” (Greenberg 1969). Khái niệm cơ bản là tình huống mà hai hoặc nhiều hơn hai loài vi sinh vật cạnh tranh cùng một mục tiêu. Loài có hiệu suất cao nhất sẽ liên kết với vị trí thụ thể loại trừ những loài khác và do đó sẽ biểu hiện bản thân chúng bằng cách làm im những loài khác. Các cơ chế loại trừ là khác nhau đối với các loài khác nhau. Một số cơ chế là loại bỏ các vị trí thụ thể có sẵn của vi khuẩn, tạo ra một hệ thống nhân bản thù địch, cạnh tranh cạn kiệt các chất dinh dưỡng thiết yếu, và bài tiết và sản xuất các chất chuyển hóa có chọn lọc hoặc các chất kháng khuẩn (Mead 2000).
Bifidobacteria và Lactobacilli được báo cáo là có thể cản trở nhiều loại mầm bệnh, bao gồm E. coli, Salmonella, Helicobacter pylori và Rotavirus (Bermudez-Brito et al. 2012). Probiotics ức chế sự bám dính của mầm bệnh bằng cách kích thích các tế bào biểu mô ruột. Các vi khuẩn đường ruột cho thấy sự tương tác phức tạp giữa vi khuẩn này với vi khuẩn khác. Sự tương tác này làm trung gian cho sự cạnh tranh các chất dinh dưỡng hiện tại và cả các vị trí bám dính của niêm mạc. Để đạt được lợi thế cạnh tranh bổ sung, các vi khuẩn probiotic cũng có thể sửa đổi môi trường của chúng để tạo ra một hệ phản chiếu thù địch đối với các mầm bệnh cạnh tranh khác. Việc sản xuất và tiết ra các chất kháng khuẩn như axit lactic và axit axetic có thể được coi là một ví dụ về biến đổi môi trường (Schiffrin và Blum 2002). Một số ít Lactobacilli và Bifidobacteria đại diện cho các đặc tính liên kết carbohydrate với một số tác nhân gây bệnh đường ruột nhất định. Tính đặc hiệu này làm cho chúng cạnh tranh với các mầm bệnh cụ thể đối với các vị trí liên kết thụ thể có trên tế bào chủ (Mukai et al. 2002). Các chủng probiotic được báo cáo là phát triển sự cản trở cấu trúc tại các thụ thể gây bệnh của tế bào ruột và do đó cản trở sự gắn kết của vi khuẩn gây bệnh (Bernet et al. 1994).
Sản xuất bacteriocin làm chất kháng khuẩn
Bacteriocin là các chất kháng khuẩn được tạo ra bởi probiotic. Đây là một trong những yếu tố được thảo luận nhiều nhất chịu trách nhiệm cho các hoạt động khác nhau của probiotic (Bermudez-Brito et al. 2012). Một số bacteriocin được tạo ra bởi vi khuẩn gram dương là plantaricin từ L. plantarum, lactacin B từ L. acidophilus, và nisin từ
Lactococcus lactis. Vi khuẩn lactic tạo ra bacteriocin, một dạng peptit kháng khuẩn. Các bacteriocin này thường được báo cáo là có một vùng hoạt động hẹp và điều đó cũng xảy ra đối với các vi khuẩn có liên quan chặt chẽ. Mặt khác, một số có hoạt tính cao chống lại các mầm bệnh từ thực phẩm (Nielsen et al. 2010). Bifidocin B, một loại bacteriocin duy nhất được sản xuất bởi B. bifidum NCFB 1454, được báo cáo là có hoạt tính đối với vi khuẩn gram dương (Yildirim et al. 1999). Nói chung, bacteriocin hoặc ức
chế tổng hợp thành tế bào hoặc tạo thành lỗ trong thành tế bào của tế bào đích và do đó làm trung gian tiêu diệt tế bào mầm bệnh (Hassan và cộng sự 2012). Ví dụ, nisin nhắm vào lipid II, tiền chất cuối cùng của thành tế bào. Lipid II bị ức chế bởi sự hình thành phức hợp, và do đó quá trình sinh tổng hợp thành tế bào bị ức chế. Do đó, phức hợp được hình thành sẽ tập hợp lại và tích hợp các peptit của thành tế bào đích để tạo thành các lỗ trên màng (Bierbaum và Sahl 2009). Các chủng có thể tạo ra bacteriocin được báo cáo là có hiệu quả cạnh tranh với môi trường vi sinh vật phức tạp. Đây có thể được coi là kết quả của hoạt động kháng khuẩn đồng thời của chúng (O’Shea et al. 2012).
Duy trì độ ẩm và độ đàn hồi của da
Duy trì đủ độ ẩm cho da là một trong những yêu cầu hàng đầu của một làn da khỏe mạnh. Làm ẩm da liên quan trực tiếp đến giá trị độ ẩm của da, là một thành phần cơ bản của quá trình chăm sóc da. Lớp sừng là lớp chính giữ nước và cũng hoạt động như một hàng rào chống mất nước (Verdier-Sevrain và Bonte 2007). Hàng rào có cấu trúc “gạch và vữa” được đặc trưng bởi keratin, filaggrin và các phiến sừng được bao phủ. Ngoài ra, chất béo có mặt hoạt động như một con dấu niêm phong cho phong bì. Các phân tử protein khác nhau, cụ thể là loricrin và filaggrin giúp tạo điều kiện thuận lợi cho hàng rào bằng cách tạo ra nhiều loại kết nối bao gồm các điểm nối, kết dính và khe hở (Jung et al. 2019). Bifidobacterium longum là một loại vi khuẩn không nhân rộng được sử dụng cho các nghiên cứu trên người. Chiết xuất hoạt chất phân giải từ Bifidobacterium longum reuteri được chứng minh là giúp làm dịu làn da nhạy cảm và tăng cường sức đề kháng của da đối với các tác động vật lý và hóa học (Arck et al. 2010). Trong một nghiên cứu lâm sàng, được thực hiện trên 20 đối tượng nữ da trắng khỏe mạnh để nghiên cứu ảnh hưởng của nồng độ ceramide và lão hóa da, người ta quan sát thấy rằng điều trị da bằng chế phẩm Streptococcus thermophilus làm tăng hoạt tính của enzyme sphingomyelinase dẫn đến tăng ceramide trong lớp sừng. Điều này dẫn đến sự cải thiện tổng thể trong việc phục hồi hàng rào và duy trì độ ẩm qua da (Di Marzio et al. 2008). Độ đàn hồi của da là đặc tính duy trì vẻ ngoài của da. Độ đàn hồi của da càng nhiều, làn da sẽ trẻ trung hơn. Độ đàn hồi của da giảm được coi là có liên quan trực tiếp đến sự hình thành nếp nhăn. Có một số báo cáo chứng minh vai trò của độ đàn hồi của da với quá trình lão hóa và nếp nhăn (Fujimura et al. 2007). Probiotics được báo cáo là làm tăng mức độ làm ẩm của da. Sữa lên men hoặc probiotic đã được báo cáo là can thiệp vào độ ẩm bình thường của lớp sừng và được phát hiện là làm tăng mức độ làm ẩm của nó (Nakamura et al. 2016). Có một số lý do liên quan đến độ đàn hồi của da. Chủ yếu là thay đổi hệ vi sinh da, thay đổi thành phần lipid của lớp sừng và giảm mức độ collagen. Một nghiên cứu sử dụng các sản phẩm phân giải của Lactobacillus rhamnosus trên một mô hình tái tạo lại biểu bì của con người được gọi là Keraskin ™ đã ghi nhận rằng việc sử dụng probiotics cải thiện sự biểu hiện của các phân tử protein nối cụ thể là occludin và claudin, và các protein giúp phục hồi và hydrat hóa hàng rào bảo vệ da cụ thể là filaggrin và loricrin (Jung và cộng sự 2019).
Sửa chữa mô biểu bì và bì
Các mô biểu bì và bì là mô bị ảnh hưởng nhiều nhất trong bất kỳ bệnh lý da tại chỗ nào, chủ yếu là trong trường hợp vết thương. Bất kỳ tổn thương nào đối với các lớp này có thể dẫn đến hình thành vết thương và sẹo. Việc sửa chữa lại các mô này rõ ràng là mối quan tâm hàng đầu để có được vẻ ngoài và sức khỏe làn da tốt. Probiotics được báo cáo là có lợi trong việc lành thương do hoạt động của chúng trên các lớp biểu bì và bì. Probiotics được báo cáo là trung gian sản xuất và giải phóng beta-defensins và do đó tăng cường khả năng miễn dịch của da. Bằng cách này, chúng hoạt động như các cơ quan tiếp nhận tín hiệu chống lại mầm bệnh (Fijan và cộng sự 2019). Lactobacillus rhamnosus GG được báo cáo là có tác dụng phân bào và cũng làm tăng tái tạo niêm mạc (Caballero-Franco et al. 2007). Axit hyaluronic là thành phần hình thành chất nền của da, chịu trách nhiệm duy trì cấu trúc bình thường và các chức năng của hàng rào biểu bì. Nó ảnh hưởng đến sự tăng sinh, biệt hóa tế bào và do đó sửa chữa mô. Các probiotic vi sinh vật khác nhau có thể tự sản xuất axit hyaluronic và thậm chí có thể nâng cao mức độ của nó trong da và giúp tái tạo mô (Lew et al. 2013).
Tạo ra ceramide và mucin
Ceramides là phân tử giữ nước chính có trong khoảng gian bào của lớp sừng. Đây là thành phần lipid chính và được cho là có tác dụng duy trì tính chất hàng rào của biểu bì. Những chất này cũng đóng vai trò thiết yếu trong việc duy trì tính thấm nước qua da (Coderch và cộng sự 2003). Bất kỳ sự can thiệp nào vào mức ceramide đều có thể dẫn đến các bệnh về da khác nhau như viêm da cơ địa dị ứng (Jensen et al. 2005).
Lớp chất nhầy đại diện cho tuyến phòng thủ đầu tiên đối với bất kỳ lớp biểu mô nào. Mucin là thành phần chính được sản xuất và tiết ra qua lớp này. Chất nhầy có thể được định nghĩa là các glycoprotein phức tạp lớn. Chúng hạn chế sự tiếp cận của các yếu tố môi trường đối với các tế bào biểu mô. Bất kỳ sự thay đổi nào về nồng độ mucin đều có thể gây viêm. Chúng tham gia vào cả chức năng hàng rào và sửa chữa (Caballero Franco et al. 2007; Gaudier et al. 2005). Probiotics được báo cáo là làm tăng mức độ ceramide trên lớp sừng ở cả người khỏe mạnh và bệnh nhân viêm da cơ địa dị ứng. Lượng ceramide tăng lên có tác dụng giảm khô, mất nước, mất màu da và căng mọng (Jensen et al. 2005). Nhiều probiotics được báo cáo hoạt động của chúng nâng cao mức độ mucin và do đó có thể điều trị tích cực các bệnh liên quan đến viêm khác nhau. Probiotics cũng được báo cáo để điều chỉnh độ dày của lớp chất nhầy bằng cách điều chỉnh gen mucin (Caballero-Franco et al. 2007).
Duy trì độ pH của làn da khỏe mạnh
Độ pH của da đóng một vai trò rất quan trọng trong việc duy trì tình trạng khỏe mạnh của da bao gồm cấu trúc (tính toàn vẹn và tính thẩm thấu của lớp sừng) và các chức năng (cân bằng nội môi) (Feingold 2007). Độ pH hơi axit (5,5–6,5) của da có nhiệm vụ trung hòa các sản phẩm gốc kiềm (chất hoạt động bề mặt khắc nghiệt), ức chế sự phát triển của mầm bệnh và cung cấp môi trường tối ưu cho hệ sinh vật tự nhiên của da. Lớp phủ hỗ trợ trong việc ngăn chặn sự xâm nhập của mầm bệnh, duy trì độ ẩm thích hợp và điều chỉnh các hoạt động bình thường của enzym (Mauro 2006). Bất kỳ loại mất cân bằng độ pH nào trên da, có tính axit hoặc kiềm, đều dẫn đến các chức năng hàng rào bị tổn hại. Sự tổng hợp các lipid thiết yếu của da bị suy giảm khi độ pH tăng cao dẫn đến mất nước quá nhiều và do đó da khô.
Tương tự, sự gia tăng độ pH của lớp sừng cũng liên quan đến một số rối loạn da, như viêm da cơ địa dị ứng, viêm da tiết bã nhờn và chàm cấp tính (Roudsari et al. 2015). Da bị tổn thương cũng trông kém đàn hồi hơn, trở nên nhạy cảm / quá mẫn cảm với các tác nhân từ môi trường và dễ bị một số bệnh nhiễm trùng da. Hơn nữa, ở cấp độ phân tử, những thay đổi ở da lão hóa bao gồm tăng độ pH của da cùng với giảm khả năng dập tắt các loại oxy phản ứng (Cinque et al. 2010) và kích hoạt hoạt động của protease (Hachem et al. 2003).
Một số nghiên cứu và các chuyên gia nghiên cứu đã gợi ý rằng probiotic và các thành phần của chúng bao gồm chất chuyển hóa, chất phân giải và hoạt chất sinh học có thể thay đổi các khía cạnh được liệt kê ở trên, bao gồm cả lão hóa da. Ngoài bacteriocin, probiotics còn tạo ra các phân tử có tính axit khác như axit béo tự do, axit lipoteichoic và axit linoleic liên hợp như một sản phẩm cuối cùng của quá trình trao đổi chất. Hơn nữa, việc sử dụng probiotics với lactose, glucose và các loại đường khác dẫn đến quá trình chuyển hóa lên men tạo ra axit lactic thông qua quá trình chuyển hóa lên men (Roudsari et al. 2015). Axit do probiotics tiết ra có nhiệm vụ duy trì môi trường axit yếu của da. Do đó, probiotics được báo cáo là có thể khôi phục lại độ pH bình thường của da và mức độ hoạt động của protease như trong trường hợp một làn da trẻ hơn và khỏe mạnh hơn (Kober và Bowe 2015).
Ảnh hưởng của các chất chuyển hóa, các sản phẩm phụ và các thành phần cấu trúc của probiotic
Tác dụng của probiotic sống trong việc sử dụng đường uống và bôi ngoài da đã được chứng minh và công bố rõ ràng. Tuy nhiên, một số nhóm nghiên cứu và các công ty tiếp thị cũng đã đề xuất việc sử dụng các thành phần probiotics khác bao gồm các chất chuyển hóa và các thành phần ngoại bào của nó. Chất béo bao gồm các axit (hyaluronic, acetic và lactic), peptidoglycan, diacetyl, sphingomyelinase và axit
lipoteichoic. Có bằng chứng cho thấy rằng các thành phần như vậy có thể tăng cường cân bằng nội môi, hàng rào và hệ thống miễn dịch của da (Lew et al. 2013).
Một protein nền ngoại bào, axit hyaluronic (HA) hiện diện chủ yếu trong da, được biết là cung cấp hỗ trợ cấu trúc cho tế bào biểu bì và chịu trách nhiệm liên kết và giữ các phân tử nước trong tế bào mô đệm (Papakonstantinou et al. 2012). HA cũng được phát hiện có liên quan đến quá trình hình thành mạch, sửa chữa mô và sự di chuyển của các nguyên bào sợi. Mức độ HA trong tế bào biểu bì giảm mạnh khi lão hóa. Do đó, HA là một thành phần quan trọng cần thiết để duy trì làn da trong tình trạng khỏe mạnh. Một số chủng vi khuẩn bao gồm Lactobacillus và Bifidiobacterium đã cho thấy có khả năng tạo ra HA (Ouwehand et al. 2017). Streptococcus thermophilus YIT2084, Pasteurella multocida, Streptococcus Zooepidemicus, Bacillus subtilis168, Streptococcus equisimilis, Lactococcus lactis LL-NAB, Bifidobacterium longum BL 8643, B. longum BB 8843, B. bifidum BB 12, Lactobacillus rhamnosus FTD1, Lactobacillus rhamnosus FTD1 83TD một số chủng được báo cáo là sản xuất axit hyaluronic cả ngoại bào và nội bào (Lew và cộng sự, 2013). HA thương mại được sản xuất từ Streptococcus nhóm C giảm độc lực được biết là tương đối tinh khiết hơn so với thu được từ nguồn động vật (Lew và Liong 2013). Tương tự, sphingomyelinase, một loại enzyme có trong các thể phiến biểu bì và bản chất của lớp sừng, chịu trách nhiệm sản xuất ceramides và phosphorylcholine và do đó duy trì các chức năng của hàng rào bảo vệ da. Bên cạnh việc duy trì mức độ hydrat hóa cho da, ceramide sphingolipids cũng chứng minh tác dụng kháng khuẩn chống lại vi khuẩn Propionibacterium acnes (Kober và Bowe 2015). Một số chủng lactobacillus, như L. casei BT 1268, L. rhamnosus FTDC 8313, và L. gasseri FTDC 8131, và bifidiobacterium, như B. animalis subsp. lactis BB 12, B. longum BL 8643 (Lew et al. 2013), được biết là làm giảm các chức năng của hàng rào bảo vệ da bằng cách sản xuất shingomylinase. Mức độ tăng ceramide cũng được báo cáo trong tế bào sừng ở người (Di Marzio và cộng sự 1999) và ở những người tình nguyện da trắng khỏe mạnh đang điều trị bằng Streptococcus thermophilus.
Peptidoglycan (PG), một thành phần quan trọng được tìm thấy nhiều trong thành tế bào của vi khuẩn gram dương, chịu trách nhiệm bảo vệ da chống lại các tác nhân gây bệnh bằng cách kích thích miễn dịch bẩm sinh thông qua việc kích hoạt thụ thể Toll-like-2 (TLR2) (Niebuhr et al. 2010), yếu tố hạt nhân kB (Sorensen et al. 2005), hBD, peptide kháng khuẩn (cathelicidin LL37) (Ruiz-Gonzalez et al. 2009) và sản xuất IL-8 (Matsubara et al. 2004). Peptidoglycan cũng được biết đến là chất khởi đầu việc tuyển dụng các tế bào killer tại vị trí lây nhiễm qua trung gian của các phân tử nhận dạng PG, như CD14, protein nhận dạng PG (PGRPs), lysozyme và amidase (Lew và Liong 2013).
Tương tự, axit lipoteichoic (LTA), một nguyên tắc kích thích miễn dịch chính của vi khuẩn gram dương gây bệnh và không gây bệnh, có thể dễ dàng định vị trong thành tế bào. Aulock và cộng sự nhận thấy thành phần tế bào này chịu trách nhiệm giải phóng các chất hóa ứng động như LTB4, IL-8, yếu tố bổ thể 5a (C5a), protein hóa ứng động đại thực bào-1 (MCP-1), và yếu tố kích thích xâm chiếm G-CSF trong cơ thể người. LTA được thành lập để trở thành một chất kích thích mạnh để di chuyển các tế bào thực bào đến vị trí bị nhiễm bệnh (Aulock et al. 2003). Lactobacillus plantarum K8 được phát hiện có tác dụng chống viêm, làm lành vết thương và chống lại các tác nhân gây bệnh trên tế bào sừng thông qua ức chế interferon-gamma (IFN-γ) hoặc factoralpha hoại tử khối u (TNF-α) thông qua LTA (Brandi và cộng sự 2020).
Lactic (LA) và axit axetic (AA) là sản phẩm chính của quá trình lên men vi khuẩn. Các vi khuẩn sản xuất axit lactic tạo ra axit lactic bằng cách đồng phân hoặc dị phân của cacbohydrat (Lew và Liong 2013). Quay trở lại năm 1996, Walter cho rằng điều trị với 12% axit lactic có thể làm tăng độ săn chắc và dày của da (biểu bì và bì). Họ cũng khẳng định việc giảm thiểu các nếp nhăn, mang lại vẻ mịn màng cho làn da (Smith 1996). Axit α-hydroxy (AHA) này được sử dụng phổ biến trong mỹ phẩm và các chế phẩm bôi ngoài da khác để cải thiện quá trình lão hoá do ánh sáng, tăng sắc tố da, mụn trứng cá, da khô và ngứa. Nó được sử dụng rộng rãi như một chất tẩy tế bào chết và chất lột tẩy do tác dụng làm bong vảy da của nó, mang lại làn da trẻ trung hơn (Lew và Liong 2013). Cả LA và AA cũng được biết là có tác dụng chữa lành vết thương. Chất thứ hai hoạt động như một chất kháng khuẩn tiềm năng có tác dụng chống lại các loài gây bệnh khác nhau bao gồm Staphylococcus aureus và Pseudomonas aeruginosa (Hansson và Faergemann 1995).
Tăng cường chức năng miễn dịch và điều chỉnh sản xuất các cytokine gây viêm
Probiotics được ghi nhận tăng cường chức năng miễn dịch. Một số cơ chế có thể được cho là có liên quan đến hoạt động này, nhưng cơ chế nổi bật nhất được đưa ra là cơ chế điều hòa các cytokine gây viêm (Medina et al. 2007). Mức độ giảm đáng kể của các cytokine tiền viêm trong huyết tương và tế bào lympho của những bệnh nhân bị viêm loét đại tràng đã được báo cáo sau khi sử dụng Lactobacillus paracasei (Federico và cộng sự 2009). Giảm mức độ cytokine tiền viêm của niêm mạc và phục hồi tính toàn vẹn của hàng rào và sinh lý đại tràng đã được báo cáo khi động vật thí nghiệm được cho ăn bằng probiotics (Madsen et al. 2001). Lactobacillus casei đã được báo cáo là làm tăng nồng độ IgA bài tiết cụ thể và toàn bộ mầm bệnh ở những con chuột bị nhiễm bệnh (Maldonado Galdeano và Perdigón 2006). Lactobacillus casei được phát hiện chịu trách nhiệm điều hòa quá trình phiên mã của các gen mã hóa các cytokine gây viêm, dẫn đến tác dụng chống viêm (Tien và cộng sự 2006). Probiotics có thể điều chỉnh hệ thống miễn dịch tùy thuộc vào loài của chúng hoặc thậm chí trên dòng của cùng một loài. Probiotics có khả năng điều chỉnh các phản ứng miễn dịch theo các hướng khác nhau, điều này làm cho chúng trở thành một sản phẩm lý tưởng cho các công thức khác nhau (Medina et al. 2007).
Tương tác chéo giữa hệ vi sinh vật và hệ thống miễn dịch da
Hệ vi sinh vật trên da thành công trong việc thúc đẩy sự bảo vệ thông qua hệ thống miễn dịch. Vi khuẩn đường ruột có hiệu quả trong việc kiểm soát cân bằng nội môi giữa cơ chế tác động T và tế bào T điều hòa. Các cơ chế đặc trưng của sự điều hòa miễn dịch bẩm sinh và thích ứng của hệ vi sinh vật ở da phụ thuộc vào chủng. Staphylococcus epidermidis gây ra các tế bào T CD8 + được nuôi dưỡng bởi các tế bào đuôi gai CD103 + vào các tế bào biểu bì, thúc đẩy phản ứng kháng khuẩn của da thông qua IL-17. Quá trình sửa chữa mô được thúc đẩy bởi phản ứng tế bào T CD8 + đặc hiệu đối với Staphylococcus epidermidis. Đáp ứng này chỉ giới hạn ở các phân tử phức hợp loại I không tương hợp mô lớn không điển hình. Ngoài ra, các thành phần thành tế bào của S. epidermidis giảm viêm da bằng cách ức chế giải phóng các cytokine gây viêm cũng hỗ trợ chữa lành vết thương. Sự xâm chiếm hệ vi sinh vật trên da đặc biệt quan trọng trong giai đoạn sơ sinh để thiết lập khả năng dung nạp miễn dịch bằng cách tích lũy các tế bào điều hòa T hoạt động (Zheng et al. 2020). Rối loạn da như bệnh vẩy nến và viêm da cơ địa dị ứng liên quan đến tình trạng viêm do Th17. Sự tiếp xúc liên tục của hệ vi sinh vật giúp củng cố trục Th17 / IL-23 của viêm và các con đường điều tiết (Sherwani và cộng sự 2018). Nakatsuji và cộng sự cho thấy tác động của vi khuẩn da chung trong việc giảm viêm trong quá trình lành vết thương bằng cách điều chỉnh quá trình viêm phụ thuộc TLR3, cho thấy cách hệ vi sinh có thể điều chỉnh phản ứng viêm da cụ thể (Lai et al. 2009).
Kết luận và viễn cảnh tương lai
Theo một nghiên cứu, tỷ lệ mắc bệnh da và dưới da tăng 46,8% trong giai đoạn 1990–2017 và là nguyên nhân gây tàn tật đứng hàng thứ tư, không bao gồm tử vong (Giesey và cộng sự. 2021). Chi phí và gánh nặng tâm lý liên quan đến các bệnh ngoài da là cao và có ý nghĩa cá nhân và xã hội đáng kể. Các lựa chọn điều trị hiện tại bao gồm thuốc kháng sinh, retinoids, steroid, thuốc chống nấm và thảo dược. Tiếp tục điều trị với một số tác nhân này có thể gây ra tình trạng kháng thuốc, khiến việc điều trị không hiệu quả và tốn kém. Một số trong số này, như thuốc kháng sinh bao gồm cả thuốc chống nấm và steroid, thiếu tính đặc hiệu và do đó cho thấy kết quả điều trị kém. Hơn nữa, chúng có xu hướng làm thay đổi hệ vi sinh vật hội sinh dẫn đến các tác dụng phụ. Do đó, việc mở rộng các biện pháp can thiệp được nhắm mục tiêu vào probiotic- hệ vi sinh và bối cảnh đang phát triển để thực hiện trên các lĩnh vực người tiêu dùng, thể hiện phạm vi đáng kể.
Sử dụng probiotic đường uống cho sức khỏe đường ruột và da đã được khẳng định tốt. Khi uống vào, probiotic có tác dụng có lợi cho da thông qua tương tác chéo giữa ruột và da liên quan đến các cơ chế, như ức chế cạnh tranh, tiết ra các chất kháng khuẩn, chuyển đổi sinh học của đường, kích thích phản ứng miễn dịch và tạo ra các chất làm lành sinh học. Sự tồn tại của Trục Ruột-Da (Bowe và Logan 2011) chỉ ra rằng việc thay đổi hệ thực vật đường ruột, vốn là yếu tố cần thiết để duy trì trạng thái bình thường và khỏe mạnh của da, có thể giúp kiểm soát các bệnh về da khác nhau bao gồm cả nhiễm trùng. Các bệnh viêm da như mụn trứng cá có thể được điều trị thích hợp bằng cách uống probiotic (Kober và Bowe 2015); tuy nhiên con đường này chủ yếu là qua trung gian hệ thống miễn dịch. Do đó, nó có thể có một phạm vi hạn chế trong việc kiểm soát nhiễm trùng, trong khi thao tác trực tiếp / sửa đổi hệ sinh vật da để khôi phục lại sự mạnh mẽ của nó có thể là một lựa chọn thuận lợi hơn. Probiotic đường uống được sử dụng nhất thời có thể không tồn tại trong các điều kiện bất lợi của đường ruột và cũng không tự hình thành được trong ruột để có tác dụng lâu dài. Bôi tại chỗ là đường dùng phù hợp nhất và dễ dàng chấp nhận đối với bất kỳ loại thuốc nào (Witting et al. 2015). Tuy nhiên, việc đánh giá tác dụng của chế phẩm sinh học trên da sau khi sử dụng trực tiếp lên khu vực địa phương mới chỉ được thực hiện trong thời gian gần đây. Các chế phẩm có chứa probiotics bôi tại chỗ ngày nay đang trở nên phổ biến do có vô số tác dụng sinh lý trên da mà không có bất kỳ tác dụng phụ nào. Nhận thức của người tiêu dùng đối với các lựa chọn thay thế tự nhiên, hữu cơ và thân thiện với môi trường là lý do cho sự phổ biến của chúng.
Tuy nhiên, việc cung cấp các vi sinh vật có lợi này đến da bị thách thức bởi các khía cạnh công thức sản phẩm bao gồm (1) duy trì khả năng tồn tại trong quá trình sản xuất và bảo quản; (2) lưu lại trên da trong thời gian đủ dài để tạo ra hiệu quả; và (3) sự phát triển của chúng trên bề mặt da sau khi sử dụng. Để thay thế cho những thách thức về công thức này, một số nhóm nghiên cứu và công ty sản xuất đang kết hợp các chất lên men probiotic, chất phân giải, sản phẩm phụ và các thành phần cấu trúc thay vào đó có thể không khai thác được tất cả tác dụng của các tế bào probiotic sống. Nhìn vào tiềm năng của những vi sinh vật này và sự khan hiếm của các nghiên cứu có tổ chức và kết quả là các sản phẩm đưa ra thị trường, có rất nhiều điều mong muốn được thực hiện và đạt được.
Tài liệu tham khảo
- Akazaki S, Nakagawa H, Kazama H et al (2002) Age-related changes in skin wrinkles assessed by a novel three-dimensional morphometric analysis. Br J Dermatol 147(1):689–695
- Al-Nuaimi Y, Sherratt MJ, Griffiths CE (2014) Skin health in older age. Maturitas 79(1):256–264
- Amara AA, Shibl A (2015) Role of probiotics in health improvement, infection control and disease treatment and management. Saudi Pharm J 23(1):107–114
- Andersson T, Erturk Bergdahl G, Saleh K et al (2019) Common skin bacteria protect their host from oxidative stress through secreted antioxidant RoxP. Sci Rep 9(1):3596
- Arck P, Handjiski B, Hagen E et al (2010) Is there a ‘gut-brain-skin axis’? Exp Dermatol 19 (5):401– 405
- Aulock SV, Morath S, Hareng L et al (2003) Lipoteichoic acid from Staphylococcus aureus is a potent stimulus for neutrophil recruitment. Immunobiology 208:413–422
- Bermudez-Brito M, Plaza-Diaz J, Munoz-Quezada S et al (2012) Probiotic mechanisms of action. Ann Nutr Metab 61(2):160–174
- Bernet MF, Brassart D, Neeser JR et al (1994) Lactobacillus acidophilus LA 1 binds to cultured human intestinal cell lines and inhibits cell attachment and cell invasion by enterovirulent bacteria. Gut 35(4):483–489 Bierbaum G, Sahl HG (2009) Lantibiotics: mode of action, biosynthesis and bioengineering. Curr Pharm Biotechnol 10(1):2–18
- Bowe WP, Logan AC (2011) Acne vulgaris, probiotics and the gut-brain-skin axis—back to the future? Gut Pathog 3(1):1
- Brandi J, Cheri S, Manfredi M et al (2020) Exploring the wound healing, anti-inflammatory, antipathogenic and proteomic effects of lactic acid bacteria on keratinocytes. Sci Rep 10:11572
- Bustamante M, Oomah D, Oliveira WP et al (2020) Probiotics and prebiotics potential for the care of skin, female urogenital tract, and respiratory tract. Folia Microbiol 65(1):245–264
- Caballero-Franco C, Keller K, De Simone C et al (2007) The VSL#3 probiotic formula induces mucin gene expression and secretion in colonic epithelial cells. Am J Physiol Gastrointest Liver Physiol 292(1):G315–G322
- Callaway TR, Edrington TS, Anderson RC et al (2008) Probiotics, prebiotics and competitive exclusion for prophylaxis against bacterial disease. Anim Health Res Rev 9(2):217–225
- Chapat L, Chemin K, Dubois B et al (2004) Lactobacillus casei reduces CD8+ T cell-mediated skin inflammation. Eur J Immunol 34(9):2520–2528
- Chiller K, Selkin BA, Murakawa GJ (2001) Skin microflora and bacterial infections of the skin. J Investig Dermatol Symp Proc 6:170–174
- Cinque B, Palumbo PTC, Melchiorre E et al (2010) Probiotics in aging skin. In: Farage MK, Miller KW, Maibach H (eds) Textbook of aging skin. Springer, Berlin, pp 811–820
- Coconnier MH, Bernet MF, Chauviere G et al (1993) Adhering heat-killed human Lactobacillus acidophilus, strain LB, inhibits the process of pathogenicity of diarrhoeagenic bacteria in cultured human intestinal cells. J Diarrhoeal Dis Res 11(4):235–242
- Coderch L, Lopez O, de la Maza A et al (2003) Ceramides and skin function. Am J Clin Dermatol 4 (2):107–129 Cowdell F (2010) Promoting skin health in older people. Nurs Older People 22(1):21– 26
- Cristofori F, Dargenio VN, Dargenio C et al (2021) Anti-inflammatory and immunomodulatory effects of probiotics in gut inflammation: a door to the body. Front Immunol 12:578386
- Dawson AL, Dellavalle RP, Elston DMI (2012) Infectious skin diseases: a review and needs assessment. Dermatol Clin 30(1):141–151
- Di Marzio L, Cinque B, De Simone C et al (1999) Effect of the lactic acid bacterium Streptococcus thermophilus on ceramide levels in human keratinocytes in vitro and stratum corneum in vivo. J Investig Dermatol 113:98–106
- Di Marzio L, Cinque B, Cupelli F et al (2008) Increase of skin-ceramide levels in aged subjects following a short-term topical application of bacterial sphingomyelinase from Streptococcus thermophilus. Int J Immunopathol Pharmacol 21(1):137–143
- Evers AWM, Duller P, van-de KPCM et al (2008) The impact of chronic skin disease on daily life (ISDL): a generic and dermatology-specific health instrument. Br J Dermatol 158(1):101–108
- Farage MA, Miller KW, Elsner P et al (2010) Characteristics of the aging skin. Wound Heal Soc 2 (1):5–10
- Federico A, Tuccillo C, Grossi E et al (2009) The effect of a new symbiotic formulation on plasma levels and peripheral blood mononuclear cell expression of some pro-inflammatory cytokines in patients with ulcerative colitis: a pilot study. Eur Rev Med Pharmacol Sci 13(4):285–293
- Feingold KR (2007) The role of epidermal lipids in cutaneous permeability barrier homeostasis. J Lipid Res 48:2531–2546
- Fijan S, Frauwallner A, Langerholc T et al (2019) Efficacy of using probiotics with antagonistic activity against pathogens of wound infections: an integrative review of literature. Biomed Res Int 2019(1):1–21
- Fujimura T, Haketa K, Hotta M et al (2007) Loss of skin elasticity precedes to rapid increase of wrinkle levels. J Dermatol Sci 47(3):233–239
- Gaudier E, Michel C, Segain JP et al (2005) The VSL# 3 probiotic mixture modifies microflora but does not heal chronic dextran-sodium sulfate-induced colitis or reinforce the mucus barrier in mice. J Nutr 135(12):2753–2761
- Giesey RL, Mehrmal S, Uppal P et al (2021) The global burden of skin and subcutaneous disease: a longitudinal analysis from the Global Burden of Disease Study from 1990-2017. SKIN J Cutan Med 5:125–136
- Greenberg B (1969) Salmonella suppression by known populations of bacteria in flies. J Bacteriol 99(3):629–635 Grice EA, Segre JA (2011) The skin microbiome. Nat Rev Microbiol 9(4):244–253
- Gueniche A, Benyacoub J, Philippe D et al (2010) Lactobacillus paracasei CNCM I-2116 (ST11) inhibits substance P-induced skin inflammation and accelerates skin barrier function recovery in vitro. Eur J Dermatol 20(6):731–737
- Hachem JP, Crumrine D, Brown Be FJ et al (2003) pH directly regulates epidermal permeability barrier homeostasis, and stratum corneum integrity/cohesion. J Investig Dermatol 121 (2):345–353
- Hacini-Rachinel F, Gheit H, Le Luduec JB et al (2009) Oral probiotic control skin inflammation by acting on both effector and regulatory T cells. PLoS One 4(3):e4903
- Hansson C, Faergemann J (1995) The effect of antiseptic solutions on microorganisms in venous leg ulcers. Acta Derm Venereol 75:31–33
- Hassan M, Kjos M, Nes IF et al (2012) Natural antimicrobial peptides from bacteria: characteristics and potential applications to fight against antibiotic resistance. J Appl Microbiol 113 (4):723–736
- Hedberg M, Hasslof P, Sjostrom I et al (2008) Sugar fermentation in probiotic bacteria–an in vitro study. Oral Microbiol Immunol 23(6):482–485
- Horii Y, Kaneda H, Fujisaki Y et al (2014) Effect of heat-killed Lactobacillus brevis SBC8803 on cutaneous arterial sympathetic nerve activity, cutaneous blood flow and transepidermal water loss in rats. J Appl Microbiol 116(5):1274–1281
- Hsu DK, Fung MA, Chen HL (2020) Role of skin and gut microbiota in the pathogenesis of psoriasis, an inflammatory skin disease. Med Microecol 4(1):1–8
- Jensen JM, Forl M, Winoto-Morbach S et al (2005) Acid and neutral sphingomyelinase, ceramide synthase, and acid ceramidase activities in cutaneous aging. Exp Dermatol 14(1):609–618
- Jung YO, Jeong H, Cho Y et al (2019) Lysates of a probiotic, Lactobacillus rhamnosus, can improve skin barrier function in a reconstructed human epidermis model. Int J Mol Sci 20 (17):4289
- Kapoor R, Menon C, Hoffstad O et al (2008) The prevalence of atopic triad in children with physician-confirmed atopic dermatitis. J Am Acad Dermatol 58(1):68–73
- Kim Y, Kim SH, Whang KY et al (2008) Inhibition of Escherichia coli O157:H7 attachment by interactions between lactic acid bacteria and intestinal epithelial cells. J Microbiol Biotechnol 18 (7):1278–1285
- Knackstedt R, Knackstedt T, Gatherwright J (2020) The role of topical probiotics in skin conditions: a systematic review of animal and human studies and implications for future therapies. Exp Dermatol 29(1):15–21
- Kober WM, Bowe WP (2015) The effect of probiotics on immune regulation, acne, and photoaging. Int J Women’s Dermatol 1(2):85–89
- Lai Y, Di Nardo A, Nakatsuji T et al (2009) Commensal bacteria regulate toll-like receptor 3- dependent inflammation after skin injury. Nat Med 15(12):1377–1382
- Lee J, Yang W, Hostetler A et al (2016) Characterization of the anti-inflammatory Lactobacillus reuteri BM36301 and its probiotic benefits on aged mice. BMC Microbiol 16:69
- Levkovich T, Poutahidis T, Smillie C et al (2013) Probiotic bacteria induce a ‘glow of health’. PLoS One 8(1):e53867 Lew L-C, Liong M-T (2013) Bioactives from probiotics for dermal health: functions and benefits. J Appl Microbiol 114:1241–1253
- Lew L, Gan C, Liong M (2013) Dermal bioactives from lactobacilli and bifidobacteria. Ann Microbiol 63:1047–1055
- Lukic J, Chen V, Strahinic I et al (2017) Probiotics or pro-healers: the role of beneficial bacteria in tissue repair. Wound Repair Regen 25(6):912–922
- Mack DR, Ahrne S, Hyde L et al (2003) Extracellular MUC3 mucin secretion follows adherence of Lactobacillus strains to intestinal epithelial cells in vitro. Gut 52(6):827–833
- Madsen K, Cornish A, Soper P et al (2001) Probiotic bacteria enhance murine and human intestinal epithelial barrier function. Gastroenterology 121(3):580–591
- Maldonado Galdeano C, Perdigón G (2006) The probiotic bacterium Lactobacillus casei induces activation of the gut mucosal immune system through innate immunity. Clin Vaccine Immunol 13(2):219–226 Maldonado Galdeano C, Cazorla SI, Lemme Dumit JM et al (2019) Beneficial effects of probiotic consumption on the immune system. Ann Nutr Metab 74(2):115–124
- Matsubara M, Harada D, Manabe H et al (2004) Staphylococcus aureus peptidoglycan stimulates granulocyte macrophage colony-stimulating factor production from human epidermal keratinocytes via mitogen-activated protein kinases. FEBS Lett 566:195–200
- Matsumoto T, Ishikawa H, Tateda K et al (2008) Oral administration of Bifidobacterium longum prevents gut-derived Pseudomonas aeruginosa sepsis in mice. J Appl Microbiol 104(3):672–680
- Mauro T (2006) SC pH: measurements, origins and functions. In: Elias P, Feingold K (eds) Skin barrier. Taylor and Francis, New York Mead GC (2000) Prospects for ‘competitive exclusion’ treatment to control salmonellas and other foodborne pathogens in poultry. Vet J 159(2):111–123
- Medina M, Izquierdo E, Ennahar S et al (2007) Differential immunomodulatory properties of Bifidobacterium logum strains: relevance to probiotic selection and clinical applications. Clin Exp Immunol 150(3):531–538
- Mikelsaar M, ZilmerM(2009) Lactobacillus fermentum ME-3—an antimicrobial and antioxidative probiotic. Microb Ecol Health Dis 21(1):1–27
- Monteagudo-Mera A, Rastall RA, Gibson GR et al (2019) Adhesion mechanisms mediated by probiotics and prebiotics and their potential impact on human health. Appl Microbiol Biotechnol 103(16):6463–6472
- Mu Q, Tavella VJ, Luo XM (2018) Role of Lactobacillus reuteri in human health and diseases. Front Microbiol 9:757
- Mukai T, Asasaka T, Sato E et al (2002) Inhibition of binding of Helicobacter pylori to the glycolipid receptors by probiotic Lactobacillus reuteri. FEMS Immunol Med Microbiol 32 (2):105–110
- Nakamura K, Sakuragi N, Takakuwa A et al (2016) Paneth cell alpha-defensins and enteric microbiota in health and disease. Biosci Microbiota Food Health 35(2):57–67
- Niebuhr M, Baumert K, Werfel T (2010) TLR-2- mediated cytokine and chemokine secretion in human keratinocytes. Exp Dermatol 19:873–877
- Nielsen DS, Cho GS, Hanak A et al (2010) The effect of bacteriocin-producing Lactobacillus plantarum strains on the intracellular pH of sessile and planktonic Listeria monocytogenes single cells. Int J Food Microbiol 141(Suppl 1):S53–S59
- O’Shea EF, Cotter PD, Stanton C et al (2012) Production of bioactive substances by intestinal bacteria as a basis for explaining probiotic mechanisms: bacteriocins and conjugated linoleic acid. Int J Food Microbiol 152(3):189–205
- O’Sullivan JN, Rea MC, O’Connor PM et al (2019) Human skin microbiota is a rich source of bacteriocin-producing staphylococci that kill human pathogens. FEMS Microbiol Ecol 95(2): fiy241
- O’Toole PW, Cooney JC (2008) Probiotic bacteria influence the composition and function of the intestinal microbiota. Interdiscip Perspect Infect Dis 2008:175285
- Oh S, Kim SH, Ko Y et al (2006) Effect of bacteriocin produced by Lactococcus sp. HY 449 on skin inflammatory bacteria. Food Chem Toxicol 44(8):1184–1190
- Ohland CL, Macnaughton WK (2010) Probiotic bacteria and intestinal epithelial barrier function. Am J Physiol Gastrointest Liver Physiol 298(6):G807–G819
- Ouwehand AC, Lahtinen S, Tiihonen K (2017) The potential of probiotics and prebiotics for skin health. In: Farage MA, Miller KW, Maibach HI (eds) Textbook of aging skin, vol 2. Springer, Berlin, pp 1299–1313
- Papakonstantinou E, Roth M, Karakiulakis G (2012) Hyaluronic acid: a key molecule in skin aging. Dermatoendocrinology 4(3):253–258
- Pessemier B, Grine L, Debaere M et al (2021) Gut–skin axis: current knowledge of the interrelationship between microbial dysbiosis and skin conditions. Microorganisms 9(353):1–34
- Rather IA, Bajpai VK, Sanjay KS et al (2016) Probiotics and atopic dermatitis: an overview. Front Microbiol 7(1):1–7
- Rosenthal M, Goldberg D, Aiello A et al (2011) Skin microbiota: microbial community structure and its potential association with health and disease. Infect Genet Evol 11(5):839–848
- Roudsari MR, Karimi R, Sohrabvandi S et al (2015) Health effects of probiotics on the skin. Crit Rev Food Sci Nutr 55:1219–1240
- Ruiz-Gonzalez V, Cancino-Diaz JC, Rodriguez-Martinez S et al (2009) Keratinocytes treated with peptidoglycan from Staphylococcus aureus produce vascula endothelial growth factor, and its expression is amplified by the subsequent production of interleukin-13. Int J Dermatol 48:846–854
- Salem I, Ramser A, Isham N et al (2018) The gut microbiome as a major regulator of the gut-skin axis. Front Microbiol 9:1–14
- Sarkar A, Lehto SM, Harty S et al (2016) Psychobiotics and the manipulation of bacteria-gut-brain signals. Trends Neurosci 39(11):763–781
- Schiffrin EJ, Blum S (2002) Interactions between the microbiota and the intestinal mucosa. Eur J Clin Nutr 56(Suppl 3):S60–S64
- Segre JA (2006) Epidermal barrier formation and recovery in skin disorders. J Clin Invest 116 (5):1150–1158
- Sherwani MA, Tufail S, Muzaffar AF et al (2018) The skin microbiome and immune system: potential target for chemoprevention? Photodermatol Photoimmunol Photomed 34(1):25–34
- Sikorska H, Smoragiewicz W (2013) Role of probiotics in the prevention and treatment of meticillin resistant Staphylococcus aureus infections. Int J Antimicrob Agents 42(1):475–481
- Singh TP, Kaur G, Kapila S et al (2017) Antagonistic activity of Lactobacillus reuteri strains on the adhesion characteristics of selected pathogens. Front Microbiol 8:486
- Singh B, Catanzaro R, Mal G et al (2019) Gut microbiota and aging: targets and anti-aging interventions. Encyclopedia Biomed Gerontol 1(1):185–198
- Smith WP (1996) Epidermal and dermal effects of topical lactic acid. J Am Acad Dermatol 35:388– 391
- Sonnenburg JL, Chen CT, Gordon JI (2006) Genomic and metabolic studies of the impact of probiotics on a model gut symbiont and host. PLoS Biol 4(12):e413
- Sorensen OE, Thapa DR, Rosenthal A et al (2005) Differential regulation of betadefensin expression in human skin by microbial stimuli. J Immunol 174:4870–4879
- Tien MT, Girardin SE, Regnault B et al (2006) Anti-inflammatory effect of Lactobacillus casei on Shigella-infected human intestinal epithelial cells. J Immunol 176(2):1228–1237
- Tytgat HL, Douillard FP, Reunanen J et al (2016) Lactobacillus rhamnosus GG outcompetes Enterococcus faecium via mucus-binding pili: evidence for a novel and heterospecific probiotic mechanism. Appl Environ Microbiol 82(19):5756–5762
- Verdier-Sevrain S, Bonte F (2007) Skin hydration: a review on its molecular mechanisms. J Cosmet Dermatol 6(2):75–82
- Vijayashankar M, Raghunath N (2012) Pustular psoriasis responding to probiotics—a new insight. Our Dermatol Online 3(1):326–329
- Witting M, Obst K, Friess W et al (2015) Recent advances in topical delivery of proteins and peptides mediated by soft matter nanocarriers. Biotechnol Adv 33(6 Pt 3):1355–1369
- Yildirim Z, Winters DK, Johnson MG (1999) Purification, amino acid sequence and mode of action of bifidocin B produced by Bifidobacterium bifidum NCFB 1454. J Appl Microbiol 86 (1):45–54
- Zhai Q, Tian F, Zhao J et al (2016) Oral administration of probiotics inhibits absorption of the heavy metal cadmium by protecting the intestinal barrier. Appl Environ Microbiol 82(14):4429–4440
- Zheng D, Liwinski T, Elinav E (2020) Interaction between microbiota and immunity in health and disease. Cell Res 30(6):492–506

