Kỹ thuật y khoa
Tiếp cận bệnh nhân toan chuyển Hóa tăng Anion Gap
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Tác giả: Andrew Z. Fenves and Michael Emmett
Dịch: NT HN;
Biên tập: Dr. Tâm (NCH)
nhathuocngocanh.com – Để tải file pdf của bài viết Tiếp cận bệnh nhân toan chuyển Hóa tăng Anion Gap, xin vui lòng click vào link ở đây.
Anion gap (AG) là hiệu số nồng độ natri máu với tổng nồng độ cloride và bicarbonate. Một phép toán hữu ích chia toan chuyển hóa thành 2 nhóm: toan chuyển hóa tăng AG (HAGMA) và toan chuyển hóa tăng clo máu —và do đó phân định được nguyên nhân tiềm ẩn gây bệnh. Khi AG được so sanh với những thay đổi nồng độ bicarbonate, các rối loạn toan kiềm khác có thể được phát hiện. Trong phần này của chương trình giảng dạy, chúng tôi thảo luận về các tình huống đại diện cho một số nguyên nhân thường gặp và hiếm gặp gây toan chuyển hóa tăng AG.
Các tình huống mô phỏng nêu bật cách AG cung cấp manh mối quan trọng giúp bác sĩ lâm sàng định hướng đến chẩn đoán đúng. Chúng tôi cũng trình bày cách tính toán, và hiệu chỉnh AG trong trường hợp hạ albumin máu và tăng glucose máu nặng. Áp suất thẩm thấu huyết tương và tính osmolal gap được mô tả và khi được dùng cùng với AG để định hướng đưa ra quyết định lâm sàng.
Giới thiệu
Việc nhận biết, chẩn đoán phân biệt và điều trị thích hợp các rối loạn toan kiềm là những khía cạnh thiết yếu của chẩn đoán lâm sàng và điều trị các tình trạng này. Rối loạn toan-kiềm thường được phát hiện và phân loại dựa vào pH, PCO2, bicarbonate, và điện giải. Tính AG và phân tích sẽ cung cấp thêm thông tin chẩn đoán và điều trị. Công thức chúng tôi dùng được gọi là “tiếp cận sinh lý”.
Khái niệm về AG được James Gamble sử dụng từ năm 1936, nhưng nó không phổ biến cho đến những năm 1950 và 1960. Ở đây, chúng ta sẽ thảo luận một số tình huống mô phỏng và minh họa cách phân tích đúng các thông số khí máu, điện giải và AG cho phép xác định chính xác các rối loạn toan kiềm thậm chí là rất phức tạp, và giúp nhanh chóng đưa ra các chẩn đoán phân biệt thích hợp.
Toan chuyển hóa và đáp ứng bù trừ hô hấp
Toan chuyển hóa là một rối loạn sinh lý làm giảm bicarbonate gây pH toan (ie, <7.35). Toan chuyển hóa cũng kích hoạt cơ chế tăng thông khí bù trừ giúp giảm PCO2 và giúp giảm tình trạng toan máu.
PaCO2 bình thường từ 35-45 mm Hg. Phản ứng tăng thông khí bù trừ cho toan chuyển hóa diễn ra đầy đủ trong vòng 12 đến 24 giờ, và cường độ của nó nó tỉ lệ thuận với độ giảm của bicarbonate. Phát hiện tương tự ở tất cả các dạng toan chuyển hóa và có thể dự đoán được. Để tính toán đáp ứng hô hấp có phù hợp với toan chuyển hóa dựa vào công thức Winter:
PaCO2= { 1.5 x [HCO3‾] + 8} ± 2
Mối quan hệ này dự đoán tốt với toan chuyển hóa có HCO3- từ 7 đến 22 mEq/L. Nhiễm toan chuyển hóa nặng hơn (bicarbonate dưới 5-7 mEq/L), nên giảm PaCO2 tối đa, nghĩa là trong phạm vi từ 8-12 mmHg. Ngoài ra, thêm 15 vào bicarbonate sẽ là con số xấp xỉ PaCO2 trong trường hợp toan chuyển hóa nhẹ đến trung bình. Nếu toan chuyển hóa còn tồn tại và PCO2 không nằm trong phạm vi dự đoán , có thể có rối loạn toan kiềm thứ 2, liên quan đến hô hấp.
Anion Gap (khoảng trống anion)
Cấu hình ion của huyết thanh bình thường được thể hiện trong Hình 1. Trong bất kỳ dung dịch nào, tổng nồng độ điện tích (mEq/L) của các cations hòa tan phải cân bằng với tổng điện tích anions hòa tan. Tuy nhiên, nếu chỉ xem xét nồng độ của 3 chất điện giải chính [Na+], [Cl−], và bicarbonate [HCO3−]), thì nồng độ cation ([Na+]) thường vượt quá giới hạn cho phép so với tổng nồng độ anion: [Na+] > ([Cl−] + [HCO3−]). Do đó, AG được tính là hiệu số giữa [Na+] và tổng anion [Cl−] + [HCO3−], (Fig1). [AG] bình thường nhìn chung từ 8 đến 12 mEq/L. Để xác định mức tăng (hoặc giảm) so với cơ bản, lý tưởng nhất là biết được giá trị nền của bệnh nhân. Tuy nhiên, khi không rõ giá trị này, chúng tôi đề xuất sử dụng mức 10 mEq/L, sẽ hiệu chỉnh nếu albumin bất thường, được thảo luận sau.
Khi toan chuyển hóa do sự tích tụ acid mạnh trong khoang dịch ngoại bào (ECF) (như lactic acid, β-hydroxybutyric, hoặc acetoacetic acids [nhưng không phảihydrochloric acid]), [HCO3−] giảm và [AG] tăng lên tương ứng. Mức độ tăng [AG] (hay Δ[AG])biểu thị nồng độ tích tụ anions acid trong huyết tương (ie, lactate, ketoacid anions, etc). Hơn thế nữa, giá trị Δ[AG] gần bằng với Δ[HCO3−]. Do đó, tỉ lệ Δ[AG]/Δ[HCO3−] nhìn chung khoảng 1. Tuy nhiên, nhiều yếu tố có thể phá vỡ mối tương quan 1:1 này. Chúng bao gồm các khoang chứa bicarbonate khác nhau và sự tích tụ anion acid, hệ đệm proton nội bào, và tốc độ bài xuất tại thận khác nhau giữa proton và anion acid. Các rối loạn toan kiềm hỗn hợp cũng phá vỡ mối tương quan cổ điển 1:1 này.
Nguyên nhân thường gặp nhất gây toan chuyển hóa tăng AG (HAGMA) được liệt kê Bảng 1. Nó được ghi nhớ với cụm từ “GOLDMARK” (Glycols [ethylene, pro-pylene, và diethylene], 5-Oxoproline [acetaminophen], L-Lactic Acid, D-Lactic acid, Methanol, Aspirin, Renal fail ure, Ketoacidosis).
Ngược lại, khi toan chuyển hóa do tích tụ hydrochloric acid hoặc mất sodium bicarbonate (hoặc sodium–acid vô cơ anion muối như sodium butyrate, citrate, acetate, lac-tate—đại diện cho bicarbonate), sau đó AG về bình thường, hoặc phát triển tình trạng toan tăng clo máu (Fig 1). Albumin huyết thanh có điện tích âm khoảng 2.5mEq/g, và anion này là thành phần lớn nhất trong AG bình thường.Do đó, giảm albumin máu sẽ làm giảm AG, nên tăng [AG] (và tăng albumin máu sẽ làm giảm [AG]). [AG] phải được “hiệu chỉnh” khi nồng độ albumin giảm hoặc tăng. Mỗi 1 gram trên 100 ml albumin dưới mức bình thường 4.5 g/100 mL, [AG] giảm khoảng 2.5 mEq/L. [AG] hiệu chỉnh trong trường hợp giảm albumin máu theo công thức:
[AG](CORRECTED)=[AG](UNCORRECTED) + 2.5= (4.5 – (Albumin)]
Nếu tăng [AG] nhưng [HCO3 ] không giảm tương xứng, xem xét toan chuyển hóa tăng AG và kiềm chuyển hóa (hoặc toan
hô hấp mạn – pH khí máu sẽ khác biệt. Các mối quan hệ này giả định các anions và cations “không đo được” trong huyết thanh ban đầu trong giới hạn bình thường và ổn định. Tăng hoặc giảm đáng kể các anion và/hoặc cation “không đo được” sẽ ảnh hưởng đến [AG]. Vấn đề liên quan đến giảm albumin máu được thảo luận sau. Tăng phospho máu, tăng canxi máu, tăng magie
máu cũng tác động làm tăng hoặc giảm [AG]. Mặc dù mối liên hệ giữa [AG] và [HCO −] là những khái niệm rất hữu ích, nhưng
không chính xác về mặt định lượng. Bác sĩ lâm sàng sắc sảo sẽ kết hợp mối liên hệ này trong phân tích của họ về toàn bộ bức
tranh lâm sàng và bệnh sử của bệnh nhân.
| Letter | Parameter | Potential causes |
| G | Glycols | Uống/truyền ethylene, propylene,hoặc diethylene glycol; chuyển hóa tạo ra glyoxylic, oxalic, D và L lactic acid. |
| O | 5-Oxoproline | Dùng acetaminophen mạn có thể hình thành 5-oxoproline (acid mạnh: pyroglutamic acid). |
| L | L-Lactic | Nhiều nguyên nhân gây nhiễm toan lactic acidosis types A và type B. |
| D | D-Lactic | Dùng carbohydrate trên những bệnh nhân hội acidosis |
| M | Methanol | Chuyển hóa hình thành acid formic. |
| A | Aspirin | Ngộ độc tạo ra nhiều acid hữu cơ bao gồm keto acids. |
| R | Suy thận | Tích lũy nhiều acid vô cơ và acid hữu cơ bao gồm sulfuric acid và phosphoric acid. |
| K | Ketoacidosis | B-OH butyric và acetoacetic acid. |
| Based on mnemonic proposed in Mehtaet al, Lancet.2008;372(9642):892. | ||
Additional Readings
- Adrogue HJ, Gennari FJ, Galla JH, Madias NE. Assessing acid- base disorders. Kidney Int. 2009;76(12):1239-1247.
+ESSENTIAL READING - Adrogue HJ, Madias NE. Secondary responses to altered acid- base status: the rules of engagement. J Am Soc Nephrol. 2010;21(6):920-923.
- Emmett M, Narins RG. Clinical use of the anion gap. Medicine (Baltimore). 1977;56(1):38-54. +ESSENTIAL READING
- FiggeJ,JaborA,KazdaA,FenclV.Aniongapandhypoalbuminemia. CritCareMed.1998;26(11):1807-1810.
- Harvey AM. Classics in clinical science: James L. Gamble and “Gamblegrams.” Am J Med. 1979;66(6):904-906.
- Mehta AN, Emmett JB, Emmett M. GOLD MARK: an anion gap mnemonic for the 21st century. Lancet. 2008;372(9642):892.
- Narins RG, Emmett M. Simple and mixed acid-base disorders: a practical approach. Medicine (Baltimore). 1980;59(3):161-187.+ESSENTIAL READING
- Peitzman SJ. The flame photometer as engine of nephrology: a biography. Am J KidneyDis.2010;56(2):379-386.
Đánh giá và sử dụng AG
Case 1: Một bệnh nhân nam 68 tuổi có tiền sử tăng huyết áp kiểm soát tốt và phì đại tuyến tiền liệt lành tính đến phòng cấp cứu vì sốt, tiểu buốt và yếu người 3 ngày nay, rét run 1 ngày nay. Sinh hiệu:
Nhiệt độ 38.6 ◦C; huyết áp 90/70 mm Hg; và mạch đều, 110/phút. Thăm khám ghi nhận da niêm khô và lơ mơ. Kết quả xét nghiệm: [Na+] 138 mEq/L; [K+] 3.1 mEq/L; [Cl−] 111 mEq/L; [HCO3−] 17 mEq/L; serum urea nitrogen (SUN) 26 mg/dL; creatinine 1.1 mg/dL; glucose 126 mg/ 100 mL; albumin 2.0 g/dL. Khí máu: pH 7.30; pCO2, 32 mm Hg; [HCO3−], 15 mEq/L; và pO2, 72 mm Hg.
Câu hỏi 1: Bất thường toan kiềm nào tồn tại trên bệnh nhân này?
a) HAGMA với bù trừ hô hấp thích hợp
b) Toan chuyển hóa tăng clo máu (AG bình thường) c) Hỗn hợp toan chuyển hóa và kiềm hô hấp
d) Kiềm chuyển hóa và toan chuyển hóa
Để trả lời câu hỏi, xem phần thảo luận sau.
Bệnh nhân này có các triệu chứng nhiễm trùng tiểu và có thể nhiễm trùng huyết. Khí máu ghi nhận tình trạng toan (pH 7.30), giảm [HCO3−] 15 mEq/L, và giảm pCO2 32 mm Hg. Công thức Winters dự đoán pCO2 khoảng 31 mm Hg {(1.5 × [HCO3−]) + 8} = 31.Kết quả xét nghiệm của bệnh nhân phù hợp với toan chuyển hóa còn bù.
Đây là toan chuyển hóa tăng AG, tăng clo máu hay rối loạn hỗn hợp? AG ban đầu (138–[111+17]) = 10
mEq/L và điều này cho thấy toan chuyển hóa AG bình thường (hay tăng clo máu). Tuy nhiên, phép tính này không tính đến tình trạng hạ albumin máu (2.0 g/100 mL). Mức giảm albumin này sẽ làm giảm AG như sau 2.5 × (4.5 − 2) = 6.2. Do đó, [AG] sau hiệu chỉnh với tình trạng hạ albumin máu, thật sự là tăng khoảng 16 mEq/L. Sau đó, mức lactate của bệnh nhân được báo lại là 6 mEq/L. Tất cả các kết quả phù hợp với HAGMA do L-lactic acidosis. Do đó, đáp án đung cho câu hỏi 1 là (a).
Toan lactic
Ở những bệnh nhân nhập viện, toan lactic là nguyên nhân rất thường gặp gây toan chuyển hóa. Nó xảy ra khi quá trình sản xuất acid lactic vượt quá độ thanh thải (bình thường khoảng 1 mmol/phút).
Thông thường quá trình sản xuất lactate tăng khi thiếu oxy mô, do giảm phân phối oxy hoặc khiếm khuyết trong việc sử dụng oxy trong ty thể.
Lactate chủ yếu có nguồn gốc từ chuyển hóa đường thông qua quá trình đường phân và một lượng nhỏ hơn có nguồn gốc từ sự khử alanine. Gan, thận và tim là các cơ quan sử dụng lactate chính. Việc tạo ra acid lactic từ quá trình đường phân kỵ khí chủ yếu tại cơ và sự chuyển đổi acid lactic thành đường tại gan được định nghĩa là Cori cycle.
Một hệ thống phân loại thông thường chia theo các nguyên nhân lâm sàng gây toan lactic thành những nguyên nhân liên quan đến suy giảm oxy mô rõ ràng (type A), và những nguyên nhân không gây suy giảm oxy toàn thân hoặc không dễ phát hiện (type B). Trong một số trường hợp, sự chồng chéo giữa toan lactic type A và type B.
Các nguyên nhân cổ điển gây toan lactic type A bao gồm giảm thể tích, sepsis, xuất huyết tiêu hóa nặng, suy tim hoặc ngừng tuần hoàn. Trừ khi tưới máu mô được phục hồi nhanh chóng, nếu không tiên lượng rất xấu.
Các nguyên nhân gây toan lactic type B bao gồm ngộ độc, thuốc và thiếu vitamin (ie thiamine) gây suy giảm chuyển hóa tế bào và/hoặc chuyển hóa ty thể hoặc tạo ra những vùng thiếu máu cục bộ. Một nguyên nhân gây toan lactic type B là ngộ độc metformin, thường gặp ở những bệnh nhân tổn thương thận cấp hoặc mạn do tích tụ metformin toàn thân. Các nguyên nhân khác gây toan lactic type B bao gồm bệnh ác tính, đặc biệt là bạch cầu cấp và lymphoma, nghiện rượu mạn tính, và một số thuốc kháng retrovirus được dùng trong điều trị HIV.
Additional Readings
- Emmett M. Anion-gap interpretation: the old and the new. NatClin Pract Nephrol. 2006;2(1):4-5.
- Figge J, Jabor A, Kazda A, Fencl V. Anion gap and hypo-albuminemia. Crit Care Med. 1998;26(11):1807-1810.
- Kraut JA, Madias NE. Lactic acidosis. N Engl J Med. 2014;371(24):2309-2319. +ESSENTIAL READING
Toan ketone đái tháo đường
Case 2: Một thanh niên 25 tuổi có tiền sử j tháo đường type 1 trở nên chán ăn sau đợt viêm dạ dày ruột và giảm liều insulin. Sau đó anh ta phát triển tình trạng buồn nôn, nôn ói, tiểu nhiều, khó thở nên đến phòng cấp cứu. Bệnh nhân cũng có tiền sử trầm cảm kéo dài, đang điều trị với fluoxetine. Anh ta bị tụt huyết áp tư thế. Hơi thở có mùi trái cây. Xét nghiệm ban đầu ghi nhận SUN 40 mg/dL; creatinine 1.5 mg/dL; glucose 800 mg/ 100 mL; [Na+] 120 mEq/L; [Cl−] 75 mEq/L; [HCO3−] 12 mEq/L; K+ 3.0 mEq/L; ([AG] 32 mEq/L); và albumin 4.0 g/100 mL. Áp suất thẩm thấu 330 mOsm/L;β-hydroxybutyrate huyết thanh >8 mEq/L; và ketone niệu diptick 3+. Nồng độ ethanol máu không phát hiện được. Khí máu ghi nhận pH 7.16; PO2 90 mm Hg; pCO2 35 mm Hg; và [HCO3−], 12 mEq/L.
Câu hỏi 2: Rối loạn toan kiềm ở bệnh nhân là gì?
a) HAGMA do toan ketone đái tháo đường (DKA)
b) HAGMA do DKA và kiềm chuyển hóa
c) HAGMA do DKA, kiềm chuyển hóa và toan hô hấp d) HAGMA do DKA và toan tăng clo máu
Để trả lời câu hỏi, xem phần thảo luận bên dưới.
Bệnh sử, thăm khám và xét nghiệm trên bệnh nhân này hoàn toàn phù hợp với DKA. Dạng HAGMA này do tích tụ 2 “ketoacids” khoang ngoại bào (β-hydroxybutyric acid và acetoacetic acid).Khi nồng độ của 2 acid tăng lên, [HCO3−] giảm xuống tương ứng, và [AG] tăng lên. Tại thời điểm nhập viện, bệnh nhân DKA có tỉ số “delta/delta” trung bình hay tỉ lệ Δ[AG]/Δ[HCO3−] khoảng 1. Tuy nhiên, ketoacid được bài tiết vào trong nước tiểu, cùng với natri và kali, sẽ làm giảm [AG] và một phần chuyển từ toan chuyển hóa dạng HAGMA sang toan chuyển hóa tăng clo máu. Hiện tượng này thường xuất hiện sau nhập viện, khi thể tích dịch của bệnh nhân được khôi phục sau bù dịch chứa NaCl và chức năng thận cải thiện. Nếu chúng ta giả định [AG] bình thường là 10 và [HCO3−] là 24; sau đó [AG] tăng 23, từ 10 lên 33 và [HCO3−] giảm 12, từ 24 xuống 12 (tất cả theo mEq/L). Do vậy, Δ[AG] vượt xa mức giảm của [HCO3−]; nghĩa là Δ[AG]/Δ[HCO3−] >>1. Do đó, chúng tôi phải giả định rằng bicarbonate thừa ra được hình thành trong thời gian bệnh hoặc [HCO3−] ban đầu không bình thường, mà thay vào đó đã tăng lên khoảng 34 mEq/L khi phát triển tình trạng DKA. Bệnh nhân này bị nôn ói nên kiềm chuyển hóa có khả năng là nguyên nhân gây tăng [HCO3−]. Bất cứ khi nào Δ[AG] tăng vượt quá mức giảm của Δ[HCO3−], điều này cho thấy HAGMA và kiềm chuyển hóa cùng tồn tại (hoặc ít gặp hơn là HAGMA và toan hô hấp mạn tính, gây tăng [HCO3−]do đáp ứng bù trừ).
Bây giờ hãy xem xét mức độ bù trừ hô hấp trên bệnh nhân này. [HCO3−] là 12 mEq/L và dự đoán theo công thức Winter thì PaCO2 khoảng 26 mm Hg. Tuy nhiên, PaCO2 bệnh nhân này là 35 mm Hg, quá cao. Điều này chỉ điểm tình trạng toan hô hấp ngoài HAGMA và kiềm chuyển hóa. Hạ kali máu có thể gây yếu cơ hô hấp. Do đó, bệnh nhân này có 3 rối loạn (HAGMA do DKA, kiềm chuyển hóa do nôn ói, và toan hô hấp khả năng do hạ kali máu) và đáp án cho câu hỏi 2 là (c).
Lưu ý [AG] được tính bằng cách sử dụng [Na+] 120 mEq/L. Tăng đường huyết làm giảm [Na+] máu vì tăng trương lực dịch ngoại bào di chuyển nước từ nội bào ra khoang ngoại bào và làm pha loãng [Na+] dịch ngoại bào. Giá trị glucose 800 mg/100 mL sẽ làm giảm [Na+]
khoảng 14 mEq/L (dự kiến giảm khoảng 2 mEq/L [Na+] cho mỗi 100 mg/100 mL glucose tăng trên mức bình thường). Khi điều trị, nồng độ glucose giảm về mức bình thường, nước sẽ di chuyển ngược vào trong tế bào, [Na+] sẽ tăng từ 120 lên khoảng 134 mEq/L. Do đó, [Na+] “hiệu chỉnh” đối với tăng đường huyết là 134 mEq/L. Tuy nhiên, sự di chuyển nước do tăng đường huyết cũng gây tác động pha loãng tương tự với clo và bicarbonate dịch ngoại bào. Do đó, để thuận tiện, nồng độ điện giải “chưa hiệu chỉnh” (đối với glucose) được dùng để tính AG khi có tăng đường huyết.
Một vấn đề khác phải được giải quyết là đo áp lực thẩm thấu (323 mOsm/L), cao hơn 25 mOsm/L so với áp lực thẩm thấu ước tính (2 × [Na+] + (glucose/18) + (SUN/2.8)) = 298 mOsm/L. ([Na+] chưa hiệu chỉnh là 120 mEq/L cũng được sử dụng để tính toán áp lực thẩm thấu; mẫu số 18 và 2.8 để chuyển đổi đơn vị glucose và SUN từ mg/100 mL thành mmol/L).
Câu hỏi 3: Nguyên nhân có khả năng gây ra khoảng trống áp lực thẩm thấu 25 mOsm/L trên bệnh nhân?
a) Tích tụ ketoacids
b) Uống rượu hoặc glycol (không phải ethanol, không phát hiện được khi nhập viện)
c) Acetone
d) Hạ natri máu do tăng đường huyết
Để trả lời câu hỏi, xem phần thảo luận bên dưới.
Khi nhiễm HAGMA, tăng anion acid nhìn chung phù hợp với sự giảm [HCO3−]. Do đó, nhân [Na+] với 2 thì tính được chloride, bicarbonate, bất kỳ anions aicd mạnh nào. Do đó, HAGMA không trực tiếp tạo ra osmolal gap. Tuy nhiên, việc dung nạp rượu, acetone, glycerol trong máu làm tăng áp lực thẩm thấu và tạo ra “osmolal gap.” Osmolal gap này biến mất nếu các chất alcohol/glycol/etc được chuyển hóa thành acid. Bệnh nhân toan ketone thường tăng osmolal gap vì tăng nồng độ acetone (và glycerol ở mức ít hơn). Hiện tượng này cũng thường gặp ở những bệnh nhân toan ketone do rượu, nên thận trọng khi chẩn đoán ngộ độc rượu hoặc glycol trong những tình huống có osmolal gap nền cao. Ngoài ra, lưu ý acetone không phải là acid và nó không làm giảm [HCO3−] hay tăng [AG]. Do đó, đáp án đúng cho câu hỏi 3 là (c), osmolal gap trên bệnh nhân này khả năng là do acetone.
Tiếp tục Case 2: Bệnh nhân được điều trị thích hợp với dịch truyền tĩnh mạch (chủ yếu là nước muối sinh lý), KCl, và regular insulin TM. Sáng hôm sau, anh ta cảm thấy tốt hơn và đói bụng. Xét nghiệm sinh hóa máu ghi nhận: SUN 18 mg/dL; creatinine 0.9 mg/dL; glucose 150mg/100mL; [Na+] 139 mEq/L;[Cl−]110mEq/L; [HCO3−]17 mEq/L;[K+]4.0mEq/ L;và[AG]12mEq/L.
Câu hỏi 4: Lựa chọn nào sau đây là đúng nhất lý giải tình trạng toan chuyển hóa tăng clo máu trên bệnh nhân này?
a) Truyền nước muối sinh lý pha loãng [HCO3−] và do đó gây toan chuyển hóa tăng clo máu.
b) Đây là một giả thuyết sau điều trị DKA cấp.
c) Thể tích phân bố khác nhau giữa các anion ketoacid và clo hình thành toan chuyển hóa tăng clo máu.
d) Việc mất muối anion ketoacid qua nước tiểu chuyển HAGMA sang dạng toan chuyển hóa tăng clo máu.
Để trả lời câu hỏi, xem phần thảo luận bên dưới.
Khi bệnh nhân DKA được điều trị thích hợp với nước muối làm tăng thể tích dịch ngoại bào, độ lọc cầu thận nhìn chung cải thiện, và cải thiện khả năng hấp thu natri ở ống thận. Điều trị insulin làm ngừng quá trình ly giải lipid ở mô ngoại vi, giảm chuỗi acid béo dài phân phối đến gan, và làm chậm quá trình hấp thu và oxy hóa acid béo tại ty thể. Các tác động hormone/chuyển hóa nhanh chóng làm giảm hình thành ketoacid tại gan. Anion ketoacid tích tụ trong dịch ngoại bào thay thế bicarbonate bị phân giải. Các anions này là bicarbonate “tiềm ẩn” và cấu thành phần lớn Δ[AG] trên bệnh nhân. Nếu chúng vẫn còn trong cơ thể và bị oxy hóa, nồng độ ECF giảm xuống và một lượng bicarbonate cân bằng sẽ được tạo ra.
Tuy nhiên, quá trình oxy hóa anions ketoacid tích tụ mất nhiều giờ. Trong khung giờ gian này, bồi phụ thể tích ECF thích hợp giúp tăng bài tiết muối natri và kali của 2 anions ketoacid (β-hydroxybutyrate and acetoacetate) qua thận. Mất muối ketoacid qua thận giúp giảm [AG] hoặc thậm chí đưa nó về mức bình thường. [Cl−] tăng do mất muối sodium ketoacid trong một thể tích nước tiểu tương đối lớn gây giảm ECF “xung quanh” một lượng tương đối cố định chloride. Truyền nước muối sinh lý, chứa một lượng lớn [Cl−] và khả năng giữ lại nó, nhìn chung do giảm ECF cũng góp phần gây tăng clo máu nhưng thường là yếu tố ít quan trọng hơn mất muối Na+ và K+ ketoacids qua nước tiểu. Điều này chuyển HAGMA sang toan chuyển hóa tăng clo máu, thường xảy ra trong giai đoạn phục hồi trong DKA. Trong những ngày tiếp theo, khôi phục điện giải về bình thường do thận bài tiết ammonium cloride, tăng [HCO3−] và giảm [Cl−]. Do vậy, đáp án đúng cho câu hỏi 4 là (d).
Cơ chế tương tự cũng giải thích tại sao bệnh nhân hít phải toluene (thông qua “hít keo” hoặc hít sơn xịt) thường biểu hiện toan chuyển hóa tăng clo máu hạ kali máu. Toluene bản thân nó không phải là acid nhưng được chuyển hóa nhanh chóng thành benzoic (benzyl) acid, nhanh chóng chuyển thành hippuric acid.
Tích tụ hippuric acid (và/hoặc benzoic acid) trong ECF sẽ hình thành HAGMA. [HCO3−] giảm, và nồng độ hippurate tăng lên tương ứng. Tuy nhiên, hầu hết bệnh nhân mắc bệnh lý này không biểu hiện HAGMA, thay vào đó thường biểu hiện toan chuyển hóa tăng clo máu và hạ kali máu nặng. Nguyên nhân là do sự bài tiết hippurate nhanh chóng và hiệu quả ở thận.
Nếu hippurate được bài tiết hiệu quả với ion ammonium, toan chuyển hóa và AG tăng sẽ được cải thiện hoặc giải quyết. Tuy nhiên, nó mất vài ngày để thận có cơ chế điều hòa thích hợp. Do đó, trong pha sớm, một phần lớn hippurate được bài tiết dưới dạng muối natri thay vì ammonium. Giảm thể tích ECFvà phát triển tình trạng cường aldosterone thứ phát. Phân phối nhiều natri đến ống lượn xa kết hợp với tình trạng cường aldosterone thứ phát tăng cường tái hấp thu natri ống lượn xa và bài tiết rất nhiều kali. Do đó, phát triển tình trạng hạ kali máu.
Trong vài ngày, sự kết hợp hạ kali máu và toan chuyển hóa để tăng bài tiết ion ammonium một cách rõ rệt. Do đó, sau vài ngày bệnh nhân với rối loạn này biểu hiện toan chuyển hóa tăng clo máu hạ kali máu và pH niệu tương đối cao (do chứa lượng lớn ammonium nước tiểu). Mô hình này gợi ý nhiều đến toan ống lượn xa (RTA), và thực ra trong những năm qua ngộ độc toluene được báo cáo là nguyên nhân gây toan ống lượn xa. Tuy nhiên, nồng độ ion ammonium nước tiểu cao đại diện cho các protons liên kết và làm tăng pH niệu. Nồng độ ammonium rất cao giúp loại trừ toan ống lượn xa.
Nếu bệnh nhân hít phải toluene có bệnh thận tiến triển, hoặc nếu tổn thương thận cấp (AKI), thì hiệu quả bài tiết hippurate giảm sút. Trong những trường hợp này, tích tụ hippuric acid có thể hình thành HAGMA.
Additional Readings
- Adrogue HJ, Wilson H, Boyd AE 3rd, Suki WN, Eknoyan G. Plasma acid-base patterns in diabetic ketoacidosis. N Engl J Med. 1982;307(26):1603-1610. +ESSENTIAL READING
- Carlisle EJ, Donnelly SM, Vasuvattakul S, Kamel KS, Tobe S, Halperin ML. Glue-sniffing and distal renal tubular acidosis: sticking to the facts.JAmSocNephrol.1991;1(8):1019-1027.
ESSENTIAL READING
- Davidson DF. Excess osmolal gap in diabetic ketoacidosis explained. Clin Chem. 1992;38(5):755-757.
- Kraut JA, Xing SX. Approach to the evaluation of a patient with an increased serum osmolal gap and high-anion-gap metabolicacidosis. Am J Kidney Dis. 2011;58(3):480-484.
- Varon J, Jacobs MB, Mahoney CA. Reflections on the anion gap in hyperglycemia. West J Med. 1992;157(6):670-672.
Ngộ độc rượu/Glycols
Case 3: Một người đàn ông 60 tuổi được vợ đưa đến phòng cấp cứu vì trầm cảm tăng dần trong 3 tháng qua và ông ta đang cố tự làm hại bản thân. Ông lú lẫn và không hợp tác, người toàn mùi rượu. Các phần thăm khám khác không ghi nhận bất thường, sinh hiệu bình thường. Xét nghiệm lúc vào viện ghi nhận SUN 20 mg/dL; creatinine 1.0 mg/dL; glucose 100 mg/ 100 mL; [Na+] 138 mEq/L; [Cl−] 105 mEq/L; [HCO3−] 24 mEq/L; and [K+] 4.0 mEq/L. Khí máu pH 7.40; pO2 100 mm Hg; và pCO2 40 mm Hg. Phân tích nước tiểu bình thường. Nồng độ ethanol là 110 mg/100 mL, và áp suất thẩm thấu máu là 350mOsm/L.
Câu hỏi 5: Điều nào sau đây có khả năng đúng nhất?
a) Bệnh nhân say với hàm lượng cao ethanol và khả năng cải thiện khi ethanol được chuyển hóa.
b) Ông ta đã uống ethanol nhưng cũng có bằng chứng về một hoặc một số loại rượu hoặc glycols khác.
c) Không có toan chuyển hóa tăng AG làm cho chẩn đoán ngộ độc methanol hoặc ethylene glycol không phù hợp.
d) Ông ta đã uống một lượng salicylate độc hại cùng với ethanol.
Trước khi thảo luận về câu trả lời đúng, chúng ta hãy giả sử rằng bác sĩ ED tin nhầm câu trả lời (a) là đúng. Ông được theo dõi tại ED vài giờ.
Case 3, tiếp tục tình huống giả định: Sau 3 giờ, bệnh nhân vẫn lú lẫn và ngày càng trở nên hung hăng. Làm lại xét nghiệm sinh hóa ghi nhận SUN 30 mg/dL; creatinine 1.2 mg/dL; glucose 120 mg/100 mL; [Na+] 140 mEq/L; [Cl−] 105 mEq/L; [HCO3−] 16 mEq/L; và [K+] 4.5 mEq/L. Khí máu pH 7.32; pO2, 100 mm Hg; và pCO2, 30 mm Hg. Áp lực thẩm thấu máu đo lại và nó giảm từ 350 xuống 310 mOsm/L. Phân tích nước tiểu cũng được làm lại và nhận thấy nhiều tinh thể phù hợp với calcium oxalate.
Câu hỏi 6: Nguyên nhân thích hợp nhất gây thay đổi tri giác trên bệnh nhân là gì?
a) Ông bị nhiễm toan lactic.
b) Ông bị toan chuyển hóa thứ phát do tích tụ glyoxylic và oxalic acid.
c) Ông phát triển hội chứng cai ethanol.
d) Ông uống salicylate ngoài ethanol và hiện tại salicylate gây HAGMA.
Để trả lời câu hỏi, xem phần thảo luận bên dưới.
Mặc dù các bác sĩ cấp cứu cho là lâm sàng và xét nghiệm sinh hóa của bệnh nhân do ngộ độc rượu, nồng độ ethanol 110 mg/dL sẽ chỉ làm tăng áp lực thẩm thấu của bệnh nhân (ie, tạo ra osmolal gap) khoảng 24 mOsm/L (chia cho nồng độ ethanol [đơn vị mg/100 mL] với 4.6 để ước tính khả năng đóng góp thẩm thấu của nó). Nhưng osmolal gap của bệnh nhân này là 57: 350 − [(138 × 2) + (30/ 2.8) + (120/18)] = 57. Do đó 33 mOsm/L osmolal gap không do ethanol trong máu (Bảng 2).
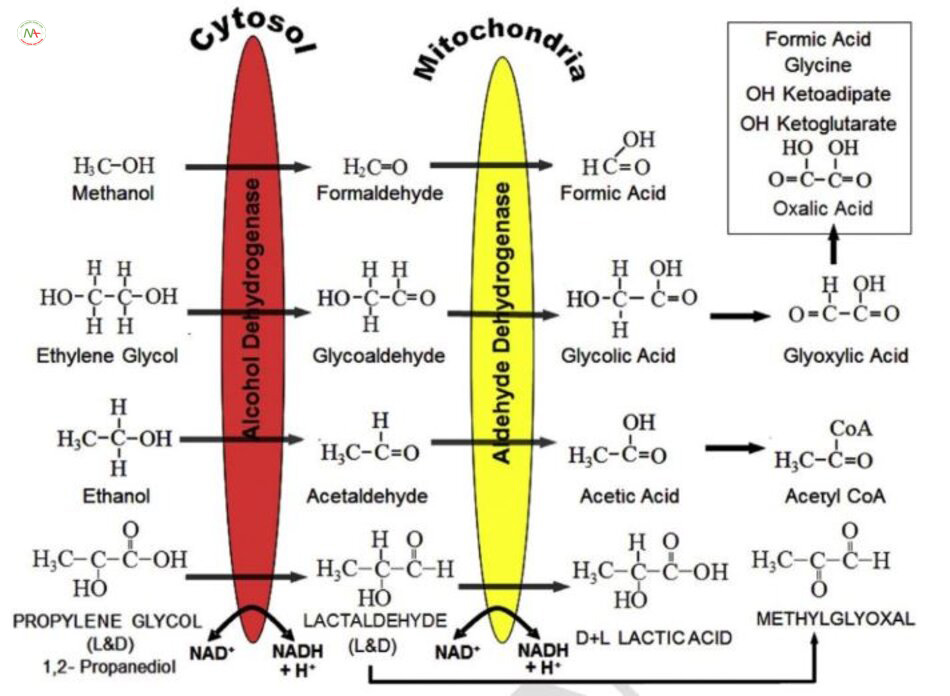
Do đó, lẽ ra phải nghi ngờ cao bệnh nhân uống một loại rượu hoặc glycol khác, có thể là chất độc. Khi uống phải rượu độc hại, như methanol, isopropanol hoặc ethylene glycol, việc uống cùng với ethanol là thường gặp. Uống cùng ethanol sẽ làm chậm khả năng oxy hóa nhiều chất độc khác bị oxy hóa bởi enzyme alcohol dehydrogenase.
Quá trình oxy hóa ethanol hình thành acetyl CoA, được chuyển hóa tại gan. Khi nồng độ ethanol giảm, tăng quá trình oxy hóa chất độc hình thành acid hữu cơ độc hại (Hình 2). Trình tự chuyển hóa này có thể đồng thời làm giảm osmolal gap và hình thành HAGMA. Trong những trường hợp cụ thể này việc tìm thấy tinh thể calcium oxalate trong nước tiểu (Hình 3) gợi ý mạnh mẽ đến ethylene glycol. Do đó cả câu hỏi 5 và 6, đáp án đúng là (b), và tích tụ acid hữu cơ có lẽ chủ yếu là glyoxylic và oxalic acid. Lưu ý một loại rượu độc hại thường được uống là isopropanol cồn công nghiệp, được chuyển hóa thành acetone. Cả isopropanol và acetone đều không phải là acid. Do đó, uống isopropanol sẽ tăng osmolal gap nhưng không gây HAGMA.
Additional Readings
- Beauchamp GA, Valento M. Toxic alcohol ingestion: prompt recognition and management in the emergency department. Emerg Med Pract. 2016;18(9):1-20.
- Kraut JA, Mullins ME. Toxic alcohols. N Engl J Med. 2018;378(3):270-280. +ESSENTIAL READING
Các chất độc khác
Case 4: Một cô gái 20 tuổi có tiền sử tâm thần phân biệt và rối loạn cảm xúc được đưa đến phòng cấp cứu sau khi uống một “lọ chứa đầy aspirin”, nói rằng cô muốn tự tử. Bác sĩ tâm thần của cô kê thuốc uống haloperidol trong quá khứ, nhưng cô
Bảng 2. Ảnh hưởng của Alcohols, Acetone và Glycols lên áp lực thẩm thấu máu
| Molecular Weight (mg/mmol) | Osmolal Gap Product by 100 mg% | |
| Ethanol | 46 | 22 |
| Isopropanol | 60 | 17 |
| Acetone | 58 | 17 |
| Methanol | 32 | 31 |
| Ethylene glycol | 62 | 16 |
| Propylene glycol | 76 | 13 |
| Diethylene glycol | 106 | 9 |
từ chối uống bất kỳ loại thuốc nào khác và cũng không uống rượu. Cô nôn nhiều lần sau khi uống aspirin và xuất hiện khó thở, ù tai. Cô không có tiền sử cố gắng tự tử trước đây. Thăm khám ghi nhận một cô gái trẻ có vẻ lo âu, tỉnh táo. Sinh hiệu ghi nhận huyết áp 118/70 mm Hg; mạch 100 lần/phút, đều; nhịp thở 26 lần/phút; nhiệt độ 37.2 ◦C. Phần khám chỉ ghi nhận thở sâu và niêm mạc khô. Xét nghiệm [Na+] 141 mEq/L; [K+] 3.8 mEq/L; [Cl−] 95 mEq/L [HCO3−] 25 mEq/L; [AG] 21 mEq/L; albumin 4.0 g/dL; SUN 10 mg/dL; creatinine 1.06 mg/dL; and glucose 116 mg/100 mL. Khí máu (khí trời) pH 7.63; pCO2 24 mm Hg; [HCO3] 24 mEq/l and pO2 90 mm Hg. Nồng độ salicylate là 71.8 mg/dL (ngưỡng điều trị là dưới 20), pH nước tiểu là 5.5. Sàng lọc độc chất âm tính ngoại trừ salicylate.
Câu hỏi 7: Rối loạn toan kiềm của bệnh nhân này là gì?
a) HAGMA
b) HAGMA và kiềm hô hấp
c) HAGMA, kiềm chuyển hóa và kiềm hô hấp
d) Kiềm chuyển hóa, kiềm hô hấp và tăng AG giả tạo (do giả hạ clo máu) (pseudohypochloremia)
Để trả lời câu hỏi, xem phần thảo luận bên dưới.
Bệnh nhân này uống một lượng lớn aspirin với nỗ lực tự sát. Nồng độ salicylate huyết thanh của cô ở ngưỡng ngộ độc. Rối loạn toan kiềm thường gặp nhất trong ngộ độc salicylate là phối hợp HAGMA và kiềm chuyển hóa. Nồng độ salicylate ngộ độc trực tiếp kích thích trung tâm hô hấp ở hành não, gây thở nhanh và sâu; điều này dẫn đến kiềm hô hấp. Ngộ độc salicylate cũng làm mất liên kết quá trình oxidative phosphorylation, ức chế men dehydrogenases trong chu trình citric acid, tăng đường phân (hình thành lactic acid), và kích thích ly giải mỡ và tổng hợp ketone ở gan. Các tác động này dẫn đến HAGMA. Một thành phần nhỏ gây HAGMA là bản thân acid salicylic.
[AG] của bệnh nhân này là 21 mEq/L (ΔAG = 11), và mức độ toan chuyển hóa này dự kiến sẽ giảm HCO3-tương ứng khoảng 11 mEq/L. Nhưng HCO3- của cô là 23 mEq/L. Kết quả này phù hợp với HAGMA do ngộ độc salicylate và kiềm chuyển hóa do nôn.Kết quả bình thường [HCO3−] là 23 mEq/L sẽ không tạo ra bất kỳ phản ứng bù trừ hô hấp nào. Tuy nhiên, khí máu nhận thấy pH kiềm (7.63) và giảm đáng kể PaCO2 (24 mm Hg). Điều này do kiềm hô hấp trong ngộ độc salicylate. Do vậy, câu trả lời đúng cho câu hỏi 7 là (c).
Điều trị ban đầu tại phòng cấp cứu với dịch truyền tĩnh mạch và kali cloride. Cân nhắc sử dụng kiềm hóa nước tiểu, giúp tăng cường bài tiết salicylate ở thận, nhưng BN này không truyền muối bicarbonate do tình trạng kiềm máu của bệnh nhân rõ rệt. Với điều trị bảo tồn, triệu chứng của bệnh nhân dần cải thiện.
Case 4, tiếp tục: Sau 3 giờ, xét nghiệm sinh hóa được làm lại và ghi nhận [Na+]140mEq/L; [K+] 3.5 mEq/L; [Cl−] 135 mEq/L; [HCO3 −] 24 mEq/L; SUN 9 mg/dL; creatinine 0.92 mg/dL; glucose 115 mg/100 mL;and [AG] −19 mEq/L.
Câu hỏi 8: Bạn giải thích các thông số điện giải như thế nào?
a) Bệnh nhân cũng uống phải muối bromide.
b) Điều này thể hiện giả tăng clo máu liên quan đến salicylate. c) Điều này thể hiện giả tăng bicarbonate máu do salycylate.
d) Nồng độ natri giảm giả tạo.
Để trả lời câu hỏi, xem phần thảo luận bên dưới.

Một vài tình trạng lâm sàng có thể gây giảm AG tới mức gần 0 hoặc thậm chí hơi âm. Hai tình trạng thường gặp nhất gây ra điều này là hạ albumin máu (giảm các anions “không đo được”) và đa u tủy (tăng các cations “không đo được” với IgG myeloma, nhưng thường không gặp trong IgA myeloma). Tuy nhiên, khi AG âm quá mức (dưới mức −5 mEq/L) điều này thường do hiện tượng giả do điện giải (giả hạ natri, giả tăng clo hoặc giả tăng bicarbonate).
Giả tăng clo máu có thể do nhiều bệnh cảnh lâm sàng. Trước đây, nguyên nhân thường gặp nhất gây giả tăng clo máu là do uống bromide mạn tính. Ion bromide trong mẫu vật có thể gây tăng clo máu giả tạo. Gần đây, người ta phát hiện ra rằng salicylate cũng có thể gây tăng clo máu giả tạo.
Đáp án đúng cho câu hỏi số 8 là (b).
Additional Readings
- Emmett M. Approach to the patient with a negative anion gap. Am J Kidney Dis. 2016;67(1):143-150. +ESSENTIAL READING
- Palmer BF, Clegg DJ. Salicylate toxicity. N Engl J Med. 2020; 382(26):2544-2555. +ESSENTIAL READING
- Wiederkehr MR, Benevides R Jr, Santa Ana CA, Emmett M. Pseudohyperchloremia and Negative Anion Gap – Think Salicy- late! Am J Med. 2021; doi: 10.1016/j.amjmed.2021.03.017.
Toan chuyển hóa tăng AG: Unusual Acid No 1
Case 5: Một phụ nữ 38 tuổi có tiền sử bệnh phổi hạn chế nặng đã được ghép phổi 2 bên từ 4 tháng trước. Cô trải qua quá trình hậu ghép phức tạp với nhiều đợt thải ghép cấp tính được điều trị thành công. Cô cũng có 2 đợt AKI, và hiện tại giảm GFR dai dẳng.
Cô ăn uống kém nên cần đặt gastric feeding tube. Cô rất trầm cảm và nói là đau dai dẳng tại vị trí G-tube. Cô uống acetaminophen 650 mg 3 lần/ngày, trong 3 tuần qua. Cô phủ nhận việc dùng bất kỳ thuốc gì khác và và nói rằng sẽ không cố làm hại bản thân. Thăm khám ghi nhận sinh hiệu bình thường, thể trạng suy dinh dưỡng và teo cơ lan tỏa. Vị trí G-tube đỏ nhưng không chảy dịch. Xét nghiệm sinh hóa glucose 90 mg/ 100 mL; SUN 10 mg/dL; creatinine 0.7 mg/dL; [Na+] 140 mEq/L; K+ 4.2 mEq/L; [Cl−] 106 mEq/L; [HCO3−] 12 mEq/L. Khí máu pH 7.21; paCO2 26 mm Hg; [HCO3−] 10 mEq/L. Albumin is 3.0g/dL, và L-lactate là 0.8 mmol/L. Nước tiểu âm tính với ketones, và β-hydroxybutyrate huyết thanh bình thường ở mức 0.5 mEq/L. Áp suất thẩm thấu máu 290 mOsm/L. Salicylate huyết thanh không phát hiện được. Nồng độ acetaminophen ở khoảng liều điều trị.
Câu hỏi 9: Nguyên nhân thường gặp nhất gây HAGMA trên bệnh nhân:
a) Uống ethylene glycol
b) 5-Oxoproline (pyroglutamic acid) c) Toan ketone do đói
d) D-Lactic acidosis
Để trả lời câu hỏi, xem phần thảo luận bên dưới.
Bệnh nhân này có HAGMA nhưng không có nguyên nhân rõ ràng. Không có bằng chứng sinh hóa cho thấy nhiễm toan lactic hoặc ketone. Mặc dù nồng độ D-lactate không đo được, nhưng không có tiền sử gợi ý cô mắc bệnh lý này (D-lactic acidosis thường gặp trên bệnh nhân hội chứng ruột ngắn). Nếu nghi ngờ D-lactic acidosis, nên đo nồng độ D-lactate huyết thanh đặc hiệu vì D- lactate không phát hiện được trong xét nghiệm “lactic acid” thông thường.
Bệnh nhân có tiền sử trầm cảm, nhưng không có tiền sử uống độc chất hoặc ngộ độc. Nếu cô uống rượu độc, như methanol hoặc glycol như ethylene glycol, các hợp chất này làm tăng áp suất thẩm thấu máu và hình thành osmolal gap. Đo ALTT máu của bệnh nhân bình thường 290 mOsm/L và phù hợp với [Na+] = 140 mEq/L (tạo ra ALTT khoảng 280 mOsm/L), glucose và SUN bình thường (chiếm khoảng 9 mOsm/L).
Ngộ độc salicylate thường gây ra HAGMA do kết hợp bản thân salicylic acid và các acid hữu cơ trung gian nội sinh khác tích tụ.Tuy nhiên, HAGMA do salicylate chỉ xảy ra khi salicylate ở ngưỡng gây độc, không phát hiện salicylate ở thời điểm nhập viện trên bệnh nhân này. Tất cả các xét nghiệm bình thường hoặc âm tính cùng với bệnh sử gợi ý nguyên nhân có khả năng nhất gây HAGMA liên quan đến dùng acetaminophen mạn tính.
Uống acetaminophen mạn tính, đặc biệt là ở phụ nữ suy dinh dưỡng và ốm yếu, ngày càng được công nhận là nguyên nhân gây ra HAGMA do sự tích tụ
5-oxoproline, còn được gọi là pyroglutamic acid. Quá trình giải độc acetaminophen được thực hiện bằng cách chuyển hóa hợp chất tự nhiên thành một số chất chuyển hóa sulfated, bao gồm acetaminophen sulfate, acetaminophen glutathione, và acetaminophen mercapturate, được bài tiết qua nước tiểu. Các phản ứng này gây cạn kiệt glutathione, cysteine, và các phân tử sulfated trung gian khác, đặc biệt khi bệnh nhân suy dinh dưỡng. Thiếu glutathione và cysteine gây tăng hình thành và tích tụ 5-oxoproline. Do vậy, đáp án đúng cho câu hỏi 9 là (b).
Không có gì phải ngạc nhiên khi những người suy dinh dưỡng và ốm yếu dễ gặp vấn đề này, nhưng vẫn chưa rõ tại sao phần lớn gặp ở bệnh nhân nữ. Tình trạng này phân biệt với ngộ độc cấp acetaminophen. Nồng độ acetaminophen cao có thể gây ngộ độc gan cấp tính, nghiêm trọng cũng như gây tổn thương thận cấp. Dạng ngộ độc cấp acetaminophen thỉnh thoảng gây toan lactic. Ngược lại, ngộ độc acetaminophen mạn có thể gây HAGMA do tích tụ 5- oxoproline và hay gặp trên những bệnh nhân dùng liều điều trị acetaminophen hoặc thậm chí là trên liều điều trị.
HAGMA do acetaminophen liên quan đến tích tụ 5-oxoproline thường tự khỏi nhanh chóng sau khi ngưng acetaminophen và nhìn chung bệnh nhân cải thiện với điều trị hỗ trợ. Mặc dù chỉ định N-acetyl-cysteine dường như có vẻ hợp lý và ít có tác dụng phụ, nhưng không có bằng chứng rõ ràng về sự cần thiết hoặc làm tăng tốc độ hồi phục.
Mặc dù phần lớn các trường hợp HAGMA do 5-oxoproline liên quan đến dùng acetaminophen, nhưng một số nguyên nhân khác có thể được tìm thấy. Tình trạng này đầu tiên được báo cáo là biến chứng của một bệnh lý di truyền rất hiếm gặp liên quan đến 5-oxoprolinase hoặc glutathione synthetase. Ngoài ra, một số bệnh nhân được điều trị với kháng sinh flucloxacillin hoặc netilmicin và các điều trị khác với thuốc vigabatrin chống động kinh cũng gây HAGMA do 5-oxoproline. Tuy nhiên, toan máu do 5-oxoproline hầu hết liên quan đến sử dụng acetaminophen mạn tính, đặc biệt ở phụ nữ suy dinh dưỡng.
Additional Readings
- Fenves AZ, Kirkpatrick HM 3rd, Patel VV, Sweetman L, Emmett M. Increased anion gap metabolic acidosis as a result of 5-oxoproline (pyroglutamic acid): a role for acetaminophen. Clin J Am Soc Nephrol. 2006;1(3):441-447. +ESSENTIAL READING
- Emmett M. Acetaminophen toxicity and 5-oxoproline (pyrogluta- mic acid): a tale of two cycles, one an ATP-depleting futile cycle and the other a useful cycle. Clin J Am Soc Nephrol. 2014;9(1):191-200.
Toan chuyển hóa tăng AG: UnusualAcid No 2
Case 6: Một người đàn ông 45 tuổi biểu hiện lú lẫn, thất điều và nói lắp tăng dần trong 5 ngày qua. Tiền sử bệnh lý ghi nhận vết đâm ở bụng 3 năm trước, vết thương đó cần phẫu thuật ổ bụng nhiều lần để cắt bỏ ruột non. Sau đó, anh ta bị tiêu chảy từng đợt mạn tính, sụt cân và suy dinh dưỡng. Gia đình anh ta nói là các đợt trước đây lú lẫn nhẹ hơn. Thuốc hàng ngày chỉ có vitamin tổng hợp. Anh không sử dụng chất kích thích hay rượu. Thăm khám ghi nhận sinh hiệu bình thường. Bệnh nhân lơ mơ, lú lẫn, nói lắp, nystagmus và dáng đi loạng choạng. Xét nghiệm [Na+] 140 mEq/L; K+ 3.8 mEq/L; [Cl−] 105 mEq/L; [HCO3 −] 10 mEq/L; SUN 12 mg/dL; creatinine 0.9 mg/dL; glucose 96 mg/100 mL; albumin 3.9 g/dL; and lactate huyết thanh 1.1 mEq/L. Khí máu pH 7.20; pCO2 21 mm Hg; và pO2 98 mm Hg. Phân tích nước tiểu bình thường và âm tính với ketones.
Câu hỏi 10: Chẩn đoán thích hợp nhất là:
a) Toan chuyển hóa tăng clo máu do tiêu chảy mạn
b) Ngộ độc rượu
c) D-Lactic acidosis
d) Toan máu do 5-Oxoproline (pyroglutamic)
Để trả lời câu hỏi, xem phần thảo luận bên dưới.
Bệnh nhân này toan chuyển hóa tăng AG, bù trừ hô hấp thích hợp. [AG] là 25 mEq/L, tăng 15 mEq/L trên ngưỡng bình thường là 10 mEq/L. Điều này phù hợp với sự giảm [HCO3−] từ 25 xuống 10 mEq/L. Do vậy, the Δ[AG]3 tăng =Δ[HCO3−] giảm. PCO2 giảm thích hợp, nên bệnh nhân không có rối loạn hô hấp. Biểu hiện lâm sàng không gợi ý sepsis, và nồng độ L-lactate bình thường. Tiêu chảy mạn tính thường gây toan chuyển hóa AG bình thường (tăng clo máu). Không có tiền sử uống rượu hoặc glycol, nhưng việc đo osmolal gap nên được xem xét kĩ trong trường hợp này vì chẩn đoán xác định có thể mất vài ngày. Tuy nhiên, dựa vào tiền sử phẫu thuật và bệnh sử, rối loạn toan máu do D- lactic nên được đưa vào đầu danh sách chẩn đoán phân biệt; do vậy, đáp án đúng cho câu hỏi 10 là (c).
D-Lactic acidosis là dạng toan chuyển hóa hiếm gặp có thể ảnh hưởng đến một số bệnh nhân hội chứng ruột ngắn hoặc các bệnh lý rối loạn hấp thu đường tiêu hóa khác. Ở những bệnh nhân này, vi khuẩn đường ruột chuyển hóa (lên men) glucose và tinh bột không hấp thu thành các acid hữu cơ, bao gồm đồng phân D-optical của lactic acid, được chuyển hóa rất chậm ở người. Do đó khi đồng phân lactic acid này được hấp thu ở ruột, gây ra tình trạng toan D-lactate.
Điều quan trọng là hầu hết các phòng xét nghiệm không đo được D-lactate.
D- Lactic acid cũng tăng trên những bệnh nhân uống một lượng lớn propylene glycol và ở nhiều bệnh nhân DKA. Trên những bệnh nhân này, D-lactic acid là sản phẩm chuyển hóa của lactaldehyde trong ngộ độc propylene glycol và methylglyoxal trong DKA. Trong DKA, nồng độ D-lactic acid có thể đạt mức 8 đến 10 mEq/L.
Bệnh nhân hội chứng ruột ngắn có thể bị toan nhẹ, mạn tính không đủ để gây nhiễm toan hoặc triệu chứng đáng kể.
Tuy nhiên, bất dung nạp carbohydrate có thể gây toan D-lactic nặng và có triệu chứng. Ngoài ra, nếu chức năng thận suy giảm, bệnh cảnh lâm sàng tương tự có thể xuất hiện.
Bệnh nhân nhiễm toan D-lactic thường biểu hiện toan chuyển hóa tăng AG và đặc trưng với bất thường về thần kinh, như lú lẫn, thất điều tiểu não, nói lắp, tiểu không tự chủ, và nystagmus. D-lactate tái hấp thu tại ống thận không hiệu quả như L-lactate. Do đó, lượng lớn D- lactate mất qua ống thận có thể chuyển HAGMA sang toan chuyển hóa tăng clo máu. Nếu nghi ngờ đến toan D-lactic, đo nồng độ D-lactate trong nước tiểu có sẵn trên thị trường và khá hữu ích.
Điều trị toan D-lactic được cá thể hóa trên từng bệnh nhân. Khi toan chuyển hóa nặng, có thể truyền nabicarbonate. Ở BN nhiễm toan D-lactic ở BN hội chứng ruột ngắn, kháng sinh đường uống (như neomycin hoặc metronidazole) có thể hữu ích. Chiến lược dự phòng bao gồm chế độ ăn ít carbohydrate, giúp giảm đưa carbohydrate đến đại tràng và hình thành D-lactate.
Additional Readings
- Bianchetti DGAM, Amelio GS, Lava SAG, et al D-Lactic acidosis in humans: systematic literature review. Pediatr Nephrol. 2018;33(4):673-681.
- Halperin ML, Kamel KS. D-Lactic acidosis: turning sugar into acids in the gastrointestinal tract. Kidney Int. 1996;49:1-8.
ESSENTIAL READING
- Uribarri J, Oh MS, Carroll HJ. D-Lactic acidosis: a review of clinical presentation, biochemical features, and pathophysiologic mechanisms. Medicine (Baltimore). 1998;77(2):73-82.
ESSENTIAL READING
Tóm tắt
AG là một cấu trúc toán học “ảo” vì không thể tồn tại khoảng trống AG thật sự trong bất cứ dung dịch nào. Tuy nhiên, đây là công cụ lâm sàng rất hữu ích trong đánh giá rối loạn toan kiềm và phân loại toan chuyển hóa. Toan chuyển hóa được chia thành hai phân nhóm chính là HAGMA và toan chuyển hóa AG bình thường (hay toan chuyển hóa tăng clo máu).
Khi tồn tại HAGMA, mối tương quan giữa lượng [AG] tăng lên tương xứng với sự giảm của [HCO3−] (hay tỉ số Δ[AG]/Δ[HCO3−] có thể là chỉ điểm rất hữu ích trong một số dạng rối loạn toan-kiềm hỗn hợp. Nếu nhiễm HAGMA tiến triển phát triển trong một khoang chất lỏng mà không mất HCO3− , hoặc tích tụ các anions acid mạnh, thì sẽ tồn tại tỉ lệ hoàn hảo 1:1 giữa Δ[AG]/ Δ[HCO3−]. Tuy nhiên, anions acid mạnh và HCO3 thật sự có không gian phân bố khác nhau và có thể được bài tiết qua thận với tốc độ khác nhau. Do đó tỉ lệ hoàn hảo 1:1 không phải lúc nào cũng tồn tại khi có HAGMA. Do đó, nhìn chung tỉ lệ 1:1 giữa Δ[AG]/Δ[HCO3-] vẫn là điểm khởi đầu tốt trong lý giải HAGMAs. Khi tăng AG đáng kể vượt quá độ giảm [HCO3−], một rối
loạn toan kiềm khác phải được xem xét – hoặc là kiềm chuyển hóa hoặc là toan hô hấp mạn tính.
AG nên được tính bất cứ khi nào có kết quả xét nghiệm điện giải. AG cao, thấp hoặc âm đều cần giải thích về mặt lâm sàng.
Article Information
- Authors’ Full Names and Academic Degrees: Andrew Z. Fenves,MD, and Michael Emmett, MD.
- Authors’ Affiliations: Division of Nephrology, Department of Internal Medicine, Massachusetts General Hospital, and Medical School, Harvard University, Boston, Massachusetts (AZF); Internal Medicine, Baylor University Medical Center, Dallas, Texas (EM).
- Address for Correspondence: Michael Emmett MD, MACP, Baylor University Medical Center, 3500 Gaston Ave, Rm H-102, Dallas, TX75246-2096. Email: m.emmett@baylorhealth.edu
- Support: This Core Curriculum was produced without any direct financial support.
- Financial Disclosure: The authors declare that they have no have relevant financial interests.
- Peer Review: Received November 23, 2020, in response to an invitation from the journal. Evaluated by 3 external peer reviewers and a member of the Feature Advisory Board, with direct editorialinput from the Feature Editor and a Deputy Editor.
- Accepted in revised form February 24, 2021.

![Tiếp cận bệnh nhân toan chuyển Hóa tăng Anion Gap 8 Hình 1. Mô tả “GambleGram” về điện giải huyết thanh. (A) Tổng nồng độ anion và cation (mEq/L) phải cân bằng. (B) Nếu chỉ xem xét [Na+], [Cl−], và [HCO3 ], anion gap (AG) bình thường sẽ tồn tại. (C) Toan chuyển hóa tăng AG giảm [HCO3 ] không thay đổi [Cl−] và do đó làm tăng [AG]. (D)AG bình thường, hoặc toan chuyển hóa tăng clo máu, giảm [HCO3 ] và tăng [Cl ].(E)Toan chuyển hóa tăng AG và kiềm chuyển hóa.Nếu tăng [AG] nhưng [HCO3 ] không giảm tương xứng, xem xét toan chuyển hóa tăng AG và kiềm chuyển hóa (hoặc toan hô hấp mạn – pH khí máu sẽ khác biệt. Các mối quan hệ này giả định các anions và cations “không đo được” trong huyết thanh ban đầu trong giới hạn bình thường và ổn định. Tăng hoặc giảm đáng kể các anion và/hoặc cation “không đo được” sẽ ảnh hưởng đến [AG]. Vấn đề liên quan đến giảm albumin máu được thảo luận sau. Tăng phospho máu, tăng canxi máu, tăng magie máu cũng tác động làm tăng hoặc giảm [AG]. Mặc dù mối liên hệ giữa [AG] và [HCO −] là những khái niệm rất hữu ích, nhưng không chính xác về mặt định lượng. Bác sĩ lâm sàng sắc sảo sẽ kết hợp mối liên hệ này trong phân tích của họ về toàn bộ bức tranh lâm sàng và bệnh sử của bệnh nhân.](https://nhathuocngocanh.com/wp-content/uploads/2023/05/tiep-can-benh-nhan-toan-chuyen-hoa-tang-anion-gap-anh-1.jpg)