Nguồn: Sách Lâm sàng tim bẩm sinh
Chủ biên
PGS.TS.BS. Nguyễn Lân Hiếu
Tham gia biên soạn
Nguyễn Lân Hiếu
Nguyễn Minh Hùng
Nguyễn Văn Hiếu
Lê Nhật Cường
Dương Công Nguyên
Trong bài viết này Nhà thuốc Ngọc Anh xin gửi đến bạn đọc chủ đề: Thông liên thất trong thực hành tim bẩm sinh.
ĐẠI CƯƠNG
Thông liên thất (ventricular septal defect – VSD) là một trong những bất thường tim bẩm sinh phổ biến nhất ở trẻ em (đứng thứ hai sau van động mạch chủ hai lá). Thông liên thất (TLT) đơn thuần chiếm 20-25% trong các bệnh lý tim bẩm sinh. Ở người trưởng thành, TLT chiếm khoảng 10% các bệnh lý tim bẩm sinh do diễn biến tự nhiên lỗ thông có khả năng tự đóng và hầu hết TLT được chẩn đoán và điều trị khi còn nhỏ.
TLT có thể tồn tại trong bệnh lý tim bẩm sinh TLT đơn thuần hoặc tồn tại trong một số bệnh tim bẩm sinh khác như: tứ chứng Fallot (tetralogy of Fallot), chuyển gốc đại động mạch (transposition of the great arteries), thất phải hai đường ra (double-outlet right ventricle), thân chung động mạch (common arterial trunk)…
Thông liên thất có thể có một hoặc nhiều lỗ, với vị trí và kích thước khác nhau, tạo ra bệnh cảnh lâm sàng rất đa dạng: từ TLT được đóng tự nhiên hoặc không có triệu chứng, đến suy tim, tăng áp động mạch phổi (pulmonary arterial hypertension) mức độ nặng…
TLT có thể mắc phải, gặp trong biến chứng sau nhồi máu cơ tim, sau phẫu thuật hoặc thay van động mạch chủ qua da, biến chứng sau phẫu thuật bệnh cơ tim phì đại lệch tâm, thay van hai lá sinh học, chấn thương, vết thương ngực,… Những trường hợp này bệnh nhân thường nặng, thái độ xử trí khác hẳn với thông liên thất bẩm sinh và sẽ được trình bày trong một tài liệu khác. Trong phạm vi chương sách này chúng tôi chỉ đề cập đến thông liên thất bẩm sinh đơn thuần.
Một số yếu tố gen và di truyền:
- TLT bẩm sinh chịu ảnh hưởng của các yếu tố bẩm sinh và môi trường và nhiều khi khó xác định được nguyên nhân. Khoảng 5% bệnh nhân có TLT có bất thường nhiễm sắc thể (NST) như ba NST 13,18 và 21.
- Các đột biến ở các gen liên quan đến TLT bẩm sinh như: GATA4, GATA6, CITED2, NKX2-5, HAND1, TBX2 và TBX18. Yếu tố SMAD3, yếu tố nội bào điều hoà tín hiệu beta TGF, có thể chỉ điểm nguy cơ giãn động mạch chủ lên (phình xoang Valsalva) ở bệnh nhân có TLT.
HÌNH THÁI HỌC VÀ SINH LÝ BỆNH
Phôi thai học
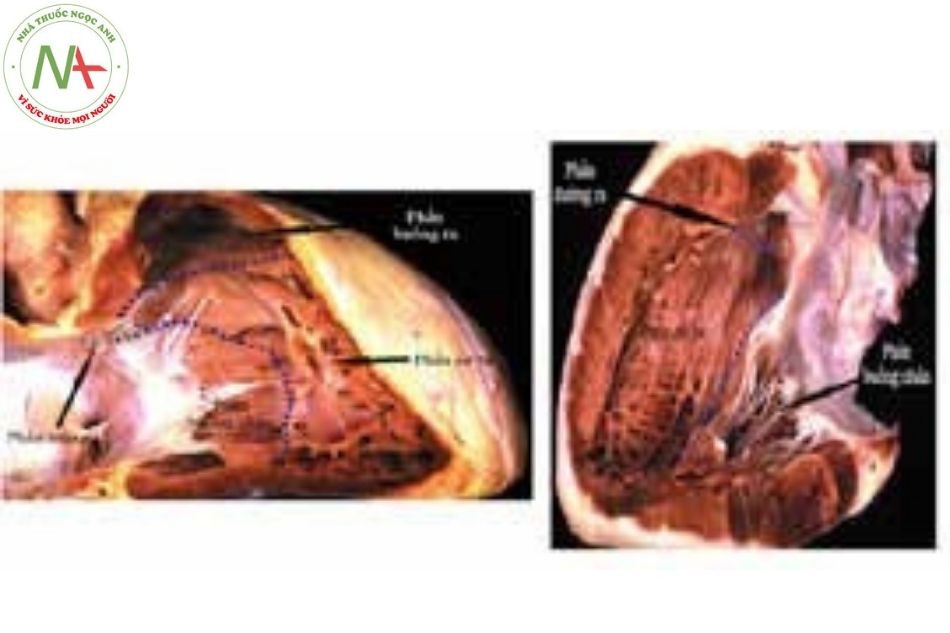
Thông liên thất là dị tật bất thường cấu trúc vách liên thất (Hình 15.1), gây ra luồng thông trái → phải (left-to-right shunt) đi từ tâm thất trái sang tâm thất phải, có thể dẫn tới tăng áp động mạch phổi (pulmonary arterial hypertension) sau khi sinh.
Quá trình ngăn các tâm thất là nhờ sự góp phần của 5 thành phần: vách liên thất nguyên thủy (primordial interventricular septum), gờ nội tâm mạc lưng (dorsal endocardial cushions), gờ nội tâm mạc bụng (ventral endocardial cushions), gờ hành phải (right bulbar ridge) và gờ hành trái (left bulbar ridge). Để ngăn tâm thất, bình thường năm thành phần này phải phát triển và thẳng đều. Điều này giải thích trong trường hợp phát triển bất thường tim, tần số dị tật vách liên thất rất cao. Dị tật này có nguyên nhân rất phức tạp do xảy ra các bất thường dưới đây:
- Gờ thân-nón động mạch phần gần tâm thất (gờ hành trái và gờ hành phải) kém phát triển.
- Sáp nhập không đầy đủ của vách liên thất phần cơ (muscular part of interventricular septum) và vách liên thất phần màng (membranous part of interventricular septum).
- Gờ nội tâm mạc không hòa nhập hoàn toàn.
- Vách liên thất phần cơ đục lỗ quá lớn.
Giải phẫu và sinh lý bệnh
Giải phẫu và phân loại thông liên thất
Vách liên thất được tạo ra từ 5 thành phần: phần màng, cơ (bè cơ), phễu, buồng nhận và một phần vách liên nhĩ thất. Lỗ TLT hình thành do khiếm khuyết trong sự phát triển của các thành phần này và tạo ra lỗ TLT với kích thước khác nhau.
Về mặt giải phẫu, thông liên thất được chia thành 4 loại:
- Type 1: thông liên thất phần phễu
(infundibular ventricular septal defect).
- Type 2: thông liên thất phần màng
(membranous ventricular septal defect).
- Type 3: thông liên thất phần buồng nhận
(inlet ventricular septal defect).
- Type 4: thông liên thất phần cơ (muscular ventricular septal defect).
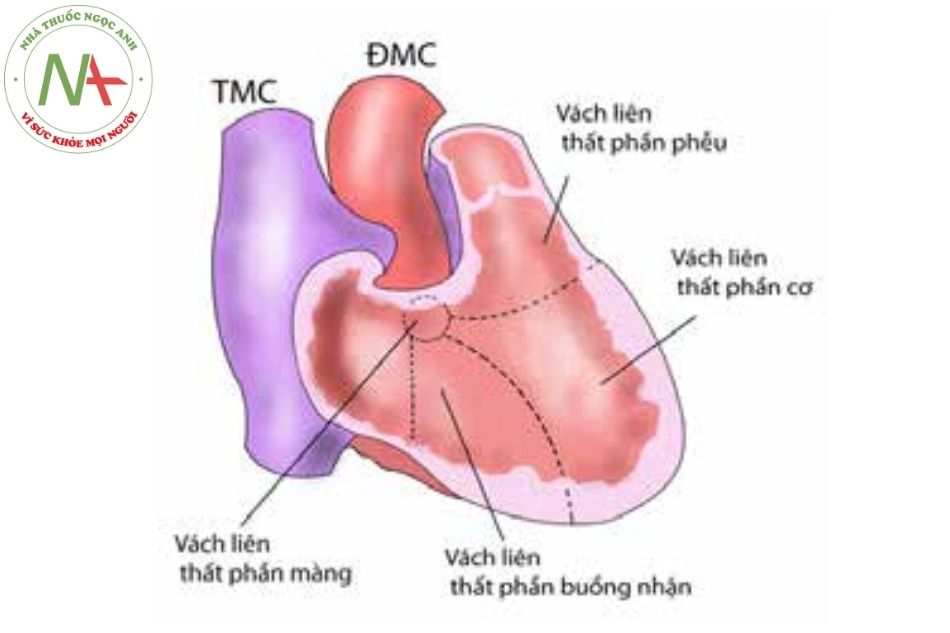
Chú thích: TMC: Tĩnh mạch chủ; ĐMC: Động mạch chủ.
TLT phần phễu (Type 1 hay còn gọi là TLT trên cựa, dưới động mạch chủ, dưới động mạch phổi, vùng nón, dưới hai đại động mạch): do khiếm khuyết vùng vách phía trên và trước vùng cựa trên thất, ngay dưới van động mạch chủ và động mạch phổi. TLT phần phễu phổ biến ở bệnh nhân gốc Á, chiếm 1/3 bệnh nhân TLT. Ngược lại người da trắng chiếm tỷ lệ ít nhất (6%).
TLT phần màng (Type 2 hay còn gọi TLT quanh màng hoặc vùng nón thất) là kiểu TLT phổ biến nhất ở người trưởng thành (chiếm 80%) với tổn thương khuyết vùng vách màng. Kiểu khiếm khuyết này nằm ở vùng thấp của cựa trên thất và gần lá vách van ba lá. Các khiếm khuyết này có thể lan ra các vùng xung quanh, vì vậy kiểu tổn thương này thường gọi là TLT quanh màng.
TLT phần buồng nhận (Type 3, kiểu kênh nhĩ thất): do khiếm khuyết của vùng vách buồng nhận, nằm dưới van hai lá và van ba lá. Mặc dù lỗ TLT gần các van này nhưng không gây hở van, trừ khi nằm trong bệnh cảnh kênh nhĩ thất (atrioventricular septal defect). Lúc này, tổn thương TLT thường rộng và hay gặp ở bệnh nhân có hội chứng Down.
TLT phần cơ (Type 4): chiếm từ 5-20%, nằm ở vùng cơ bè, xa các van tim. TLT phần cơ có kích thước khác nhau, một lỗ hoặc nhiều lỗ, còn gọi là TLT kiểu “pho mát Thuỵ Sĩ” với nhiều đường ra bên phía thất phải.
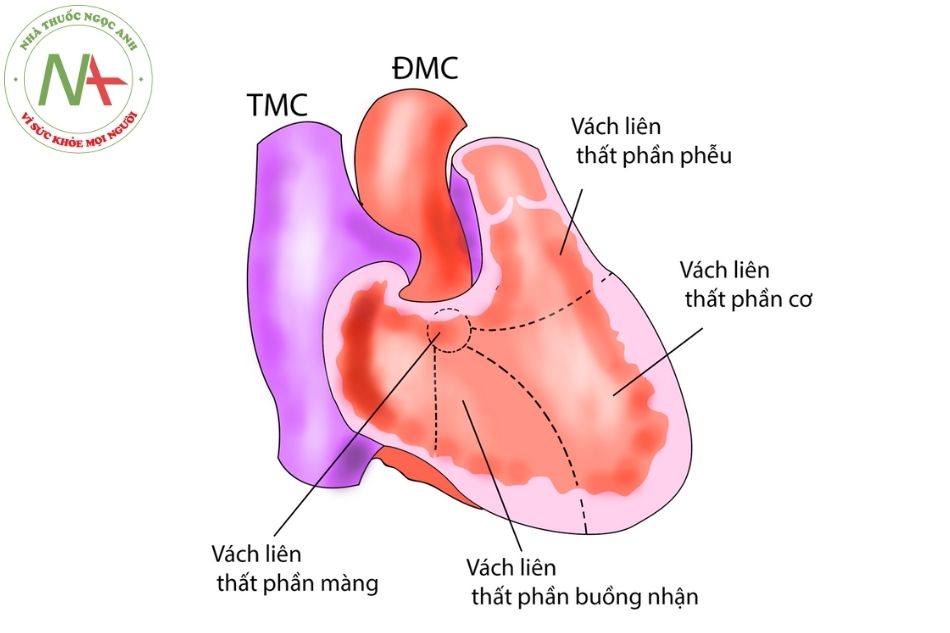
Tổn thương khuyết Gerbode (Gerbode defect) hay thông giữa thất trái → nhĩ phải (left ventricular to right atrial communication): là dạng ít gặp nhất, do khiếm khuyết của phần vách màng giữa thất trái và nhĩ phải, tạo ra luồng thông từ thất trái sang nhĩ phải. Tổn thương này cũng có thể thứ phát sau viêm nội tâm mạc nhiễm khuẩn hoặc sau thay van tim (Hình 3).
Sinh lý bệnh
Trong thì tâm thất thu, một lượng máu từ thất trái đi qua lỗ TLT sang thất phải sau đó lên phổi và theo các tĩnh mạch phổi quay trở lại nhĩ trái rồi xuống thất trái và gây nên hai hệ quả:
- Lượng máu tuần hoàn luẩn quẩn nói trên gây ra tình trạng quá tải thể tích thất trái trong thời kỳ tâm trương. Trên lâm sàng biểu hiện bởi tình trạng suy tim trái tăng gánh tâm trương.
- Do thất trái bình thường có áp lực tâm thu (~120 mmHg) cao hơn rất nhiều so với thất phải (~20 mmHg) nên thất phải sẽ bị tăng tải áp lực và thể tích. Chính áp lực và thể tích tăng lên của thất phải sẽ dần gây nên những biến đổi của hệ tiểu động mạch phổi, gây nên tăng áp động mạch phổi. Ban đầu chỉ là phản ứng có thể hồi phục nhưng dần dần trở nên cố định và không thể đảo ngược được.
Trong trường hợp nặng và tiến triển lâu ngày, áp lực động mạch phổi có thể tăng cao đến mức ngang bằng hoặc vượt hơn cả áp lực hệ thống. Khi áp lực thất phải cao hơn bên thất trái thì luồng máu qua lỗ TLT bị đảo ngược, tức là máu đi từ thất phải → thất trái (right – to – left shunt). Máu thất phải có độ bão hòa oxy thấp hơn máu bên thất trái do đó luồng máu đảo ngược này sẽ gây nên biểu hiện tím trên lâm sàng.
Những ảnh hưởng huyết động học của TLT càng thấy rõ ở những bệnh nhân có lỗ thông lớn. Những bệnh nhân này có thể biểu hiện suy tim, khó thở, ăn uống kém, chậm tăng trưởng và phát triển cũng như dễ mắc nhiễm trùng phổi nặng. Những trẻ có lỗ thông nhỏ không ảnh hưởng huyết động có thể không có triệu chứng lâm sàng.
Đánh giá kích thước thông liên thất về mặt giải phẫu
Hiện chưa có thống nhất về phân loại kích thước thông liên thất. Tuy nhiên, có thể đánh giá mức độ lớn của thông liên thất dựa trên: tỉ lệ đường kính lỗ thông và đường kính gốc động mạch chủ; chiều luồng thông; tỷ lệ lưu lượng tuần hoàn phổi và tuần hoàn hệ thống – Qp/Qs; mức độ quá tải thể tích thất trái.
TLT lỗ nhỏ
- Có luồng thông trái -> phải (left-to-right shunt) nhỏ (với Qp/Qs < 1,5) và sức cản mạch phổi không tăng đáng kể.
- Với đường kính lỗ TLT ≤ 25% đường kính vòng van động mạch chủ.
- Không có quá tải thể tích thất trái và không tăng áp động mạch phổi.
- Hầu hết các loại TLT quanh màng hoặc phần cơ nhỏ có thể tự đóng trong thời kỳ niên thiếu.
TLT mức độ trung bình
- Với luồng thông lớn hơn (1,5 ≤ Qp/Qs < 2 ).
- Kích thước lỗ thông từ 25% tới dưới 75% đường kính vòng van động mạch chủ.
- Gây quá tải thể tích thất trái mức độ trung bình, ảnh hưởng đến động mạch phổi, nhĩ trái và thất trái.
- Bệnh nhân có tăng áp động mạch phổi trung bình.
TLT lỗ lớn
- Đường kính lỗ thông ≥ 75% đường kính vòng van động mạch chủ.
- Luồng thông trái -> phải lớn: Hầu hết trẻ sơ sinh có TLT lớn thì luồng thông trái -> phải lớn xuất hiện sớm (Qp/Qs ≥ 2), tại thời điểm sức cản động mạch phổi giảm nhanh sau sinh. Kết quả gây quá tải thể tích thất trái và suy tim.
- Các lỗ TLT loại này có thể chỉ định đóng trong năm đầu tiên.
Đánh giá kích thước thông liên thất về mặt giải phẫu
Cần lưu ý là phân loại này chỉ mang tính chất tương đối, cần xem xét kích thước (chiều cao, trọng lượng) của bệnh nhân, đặc biệt là ở trẻ nhỏ.
- Nhỏ: < 4 mm.
- Vừa: 4 đến 6 mm.
- Lớn: > 6 mm.
Thông liên thất tồn lưu:
Có thể gặp ở một số bệnh nhân đã được phẫu thuật/can thiệp đóng lỗ TLT từ trước, có thể còn TLT tồn lưu; kích thước thường nhỏ và không ảnh hưởng huyết động nhiều.
Diễn biến tự nhiên của thông liên thất
Diễn biến tự nhiên của TLT khi không được điều trị có liên quan chặt chẽ đến kích thước và vị trí của lỗ thông.
Theo vị trí thông liên thất Tiến triển của TLT phần cơ
TLT phần cơ bè có khả năng tự đóng cao (tới 80%), theo một số nghiên cứu thì đa số các TLT nhỏ vùng này đều tự đóng trước 8-10 tháng tuổi. Các TLT nằm ở phía trước hoặc sau dưới thường có tỉ lệ tự đóng cao hơn và nhanh hơn TLT nằm ở vùng mỏm, điều này cũng giải thích tại sao đa số các TLT phần cơ có chỉ định bít thường nằm ở vùng mỏm tim hơn là các vùng khác.
Các TLT phần cơ nằm ở vùng đường ra hoặc buồng nhận thường ít có xu hướng tự đóng.
Tiến triển của TLT phần quanh màng
So với các TLT phần cơ có cùng kích thước, các TLT phần quanh màng kích thước nhỏ hoặc trung bình thường có tỉ lệ tự đóng thấp hơn và chậm hơn. Tỷ lệ tự đóng của TLT phần quanh màng thay đổi theo các nghiên cứu, thời gian theo dõi và tiêu chuẩn lựa chọn bệnh nhân trong nghiên cứu; nhưng nhìn chung con số này dao động trong khoảng 9-37%. TLT phần quanh màng thường ít khi tự đóng sau khi trẻ trên 2 tuổi.
TLT phần quanh màng thường phối hợp với hiện tượng phình vách màng, chiếm 74-77%. Trường hợp TLT lan dưới van ĐMC có thể dẫn tới sa van động mạch chủ, gây hở van động mạch chủ (aortic valve regurgitation).
Tiến triển của TLT dưới đại động mạch
Trong thể TLT này khả năng tự đóng là rất thấp, một số nghiên cứu cho thấy tỷ lệ này chỉ khoảng 4% với các lỗ thông kích thước nhỏ hơn 4 mm. Một nghiên cứu cho thấy thể TLT này thường phối hợp với hiện tượng sa van động mạch chủ (17-69%), hở van động mạch chủ (16,7-36%), phình xoang Valsalva (9%).
Theo kích thước thông liên thất Thông liên thất kích thước nhỏ
- Khoảng 75-80% các TLT nhỏ sẽ tự đóng lại trong vòng hai năm đầu đời. Thông liên thất phần cơ được đóng lại do sự phát triển và lớn lên của vách liên thất phần cơ xung quanh. Trong khi đó, lỗ thông liên thất nhỏ phần màng có thể đóng lại do việc bố trí lá vách của van ba lá, xảy ra do dòng máu phụt qua lỗ thông, cũng như sự phát triển của phình vách màng.
- Ở trẻ lớn hơn, qua theo dõi ghi nhận một tỷ lệ nhỏ thông liên thất có thể đóng cho đến tuổi vị thành niên.
- Ở người lớn với các lỗ TLT nhỏ với luồng thông trái -> phải (hay còn gọi là tổn thương Roger) thường không có triệu chứng và kèm theo có tiếng thổi tâm thu rõ, có rung miu. Tuy nhiên, có nguy cơ gây viêm nội tâm mạc nhiễm khuẩn với tỉ lệ thấp.
- Một số ít thông liên thất dưới van ĐMC có thể tiến triển gây biến chứng hở van động mạch chủ tạo ra tiếng thổi tâm trương trên lâm sàng (hội chứng Laubry-Pezzi).
Thông liên thất kích thước trung bình
Trẻ em có lỗ TLT kích thước trung bình có thể không có triệu chứng hoặc suy tim nhẹ, đáp ứng với điều trị nội khoa và theo thời gian khi trẻ lớn lỗ TLT có thể đóng lại hoàn toàn hoặc một phần.
- Ở người trưởng thành có TLT mức độ trung bình sẽ không được đóng lại hoàn toàn, bệnh có thể tiến triển thành tăng áp động mạch phổi và xuất hiện các triệu chứng của quá tải thể tích thất trái.
Thông liên thất kích thước lớn
- Lỗ thông không thể tự đóng lại được, cần can thiệp đóng TLT bằng ngoại khoa hoặc thủ thuật can thiệp (nếu có thể).
- Tăng áp động mạch phổi tiến triển: nếu TLT lớn chưa được can thiệp, có thể xuất hiện tăng áp động mạch phổi tiến triển thành bệnh lý mạch máu phổi. Lưu lượng của luồng thông trái -> phải sẽ giảm khi sức cản động mạch phổi tăng lên.
- Khi bệnh lý tiến triển nặng lên và có luồng thông phải -> trái (right-to-left shunt), được gọi là phức hợp Eisenmenger (Eisenmenger complex): sức cản động mạch phổi tăng dần, áp lực buồng thất phải có thể bằng, thậm chí cao hơn áp lực hệ thống và hậu quả gây đảo ngược luồng thông qua lỗ TLT, dẫn tới hậu quả lâm sàng gây giảm oxy máu động mạch và tím, được gọi chung là hội chứng Eisenmenger.
Các biến chứng của thông liên thất
- Những TLT lỗ lớn thường dẫn đến sự kém phát triển thể chất, suy tim, viêm phế quản phổi kéo dài, hay tái phát ngay từ những năm đầu đời của trẻ.
- Hội chứng Eisenmenger: Ở bệnh nhân có TLT trung bình đến lớn, nếu không được sửa chữa có thể dẫn đến hội chứng Eisenmenger, là nguyên nhân chính gây tử vong sau này của những bệnh nhân TLT.
- Viêm nội tâm mạc nhiễm khuẩn: Sự tồn tại của TLT cũng làm xuất hiện nguy cơ viêm nội tâm mạc nhiễm khuẩn, với tần suất khoảng 14,5-24 trường hợp trên 10000 bệnh nhân mỗi năm.
- TLT nằm gần van động mạch chủ, có thể dẫn tới sa lá van, phình vách màng và sẽ là nguyên nhân chính của hở van động mạch chủ trong thể TLT này.
- Hẹp dưới van động mạch chủ (subaortic stenosis): Bệnh nhân TLT phần màng đôi khi có thể phát triển hẹp dưới van ĐMC bởi tăng sinh các xơ hoặc sợi. Chỉ định phẫu thuật dựa trên chênh áp (gradient qua chỗ hẹp đường ra thất trái) và triệu chứng lâm sàng. Cần theo dõi lâu dài sau phẫu thuật cắt bỏ do có thể tái phát.
- Biến chứng rối loạn nhịp: cả rối loạn nhịp thất và nhịp nhĩ, như ngoại tâm thu thất, ngoại tâm thu nhĩ, rung nhĩ.
- Tắc nghẽn đường ra thất phải (right ventricular outflow obstruction): Trong TLT phần quanh màng, ở một số hiếm bệnh nhân có thể phát triển phì đại trong buồng thất phải, do tổn thương dòng phụt theo thời gian có thể dẫn đến hẹp đường ra tống máu. Thất phải hai buồng (double-chambered right ventricle) là hậu quả khi các dải phát triển cơ phì đại, chia buồng thất phải thành hai khoang, có thể xảy ra cả ở những bệnh nhân chưa hoặc đã trải qua phẫu thuật sửa chữa. Sự cản trở tống máu dẫn đến tăng áp lực buồng thất phải và giảm luồng thông trái -> phải. Ban đầu, quá trình này có thể giúp cải thiện tình trạng suy tim ở trẻ nhỏ; tuy nhiên, khi tình trạng phì đại nặng có thể tiến triển thành luồng thông phải -> trái, với các đặc điểm lâm sàng tương tự như trong tứ chứng Fallot.
CHẨN ĐOÁN
Triệu chứng cơ năng
Các biểu hiện lâm sàng của thông liên thất phụ thuộc vào kích thước lỗ thông, mức độ luồng thông, tương quan giữa sức cản mạch máu phổi (pulmonary vascular resistance) và sức cản mạch máu hệ thống (systemic vascular resistance), mức độ suy tim nếu có.
Khó thở khi gắng sức và mệt ở bệnh nhân TLT có thể do hậu quả của quá tải thể tích thất trái, kết hợp với hở van động mạch chủ và hở van ba lá nhiều, tăng áp động mạch phổi, có thất phải hai buồng.
Ngất là triệu chứng hiếm xảy ra ở bệnh nhân TLT; có thể do tăng áp động mạch phổi nặng, tắc nghẽn đường ra thất phải do thất phải hai buồng, phình lớn của phần quanh màng gây tắc nghẽn đường ra thất phải hoặc rối loạn nhịp tim.
Triệu chứng của các tổn thương kết hợp khác: Một số bệnh nhân TLT có các tổn thương tim bẩm sinh/mắc phải phối hợp khác, bao gồm hở van động mạch chủ, hở van ba lá , hoặc phình xoang Valsalva.
- Hở van động mạch chủ: hay gặp ở bệnh nhân TLT phần phễu và gặp ở một số TLT phần màng lan lên sát van ĐMC. Nguyên nhân do khiếm khuyết hoặc thiểu sản của phần vách nón, gây ra bất thường giải phẫu vùng cấu trúc nâng đỡ van động mạch chủ và xoang Valsalva. Trong thì tâm thu, do hiệu ứng Venturi kéo lá vành phải hoặc trái vào phía buồng thất phải qua lỗ TLT do đó làm lỗ TLT nhỏ lại tương đối. Trong thì tâm trương, bình thường lá van động mạch chủ sẽ đóng lại do áp lực của động mạch chủ nhưng khi lá van không được nâng đỡ tốt sẽ sa vào đường ra thất trái (sa van), gây hở van động mạch chủ và gây quá tải thể tích thất trái.
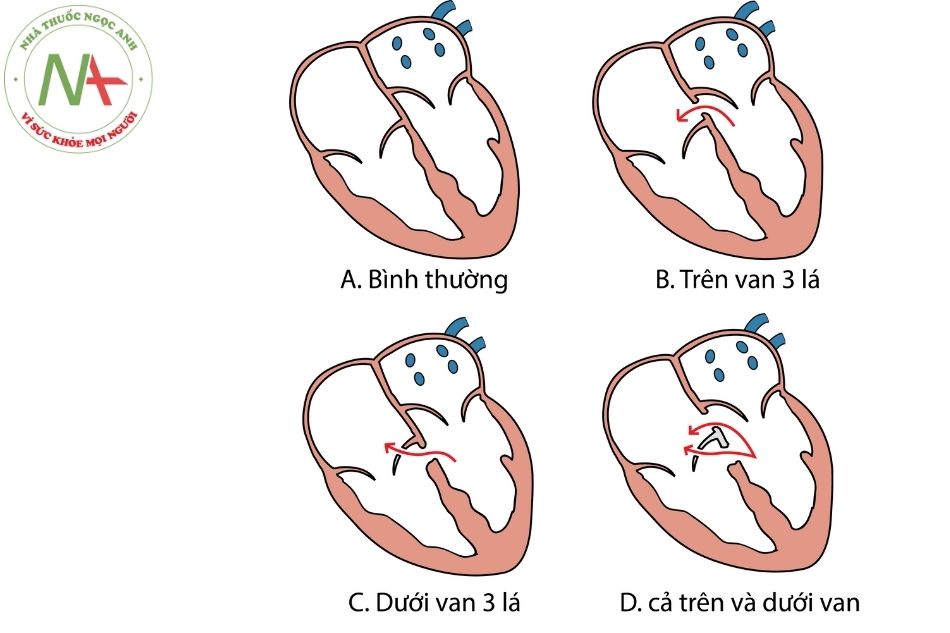
Chiều mũi tên: Chiều dòng máu
A. Luồng thông qua lỗ thông liên thất hút lá van động mạch chủ về phía bên phải (hiệu ứng Venturi). B. Sa van động mạch chủ. C. Hở van động mạch chủ.
- Hở van ba lá: Tiếng thổi của hở van ba lá ít gặp ở bệnh nhân có TLT. Hở ba lá ở bệnh nhân TLT phần màng do lá vách van ba lá bị xé hoặc loạn sản; hoặc do luồng thông qua lỗ TLT đẩy lá trước van ba lá.
Khám thực thể
Phần lớn TLT có thể được phát hiện qua thăm khám lâm sàng, triệu chứng phụ thuộc vào kiểu TLT, kích thước và các bất thường huyết động.
Tiếng thổi tâm thu: phụ thuộc vào lưu lượng máu qua lỗ thông. Có hai yếu tố quyết định lưu lượng máu qua là kích thước lỗ thông và chênh áp qua lỗ thông.
- Lỗ TLT nhỏ thì tiếng thổi tâm thu thường lớn, tiếng thổi tâm thu có âm sắc cao, ở khoang liên sườn 3-4 cạnh ức trái và thường có rung miu tâm thu.
- Tiếng đóng van động mạch chủ có thể nghe thấy hoặc bị mờ đi bởi tiếng thổi.
- Tiếng thổi trong TLT kéo dài toàn tâm thu nhưng thường ngừng trước tiếng T2 do trong TLT phần cơ lỗ thông gần như biến mất giữa kỳ tâm thu khi tim co lại.
Có thể có sự thay đổi tính chất tiếng thổi tâm thu do các các tổn thương phối hợp khác như thất phải hai buồng, tăng áp mạch máu phổi (pulmonary hypertension), vỡ xoang Valsalva hay hở van động mạch chủ. TLT phần màng có thể đóng tự phát do việc dính của lá vách van ba lá, hình thành nên phình vách màng; phình vách màng này có thể tạo ra tiếng click giữa tâm thu và có thể gây ngất khi nó lớn gây cản trở đường tống máu thất phải.
Bệnh nhân TLT có thể có hẹp van hoặc dưới van động mạch phổi. Tiếng thổi toàn tâm thu điển hình có thể bị thay đổi thành tiếng thổi hình chóp “diamond-shaped”, còn gọi là tiếng thổi giữa tâm thu (crescendo decrescendo murmur), hay đơn giản chỉ là tiếng thổi tống máu qua động mạch phổi bị hẹp. Tương tự như vậy ở bệnh nhân TLT với thất phải hai buồng có tiếng thổi dạng này lớn nghe được ở bờ trái xương ức, kèm theo rung miu. TLT phần phễu cho dòng máu qua lỗ TLT đi lên thẳng động mạch phổi và do vậy có tiếng thổi tống máu tâm thu nghe rõ ở khoang liên sườn 2 cạnh ức.
Ở bệnh nhân với TLT phần phễu hoặc phần màng gây biến chứng hở van ĐMC: có thêm tiếng thổi tâm trương của hở van ĐMC. Khi mức độ hở van động mạch chủ nhiều, biểu hiện các dấu hiệu như mạch nảy mạnh chìm sâu, tiếng thổi 2 thì nghe rõ ở bờ trên xương ức. Đôi khi dễ nhầm lẫn với tiếng thổi liên tục gặp trong bệnh còn ống động mạch (patent ductus arteriosus) hay vỡ phình xoang Valsalva (sinus of Valsalva aneurysm and fistula). Điểm khác nhau trong trường hợp này là thành phần tiếng thổi tâm thu ngừng trước tiếng T2. Bệnh nhân cũng có biểu hiện giãn buồng tim trái khi hở van động mạch chủ nhiều.
Bệnh nhân có TLT mức độ vừa đến nhiều, tính chất và thời gian của tiếng thổi sẽ thay đổi theo tiến triển của bệnh lý tăng áp mạch máu phổi. Bệnh nhân có tăng áp động mạch phổi, tiếng thổi xuất hiện đầu kỳ tâm thu và đạt đỉnh sớm hơn.
Khi TLT có bệnh lý tắc mạch phổi và tăng áp động mạch phổi nặng như trong hội chứng Eisenmenger, bệnh nhân có tím trung ương và ngón tay dùi trống rõ. Các dấu hiệu lâm sàng ở bệnh nhân có hội chứng Eisenmenger:
- Không có tiếng thổi toàn tâm thu điển hình của TLT do áp lực hai buồng thất cân bằng và không còn luồng thông trái -> phải. Tiếng thổi tâm thu có trong hội chứng Eisenmenger là do hở van ba lá. Có thể đó là tiếng thổi tống máu giữa tâm thu ở bệnh nhân tăng áp mạch máu phổi nhiều và thường có tiếng thổi tâm trương của hở van động mạch phổi (tiếng thổi Graham Steel).
- Tiếng đóng van động mạch phổi mạnh, thường hợp nhất với đóng van động mạch chủ tạo ra tiếng T2 đơn độc.
- Khi bệnh nặng hơn sẽ có các biểu hiện dấu hiệu suy tim phải như phù, cổ trướng và gan to.
Khám thực thể
Điện tâm đồ
Thường không đặc hiệu. Các bệnh nhân có TLT lỗ nhỏ, điện tâm đồ thường không có gì đặc biệt. Tuy nhiên, các bất thường điện tâm đồ như chậm dẫn truyền trong thất hay block nhánh phải thường thấy ở các bệnh nhân có TLT lớn. Các dấu hiệu như giãn nhĩ trái và thất trái hoặc phì đại có thể cho thấy các dấu hiệu của quá tải thể tích thất trái do luồng thông hay mức độ hở van động mạch chủ.
Trong trường hợp có hội chứng Eisenmenger, hoặc do tắc nghẽn đường ra thất phải như thất phải hai buồng, điện tâm đồ có dấu hiệu áp lực thất phải cao như trục phải, giãn nhĩ phải và thất phải hoặc phì đại hai thất.
Các rối loạn nhịp như ngoại tâm thu nhĩ, thất xuất hiện nhiều hơn khi áp lực thất phải càng cao.
Phim Xquang tim phổi
- Ở bệnh nhân có lỗ TLT nhỏ, phim Xquang ngực cho thấy chỉ số tim ngực bình thường và tưới máu phổi bình thường.
- Ở bệnh nhân có TLT lỗ lớn, phim Xquang ngực cho thấy bóng tim to, rốn phổi đậm, giãn nhĩ trái và động mạch phổi do quá tải thể tích; đây là các dấu hiệu cho thấy mức độ của luồng thông, tăng mức độ tưới máu ở phổi.
- Trong trường hợp thông liên thất nặng kèm tăng áp động mạch phổi cố định (hội chứng Eisenmenger): bóng thất phải to (trên Xquang tim phổi nghiêng), kèm theo giãn nhĩ phải và hình ảnh“vòi voi” biểu hiện phần động mạch phổi trung tâm giãn to nhưng mạch phổi ở 1/3 ngoại vi thì co nhỏ lại.
Siêu âm tim
Cho đến nay, siêu âm tim là phương pháp chẩn đoán không xâm lấn hiệu quả nhất trong bệnh thông liên thất. Giá trị của siêu âm tim không chỉ giúp chẩn đoán thông liên thất mà còn có giá trị trong chỉ định điều trị lỗ thông liên thất bằng phương pháp phẫu thuật hay can thiệp qua đường ống thông. Đánh giá thông liên thất trên siêu âm tim gồm có:
- Chẩn đoán xác định TLT: hình ảnh khuyết một phần vách liên thất (siêu âm 2D), dòng chảy rối tâm thu khi đặt cửa sổ Doppler ở phía thất phải của lỗ TLT, đánh giá tổn thương TLT và các dị tật đi kèm.
- Chẩn đoán vị trí của TLT, kích thước TLT, để ứng dụng trong thủ thuật bít lỗ thông bằng dụng cụ.
- Chẩn đoán tổn thương phối hợp: hở van nhĩ thất, van ĐMC, phình vách màng (trong TLT phần quanh màng), các dị tật bẩm sinh khác của tim.
- Đánh giá ảnh hưởng huyết động của lỗ TLT lên tim: đo kích thước các buồng thất, ước lượng áp lực ĐMP.
Siêu âm trong thông liên thất: bao gồm siêu âm tim 2D, TM, Doppler, 3D và siêu âm tim trong quá trình can thiệp.
(1) Siêu âm 2D
Trên siêu âm 2D, vách liên thất có dạng cong. Phương pháp kinh điển sử dụng các mặt cắt 2D để xác định vị trí, mức độ mở rộng của lỗ TLT. Mặc dù lỗ thông liên thất thường được miêu tả là thuộc phần màng, phần cơ, dưới đại động mạch hay phần buồng nhận nhưng một lỗ thông liên thất có thể không nằm khu trú ở bất kỳ phần nào trong các phần trên mà lan rộng tới các phần xung quanh.
Ngoài ra, cũng có thể có nhiều lỗ thông khác nhau cùng xuất hiện ở một vùng hoặc nhiều vùng của vách liên thất.
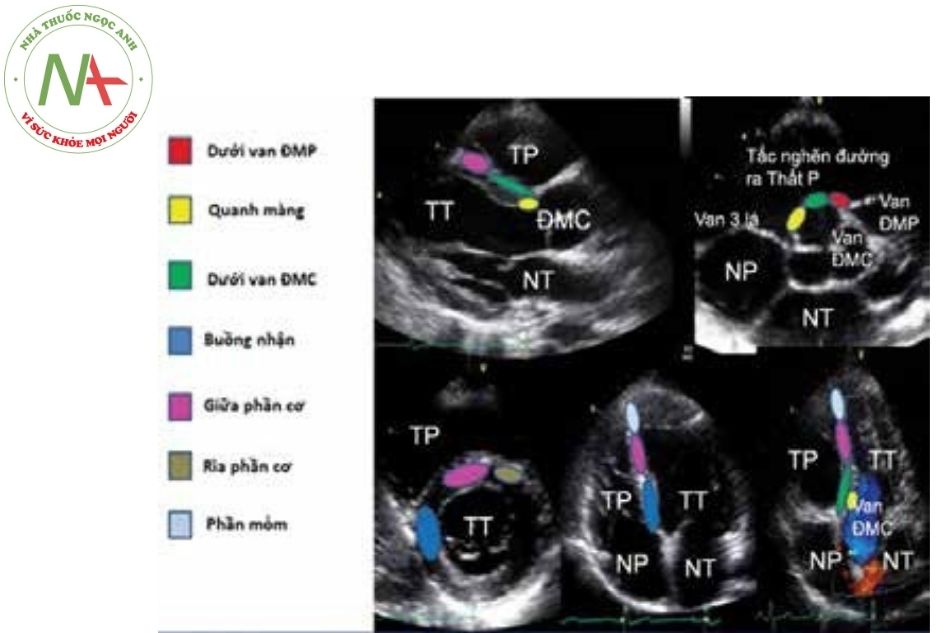
Siêu âm tim 2D chẩn đoán TLT
- Trên mặt cắt trục dọc cạnh ức: cho phép phân biệt được các loại TLT giữa phần cơ, màng và phần phễu. Hai tổn thương màng và phễu được nhìn thấy dưới van động mạch chủ và khó phân biệt ở góc siêu âm này.
- Mặt cắt trục ngắn cạnh ức: Vị trí TLT ở góc từ 09 giờ đến 11 giờ là TLT phần quanh màng; vị trí TLT ở góc từ 12 giờ đến 14 giờ của đường ra thất phải xác định TLT dưới đại động mạch; vị trí TLT > 14h là TLT phần buồng nhận.
- Ở mặt cắt cạnh ức cũng có thể thấy mức độ phình giãn của phần vách màng hay xoang Valsalva và đánh giá mức độ hở van động mạch chủ và thất phải hai buồng.
- Mặt cắt 5 buồng từ mỏm: Đây là mặt cắt quan trọng để xác định TLT phần quanh màng không có gờ ĐMC. Góc cắt siêu âm từ mỏm có thể đánh giá TLT phần buồng nhận, phần cơ và tổn thương Gerbode. TLT phần buồng nhận nằm ngay cạnh van hai lá và van ba lá và kéo dài tới chỗ gắn dây chằng của van ba lá, trong khi TLT phần cơ nằm ở vách bè xa các van
- Ngoài ra, một số mặt cắt khác có thể dùng để hỗ trợ trong trường hợp hình ảnh siêu âm tim chưa rõ như mặt cắt dưới sườn, 4 buồng từ mỏm.
Thứ tự mặt cắt từ trên xuống: Mặt cắt cạnh ức trục dài và trục ngắn; Mặt cắt 4 buồng, 5 buồng từ mỏm tim.
Chú thích: TP: Thất phải; TT: Thất trái; NP: Nhĩ phải; NT: Nhĩ trái; ĐMC: Động mạch chủ; ĐMP: Động mạch phổi; P: Phải.
- Kích thước gờ động mạch chủ: khoảng cách từ bờ lỗ thông đến van động mạch chủ. Trên siêu âm tim, gờ động mạch chủ thông thường được đo ở các mặt cắt trục dọc cạnh ức, mặt cắt 5 buồng. Gờ động mạch chủ được xác định chính là một dải mảnh tăng âm ở bờ trên của TLT liên tiếp với tổ chức dưới van động mạch chủ.
- Cạnh lỗ thông liên thất phần quanh màng có thể thấy hình ảnh phình vách màng là tổ chức phát triển từ lá vách của van ba lá kéo đến bao quanh lỗ thông liên thất, trong một số trường hợp nó có thể bít hoàn toàn hay không hoàn toàn lỗ thông liên thất.
Siêu âm cũng cung cấp các đánh giá về huyết động, xác định quá tải thể tích nhĩ trái, thất trái và nhĩ phải, thất phải và động mạch phổi; xác định và đánh giá mức độ nặng của các biến chứng như: thất phải hai buồng, hở van động mạch chủ, tăng áp mạch máu phổi và phình vách màng hoặc phình xoang Valsalva. Cuối cùng, siêu âm tim cũng cho các thông tin về mức độ biến dạng của van động mạch chủ, sa van và hở van động mạch chủ ở hầu hết các bệnh nhân TLT phần phễu và TLT phần màng. Trong TLT đơn thuần sẽ không có giãn nhĩ phải trên siêu âm tim. Khi bệnh nhân TLT có giãn buồng nhĩ phải cần đi tìm các tổn thương kèm theo như: giãn nhĩ phải không thường gặp trong TLT đơn thuần và do các nguyên nhân sau:
- Hội chứng Eisenmenger.
- Khuyết Gerbode: Luồng thông giữa thất trái và nhĩ phải, có thể do bẩm sinh hoặc mắc phải.
- Thất phải hai buồng, do phì đại của bó cơ bất thường phát triển trong thất phải ở vùng gần TLT phần màng gây hẹp dưới van động mạch phổi. Bó cơ này chia thất phải làm buồng: buồng gần phía van ba lá là buồng có áp lực cao và buồng xa gần phía van động mạch phổi là buồng có áp lực thấp. Tình trạng này xảy ra từ 3 đến 10% các bệnh nhân TLT quanh màng và giúp bảo vệ phổi, tránh nguy cơ tăng áp mạch máu phổi.
Tỷ lệ Qp/Qs khó tính được trên siêu âm tim. Kích thước tâm thất trái và tâm nhĩ trái bình thường cho thấy lỗ TLT thường nhỏ với luồng thông trái -> phải. Mặt khác, nhĩ trái, thất trái và động mạch phổi giãn không rõ nguyên nhân chỉ ra một lỗ TLT lớn với luồng thông trái -> phải nhiều, cần thiết xét can thiệp.
(2) Siêu âm TM
Siêu âm TM không cho những hình ảnh trực tiếp của lỗ TLT mà chỉ cung cấp những thông tin gián tiếp: kích thước và chức năng tâm thu thất trái, dạng di động của van động mạch phổi (là dấu hiệu gián tiếp của tăng áp động mạch phổi).
(3) Siêu âm Doppler
Doppler màu
- Siêu âm Doppler màu là phương pháp hỗ trợ rất hữu dụng để phát hiện các lỗ Phương pháp này có thể được sử dụng để giúp định khu và xác định sự có mặt, vị trí của lỗ TLT dựa vào các đặc điểm của phổ Doppler. Trong nhiều trường hợp nhất là các TLT phần quanh màng, tổ chức phình vách màng có thể che bớt một phần lỗ thông, do đó, kích thước giải phẫu thật của lỗ thông có thể lớn hơn kích thước hiện có trên siêu âm. Bởi vậy trên siêu âm tim, việc đo dựa trên luồng thông trên Doppler màu giúp đánh giá chính xác kích thước của lỗ thông liên thất.
- Siêu âm Doppler để xác định kích thước, mức độ luồng thông, các biến chứng, ảnh hưởng lên tim như sau:
- Siêu âm Doppler liên tục với vận tốc ≥ 5 m/s qua lỗ TLT nghĩ đến TLT lỗ nhỏ với luồng thông trái → phải. Với TLT kiểu đường hầm (tunnel-type) (chiều dài lỗ thông/chiều rộng > 1,2), trên siêu âm Doppler liên tục có thể đánh giá quá mức chênh áp qua lỗ thông.
- Mặt khác, khi vận tốc dòng chảy qua lỗ TLT đo được trên siêu âm Doppler liên tục thấp gợi ý áp lực thất phải cao, cần tìm thêm liệu có tắc nghẽn đường ra thất phải (right ventricular outflow obstruction), hẹp van động mạch phổi hay tăng áp mạch máu phổi nhiều phối hợp.
- Khi chỉ có TLT, luồng thông qua lỗ thông chủ yếu là trái sang phải (trong cả hai kỳ tâm thu và tâm trương). Khi có thêm các bất thường tim phải như hẹp van động mạch phổi, rối loạn chức năng tâm trương thất phải hay có block nhánh phải rộng có thể xuất hiện luồng thông phải → trái trên siêu âm Doppler hoặc siêu âm tim cản âm.
Doppler liên tục
- Góp phần xác định hướng của luồng thông dựa trên chiều dương hay âm của phổ.
- Đo chênh áp giữa thất trái và thất phải qua lỗ thông liên thất để ước tính áp lực động mạch phổi:
Gradient = ALTT – ALTP = 4v2
(Lưu ý: ALTP = ALĐMPtt = ALTT – 4v2)
(Trong đó: v là vận tốc tối đa luồng thông qua lỗ TLT (đo trên Doppler liên tục); ALTT là áp lực thất trái – chính là huyết áp tâm thu đo ở cánh tay bệnh nhân; ALTP là áp lực thất phải; ALĐMPtt là áp lực động mạch phổi tâm thu. Áp lực thất phải thường tương đương với áp lực động mạch phổi tâm thu nếu không có chênh áp giữa buồng thất phải và động mạch phổi. Ước tính ALĐMP tâm thu dựa vào phổ của hở van ba lá, ALĐMP trung bình và cuối tâm trương dựa vào phổ của hở van động mạch phổi.)
(4) Siêu âm tim 3D
- Có thể được sử dụng để xác định giải phẫu của lỗ Siêu âm tim 3D cho phép định khu tổn thương và tìm mối liên quan của nó với các cấu trúc tim khác và vượt trội hơn siêu âm 2D trong việc mô tả hình dạng và kích thước lỗ TLT. Những thông tin này đặc biệt quan trọng trong việc lựa chọn bệnh nhân và lựa chọn thiết bị để can thiệp bít TLT qua da và đặc biệt trong điều trị TLT phần cơ.
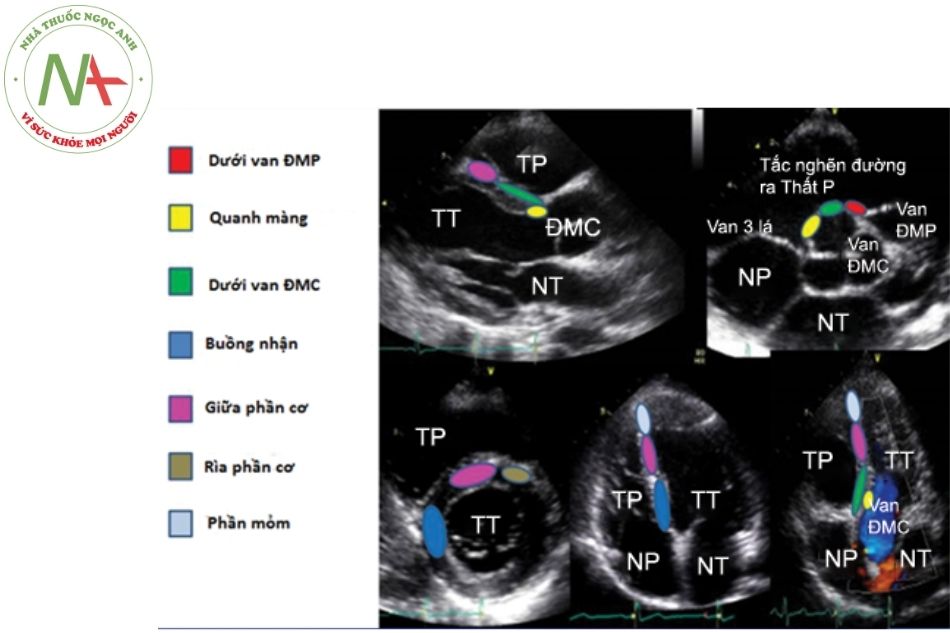
Chú thích: TLT: Thông liên thất; ĐMP: Động mạch phổi; NP: Nhĩ phải; NT: Nhĩ trái; TP: Thất phải; TT: Thất trái.
(5) Siêu âm tim trong quá trình can thiệp
Trong quá trình can thiệp, siêu âm tim có vai trò hướng dẫn đo kích thước lỗ thông, lựa chọn kích thước dụng cụ phù hợp, theo dõi vị trí của dây dẫn, hệ thống ống thông và ống thả trong buồng tim cũng như vị trí của dụng cụ trước và sau khi thả. Thêm vào đó, siêu âm tim giúp đánh giá chức năng van nhĩ thất và van động mạch chủ trước và ngay sau can thiệp, phát hiện và lượng hóa mức độ luồng thông tồn lưu ngay sau can thiệp nếu có. Thông thường, siêu âm tim qua thành ngực là đủ, tuy nhiên, trong các trường hợp khó, siêu âm tim qua thực quản là phương tiện hữu ích giúp hỗ trợ can thiệp.
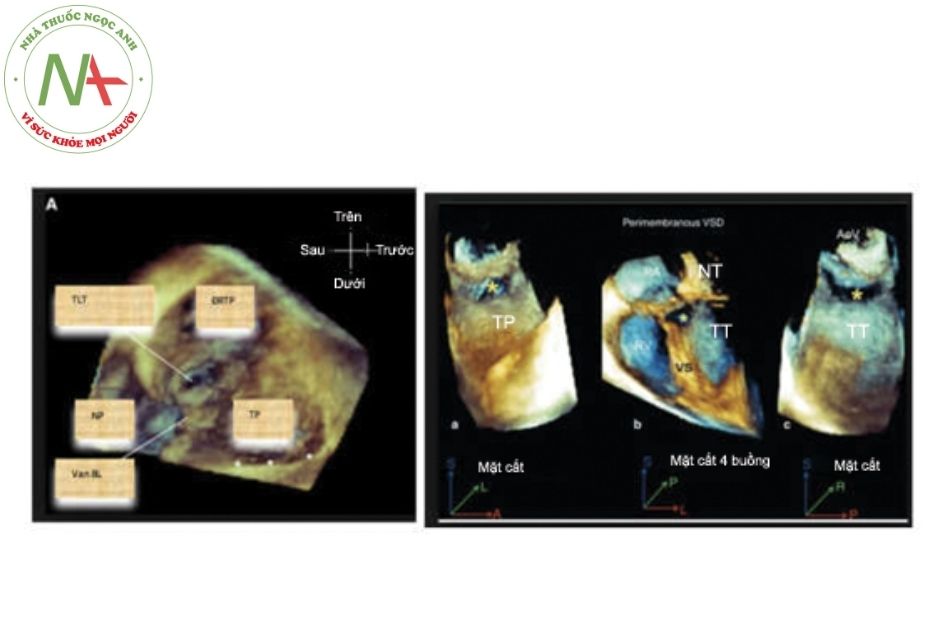
Chú thích: NP: Nhĩ phải; TP: Thất phải; TT: Thất trái; ĐMC: Động mạch chủ.
Gần đây, vai trò của siêu âm tim 3D trong hướng dẫn can thiệp cũng được nhấn mạnh do siêu âm 3D giúp đánh giá chính xác hơn kích thước lỗ thông cũng như kích thước các gờ quan trọng (Hình 15.10).
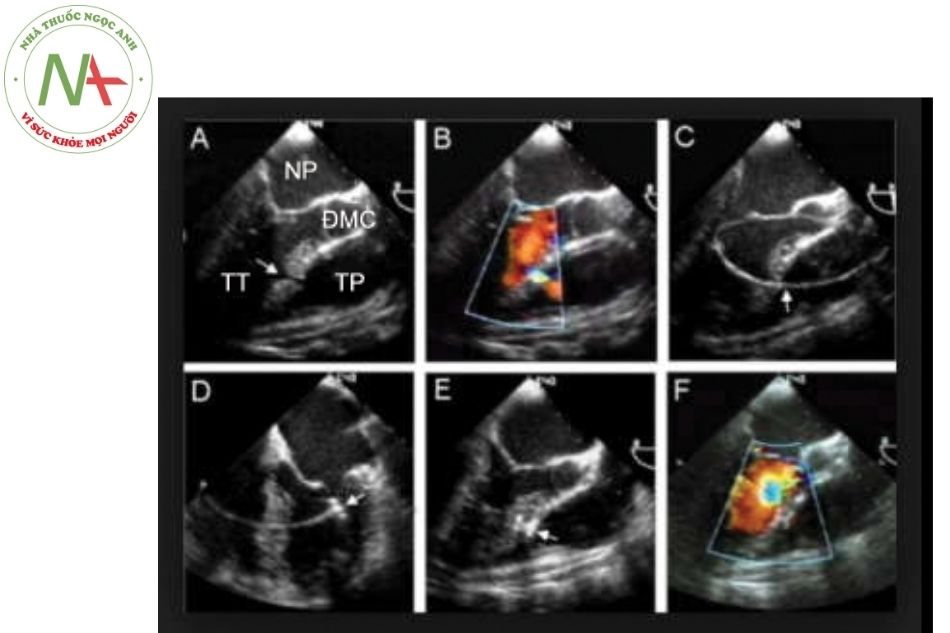
Chú thích: ĐMP: Động mạch phổi; ĐMC: Động mạch chủ; TLT: Thông liên thất; NT: Nhĩ trái; TT: Thất trái.
Nghiệm pháp gắng sức
Chỉ định: bệnh nhân TLT nghi ngờ có triệu chứng cơ năng. Đôi khi các triệu chứng ở các bệnh nhân này thường kín đáo và làm chậm chỉ định can thiệp sửa chữa.
Khi kết quả không đạt được 70% chức năng như mong đợi được coi là bất thường.
Hình ảnh cộng hưởng từ tim
Hình ảnh cộng hưởng từ giúp đánh giá chính xác, tin cậy về cấu trúc và chức năng tim. Kỹ thuật này có một số ưu điểm hơn siêu âm tim vì cho phép đánh giá toàn diện hơn các buồng tim và các mạch máu lớn do MRI không bị ảnh hưởng bởi khí, xương hay sẹo phẫu thuật.
Chụp cộng hưởng từ thường chỉ định khi:
- Kỹ thuật chụp cộng hưởng từ với thuốc đối quang từ giúp ta có thể tính toán tỷ lệ Qp/Qs cho kết quả chính xác so với kết quả thông tim huyết động.
- Chụp cộng hưởng từ có thể đánh giá các tổn thương phối hợp như tăng áp mạch máu phổi, tổn thương tĩnh mạch phổi hay động mạch chủ.
- Chụp cộng hưởng từ có thể xác định các tổn thương vùng mỏm.
Chụp cắt lớp vi tính đa dãy (MSCT) tim
Giúp đánh giá các tổn thương ở động mạch phổi, tĩnh mạch chủ hay động mạch chủ và TLT. Ngoài ra, chụp cắt lớp vi tính giúp đánh giá tổn thương động mạch vành. Bất lợi của chụp cắt lớp vi tính là bệnh nhân bị phơi nhiễm với nguồn phóng xạ ion hoá và phải chụp nhiều lần.
Thông tim
Chỉ định
- TLT lớn cần đánh giá tỷ lệ Qp/Qs và áp lực động mạch phổi.
- TLT kết hợp với thất phải hai buồng hoặc hẹp van động mạch phổi khi kích thước luồng thông cũng như mức độ chênh áp đường ra, áp lực động mạch phổi cần được đánh giá chính xác.
- TLT kèm theo tăng áp động mạch phổi: lúc này thông tim để đo áp lực động mạch phổi, chỉ số tim CI, sức cản mạch phổi và sức cản mạch hệ thống cũng như đánh giá các nghiệm pháp oxy, thuốc giãn mạch phổi, và khí NO nhằm xem xét khả năng sửa chữa tổn thương.Các chỉ định khác như đánh giá mức độ hở van động mạch chủ ở bệnh nhân có sa van động mạch chủ, xác định xem TLT có nhiều lỗ hay không trước phẫu thuật, bít lỗ thông liên thất qua da bằng dụng cụ phù hợp, chụp động mạch vành ở bệnh nhân người lớn có nguy cao cần phẫu thuật.
Chẩn đoán phân biệt
Bệnh nhân có TLT lỗ nhỏ, có tiếng thổi toàn tâm thu cần phân biệt với hở van hai lá và hở van ba lá. Tuy nhiên, TLT có thể đi kèm các tổn thương này, đôi khi nghe thấy nhiều hơn một tiếng thổi tâm thu.
Trong tắc nghẽn đường ra thất trái (left ventricular outflow tract obstruction), đôi khi có thể nghe thấy tiếng thổi tâm thu có âm sắc thô, giống với tiếng thổi TLT, nhưng điểm khác biệt là tiếng thổi ở đây là kiểu tống máu và phân biệt với tiếng thổi do TLT bằng các nghiệm pháp như Valsalva, ngồi xổm, nâng chân…
Các tiếng thổi đầu và giữa tâm thu của TLT có tăng áp động mạch phổi nên được phân biệt với các nguyên nhân khác như hẹp van ĐMC hay hẹp van ĐMP.
Các tiếng thổi tâm thu và tâm trương khi bệnh nhân TLT có kèm theo hở van ĐMC đôi khi bị nhầm với tiếng thổi liên tục ở bệnh nhân còn ống động mạch hoặc vỡ phình xoang Valsalva hay do rò động mạch vành (coronary artery fistula) lớn. Siêu âm tim qua thành ngực cũng có thể giúp phân biệt các trường hợp này.
Chẩn đoán xác định
Chẩn đoán xác định bệnh thông liên thất dựa vào một số triệu chứng lâm sàng và cận lâm sàng sau:
Lâm sàng
- Triệu chứng suy tim: khó thở gắng sức, gan to, tiểu ít, phù, nhịp tim nhanh, rale ẩm ở phổi.
- Thổi tâm thu khoang liên sườn 3 đường cạnh ức trái lan xung quanh (có thể khoang liên sườn 4 nếu lỗ thông gần mỏm tim, hoặc khoang liên sườn 2 nếu lỗ thông ở cao dưới hai van đại động mạch).
Thổi tâm trương ổ van động mạch chủ do hở van động mạch chủ trong trường hợp thông liên thất dưới hai đại động mạch.
- Có thể gặp T2 mạnh trong trường hợp có tăng áp động mạch phổi.
- Với trẻ em có thể có các dấu hiệu như: chậm tăng cân, viêm phổi kéo dài thường xuyên.
Cận lâm sàng
- Xquang ngực: phổi mờ do nhiều máu lên phổi, bóng tim to, cung động mạch phổi phồng.
- Điện tâm đồ: tăng gánh thất trái.
- Siêu âm tim: Giúp chẩn đoán xác định. Cần kết hợp nhiều mặt cắt để đánh giá vị trí lỗ thông, kích thước lỗ thông, chiều luồng thông qua lỗ thông, áp lực động mạch phổi, ảnh hưởng của lỗ thông lên các buồng
ĐIỀU TRỊ
Khuyến cáo hội Tim mạch châu u (ESC) 2020 về xử trí thông liên thất
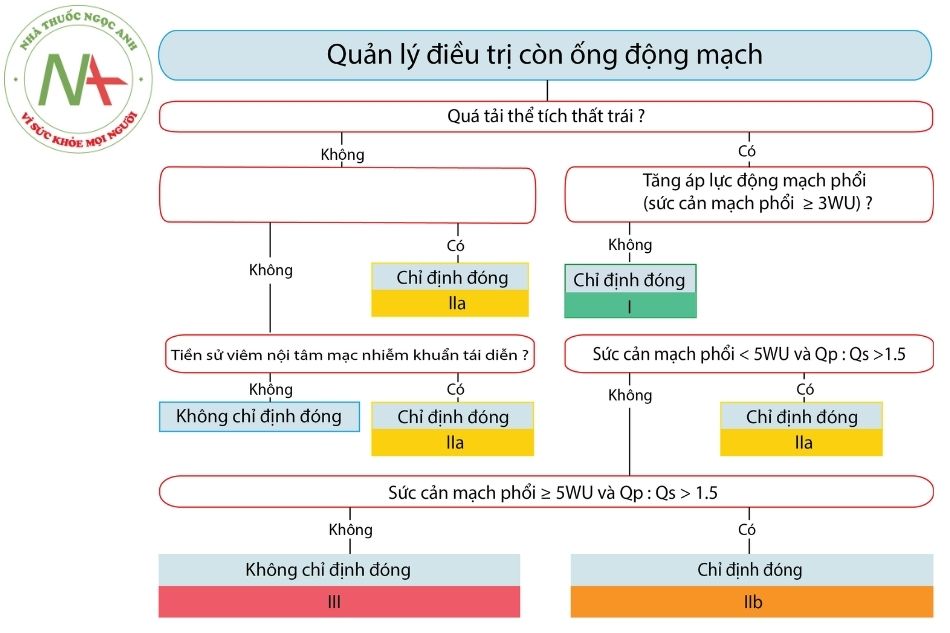
Điều trị nội khoa
- Điều trị suy tim sung huyết bằng thuốc lợi tiểu, ức chế men chuyển/ức chế thụ thể, chẹn beta giao cảm.
- Chế độ chăm sóc, theo dõi: không cần thiết phải hạn chế hoạt động thể lực nếu không có tăng áp động mạch phổi.
Chỉ định đóng lỗ TLT bẩm sinh
Ở trẻ nhỏ
- TLT cần được đóng sớm trong 6 tháng đầu đời nếu trẻ có triệu chứng của suy tim ứ huyết không khống chế được, bội nhiễm phổi tái phát, chậm phát triển thể chất.
- Với những trẻ TLT lớn có thể khống chế được suy tim hoặc không triệu chứng, việc phẫu thuật có thể trì hoãn tới khi trẻ được 2 tuổi.
- Với những trẻ lớn hơn cần tiến hành lượng giá lưu lượng luồng thông trái -> phải, chỉ định đóng lỗ thông khi Qp/Qs ≥ 1,5 và sức cản mạch phổi < 7 đơn vị Wood.
Ở người lớn
Bảng 1. Khuyến cáo ESC 2020 về xử trí thông liên thất ở người trưởng thành
| Khuyến cáo | Loại khuyến cáo | Mức chứng cứ |
| Ở bệnh nhân có bằng chứng của việc quá tải thể tích thất trái và không tăng áp động mạch phổi (không có dấu hiệu tăng áp động mạch phổi trên thăm dò không xâm lấn hoặc thăm dò xâm lấn cho thấy sức cản mạch phổi < 3 WU), đóng lỗ TLT được khuyến cáo bất kể có triệu chứng hay không. | I | C |
| Ở bệnh nhân không có luồng thông trái -> phải có ý nghĩa nhưng có tiền sử viêm nội tâm mạc nhiễm khuẩn nên được cân nhắc đóng lỗ thông. | IIa | C |
| Ở bệnh nhân có thông liên thất dẫn đến sa lá van động mạch chủ gây hở van động mạch chủ, phẫu thuật có thể được cân nhắc. | IIa | C |
| Ở bệnh nhân có tăng áp động mạch phổi với sức cản mạch phổi từ 3-5 WU, việc đóng lỗ TLT có thể được cân nhắc khi luồng thông trái -> phải có ý nghĩa (Qp:Qs > 1,5). | IIa | C |
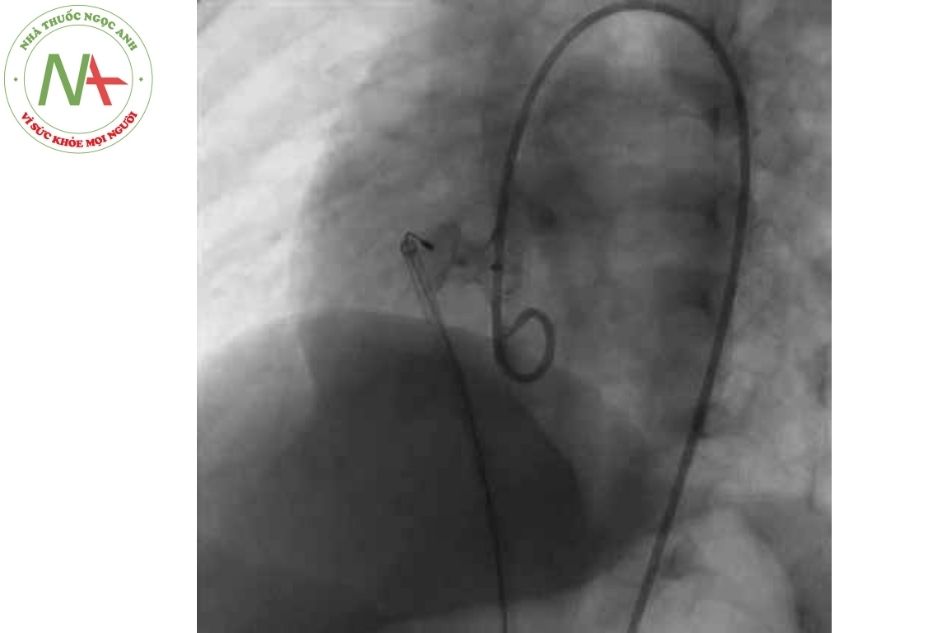
Thông tim can thiệp đóng TLT bằng dụng cụ
- Có thể được xem xét ở những bệnh nhân có nguy cơ phẫu thuật cao, những bệnh nhân đã can thiệp phẫu thuật nhiều lần trước đó hoặc những lỗ thông liên thất có đường mổ khó khăn.
- Những TLT phần cơ bè ở trung tâm có thể được can thiệp đóng lỗ thông bằng dụng cụ tốt hơn phẫu thuật.
- Những TLT phần quanh màng có thể đóng bằng dụng cụ, nhưng có nguy cơ gây block nhĩ thất hoàn toàn và chèn ép vào van ba lá gây hở van ba lá hoặc nguy cơ hở van động mạch chủ nên cần thận trọng.
Phẫu thuật đóng TLT
Kỹ thuật phẫu thuật
Bít lỗ thông trực tiếp dưới điều kiện tim phổi nhân tạo, đường tiếp cận qua tâm nhĩ hay được dùng hơn qua mở tâm thất phải.
- Có thể siết (banding) động mạch phổi trong một số trường hợp có tổn thương phối hợp khiến việc sửa chữa toàn bộ khó khăn.
- Một số trung tâm sử dụng phương pháp được gọi là Hybrid qua đường rạch mở ngực trái và tiến hành đặt thiết bị bít lỗ thông “qua tâm thất” mà không cần tim phổi nhân tạo để bít lỗ TLT phần cơ.
Chỉ định và thời điểm
- Chỉ định: luồng thông trái -> phải đáng kể với Qp/Qs > 2:1 là một chỉ định của phẫu thuật.
- Thời điểm phẫu thuật:
- Trẻ nhũ nhi có suy tim sung huyết và chậm tăng trưởng, không đáp ứng với điều trị nội khoa nên được phẫu thuật ở bất kỳ độ tuổi nào.
- Trẻ nhũ nhi với TLT lỗ thông lớn và có bằng chứng tăng sức cản mạch phổi nên được phẫu thuật càng sớm càng tốt.
- Trẻ nhũ nhi không đáp ứng với điều trị nội khoa có thể được phẫu thuật trong độ tuổi từ 12 đến 18 tháng.
- Trẻ không có triệu chứng có thể được phẫu thuật ở độ tuổi từ 2 đến 4 tuổi.
Chống chỉ định
Tỷ lệ sức cản mạch phổi/sức cản mạch hệ thống (PVR/SVR) bằng 0,5 hoặc lớn hơn hoặc bệnh lý mạch máu phổi tắc nghẽn với luồng thông phải -> trái lớn.
Phương pháp phẫu thuật cho các trường hợp đặc biệt – TLT và còn ống động mạch (COĐM)
- TLT và còn ống động mạch (COĐM)
- Nếu còn ống động mạch lớn, ống đơn thuần có thể đóng trong 6 đến 8 tuần đầu, và TLT có thể được bít sau đó.
- Nếu TLT lớn gây ảnh hưởng huyết động sẽ cần đóng TLT sớm hơn, đồng thời ống động mạch sẽ được thắt vào thời điểm sửa chữa TLT.
- TLT có hẹp eo động mạch chủ: lựa chọn phương pháp phẫu thuật một thì hoặc hai thì tuỳ thuộc vào từng trung tâm tim mạch. Ban đầu chỉ sửa chữa hẹp eo động mạch chủ và sau đó bít TLT nếu có chỉ định. Các phương pháp khác gồm sửa chữa hẹp eo động mạch chủ và phẫu thuật siết bớt động mạch phổi nếu TLT lớn hoặc sửa được cả hai khiếm khuyết cùng lúc, dùng một đến hai đường mổ.
- TLT và hở van động mạch chủ thường liên quan đến TLT phần phễu và TLT phần quanh màng. Khi có hở van động mạch chủ, nên bít lỗ thông ngay lập tức, kể cả khi Qp/Qs < 2, để ngăn hở van động mạch chủ hoặc loại bỏ hở van động mạch chủ. Một số trung tâm bít TLT nếu có bằng chứng sa van động mạch chủ kể cả khi không có hở van động mạch chủ.
THEO DÕI SAU PHẪU THUẬT VÀ CAN THIỆP
Sau phẫu thuật vá thông liên thất
- Tái khám định kỳ: khám lâm sàng, Xquang ngực, điện tâm đồ và siêu âm tim vào các thời điểm 1 tháng, 3 tháng, 6 tháng, 12 tháng sau khi phẫu thuật. Sau đó nếu không có TLT tồn lưu có thể tái khám mỗi 3-5 năm.
- Những trường hợp có suy tim, tăng áp động mạch phổi trước phẫu thuật sẽ tiếp tục điều trị sau phẫu thuật cho tới khi các triệu chứng biến mất.
- TLT tồn lưu cần phẫu thuật lại khi Qp/Qs > 1,5.
- Block nhánh phải có thể gặp ở 50% đến 90% bệnh nhân mổ TLT qua đường mở thất phải và tới 40% bệnh nhân mổ TLT qua đường tâm nhĩ phải.
- Block nhĩ thất thường tạm thời, có khi kéo dài 1-2 tuần, cần sử dụng máy tạo nhịp tạm thời. Những bệnh nhân có block 2 hoặc 3 phân nhánh tạm thời sau phẫu thuật có nguy cơ phát triển thành block nhĩ thất hoàn toàn vài năm sau đó.
- Bệnh nhân với TLT lỗ nhỏ (kể cả TLT tồn lưu) nếu thất trái, áp lực ĐMP bình thường, không triệu chứng và không kèm tổn thương khác, có thể tái khám mỗi 3-5 năm.
Sau bít thông liên thất bằng dụng cụ
- Uống aspirin:
- Ở trẻ em: aspirin liều 3-5 mg/kg/ngày trong 6 tháng đầu.
- Ở người lớn: aspirin liều thấp (75-100 mg/ ngày) trong 6 tháng đầu.
- Tái khám, theo dõi lâm sàng và siêu âm tim định kỳ vào các thời điểm 1 tháng, 3 tháng, 6 tháng, 1 năm sau khi can thiệp. Sau đó tùy thuộc vào kết quả mà có thể tái khám mỗi 2-3 năm.
Tài liệu tham khảo
1.Phạm Nguyễn Vinh, Nguyễn Lân Hiếu và cs. (2012). Khuyến cáo 2010 của Hội tim mạch học Việt Nam về xử trí bệnh tim bẩm sinh ở người lớn. Khuyến cáo 2010 về các bệnh lý tim mạch và chuyển hoá. Nhà xuất bản Y học chi nhánh Hồ Chí Minh, Tp.Hồ Chí Minh, Việt Nam, tr.23-25.
2. Stout K.K. et al (2019). 2018 AHA/ACC Guideline for the Management of Adults With Congenital Heart Disease. JACC 73(12): e81-192.
3. Helmut Baumgartner, Julie De Backer, Sonya V Babu-Narayan et al, ESC Scientific Document Group, 2020 ESC Guidelines for the management of adult congenital heart disease: The Task Force for the management of adult congenital heart disease of the European Society of Cardiology (ESC), European Heart Journal, https:// doi.org/10.1093/eurheartj/ehaa554.
4. Đoàn Đức Dũng. Đánh giá kết quả trung hạn của phương pháp bít thông liên thất bằng coil-pfm hoặc dụng cụ 1 cánh trong bít thông liên thất phần quanh màng. Luận án tiến sĩ y học (2019).
5. Nguyen Lan Hieu, Phan Tan Quang, Dinh Huynh Linh, Tran Ba Hieu, Sharmin, S. et al. (2018). Percutaneous closure of perimembranous ventricular septal defect using patent ductus arteriosus occluders. PLOS ONE, 13(11), e0206535. https://doi.org/10.1371/journal.pone.0206535
6. Nguyen Lan Hieu, Phan Tan Quang, Dinh Huynh Linh, Tran Ba Hieu., Won, H., & Thottian, J. et al. (2018). Nit-Occlud Lê VSD coil versus Duct Occluders for percutaneous perimembranous ventricular septal defect closure. Congenital Heart Disease, 13(4), 584-593. https://doi.org/10.1111/chd.12613.
7. Nguyen Lan Hieu, Phan Tan Quang, Dinh Huynh Linh, Won, H., & Kim, S. (2018). TCTAP A-061 Percutaneous Closure of Perimembranous Ventricular Septal Defects Using Patent Ductus Arteriosus Closure Device: 5-year Follow-Up Prospective Cohort Study. Journal Of The American College Of Cardiology, 71(16), S35. https://doi. org/10.1016/j.jacc.2018.03.116.
8. Phan Tan Quang, Kim S, Nguyen Lan Hieu. (2017). Percutaneous closure of congenital Gerbode defect using Nit-Occlud® Lê VSD coil. World Journal Of Cardiology, 9(7), 634. https://doi.org/10.4330/wjc.v9.i7.634
9. Zhao QM, Niu C, Liu F, et Spontaneous Closure Rates of Ventricular Septal Defects (6,750 Consecutive Neonates). Am J Cardiol 2019; 124:613.
10. Prasad S. Ventricular Septal Defect. In: Diagnosis and Management of Adult Congenital Heart Disease, Gatzoulis MA WG, Daubeney PEF (Eds), Churchill Livingstone, Philadelphia 2003. 171.
11. Saxena A., et al. (2019). Indian guidelines for indications and timing of intervention for common con- genital heart diseases: Revised and updated consensus statement of the Working group on management of congenital heart diseases. Ann Pediatr Card;12:254‐286.
12. Perloff JK. Ventricular Septal Defect. In: The Clinical Recognition of Congenital Heart Disease, 6th ed, B. Saunders Company, Philadelphia 2012. p.396.
13. Nishath Quader., et al. (2017). Ventricular septal defect, The Washington Manual of Echocardiography, second edition, Wolters Kluwer, Philadelphia, 321-322.

