Bệnh thần kinh
Quản lý dịch ở bệnh nhân trải qua phẫu thuật thần kinh
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
nhathuocngocanh.com – Để tải file PDF của bài viết Quản lý dịch ở bệnh nhân trải qua phẫu thuật thần kinh xin vui lòng click vào link ở đây.
Tác giả: Taeha Ryu
Dịch bài: BS. Đặng Thanh Tuấn – BV Nhi Đồng 1
Tóm tắt
Quản lý dịch là một thành phần quan trọng của chăm sóc chu phẫu cho bệnh nhân trải qua phẫu thuật thần kinh. Mục tiêu chính của quản lý dịch trong phẫu thuật thần kinh là duy trì tình trạng đẳng thể tích và ngăn ngừa giảm áp suất thẩm thấu huyết thanh. Để duy trì tình trạng đẳng thể tích, điều quan trọng là phải truyền dịch với lượng thích hợp theo các phương pháp thích hợp, và để ngăn ngừa giảm áp suất thẩm thấu huyết thanh, việc lựa chọn dịch là điều cần thiết. Có nhiều tranh luận về sự lựa chọn và lượng dịch tối ưu được truyền trong giai đoạn chu phẫu. Tuy nhiên, có rất ít nghiên cứu lâm sàng chất lượng cao về liệu pháp truyền dịch cho bệnh nhân phẫu thuật thần kinh. Tổng quan này sẽ thảo luận về sự lựa chọn và lượng dịch tối ưu ở bệnh nhân phẫu thuật thần kinh dựa trên các tài liệu, các vấn đề gần đây và thực hành quản lý dịch sau phẫu thuật.
Giới thiệu
Quản lý dịch là một phần của chăm sóc cơ bản trong nhiều tình huống lâm sàng. Điều trị bằng dịch chu phẫu ở những bệnh nhân trải qua phẫu thuật thần kinh là một thành phần quan trọng của thực hành gây mê và chăm sóc quan trọng. Ngày càng có nhiều bằng chứng cho thấy liệu pháp truyền dịch trong phẫu thuật có thể ảnh hưởng đến kết quả sau phẫu thuật [1–3].
Mục đích chính của quản lý dịch trong gây mê phẫu thuật thần kinh là ngăn ngừa tổn thương não do tưới máu não không đủ và cung cấp một môi trường phẫu thuật tốt. Vì vậy, việc duy trì ổn định huyết động và áp lực tưới máu não thích hợp trong quá trình phẫu thuật thần kinh là vô cùng cần thiết.
Các thay đổi huyết động và mất cân bằng điện giải thường xảy ra trong phẫu thuật thần kinh do thường xuyên sử dụng thuốc lợi tiểu để làm giảm áp lực não nội sọ và phù nề. Ngoài ra, tùy thuộc vào loại phẫu thuật, có thể cần phải truyền một lượng lớn dịch để điều chỉnh tình trạng giảm thể tích tuần hoàn chu phẫu và huyết động không ổn định quanh phẫu thuật, và ngăn ngừa co thắt mạch não.
Một cuộc tranh luận rộng rãi về sự lựa chọn và liều lượng dịch tối ưu để ổn định huyết động và cải thiện kết quả còn tồn tại.
Tổng quan này nhằm hỗ trợ các ứng dụng lâm sàng và nghiên cứu về liệu pháp dịch trong phẫu thuật thần kinh bằng cách xem xét các vấn đề và tài liệu gần đây về liệu pháp dịch quanh phẫu thuật trong các lĩnh vực phẫu thuật khác nhau, bao gồm cả phẫu thuật thần kinh.
Lựa chọn dịch ở các bệnh nhân phẫu thuật thần kinh
Nguyên tắc chung của liệu pháp truyền dịch trong phẫu thuật thần kinh là duy trì lượng máu bình thường và ngăn chặn sự giảm độ thẩm thấu huyết tương. Trong hàng rào máu não bình thường (blood-brain barrier – BBB), sự di chuyển của nước giữa huyết tương và não chủ yếu bị ảnh hưởng bởi gradient thẩm thấu. Vì vậy, trong phẫu thuật thần kinh, độ thẩm thấu của dịch là yếu tố quan trọng nhất để ngăn ngừa phù não.
Dịch tinh thể chứa các chất phân tử nhỏ mà không có chất cao phân tử, và nó được phân loại là nhược trương, đẳng trương hoặc ưu trương tùy theo áp suất thẩm thấu của nó. Dung dịch Lactated Ringer (LR), một dung dịch tinh thể thường được sử dụng, nó nhược trương ở 273 mOsm/L. Độ thẩm thấu huyết tương thấp có thể gây phù não. Do đó, các dung dịch nhược trương, chẳng hạn như LR, được tránh sử dụng, trong khi nước muối sinh lý (normal saline – NS)
theo truyền thống được sử dụng làm dịch chính ở bệnh nhân phẫu thuật thần kinh [4].
Vì việc giảm áp suất keo mà không làm thay đổi áp suất thẩm thấu làm tăng phù não ở các mô hình động vật bị chấn thương não [5], các dung dịch keo đã được biết đến để ngăn chặn việc giảm nghiêm trọng áp suất keo khi được sử dụng một cách thích hợp. Tuy nhiên, lực lượng đặc nhiệm của Hiệp hội Y học Chăm sóc Chuyên sâu Châu Âu (ESICM) đã khuyến cáo không nên sử dụng dung dịch keo ở bệnh nhân chấn thương não [6], tiếp tục tranh luận về việc sử dụng dung dịch keo trong phẫu thuật thần kinh.
Các dung dịch tinh thể
Các dung dịch nhược trương, chẳng hạn như dung dịch LR, được tránh dùng cho bệnh nhân phẫu thuật thần kinh để giảm thiểu tích tụ dịch não. Ngược lại, NS, một dung dịch tinh thể đẳng trương, đã được sử dụng rộng rãi trong phẫu thuật thần kinh vì nó được cho là làm giảm nguy cơ phù não [7]. Tuy nhiên, vì NS có lượng natri và clorua bằng nhau (154 mEq/L), nhiễm toan chuyển hóa tăng clo huyết xảy ra khi dùng một lượng lớn NS vì nồng độ clorua của nó cao hơn nồng độ clorua huyết tương bình thường (96– 106 mEq/L) .
Nhiều phòng thí nghiệm và nghiên cứu lâm sàng đã báo cáo mối liên quan phụ thuộc vào liều lượng giữa tăng clo huyết và việc sử dụng NS [8–10]. Nhiễm toan tăng clo huyết có liên quan đến chấn thương thận cấp tính (AKI) trong khi phẫu thuật bụng [9]. Trong một nghiên cứu hồi cứu lớn, phù hợp với xu hướng trên 22.851 bệnh nhân trải qua phẫu thuật không do tim, tăng clo huyết sau phẫu thuật dẫn đến nhiễm toan chuyển hóa cấp tính, dẫn đến tăng tỷ lệ tử vong và thời gian nằm viện trong 30 ngày [10]. Một nghiên cứu hồi cứu lớn về phẫu thuật bụng cho thấy bệnh nhân được điều trị bằng dung dịch tinh thể cân bằng có kết quả tốt hơn, bao gồm tử vong, nhiễm trùng sau phẫu thuật, cần điều trị thay thế thận (RRT), cần truyền máu, mất cân bằng điện giải và nhiễm toan so với những bệnh nhân được điều trị bằng NS [9].
Trong khi đó, các kết quả bất lợi của NS không được quan sát thấy trong một nghiên cứu đối chứng ngẫu nhiên trên bệnh nhân bị bệnh nặng [11,12], bệnh nhân không bị bệnh nặng [13] và bệnh nhân sau phẫu thuật đã trải qua phẫu thuật thần kinh [14]. Trong một phân tích tổng hợp gần đây, dung dịch tinh thể cân bằng có lợi trong việc làm giảm đáng kể tình trạng tăng clo huyết sau phẫu thuật và nhiễm toan chuyển hóa, nhưng bằng chứng không đủ để so sánh tác động của tinh thể có đệm và không đệm đối với tỷ lệ tử vong và suy các cơ quan [15].
Ngược lại, các dung dịch muối cân bằng (balanced salt solution – BSS) thay thế các ion clorua bằng lactat, axetat và gluconat, giúp ngăn ngừa sự xuất hiện của nhiễm toan chuyển hóa tăng clo huyết [16]. BSS là lựa chọn phổ biến nhất của dịch hồi sức trong thực hành lâm sàng [17]. Ở những bệnh nhân đã trải qua phẫu thuật cắt sọ, nhóm NS có nồng độ natri và clorua cao hơn và có nhiều bệnh nhân bị nhiễm toan rõ rệt hơn so với nhóm BSS [18].
Tuy nhiên, mặc dù LR là một dung dịch tinh thể cân bằng, nó có tính nhược trương. Áp suất thẩm thấu huyết tương giảm 1 mOsm/L dẫn đến tăng 19 mmHg áp suất của dịch di chuyển qua BBB và giảm 3% áp suất thẩm thấu huyết tương dẫn đến phù não với tăng 3% thể tích não. và giảm 30% thể tích máu não tủy nội sọ [16,19]. Hồi sức trước khi vào bệnh viện với LR so với NS có liên quan đến việc tăng tỷ lệ tử vong ở bệnh nhân chấn thương sọ não (TBI) [20]. Do đó, LR không thích hợp cho bệnh nhân phẫu thuật thần kinh. Thay vào đó, BSS đẳng trương, không bao gồm các dung dịch nhược trương, chẳng hạn như LR, đã nổi lên như một dịch được lựa chọn cho những bệnh nhân trải qua phẫu thuật thần kinh [21].
Dung dịch cân bằng đẳng trương làm giảm tỷ lệ nhiễm toan chuyển hóa tăng clo máu và mất cân bằng điện giải ở bệnh nhân chấn thương sọ não, nhưng áp lực nội sọ không khác biệt so với NS [22]. Mặc dù một dung dịch cân bằng có lợi ích rõ ràng là giảm nhiễm toan chuyển hóa tăng clo huyết, nhưng lợi thế của nó là giảm tỷ lệ mắc bệnh và tử vong thì không rõ ràng và cần được đánh giá.
Dữ liệu chất lượng cao so sánh NS và các dung dịch cân bằng ở bệnh nhân chu phẫu và phẫu thuật thần kinh vẫn chưa có sẵn. Dựa trên các bằng chứng trên, mặc dù bằng chứng vẫn còn thiếu, dung dịch cân bằng đẳng trương được ưu tiên hơn NS ở bệnh nhân phẫu thuật thần kinh vì giảm nguy cơ nhiễm toan chuyển hóa và tổn thương thận.
Dung dịch keo
Các phân tử lớn không hòa tan trong dung dịch keo làm tăng áp lực keo nội mạch. Trên mô hình động vật bị chấn thương sọ não, việc giảm áp suất keo mà không làm thay đổi áp suất thẩm thấu làm tăng phù não [5]. Dung dịch keo thường được sử dụng để giảm phù não và cải thiện huyết động trong phẫu thuật thần kinh [23].
Tinh bột hydroxyetyl (HES)
Một số thử nghiệm ngẫu nhiên đã chỉ ra rằng HES có tác dụng phụ đối với chức năng thận. Ứng dụng lâm sàng thường quy của HES ở bệnh nhân nhiễm trùng huyết nặng trong nghiên cứu VISEP có liên quan đến tỷ lệ suy thận cấp và RRT cao hơn Tương tự, hai thử nghiệm lớn so sánh dung dịch keo và dung dịch tinh thể ở bệnh nhân nhiễm trùng huyết nặng, thử nghiệm 6S và thử nghiệm CHEST [26], cho thấy tỷ lệ AKI và nhu cầu RRT tăng lên.
Ngược lại, không có sự khác biệt về tỷ lệ suy thận và tỷ lệ tử vong giữa nước muối và HES 130/0,4 ở bệnh nhân nhiễm trùng huyết nặng trong thử nghiệm CRYSTMAS [27]. Tương tự như vậy, nghiên cứu CRISTAL, một thử nghiệm ngẫu nhiên, lớn, [28], so sánh tác động của dung dịch keo và dung dịch tinh thể ở những bệnh nhân bị bệnh nặng với giảm thể tích tuần hoàn và không tìm thấy sự khác biệt đáng kể về tỷ lệ tử vong và nhu cầu RRT trong 28 ngày.
Do các kết quả mâu thuẫn nhau, một tổng quan hệ thống và phân tích tổng hợp bao gồm các thử nghiệm trên đã kết luận rằng HES làm tăng đáng kể nguy cơ tử vong và AKI ở những bệnh nhân bị bệnh nặng [29]. Lực lượng đặc nhiệm ESICM về điều trị thể tích dung dịch keo ở những bệnh nhân bị bệnh nặng đã khuyến cáo không nên sử dụng HES 130 6% ở những bệnh nhân bị nhiễm trùng huyết nặng hoặc có nguy cơ bị AKI. Họ cũng khuyến cáo không sử dụng dung dịch keo ở những bệnh nhân bị chấn thương đầu [6]. Dựa trên bằng chứng tích lũy, Cơ quan Thuốc Châu Âu đã hạn chế việc sử dụng HES ở những bệnh nhân bị bệnh nặng, và Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ đã thêm một cảnh báo hộp đen. Một phân tích tổng hợp gần đây so sánh dung dịch keo và dung dịch tinh thể để hồi sức dịch ở những bệnh nhân nặng cho thấy tỷ lệ tử vong ít hoặc không có sự khác biệt với bằng chứng chắc chắn trung bình, mặc dù tinh bột làm tăng nhẹ nhu cầu truyền máu và
RRT [30]. Tuy nhiên, sự không đồng nhất của các giao thức và kết quả trong nghiên cứu nói trên tiếp tục gây ra tranh cãi về các khuyến nghị về hạn chế HES.
Có một số bằng chứng phản đối về việc hạn chế sử dụng HES ở bệnh nhân phẫu thuật thần kinh.
Một số mô hình động vật và các nghiên cứu trong ống nghiệm đã cho thấy tác dụng bảo vệ của HES trên BBB [31–33]. Hai thử nghiệm đối chứng ngẫu nhiên ban đầu so sánh HES với dung dịch tinh thể ở bệnh nhân đột quỵ do thiếu máu cục bộ cho thấy không có sự khác biệt về độ an toàn, hiệu quả huyết động và tỷ lệ biến chứng [34,35].
HES đôi khi được sử dụng để duy trì trạng thái thể tích tối ưu nhằm ngăn ngừa thiếu máu não chậm (DCI) do co thắt mạch não sau xuất huyết dưới nhện (SAH) như một thành phần của liệu pháp ba H. So với nhóm điều trị tiêu chuẩn, liệu pháp truyền dịch hướng đến mục tiêu (GDFT) với nhóm HES bolus cho thấy tần suất co thắt mạch và biến chứng tim phổi giảm [36]. Một nghiên cứu hồi cứu gần đây đã so sánh những bệnh nhân SAH nhận HES với những bệnh nhân được điều trị bằng dung dịch tinh thể và không tìm thấy sự khác biệt đáng kể trong RRT [37]. Một nghiên cứu hồi cứu khác cho thấy không có mối tương quan thuận giữa liều tích lũy của HES và creatinin huyết thanh ở những bệnh nhân SAH có chức năng thận bình thường và kết luận rằng việc sử dụng HES 6% 130/0,4 là an toàn ở những bệnh nhân SAH không có suy thận từ trước. Tuy nhiên, cần thận trọng trong thời gian sử dụng lặp đi lặp lại phương tiện cản quang [38]. Đáng chú ý là tỷ lệ mắc AKI không tăng mặc dù lượng HES đáng kể được sử dụng trong các thử nghiệm trên.
Tuy nhiên, vẫn chưa có bằng chứng về tính ưu việt của việc sử dụng HES ở bệnh nhân phẫu thuật thần kinh. Cần xem xét các tác dụng tiêu cực có thể xảy ra, chẳng hạn như chấn thương thận và rối loạn đông máu, và nên sử dụng HES một cách thận trọng cho bệnh nhân phẫu thuật thần kinh, phù hợp với nguyên tắc không gây hại.
Albumin
Trong các nghiên cứu trên động vật, liệu pháp albumin nồng độ cao đã cải thiện lưu lượng máu não cục bộ (CBF), giảm kích thước nhồi máu và phù não, và cải thiện chức năng thần kinh [39– 41]. Trong một nghiên cứu hồi cứu về bệnh nhân SAH, tỷ lệ bệnh nhân có kết cục tốt sau 3 tháng ở nhóm dùng albumin cao hơn so với nhóm không dùng albumin, mặc dù không có sự khác biệt đáng kể về tỷ lệ co thắt mạch có triệu chứng [42].
Tuy nhiên, thử nghiệm SAFE, một thử nghiệm mù đôi, ngẫu nhiên, đa trung tâm, so sánh 4% albumin và NS ở những bệnh nhân bị bệnh nặng và không cho thấy sự khác biệt đáng kể về kết quả, chẳng hạn như tỷ lệ tử vong, tỷ lệ suy cơ quan, thời gian nằm trong đơn vị chăm sóc đặc biệt ( ICU) thời gian lưu trú, thời gian nằm viện, thời gian thở máy và thời gian RRT [43]. Tuy nhiên, trong phân tích phân nhóm, nguy cơ tử vong tương đối (RR) của bệnh nhân chấn thương ở nhóm dùng albumin so với nhóm nước muối (RR = 1,36) cao hơn ở nhóm bệnh nhân không bị chấn thương (RR = 0,96). Sự khác biệt này trong RR tử vong là do nhiều bệnh nhân chấn thương não được chỉ định cho nhóm dùng albumin hơn là nhóm nước muối.
Một phân tích hậu kỳ của một nhóm bệnh nhân mắc bệnh TBI trong thử nghiệm SAFE, nghiên cứu SAFE-TBI, cho thấy tỷ lệ tử vong trong 2 năm của bệnh nhân chấn thương não nặng ở nhóm dùng albumin cao hơn đáng kể so với nhóm nước muối [44]. Một phân tích theo dõi hậu kỳ về TBI nặng cho thấy rằng tăng áp lực nội sọ có thể góp phần vào tỷ lệ tử vong cao ở nhóm dùng albumin [7]. Kết quả của thử nghiệm SAFE và phân tích hậu kỳ tiếp tục ảnh hưởng đến việc sử dụng albumin ở bệnh nhân TBI [45].
Tuy nhiên, những kết quả này cần được xem xét một cách thận trọng. Thử nghiệm SAFE- TBI có những hạn chế riêng trong phân tích phân nhóm hậu kỳ. Tỷ lệ tử vong của bệnh nhân TBI không phải là tiêu chí chính của thử nghiệm SAFE, và thiết kế thử nghiệm không phải là ngẫu nhiên để phân tích TBI. Hơn nữa, albumin người 4% được sử dụng trong nghiên cứu SAFE là một dung dịch giảm thẩm thấu có thể có khả năng làm tăng áp lực nội sọ và gây phù não [46].
Các mô hình SAH thực nghiệm trên động vật đã chứng minh tác dụng có lợi của albumin [39,47,48], và đã có một số bằng chứng về tác dụng có lợi của albumin ở bệnh nhân SAH [49,50].
Thử nghiệm ALISAH [49], được thiết kế để xác định tính khả thi và an toàn của việc sử dụng albumin ở bệnh nhân SAH, đã bị chấm dứt do hai biến chứng nghiêm trọng của phù phổi đã được báo cáo. Những bệnh nhân nhận được 1,25 g/kg/ngày của 25% albumin trong 7 ngày cho thấy kết quả thần kinh tốt hơn so với những người dùng liều thấp hơn. Phân tích tiếp theo của thử nghiệm ALISAH cho thấy liều lượng albumin cao hơn có liên quan đến tỷ lệ co thắt mạch, DCI và nhồi máu não thấp hơn [50]. Tuy nhiên, những kết quả này nên được diễn giải một cách thận trọng. Thử nghiệm cho biết có kích thước mẫu không đủ và không đủ công suất vì nó không được thiết kế để nghiên cứu tác dụng có lợi của albumin.
Thử nghiệm thử nghiệm ALIAS cho thấy liệu pháp albumin liều cao có tiềm năng bảo vệ thần kinh sau đột quỵ do thiếu máu cục bộ [51]. Tuy nhiên, thử nghiệm ALIAS phần 1 đã bị đình chỉ sau khi phân tích an toàn cho thấy tỷ lệ phù phổi và tỷ lệ tử vong tăng lên [52]. Thử nghiệm ALIAS phần 2, được sửa đổi bằng cách bổ sung các tiêu chí loại trừ và các biện pháp an toàn, cũng bị đình chỉ vì tỷ lệ phù phổi cao ở nhóm dùng albumin [53]. Phân tích tổng hợp dữ liệu từ thử nghiệm ALIAS phần 1 và 2 cho thấy không có sự khác biệt về kết quả thần kinh 90 ngày và tỷ lệ tử vong giữa nhóm 25% albumin và nhóm nước muối. Tuy nhiên, có sự gia tăng nguy cơ phù phổi và xuất huyết trong não ở những bệnh nhân dùng albumin 25% với liều 2 g/kg [54]. Dựa trên bằng chứng này, ESICM khuyến cáo không nên sử dụng albumin liều cao ở bệnh nhân đột quỵ do thiếu máu cục bộ cấp tính và sử dụng albumin liều thấp (4%) hoặc cao (20–25%) ở bệnh nhân chăm sóc thần kinh [55] .
Mặc dù vẫn tồn tại những tranh cãi dựa trên những bằng chứng trên, việc sử dụng albumin trong giai đoạn chu phẫu của phẫu thuật thần kinh vẫn còn nhiều nghi vấn. Các rủi ro tiềm ẩn và lợi ích của việc sử dụng albumin nên được đánh giá theo từng trường hợp cụ thể.
Làm thế nào để dùng một lượng tối ưu dịch truyền ở bệnh nhân phẫu thuật thần kinh
Mục tiêu chính của quản lý dịch chu phẫu trong phẫu thuật thần kinh là duy trì sự ổn định huyết động và một lượng CBF đầy đủ. Ngày càng có nhiều bằng chứng cho thấy liệu pháp truyền dịch trong phẫu thuật ảnh hưởng đến kết quả sau phẫu thuật [1–3].
Liệu pháp dịch hạn chế so với liệu pháp dịch tự do trong các ca phẫu thuật lớn
Các phác đồ truyền dịch trong phẫu thuật, bao gồm mất nước chu phẫu, mất khoang thứ ba và mất nước không nhận biết, có xu hướng tạo ra sự cân bằng dịch dương tính có liên quan đến các biến chứng sau phẫu thuật [1].
Trong thập kỷ gần đây, một số nghiên cứu ngẫu nhiên có đối chứng đã so sánh liệu pháp truyền dịch hạn chế với liệu pháp truyền dịch tự do ở những bệnh nhân trải qua các cuộc phẫu thuật lớn ở bụng. Brandstrup và cộng sự [2] cho thấy bệnh nhân trong nhóm tự do tăng trọng lượng cơ thể và có nhiều biến chứng hơn nhóm hạn chế.
Sau thử nghiệm này, nhiều nghiên cứu về phẫu thuật bụng cho kết quả khả quan đối với liệu pháp hạn chế dịch, dẫn đến việc chuyển dần sang xu hướng sử dụng hạn chế dịch trong phẫu thuật với khái niệm cân bằng zero. Tuy nhiên, trong hai nghiên cứu quan sát lớn, khái niệm cân bằng zero đã được quan tâm do khả năng xảy ra các kết quả tồi tệ hơn, bao gồm cả AKI liên quan đến hạn chế quá mức [56,57].
Gần đây, thử nghiệm RELIEF đã so sánh liệu pháp truyền dịch hạn chế trong khi duy trì cân bằng zero chu phẫu với liệu pháp truyền dịch tự do [3]. Kết quả cho thấy những bệnh nhân trong nhóm hạn chế có tỷ lệ nhiễm trùng vết mổ gia tăng và nguy cơ mắc AKI cao.
Dựa trên bằng chứng gần đây này, kết quả chu phẫu tồi tệ hơn đã được quan sát thấy ở những bệnh nhân bị mất nước và hạn chế quá nhiều dịch. Do đó, tối ưu hóa dịch là điều cần thiết để quản lý dịch chu phẫu. Cũng cần lưu ý rằng lượng thể tích được sử dụng trong các liệu pháp thể tích tự do và hạn chế là không nhất quán và hơi khác nhau đối với mỗi nghiên cứu [58]. Đặc biệt, sự tăng cân sau phẫu thuật của nhóm hạn chế trong một nghiên cứu trước đó của Brandstrup et al. [2] được so sánh với nhóm tự do của nghiên cứu RELIEF [3]. Do đó, hạn chế quá mức có thể dẫn đến kết quả tồi tệ hơn, chẳng hạn như AKI.
GDFT dựa trên các thông số động
Để đạt được trạng thái thể tích dịch tối ưu, điều cần thiết là tránh mất nước quá mức và hạn chế quá mức và phát triển các chế độ dịch tối ưu hóa riêng bằng cách sử dụng các thông số khách quan. Các thông số mục tiêu này nên được xác định mục tiêu chu phẫu và đo lường chu phẫu.
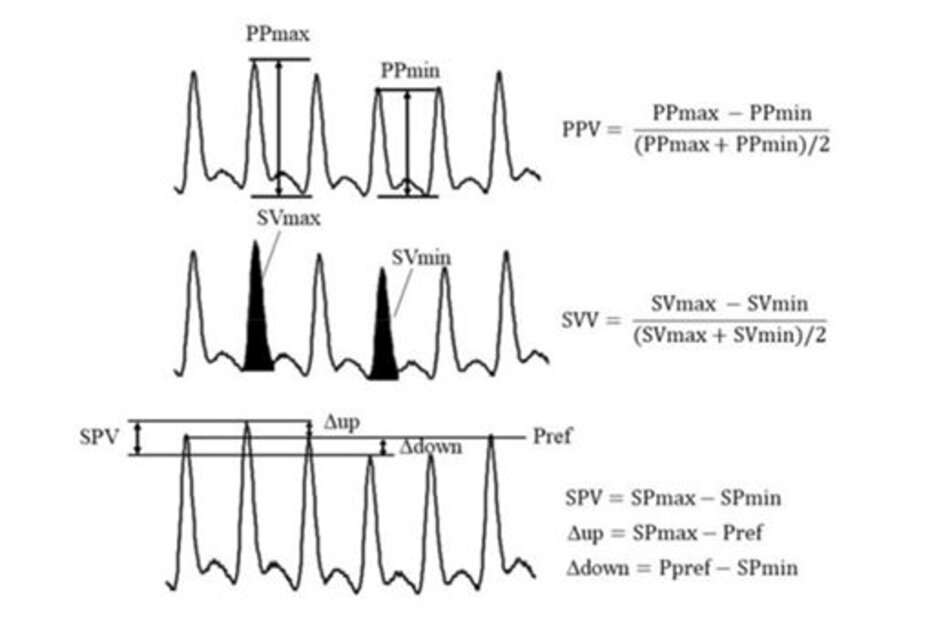
Các thông số động lực học bắt nguồn từ sóng áp lực động mạch. Thông khí cơ học tạo ra những thay đổi định kỳ trong dạng sóng động mạch. Các thông số khác nhau có được từ sự thay đổi định kỳ này. Áp suất mạch (PP) là hiệu số giữa áp suất tâm thu và huyết áp tâm trương. Diện tích dưới đường cong của sóng áp lực động mạch đại diện cho thể tích nhát bóp (SV). Biến thiên áp suất tâm thu (SPV) là hiệu số giữa áp suất tâm thu tối đa và tối thiểu. SPV bao gồm hai thành phần, delta lên (Δup) và delta xuống (Δdown), bằng áp suất tham chiếu (Pref). Pref là áp suất tâm thu được đo khi kết thúc quá trình thở ra hoặc khi ngừng thở. PPV: biến thiên áp suất mạch, SVV: biến thiên thể tích nhát bóp.
Liệu pháp truyền dịch hướng theo mục tiêu (Goal-directed fluid therapy – GDFT), một chế độ truyền dịch mới xuất hiện gần đây, là một loại truyền dịch nhằm tối ưu hóa các mục tiêu được xác định trước dựa trên các thông số huyết động được đo trực tiếp (Hình 1), chẳng hạn như cung lượng tim, thể tích nhát bóp (SV), biến đổi thể tích nhát bóp (SVV) , biến thiên áp lực mạch (PPV), biến thiên áp suất tâm thu (SPV), chỉ số biến thiên độ nẩy (PVI), và các yếu tố khác [1].
Kết quả thuận lợi và giảm chi phí đã được chứng minh cho những bệnh nhân trải qua GDFT trong một cuộc phẫu thuật lớn ở bụng [59-61]. Mặc dù độ chắc chắn của bằng chứng là rất thấp, một phân tích tổng hợp so sánh GDFT và liệu pháp truyền dịch hạn chế trong các ca phẫu thuật lớn không liên quan đến tim cho thấy tỷ lệ tử vong hơi thấp ở nhóm GDFT và không có sự khác biệt giữa hai nhóm về biến chứng. tỷ lệ và thời gian nằm viện [1]. Không giống như các nghiên cứu khác, bao gồm cả phân tích tổng hợp này, một nghiên cứu [62] phát hiện ra rằng tổng thể tích truyền ở nhóm hạn chế (truyền dung dịch tinh thể cơ bản nằm trong khoảng từ 4 đến 10 ml/kg/h) so với nhóm GDFT. Một hạn chế của phân tích tổng hợp này là thiếu định nghĩa về liệu pháp hạn chế truyền dịch. GDFT bao gồm một dịch truyền cơ bản nhất định và lặp lại nhiều lần các dịch (thường là dung dịch keo) để đạt được mục tiêu được xác định trước. Tốc độ truyền cơ bản đặc biệt quan trọng để so sánh GDFT với các phác đồ truyền dịch khác.
GDFT trong phẫu thuật thần kinh
Trong hai nghiên cứu hồi cứu bệnh nhân SAH, cân bằng dịch ròng dương tính có liên quan độc lập với kết quả kém [63,64]. Tuy nhiên, vì khó có thể so sánh các liệu pháp điều trị bằng dịch hạn chế và tự do ở những bệnh nhân phẫu thuật thần
kinh phải duy trì thể tích tuần hoàn, các nghiên cứu gần đây về GDFT đã được tiến hành. Đã có một số nghiên cứu để tối ưu hóa việc truyền dịch bằng cách sử dụng các thông số động được đo liên tục, chẳng hạn như SVV, PPV và PVI cho những bệnh nhân trải qua phẫu thuật thần kinh.
SVV là một yếu tố dự báo nhạy cảm về khả năng đáp ứng dịch trước và trong khi phẫu thuật não [65–67]. Sau khi khởi mê và trước khi bắt đầu quy trình phẫu thuật, SVV dự đoán nhạy cảm hơn SVV khi truyền dung dịch LR so với áp lực động mạch trung bình, nhịp tim, cung lượng tim và áp lực tĩnh mạch trung tâm (CVP) ở bệnh nhân phẫu thuật thần kinh [65]. SVV 9,5% được kết luận là ngưỡng tối ưu (độ nhạy: 78,6%, độ đặc hiệu: 93%) để dự đoán SVV tăng > 5% sau khi truyền 100 ml dung dịch keo [66]. Mục tiêu của SVV của GDFT có thể ảnh hưởng đến kết quả lâm sàng cho việc cắt bỏ khối u não trên lều [67]. So sánh hai phác đồ GDFT để cắt bỏ khối u trên lều (với giá trị ngưỡng SVV được đặt ở 10 cho nhóm SVV thấp và 18 cho nhóm SVV cao), nhóm SVV thấp có mức lactate huyết thanh sau phẫu thuật thấp hơn, thời gian lưu lại ICU ngắn hơn và tỷ lệ biến cố thần kinh sau phẫu thuật thấp hơn so với nhóm SVV cao [67]. So sánh nhóm GDFT được quản lý dịch bằng các thông số huyết động bao gồm SVV với nhóm chứng được quản lý dịch theo quyết định điều trị của bác sĩ gây mê, nhóm trước đây có lượng dịch được truyền ít hơn, thời gian lưu lại ICU ngắn hơn, chi phí ICU thấp hơn và mức lactate thấp hơn so với nhóm đối chứng [68].
PPV và PVI cũng đã được báo cáo là những yếu tố dự báo tốt về phản ứng của dịch trong quá trình phẫu thuật não [69–72]. Giữa nhóm CVP, duy trì CVP 5–10 cmH2O và nhóm PPV, duy trì PPV dưới 13%, ở những bệnh nhân trải qua phẫu thuật u não, nhóm sau có huyết động ổn định sau phẫu thuật tốt hơn và nhu cầu dịch sau phẫu thuật ít hơn [69]. GDFT do PPV hướng dẫn trong quá trình cắt bỏ khối u trên lều có quy mô giãn não tương đương, nồng độ lactate huyết thanh thấp, nhiều dịch trong phẫu thuật hơn và lượng nước tiểu cao hơn so với nhóm chăm sóc tiêu chuẩn [70]. Ở vị trí ngồi trong phẫu thuật thần kinh, đo PPV và PVI bằng cảm biến tai dự đoán khả năng đáp ứng dịch tốt, nhưng không thể dự đoán PVI bằng cảm biến ngón tay. Tuy nhiên, PVI được đo bằng cảm biến tai bị giới hạn bởi một tín hiệu không đáng tin cậy ở 26% bệnh nhân [71].
Một nghiên cứu trên trẻ em trải qua phẫu thuật thần kinh cho thấy kết quả khác nhau. So sánh PVI, ΔVpeak (biến thiên hô hấp trong vận tốc đỉnh của dòng máu động mạch chủ), áp lực động mạch, CVP, nhịp tim, đường kính tĩnh mạch chủ dưới, SPV (bao gồm delta lên [Δup] và delta xuống [Δdown]) và PPV ở bệnh nhi trải qua phẫu thuật thần kinh, PVI và ΔVpeak dự đoán tốt phản ứng dịch, nhưng PPV và các thông số tĩnh và động khác được báo cáo là không thể đoán trước được [72].
Xem xét rằng những thay đổi huyết động tương đối phổ biến trong phẫu thuật thần kinh, GDFT, cung cấp tình trạng dịch tối ưu cho từng cá nhân, là một chiến lược quản lý dịch đầy hứa hẹn.
Kết luận
Mặc dù có nhiều nghiên cứu về quản lý dịch chu phẫu, vẫn chưa có đủ bằng chứng để đưa ra kết luận chắc chắn về quản lý dịch ở bệnh nhân phẫu thuật thần kinh.
Mặc dù vẫn còn thiếu bằng chứng, các dung dịch tinh thể cân bằng đẳng trương nên được coi là dịch được lựa chọn đầu tiên, trong khi các dung dịch nhược trương nên tránh. Hơn nữa, các dung dịch keo nên được sử dụng một cách thận trọng, và các rủi ro và lợi ích tiềm ẩn của chúng nên được xem xét.
Để đạt được trạng thái thể tích dịch tối ưu đồng thời tránh tình trạng thừa nước và hạn chế quá mức, cần cân nhắc số lượng và thời gian truyền dịch và nên sử dụng chiến lược dịch phù hợp với từng cá nhân bằng cách sử dụng GDFT dựa trên các thông số dịch động.
References
- Wrzosek A, Jakowicka-Wordliczek J, Zajaczkowska R, Serednicki WT, Jankowski M, Bala MM, et al. Perioperative restrictive versus goal-directed fluid therapy for adults undergoing major non-cardiac Cochrane Database Syst Rev. 2019;12:CD012767. [PMC free article] [PubMed] [Google Scholar]
- Brandstrup B, Tønnesen H, Beier-Holgersen R, Hjortsø E, Ørding H, Lindorff-Larsen K, et al. Danish Study Group on Perioperative Fluid Therapy. Effects of intravenous fluid restriction on postoperative complications: comparison of two perioperative fluid regimens: a randomized assessor-blinded multicenter Ann Surg. 2003;238:641–8. [PMC free article] [PubMed] [Google Scholar]
- Myles PS, Bellomo R, Corcoran T, Forbes A, Peyton P, Story D, et al. Australian and New Zealand College of Anaesthetists Clinical Trials Network and the Australian and New Zealand Intensive Care Society Clinical Trials Group. Restrictive versus liberal fluid therapy for major abdominal surgery. N Engl J Med. 2018;378:2263–74. [PubMed] [Google Scholar]
- Tommasino C, Picozzi Volume and electrolyte management. Best Pract Res Clin Anaesthesiol. 2007;21:497–516. [PubMed] [Google Scholar]
- Drummond JC, Patel PM, Cole DJ, Kelly PJ. The effect of the reduction of colloid oncotic pressure, with and without reduction of osmolality, on post-traumatic cerebral edema. Anesthesiology. 1998;88:993– [PubMed] [Google Scholar]
- Reinhart K, Perner A, Sprung CL, Jaeschke R, Schortgen F, Johan Groeneveld AB, et al. European Society of Intensive Care Medicine. Consensus statement of the ESICM task force on colloid volume therapy in critically ill Intensive Care Med. 2012;38:368–83. [PubMed] [Google Scholar]
- Cooper DJ, Myburgh J, Heritier S, Finfer S, Bellomo R, Billot L, et al. SAFE-TBI Investigators; Australian and New Zealand Intensive Care Society Clinical Trials Group. Albumin resuscitation for traumatic brain injury: is intracranial hypertension the cause of increased mortality? J Neurotrauma. 2013;30:512–8. [PMC free article] [PubMed] [Google Scholar]
- Quilley CP, Lin YS, McGiff Chloride anion concentration as a determinant of renal vascular responsiveness to vasoconstrictor agents. Br J Pharmacola. 1993;108:106–10. [PMC free article] [PubMed] [Google Scholar]
- Shaw AD, Bagshaw SM, Goldstein SL, Scherer LA, Duan M, Schermer CR, et al. Major complications, mortality, and resource utilization after open abdominal surgery: 0.9% saline compared to Plasma-Lyte. Ann 2012;255:821–9. [PubMed] [Google Scholar]
- McCluskey SA, Karkouti K, Wijeysundera D, Minkovich L, Tait G, Beattie WS. Hyperchloremia after noncardiac surgery is independently associated with increased morbidity and mortality: a propensity- matched cohort Anesth Analg. 2013;117:412–21. [PubMed] [Google Scholar]
- Semler MW, Self WH, Wanderer JP, Ehrenfeld JM, Wang L, Byrne DW, et al. SMART Investigators and the Pragmatic Critical Care Research Group. Balanced crystalloids versus saline in critically ill adults. N Engl J Med. 2018;378:829–39. [PMC free article] [PubMed] [Google Scholar]
- Young P, Bailey M, Beasley R, Henderson S, Mackle D, McArthur C, et al. SPLIT Investigators; ANZICS Effect of a buffered crystalloid solution vs saline on acute kidney injury among patients in the intensive care unit: the SPLIT randomized clinical trial. JAMA. 2015;314:1701–10. [PubMed] [Google Scholar]
- Self WH, Semler MW, Wanderer JP, Wang L, Byrne DW, Collins SP, et al. SALT-ED Investigators. Balanced crystalloids versus saline in noncritically ill adults. N Engl J Med. 2018;378:819–28. [PMC free article] [PubMed] [Google Scholar]
- Hassan MH, Hassan WMNW, Zaini RHM, Shukeri WFWM, Abidin HZ, Eu CS. Balanced fluid versus saline-based fluid in post-operative severe traumatic brain injury patients: acid-base and electrolytes Malays J Med Sci. 2017;24:83–93. [PMC free article] [PubMed] [Google Scholar]
- Odor PM, Bampoe S, Dushianthan A, Bennett-Guerrero E, Cro S, Gan TJ, et Perioperative administration of buffered versus non-buffered crystalloid intravenous fluid to improve outcomes following adult surgical procedures: a Cochrane systematic review. Perioper Med (Lond) 2018;7:27. [PMC free article] [PubMed] [Google Scholar]
- Dąbrowski W, Woodcock T, Rzecki Z, Malbrain MLNG. The use of crystalloids in traumatic brain Anaesthesiol Intensive Ther. 2018;50:150–9. [PubMed] [Google Scholar]
- Hammond NE, Taylor C, Finfer S, Machado FR, An Y, Billot L, et Fluid-TRIPS and Fluidos Investigators; George Institute for Global Health, The ANZICS Clinical Trials Group, BRICNet, and the REVA research Network. Patterns of intravenous fluid resuscitation use in adult intensive care patients between 2007 and 2014: an international cross-sectional study. PLoS One. 2017;12:e0176292. [PMC free article] [PubMed] [Google Scholar]
- Hafizah M, Liu CY, Ooi JS. Normal saline versus balanced-salt solution as intravenous fluid therapy during neurosurgery: effects on acid-base balance and electrolytes. J Neurosurg Sci. 2017;61:263–70. [PubMed] [Google Scholar]
- Hladky SB, Barrand MA. Mechanisms of fluid movement into, through and out of the brain: evaluation of the Fluids Barriers CNS. 2014;11:26. [PMC free article] [PubMed] [Google Scholar]
- Rowell SE, Fair KA, Barbosa RR, Watters JM, Bulger EM, Holcomb JB, et al. The impact of pre-hospital administration of lactated Ringer’s solution versus normal saline in patients with traumatic brain injury. J 2016;33:1054–9. [PMC free article] [PubMed] [Google Scholar]
- Carney N, Totten AM, O’Reilly C, Ullman JS, Hawryluk GW, Bell MJ, et Guidelines for the management of severe traumatic brain injury, fourth edition. Neurosurgery. 2017;80:6–15. [PubMed] [Google Scholar]
- Roquilly A, Loutrel O, Cinotti R, Rosenczweig E, Flet L, Mahe PJ, et al. Balanced versus chloride-rich solutions for fluid resuscitation in brain-injured patients: a randomised double-blind pilot study. Crit 2013;17:R77. [PMC free article] [PubMed] [Google Scholar]
- Exo JL, Shellington DK, Bayir H, Vagni VA, Janesco-Feldman K, Ma L, et al. Resuscitation of traumatic brain injury and hemorrhagic shock with polynitroxylated albumin, hextend, hypertonic saline, and lactated Ringer’s: effects on acute hemodynamics, survival, and neuronal death in mice. J Neurotrauma. 2009;26:2403–8. [PMC free article] [PubMed] [Google Scholar]
- Brunkhorst FM, Engel C, Bloos F, Meier-Hellmann A, Ragaller M, Weiler N, et al. German Competence Network Sepsis (SepNet). Intensive insulin therapy and pentastarch resuscitation in severe sepsis. N Engl J 2008;358:125–39. [PubMed] [Google Scholar]
- Perner A, Haase N, Guttormsen AB, Tenhunen J, Klemenzson G, Åneman A, et al. 6S Trial Group; Scandinavian Critical Care Trials Group. Hydroxyethyl starch 130/0.42 versus Ringer’s acetate in severe N Engl J Med. 2012;367:124–34. [PubMed] [Google Scholar]
- Myburgh JA, Finfer S, Bellomo R, Billot L, Cass A, Gattas D, et al. CHEST Investigators; Australian and New Zealand Intensive Care Society Clinical Trials Hydroxyethyl starch or saline for fluid resuscitation in intensive care. N Engl J Med. 2012;367:1901–11. [PubMed] [Google Scholar]
- Guidet B, Martinet O, Boulain T, Philippart F, Poussel JF, Maizel J, et al. Assessment of hemodynamic efficacy and safety of 6% hydroxyethylstarch 130/0.4 vs. 0.9% NaCl fluid replacement in patients with severe sepsis: the CRYSTMAS Crit Care. 2012;16:R94. [PMC free article] [PubMed] [Google Scholar]
- Annane D, Siami S, Jaber S, Martin C, Elatrous S, Declère AD, et al. CRISTAL Investigators. Effects of fluid resuscitation with colloids vs crystalloids on mortality in critically ill patients presenting with hypovolemic shock: the CRISTAL randomized JAMA. 2013;310:1809–17. [PubMed] [Google Scholar]
- Zarychanski R, Abou-Setta AM, Turgeon AF, Houston BL, McIntyre L, Marshall JC, et al. Association of hydroxyethyl starch administration with mortality and acute kidney injury in critically ill patients requiring volume resuscitation: a systematic review and meta-analysis. 2013;309:678–88. [PubMed] [Google Scholar]
- Lewis SR, Pritchard MW, Evans DJ, Butler AR, Alderson P, Smith AF, et al. Colloids versus crystalloids for fluid resuscitation in critically ill people. Cochrane Database Syst Rev. 2018;8:CD000567. [PMC free article] [PubMed] [Google Scholar]
- Gerhartl A, Hahn K, Neuhoff A, Friedl HP, Förster CY, Wunder C, et al. Hydroxyethylstarch (130/0.4) tightens the blood-brain barrier in Brain Res. 2020;1727:146560. [PubMed] [Google Scholar]
- Schick MA, Burek M, Förster CY, Nagai M, Wunder C, Neuhaus W. Hydroxyethylstarch revisited for acute brain injury treatment. Neural Regen Res. 2021;16:1372–6. [PMC free article] [PubMed] [Google Scholar]
- Chi OZ, Lu X, Wei HM, Williams JA, Weiss HR. Hydroxyethyl starch solution attenuates blood-brain barrier disruption caused by intracarotid injection of hyperosmolar mannitol in Anesth Analg. 1996;83:336–41. [PubMed] [Google Scholar]
- Woessner R, Grauer MT, Dieterich HJ, Bepperling F, Baus D, Kahles T, et al. Influence of a long-term, high-dose volume therapy with 6% hydroxyethyl starch 130/0.4 or crystalloid solution on hemodynamics, rheology and hemostasis in patients with acute ischemic stroke. Results of a randomized, placebo-controlled, double-blind Pathophysiol Haemost Thromb. 2003;33:121–6. [PubMed] [Google Scholar]
- Rudolf J; HES in Acute Stroke Study Group. Hydroxyethyl starch for hypervolemic hemodilution in patients with acute ischemic stroke: a randomized, placebo-controlled phase II safety study. Cerebrovasc 2002;14:33–41. [PubMed] [Google Scholar]
- Mutoh T, Kazumata K, Ishikawa T, Terasaka Performance of bedside transpulmonary thermodilution monitoring for goal-directed hemodynamic management after subarachnoid hemorrhage. Stroke. 2009;40:2368–74. [PubMed] [Google Scholar]
- Bercker S, Winkelmann T, Busch T, Laudi S, Lindner D, Meixensberger J. Hydroxyethyl starch for volume expansion after subarachnoid haemorrhage and renal function: results of a retrospective PLoS One. 2018;13:e0192832. [PMC free article] [PubMed] [Google Scholar]
- Kunze E, Stetter C, Willner N, Koehler S, Kilgenstein C, Ernestus RI, et al. Effects of fluid treatment with hydroxyethyl starch on renal function in patients with aneurysmal subarachnoid J Neurosurg Anesthesiol. 2016;28:187–94. [PubMed] [Google Scholar]
- Huh PW, Belayev L, Zhao W, Busto R, Saul I, Ginsberg MD. The effect of high-dose albumin therapy on local cerebral perfusion after transient focal cerebral ischemia in rats. Brain 1998;804:105–13. [PubMed] [Google Scholar]
- Belayev L, Saul I, Huh PW, Finotti N, Zhao W, Busto R, et al. Neuroprotective effect of high-dose albumin therapy against global ischemic brain injury in rats. Brain Res. 1999;845:107–11. [PubMed] [Google Scholar]
- Belayev L, Liu Y, Zhao W, Busto R, Ginsberg MD. Human albumin therapy of acute ischemic stroke: marked neuroprotective efficacy at moderate doses and with a broad therapeutic Stroke. 2001;32:553–60. [PubMed] [Google Scholar]
- Suarez JI, Shannon L, Zaidat OO, Suri MF, Singh G, Lynch G, et Effect of human albumin administration on clinical outcome and hospital cost in patients with subarachnoid hemorrhage. J Neurosurg. 2004;100:585–90. [PubMed] [Google Scholar]
- Finfer S, Bellomo R, Boyce N, French J, Myburgh J, Norton R, SAFE Study Investigators A comparison of albumin and saline for fluid resuscitation in the intensive care unit. N Engl J Med. 2004;350:2247–56. [PubMed] [Google Scholar]
- SAFE Study Investigators. Australian and New Zealand Intensive Care Society Clinical Trials Group. Australian Red Cross Blood George Institute for International Health. Myburgh J, Cooper DJ,
- Finfer S, Bellomo R, Norton R, et al. Saline or albumin for fluid resuscitation in patients with traumatic brain injury. N Engl J Med. 2007;357:874–84. [PubMed] [Google Scholar]
- Huijben JA, Volovici V, Cnossen MC, Haitsma IK, Stocchetti N, Maas AIR, et CENTER-TBI investigators and participants. Variation in general supportive and preventive intensive care management of traumatic brain injury: a survey in 66 neurotrauma centers participating in the Collaborative European NeuroTrauma Effectiveness Research in Traumatic Brain Injury (CENTER-TBI) study. Crit Care. 2018;22:90. [PMC free article] [PubMed] [Google Scholar]
- Van Aken HK, Kampmeier TG, Ertmer C, Westphal M. Fluid resuscitation in patients with traumatic brain injury: what is a SAFE approach? Curr Opin 2012;25:563–5. [PubMed] [Google Scholar]
- Wang L, Li M, Xie Y, Xu L, Ye R, Liu Preclinical efficacy of human albumin in subarachnoid hemorrhage. Neuroscience. 2017;344:255–64. [PubMed] [Google Scholar]
- Belayev L, Pinard E, Nallet H, Seylaz J, Liu Y, Riyamongkol P, et al. Albumin therapy of transient focal cerebral ischemia: in vivo analysis of dynamic microvascular Stroke. 2002;33:1077–84. [PubMed] [Google Scholar]
- Suarez JI, Martin RH, Calvillo E, Dillon C, Bershad EM, Macdonald RL, et al. ALISAH Investigators. The Albumin in Subarachnoid Hemorrhage (ALISAH) multicenter pilot clinical trial: safety and neurologic Stroke. 2012;43:683–90. [PMC free article] [PubMed] [Google Scholar]
- Suarez JI, Martin RH, Calvillo E, Bershad EM, Venkatasubba Rao CP. Effect of human albumin on TCD vasospasm, DCI, and cerebral infarction in subarachnoid hemorrhage: the ALISAH study. Acta Neurochir 2015;120:287–90. [PubMed] [Google Scholar]
- Palesch YY, Hill MD, Ryckborst KJ, Tamariz D, Ginsberg MD. The ALIAS pilot trial: a dose-escalation and safety study of albumin therapy for acute ischemic stroke–II: neurologic outcome and efficacy Stroke. 2006;37:2107–14. [PubMed] [Google Scholar]
- Ginsberg MD, Palesch YY, Martin RH, Hill MD, Moy CS, Waldman BD, et al. ALIAS Investigators. The albumin in acute stroke (ALIAS) multicenter clinical trial: safety analysis of part 1 and rationale and design of part Stroke. 2011;42:119–27. [PMC free article] [PubMed] [Google Scholar]
- Ginsberg MD, Palesch YY, Hill MD, Martin RH, Moy CS, Barsan WG, et al. ALIAS and Neurological Emergencies Treatment Trials (NETT) Investigators. High-dose albumin treatment for acute ischaemic stroke (ALIAS) Part 2: a randomised, double-blind, phase 3, placebo-controlled Lancet Neurol. 2013;12:1049–58. [PMC free article] [PubMed] [Google Scholar]
- Martin RH, Yeatts SD, Hill MD, Moy CS, Ginsberg MD, Palesch YY; ALIAS Parts 1 and 2 and NETT ALIAS (albumin in acute ischemic stroke) trials: analysis of the combined data from parts 1 and 2. Stroke. 2016;47:2355–9. [PMC free article] [PubMed] [Google Scholar]
- Oddo M, Poole D, Helbok R, Meyfroidt G, Stocchetti N, Bouzat P, et al. Fluid therapy in neurointensive care patients: ESICM consensus and clinical practice Intensive Care Med. 2018;44:449–63. [PubMed] [Google Scholar]
- Shin CH, Long DR, McLean D, Grabitz SD, Ladha K, Timm FP, et al. Effects of intraoperative fluid management on postoperative outcomes: a hospital registry Ann Surg. 2018;267:1084–92. [PubMed] [Google Scholar]
- Thacker JK, Mountford WK, Ernst FR, Krukas MR, Mythen Perioperative fluid utilization variability and association with outcomes: considerations for enhanced recovery efforts in sample US surgical populations. Ann Surg. 2016;263:502–10. [PubMed] [Google Scholar]
- Bundgaard-Nielsen M, Secher NH, Kehlet H. ‘Liberal’ vs. ‘restrictive’ perioperative fluid therapy–a critical assessment of the Acta Anaesthesiol Scand. 2009;53:843–51. [PubMed] [Google Scholar]
- Benes J, Giglio M, Brienza N, Michard F. The effects of goal-directed fluid therapy based on dynamic parameters on post-surgical outcome: a meta-analysis of randomized controlled Crit Care. 2014;18:584. [PMC free article] [PubMed] [Google Scholar]
- Corcoran T, Rhodes JE, Clarke S, Myles PS, Ho KM. Perioperative fluid management strategies in major surgery: a stratified meta-analysis. Anesth 2012;114:640–51. [PubMed] [Google Scholar]
- Michard F, Mountford WK, Krukas MR, Ernst FR, Fogel Potential return on investment for implementation of perioperative goal-directed fluid therapy in major surgery: a nationwide database study. Perioper Med (Lond) 2015;4:11. [PMC free article] [PubMed] [Google Scholar]
- Colantonio L, Claroni C, Fabrizi L, Marcelli ME, Sofra M, Giannarelli D, et al. A randomized trial of goal directed standard fluid therapy in cytoreductive surgery with hyperthermic intraperitoneal chemotherapy. J Gastrointest Surg. 2015;19:722–9. [PubMed] [Google Scholar]
- Kissoon NR, Mandrekar JN, Fugate JE, Lanzino G, Wijdicks EF, Rabinstein AA. Positive fluid balance is associated with poor outcomes in subarachnoid hemorrhage. J Stroke Cerebrovasc Dis. 2015;24:2245–51. [PubMed] [Google Scholar]
- Martini RP, Deem S, Brown M, Souter MJ, Yanez ND, Daniel S, et al. The association between fluid balance and outcomes after subarachnoid Neurocrit Care. 2012;17:191–8. [PubMed] [Google Scholar]
- Li J, Ji FH, Yang JP. Evaluation of stroke volume variation obtained by the FloTrac™/Vigileo™ system to guide preoperative fluid therapy in patients undergoing brain surgery. J Int Med Res. 2012;40:1175–81. [PubMed] [Google Scholar]
- Berkenstadt H, Margalit N, Hadani M, Friedman Z, Segal E, Villa Y, et al. Stroke volume variation as a predictor of fluid responsiveness in patients undergoing brain surgery. Anesth Analg. 2001;92:984–9. [PubMed] [Google Scholar]
- Wu CY, Lin YS, Tseng HM, Cheng HL, Lee TS, Lin PL, et al. Comparison of two stroke volume variation- based goal-directed fluid therapies for supratentorial brain tumour resection: a randomized controlled Br J Anaesth. 2017;119:934–42. [PubMed] [Google Scholar]
- Luo J, Xue J, Liu J, Liu B, Liu L, Chen Goal-directed fluid restriction during brain surgery: a prospective randomized controlled trial. Ann Intensive Care. 2017;7:16. [PMC free article] [PubMed] [Google Scholar]
- Sundaram SC, Salins SR, Kumar AN, Korula Intra-operative fluid management in adult neurosurgical patients undergoing intracranial tumour surgery: randomised control trial comparing pulse pressure variance (PPV) and central venous pressure (CVP) J Clin Diagn Res. 2016;10:UC01–5. [PMC free article] [PubMed] [Google Scholar]
- Hasanin A, Zanata T, Osman S, Abdelwahab Y, Samer R, Mahmoud M, et al. Pulse pressure variation- guided fluid therapy during supratentorial brain tumour excision: a randomized controlled trial. Open Access Maced J Med 2019;7:2474–9. [PMC free article] [PubMed] [Google Scholar]
- Bapteste L, Carrillon R, Javelier S, Guyotat J, Desgranges FP, Lehot JJ, et al. Pulse pressure variations and plethysmographic variability index measured at ear are able to predict fluid responsiveness in the sitting position for J Neurosurg Anesthesiol. 2020;32:263–7. [PubMed] [Google Scholar]
- Byon HJ, Lim CW, Lee JH, Park YH, Kim HS, Kim CS, et Prediction of fluid responsiveness in mechanically ventilated children undergoing neurosurgery. Br J Anaesth. 2013;110:586–91. [PubMed] [Google Scholar]
