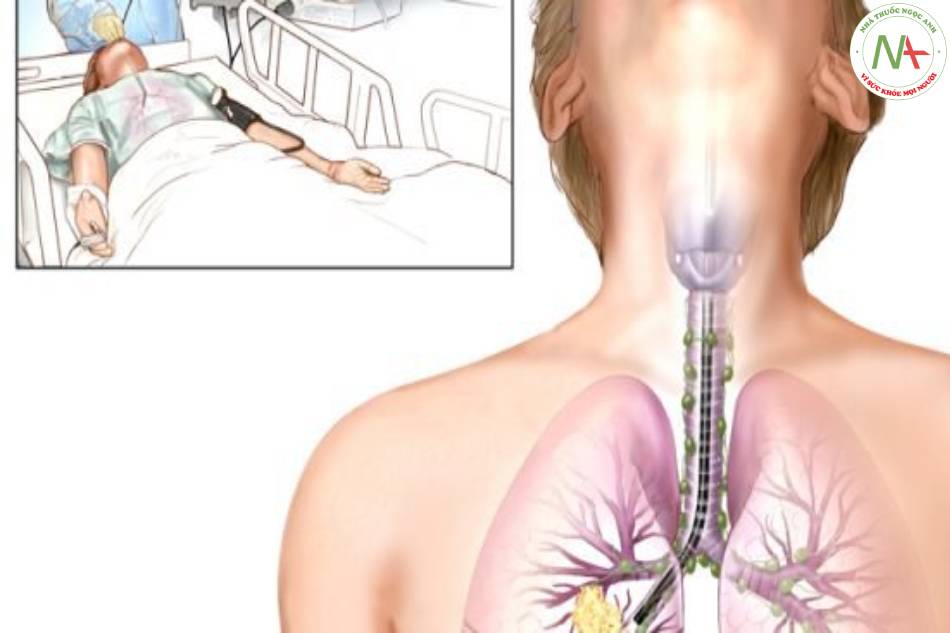
Bệnh hô hấp
Nội soi phế quản ở bệnh nhân suy hô hấp tại khoa hồi sức tích cực có và không có đặt nội khí quản
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Bài viết Nội soi phế quản ở bệnh nhân suy hô hấp tại khoa hồi sức tích cực có và không có đặt nội khí quản tải về file pdf ở đây.
Bản dịch: BS. Đặng Thanh Tuấn – BV Nhi Đồng 1
Tóm tắt
Nội soi phế quản là một trong những công cụ quan trọng đối với các bác sĩ chuyên khoa Hô hấp và Hồi sức tích cực để chẩn đoán và điều trị các tình trạng phổi khác nhau. Nó ngày càng được sử dụng bởi những bác sĩ hồi sức do tính an toàn và tính di động của nó. Việc sử dụng nội soi phế quản trong đơn vị chăm sóc đặc biệt (ICU) đã làm cho việc chẩn đoán và điều trị nhiều tình trạng trở nên khả thi hơn đối với các bác sĩ hồi sức. Thuốc an thần, tại chỗ hoặc tiêm tĩnh mạch, thường giúp dung nạp tốt hơn cho thủ thuật. Tuy nhiên, những nguy cơ và lợi ích của nội soi phế quản nên được cân nhắc cẩn thận ở những bệnh nhân nguy kịch. Các bệnh nhân thiếu oxy trong ICU đặt ra một thách thức vì thiếu oxy là một trong những biến chứng đã biết của nội soi phế quản và nguy cơ này càng trầm trọng hơn ở những bệnh nhân bị suy hô hấp do thiếu oxy. Nội soi phế quản là chống chỉ định tương đối ở những bệnh nhân bị giảm oxy máu nặng và rối loạn đông máu. Tuy nhiên, nội soi phế quản ở bệnh nhân thiếu oxy có thể có ý nghĩa chẩn đoán cũng như điều trị. Ở những bệnh nhân bị suy hô hấp do thiếu oxy, việc sử dụng thông khí không xâm lấn (NIV) trong quá trình nội soi phế quản đã được chứng minh là làm giảm nguy cơ đặt nội khí quản. Mặt khác, nội soi phế quản ở bệnh nhân thở máy không có chống chỉ định và đã được áp dụng rộng rãi. Nói chung, theo dõi chặt chẽ các dấu hiệu sinh tồn, hạn chế thời gian đặt ống soi trong đường thở và hiểu rõ sinh lý của bệnh nhân có thể giúp giảm nguy cơ biến chứng. Trong tổng quan này, chúng tôi thảo luận về các chỉ định, kỹ thuật, biến chứng và hiệu suất liên quan đến nội soi phế quản ở những bệnh nhân thiếu oxy nặng.
Giới thiệu
Nội soi phế quản là một công cụ quan trọng đối với các bác sĩ chuyên khoa phổi và chăm sóc tích cực để chẩn đoán cũng như điều trị các bệnh phổi khác nhau (1 – 3). Trong đơn vị chăm sóc đặc biệt (ICU), do tính an toàn và tính di động của nó (3), nội soi phế quản đóng một vai trò chẩn đoán và điều trị quan trọng ở những bệnh nhân bị bệnh nặng không thể vận chuyển đến các đơn vị chẩn đoán hoặc chẩn đoán hình ảnh từ xa (1). Các tình trạng khác nhau như rối loạn chức năng dây thanh âm, nhuyễn hóa phế quản, tắc nghẽn đường thở, dị vật, viêm phổi, bệnh nhu mô phổi lan tỏa và ung thư phổi có thể được chẩn đoán dễ dàng bằng nội soi phế quản (3). Nó cũng có thể giúp điều trị một số tình trạng bao gồm tắc nghẽn đường thở, dị vật, ho ra máu, tắc nghẽn chất nhầy và các tình trạng khác (4 – 6). Nhìn chung, nội soi phế quản được coi là một thủ thuật có nguy cơ thấp ở những bệnh nhân khỏe mạnh hoặc bệnh nhân mắc các bệnh hệ thống nhẹ, ổn định (7). Tuy nhiên, những bệnh nhân bị suy hô hấp do thiếu oxy từ trước đặt ra một thách thức đặc biệt cho bác sĩ nội soi phế quản. Khả năng tình trạng thiếu oxy trầm trọng hơn và nhu cầu tăng cường chăm sóc phải được cân nhắc với lợi ích của thủ thuật. Trong tổng quan này, chúng tôi thảo luận về nội soi phế quản ống mềm ở bệnh nhân suy hô hấp do thiếu oxy, đặc biệt là những bệnh nhân được điều trị bằng hỗ trợ thông khí không xâm lấn và xâm lấn.
Chỉ định và chống chỉ định
Chỉ định
Chỉ định chẩn đoán
Viêm phổi
Vi khuẩn, nấm hoặc virus
Thâm nhiễm không giải thích được trên Xquang ngực hoặc CT ngực
Nghi ngờ dị vật
Ho ra máu
Xác định vị trí chảy máu
Sau chấn thương
Xác định vị trí tổn thương khí quản hoặc lỗ rò khí quản
Bệnh nhân bỏng
Xác định mức độ bỏng khí quản
Tắc nghẽn đường thở
Xác định nguyên nhân lành tính hay ác tính
Chỉ dẫn điều trị
Loại bỏ dị vật
Tắc nghẽn chất nhầy và xẹp phổi
Loại bỏ khối u cho tắc nghẽn đường thở
Đặt stent
Kiểm soát chảy máu từ các tổn thương trung tâm bằng cách chèn thuốc chẹn nội phế quản,
liệu pháp áp lạnh hoặc đông máu argon plasma
Loại bỏ dị vật
Chống chỉ định
- Hiệp hội lồng ngực Hoa Kỳ khuyến cáo tránh nội soi phế quản và rửa phế quản phế nang (BAL) ở những bệnh nhân bị giảm oxy máu không thể điều chỉnh (áp lực riêng phần của oxy (PaO2) <75 mmHg, PaO2/FiO2) <150 hoặc độ bão hòa oxy (SpO2) <90% với oxy bổ sung) (9).
- Nên tránh sinh thiết xuyên phế quản nếu bệnh nhân bị giảm tiểu cầu nghiêm trọng với số lượng tiểu cầu <50K, rối loạn đông máu hoặc rối loạn chức năng thận nặng (3).
- NIV nên tránh nếu bệnh nhân có một trong các biểu hiện sau: Biến dạng khuôn mặt, chảy máu đường tiêu hóa trên, tắc nghẽn đường thở trên, không có khả năng bảo vệ đường thở, trạng thái tinh thần thay đổi đáng kể, hội chứng mạch vành cấp tính, huyết động không ổn định nghiêm trọng và ngừng thở hoặc ngừng tim (10).
Chuẩn bị
Giấy đồng thuận
Thông tin bằng lời nói và bằng văn bản giải thích các chỉ định, quy trình và các biến chứng tiềm ẩn phải được cung cấp. Nếu bệnh nhân không có khả năng đưa ra quyết định, người thân nên được tiếp cận để có được sự đồng ý. Trong nội soi phế quản theo chương trình, nên tránh thức ăn đặc/béo trong 8 giờ và tránh thức ăn nhạt/không béo và sữa không phải sữa mẹ trong 6 giờ. Các chất lỏng trong suốt như nước, nước ép trái cây không có bã được phép sử dụng tối đa 2 giờ trước khi làm thủ thuật (11, 12). Đối với bệnh nhân đang hỗ trợ máy thở hoặc bệnh nhân cần nội soi phế quản cấp cứu, hút dịch dạ dày bằng ống thông mũi/dạ dày ngay trước khi làm thủ thuật có thể đủ để ngăn ngừa hít sặc (13).
Nguy cơ và biện pháp phòng ngừa
Những bệnh nhân bị bệnh nặng nói chung có nguy cơ cao đối với bất kỳ thủ thuật xâm lấn nào, đặc biệt là những người bị rối loạn chuyển hóa hoặc cơ địa chảy máu (6). Vì vậy, tất cả các rối loạn điện giải và rối loạn đông máu phải được điều chỉnh trước khi bắt đầu nội soi phế quản (14 – 16). Một số yếu tố như PaO2 dưới 70 mmHg với FiO2 lớn hơn 70, áp lực dương cuối thì thở ra (PEEP) >10 cmH2O, co thắt phế quản đang hoạt động, nhồi máu cơ tim gần đây, rối loạn nhịp tim không ổn định, tăng áp lực nội sọ (ICP) được xác định là tăng nguy cơ biến chứng của nội soi phế quản (2). Những nguy cơ và lợi ích của nội soi phế quản nên được đánh giá cẩn thận ở những bệnh nhân bị thiếu oxy nghiêm trọng.
Giám sát
Nội soi phế quản có liên quan đến sự thay đổi độ giãn nở của phổi và tăng áp lực động mạch trung bình, áp lực động mạch phổi trung bình và nồng độ carbon dioxide (CO2) (17 – 19). Thiếu oxy và nhịp tim nhanh là kết quả của BAL trong một số nghiên cứu, mặc dù chúng không có ý nghĩa lâm sàng ở hầu hết bệnh nhân (20). Nội soi phế quản với BAL có liên quan đến tình trạng oxygen hóa xấu đi, với tỷ lệ PaO2/FiO2 giảm 80–86% so với ban đầu bất kể thể tích BAL được sử dụng (21). Để tránh điều này, chúng tôi thường xuyên tăng FiO2 đến 100% trước khi bắt đầu nội soi phế quản. Trong trường hợp độ bão hòa liên tục dưới 88%, nên rút ống soi phế quản ra khỏi đường thở và nên tăng FiO2 hoặc PEEP. Độ bão hòa oxy của bệnh nhân nên tăng lên 95% hoặc cao hơn trước khi tiếp tục nội soi phế quản.
Giống như tất cả các bệnh nhân ICU, những người sẽ trải qua nội soi phế quản nên được theo dõi tim liên tục, theo dõi huyết áp không xâm lấn hoặc xâm lấn, đo oxy trong mạch và theo dõi CO2 cuối thì thở ra (16). Đặt báo động cho các dấu hiệu sinh tồn bất thường giúp hồi sức và rút khỏi đường thở nhanh hơn trong trường hợp có biến chứng. Cần có sẵn các loại thuốc để hóa giải an thần và điều trị rối loạn nhịp tim, hạ huyết áp, co giật và các thiết bị cần thiết để hồi sức (22). Đối với bệnh nhân không đặt nội khí quản, cần thảo luận với bệnh nhân về nhu cầu đặt nội khí quản trong hoặc sau thủ thuật. Trong những trường hợp như vậy, nên có bóng giúp thở kèm mặt nạ và ống nội khí quản (ETT) ở đầu giường trước khi bắt đầu thủ thuật (22). Ở những bệnh nhân bị chấn thương đầu, việc theo dõi ICP là cần thiết do nguy cơ tăng nồng độ PCO2 trong quá trình nội soi phế quản (23, 24).
An thần
Bệnh nhân được dùng thuốc an thần trong khi nội soi phế quản thường chịu đựng thủ thuật tốt hơn và ít có khả năng thất bại trong thủ thuật (25 – 27). Nếu bệnh nhân đã được đặt nội khí quản trước khi làm thủ thuật, thì nên tạm thời tăng liều an thần tiêm tĩnh mạch để tạo điều kiện thuận lợi cho nội soi phế quản. Đối với những bệnh nhân thiếu oxy không đặt nội khí quản, các bác sĩ thường lo ngại về tình trạng suy giảm trung khu hô hấp và tình trạng thiếu oxy liên quan đến thuốc an thần trong suốt quá trình nội soi. Ở những bệnh nhân không bị thiếu oxy trải qua nội soi phế quản, việc sử dụng thuốc an thần vừa phải không liên quan đến việc tăng tỷ lệ mất bão hòa nghiêm trọng so với những bệnh nhân không được dùng thuốc an thần vừa phải (28). Trong một RCT của Saksitthichok và cộng sự, tất cả bệnh nhân được cho 50 µg fentanyl trước khi làm thủ thuật (29). Trong số 51 bệnh nhân được nghiên cứu trong RCT này, không có trường hợp nào quá liều an thần hoặc tụt độ bão hòa cần đặt nội khí quản được xác định trong quá trình thử nghiệm này. Trong một RCT khác của Simon và cộng sự, các tác giả đã sử dụng propofol bolus từ 10 đến 20 mg cứ sau 2 đến 3 phút (30). Ở nhánh thông khí không xâm lấn, trong số 20 bệnh nhân, không có bệnh nhân nào giảm độ bão hòa đáng kể hoặc cần đặt nội khí quản trong vòng 8 giờ sau thủ thuật. Ở nhóm ống thông mũi lưu lượng cao, trong số 20 bệnh nhân có 1 bệnh nhân phải đặt nội khí quản ngay sau thủ thuật. Các bệnh nhân còn lại ở nhóm ống thông mũi lưu lượng cao, không cần đặt nội khí quản trong vòng 8 giờ sau thủ thuật. Phương pháp cá nhân hóa nên được sử dụng dựa trên tình trạng lâm sàng của bệnh nhân và thời gian của thủ thuật. Thuốc an thần với fentanyl liều thấp hoặc tiêm nhanh propofol ngắt quãng là những lựa chọn an toàn.
Gây tê tại chỗ
Lidocaine nên được sử dụng để gây tê tại chỗ trong quá trình nội soi phế quản, trừ khi có chống chỉ định (31). Cả hai kỹ thuật cricothyroid và xịt khi bạn di chuyển đều có hiệu quả trong việc đưa lidocaine đến dây thanh âm và khí quản tùy thuộc vào quy trình và phương thức hỗ trợ thông khí (31). Khí dung có thể được sử dụng như một kỹ thuật đưa lidocain vào đường thở (32). Nên sử dụng dung dịch 1–2% lidocain để xịt khi sử dụng (33). Bác sĩ nội soi phế quản nên sử dụng liều lidocain thấp nhất đủ để ngăn ngừa ho quá mức nhằm tránh tác dụng phụ như độc tính của lidocain. Lượng capocaine trung bình được yêu cầu trong hầu hết các nghiên cứu dao động từ 80 đến 160 mg (34, 35). Quá liều lượng lidocain dẫn đến hệ thần kinh trung ương (CNS) và nhiễm độc tim. Các dấu hiệu và triệu chứng của ngộ độc thần kinh trung ương bao gồm từ tê quanh hốc mắt, buồn nôn, lú lẫn, buồn ngủ, rung giật nhãn cầu, dị cảm đến co giật và hôn mê. Các dấu hiệu và triệu chứng của nhiễm độc tim bao gồm hạ huyết áp, nhịp tim chậm, rối loạn nhịp tim và ngừng tim. Điều trị ngộ độc lidocain thường là điều trị hỗ trợ.
Nội soi phế quản với thông khí không xâm lấn (NIV)
NIV là nền tảng trong điều trị suy hô hấp cấp do nhiều nguyên nhân khác nhau (10, 36, 37). Nó làm giảm tỷ lệ đặt nội khí quản ở bệnh nhân suy hô hấp do thiếu oxy (7, 38). Một số loạt ca bệnh và nghiên cứu ngẫu nhiên có đối chứng cho thấy NIV có thể ngăn ngừa suy giảm hô hấp ở những bệnh nhân thiếu oxy thở tự nhiên được nội soi phế quản (4 – 6, 8 – 10, 39). NIV giúp bù lại sức cản đường thở và công thở thêm do nội soi phế quản tạo ra trong suốt quá trình. Việc sử dụng NIV trong quá trình nội soi phế quản làm giảm nguy cơ đặt nội khí quản ở bệnh nhân suy hô hấp do thiếu oxy (7). Một thử nghiệm ngẫu nhiên đơn lẻ nhưng được tiến hành tốt cho thấy máy áp lực đường thở dương liên tục (CPAP) cộng với oxy tốt hơn so với oxy đơn thuần trong quá trình nội soi phế quản ở bệnh nhân bị thiếu oxy, ngăn ngừa tình trạng giảm độ bão hòa và nhu cầu hỗ trợ máy thở sau thủ thuật (40). Ba nghiên cứu cho thấy NIV giúp ngăn ngừa nhu cầu thở máy ở bệnh nhân thiếu oxy khi nội soi phế quản (29, 30, 41).
Thủ tục
Chế độ máy thở nên được đặt thành hỗ trợ áp lực (40). Áp lực hít vào nên được chuẩn độ trong khoảng từ 10 đến 25 cmH2O và PEEP từ 5 đến 10 cmH2O để đạt được thông khí và oxygen hóa tối ưu (30, 35, 41).
Cài đặt máy thở nên được điều chỉnh theo khả năng chịu đựng của bệnh nhân. Có thể sử dụng mặt nạ toàn mặt đơn giản với đầu nối xoay làm mặt tiếp xúc được cố định vào mặt bệnh nhân bằng dây đai đàn hồi để thực hiện thủ thuật cùng với dụng cụ chắn răng (Hình 1). Kích thước của ống soi phế quản được sử dụng trong các nghiên cứu có đường kính ngoài từ 4 đến 6,4 mm tùy thuộc vào quy trình dự định. Cả đường mũi và đường miệng đều an toàn như nhau. Nên dùng dung dịch lidocain 2% để gây tê tại chỗ vùng mũi họng và khí phế quản. Thuốc an thần ngắn hạn có thể được sử dụng và điều chỉnh tùy theo tình trạng hô hấp và huyết động của họ (29, 30, 42). Bệnh nhân nên được cung cấp 100% FiO2 trong quá trình nội soi phế quản (một hoặc nhiều quy trình này có thể được thực hiện trong cùng một ứng dụng nội soi phế quản: BAL, chải phế quản, sinh thiết và hút điều trị) theo NIV. Sau nội soi phế quản, NIV nên được tiếp tục ở tất cả các bệnh nhân trong ít nhất hai giờ để giảm thiểu nguy cơ đặt nội khí quản (43).
Tình huống
Một người đàn ông 50 tuổi có tiền sử bệnh tăng huyết áp, đái tháo đường và bệnh bạch cầu dòng tủy cấp tính với tiền sử cấy ghép tủy xương xuất hiện tình trạng khó thở tăng dần. Anh ta được ghi nhận là bị thiếu oxy trong không khí trong phòng và cần 2 L/phút oxy qua ống thông mũi. CT ngực cho thấy mờ kính mờ hai bên liên quan đến viêm phổi. Mặc dù dùng kháng sinh phổ rộng, tình trạng lâm sàng của anh ấy vẫn tiếp tục xấu đi và anh ấy bắt đầu cần bổ sung oxy 4 L/phút. Quyết định nội soi phế quản để loại trừ nhiễm trùng cơ hội. Trước khi nội soi phế quản, hầu họng được gây tê bằng thuốc xịt lidocain. Anh ấy được hỗ trợ NIV với IPAP là 10 cmH2O và EPAP là 5 cmH2O. FiO2 được tăng lên 100%.
Sau đó, 50 mcg fentanyl IV và 1 mg midazolam IV được dùng để an thần vừa phải. IPAP được chuẩn độ để duy trì thể tích khí lưu thông là 400 và PEEP được tăng lên 10. Sau đó, ống soi phế quản được đưa qua bộ chuyển đổi, qua mặt nạ, và lidocain được sử dụng để gây tê dây thanh quản và cây khí phế quản. Một BAL đã được thực hiện từ thùy giữa bên phải cùng với sinh thiết xuyên phế quản. Không có chảy máu đáng kể đã được ghi nhận. Sau khi nội soi phế quản, bệnh nhân tỉnh táo và làm theo y lệnh. IPAP và EPAP đã được loại bỏ cùng với FiO2. Bệnh nhân cần 6 lít oxy sau thủ thuật trong 24 giờ để duy trì độ bão hòa oxy lớn hơn 90%. Bệnh nhân được chẩn đoán mắc bệnh nấm Mucor và bắt đầu dùng thuốc kháng nấm.
Nội soi phế quản ở bệnh nhân đặt nội khí quản thở máy
Nội soi phế quản ở bệnh nhân thở máy không có chống chỉ định; ngược lại, tiện ích của nó có thể bao gồm từ việc xác định quá trình điều trị (BAL và sinh thiết xuyên phế quản) đến việc cứu sống khi nó được thực hiện để loại bỏ các nút nhầy, làm giảm tắc nghẽn đường thở trung tâm hoặc kiểm soát ho ra máu ồ ạt (2). Các nghiên cứu đã báo cáo rằng 65% đến 79% nội soi phế quản trong ICU được thực hiện ở bệnh nhân thở máy (1, 2, 22).
Kích thước ETT
Hiệp hội Lồng ngực Anh khuyến cáo rằng “đường kính ngoài của ống nội soi phế quản được sử dụng trong cơ sở ICU nên được lựa chọn cẩn thận theo kích thước của ETT và loại thiết bị đường thở được sử dụng” (16). Bằng cách đưa ống soi phế quản vào ETT, nó sẽ chiếm tới 66% đường kính của ETT (16). Lý tưởng nhất là đường kính trong của ống ET phải cao hơn ít nhất 2 mm so với đường kính ngoài của ống soi phế quản. Nội soi phế quản có đường kính nhỏ hơn sẽ không hiệu quả trong việc hút chất nhầy hoặc cục máu đông như nội soi phế quản lớn hơn; do đó, việc lựa chọn ống soi phế quản cũng phải phụ thuộc vào chỉ định soi phế quản (2). Nội soi phế quản có thể gây căng phồng phổi và chấn thương khí áp bằng cách tăng sức cản do tắc nghẽn một phần đường thở (44).
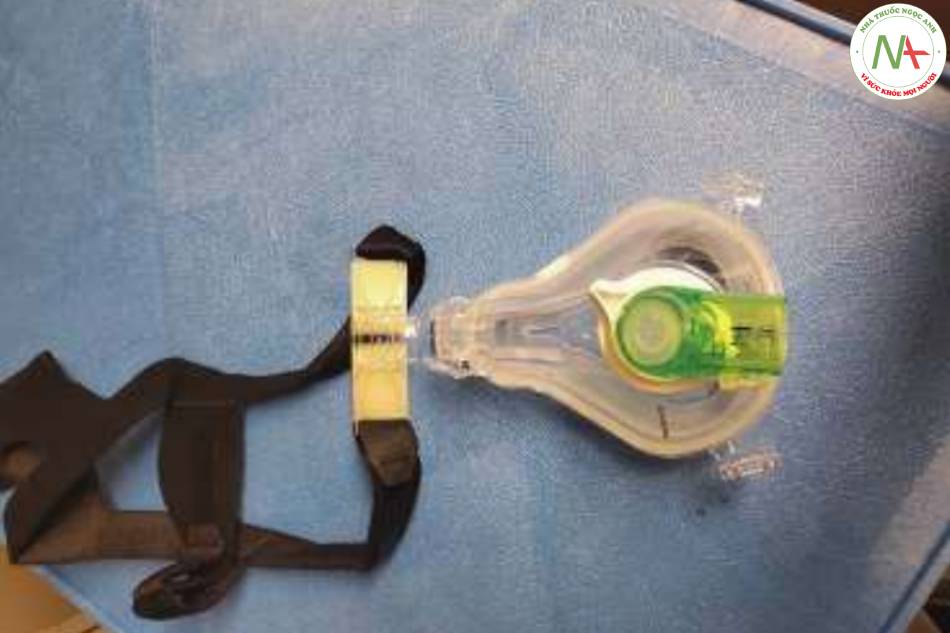

Sự chuẩn bị
Một bộ chuyển đổi đặc biệt được gắn vào ETT cho phép đưa ống soi phế quản vào mà không ảnh hưởng đáng kể đến thể tích khí lưu thông (22) (Hình 2). Khối cắn xung quanh ETT có thể ngăn chặn bất kỳ thiệt hại nào đối với sợi quang học (2). Có thể cần bôi trơn ống soi phế quản để tạo điều kiện cho nó đi qua ETT (2).
Cài đặt máy thở
Nên cho bệnh nhân thở oxy trước đến 100% FiO2 trước khi nội soi phế quản cũng như trong quá trình nội soi phế quản và hồi phục (22). Cài đặt thông khí bắt buộc là cần thiết để duy trì thông khí đầy đủ (16). Vì áp lực đỉnh sẽ tăng lên trong quá trình nội soi phế quản, điều quan trọng là phải tăng giới hạn báo động của áp lực để đảm bảo cung cấp đủ thể tích khí lưu thông (16). Chúng tôi không khuyến nghị sử dụng chế độ thông khí tự phát. Chúng tôi thường đặt máy thở ở chế độ thông khí kiểm soát thể tích với giới hạn báo động áp lực cao hơn. Chế độ thông khí kiểm soát áp lực có thể được sử dụng trong quá trình nội soi phế quản. Tuy nhiên, cần theo dõi cẩn thận và điều chỉnh áp lực để đạt được thể tích khí lưu thông thích hợp cũng như tránh sự dao động của thể tích khí lưu thông trong quá trình tiến và rút ống soi. Máy thở giới hạn áp lực nhắm mục tiêu theo thể tích có thể là một chế độ máy thở tốt. Tuy nhiên, chế độ máy thở này cũng sẽ yêu cầu điều chỉnh các giới hạn áp lực để đảm bảo đủ thể tích khí lưu thông. Không có nghiên cứu nào cho thấy sự vượt trội của một chế độ thông khí so với chế độ thông khí khác. FiO2 thường được đặt ở mức 100% trong suốt thời gian thực hiện thủ thuật.
Biến chứng
Giảm oxy máu
Giảm oxy máu là một trong những biến chứng phổ biến nhất của nội soi phế quản, có thể kéo dài đến 2 giờ sau thủ thuật (17). Tình trạng thiếu oxy thoáng qua có thể thấy ở 0,8–35% bệnh nhân trải qua nội soi phế quản mà không bổ sung oxy mặc dù độ bão hòa oxy trên 90% trước khi làm thủ thuật (45, 46). Tình trạng thiếu oxy có thể dễ dàng điều chỉnh bằng cách bổ sung oxy. Cơ chế giảm oxy máu trong quá trình nội soi phế quản bao gồm tắc nghẽn đường hô hấp trên ở bệnh nhân béo phì, tắc nghẽn khí quản do mất cân bằng thông khí-tưới máu do soi phế quản, hút, gây tê tại chỗ, chảy máu, v.v. cũng như giảm thông khí do thuốc an thần (47).
Ở người khỏe mạnh, PaO2 có thể giảm 20–30 mmHg, trong khi ở bệnh nhân nặng, nó có thể giảm tới 30–60 mmHg (48). Nên tránh tình trạng thiếu oxy máu bằng cách cung cấp oxy cho tất cả bệnh nhân có FiO2 100% trong 15 phút trước khi làm thủ thuật và giảm thiểu việc hút kéo dài, làm giảm dung tích cặn gắng sức và thể tích khí lưu thông (49, 50). Nhỏ nước muối và Lidocaine làm trầm trọng thêm tình trạng thiếu oxy trong máu (51). Áp dụng NIV giúp tăng áp lực đường thở trung bình và thể tích khí lưu thông, do đó cải thiện quá trình oxygen hóa và thông khí (35, 52, 53).
Bệnh nhân bị suy hô hấp do thiếu oxy có nhiều nguy cơ bị thiếu oxy trầm trọng hơn khi nội soi phế quản (54). BAL ở những bệnh nhân thở máy làm tăng tạm thời gradient Aa [P(A-a)O2] và làm xấu đi tỷ lệ PaO2/FiO2 không phụ thuộc vào thể tích BAL (21, 55). Điều này chủ yếu được quan sát thấy ở những bệnh nhân mắc hội chứng suy hô hấp cấp tính (ARDS), trong đó PaO2 giảm hơn 30% được ghi nhận ở 35% bệnh nhân (17). Schnabel và cộng sự (52) lưu ý rằng trong 164 ca nội soi phế quản với BAL ở những bệnh nhân nặng, thở máy nghi ngờ viêm phổi, 29% bệnh nhân bị giảm tỷ lệ PaO2/FiO2 lớn hơn 25% sau 1 giờ sau thủ thuật và tồn tại ở 14% bệnh nhân sau 24 giờ sau thủ thuật. 22% bệnh nhân có huyết động không ổn định trong vòng 24 giờ đầu sau thủ thuật (52). Prebil và cộng sự (56) đã nghiên cứu 100 ca nội soi phế quản nghiên cứu với BAL ở những bệnh nhân bị bệnh nặng và thở máy. Họ phát hiện ra rằng thiếu oxy máu là biến chứng phổ biến nhất trong quá trình phẫu thuật xảy ra ở 9% bệnh nhân (57). Kracco và cộng sự (54) nghiên cứu 169 thủ thuật nội soi phế quản ở bệnh nhân không đặt nội khí quản có PaO2/FiO2 <300. 35% bệnh nhân cần hỗ trợ thở máy tăng cường trong vòng 24 giờ, trong khi 15% bệnh nhân cần đặt nội khí quản (54). Kalcheim-Dekel và cộng sự đã thực hiện nội soi phế quản ở 7 bệnh nhân mắc ARDS khi họ ở tư thế nằm sấp, và chỉ có một bệnh nhân ghi nhận giảm độ bão hòa đáng kể (57).
Tràn khí màng phổi
Tràn khí màng phổi thường là một biến chứng hiếm gặp trong quá trình nội soi phế quản với BAL. Đã có một số báo cáo về tràn khí màng phổi sau BAL ở những bệnh nhân thở máy ngay cả khi không sinh thiết xuyên phế quản (18). Trong nghiên cứu của Cracco và cộng sự (54), tỷ lệ tràn khí màng phổi thấp. 2 bệnh nhân (1,1%) bị tràn khí màng phổi sau BAL mà không sinh thiết xuyên phế quản. Hầu hết các trường hợp tràn khí màng phổi liên quan đến nội soi phế quản đều liên quan đến sinh thiết xuyên phế quản (58). O’Brien và cộng sự (59) đã nghiên cứu 71 bệnh nhân thở máy trải qua sinh thiết xuyên phế quản. Mười bệnh nhân (14,3%) bị tràn khí màng phổi sau khi sinh thiết xuyên phế quản (59). Ở bệnh nhân không ghép phổi tỷ lệ tràn khí màng phổi là 18,9% cao hơn tỷ lệ tràn khí màng phổi ở bệnh nhân ghép phổi là 6,5% (P=0,085) (59). Pincus và cộng sự nghiên cứu 13 bệnh nhân trải qua sinh thiết xuyên phế quản để chẩn đoán thâm nhiễm phổi lan tỏa; 2 trường hợp tràn khí màng phổi (15%) đã được ghi nhận trong nghiên cứu của họ (60). Bulpa và cộng sự (61) đã phân loại 22 bệnh nhân có khả năng miễn dịch bình thường được sinh thiết xuyên phế quản dựa trên có hay không có ARDS. Tỷ lệ tràn khí màng phổi ở bệnh nhân ARDS là 27,2% (3/11 bệnh nhân) so với 9% (1/11 bệnh nhân) ở bệnh nhân không ARDS (61). Trong nghiên cứu của Papin và cộng sự (62), tràn khí màng phổi được phát hiện ở 1 trong số 15 bệnh nhân (6%) trải qua sinh thiết xuyên phế quản trong khi thở máy.
Chảy máu
Nội soi phế quản chỉ với BAL hiếm khi gây chảy máu đáng kể, ngay cả ở những bệnh nhân bị giảm tiểu cầu nặng (63). Hầu hết các trường hợp chảy máu được ghi nhận ở sinh thiết xuyên phế quản (16). Nghiên cứu được thực hiện bởi O’Brien và cộng sự (59) cho thấy ở những bệnh nhân thở máy trải qua sinh thiết xuyên phế quản, chảy máu đáng kể về mặt lâm sàng (>30 và <100 mL) được quan sát thấy ở 4,8% bệnh nhân. Chỉ có một bệnh nhân (1,2%) bị chảy máu hơn 100 mL khi làm sinh thiết (59). Tuy nhiên, Bulpa và cộng sự (61) đã tìm thấy tỷ lệ chảy máu cao hơn trong nghiên cứu của họ. Bốn trong số 38 trường hợp (10,5%) bị chảy máu đáng kể sau khi sinh thiết xuyên phế quản. Nguy cơ chảy máu cao hơn ở bệnh nhân suy giảm miễn dịch (18,75%) so với bệnh nhân bình thường về miễn dịch (4,5%) (61).
Nói chung, chảy máu có thể thấy ở 5% trường hợp sinh thiết xuyên phế quản (16). Tuy nhiên, chảy máu trong quá trình nội soi phế quản ở bệnh nhân thiếu oxy có thể làm tình trạng thiếu oxy trầm trọng hơn và có thể cần tăng cường chăm sóc hoặc can thiệp bổ sung.
Kết quả chẩn đoán của nội soi phế quản trong suy hô hấp thiếu oxy
| Nghiên cứu | Dân số | Can thiệp | Kết quả |
| Kracco và cộng sự | 169 bệnh nhân thiếu oxy cần oxy >8 lít/phút hoặc NIPPV | Có hoặc không có BAL | Hiệu suất chẩn đoán: 59%; thay đổi trị liệu: 51% |
| O’Brien và cộng sự | 71 bệnh nhân thở máy: thở máy kéo dài sau ghép phổi 34 bệnh nhân; suy giảm miễn dịch 17 bệnh nhân; không suy giảm miễn dịch, 20 bệnh nhân | Sinh thiết xuyên phế quản | Thay đổi cách xử trí: 58,8% bệnh nhân suy giảm miễn dịch và 60% bệnh nhân không suy giảm miễn dịch |
| Bulpa và cộng sự | 38 bệnh nhân thở máy | BAL và sinh thiết xuyên phế quản | Hiệu suất chẩn đoán: sinh thiết xuyên phế quản và BAL, 74% (BAL: 29%; sinh thiết xuyên phế quản: 63%). Thay đổi trị liệu: 63% bệnh nhân |
| Arcadu và cộng sự | 106 bệnh nhân suy hô hấp cấp và ILD cơ bản | BAL. Không có sinh thiết xuyên phế quản nào được thực hiện trong đoàn hệ này | Năng suất chẩn đoán: 16 (13%); 12 ca nhiễm trùng và 4 ca xuất huyết |
BAL, rửa phế quản phế nang.
Tử vong
Nhìn chung, tỷ lệ tử vong trong vòng 24 giờ sau nội soi phế quản là thấp. Kracco và cộng sự (54) đã mô tả 4 trường hợp ngừng tim (2,3%) trong vòng 24 giờ và ba trường hợp tử vong (1,77%) trong vòng 24 giờ sau nội soi phế quản trong số 160 ca nội soi phế quản ở bệnh nhân thở máy.
Năng suất chẩn đoán
Trong nghiên cứu của Cracco và cộng sự (54), nội soi phế quản sợi quang có hoặc không có BAL cung cấp chẩn đoán trong 100 (59%) thủ thuật, và kết quả dẫn đến việc bắt đầu hoặc ngừng điều trị trong 86 (51%) thủ thuật (54).
O’Brien và cộng sự (59) đã nghiên cứu 71 bệnh nhân thở máy trải qua sinh thiết xuyên phế quản. Trong số 71 bệnh nhân, 34 (47,9%) bệnh nhân thở máy kéo dài sau ghép phổi, 20 (28,2%) bệnh nhân là bệnh nhân không bị suy giảm miễn dịch và 17 bệnh nhân (23,9%) là bệnh nhân bị suy giảm miễn dịch (59). Sinh thiết xuyên phế quản dẫn đến sự thay đổi trong việc xử trí y khoa ở 10 bệnh nhân (58,8%) bị suy giảm miễn dịch và 12 (60,0%) bệnh nhân không bị suy giảm miễn dịch (59).
Bulpa và cộng sự (61) đã nghiên cứu 38 bệnh nhân thở máy đã trải qua BAL và sinh thiết xuyên phế quản. BAL đưa ra chẩn đoán cụ thể ở 11 (29%) bệnh nhân. BAL là nghiên cứu chẩn đoán dương tính duy nhất ở 4 (10,5%) bệnh nhân (61). Tương tự, sinh thiết xuyên phế quản cung cấp chẩn đoán trong 24 (63%) trường hợp và đóng góp như một xét nghiệm chẩn đoán duy nhất ở 17 (44%) bệnh nhân (61). Sự kết hợp giữa BAL và sinh thiết xuyên phế quản đã đưa ra chẩn đoán ở 28 (74%) bệnh nhân và dẫn đến thay đổi điều trị ở 24 (63%) bệnh nhân (61).
Nội soi phế quản trong đánh giá lâm sàng suy hô hấp cấp tính ở bệnh nhân mắc bệnh phổi kẽ thường chỉ được thực hiện với tỷ lệ 13% trong nghiên cứu đoàn hệ hồi cứu lớn này (64). Trong một nghiên cứu xem xét những bệnh nhân được nội soi phế quản để điều trị ho ra máu, 29% bệnh nhân bị ung thư biểu mô phế quản, 23% bị viêm phế quản và 22% không có nguyên nhân rõ ràng (2). Hiệu quả của nội soi phế quản trong việc loại bỏ nút nhầy và cải thiện thông khí phổi dao động từ 41% đến 81% (2). Khi không khí được bơm vào qua kênh làm việc của nội soi phế quản, tỷ lệ bệnh nhân tái giãn nở phổi xẹp phổi tăng lên 85% (65).
Kết luận
Một số bệnh nhân được điều trị suy hô hấp cấp tính trong ICU sẽ yêu cầu nội soi phế quản chẩn đoán hoặc điều trị. Mặc dù nội soi phế quản thường được coi là một biện pháp can thiệp an toàn (7), nhưng ai cũng biết rằng nội soi phế quản có thể gây ra tình trạng thiếu oxy đáng kể (39). Nội soi phế quản ở bệnh nhân suy hô hấp do thiếu oxy có nguy cơ cao hơn so với bệnh nhân không bị thiếu oxy. Đó là lý do tại sao các nguy cơ và lợi ích nên được đánh giá kỹ lưỡng trước khi tiến hành nội soi phế quản. Nội soi phế quản có thể được thực hiện với NIV hoặc thở máy. Các thao tác như BAL được dung nạp tốt. Tuy nhiên, cần cân nhắc cẩn thận trước khi tiến hành sinh thiết xuyên phế quản.
Tài liệu tham khảo
- Koh SO, Kim JH, Oh HK. Clinical experiences of fiberoptic bronchoscopy in patients with respiratory failure in the intensive care unit. Yonsei Med J 1990;31:219-24. 10.3349/ymj.1990.31.3.219 [PubMed] [CrossRef] [Google Scholar]
- Raoof S, Mehrishi S, Prakash UB. Role of bronchoscopy in modern medical intensive care unit. Clin Chest Med 2001;22:241-61, vii. 10.1016/S0272-5231(05)70041-1 [PubMed] [CrossRef] [Google Scholar]
- Silver MR, Balk RA. Bronchoscopic procedures in the intensive care unit. Crit Care Clin 1995;11:97-109. 10.1016/S0749-0704(18)30087-3 [PubMed] [CrossRef] [Google Scholar]
- Ambrosino N, Guarracino F. Unusual applications of noninvasive ventilation. Eur Respir J 2011;38:440-9. 10.1183/09031936.00192810 [PubMed] [CrossRef] [Google Scholar]
- Korkmaz Ekren P, Basarik AB, Gurgun A, et al. Can fiberoptic bronchoscopy ne applied to critically ill patients treated with noninvasive ventilation for acute respiratory distress syndrome? Prospective observational study. BMC Pulm Med 2016;16:89. 10.1186/s12890-016-0236-y [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Confalonieri M, Potena A, Carbone G, et al. Acute respiratory failure in patients with severe community-acquired pneumonia. A prospective randomized evaluation of noninvasive ventilation. Am J Respir Crit Care Med 1999;160:1585-91. 10.1164/ajrccm.160.5.9903015 [PubMed] [CrossRef] [Google Scholar]
- Depuydt PO, Benoit DD, Vandewoude KH, et al. Outcome in noninvasively and invasively ventilated hematologic patients with acute respiratory failure. Chest 2004;126:1299-306. 10.1378/chest.126.4.1299 [PubMed] [CrossRef] [Google Scholar]
- Rittayamai N, Brochard L. Recent advances in mechanical ventilation in patients with acute respiratory distress syndrome. Eur Respir Rev 2015;24:132-40. 10.1183/09059180.00012414 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Goldstein RA, Rohatgi PK, Bergofsky EH, et al. Clinical role of bronchoalveolar lavage in adults with pulmonary disease. Am Rev Respir Dis 1990;142:481-6. 10.1164/ajrccm/142.2.481 [PubMed] [CrossRef] [Google Scholar]
- Nava S, Hill N. Non-invasive ventilation in acute respiratory failure. Lancet 2009;374:250-9. 10.1016/S01406736(09)60496-7 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Practice Guidelines for Preoperative Fasting and the Use of Pharmacologic Agents to Reduce the Risk of Pulmonary Aspiration: Application to Healthy Patients Undergoing Elective Procedures: An Updated Report by the American Society of Anesthesiologists Task Force on Preoperative Fasting and the Use of Pharmacologic Agents to Reduce the Risk of Pulmonary Aspiration. Anesthesiology 2017;126:376-93. 10.1097/ALN.0000000000001452 [PubMed] [CrossRef] [Google Scholar]
- Dobson G, Chow L, Filteau L, et al. Guidelines to the Practice of Anesthesia – Revised Edition 2020. Can J Anaesth 2020;67:64-99. [PMC free article] [PubMed] [Google Scholar]
- Lee JC, Williams GW, Kozar RA, et al. Multitargeted Feeding Strategies Improve Nutrition Outcome and Are Associated With Reduced Pneumonia in a Level 1 Trauma Intensive Care Unit. JPEN J Parenter Enteral Nutr 2018;42:529-37. [PubMed] [Google Scholar]
- Kozak EA, Brath LK., Do “screening” coagulation tests predict bleeding in patients undergoing fiberoptic bronchoscopy with biopsy? Chest 1994;106:703-5. 10.1378/chest.106.3.703 [PubMed] [CrossRef] [Google Scholar]
- Brickey DA, Lawlor DP. Transbronchial biopsy in the presence of profound elevation of the international normalized ratio. Chest 1999;115:1667-71. 10.1378/chest.115.6.1667 [PubMed] [CrossRef] [Google Scholar]
- Du Rand IA, Blaikley J, Booton R, et al. British Thoracic Society guideline for diagnostic flexible bronchoscopy in adults: accredited by NICE. Thorax 2013;68 Suppl 1:i1-i44. 10.1136/thoraxjnl-2013-203618 [PubMed] [CrossRef] [Google Scholar]
- Trouillet JL, Guiguet M, Gibert C, et al. Fiberoptic bronchoscopy in ventilated patients. Evaluation of cardiopulmoclininary risk under midazolam sedation. Chest 1990;97:927-33. 10.1378/chest.97.4.927 [PubMed] [CrossRef] [Google Scholar]
- Steinberg KP, Mitchell DR, Maunder RJ, et al. Safety of bronchoalveolar lavage in patients with adult respiratory distress syndrome. Am Rev Respir Dis 1993;148:556-61. 10.1164/ajrccm/148.3.556 [PubMed] [CrossRef] [Google Scholar]
- Klein U, Karzai W, Zimmermann P, et al. Changes in pulmonary mechanics after fiberoptic bronchoalveolar lavage in mechanically ventilated patients. Intensive Care Med 1998;24:1289-93. 10.1007/s001340050764 [PubMed] [CrossRef] [Google Scholar]
- Markou NK, Kanakaki MC, Boutzouka E, et al. Fluctuations in gas exchange andcardiovascular parameters during flexible bronchoscopy. J Bronchol 1999;6:241-6. 10.1097/00128594-199910000-00003 [CrossRef] [Google Scholar]
- Bauer TT, Torres A, Ewig S, et al. Effects of bronchoalveolar lavage volume on arterial oxygenation in mechanically ventilated patients with pneumonia. Intensive Care Med 2001;27:384-93. 10.1007/s001340000781 [PubMed] [CrossRef] [Google Scholar]
- Barrett CR, Jr. Flexible fiberoptic bronchoscopy in the critically ill patient. Methodology and indications. Chest 1978;73:746-9. 10.1378/chest.73.5.746 [PubMed] [CrossRef] [Google Scholar]
- Kerwin AJ, Croce MA, Timmons SD, et al. Effects of fiberoptic bronchoscopy on intracranial pressure in patients with brain injury: a prospective clinical study. J Trauma 2000;48:878-82; discussion 882-3. 10.1097/00005373200005000-00011 [PubMed] [CrossRef] [Google Scholar]
- Peerless JR, Snow N, Likavec MJ, et al. The effect of fiberoptic bronchoscopy on cerebral hemodynamics in patients with severe head injury. Chest 1995;108:962-5. 10.1378/chest.108.4.962 [PubMed] [CrossRef] [Google Scholar]
- Maguire GP, Rubinfeld AR, Trembath PW, et al. Patients prefer sedation for fibreoptic bronchoscopy. Respirology 1998;3:81-5. 10.1111/j.1440-1843.1998.tb00101.x [PubMed] [CrossRef] [Google Scholar]
- Morris LG, Zeitler DM, Amin MR. Unsedated flexible fiberoptic bronchoscopy in the resident clinic: technique and patient satisfaction. Laryngoscope 2007;117:1159-62. 10.1097/MLG.0b013e31806009e6 [PubMed] [CrossRef] [Google Scholar]
- De S. Assessment of patient satisfaction and lidocaine requirement during flexible bronchoscopy without sedation. J Bronchology Interv Pulmonol 2009;16:176-9. 10.1097/LBR.0b013e3181afca25 [PubMed] [CrossRef] [Google Scholar]
- Hong KS, Choi EY, Park DA, et al. Safety and Efficacy of the Moderate Sedation During Flexible Bronchoscopic Procedure: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Medicine (Baltimore) 2015;94:e1459. 10.1097/MD.0000000000001459 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Saksitthichok B, Petnak T, So-Ngern A, et al. A prospective randomized comparative study of high-flow nasal cannula oxygen and non-invasive ventilation in hypoxemic patients undergoing diagnostic flexible bronchoscopy. J Thorac Dis 2019;11:1929-39. 10.21037/jtd.2019.05.02 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Simon M, Braune S, Frings D, et al. High-flow nasal cannula oxygen versus non-invasive ventilation in patients with acute hypoxaemic respiratory failure undergoing flexible bronchoscopy–a prospective randomised trial. Crit Care 2014;18:712. 10.1186/s13054-014-0712-9 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Webb AR, Woodhead MA, Dalton HR, et al. Topical nasal anaesthesia for fibreoptic bronchoscopy: patients’ preference for lignocaine gel. Thorax 1989;44:674-5. 10.1136/thx.44.8.674 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Isaac PA, Barry JE, Vaughan RS, et al. A jet nebuliser for delivery of topical anesthesia to the respiratory tract. A comparison with cricothyroid puncture and direct spraying for fibreoptic bronchoscopy. Anaesthesia 1990;45:46-8. 10.1111/j.1365-2044.1990.tb14504.x [PubMed] [CrossRef] [Google Scholar]
- Randell T, Yli-Hankala A, Valli H, et al. Topical anaesthesia of the nasal mucosa for fibreoptic airway endoscopy. Br J Anaesth 1992;68:164-7. 10.1093/bja/68.2.164 [PubMed] [CrossRef] [Google Scholar]
- Efthimiou J, Higenbottam T, Holt D, et al. Plasma concentrations of lignocaine during fibreoptic bronchoscopy. Thorax 1982;37:68-71. 10.1136/thx.37.1.68 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Antonelli M, Conti G, Riccioni L, et al. Noninvasive positive-pressure ventilation via face mask during bronchoscopy with BAL in high-risk hypoxemic patients. Chest 1996;110:724-8. 10.1378/chest.110.3.724 [PubMed] [CrossRef] [Google Scholar]
- Schönhofer B, Kuhlen R, Neumann P, et al. Non-invasive ventilation as treatment for acute respiratory insufficiency. Essentials from the new S3 guidelines. Anaesthesist 2008;57:1091-102. [PubMed] [Google Scholar]
- Kluge S, Baumann HJ, Kreymann G. Intrahospital transport of a patient with acute exacerbation of chronic obstructive pulmonary disease under noninvasive ventilation. Intensive Care Med 2005;31:886. 10.1007/s00134-0052626-0 [PubMed] [CrossRef] [Google Scholar]
- Hilbert G, Gruson D, Vargas F, et al. Noninvasive ventilation in immunosuppressed patients with pulmonary infiltrates, fever, and acute respiratory failure. N Engl J Med 2001;344:481-7. 10.1056/NEJM200102153440703 [PubMed] [CrossRef] [Google Scholar]
- Albertini RE, Harrell JH, 2nd, Kurihara N, Moser KM. Arterial hypoxemia induced by fiberoptic bronchoscopy. JAMA 1974;230:1666-7. 10.1001/jama.1974.03240120034016 [PubMed] [CrossRef] [Google Scholar]
- Maitre B, Jaber S, Maggiore SM, et al. Continuous positive airway pressure during fiberoptic bronchoscopy in hypoxemic patients. A randomized double-blind study using a new device. Am J Respir Crit Care Med 2000;162:1063-7. 10.1164/ajrccm.162.3.9910117 [PubMed] [CrossRef] [Google Scholar]
- Antonelli M, Conti G, Rocco M, et al. Noninvasive positive-pressure ventilation vs. conventional oxygen supplementation in hypoxemic patients undergoing diagnostic bronchoscopy. Chest 2002;121:1149-54. 10.1378/chest.121.4.1149 [PubMed] [CrossRef] [Google Scholar]
- Clark G, Licker M, Younossian AB, et al. Titrated sedation with propofol or midazolam for flexible bronchoscopy: a randomised trial. Eur Respir J 2009;34:1277-83. 10.1183/09031936.00142108 [PubMed] [CrossRef] [Google Scholar]
- Esquinas A, Zuil M, Scala R, et al. Bronchoscopy during non-invasive mechanical ventilation: a review of techniques and procedures. Arch Bronconeumol 2013;49:105-12. 10.1016/j.arbr.2013.01.007 [PubMed] [CrossRef] [Google Scholar]
- Labbe A, Meyer F, Albertini M. Bronchoscopy in intensive care units. Paediatr Respir Rev 2004;5 Suppl A:S15-9.[PubMed]
- Milman N, Faurschou P, Grode G, et al. Pulse oximetry during fibreoptic bronchoscopy in local anaesthesia: frequency of hypoxaemia and effect of oxygen supplementation. Respiration 1994;61:342-7. 10.1159/000196366 [PubMed] [CrossRef] [Google Scholar]
- Mouchantaf FG, Shostak E, Lamb CR. Characteristics and financial costs of patients with respiratory failure at bronchoscopy. J Bronchology Interv Pulmonol 2012;19:188-94. 10.1097/LBR.0b013e31825aa467 [PubMed] [CrossRef] [Google Scholar]
- Chhajed PN, Glanville AR. Management of hypoxemia during flexible bronchoscopy. Clin Chest Med 2003;24:511-6. 10.1016/S0272-5231(03)00050-9 [PubMed] [CrossRef] [Google Scholar]
- Matsumoto T, Sato Y, Fukuda S, et al. Safety and efficacy of bronchoalveolar lavage using a laryngeal mask airway in cases of acute hypoxaemic respiratory failure with diffuse lung infiltrates. Intern Med 2015;54:731-5. 10.2169/internalmedicine.54.2686 [PubMed] [CrossRef] [Google Scholar]
- Herrejón A, Simó M, Pérez ME, et al. Comparación de la presión arterialy transcutánea de oxígeno durante la fibrobroncoscopia. ArchBronconeumol 1989;25:80-3. 10.1016/S0300-2896(15)31767-1 [CrossRef] [Google Scholar]
- Golpe R, Mateos A. Supplemental oxygen during flexible bronchoscopy. Chest 2002;121:663-4. 10.1378/chest.121.2.664 [PubMed] [CrossRef] [Google Scholar]
- Credle WF, Jr, Smiddy JF, Shea DW, et al. Fiberoptic bronchoscopy in acute respiratory failure in the adult. N Engl J Med 1973;288:49-50. 10.1056/NEJM197301042880117 [PubMed] [CrossRef] [Google Scholar]
- Schnabel RM, van der Velden K, Osinski A, et al. Clinical course and complications following diagnostic bronchoalveolar lavage in critically ill mechanically ventilated patients. BMC Pulm Med 2015;15:107. 10.1186/s12890-015-0104-1 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Meduri GU, Turner RE, Abou-Shala N, et al. Noninvasive positive pressure ventilation via face mask. First-line intervention in patients with acute hypercapnic and hypoxemic respiratory failure. Chest 1996;109:179-93. 10.1378/chest.109.1.179 [PubMed] [CrossRef] [Google Scholar]
- Cracco C, Fartoukh M, Prodanovic H, et al. Safety of performing fiberoptic bronchoscopy in critically ill hypoxemic patients with acute respiratory failure. Intensive Care Med 2013;39:45-52. 10.1007/s00134-012-2687-9 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Hertz MI, Woodward ME, Gross CR, et al. Safety of bronchoalveolar lavage in the critically ill, mechanically ventilated patient. Crit Care Med 1991;19:1526-32. 10.1097/00003246-199112000-00015 [PubMed] [CrossRef] [Google Scholar]
- Prebil SE, Andrews J, Cribbs SK, et al. Safety of research bronchoscopy in critically ill patients. J Crit Care 2014;29:961-4. 10.1016/j.jcrc.2014.06.006 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Kalchiem-Dekel O, Shanholtz CB, Jeudy J, et al. Feasibility, safety, and utility of bronchoscopy in patients with ARDS while in the prone position. Crit Care 2018;22:54. 10.1186/s13054-018-1983-3 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Milman N, Munch E, Faurschou P, et al. Fiberoptic bronchoscopy in local anaesthesia. Indications, results and complications in 1323 examinations. Acta Endosc 1993;23:151-62. 10.1007/BF02969956 [CrossRef] [Google Scholar]
- O’Brien JD, Ettinger NA, Shevlin D, et al. Safety and yield of transbronchial biopsy in mechanically ventilated patients. Crit Care Med 1997;25:440-6. 10.1097/00003246-199703000-00012 [PubMed] [CrossRef] [Google Scholar]
- Pincus PS, Kallenbach JM, Hurwitz MD, et al. Transbronchial biopsy during mechanical ventilation. Crit Care Med 1987;15:1136-9. 10.1097/00003246-198712000-00013 [PubMed] [CrossRef] [Google Scholar]
- Bulpa PA, Dive AM, Mertens L, et al. Combined bronchoalveolar lavage and transbronchial lung biopsy: safety and yield in ventilated patients. Eur Respir J 2003;21:489-94. 10.1183/09031936.03.00298303 [PubMed] [CrossRef] [Google Scholar]
- Papin TA, Grum CM, Weg JG. Transbronchial biopsy during mechanical ventilation. Chest 1986;89:168-70. 10.1378/chest.89.2.168 [PubMed] [CrossRef] [Google Scholar]
- Faiz SA, Jimenez CA, Fellman BM, et al. Incidence of Bleeding Complications With Flexible Bronchoscopy in Cancer Patients With Thrombocytopenia. J Bronchology Interv Pulmonol 2019;26:280-6. 10.1097/LBR.0000000000000590 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Arcadu A, Moua T. Bronchoscopy assessment of acute respiratory failure in interstitial lung disease. Respirology 2017;22:352-9. 10.1111/resp.12909 [PubMed] [CrossRef] [Google Scholar]
- Tsao TC, Tsai YH, Lan RS, et al. Treatment for collapsed lung in critically ill patients. Selective intrabronchial air insufflation using the fiberoptic bronchoscope. Chest 1990;97:435-8. [PubMed] [Google Scholar]