COVID-19
Mối liên quan giữa cường độ thông gió với tỷ lệ tử vong trong 28 ngày ở Bệnh nhân COVID 19 bị suy hô hấp cấp: Thông tin chi tiết từ nghiên cứu PRoVENT – COVID
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Nhà thuốc Ngọc Anh – Bài viết Mối liên quan giữa cường độ thông gió với tỷ lệ tử vong trong 28 ngày ở Bệnh nhân COVID 19 bị suy hô hấp cấp: Thông tin chi tiết từ nghiên cứu PRoVENT – COVID do BS.Đặng Thanh Tuấn – BV Nhi Đồng 1 biên dịch, để tải file PDF bài viết xin vui lòng click vào link ở đây.
Tóm tắt
Bối cảnh
Cường độ thông khí, được phản ánh bởi áp lực đẩy (AP, driving pressure) và năng lượng cơ học (MP, mechanical power), có mối liên quan đến kết cục ở những bệnh nhân được thở máy xâm lấn có hoặc không có hội chứng suy hô hấp cấp (ARDS). Không chắc chắn liệu mối liên quan tương tự có tồn tại ở bệnh nhân do coronavirus 2019 (COVID-19) bị suy hô hấp cấp tính hay không.
Phương pháp
Chúng tôi nhằm mục đích điều tra tác động của cường độ thông khí đến kết quả của bệnh nhân. Nghiên cứu PRoVENT-COVID là một nghiên cứu quan sát đa trung tâm quốc gia trên bệnh nhân COVID-19 được thông khí xâm lấn. Các thông số về máy thở được thu thập vào một thời điểm cố định vào ngày dương lịch đầu tiên của quá trình thông khí xâm lấn. AP và MP động trung bình được tính toán cho từng bệnh nhân tại các thời điểm mà không có bằng chứng về nhịp thở tự phát. Mô hình nguy cơ tỷ lệ Cox và phân tích phân tầng kép được điều chỉnh cho các yếu tố gây nhiễu được sử dụng để ước tính các mối liên hệ độc lập của AP và MP với kết quả. Tiêu chí chính là tỷ lệ tử vong trong 28 ngày.
Kết quả
Trong 825 bệnh nhân được đưa vào phân tích này, tỷ lệ tử vong trong 28 ngày là 27,5%. AP không liên quan độc lập với tử vong (HR 1,02 [khoảng tin cậy 95% 0,88-1,18]; P = 0,750). Tuy nhiên, MP có liên quan độc lập với tỷ lệ tử vong trong 28 ngày (HR 1,17 [95% CI 1,01-1,36]; P = 0,031), và phần tư MP ngày càng tăng, được phân tầng theo mức AP tương đương, có nguy cơ tử vong 28 ngày cao hơn (HR 1,15 [KTC 95% 1,01¬1,30]; P = 0,028).
Kết luận
Trong nhóm thuần tập gồm những bệnh nhân suy hô hấp cấp tính được thở bằng COVID-19 bị bệnh nặng này, chúng tôi cho thấy mối liên quan độc lập giữa MP, nhưng không phải AP với tỷ lệ tử vong trong 28 ngày. MP có thể đóng vai trò là một dấu ấn sinh học tiên lượng ngoài AP ở những bệnh nhân này. Những nỗ lực nhằm hạn chế cả AP và MP có thể mang lại kết quả tốt hơn.
Giới thiệu
Tỷ lệ tử vong cao ở bệnh nhân do coronavirus 2019 (COVID-19) cần thông khí xâm nhập vì suy hô hấp cấp [1, 2]. Rất khó tiên lượng đầy đủ mặc dù rất cần thiết đối với việc xác định những bệnh nhân có nguy cơ tử vong cao, để xem xét các phương pháp tiếp cận thay thế với hy vọng cải thiện kết quả. Các nghiên cứu đã chỉ ra mối liên quan của một số yếu tố, như giới tính, tuổi, bệnh đi kèm, các dấu hiệu sinh hóa và mức độ nghiêm trọng của bệnh tật với tỷ lệ tử vong [3-11]. Các nghiên cứu cũng cho thấy mối liên hệ giữa các thông số khác nhau của thông khí xâm lấn, bao gồm mức độ giảm oxy máu, áp lực dương cuối thì thở ra (PEEP), thể tích khí lưu thông (VT) và độ giãn nở hệ thống hô hấp (Crs) với kết cục ở những bệnh nhân này [4, 5, 8-11].
Ở những bệnh nhân được thở máy vì lý do khác ngoài COVID-19, các nghiên cứu gần đây đã chỉ ra mối liên quan giữa áp lực đẩy (AP) và năng lượng cơ học (MP) của thông khí với tỷ lệ tử vong, cả ở bệnh nhân có và bệnh nhân không có hội chứng suy hô hấp cấp tính (ARDS) [12-20]. AP là áp lực do máy thở được sử dụng để cung cấp VT, như thể hiện sức căng tác dụng lên phổi trong mỗi lần thở. MP là giá trị tóm tắt cho lượng năng lượng trên một đơn vị thời gian được truyền từ máy thở đến hệ hô hấp [15], và một phần năng lượng này tác động trực tiếp lên mô phổi, nơi nó có thể gây hại. MP được tính từ VT, RR và AP. Hai thông số này là những dấu ấn sinh học hấp dẫn, bởi vì chúng có thể dễ dàng tính toán ở cạnh giường, sẵn có và không tốn kém.
Mối liên quan của AP và MP với kết cục ở bệnh nhân COVID-19 cần thông khí xâm nhập do suy hô hấp cấp vẫn chưa được nghiên cứu. Để điều tra tác động của cường độ thông khí lên tỷ lệ tử vong trong 28 ngày, chúng tôi đã thực hiện phân tích lập kế hoạch trước của một nhóm thuần tập đa trung tâm quốc gia có quy mô thuận tiện gồm các bệnh nhân COVID-19 được thông khí xâm lấn vì suy hô hấp cấp tính. Giả thuyết cho rằng cả AP và MP đều có mối liên hệ độc lập với tỷ lệ tử vong.
Phương pháp
Thiết kế
Báo cáo này liên quan đến phân tích thứ cấp được lập kế hoạch trước của nghiên cứu PRoVENT-COVID, một nghiên cứu quan sát hồi cứu, đa trung tâm, do điều tra viên khởi xướng về bệnh nhân COVID-19 được thở máy xâm nhập được thực hiện trong 3 tháng đầu tiên của đại dịch tại 22 ICU ở Hà Lan [8]. Đề cương nghiên cứu của nghiên cứu PRoVENT-COVID đã được xuất bản trước [21], và một kế hoạch phân tích thống kê cho phân tích hiện tại, được viết trước khi đánh giá cơ sở dữ liệu, có sẵn trên mạng [22]. Thông tin chi tiết về nghiên cứu dành cho thân nhân đã được công bố trước đây [8]. Hội đồng đánh giá thể chế của Amsterdam UMC, Amsterdam, Hà Lan, đã phê duyệt đề cương nghiên cứu, và nhu cầu được sự đồng ý của bệnh nhân đã được miễn khi xem thiết kế quan sát của nghiên cứu.
Người bệnh
Các bệnh nhân liên tiếp từ 18 tuổi trở lên đủ điều kiện tham gia nghiên cứu PRoVENT- COVID nếu được nhận vào một trong các ICU tham gia và đã được thông khí xâm nhập do suy hô hấp cấp do COVID-19. Nghiên cứu ban đầu không có tiêu chí loại trừ — đối với phân tích hiện tại, chúng tôi đã loại trừ những bệnh nhân có dữ liệu thông khí không đầy đủ để tính AP hoặc MP. Chúng tôi cũng loại trừ những bệnh nhân không theo dõi vào ngày 28.
Dữ liệu thu thập, phân loại và tính toán
Nhân khẩu học và dữ liệu về các bệnh nền và thuốc điều trị tại nhà đã được thu thập. Vào ngày lịch đầu tiên của thông khí xâm lấn, trong giờ đầu tiên sau khi đặt nội khí quản và sau đó cứ sau 8 giờ tại các thời điểm cố định, các thông số và cài đặt máy thở được thu thập.
Đầu tiên, người ta xác định xem có bằng chứng của việc thở tự phát hay không. Thở tự phát được coi là có khả năng xảy ra nếu: 1) bệnh nhân đang ở chế độ thông khí tự phát, ví dụ, thông khí hỗ trợ áp lực; hoặc 2) bệnh nhân đang ở chế độ thông khí không tự phát với RR đo được (tổng) vượt quá RR đặt > 2 nhịp thở mỗi phút. AP và MP chỉ được tính cho những thời điểm mà tại đó không có bằng chứng về nhịp thở tự phát. Mỗi thời điểm, AP và MP động được tính bằng các công thức tiêu chuẩn sau:
Dynamic AP (cmH2O) = áp lực đỉnh (Ppeak) – PEEP [12,16] (1)
MP (J/phút) = 0,098 * VT * RR * (Ppeak – 0,5 * AP) [15,16,23,24] (2)
AP và MP được tóm tắt là giá trị trung bình trong ngày thông khí đầu tiên theo lịch.
Kết cục
Kết cục chính là tử vong trong 28 ngày.
Phân tích thống kê
Các biến liên tục được báo cáo ở dạng trung vị (phần tư 25% – phần tư 75%) và được so sánh với các kiểm định tổng xếp hạng của Wilcoxon, và các biến phân loại theo số phần trăm và so với các kiểm định chính xác của Fisher.
Các biến có P <0,10 trong mô hình dự đoán đơn biến đã được chọn và đưa vào mô hình đa biến. Các biến có P <0,05 trong mô hình đa biến được chọn làm hiệp biến để đưa vào các mô hình cuối cùng. Các biến sau đây được xem xét để đánh giá ban đầu: tuổi, giới tính, chỉ số khối cơ thể, áp lực riêng phần của oxy động mạch/nồng độ oxy hít vào (PaO2/FiO2), creatinin huyết tương, tiền sử bệnh tăng huyết áp, suy tim, tiểu đường, bệnh thận mãn tính, bệnh phổi tắc nghẽn mãn tính, bệnh ác tính huyết học đang hoạt động và/hoặc khối u đặc đang hoạt động, sử dụng thuốc ức chế men chuyển, sử dụng thuốc chẹn thụ thể angiotensin II, sử dụng thuốc vận mạch hoặc thuốc co mạch, cân bằng dịch, pH, áp lực động mạch trung bình, nhịp tim, và độ giãn nở hệ thống hô hấp. Các hiệp biến cơ bản này được lựa chọn theo mức độ phù hợp lâm sàng và như đã được sử dụng trong nghiên cứu trước đó [8].
Một mô hình nguy cơ tỷ lệ Cox đa biến bao gồm các hiệp biến được chọn từ những mô tả ở trên và coi AP hoặc MP trung bình là yếu tố dự báo quan tâm đã được xây dựng. Để so sánh khả năng dự đoán tương đối của cả hai biến, một mô hình bổ sung đã được xây dựng bao gồm AP và MP cùng nhau, sau khi đánh giá tương quan và đa cộng tuyến thông qua hệ số tương quan của Pearson và hệ số lạm phát phương sai, tương ứng. Nếu tìm thấy đa cộng tuyến, mô hình này đã bị loại bỏ và chúng tôi theo dõi các mô hình độc lập cho AP và MP. Đối với tất cả các mô hình, tỷ lệ nguy hiểm (HR) với khoảng tin cậy (CI) 95% của nó đã được báo cáo. Để đánh giá thêm tác động của AP và MP, người ta đã tạo ra các nhóm ngũ phân vị tăng AP và MP, và các ước tính cho mỗi nhóm ngũ phân vị thu được từ mô hình trên được vẽ biểu đồ. Ngoài ra, một phân tích phân tầng kép đã được sử dụng để đánh giá tác động của từng biến khi biến khác được giữ không đổi. Đầu tiên, nhóm thuần tập được phân tầng thành sáu lượng tử AP và sau đó mỗi lượng tử lại được phân tầng thêm trong các phần tử của MP tăng dần. Các phần tư kết quả đã khớp với AP và tăng MP. Sau đó, các mô hình trên được tái tạo để rút ra tỷ lệ nguy hiểm cho từng phần tư. Tương tự, chiến lược tương tự cũng được thực hiện để tạo các phần tử có MP phù hợp và tăng AP.
Đường cong Kaplan – Meier được sử dụng để so sánh tỷ lệ tử vong trong 28 ngày giữa các bệnh nhân nhận AP và MP trung bình cao và thấp. Mức giới hạn được sử dụng cho AP được đặt ở 15 cmH2O [12, 16], mặc dù ngưỡng lý tưởng cho AP động ít chắc chắn hơn cho AP tĩnh. Giới hạn lý tưởng cho MP vẫn chưa được thiết lập, nhưng các báo cáo gần đây cho thấy giá trị 17J/phút có thể là ngưỡng hợp lý cho thông số này [13, 16, 25].
Hai phân tích độ nhạy đã được thực hiện. Đầu tiên, các mô hình được chạy lại theo mức độ giảm oxy máu vào ngày đầu tiên của thông khí xâm nhập. Đối với điều này, chúng tôi đã sử dụng các ngưỡng như được sử dụng trong định nghĩa Berlin cho ARDS: giảm oxy máu nhẹ (200 < PaO2/FiO2 < 300 mmHg), trung bình (100 < PaO2/FiO2 < 200 mmHg) và nặng (PaO2/FiO2 < 100 mmHg). Các mô hình được lặp lại xem xét sự tương tác giữa biến số quan tâm (AP hoặc MP) và mức độ giảm oxy máu tại thời điểm ban đầu. Thứ hai, các mô hình được chạy lại với một phương trình đã được xác nhận thay thế để tính MP ở những bệnh nhân được điều trị bằng thông khí có kiểm soát áp lực (PCV);
MPPCV (J/phút) = 0,098 * VT * RR * (AP + PEEP)
[26]. (3)
Tất cả các phân tích được thực hiện bằng R phiên bản 4.0.2 và P <0,05 là có ý nghĩa.
Kết quả
Người bệnh
Trong số 1102 bệnh nhân được ghi danh ban đầu trong nghiên cứu PRoVENT-COVID, 825 (74,9%) đã được sử dụng trong phân tích hiện tại (Tập tin bổ sung 1: Hình S1). Đặc điểm nhân khẩu học và đặc điểm thông khí được trình bày trong Bảng 1. Hầu hết bệnh nhân có ARDS mức độ trung bình, sử dụng phân loại mức độ nặng theo định nghĩa hiện tại của Berlin về ARDS. Các tình trạng tiền mắc bệnh phổ biến nhất là tăng huyết áp và đái tháo đường. 227 (27,5%) bệnh nhân tử vong trong 28 ngày đầu theo dõi. Các kết quả lâm sàng khác được trình bày trong Tệp bổ sung 1: Bảng S1.
AP và MP
Số lần quan sát trung bình trong ngày đầu tiên của thông khí xâm lấn mà tại đó dữ liệu thông khí được thu thập là 3 [2 đến 3]. Trong 88,2% [75 đến 100%] các quan sát trên mỗi bệnh nhân, không có bằng chứng về nhịp thở tự phát và AP và MP có thể được tính toán. Phân bố các thông số máy thở được trình bày trong tập tin bổ sung 1: Hình S2.
Trong ngày dương lịch đầu tiên của thông khí xâm nhập, AP trung vị là 14,0 [12,0 đến 16,0] cm H2O và MP trung vị là 18,5 [15,5 đến 22,2] J/phút. AP> 15 cm H2O ở 270 (32,7%) bệnh nhân; MP17 J/phút ở 473 (57,3%) bệnh nhân.
Mô hình nguy cơ cơ sở được sử dụng cho phân tích điều chỉnh được trình bày trong tệp Bổ sung 1: Bảng S2. Các biến sau đây được liên kết độc lập với kết quả và được chọn làm yếu tố gây nhiễu cho các mô hình cuối cùng: tuổi, bệnh phổi tắc nghẽn mãn tính, pH và nhịp tim. Không tìm thấy dấu hiệu đa cộng tuyến giữa AP và MP trong mô hình khi gộp cả hai biến lại với nhau, do đó, mô hình này không bị loại bỏ (Tệp bổ sung 1: Bảng S3).
Bảng 1: Đặc điểm cơ bản và kết quả lâm sàng của các bệnh nhân được thu nhận theo nhóm thuần tập được nghiên cứu
| Overall cohort (n = 825) | |
| Age, years | 65.0 (57.0-71.0) |
| Male gender – no (%) | 600 (72.7) |
| Body mass index, kg/m2 | 27.8 (25.2-30.8) |
| Transferred under invasive ventilation | 130 (15.8) |
| Days between intubation and admission | 0.0 (0.0-0.0) |
| Use of non-invasive ventilation prior to intubation – no (%) | 67/751 (8.9) |
| Duration of non-invasive ventilation, h | 6.5 (2.0-19.9) |
| Chest CT scan performed – no (%) | 268/799 (33.5) |
| Lung parenchyma affected – no (%) | |
| 0% | 13/268 (4.9) |
| 25% | 88/268 (32.8) |
| 50% | 78/268 (29.1) |
| 75% | 71/268 (26.5) |
| 100% | 18/268 (6.7) |
| Chest X-ray performed – no (%) | 454/525 (86.5) |
| Quadrants affected – no (%) | |
| 1 | 38/453 (8.4) |
| 2 | 108/453 (23.8) |
| 3 | 129/453 (28.5) |
| 4 | 178/453 (39.3) |
| Severity of ARDS – no (%) | |
| No | 9/813 (1.1) |
| Mild | 73/813 (9.0) |
| Moderate | 488/813 (60.0) |
| Severe | 243/813 (29.9) |
| Co-existing disorders – no (%) | |
| Hypertension | 279 (33.8) |
| Heart failure | 35 (4.2) |
| Diabetes | 191 (23.2) |
| Chronic kidney disease | 37 (4.5) |
| Baseline creatinine, gmol/L* | 78.0 (62.0-98.0) |
| Liver cirrhosis | 3 (0.4) |
| Chronic obstructive pulmonary disease | 68 (8.2) |
| Active hematological neoplasia | 12 (1.5) |
| Active solid neoplasia | 21 (2.5) |
| Neuromuscular disease | 3 (0.4) |
| Immunosuppression | 19 (2.3) |
| Previous medication – no (%) | |
| Systemic steroids | 31 (3.8) |
| Inhalation steroids | 92 (11.2) |
| Angiotensin converting enzyme inhibitor | 142 (17.2) |
| Angiotensin II receptor blocker | 90 (10.9) |
| Beta-blockers | 149 (18.1) |
| Insulin | 61 (7.4) |
| Metformin | 135 (16.4) |
| Statins | 251 (30.4) |
| Calcium channel blockers | 157 (19.0) |
| Vital signs at day 01 | |
| Heart rate, bpm** | 85.0 (74.5-97.8) |
| Mean arterial pressure, mmHg** | 80.5 (73.8-88.0) |
| Laboratory tests at day 01 | |
| pH** | 7.36 (7.31-7.41) |
| Worst PaO2/FiO2, mmHg*** | 123.9 (94.3-160.1) |
| PaCO2, mmHg** | 44.5 (39.5-50.3) |
| Lactate mmol/L** | 1.1 (0.9-1.4) |
| Organ support at day 01 – no (%) | |
| Continuous sedation | 790/823 (96.0) |
| Inotropic or vasopressor | 640/823 (77.8) |
| Vasopressor | 639/823 (77.6) |
| Inotropic | 41/823 (5.0) |
| Fluid balance, mL | 539.0 (0.0-1340.0) |
| Urine output, mL | 691.0 (380.0-1155.0) |
| Ventilation support at day 01 | |
| Assisted ventilation – no (%) | 151/823 (18.3) |
| Tidal volume, mL/kg PBW**,a | 6.4 (5.9-7.0) |
| Tidal volume < 8 mL/kg PBW | 787 (96.1) |
| PEEP, cmH2O**,a | 13.0 (11.0-14.7) |
| Peak pressure, cmH2O**,a | 27.0 (24.2-30.0) |
| Driving pressure, cmH2O**,a | 14.0 (12.0-16.0) |
| Driving pressure > 15 cmH2O | 270 (32.7) |
| Mechanical power | |
| Absolute, J/min**,a | 18.5 (15.5-22.2) |
| Mechanical power > 17 J/min | 473 (57.3) |
| Adjusted by compliance, (J/min)/(mL/cmH2O) | 0.57 (0.43-0.75) |
| Mechanical power > 0.23 (J/min)/(mL/cmH2O) | 510 (61.8) |
| Compliance, mL/cmH2O**-a | 32.1 (26.9-39.6) |
| Total respiratory rate, mpm**-a | 21.7 (19.8-24.0) |
| Set respiratory rate, mpm**-a | 22.0 (20.0-24.0) |
| Minute ventilation, L/min**-a | 9.5 (8.4-11.0) |
| FiO2** | 0.57 (0.48-0.68) |
| etCO2, mmHg** | 36.9 (33.0-42.0) |
| Rescue therapy at day 01 – no (%) | |
| Prone positioning | 263/811 (32.4) |
| Duration, h | 8.0 (4.0-13.0) |
| Recruitment maneuver | 14/667 (2.1) |
| ECMO | 4/810 (0.5) |
| Use of NMBA | 212/822 (25.8) |
| Hours of use | 0.0 (0.0-8.0) |
| Clinical outcome | |
| 28-day mortality | 227 (27.5) |
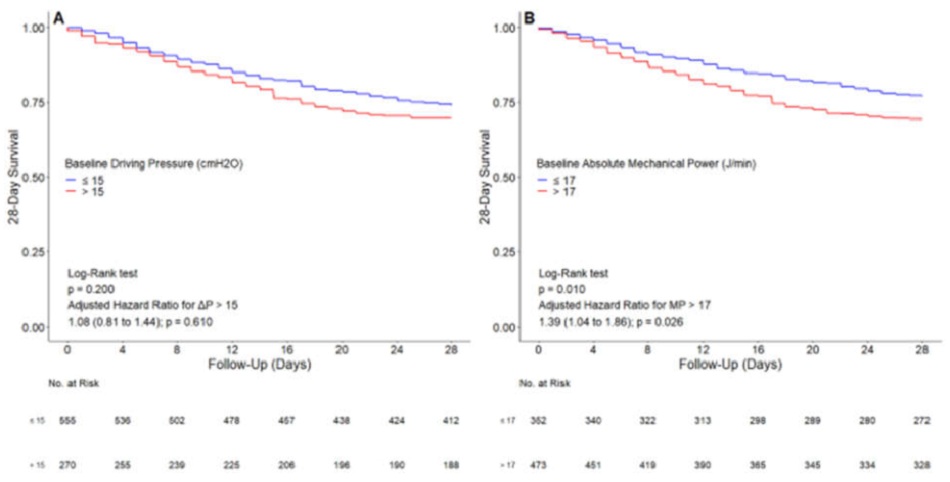
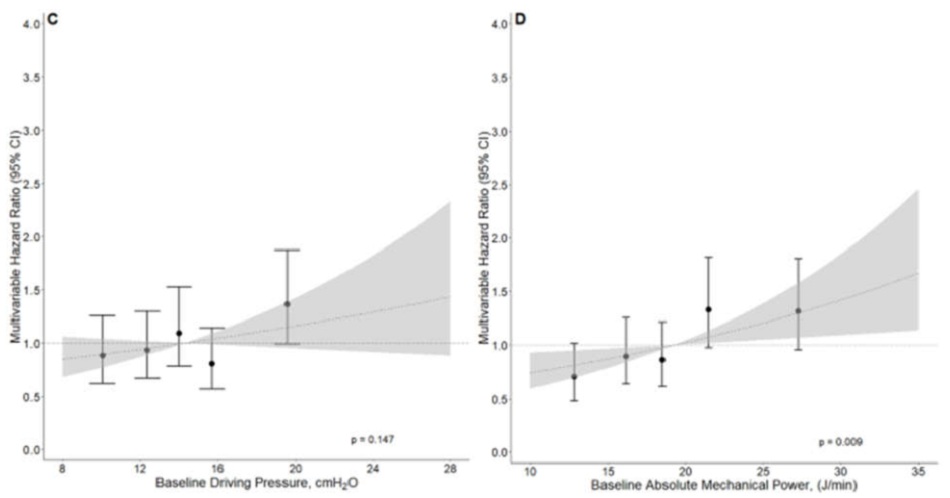
Hình 1: Mối liên hệ giữa áp lực đẩy và năng lượng cơ học và tỷ lệ tử vong trong 28 ngày. Đường cong Kaplan – Meier so sánh tỷ lệ tử vong trong 28 ngày của bệnh nhân thở máy với AP> 15 cmH2O so với AP < 15 cmH2O. Đường cong B Kaplan – Meier so sánh tỷ lệ tử vong trong 28 ngày của bệnh nhân thở máy với MP> 17 (J/phút) so với < 17 (J/phút). C và D Ảnh hưởng của việc tăng mức AP hoặc MP lên tỷ lệ tử vong trong 28 ngày. Vòng tròn và thanh lỗi là tỷ lệ nguy hiểm và khoảng tin cậy 95% cho 5 lượng tử tăng AP hoặc MP. Các đường đứt nét và vùng màu xám đại diện cho tỷ lệ nguy hiểm và khoảng tin cậy 95% cho các giá trị tăng dần của AP hoặc MP được phân tích như một biến liên tục và tập trung vào giá trị trung bình của mỗi biến. Tất cả các mô hình đều được điều chỉnh theo độ tuổi, bệnh phổi tắc nghẽn mãn tính, độ pH và nhịp tim. AP: áp lực đẩy; MP: năng lượng cơ học
Bảng 2: Mô hình đơn biến và đa biến đánh giá mối liên quan của áp lực đẩy cơ bản và năng lượng cơ học với tỷ lệ tử vong trong 28 ngày
| Univariable model | Multivariable model
for AP |
Multivariable model for MP | Multivariable model for AP and MP | |||||
| Hazard ratio (95%
CI) |
p value | Hazard ratio (95%
CI) |
p value | Hazard ratio (95%
CI) |
p value | Hazard ratio (95% CI) | p value | |
| Demographic
characteristics |
||||||||
| Age | 1.87 (1.58
2.21) |
<0.001 | 1.89 (1.58
2.25) |
<0.001 | 1.91 (1.60
2.28) |
<0.001 | 1.91 (1.61
2.28) |
<0.001 |
| Co-existing
disorders |
||||||||
| COPD | 1.81 (1.22
2.68) |
0.003 | 1.70 (1.14
2.53) |
0.009 | 1.78 (1.20
2.66) |
0.004 | 1.79 (1.20
2.68) |
0.004 |
| Laboratory tests at day 01 | ||||||||
| pH | 0.68 (0.60
0.76) |
<0.001 | 0.75 (0.65
0.87) |
<0.001 | 0.77 (0.66
0.89) |
<0.001 | 0.77 (0.66
0.89) |
<0.001 |
| Vital signs at day 01 | ||||||||
| Heart rate | 1.23 (1.08
1.41) |
0.001 | 1.17 (1.01
1.35) |
0.031 | 1.16 (1.01
1.34) |
0.035 | 1.16 (1.01
1.34) |
0.037 |
| Ventilatory variables at day 01 | ||||||||
| Driving pressure | 1.09 (0.96
1.24) |
0.190 | 1.10 (0.97
1.24) |
0.147 | – | – | 1.02 (0.88
1.18) |
0.750 |
| Absolute
mechanical power |
1.17 (1.02
1.33) |
0.020 | – | – | 1.18 (1.04
1.35) |
0.009 | 1.17 (1.01
1.36) |
0.031 |
Kết hợp của AP và MP với tỷ lệ tử vong trong 28 ngày
AP không có mối liên quan với tỷ lệ tử vong trong 28 ngày, không có mối liên hệ nào với một biến số (HR, 1,09 [95% CI, 0,96-1,24]; P = 0,190), cũng như trong đánh giá đa biến (HR, 1,02 [95% CI, 0,88-1,18 ]; P = 0,750) (Hình 1 và Bảng 2). Ngược lại, MP có mối liên quan với tỷ lệ tử vong trong 28 ngày, cả trong một biến số (HR, 1,17 [95% CI, 1,02 đến 1,33]; P = 0,020) và trong một đánh giá đa biến (HR, 1,17 [95% CI, 1,01 đến 1,36]; P = 0,031). Trong khi tỷ lệ tử vong trong 28 ngày không khác nhau giữa những bệnh nhân có AP> 15cm H2O so với < 15 cm H2O, tỷ lệ tử vong trong 28 ngày cao hơn ở những bệnh nhân có MP> 17 J/phút so với < 17 J/phút (Hình 1).
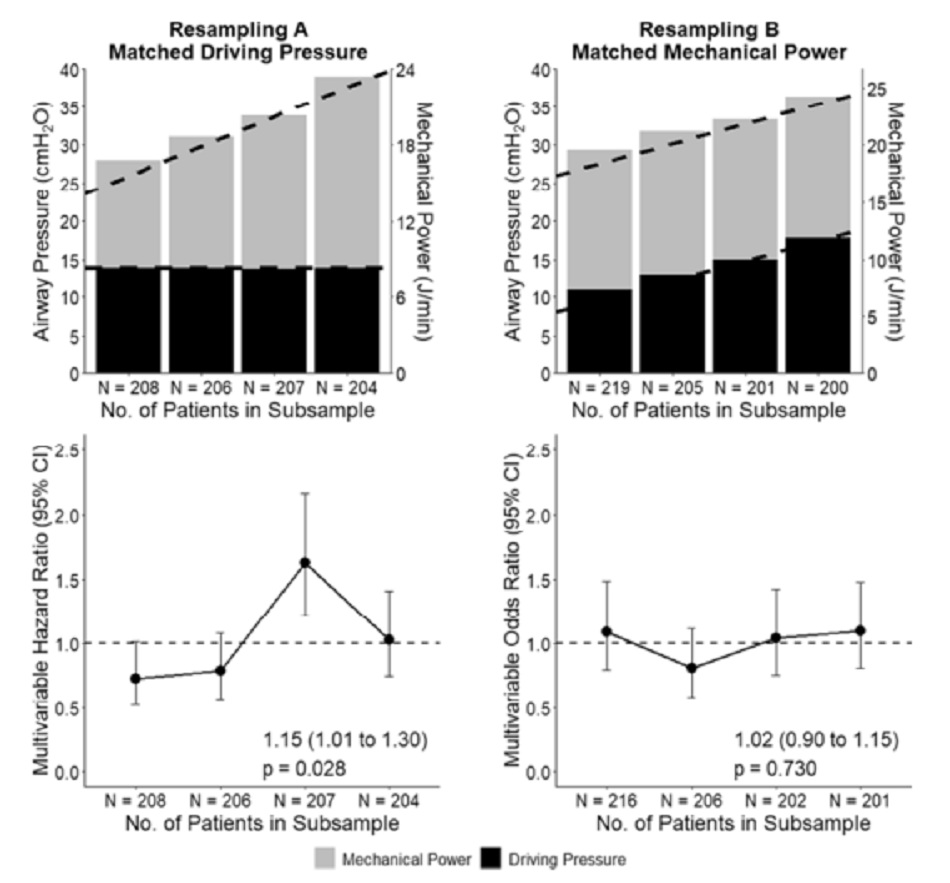
Nếu AP được giữ không đổi và chỉ MP tăng (tức là do sự gia tăng của các thành phần khác ngoài AP) thì ảnh hưởng có ý nghĩa thống kê đến kết quả được tìm thấy — tăng phần tư MP, phân tầng theo các mức AP tương đương, có liên quan đến tăng nguy cơ 28 tử vong theo ngày
(HR, 1,15 [95% CI, 1,01 đến 1,30]; P = 0,028) (Hình 2). Tuy nhiên, phần tư AP ngày càng tăng, được phân tầng theo các mức MP tương đương, không liên quan đến tỷ lệ tử vong trong 28 ngày (HR, 1,02 [95% CI, 0,90 đến 1,15]; P = 0,730). Không tìm thấy tương tác giữa tác dụng của AP hoặc MP trên tử vong 28 ngày và mức độ giảm oxy máu lúc ban đầu (Bảng 3). Phân tích độ nhạy sử dụng một phương trình thay thế cho MP ở bệnh nhân điều trị PCV không thay đổi kết quả (Tệp bổ sung 1: Bảng S4, Hình S2 và S3).
Hình 2: Tỷ lệ nguy cơ đối với tỷ lệ tử vong trong 28 ngày trên các phần tư liên quan của áp lực đẩy và năng lượng cơ học. A (trái) Các giá trị có thể so sánh được của AP, nhưng các giá trị của MP đang tăng dần qua các tầng. HR đa biến để tăng MP trên mỗi tầng được trình bày bên dưới. B (phải) Các giá trị có thể so sánh được của MP, nhưng các giá trị của AP đang tăng dần qua các tầng. HR đa biến để tăng AP trên mỗi tầng được trình bày dưới đây. Trục Y1 là áp lực đường thở; trục Y2 là năng lượng cơ học. Trục X báo cáo kích thước mẫu nhóm thuần tập. Vòng tròn và thanh lỗi trong bảng bên dưới là HR và khoảng tin cậy 95% cho các phần tư của AP tăng và MP phù hợp hoặc ngược lại. Tất cả các mô hình đã được điều chỉnh theo tuổi, bệnh phổi tắc nghẽn mãn tính, pH và nhịp tim
Bảng 3 Ảnh hưởng của áp lực đẩy và năng lượng cơ học đến tử vong 28 ngày theo mức độ nghiêm trọng của tình trạng giảm oxy máu lúc ban đầu
| Multivariable hazard ratio (95% CI) | P value | |
| Driving pressure | ||
| Mild ARDS | 1.66 (0.97-2.84) | Reference |
| Moderate ARDS | 1.01 (0.85-1.19) | 0.083 |
| Severe ARDS | 1.12 (0.89-1.40) | 0.173 |
| Mechanical power | ||
| Mild ARDS | 1.10 (0.59-2.05) | Reference |
| Moderate ARDS | 1.11 (0.94-1.29) | 0.899 |
| Severe ARDS | 1.30 (1.01-1.68) | 0.635 |
Thảo luận
Trong nghiên cứu quan sát này đánh giá mối liên quan của AP và MP trên tỷ lệ tử vong 28 ngày của bệnh nhân được thông khí xâm nhập do suy hô hấp cấp liên quan đến COVID-19, AP cao hơn thì không, nhưng MP cao hơn có liên quan đến tăng tỷ lệ tử vong 28 ngày sau khi điều chỉnh yếu tố gây nhiễu. Ngoài ra, khi AP được giữ không đổi, MP tăng dần, do sự gia tăng các thành phần khác, như VT hoặc RR, dẫn đến nguy cơ tử vong trong 28 ngày cao hơn.
So sánh nhóm thuần tập bệnh nhân của chúng tôi với bệnh nhân COVID-19 trong một loạt bệnh nhân trên toàn thế giới, các đặc điểm cơ bản và tỷ lệ tử vong trong 28 ngày là tương tự nhau [1, 11, 27-29]. Hai nghiên cứu quan sát lớn, bắt nguồn từ Pháp và từ Hoa Kỳ, đã báo cáo một AP trung vị tương tự, lần lượt là 13 [10 đến 17] và 15 [11 đến 18] cm H2O. Cho đến nay, MP chỉ được báo cáo trong một nhóm thuần tập của bệnh nhân COVID-19 [11], trong đó MP cao hơn nhiều so với nhóm của chúng tôi, 26,5 [18,6 đến 34,9] so với 18,5 [15,5 đến 22,2] J/phút. Vẫn chưa rõ tại sao chúng ta lại thấy sự khác biệt đáng kể này, vì cùng một phương trình cho MP đã được sử dụng. Tuy nhiên, MP trong nghiên cứu của chúng tôi có thể so sánh với MP được báo cáo trong nhóm bệnh nhân mắc ARDS từ nguồn gốc khác ngoài COVID-19 [13, 16, 19].
Đây là nghiên cứu đầu tiên về mối liên quan của AP và MP với tỷ lệ tử vong ở bệnh nhân COVID-19 được thở máy xâm lấn. Ngược lại với các nghiên cứu trước đây về AP và MP ở những bệnh nhân được thông khí vì nguyên nhân khác ngoài COVID-19, AP cao hơn không liên quan đến tăng nguy cơ tử vong. MP được điều chỉnh cho các yếu tố gây nhiễu có liên quan đến tỷ lệ tử vong trong 28 ngày, phù hợp với các nghiên cứu trước đây [13, 16, 19]. Hơn nữa, phần tư MP ngày càng tăng, được phân tầng dựa trên các mức AP tương đương, có liên quan đến tăng nguy cơ tử vong trong 28 ngày, cho thấy giá trị dự đoán của MP ngoài AP, phù hợp với một nghiên cứu trước đây ở bệnh nhân được thở máy vì một lý do khác ngoài COVID-19 [18]. Gần đây, một nghiên cứu đã chỉ ra tác dụng bất lợi của việc tiếp xúc với cường độ cao hơn của AP và MP theo thời gian ở những bệnh nhân bị bệnh nặng được thông khí do suy hô hấp do nguyên nhân khác ngoài COVID-19 [16].
Trong phân tích của chúng tôi, tín hiệu cho năng lượng cơ học mạnh hơn cho AP. Trong những năm gần đây, AP đã trở thành một giá trị được bác sĩ lâm sàng nhắm mục tiêu không vượt quá một giá trị nhất định. Điều này có thể do thực tế là năng lượng cơ học ở cạnh giường khó tính hơn AP. Do đó, điều này có thể dẫn đến các mức AP thấp hơn với phân bố hẹp trong nhóm thuần tập hiện tại và điều này có thể dẫn đến không đủ sức mạnh thống kê để kiểm tra xem AP có mối liên hệ thống kê với kết quả hay không. Trong nhóm thuần tập của chúng tôi, MP thường cao và có sự phân bổ rộng.
Mặc dù phát hiện ra rằng mối liên hệ của AP với tỷ lệ tử vong trong 28 ngày không đạt được ý nghĩa thống kê, AP vẫn là một dấu ấn sinh học kỹ thuật số quan trọng. Giới hạn AP được phát hiện có tiềm năng mạnh mẽ để cải thiện kết quả trong các nhóm bệnh nhân khác [13, 14, 16]. Bên cạnh đó, AP dễ tính hơn nhiều so với MP. Trong thực tế hàng ngày, MP có thể đóng vai trò như một dấu ấn sinh học kỹ thuật số bổ sung được tính toán và hiển thị trên màn hình của máy thở. Tuy nhiên, vẫn cần bằng chứng thử nghiệm ngẫu nhiên có đối chứng để hiểu giá trị thực sự và độc lập của giới hạn AP và MP.
Nhiều phương trình khác nhau để tính MP đã được nghiên cứu và báo cáo trong những năm gần đây [16-20, 25, 30]. Vì áp lực xuyên phổi và áp lực bình nguyên không được đo thường xuyên, chúng tôi sử dụng áp lực đẩy trong phương trình MP. Các phát hiện gần đây cho thấy rằng sự thay thế này là đáng tin cậy [30], và cách tiếp cận này đã được xác nhận khác [16]. Ngoài ra, việc sử dụng AP động giúp đơn giản hóa việc tính toán MP ở đầu giường. Phân tích độ nhạy, sử dụng một phương trình khác đã được xác nhận trước đó cho MP ở bệnh nhân điều trị PCV [26] đã không thay đổi kết quả.
Nghiên cứu của chúng tôi có một số điểm mạnh. Nghiên cứu có quy mô thuận tiện và bao gồm một số lượng lớn các trung tâm. Ngoài ra, cả trung tâm học thuật và phi học thuật đều tham gia, cải thiện tính tổng quát của các phát hiện của chúng tôi. Dữ liệu thông khí được thu thập bởi nhân viên nghiên cứu được đào tạo. Chúng tôi hạn chế phân tích ở những bệnh nhân không có bằng chứng về nhịp thở tự phát, vì cả AP và MP đều chưa thể được tính toán một cách đáng tin cậy ở những bệnh nhân thở tự phát, và chúng tôi tuân thủ kế hoạch phân tích thống kê được xuất bản trước.
Nghiên cứu của chúng tôi cũng có những hạn chế. Trong nghiên cứu này, chúng tôi không thu thập các dấu ấn sinh học trong máu, như nồng độ D-dimer, đã được chứng minh là có mối liên hệ chặt chẽ với tỷ lệ tử vong [10]. Do đó, chúng tôi không thể thêm chúng vào mô hình của mình. Tương tự, thuyên tắc phổi không được đưa vào các mô hình của chúng tôi, đây có thể là một yếu tố gây nhiễu, vì khoảng tử vong tăng lên có thể dẫn đến MP cao hơn. Hơn nữa, điểm số mức độ nghiêm trọng của bệnh không được bao gồm, vì các trung tâm tham gia sử dụng các điểm số khác nhau, không loại trừ lẫn nhau. Tuy nhiên, nhiều hiệp biến cơ bản đã được sử dụng trong các mô hình của chúng tôi, đại diện cho nhiều hệ thống cơ quan, phương pháp điều trị hỗ trợ và các bệnh đi kèm, phù hợp với các nghiên cứu trước đây điều tra tác động của AP và MP [16, 18, 19]. Ngoài ra, trong nửa đầu năm 2020, không có việc sử dụng dexamethasone hoặc tocilizumab tiêu chuẩn, có thể ảnh hưởng đến kết quả của bệnh nhân. Một hạn chế khác là việc bình thường hóa MP bằng cách độ giãn nở hệ thống hô hấp hoặc trọng lượng cơ thể dự đoán cho thấy giá trị dự đoán cao hơn so với MP không bình thường hóa [17]. Tuy nhiên, MP chuẩn hóa ít được xác nhận hơn so với MP tuyệt đối. Ngoài ra, không biết liệu mối quan hệ này có phản ánh nhiều hơn mối liên quan giữa độ giãn nở của hệ thống hô hấp và kết quả của bệnh nhân hay không.
Kết luận
Trong nhóm bệnh nhân COVID-19 này được thông khí xâm nhập vì suy hô hấp cấp, cả MP cao hơn và phần tư MP ngày càng tăng được phân tầng theo các mức AP tương đương đều có liên quan đến tăng nguy cơ tử vong trong 28 ngày. Kết hợp với nhau, cả AP và MP đều là các dấu ấn sinh học kỹ thuật số hữu ích để tiên lượng ở bệnh nhân COVID-19 được thở máy xâm lấn. Nhắm mục tiêu MP thấp hơn, ngoài AP thấp hơn, có thể mang lại kết quả tốt hơn.
Xem thêm: