Bệnh hô hấp
KỸ THUẬT SINH THIẾT PHỔI XUYÊN THÀNH NGỰC DƯỚI HƯỚNG DẪN CỦA CẮT LỚP VI TÍNH
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Bài viết KỸ THUẬT SINH THIẾT PHỔI XUYÊN THÀNH NGỰC DƯỚI HƯỚNG DẪN CỦA CẮT LỚP VI TÍNH – Tải file PDF Tại Đây.
Đổ Ngọc Cường, Nguyễn Vũ Đằng Trường Đại học Y Dược Cần Thơ
ĐẶT VẤN ĐỀ
Bệnh lý trong lồng ngực dưới dạng nốt nhỏ hay u ở phổi rất thường gặp trên lâm sàng. Việc xác định bản chất của những tổn thương này đôi khi khó khăn đối với các bác sĩ lâm sàng nội khoa và ngoại khoa, vì nguyên nhân gây tổn thương khá đa dạng, có thể là tổn thương lành tính hoặc ung thư phổi hoặc ung thư di căn từ cơ quan khác. Với mỗi nguyên nhân gây bệnh, việc điều trị và tiên lượng đặt ra ở từng trường hợp cũng có sự khác biệt lớn. Nhận diện được tổn thương phổi ác tính ở giai đoạn sớm góp phần làm cho kết quả điều trị khả quan hơn rất nhiều. Theo thống kê của Cơ quan Nghiên cứu Ung thư Quốc tế (International Agency for Research on Cancer – IARC) công bố những dữ liệu ung thư toàn cầu Globocan 2020, trên thế giới, ung thư phổi là bệnh ung thư thường gặp đứng hàng thứ hai sau ung thư vú ở nữ giới về số ca mắc mới, với hơn 2,2 triệu ca mắc mới hàng năm chiếm khoảng 11,4%, nhưng vẫn là nguyên nhân hàng đầu gây tử vong do ung thư (ước tính khoảng 1,8 triệu ca chiếm tỉ lệ khoảng 18%). Riêng tại Việt Nam, ung thư phổi là một trong những bệnh lý ác tính có số lượng người mắc và tỉ lệ tử vong hàng đầu trong các bệnh ung thư thường gặp ở cả hai giới với tỉ lệ mắc ung thư phổi xếp thứ hai trong số mười loại ung thư thường gặp (xếp sau ung thư gan) với 26.262 ca mắc mới và 23.797 ca tử vong vì căn bệnh này, trong đó tỉ lệ nam và nữ bị ung thư phổi lần lượt là 18,9% và 9,1% [1].
Thông thường, các tổn thương dạng u hay nốt nhỏ của lồng ngực trên bệnh nhân được phát hiện tình cờ hoặc đã có triệu chứng dựa vào X quang ngực. Phát hiện này làm cho thầy thuốc thường có sự lựa chọn chụp thêm cắt lớp vi tính (CT) hay chụp cắt lớp phát xạ positron (PET) ngực để đánh giá tổn thương, dù rằng trên hình ảnh CT hay PET có sự gợi ý lành hay ác tính nhưng tiêu chuẩn vàng để xác định và phân loại bệnh ác tính là phải lấy được mẫu trực tiếp từ mô tổn thương và phát hiện được tế bào ung thư trong mẫu mô qua kính hiển vi. Có nhiều cách thực hiện lấy mẫu bệnh phẩm từ những tổn thương ở phổi, trong đó nội soi phế quản và sinh thiết phổi xuyên thành ngực là được sử dụng nhiều nhất. Nội soi phế quản giúp tiếp cận các khối u trung tâm hoặc các tổn thương đã xâm lấn vào các nhánh phế quản trung tâm, sinh thiết phổi xuyên thành ngực giúp tiếp cận các khối ở ngoại vi [2].
Sinh thiết phổi xuyên thành ngực bằng kim dưới hướng dẫn của CT là một kỹ thuật lấy mẫu bệnh phẩm chẩn đoán tương đối mới tại Việt Nam và hiện đang được áp dụng rộng rãi tại các cơ sở y tế. Kỹ thuật này có thể giúp cho bác sĩ lấy được bệnh phẩm ở các tổn thương kích thước nhỏ nằm ở sâu hoặc vị trí nguy hiểm như trung thất, sát tim và các mạch máu lớn.
Câu hỏi đặt ra là sinh thiết phổi xuyên thành ngực bằng kim dưới hướng dẫn của CT có độ chính xác và độ an toàn như thế nào trong chẩn đoán bản chất khối u phổi? Do đó chúng tôi chọn chủ đề này để tìm hiểu và có nhận định tổng quan.
NỘI DUNG TỔNG QUAN
Lịch sử
Kỹ thuật dùng kim xuyên qua khoang liên sườn để lấy một mảnh mô bệnh từ tổn thương phổi ngoại vi đã được Graver L. P. và Binkley J. S. [3] cũng như Craver L. F. [4] mô tả và khuyến khích thực hiện từ những năm 1939-1940. Cũng trong năm 1940, Tripoli C. J. và Holland L. F. đã mô tả việc sử dụng kim sinh thiết Vim-Silverman cho thủ thuật này [5]. Năm 1954, sinh thiết lõi ở phổi đầu tiên được báo cáo bởi Dutra F. R. và Geraci C. L. [6]. Trong những năm sau đó, thủ thuật này đã đạt được nhiều thành công giai đoạn đầu trong chẩn đoán bệnh phổi ác tính khu trú, lành tính khu trú và lan tỏa [7], [8]. Ca sinh thiết phổi dưới hướng dẫn của CT đầu tiên được báo cáo bởi Haaga J. R. và Alfidi R. J. năm 1976 [9]. Kể từ đó, đã có sự cải tiến đáng kể về kỹ thuật và thiết bị được sử dụng cho quy trình kỹ thuật này. Với độ chính xác, độ nhạy và độ đặc hiệu chẩn đoán ngày càng cao để phát hiện khối u ác tính, sinh thiết phổi bằng kim xuyên thành ngực hiện nay là một công cụ không thể thiếu trong việc đánh giá các bất thường ở phổi.
Chỉ định
Sinh thiết phổi xuyên thành ngực được chỉ định cho các nốt hoặc khối ở phổi không xác định, đặc biệt là những khối có thể cần hóa trị hoặc xạ trị thay vì phẫu thuật và ở những bệnh nhân có tiền sử bệnh ác tính ngoài phổi. Liệu pháp nhắm trúng đích (targeted therapy) hiện đã trở thành một phương pháp quan trọng trong điều trị ung thư phổi, nên sinh thiết phổi bằng kim xuyên thành ngực cũng được thực hiện để lấy mô cho việc xét nghiệm phân tử, từ đó có thể tìm ra được những bệnh nhân hưởng được lợi ích từ phương pháp điều trị này. Nhiều nghiên cứu đã xác nhận rằng các đột biến thụ thể yếu tố tăng trưởng biểu bì (epidermal growth factor receptor – EGFR) gặp ở bệnh nhân ung thư phổi có thể được phát hiện từ các mẫu chọc hút bằng kim nhỏ, từ đó giúp bác sĩ điều trị xác định những bệnh nhân sẽ được hưởng lợi ích từ thuốc ức chế tyrosine kinase của EGFR [10], [11]. Tương tự, các thông tin khác, chẳng hạn như tình trạng thụ thể estrogen và progesterone của di căn ung thư vú, cũng có thể được xác định bằng sinh thiết phổi bằng kim xuyên thành ngực.
Kỹ thuật này cũng hữu ích giúp chẩn đoán phân biệt nhiễm trùng phổi khu trú hay u phổi. Các tổn thương trung thất, màng phổi và thành ngực cũng thường được tiếp cận bằng sinh thiết kim.
Chống chỉ định
Rối loạn đông máu là chống chỉ định tương đối. Các chỉ số đông máu, bao gồm thời gian protrombin (PT), thời gian thromboplastin từng phần được hoạt hóa (APTT), số lượng tiểu cầu, INR (international normalized ratio) cần được làm xét nghiệm trước khi làm thủ thuật. Bệnh nhân có số lượng tiểu cầu trước thủ thuật < 100.000/ml và tỉ lệ APPT hoặc tỉ lệ PT > 1,4 cần được tư vấn của bác sĩ huyết học và đây là chống chỉ định tương đối cho thủ thuật [12]. Ở những bệnh nhân đang dùng thuốc kháng chống kết tập tiểu cầu, chỉ có thể tiếp tục dùng aspirin nếu đang sử dụng và nên ngừng sử dụng các thuốc kháng chống kết tập tiểu cầu khác trước thủ thuật và có thể sử dụng lại trong vòng 48 giờ sau thủ thuật. Ở những bệnh nhân đang dùng thuốc chống đông máu như warfarin, nên ngừng điều trị ít nhất 5 ngày trước khi thực hiện thủ thuật [13]. Nên ngừng một liều heparin trọng lượng phân tử thấp trước khi làm thủ thuật. Cần thực hiện các bước để điều chỉnh INR > 1,5 bằng cách sử dụng huyết tương tươi đông lạnh hoặc vitamin K. Khuyến cáo truyền tiểu cầu khi số lượng tiểu cầu < 50.000/pL [14].
Đối với bệnh nhân có FEV < 35% được đánh giá bằng kiểm tra chức năng hô hấp gần đây nên được hội chẩn kỹ lưỡng giữa các bác sĩ chuyên khoa, tối thiểu là giữa bác sĩ chẩn đoán hình ảnh và bác sĩ chuyên khoa hô hấp để đánh giá rủi ro so với lợi ích của việc tiếp tục thực hiện thủ thuật. Phải có sẵn các phim X quang gần đây cũng như trước đó để quyết định liệu thủ thuật này có mang lại lợi ích hay không [12].
Tuy nhiên, ngay cả khi tổn thương phù hợp để sinh thiết phổi bằng kim xuyên thành ngực, vẫn có những chống chỉ định tương đối với thủ thuật này như trong những trường hợp bệnh nhân không hợp tác (trạng thái tâm thần thay đổi, ho khó chịu), đang thở máy (thông khí áp lực dương), suy hô hấp nghiêm trọng (như trường hợp bị khí thũng nặng, đã phẫu thuật cắt phổi đối bên, bệnh phổi kẽ nặng), tăng áp động mạch phổi, tổn thương nhỏ (< 1 cm) sát cơ hoành và tổn thương trung tâm gần những mạch máu lớn hoặc các cơ quan trong trung thất [15], [16].
Phân loại
Theo truyền thống, vị trí kim được xác định bằng cách thực hiện chụp CT thông thường chụp từng hồi hoặc CT tluoroscopy. Sinh thiết dưới hướng dẫn của CT tluoroscopy cho phép thủ thuật viên quan sát rõ vị trí kim theo thời gian thực trong nhu mô phổi đến vị trí tổn thương cần sinh thiết và đã được báo cáo là có hiệu suất chẩn đoán cao, giúp thủ thuật viên kiểm soát tốt hơn kim sinh thiết, từ đó giảm đáng kể được biến chứng xảy ra. Ngoài ra có thể thấy hình ảnh kim sinh thiết liên tục trong ngực bệnh nhân theo thời gian thực nên thủ thuật viên tự tin hơn đáng kể trong quá trình thực hiện. Khi chụp CT thông thường thường được giới hạn khu trú ở vùng phổi cần sinh thiết và có thể sử dụng kỹ thuật liều tia thấp thiết lập trên máy để giảm liều tia bức xạ (tia X) cho bệnh nhân. Khi chụp CT thông thường từng hồi, thủ thuật viên sẽ rời khỏi phòng CT và do đó không tiếp xúc với tia bức xạ. Tuy nhiên sinh thiết dưới hướng dẫn CT thông thường làm kéo dài thời gian làm thủ thuật lên đáng kể, trong khi thời gian can thiệp trong sinh thiết dưới hướng dẫn của CT fluoroscopy ngắn hơn do thủ thuật viên không rời khỏi phòng CT trong suốt quá trình sinh thiết. Do phải ở xuyên suốt trong phòng CT như thế nên sinh thiết dưới hướng dẫn của CT fluoroscopy đã được báo cáo khiến cả thủ thuật viên và bệnh nhân nhiễm tia bức xạ đáng kể so với chụp CT thông thường. Liều tia bức xạ đối với thủ thuật viên là điều cần quan tâm, đặc biệt là bàn tay của thủ thuật viên nằm trong chùm tia bức xạ trong quá trình thực hiện. So với CT tluoroscopy, sinh thiết dưới hướng dẫn của CT thông thường làm giảm liều tia bức xạ đáng kể do có kỹ thuật liều tia thấp và chụp ngắt quãng, khu trú tổn thương.
Một nghiên cứu tiến cứu của Kim G. R. và cộng sự đã đánh giá liều bức xạ, tỉ lệ biến chứng và độ chính xác trong chẩn đoán của các thủ thuật sinh thiết chọc hút bằng kim nhỏ dưới hướng dẫn của CT đối với các tổn thương phổi được thực hiện có hoặc không có CT fluoroscopy. Tổng cộng có 142 bệnh nhân được chia thành 2 nhóm, nhóm 1 có 72 bệnh nhận được sinh thiết chọc hút bằng kim nhỏ dưới hướng dẫn của CT fluoroscopy, nhóm 2 có 70 bệnh nhân sử dụng kỹ thuật CT thông thường. Kết quả ghi nhận liều hiệu dụng ước tính trung bình đối với bệnh nhân (6,53 mSv ở nhóm 1 và 2,72 mSv ở nhóm 2, p < 0,001) và bác sĩ (0,054 mSv ở nhóm 1 và 0,029 mSv ở nhóm 2, p < 0,001), có sự khác nhau đáng kể giữa các nhóm. Hơn nữa, tỉ lệ biến chứng khác biệt đáng kể giữa hai nhóm bệnh nhân là 13,4% so với 31,4% (p = 0,012). CT tluoroscopy ít biến chứng hơn so với CT thông thường chủ yếu là thời gian thực hiện ngắn hơn và ít kim đâm hơn. Độ nhạy, độ đặc hiệu và độ chính xác lần lượt là 97,8%, 100%, 98,4% ở nhóm 1 và 95,3%, 100%, 89,5% ở nhóm 2, sự khác biệt không có ý nghĩa nghĩa thống kê (p > 0,05) [17]. Prosch H. và cộng sự (2012) cũng đã chứng minh so với CT fluoroscopy hiệu quả chẩn đoán của kỹ thuật sinh thiết dưới hướng dẫn của CT đa lát là khác biệt không đáng kể, độ nhạy 95,9% so với 95,5%, độ đặc hiệu 95,5% so với 96,7%, giá trị tiên đoán âm 84% so với 87,9% và giá trị tiên đoán dương 98,9% so với 98,8% [18].
Hiện cũng chưa có khuyến nghị nhất định nào cho việc lựa chọn hướng dẫn sinh thiết dưới CT thông thường hay CT fluoroscopy. Việc lựa chọn tùy thuộc vào sự cân nhắc ưu, nhược điểm của từng kỹ thuật và thói quen của thủ thuật viên.
Lựa chọn kim sinh thiết
Có nhiều lựa chọn để thực hiện sinh thiết bằng kim xuyên thành ngực bao gồm kim hút và kim cắt. Lựa chọn kim được dựa trên tiền sử bệnh nhân, vị trí, kích thước của tổn thương, quỹ đạo kim dự kiến và quan trọng là thông tin cần tìm từ mẫu mô. Tình trạng đông máu, sự gần các cấu trúc quan trọng và thói quen của thủ thuật viên cũng đóng một vai trò trong việc lựa chọn kim. Những kim này có thể được sử dụng một mình hoặc đồng trục với kim dẫn hướng khi cần lấy nhiều mẫu mô. Chẩn đoán mô học có thể được xác định chính xác trong hầu hết các trường hợp bằng kim sinh thiết từ 18 đến 20G.
Kim hút thường được sử dụng để lấy mẫu chủ yếu cho phân tích tế bào học. Những kim này là kim vát đơn giản có kích thước nhỏ hơn và có cạnh không cắt được. Cơ chế lấy mẫu bằng kim hút là chuyển động qua lại nhanh chóng đồng thời xoay trong mô/tổn thương và áp dụng lực hút bằng ống tiêm. Chuyển động này được tiếp tục tối đa mười lần hoặc cho đến khi lấy được máu ở trục kim. Lực hút của ống tiêm được giải phóng khi kim được rút ra để lấy mẫu xét nghiệm tế bào học. Một số kim hút được sử dụng phổ biến hơn bao gồm Chiba, Franseen, Westcott, MaxiCELL, Greene và Turner (Hình 1).
Kim cắt được thiết kế đặc biệt để cung cấp mẫu cho phân tích mô học thay vì đánh giá tế bào học. Những chiếc kim này loại bỏ các mảnh mô nhỏ (< 0,1-0,4 mm) thay vì tế bào. Các cơ chế cắt khác nhau bao gồm kim cắt đầu và kim cắt bên. Kim cắt bên thường có tác dụng tốt nhất với các khối mô mềm, trong khi kim cắt đầu có tác dụng tốt với các tổn thương rắn hơn.
Một trong những loại kim được sử dụng phổ biến nhất cho sinh thiết lõi hiện nay là kim Tru-Cut (Hình 2). Nó là một kim cắt bên bao gồm một ống cắt bên ngoài và một kim định hình có rãnh bên trong. Sau khi đưa đầu kim vào mép mô cần lấy mẫu, kim định hình có rãnh bên trong được đưa vào và tiếp theo là ống cắt bên ngoài, cắt một mảnh mô đang được lấy mẫu. Kim có thể thiết kế dạng thủ công, bán tự động hoặc tự động hoàn toàn.
Hiện nay, hầu hết việc sinh thiết phổi xuyên thành ngực thực hiện bằng các thiết bị sinh thiết tự động hoặc bán tự động được gọi là “súng sinh thiết” với kỹ thuật đồng trục bao gồm việc đặt kim dẫn vào vị trí sinh thiết và đủ rộng để đưa kim sinh thiết thực sự đi qua để lấy mẫu với số lần cần thiết, qua đó giảm được số lần phải đâm kim nhiều lần vào phổi, giảm được tỉ lệ biến chứng [19], [20]. Khi được thực hiện đúng kỹ thuật, quy trình này tương đối an toàn với độ chính xác chẩn đoán tương đương với sinh thiết phổi mở [20].


Chuẩn bị trước sinh thiết
Vì sinh thiết phổi dưới hướng dẫn của CT là một thủ thuật xâm lấn có khả năng xảy ra các biến chứng, bao gồm cả tử vong [21], [22], nên việc bệnh nhân và gia đình hiểu rõ về thủ thuật cũng như các rủi ro tiềm ẩn là rất quan trọng. Tất cả bệnh nhân phải được tư vấn về mục đích, tính hữu ích và phương pháp thực hiện sinh thiết; các biến chứng có thể xảy ra như tràn khí màng phổi, xuất huyết và tắc mạch khí và cách điều trị các biến chứng này. Hướng dẫn của Hiệp hội Lồng ngực Anh gợi ý thêm “Người thực hiện nên kiểm tra quá trình thực hành của mình và theo dõi tỉ lệ biến chứng để thông báo cho bệnh nhân trước khi bệnh nhân đưa ra sự đồng ý” [12]. Thủ thuật chỉ được thực hiện khi có sự đồng ý bằng văn bản của bệnh nhân và người nhà sau khi đã được nghe thủ thuật viên giải thích rõ.
Thực hiện thủ thuật
Thiết lập một đường truyền tĩnh mạch và truyền dung dịch phù hợp theo yêu cầu của bác sĩ trong suốt quá trình làm thủ thuật. Cũng cần thiết cho bệnh nhân thở oxy đều đặn khoảng 2 lít/phút qua cannula mũi. Lấy các dấu hiệu sinh tồn cơ bản và đánh giá trước khi bắt đầu thủ thuật. Cần phải theo dõi tim mạch liên tục trong suốt quá trình thủ thuật theo từng phác đồ của cơ sở bệnh viện. Ngoài ra, bệnh nhân có thể được yêu cầu thực hiện bài tập nín thở trước khi bắt đầu sinh thiết.
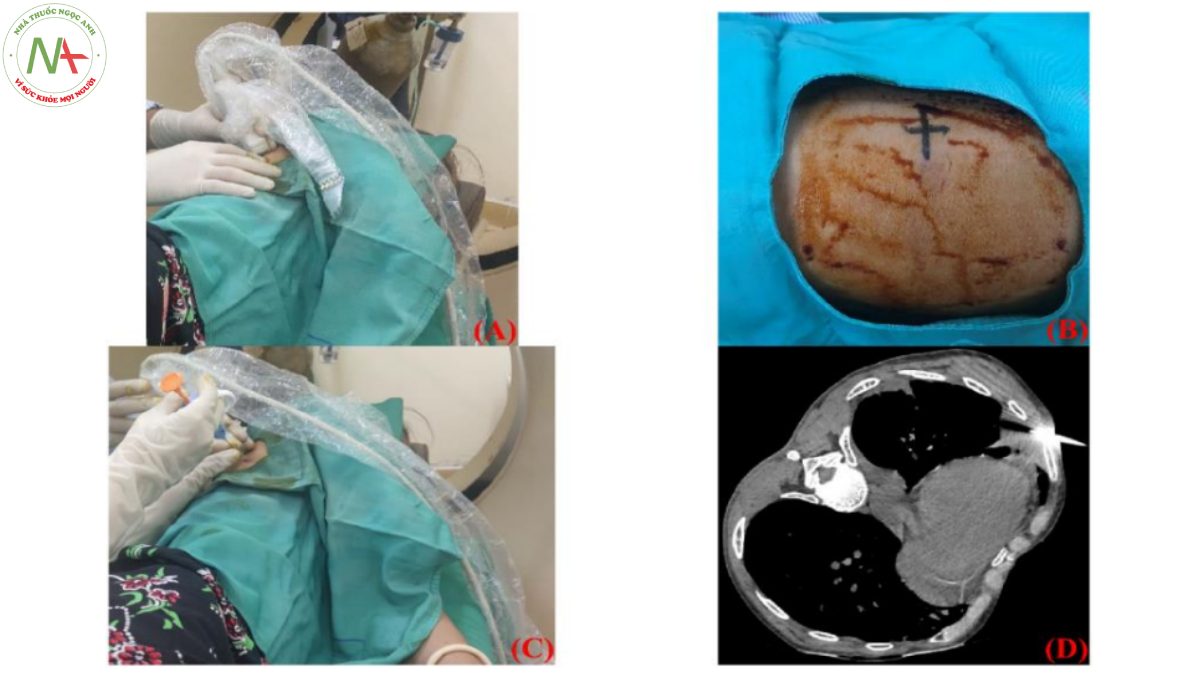
Sau khi xem xét hình ảnh CT, cần lựa chọn tư thế cơ thể của bệnh nhân thích hợp, bệnh nhân nên được đặt ở tư thế nằm sấp, nằm ngửa hoặc nằm nghiêng để việc chọc kim vào phổi được thực hiện an toàn bằng đường vào đến tổn thương ngắn nhất có thể. Điểm đâm kim, hướng và khoảng cách tiếp cận được lên kế hoạch cho quá trình làm thủ thuật. Đường kim sinh thiết cần tránh kén khí lớn, các rãnh phổi, mạch máu nhìn thấy và tiểu phế quản bất cứ khi nào có thể. Da của bệnh nhân được sát trùng bằng povidine. Dung dịch lidocain 1% để gây tê cục bộ được tiêm dưới da lên bề mặt màng phổi. Kim sinh thiết được đưa vào tổn thương dưới sự hướng dẫn của CT thông thường có thể kết hợp kèm siêu âm hoặc CT tluoroscopy (Hình 3). Ngay sau khi sinh thiết, rút kim từ từ và đắp gạc lên da. Các mẫu mô bệnh phẩm thu được ngay lập tức được ngâm trong dung dịch formalin 10% [23], [24]. Đánh giá chất lượng mẫu đại thể, gởi về khoa/phòng giải phẫu bệnh khi đã đạt và đủ số lượng mẫu.
Hình 3. Bệnh nhân nằm tư thế thích hợp, trải khăn lỗ, sát trùng và đánh dấu định vị vị trí sẽ chọc kim sinh thiết (A, B), gây tê và thực hiện chọc kim dẫn vào tổn thương phổi dưới hướng dẫn của CT có thể kết hợp thêm siêu âm để định hướng tốt hơn (C, D).
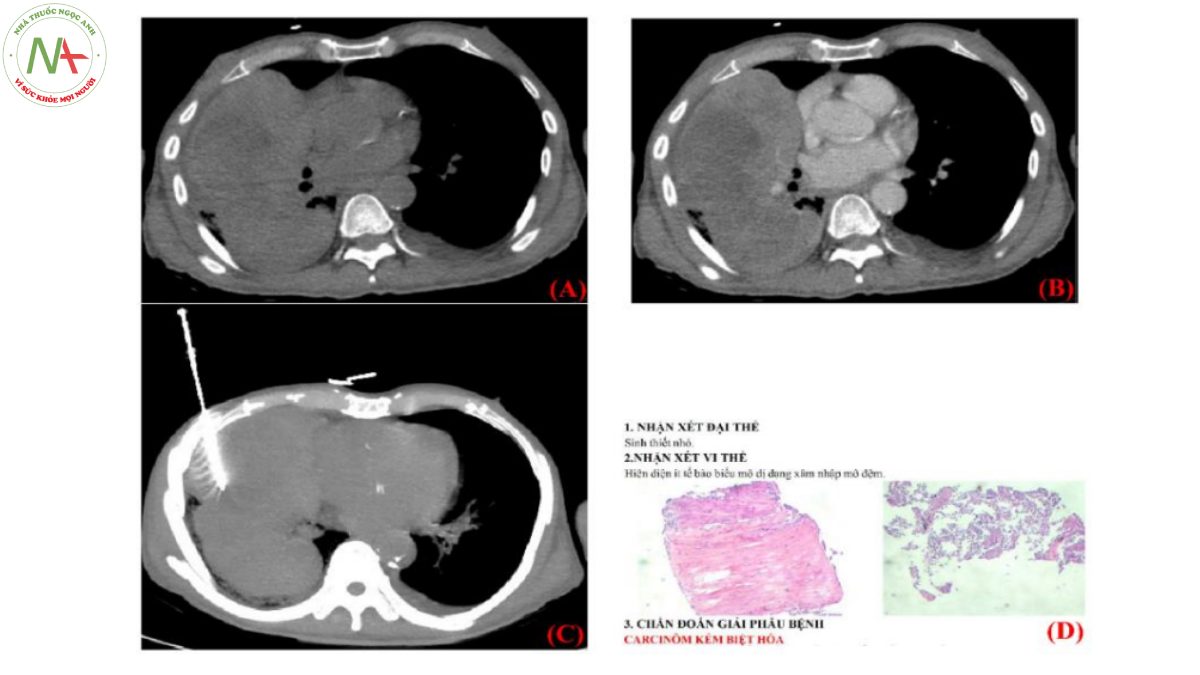
Hình 4. Bệnh nhân có khối tổn thương lớn ở phổi phải nghi ngờ tổn thương ác tính sau khi chụp CT ngực có tiêm thuốc tương phản (A, B) nên tiến hành sinh thiết phổi dưới hướng dẫn CT và có kết quả giải phẫu bệnh xác định là ung thư phổi (C, D)
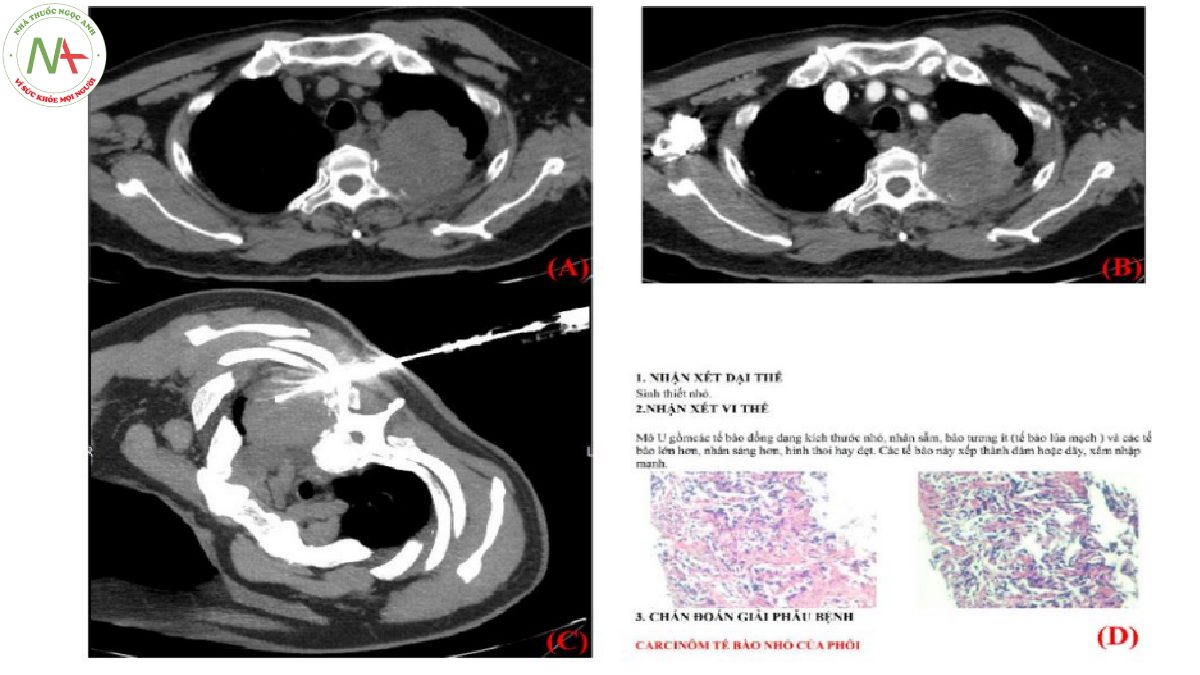
Hình 5. Bệnh nhân có khối tổn thương ở thùy trên phổi trái nghi ngờ tổn thương ác tính sau khi chụp CT ngực có tiêm thuốc tương phản (A, B) nên tiến hành sinh thiết phổi dưới hướng dẫn CT và có kết quả giải phẫu bệnh xác định là ung thư phổi (C, D)
Chăm sóc sau sinh thiết
Cần chụp CT toàn bộ lồng ngực để phát hiện các biến chứng như tràn khí màng phổi, xuất huyết hoặc bóng khí trong tuần hoàn hệ thống. Tất cả các triệu chứng như ho, chảy máu, khó chịu ở ngực và những thay đổi trong kết quả theo dõi tim mạch, hô hấp cần phải được đánh giá kỹ lưỡng [25], [26].
Biến chứng
Hầu hết các biến chứng xảy ra ngay lập tức hoặc trong vòng một giờ đầu sau khi sinh thiết và chúng có thể được điều trị bảo tồn, thường là điều trị ngoại trú. Các biến chứng thường gặp bao gồm tràn khí màng phổi, chảy máu cục bộ và ho ra máu. Các biến chứng hiếm gặp bao gồm tụ máu thành ngực, tràn máu màng phổi, xuất huyết, gieo rắc tế bào u và tắc mạch do khí.
Choi C. M. và cộng sự (2004) đã báo cáo tỉ lệ tràn khí màng phổi sau khi sinh thiết phổi dưới hướng dẫn CT từ 9-54%, tỉ lệ trung bình là 20% [27]. Có khoảng 5-18% sẽ phải đặt ống dẫn lưu màng phổi và nằm viện kéo dài [28]. Các yếu tố khiến bệnh nhân dễ bị tràn khí màng phổi sau khi sinh thiết bao gồm kích thước tổn thương, sự hiện diện của kén khí to, khí thũng, bệnh phổi kẽ, chiều dài đường kim trong phổi, khoảng cách đến bề mặt màng phổi, số lần kim đi qua, tiền sử phẫu thuật phổi cùng bên, và khả năng hợp tác của bệnh nhân trong quá trình thực hiện thủ thuật. Khi tư vấn, cần cân nhắc các lựa chọn kỹ thuật sinh thiết khác thay thế cho đường qua da xuyên thành ngực khi có bệnh lý tiềm ẩn khiến bệnh nhân gặp nguy hiểm, chẳng hạn sinh thiết qua nội soi phế quản và sinh thiết qua phẫu thuật lồng ngực [28], [29].
KẾT LUẬN
Sinh thiết phổi xuyên thành ngực dưới hướng dẫn của CT là phương pháp xâm lấn tối thiểu, khá an toàn và hiệu quả để chẩn đoán mô bệnh học cho các tổn thương và/hoặc khối ở phổi. Cần lập kế hoạch cẩn thận trước thủ thuật, chuẩn bị bệnh nhân và tuân thủ quy trình thủ thuật nghiêm ngặt có thể giảm thiểu rủi ro liên quan đến sinh thiết phổi. Tuy nhiên, điều quan trọng là phải tư vấn một cách đầy đủ, rõ ràng về thủ thuật cũng như biến chứng có thể xảy ra và có sự đồng ý của bệnh nhân trước khi thực hiện.
TÀI LIỆU THAM KHẢO
- Sung H., Ferlay J., Siegel R. L., Laversanne M., Soerjomataram I., et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. A Cancer Journalfor Clinicians. 71(3), 209-249, doi: 10.3322/caac.21660.
- Nakamura K., Matsumoto K., Inoue C., Matsusue E. and Fujii S. Computed Tomography-guided Lung Biopsy: A Review of Techniques for Reducing the Incidence of Complications. Interventional radiology (Higashimatsuyama-shi (Japan). 2021. 6(3), 83-92, doi:10.22575/interventionalradiology.2021-0012.
- Graver L. P. and Binkley J. S. Aspiration biopsy of tumors of the lung. Journal of Thoracic Surgery. 8(4), 436-463, doi: 10.1016/S0096-5588(20)32086-9.
- Craver L. F. Diagnosis of malignant lung tumors by aspiration biopsy and by sputum examination. Surgery. 1940. 8(6), 947-960.
- Tripoli C. J. and Holland L. F. Carcinoma of the lung: Analysis of 195 cases with special note on needle puncture biopsy. South Medical Journal. 33, 559-565.
- Dutra F. R. and Geraci C. L. Needle biopsy of the lung. Journal of the American Medical Association. 155(1), 21-24, doi: 10.1001/jama.1954.03690190027008.
- Youmans C. R. Jr., De Groot W. J., Marshall R., Morettin L. B. and Derrick J. R. Needle biopsy of the lung in diffuse parenchymal disease An analysis of 151 cases. Annals of Surgery. 120(5), 637-643, doi: 10.1016/s0002-9610(70)80184-2.
- Zavala D. C. and Bedell G. N. Percutaneous lung biopsy with a cutting needle. An analysis of 40 cases and comparison with other biopsy techniques. American Review of Respiratory Disease. 106(2), 186-193, doi: 10.1164/arrd.1972.106.2.186.
- Haaga J. R. and Alfidi R. J. Precise biopsy localization by computer tomography. Radiology. 1976. 118(3), 603-607, doi: 10.1148/118.3.603.
- Otani H., Toyooka S., Soh J., Yamamoto H., Suehisa H., et al. Detection of EGFR gene mutations using the wash fluid of CT-guided biopsy needle in NSCLC patients. Journal of thoracic oncology : official publication of the International Association for the Study of Lung Cancer. 2008. 3(5), 472-476, doi: 10.1097/JTO.0b013e31816de2cd.
- Smouse J. H., Cibas E. S., Jănne P. A., Joshi V. A., Zou K. H., et al. EGFR mutations are detected comparably in cytologic and surgical pathology specimens of nonsmall cell lung cancer. Cancer. 2009. 117(1), 67-72, doi: 10.1002/cncy.20011.
- Manhire A., Charig M., Clelland C., Gleeson F., Miller R., et al. Guidelines for radiologically guided lung biopsy. 2003. 58(11), 920-936, doi: 10.1136/thorax.58.11.920.
- Aktaặ A. R., Gỏzlek E., Yilmaz 0., Kayan M., ủnlũ N., et al. CT-guided transthoracic biopsy: histopathologic results and complication rates. Diagnostic and interventional radiology (Ankara, Turkey). 21(1), 67-70, doi: 10?5152/dir.2014.140140.
- Malloy P. C., Grassi C. J., Kundu S., Gervais D. A., Miller D. L., et al. Consensus guidelines for periprocedural management of coagulation status and hemostasis risk in percutaneous image-guided interventions. Journal of vascular and interventional radiology : JVIR. 20(7 Suppl), S240-249, doi: 10.1016/j.jvir.2008.11.027.
- Wu C. C., Maher M. M. and Shepard J. A. CT-guided percutaneous needle biopsy of the chest: preprocedural evaluation and technique. American Journal of Radiology. 196(5), W511- W514, doi: 10.2214/ajr.10.4657.
- Winokur R. S., Pua B. B., Sullivan B. W. and Madoff D. C. Percutaneous lung biopsy: technique, efficacy, and complications. Seminars in Interventional Radiology. 30(2), 121-127, doi: 10.1055/s-0033-1342952.
- Kim G. R., Hur J., Lee S. M., Lee H. J., Hong Y. J., et al. CT fluoroscopy-guided lung biopsy versus conventional CT-guided lung biopsy: a prospective controlled study to assess radiation doses and diagnostic performance. Eur Radiol. 21(2), 232-239, doi: 10.1007/s00330-010-1936-y.
- Prosch H., Stadler A., Schilling M., Burklin S., Eisenhuber E., et al. CT fluoroscopy-guided vs. multislice CT biopsy mode-guided lung biopsies: accuracy, complications and radiation dose. European journal of radiology. 81(5), 1029-1033, doi: 10.1016/j.ejrad.2011.01.064.
- Gupta S. and Madoff D. C. Image-guided percutaneous needle biopsy in cancer diagnosis and staging. Techniques in vascular andinterventionalradiology. 10(2), 88-101, doi: 10.1053/j.tvir.2007.09.005.
- Lal H., Neyaz Z., Nath A. and Borah S. CT-guided percutaneous biopsy of intrathoracic lesions. Korean journal of radiology. 13(2), 210-226, doi: 10.3348/kjr.2012.13.2.210.
- Richardson C. M., Pointon K. S., Manhire A. R. and Macfarlane J. T. Percutaneous lung biopsies: a survey of UK practice based on 5444 biopsies. The British journal of radiology. 75(897), 731-735, doi: 10.1259/bjr.75.897.750731.
- Tomiyama N., Yasuhara Y., Nakajima Y., Adachi S., Arai Y., et al. CT-guided needle biopsy of lung lesions: a survey of severe complication based on 9783 biopsies in Japan. European journal of radiology. 59(1), 60-64, doi: 10.1016/j.ejrad.2006.02.001.
- Yamagami T., lida S., Kato T., Tanaka O., Toda S., et al. Usefulness of new automated cutting needle for tissue-core biopsy of lung nodules under CT fluoroscopic guidance. 2003. 124(1), 147-154, doi: 10.1378/chest.124.1.147.
- Mendiratta-Lala M., Sheiman R., Brook O. R., Gourtsoyianni S., Mahadevan A., et al. CT- guided core biopsy and percutaneous fiducial seed placement in the lung: can these procedures be combined without an increase in complication rate or decrease in technical success? European journal of radiology. 83(4), 720-725, doi: 10.1016/j.ejrad.2014.01.006.
- Kakizawa H., Toyota N., Hieda M., Hirai N., Tachikake T., et al. Risk factors for severity of pneumothorax after CT-guided percutaneous lung biopsy using the single-needle method. Hiroshima journal of medical sciences. 59(3), 43-50.
- Loh S. E., Wu D. D., Venkatesh S. K., Ong C. K., Liu E., et al. CT-guided thoracic biopsy: evaluating diagnostic yield and complications. Annals of the Academy of Medicine. 42(6), 285-290.
- Choi C. M., Um S. W., Yoo C. G., Kim Y. W., Han S. K., et al. Incidence and risk factors of delayed pneumothorax after transthoracic needle biopsy ofthe lung. 2004. 126(5), 1516- 1521, doi: 10.1378/chest.126.5.1516.
- Taleb S., Jalaeian H., Frank N., Golzarian J. and D’Souza D. Is a Routine Chest X-ray Necessary in Every Patient After Percutaneous CT-Guided Lung Biopsy? A Retrospective Review of 278 Cases. Cardiovascular and interventional radiology. 40(9), 1415-1420, doi: 10.1007/s00270-017-1632-2.
- Lorenz J. and Blum M. Complications of percutaneous chest biopsy. Seminars in interventional radiology. 23(2), 188-193, doi: 10.1055/s-2006-941449.