Velpatasvir
Danh pháp
Tên chung quốc tế
Tên danh pháp theo IUPAC
methyl N-[(1R)-2-[(2S,4S)-2-[5-[6-[(2S,5S)-1-[(2S)-2-(methoxycarbonylamino)-3-methylbutanoyl]-5-methylpyrrolidin-2-yl]-21-oxa-5,7-diazapentacyclo[11.8.0.03,11.04,8.014,19]henicosa-1(13),2,4(8),5,9,11,14(19),15,17-nonaen-17-yl]-1H-imidazol-2-yl]-4-(methoxymethyl)pyrrolidin-1-yl]-2-oxo-1-phenylethyl]carbamate
Nhóm thuốc
Thuốc kháng virus
Mã ATC
J — Thuốc kháng khuẩn sử dụng hệ thống
J05 — Thuốc kháng virus cho sử dụng hệ thống
J05A — Thuốc kháng virus trực tiếp
J05AP — Thuốc kháng vi-rút để điều trị nhiễm HCV
J05AP55 — Sofosbuvir và velpatasvir
J – Thuốc kháng khuẩn sử dụng hệ thống
J05 — Thuốc kháng virus cho sử dụng hệ thống
J05A — Thuốc kháng virus trực tiếp
J05AP — Thuốc kháng vi-rút để điều trị nhiễm HCV
J05AP56 – Sofosbuvir, velpatasvir và voxilaprevir
Mã UNII
KCU0C7RS7Z
Mã CAS
1377049-84-7
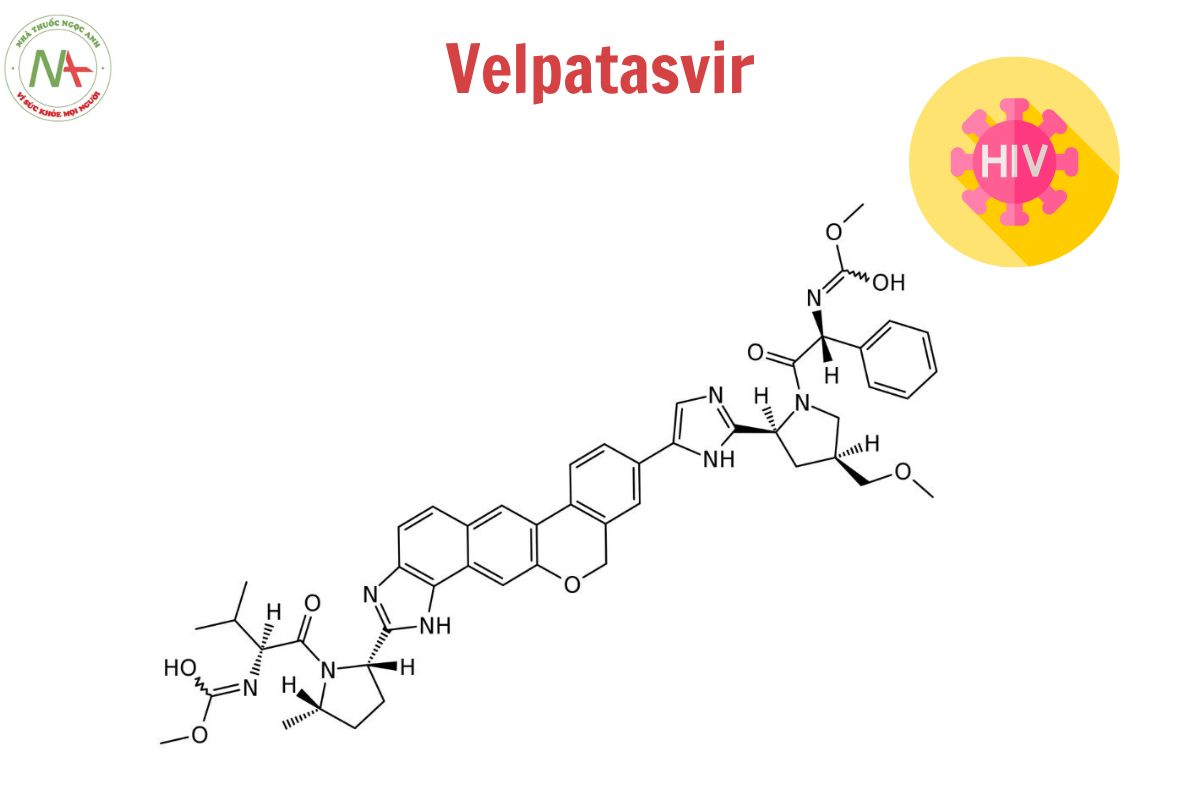
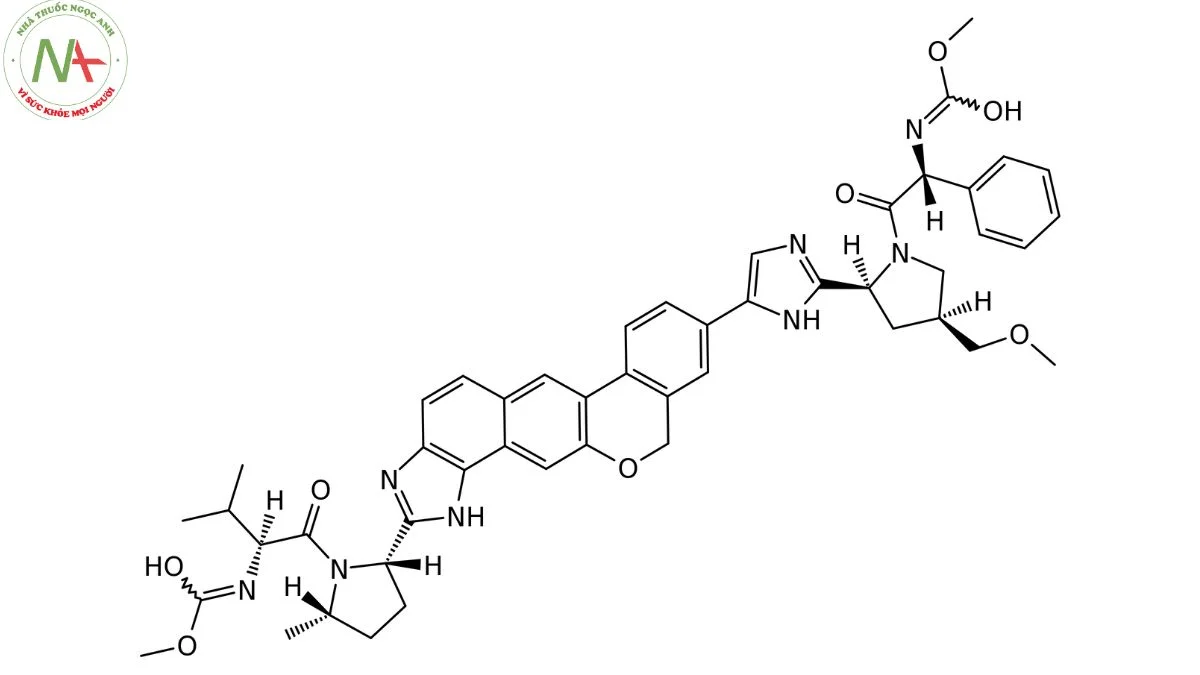
Cấu trúc phân tử
Công thức phân tử
C49H54N8O8
Phân tử lượng
883.0 g/mol
Cấu trúc phân tử
Velpatasvir là một hợp chất dị vòng hữu cơ phức tạp, N-acylpyrrolidine, dẫn xuất L-valine, este carbamate, một dẫn xuất của imidazole, tổ hợp vòng và ether.
Các tính chất phân tử
Số liên kết hydro cho: 4
Số liên kết hydro nhận: 10
Số liên kết có thể xoay: 13
Diện tích bề mặt tôpô: 193Ų
Số lượng nguyên tử nặng: 65
Các tính chất đặc trưng
Tỷ trọng riêng: 1.3±0.1 g/cm3
Độ tan trong nước: 0.00585 mg/mL
Hằng số phân ly pKa: 5.97
Chu kì bán hủy: 15 giờ
Khả năng liên kết với Protein huyết tương: >99,5%
Dạng bào chế
Viên pellet: 37.5 mg
Viên nén: 50 mg, Velpatasvir 100 mg (sofosbuvir/velpatasvir 400/100 mg)
Độ ổn định và điều kiện bảo quản
Velpatasvir nên được bảo quản ở nhiệt độ phòng, tránh ánh nắng trực tiếp và độ ẩm cao.
Nguồn gốc
Velpatasvir là một loại thuốc điều trị viêm gan C, được phát hiện bởi các nhà nghiên cứu của Gilead Sciences vào năm 2013. Velpatasvir có khả năng ức chế enzyme NS5A, một thành phần quan trọng của virus viêm gan C, ngăn chặn sự sao chép và lây lan của virus trong cơ thể.
Velpatasvir được phát triển với mục tiêu tạo ra một loại thuốc có thể điều trị được tất cả các gen của virus viêm gan C, từ gen 1 đến gen 6. Velpatasvir được kết hợp với sofosbuvir, một loại thuốc khác cũng có tác dụng chống virus viêm gan C, để tạo thành Epclusa (sofosbuvir/velpatasvir), một loại thuốc uống chỉ cần dùng một viên mỗi ngày.
Epclusa đã được chứng minh là có hiệu quả cao trong việc điều trị viêm gan C ở nhiều bệnh nhân khác nhau, kể cả những người có bệnh gan nặng hoặc đã từng điều trị thất bại. Epclusa đã được phê duyệt bởi FDA vào năm 2016 và được coi là một bước đột phá trong lĩnh vực điều trị viêm gan C.
Dược lý và cơ chế hoạt động
Velpatasvir là một phân tử thuốc nhỏ với khả năng kháng vi-rút mạnh, chủ yếu được áp dụng trong phối hợp với sofosbuvir để điều trị viêm gan C. Chất này hoạt động bằng cách ức chế protein NS5A, làm giảm quá trình nhân lên của virus. Thậm chí khi dùng ở liều cao hơn đến 5 lần so với liều khuyến nghị, Velpatasvir vẫn không gây ảnh hưởng đáng kể lên khoảng QTc.
Tính chất hoạt động của Velpatasvir có điểm tương đồng với các chất ức chế NS5A khác, nó tập trung vào miền I của NS5A chứa chuỗi axit amin từ 33 đến 202. Các chất ức chế này cạnh tranh với RNA để gắn kết vào khu vực đặc biệt này. Một số nghiên cứu cho rằng chúng có thể kết nối với mục tiêu của chúng trong quá trình sao chép khi vị trí kết nối lộ ra ngoài. Hơn nữa, sự ức chế của NS5A có thể gây ra sự phân bố lại của protein vào các hạt lipid. Tuy nhiên, vai trò cụ thể của NS5A trong việc sao chép RNA vẫn còn là một bí ẩn, mặc dù chúng ta biết rằng đó là một yếu tố quan trọng trong quá trình này.
Ứng dụng trong y học
Velpatasvir, một thuốc kháng vi-rút tác dụng trực tiếp (DAA), đã trở thành một yếu tố quan trọng trong liệu pháp điều trị viêm gan C mãn tính, bệnh truyền nhiễm gây ra bởi virus viêm gan C (HCV). Với HCV tồn tại 9 kiểu gen, trong đó kiểu gen 1 chiếm 72% tổng số bệnh nhân mắc HCV mạn tính tại Hoa Kỳ, Velpatasvir đóng vai trò bằng cách cản trở NS5A, một protein quan trọng của virus.
Từ năm 2011 trở đi, cách tiếp cận điều trị viêm gan C mãn tính đã chứng kiến nhiều tiến bộ, nhất là với sự xuất hiện của các DAA như Velpatasvir. Điểm đặc biệt, Velpatasvir mang lại hiệu quả chống kháng thuốc vượt trội hơn các thuốc thế hệ đầu như Ledipasvir và Daclatasvir.
Năm 2016, cả Hiệp hội Nghiên cứu Bệnh Gan Hoa Kỳ (AASLD) và Hiệp hội Bệnh Truyền nhiễm Hoa Kỳ (IDSA) đều khuyến nghị Velpatasvir kết hợp với sofosbuvir như là lựa chọn hàng đầu cho sáu kiểu gen của HCV.
Hiện nay, Velpatasvir chỉ có trong sản phẩm kết hợp với Sofosbuvir mang tên Epclusa. Mục đích chính của việc điều trị bằng Epclusa là đạt được đáp ứng virus kéo dài (SVR) sau 12 tuần liên tục. Thành công trong việc đạt SVR không chỉ giúp loại bỏ HCV mà còn mang lại nhiều lợi ích cho sức khỏe, bao gồm giảm biến chứng gan, nâng cao chất lượng cuộc sống, giảm rủi ro mắc ung thư gan và giảm tỷ lệ tử vong.
Từ tháng 6/2016, Velpatasvir kết hợp với Sofosbuvir đã được giới thiệu dưới tên thương hiệu Epclusa. Điểm nổi bật của Epclusa là khả năng điều trị tất cả các kiểu gen HCV, kể cả trường hợp có xơ gan. Với hiệu quả đáng chú ý, đáp ứng virus bền vững (SVR) từ 93-99% tùy thuộc vào gen và mức độ xơ gan, Epclusa đã được cả Mỹ và Canada đánh giá và khuyến cáo như lựa chọn hàng đầu trong việc điều trị HCV.
Dược động học
Hấp thu
Khi qua đường uống, Velpatasvir có sinh khả dụng từ 25-30%.
Phân bố
Velpatasvir có thể tích phân bố trong khoảng 1,4-1,6 L/kg, với hơn 99,5% gắn liền với protein trong huyết tương.
Chuyển hóa
Velpatasvir được chuyển hóa một phần qua CYP2B6, CYP2C8 và CYP3A4.
Thải trừ
Khoảng 94% Velpatasvir được loại bỏ thông qua hệ tiêu hóa, trong đó 77% vẫn giữ nguyên dạng ban đầu. Chỉ có 0,4% dược chất được bài tiết qua nước tiểu. Thời gian dược chất tồn tại nửa đời trong cơ thể là khoảng 15 giờ và tốc độ thanh thải Velpatasvir được ước tính là 0,12 L/h/kg.
Phương pháp sản xuất
Để sản xuất Velpatasvir trong công nghiệp dược phẩm, người ta thường sử dụng phương pháp tổng hợp hóa học. Phương pháp này bao gồm nhiều bước phản ứng, trong đó các nguyên liệu ban đầu được biến đổi thành các chất trung gian và sau đó kết hợp với nhau để tạo ra Velpatasvir. Một số bước phản ứng quan trọng trong quá trình tổng hợp velpatasvir là:
- Phản ứng giữa 2,4-dichloropyrimidine và 2,6-difluorobenzylamine để tạo ra 2,4-dichloro-6-(2,6-difluorobenzylamino)pyrimidine.
- Phản ứng giữa 2,4-dichloro-6-(2,6-difluorobenzylamino)pyrimidine và 1-(tert-butoxycarbonyl)-4-piperidinol để tạo ra 2,4-dichloro-6-[(2,6-difluorobenzyl)oxy]-N-(tert-butoxycarbonyl)piperidin-4-amine.
- Phản ứng giữa 2,4-dichloro-6-[(2,6-difluorobenzyl)oxy]-N-(tert-butoxycarbonyl)piperidin-4-amine và (S)-methyl 2-amino-3-methylbutanoate hydrochloride để tạo ra (S)-methyl N-(tert-butoxycarbonyl)-4-[6-(2,6-difluorobenzyl)oxy-2-chloropyrimidin-4-yl]piperidine-1-carboxylate.
- Phản ứng giữa (S)-methyl N-(tert-butoxycarbonyl)-4-[6-(2,6-difluorobenzyl)oxy-2-chloropyrimidin-4-yl]piperidine-1-carboxylate và (R)-methyl 1-(cyclopropylamino)-2-cyanoethanethioate để tạo ra (R)-methyl N-{(S)-1-[6-(2,6-difluorobenzyl)oxy-2-chloropyrimidin-4-yl]-4-piperidinyl}-N-cyclopropylcyanomethanethioimidate.
- Phản ứng giữa (R)-methyl N-{(S)-1-[6-(2,6-difluorobenzyl)oxy-2-chloropyrimidin-4-yl]-4-piperidinyl}-N-cyclopropylcyanomethanethioimidate và (S)-tert-butyl (1R,3S,5S)-3-amino-5-methylcyclohexane-1-carboxylate để tạo ra Velpatasvir.
Phương pháp tổng hợp hóa học có thể cho ra sản phẩm Velpatasvir với hiệu suất cao và độ tinh khiết cao. Tuy nhiên, phương pháp tổng hợp velpatasvir theo cách này cũng có một số nhược điểm như:
- Cần sử dụng nhiều chất phản ứng và dung môi hóa học có thể gây ô nhiễm môi trường và nguy hiểm cho sức khỏe con người.
- Cần thực hiện nhiều bước phản ứng và quá trình lọc, rửa, khô và tinh chế sản phẩm, làm tăng chi phí và thời gian sản xuất.
Độc tính ở người
Velpatasvir có thể gây ra một số tác dụng phụ như đau đầu, mệt mỏi, buồn nôn hoặc phản ứng dị ứng. Nếu có bất kỳ triệu chứng nào bất thường hoặc nghiêm trọng khi sử dụng Velpatasvir, nên báo ngay cho bác sĩ.
Tính an toàn
Velpatasvir không gây ra nguy cơ ung thư hay ảnh hưởng đến sức khỏe của thai nhi. Dù chưa được nghiên cứu rõ ràng với các bà mẹ cho con bú đang được điều trị cho viêm gan C, nhưng do velpatasvir kết hợp chặt chẽ với protein huyết tương (>99%), khả năng chuyển vào sữa mẹ có thể rất thấp. Mặc dù vậy, nên cân nhắc việc dừng cho con bú khi sử dụng velpatasvir kết hợp với ribavirin.
Viêm gan C không lây qua sữa mẹ, và thực tế, sữa mẹ có khả năng tiêu diệt virus viêm gan C. Tuy nhiên, nếu núm vú bị nứt hoặc chảy máu, các bà mẹ nhiễm HCV nên cân nhắc việc tạm thời không cho con bú. Trẻ sơ sinh của mẹ nhiễm HCV nên được kiểm tra về khả năng nhiễm bệnh, và việc thử nghiệm cho kháng thể HCV ở trẻ trước 18 tháng tuổi được đề xuất.
Tương tác với thuốc khác
Velpatasvir hoạt động cả như một chất ức chế và một chất đối kháng của nhiều protein vận chuyển, cùng với việc bị chuyển hóa bởi một số enzyme gan. Như vậy, nó có khả năng tương tác với các dược chất khác như efavirenz/emtricitabine/tenofovir và rifampicin, ảnh hưởng đến hàm lượng velpatasvir trong cơ thể.
Digoxin, một dược chất bị đào thải bởi PGp, khi kết hợp với velpatasvir và sofosbuvir có thể tăng cường hiệu ứng.
Đồng thời, thuốc giảm axit dạ dày có thể làm giảm hiệu quả của velpatasvir.
Lưu ý khi sử dụng Velpatasvir
Bệnh nhân nên tham khảo ý kiến bác sĩ trước khi sử dụng Velpatasvir, đặc biệt nếu có tiền sử bệnh tim, thận, gan hoặc bất kỳ dị ứng nào với thuốc.
Bệnh nhân nên uống Velpatasvir theo đúng liều lượng và thời gian do bác sĩ chỉ định. Không nên ngừng sử dụng thuốc trước khi hoàn thành liệu trình điều trị, trừ khi có sự cho phép của bác sĩ.
Bệnh nhân nên kiểm tra chức năng gan và thận thường xuyên trong quá trình sử dụng Velpatasvir để phát hiện sớm các biến chứng có thể xảy ra.
Bệnh nhân nên tránh uống rượu hoặc các chất kích thích khác khi sử dụng Velpatasvir vì chúng có thể làm tăng nguy cơ gây tổn thương gan hoặc tương tác xấu với thuốc.
Bệnh nhân nên báo cho bác sĩ biết nếu mang thai, đang cho con bú hoặc có kế hoạch mang thai trong khi sử dụng Velpatasvir vì thuốc có thể ảnh hưởng đến thai nhi hoặc sữa mẹ.
Bệnh nhân nên thông báo cho bác sĩ về các loại thuốc khác đang dùng, bao gồm cả thuốc không kê đơn, thảo dược hoặc bổ sung dinh dưỡng để tránh tương tác thuốc gây nguy hiểm.
Một vài nghiên cứu của Velpatasvir trong Y học
Tác động của điều trị bằng sofosbuvir/velpatasvir/voxilaprevir đối với tình trạng tăng đường huyết trong huyết thanh ở bệnh nhiễm virus viêm gan C: đánh giá hệ thống và phân tích tổng hợp
Đặt vấn đề: Sự kết hợp giữa Sofosbuvir (SOF), velpatasvir (VEL) và voxilaprevir (VOX) là liệu pháp cứu nguy hiệu quả, an toàn cho những bệnh nhân thất bại điều trị trước đó. Điều trị bằng thuốc kháng vi-rút tác dụng trực tiếp (DAA) đối với nhiễm vi-rút viêm gan C (HCV) ở bệnh nhân tiểu đường có tiền sử hạ đường huyết có thể cải thiện tình trạng kháng insulin do thanh thải HCV. Tuy nhiên, một số nghiên cứu đã chỉ ra rằng SOF/VEL/VOX gây tăng đường huyết độ 3 và các tác dụng phụ khác, điều này trái ngược với kết quả của các nghiên cứu DAA khác.
Mục đích: Phân tích tỷ lệ tăng đường huyết độ 3 của SOF/VEL/VOX đối với nhiễm HCV mạn tính.
Phương pháp: Chúng tôi đã tìm kiếm cơ sở dữ liệu điện tử từ khi bắt đầu xây dựng từng cơ sở dữ liệu cho đến tháng 10 năm 2021. Mô hình hiệu ứng ngẫu nhiên đã được sử dụng để tổng hợp dữ liệu. Nghiên cứu được thực hiện theo hướng dẫn PRISMA và đánh giá chất lượng được thực hiện bằng cách sử dụng công cụ sai lệch rủi ro Cochrane cho các thử nghiệm ngẫu nhiên có đối chứng (RCT). Quy trình nghiên cứu đã được đăng ký trên cơ sở dữ liệu INPLASY (Số đăng ký 2021120109).
Kết quả: Năm RCT đã được đưa vào tổng quan này. Nhìn chung, 49 trong số 2315 bệnh nhân có tăng đường huyết độ 3 với tỷ lệ nguy cơ là 0,015 (khoảng tin cậy 95%, 0,010-0,020; p < 0,001) và tỷ lệ nguy cơ mới mắc (IRR) đối với bệnh xơ gan so với không bị xơ gan là 12.000 (khoảng tin cậy 95%: 0,727-198,160), IRR kiểu gen 3 kiểu gen 1 của HCV là 4,13 (khoảng tin cậy 95%: 1,52-11,22) trong phân tích phân nhóm. Không có sự khác biệt đáng kể nào được tìm thấy trong các phân nhóm khác, về kinh nghiệm điều trị DAA trước đó và về thời gian điều trị.
Kết luận: Mặc dù tỷ lệ tăng đường huyết hiếm gặp ở bệnh nhân tiểu đường mắc HCV, nhưng khuyến cáo nên theo dõi chặt chẽ nồng độ glucose trong 3 tháng đầu điều trị và điều chỉnh thuốc trị tiểu đường nếu cần thiết.
Tài liệu tham khảo
- Drugbank, Velpatasvir, truy cập ngày 10 tháng 10 năm 2023.
- Hung, H. Y., Lai, H. H., Lin, H. C., & Chen, C. Y. (2023). The impact of sofosbuvir/velpatasvir/voxilaprevir treatment on serum hyperglycemia in hepatitis C virus infections: a systematic review and meta-analysis. Annals of medicine, 55(1), 463–479. https://doi.org/10.1080/07853890.2023.2168745
- Pubchem, Velpatasvir, truy cập ngày 10 tháng 10 năm 2023.
- Bộ Y Tế (2012), Dược thư quốc gia Việt Nam, Nhà xuất bản Y học, Hà Nội
Xuất xứ: Ấn Độ
Xuất xứ: Canada
Xuất xứ: Ấn Độ
Xuất xứ: Ấn Độ