Ulipristal
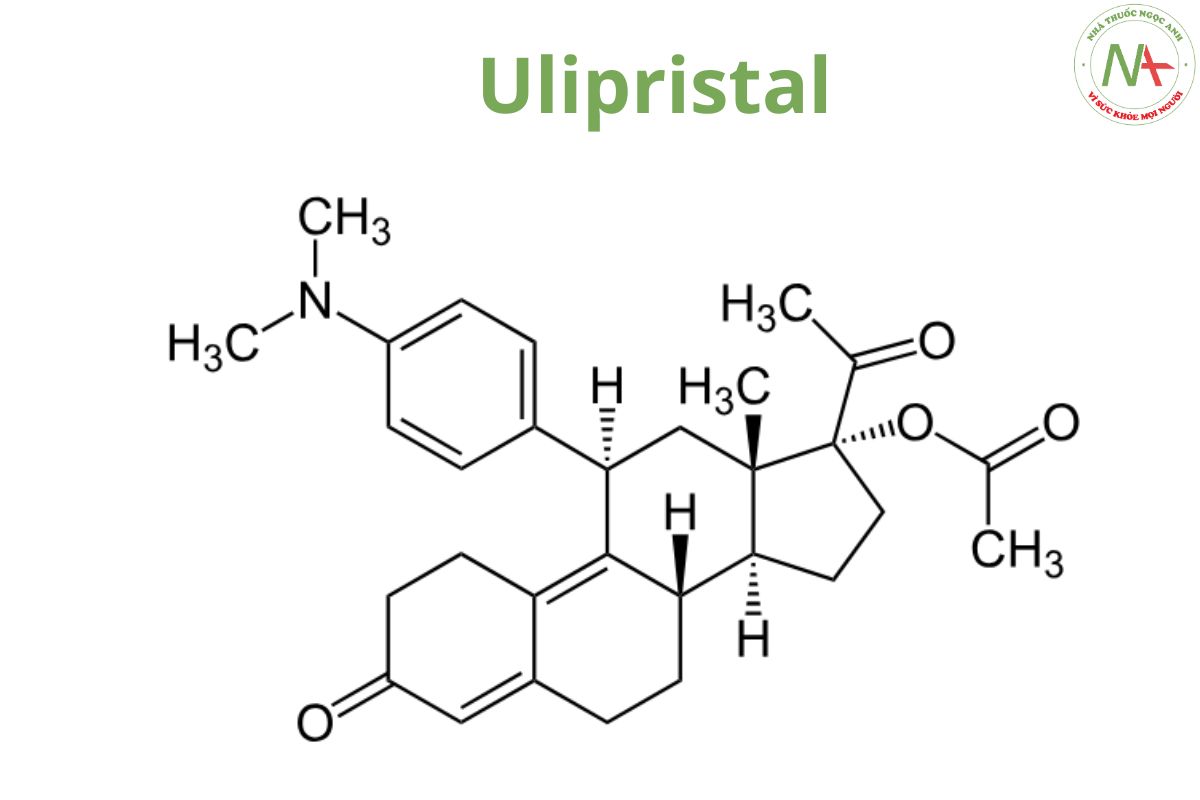
Danh pháp
Tên chung quốc tế
Tên danh pháp theo IUPAC
(8S,11R,13S,14S,17R)-17-acetyl-11-[4-(dimethylamino)phenyl]-17-hydroxy-13-methyl-1,2,6,7,8,11,12,14,15,16-decahydrocyclopenta[a]phenanthren-3-one
Ulipristal thuộc nhóm nào?
Ulipristal là thuốc gì? Các hormone sinh dục và chất điều hòa khác của hệ sinh dục
Mã ATC
G – Hệ tiết niệu sinh dục và hormone sinh dục
G03 – Hormon giới tính và các chất điều hòa của hệ sinh dục
G03A – Thuốc tránh thai nội tiết dùng toàn thân
G03AD – Thuốc tránh thai khẩn cấp
G03AD02 – Ulipristal
G – Hệ tiết niệu sinh dục và hormone sinh dục
G03 – Hormon giới tính và các chất điều hòa của hệ sinh dục
G03X – Các hormone sinh dục và chất điều hòa khác của hệ sinh dục
G03XB – Bộ điều biến thụ thể progesterone
G03XB02 – Ulipristal
Mã UNII
6J5J15Q2X8
Mã CAS
159811-51-5
Cấu trúc phân tử
Công thức phân tử
C28H35NO3
Phân tử lượng
433.6 g/mol
Các tính chất phân tử
Số liên kết hydro cho: 4
Số liên kết hydro nhận: 3
Số liên kết có thể xoay: 3
Diện tích bề mặt cực tôpô: 57,6
Số lượng nguyên tử nặng: 32
Số lượng nguyên tử trung tâm xác định được: 5
Liên kết cộng hóa trị: 1
Dạng bào chế
Viên nén: thuốc Ulipristal acetate,…

Nguồn gốc
- Tháng 5/2009, Cơ quan Dược phẩm Châu Âu đã cấp phép cho Ulipristal.
- Năm 2014, EMA khuyến nghị ulipristal không cần kê đơn ở Liên minh Châu Âu.
- Ngày 13/ 8 /2010, FDA đã phê duyệt Ulipristal sử dụng tại Hoa Kỳ.
- Ngày 01/12/2010, Ulipristal được phân phối tại nhiều hiệu thuốc bán lẻ, phòng khám,…
Dược lý và cơ chế hoạt động
- Ulipristal là một chất điều biến thụ thể progestin thuận nghịch có chọn lọc và các mục tiêu mô của nó bao gồm buồng trứng và vùng dưới đồi, tử cung, cổ tử cung. Ulipristal hoạt động như chất đối kháng khi có hoặc không có progesterone, chất chủ vận tùy theo mô đích. Ulipristal tạo ra tác dụng tránh thai kháng progesterone trên buồng trứng bằng cách liên kết với các thụ thể progesterone của cơ thể, ức chế hoặc trì hoãn sự rụng trứng và giảm độ dày nội mạc tử cung trên nội mạc tử cung.
- Ulipristal t liên kết với thụ thể progesterone, cải thiện tính đặc hiệu của thụ thể progesterone và ngăn chặn tác dụng của hormone. Ulipristal có thể chuyển hóa thành dẫn xuất của 19-norprogesterone có khả năng ức chế hoặc trì hoãn sự rụng trứng,ngăn ngừa mang thai trong vòng 120 giờ sau khi giao hợp. Sử dụng ulipristal acetat trước khi rụng trứng làm chậm sự giải phóng, phát triển nang trứng, có thể là do ức chế nồng độ estradiol. Trong cuối chu kỳ kinh nguyệt, tác dụng của ulipristal là do khả năng làm giảm độ dày nội mạc tử cung.
Dược động học
Hấp thu
Khi dùng đường uống với liều ulipristal 30 mg được hấp thu nhanh chóng. Nồng độ đỉnh trong huyết thanh khoảng một giờ. Dùng sau bữa ăn nhiều chất béo,Tmax bị chậm 3 giờ, Cmax của Ulipristal giảm từ 40% đến 45%.
Chuyển hóa
Ulipristal được chuyển hóa thành các chất chuyển hóa di-demethyl hóa, mono-demethyl hóa chủ yếu bởi isoenzym gan cytochrome P450 và CYP 1A2. Chất chuyển hóa di-demethyl hóa không có hoạt tính lâm sàng.
Phân bố
Ulipristal có khả năng liên kết protein huyết tương cao với lipoprotein-cholesterol mật độ cao, glycoprotein alpha 1 -axit, albumin
Thải trừ
Ulipristal có thời gian bán hủy khi dùng liều duy nhất 30 mg là khoảng 32,4 ± 6,3 giờ.
Ứng dụng trong y học
Ulipristal được chỉ định sử dụng như một biện pháp tránh thai khẩn cấp sau khi giao hợp hoặc có thể tránh thai thất bại khi dùng trong vòng 120 giờ. Ngoài ra Ulipristal được chỉ định để điều trị các dấu hiệu và triệu chứng của u xơ tử cung ở phụ nữ trưởng thành.
Tác dụng phụ
Ulipristal được dung nạp tốt, các tác dụng phụ của Ulipristal không nghiêm trọng hơn so với levonorgestrel. Ulipristal có thể gây tác dụng phụ sau: đau bụng kinh, mệt mỏi, chóng mặt, nhức đầu,đau bụng, buồn nôn. Việc sử dụng ulipristal cũng có thể gây chậm kỳ kinh nguyệt
Độc tính ở người
Chưa có dữ liệu.
Liều dùng
Liều khuyến cáo của ulipristal là 30 mg uống sau khi giao hợp
Tương tác với thuốc khác
Ulipristal có thể tương tác bất lợi với các cơ chất của CYP3A4, như carbamazepine hoặc ritonavir, rifampicin, phenytoin
Chống chỉ định
- Ulipristal chống chỉ định ở những bệnh nhân đang mang thai hoặc những người không chắc chắn về tình trạng mang thai của mình.
- Không chỉ định sử dụng Ulipristal trước khi có kinh hoặc ở phụ nữ sau mãn kinh.
Lưu ý khi sử dụng
- Ulipristal có gây tổn thương cho thai nhi khi dùng trong thời kỳ mang thai vì vậy không dùng Ulipristal cho phụ nữ có thai.
- Không dùng Ulipristal cho phụ nữ cho con bú vì hiện nay chưa có đầy đủ tính an toàn về Ulipristal cho nhóm đối tượng này.
- Không nên dùng Ulipristal cho người < 18 tuổi.
- Ulipristal nên được dùng càng sớm càng tốt và trong vòng 120 giờ kể từ khi giao hợp.
- Ulipristal không có tác dụng chống lại bệnh lây truyền qua đường tình dục hoặc lây truyền HIV.
Một vài nghiên cứu của Ulipristal trong Y học
Ulipristal Acetate trong điều trị u xơ tử cung có triệu chứng

Mới đây, kết quả nghiên cứu thử nghiệm lâm sàng ngẫu nhiên có nhóm chứng phase 3 tiến hành tại 25 trung tâm của Mỹ nhằm đánh giá hiệu quả và tính an toàn của UPA trong điều trị u xơ tử cung có triệu chứng vừa được công bố. Đối tượng nghiên cứu được phân nhóm ngẫu nhiên tỷ lệ 1:1:1 vào 3 nhóm: uống UPA 5mg/ ngày, uống UPA 10mg/ ngày và uống giả dược. Phụ nữ trước mãn kinh (FSH £ 20 mUI/ml), trong độ tuổi từ 18 đến 50, có u xơ tử cung có triệu chứng được tuyển lựa vào nghiên cứu. Tiêu chuẩn nhận chính là cường kinh hoặc rong kinh trong ³ 4 chu kỳ trong 6 tháng gần nhất, lượng máu mất ³ 80ml, có ³ 1 khối u xơ tử cung phát hiện qua siêu âm ngả âm đạo và kích thước tử cung £ thai 20 tuần qua khám lâm sàng. Tiêu chuẩn loại là có tiền sử đốt nội mạc tử cung hoặc phẫu thuật khác trên tử cung trong 2 tháng trước sàng lọc hoặc thuyên tắc động mạch tử cung trong 6 tháng trước sàng lọc. Phụ nữ có dùng biện pháp tránh thai có progestin trước 2 tháng, hoặc điều trị đồng vận GnRH trước 5 tháng hoặc dùng một tác nhân thuộc nhóm SPRM khác để ngừa thai khẩn cấp bất kỳ thời điểm nào trước sàng lọc cũng bị loại khỏi nghiên cứu. Phụ nữ có khả năng có thai được yêu cầu sử dụng biện pháp tránh thai không nội tiết trong suốt nghiên cứu.
Kết cục chính là tỷ lệ bệnh nhân vô kinh (hoặc ra máu dạng spotting) trong 35 ngày điều trị liên tục và thời gian từ lúc bắt đầu điều trị đến vô kinh. Tính chất kinh nguyệt được đối tượng nghiên cứu ghi lại dưới dạng nhật ký 24 giờ. Bảng câu hỏi Chất lượng cuộc sống liên quan sức khoẻ và triệu chứng u xơ tử cung (USF QOL) bao gồm 29 nội dung được áp dụng để đánh giá ảnh hưởng của u xơ tử cung đến cuộc sống của bệnh nhân trước và sau điều trị. Siêu âm đo độ dày niêm mạc tử cung được thực hiện vào ngày 10-18 chu kỳ. Sinh thiết niêm mạc tử cung được thực hiện vào 3 thời điểm: sàng lọc vào nghiên cứu, giữa ngày 10-18 chy kỳ đầu tiên ngay sau điều trị, khi kết thúc 12 tuần theo dõi sau điều trị hoặc ngay trước khi kết thúc nghiên cứu.
Tổng cộng có 612 đối tượng được sàng lọc, 157 đối tượng được tuyển chọn vào nghiên cứu, 148 hoàn thành đợt điều trị và 133 hoàn thành đợt theo dõi. Tỷ lệ tuân thủ điều trị đạt 89-91% và tuân thủ theo dõi sau điều trị 83-90%.
Kết quả, tỷ lệ phụ nữ đạt vô kinh trong 35 ngày điều trị ở cả 2 nhóm can thiệp liều 5mg và 10mg đều cao hơn có ý nghĩa thống kê so với nhóm giả dược, lần lượt là 47,2% (KTC 95% 31,6-63,2) và 58,3% (KTC 95% 41,2-74,1) so với 1,8% (KTC 95% 0,0-10,9). Chất lượng cuộc sống được cải thiện trong nhóm can thiệp so với nhóm chứng (p<0,001). Sau 12 tuần điều trị, kích thước khối u giảm 9,6% (p=0,218) trong nhóm uống UPA 5mg, giảm 16,3% trong nhóm 10mg (p=0,86) và tăng trong nhóm giả dược 7,2%. Sau 12 tuần theo dõi, kích thước khối u giảm 2,3% (p=0,605) trong nhóm uống UPA 5mg, giảm 17,4% trong nhóm 10mg (p=0,124) và tăng 5,7% trong nhóm giả dược.
Về độ an toàn, không có trường hợp nào ngưng điều trị do tác dụng phụ (AE) của thuốc. Các trường hợp AE nghiêm trọng, không liên quan đến việc điều trị, gồm 1 ca đau ngực và lo âu thuộc nhóm giả dược, 1 ca phản ứng với nhện cắn trong nhóm 5mg UPA và 1 ca mắc bệnh trĩ và nhiễm cúm trong nhóm 10mg, 1 ca tăng huyết áp trong nhóm 10mg UPA. AE cần điều trị được báo cáo với tỷ lệ 28,6% trong nhóm giả dược, 43,4% trong nhóm 5mg UPA và 54,2% trong nhóm 10mg UPA, bao gồm: cơn bốc hoả mức độ nhẹ-trung bình, tăng creatinin phosphokinase máu và tăng huyết áp. Những trường hợp tăng creatinin phosphokinase ở mức độ nhẹ và không liên quan biến cố tim mạch nào. 5 ca tăng huyết áp được báo cáo là tình trạng tăng nặng của bệnh lý nền mãn tính và 1 ca tăng huyết áp mới phát hiện trong 12 tuần theo dõi. Các tác giả ghi nhận nhóm bệnh nhân tăng huyết áp có béo phì và đã có tăng huyết áp không điều trị tại thời điểm sàng lọc.
Không có trường hợp nào ung thư niêm mạc tử cung trong các kết quả sinh thiết; 1 trường hợp tăng sản niêm mạc tử cung điển hình trong nhóm 10mg UPA và tự hồi phục không cần điều trị sau khi kết thúc theo dõi. Tỷ lệ biến đổi niêm mạc tử cung do SPRM tương đồng và sự thay đổi độ dày niêm mạc tử cung cũng không khác biệt giữa 3 nhóm.
Tóm lại, nghiên cứu cho thấy UPA đường uống có hiệu quả trong điều trị u xơ tử cung có triệu chứng, vốn là chỉ định phẫu thuật cắt tử cung thường gặp trong thực hành lâm sàng. Phương pháp này mở rộng thêm cơ hội cho bệnh nhân muốn bảo tồn khả năng mang thai hoặc không đủ điều kiện cho phẫu thuật.
BS Hê Thanh Nhã Yến – Bệnh viện Mỹ Đức
Tài liệu tham khảo
- Thư viện y học quốc gia, Ulipristal, pubchem. Truy cập ngày 07/11/2023.
- BS Hê Thanh Nhã Yến – Bệnh viện Mỹ Đức. Simon, James A. MD, Ulipristal acetate for treatment of symptomatic uterine leiomyomas: a randomized controlled trial. Obstetrics & gynecology: March 2018 – Vol 131 – Issue 3 – p 431-439.
- Nguồn: Simon, James A. MD, Ulipristal acetate for treatment of symptomatic uterine leiomyomas: a randomized controlled trial. Obstetrics & gynecology: March 2018 – Vol 131 – Issue 3 – p 431-439.
