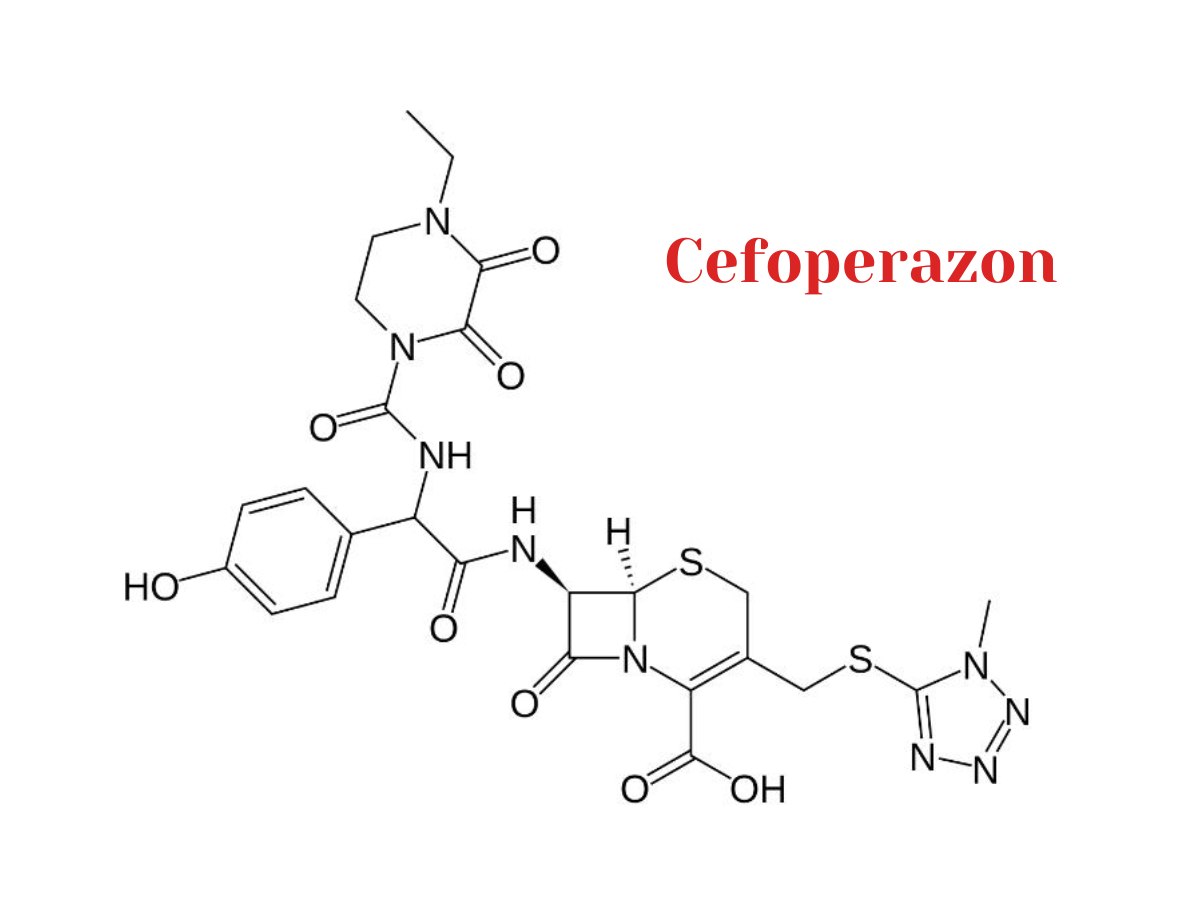
Cefoperazon
Danh pháp
Tên chung quốc tế
Tên danh pháp theo IUPAC
6R,7R)-7-[[(2R)-2-[(4-ethyl-2,3-dioxopiperazine-1-carbonyl)amino]-2-(4-hydroxyphenyl)acetyl]amino]-3-[(1-methyltetrazol-5-yl)sulfanylmethyl]-8-oxo-5-thia-1-azabicyclo[4.2.0]oct-2-ene-2-carboxylic acid
Nhóm thuốc
Kháng sinh nhóm Cephalosporin thế hệ 3
Mã ATC
J – Thuốc chống nhiễm trùng dùng toàn thân
J01 – Kháng sinh dùng toàn thân
J01D – Thuốc kháng khuẩn beta-lactam khác
J01DD – Cephalosporin thế hệ thứ ba
J01DD12 – Cefoperazon
Mã UNII
7U75I1278D
Mã CAS
62893-19-0
Xếp hạng phân loại cho phụ nữ có thai
AU TGA loại: NA
US FDA loại: B
Cấu trúc phân tử
Công thức phân tử
C 25 H 27 N 9 O 8 S 2
Phân tử lượng
645,7 g/mol
Cấu trúc phân tử
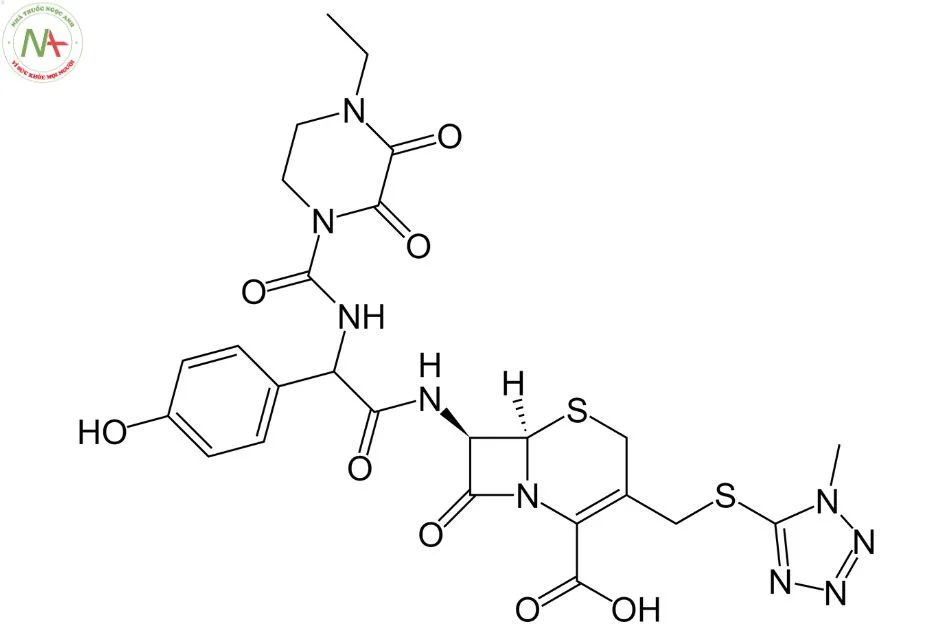
Nhóm Thiol (-SH) : Bao gồm nitơ (N) và lưu huỳnh (S). Đây là một phần quan trọng góp phần định hình và tạo tính chất chức năng của kháng sinh.
Nhóm Carbonyl (C=O): Cefoperazon có các nhóm carbonyl (C=O) ở nhiều vị trí trong cấu trúc, góp phần vào các tính chất chức năng và tương tác hóa học của kháng sinh.
Nhóm Amide (C-NH2): Cefoperazon cũng chứa nhóm amide (C-NH2) ở một vị trí trong cấu trúc, đóng vai trò quan trọng trong cấu trúc của cephalosporin.
Nhóm Methyl (CH3): Một số nhóm methyl (CH3) cũng xuất hiện trong cấu trúc, góp phần tạo thành cấu trúc phức tạp và đa dạng của kháng sinh.
Các tính chất phân tử
Số liên kết hydro cho: 4
Số liên kết hydro nhận: 13
Số liên kết có thể xoay: 9
Diện tích bề mặt tôpô: 271 Ų
Số lượng nguyên tử nặng: 44
Các tính chất đặc trưng
Điểm nóng chảy: 188-190oC
LogP: -0,74
Khả năng liên kết protein:
Thời gian bán hủy:
Cảm quan
Cefoperazon thường có dạng bột tinh thể màu trắng hoặc màu nhạt.
Cefoperazon có khả năng tan trong nước, tạo thành một dung dịch.
Cefoperazon thường tan trong nhiều dung môi hữu cơ, như methanol, ethanol và acetone. Điều này có thể hữu ích trong việc chuẩn bị dung dịch hoặc hỗn hợp pha loãng.
Dạng bào chế
Bột pha tiêm cefoperazon sodium tương đương cefoperazon 1g, cefoperazon 2g.
Độ ổn định và điều kiện bảo quản của Cefoperazon
Thuốc tiêm cefoperazon 2g là thuốc có tính chất hóa học nhạy cảm và có thể bị phân hủy trong môi trường không thuận lợi, như nhiệt độ cao, độ ẩm và ánh sáng mạnh. Độ ổn định của Cefoperazon cũng phụ thuộc vào điều kiện lưu trữ và thời gian.
Cefoperazon thường nên được bảo quản ở nhiệt độ từ 20°C đến 25°C (68°F đến 77°F). Tránh lưu trữ ở nhiệt độ quá cao hoặc quá thấp, vì điều này có thể ảnh hưởng đến độ ổn định của kháng sinh.
Cefoperazon nên được bảo quản xa tầm ánh sáng mạnh. Ánh sáng có thể gây ra quá trình phân hủy hóa học và làm mất đi tính chất của sản phẩm.
Cefoperazon cần được bảo quản trong môi trường khô ráo để tránh tác động của độ ẩm, gây ra sự phân hủy và biến đổi hóa học.
Đảm bảo rằng Cefoperazon được đóng gói kín đáo để tránh tác động của không khí và các yếu tố khác từ môi trường bên ngoài.
Nguồn gốc
Cefoperazon được phát triển bởi các nhà khoa học tại công ty dược phẩm đa quốc gia châu Âu – AstraZeneca.
Cefoperazon là một cephalosporin thế hệ thứ ba, một loại kháng sinh được biến đổi từ cấu trúc cephalosporin gốc để tăng khả năng kháng khuẩn và hiệu suất chống nhiễm trùng.
Cefoperazon đã được giới thiệu vào cuối những năm 1970 và được cấp bằng sáng chế vào năm 1974 được chấp thuận sử dụng lâm sàng vào cuối năm 1980 đầu năm 1981
Cefoperazon đã được thêm vào danh mục kháng sinh để điều trị các nhiễm trùng nặng, bao gồm nhiễm trùng hô hấp, tiết niệu, bài tiết và các nhiễm trùng dưới da và được bán dưới các tên thương mại như Cefopefast 1000.
Dược lý và cơ chế hoạt động
Cefoperazon là cephalosporin thế hệ 3.
Hoạt tính kháng khuẩn của Cefoperazon là thông qua việc ức chế tổng hợp thành tế bào của vi khuẩn bằng cách acyl hóa các chất xúc tác transpeptidase liên kết màng: điều này ngăn chặn sự liên kết chéo của các chuỗi peptidoglycan cơ bản cần thiết cho độ chắc chắn của thành tế bào vi khuẩn.
Kháng sinh cefoperazon có tác dụng tương đương với ceftazidime, nhưng ít tác dụng hơn đối với một số chủng Enterobacteriaceae.
Cefoperazon có tác dụng chống lại Pseudomonas aeruginosa, nhưng kém hơn ceftazidime.
Cefoperazon tương đối ổn định đối với nhiều beta-lactamase do vi khuẩn gram (+) và gram (-) tiết ra.
Phạm vi hoạt động của Cefoperazon được mở rộng, bao gồm:
Các vi sinh vật gram (+) có tác động mạnh: Staphylococcus aureus, S. cholermidis, Strept. pneumoniae, Strep. pyogenes, Strept. agalactiae ; Enterococcus.
Vi sinh vật gram (-) có tác động mạnh: E. Coli, Enterobacter spp., Klebsiella spp, H. Influenzae, Proteus vulgaris, Proteus mirabilis, Neisseria gonorrhoeae, Morganella morganii, Providencia rettgeri, Providencia stuartii, Acinetobacter calcoaceticus.
Vi khuẩn kị khí: Cầu khuẩn Gram dương ( Peptococcus và Peptostreptococcus); Clostridium spp., Bacteroides fragilis.
Cefoperazon cũng có tác dụng trên in vitro chống lại nhiều vi sinh vật gây bệnh bao gồm: Salmonella và Shigella spp., Serratia liquefacicus, N. meningitidis, Bordetella pertussis, Yersinia enterocolitica, Clostridium diffcile, Fusobacterium spp., Eubacterium spp, H. influenza và N. gonorrhoeae tiết beta-lactamase.
Tác dụng của Cefoperazon được nâng cao khi kết hợp với sulbactam (cefoperazone + sulbactam), sulbactam một chất ức chế beta-lactamase, đặc biệt là chống lại Enterobacteriacae và Bacteroides spp., tuy nhiên hỗn hợp này lại ảnh hưởng đến Pseudomonas aeruginosa (đã được báo cáo là có hiện tượng kháng thuốc).
Ứng dụng trong y học của Cefoperazon
Điều trị nhiễm trùng
Cefoperazon được sử dụng rộng rãi trong việc điều trị các nhiễm trùng do vi khuẩn nhạy cảm gây ra. Cefoperazon có khả năng tác động đối với một loạt các vi khuẩn Gram dương và Gram âm, bao gồm các vi khuẩn ưa khí và kỵ khí, giúp tiêu diệt các vi khuẩn gây bệnh.
Nhiễm trùng hô hấp
Cefoperazon có thể được sử dụng để điều trị các nhiễm trùng hô hấp như viêm phổi, viêm phế quản và viêm amidan do các vi khuẩn như Streptococcus pneumoniae, Haemophilus influenzae và các chủng khác.
Nhiễm trùng tiết niệu và đường tiết niệu
Kháng sinh này cũng được sử dụng trong việc điều trị các nhiễm trùng tiết niệu và đường tiết niệu, bao gồm viêm bàng quang, viêm niệu đạo và viêm thận.
Nhiễm trùng bài tiết và da
Cefoperazon cũng có thể được sử dụng trong điều trị các nhiễm trùng bài tiết như viêm màng não do vi khuẩn nhạy cảm gây ra, cũng như trong một số trường hợp nhiễm trùng da và mô mềm.
Phẫu thuật tiêu hóa và bụng
Trong một số trường hợp phẫu thuật tiêu hóa và bụng, Cefoperazon có thể được sử dụng để phòng ngừa nhiễm trùng sau phẫu thuật.
Nhiễm trùng máu và nhiễm trùng nội tiết
Kháng sinh này cũng có thể được sử dụng để điều trị các nhiễm trùng máu và nhiễm trùng nội tiết do vi khuẩn nhạy cảm gây ra.
Trong một số trường hợp khác
Ngoài những ứng dụng trên, Cefoperazon còn được sử dụng trong điều trị các nhiễm trùng khác như viêm khớp, nhiễm trùng mắt, nhiễm trùng ngoại vi và nhiễm trùng phổi do vi khuẩn nhạy cảm gây ra.
Dược động học
Hấp thu
Cefoperazon không được hấp thu thông qua đường tiêu hóa nên bắt buộc phải dùng đường tiêm truyền.
Dạng thường dùng của Cefoperazon là dạng muối natri .
Cmax trong huyết tương là 65 microgam/ml sau 1 giờ tiêm bắp thuốc với liều 1 g.
Phân bố
Cefoperazon có khả năng liên kết với protein huyết 82 – 93%, tùy theo nồng độ tiêm .
Cefoperazon được tìm thấy là phân bố tương đối ở các mô và dịch của cơ thể.
Thể tích phân bố biểu kiến:
Người lớn khoảng 10 – 13 lít/kg
Trẻ sơ sinh khoảng 0,5 lít/kg.
Cefoperazon có thể qua được nhau thai và được tìm thấy là bài tiết vào sữa mẹ với nồng độ thấp, tuy nhiên không qua được dịch não tủy.
Chuyển hóa
Không có dữ liệu.
Thải trừ
Thải trừ của Cefoperazon chủ yếu qua mật (70% – 75%).
Cefoperazon được tìm thấy trong nước tiểu và chủ yếu là được lọc qua cầu thận.
Có khoảng 30% liều thuốc được tìm thấy trong nước tiểu ở dạng không đổi.
Phương pháp sản xuất
Cefoperazon là một loại kháng sinh cephalosporin thế hệ thứ ba được sản xuất thông qua quá trình sinh học.
Chọn chủng vi khuẩn sản xuất
Sản xuất Cefoperazon bắt đầu bằng việc chọn một chủng vi khuẩn sản xuất, thường là các chủng vi khuẩn của họ Streptomyces hoặc Cephalosporium.
Chế biến nguồn dược liệu
Vi khuẩn sản xuất được tạo điều kiện tối ưu để tăng sản xuất hợp chất chính của Cefoperazon. Sau khi vi khuẩn đã phát triển đủ, nguồn dược liệu chứa Cefoperazon được thu thập và tiếp tục xử lý.
Quá trình lên men và sản xuất
Nguồn dược liệu chứa Cefoperazon được đưa vào quá trình lên men, trong đó vi khuẩn sản xuất tạo ra Cefoperazon thông qua các tác nhân sinh học và các phản ứng sinh học phức tạp. Quá trình lên men này diễn ra trong các bioreactor đặc biệt.
Tách và tinh chế
Sau khi quá trình lên men kết thúc, nguồn dược liệu chứa Cefoperazon được tách riêng khỏi các thành phần khác của nồng nghệ, chẳng hạn như vi khuẩn sản xuất và các chất còn lại từ quá trình lên men. Quá trình tách và tinh chế này có thể bao gồm sử dụng các phương pháp hóa học và vật lý như chiết xuất, lọc và sử dụng các dung môi.
Định hình cấu trúc và kiểm tra chất lượng
Các kỹ thuật phân tích được sử dụng để đảm bảo cấu trúc và chất lượng của Cefoperazon, bao gồm phân tích phổ hấp thụ tử ngoại (UV), sắc ký lỏng, khối lượng phân tử và các phương pháp khác.
Đóng gói và phân phối
Sau khi Cefoperazon đã được sản xuất và kiểm tra chất lượng, Cefoperazon sẽ được đóng gói trong các dạng phù hợp như bột hoặc dạng tiêm và sau đó được phân phối đến các cơ sở y tế để sử dụng trong điều trị nhiễm trùng.
Độc tính của Cefoperazon
Các triệu chứng quá liều được báo cáo bao gồm tiểu ra máu, tiêu chảy, buồn nôn, đau bụng trên và nôn.
Tương tác của Cefoperazon với thuốc khác
Sử dụng cùng lúc Cefoperazon và aminoglycosid có thể gây tăng nguy cơ tác động độc đối với chức năng thận.
Trong điều kiện in vitro, hoạt động kháng khuẩn của Cefoperazon và aminoglycosid có thể tương tác một cách cộng hưởng hoặc tương hợp chống lại một số vi khuẩn Gram âm, bao gồm Pseudomonas aeruginosa và Serratia marcescens.
Khi sử dụng cùng lúc Cefoperazon với warfarin và heparin, Cefoperazon có thể gây tác động tăng cường giảm prothrombin trong máu, dẫn đến nguy cơ tăng cao về chảy máu.
Trong trường hợp dùng đồng thời Cefoperazon với các loại thuốc độc cho gan, việc theo dõi chức năng gan là cần thiết.
Cefoperazon có khả năng làm giảm hiệu quả của vắc xin thương hàn.
Khi kiểm tra nồng độ đường huyết trong nước tiểu, Cefoperazon có thể dẫn đến kết quả dương tính giả.
Phản ứng tương tự với disulfiram có thể xảy ra khi uống rượu hoặc sản phẩm chứa rượu trong khoảng thời gian điều trị và trong vòng 72 giờ sau khi sử dụng Cefoperazon, gây ra các triệu chứng như đỏ mặt, ra mồ hôi, đau đầu, buồn nôn, nôn mửa và nhịp tim tăng nhanh.
Lưu ý khi dùng Cefoperazon
Lưu ý và thận trọng chung
Phản ứng quá mẫn chéo, bao gồm cả sốc phản vệ, đã được ghi nhận ở một số người bệnh dị ứng với kháng sinh nhóm beta-lactam, do đó việc sử dụng Cefoperazon cần cẩn trọng.
Cần theo dõi kỹ các biểu hiện và triệu chứng của sốc phản vệ sau lần dùng đầu tiên, đặc biệt đối với những người bệnh có tiền sử dị ứng với penicillin. Tuy nhiên, tần suất phản ứng quá mẫn chéo với penicillin khi sử dụng Cefoperazon thấp.
Việc sử dụng Cefoperazon trong thời gian dài có thể tạo điều kiện cho sự phát triển của các chủng kháng thuốc. Trong trường hợp nhiễm trùng gia tăng, cần ngừng sử dụng thuốc Cefoperazon.
Cần thận trọng khi kê đơn Cefoperazon cho người có vấn đề về đường tiêu hóa, đặc biệt là triệu chứng viêm đại tràng.
Việc theo dõi thời gian đông máu (prothrombin) cần thực hiện đối với người bệnh có nguy cơ giảm đông máu, và cân nhắc sử dụng vitamin K khi cần. Đặc biệt, cần theo dõi mức đông máu ở những người bệnh có rối loạn hấp thu hoặc dự phòng qua đường tĩnh mạch; việc sử dụng vitamin K có thể được xem xét.
Lưu ý cho người đang mang thai
Dựa trên nghiên cứu trên các loài chuột, chuột cống và khỉ, Cefoperazon không gây hại đến phôi thai. Cephalosporin thường được xem là an toàn trong thai kỳ.
Tuy nhiên, do thiếu thông tin từ các nghiên cứu kiểm soát chặt chẽ về việc sử dụng Cefoperazon trên thai phụ, Cefoperazon nên được sử dụng trong thai kỳ chỉ khi thực sự cần thiết.
Lưu ý cho người đang cho con bú
Cefoperazon được tiết vào sữa mẹ ở nồng độ thấp (khoảng 0,4 – 0,9 microgram/ml sau khi tiêm liều 1 g).
Tuy nồng độ thấp này không có tác động đáng kể đến trẻ sơ sinh đang bú mẹ, nhưng cần thận trọng khi sử dụng Cefoperazon cho người đang cho con bú.
Lưu ý cho người vận hành máy móc hay lái xe
Cefoperazon không gây ảnh hưởng đến nhóm đối tượng này.
Một vài nghiên cứu về Cefoperazon trong Y học
So sánh hiệu quả điều trị giữa tigecycline cộng với Cefoperazon-sulbactam liều cao và tigecycline đơn trị liệu trong điều trị viêm phổi liên quan đến thở máy do Acinetobacter baumannii kháng thuốc rộng rãi
Mục tiêu: Nghiên cứu này xem xét hiệu quả của Cefoperazon-sulbactam liều cao kết hợp với tigecycline đối với bệnh viêm phổi liên quan đến thở máy (VAP) do Acinetobacter baumannii (XDR-AB) kháng thuốc rộng rãi gây ra.
Vật liệu và phương pháp: 42 bệnh nhân VAP do nhiễm XDR-AB được chia ngẫu nhiên thành 2 nhóm: nhóm TIG (tiêm tigecycline) và nhóm TIG+CFS (tiêm tigecycline và Cefoperazon-sulbactam (1:1)). Điện di trên gel trường xung (PFGE) đã được sử dụng để tạo kiểu gen cho XDR-AB bị cô lập. Phương pháp vi pha loãng được sử dụng để kiểm tra nồng độ ức chế tối thiểu (MIC) của Cefoperazon-sulbactam hoặc tigecycline trong ống nghiệm và tác dụng kết hợp được xác định bằng phương pháp bàn cờ.
Kết quả: Tổng tỷ lệ hiệu quả kết hợp (bao gồm tất cả bệnh nhân đã chứng minh tình trạng được cải thiện) cao hơn đáng kể ở nhóm TIG+CFS (85,7%) so với nhóm TIG (47,6%) (p = 0,010). Không có sự khác biệt đáng kể nào được ghi nhận liên quan đến các phản ứng bất lợi giữa hai nhóm. 42 chủng XDR-AB phân lập được phân thành bốn loại. MIC của hai loại thuốc kết hợp thấp hơn đáng kể so với từng loại thuốc được sử dụng riêng lẻ (p <0,05).
Kết luận: Liều cao Cefoperazon-sulbactam có thể cải thiện hoạt tính kháng vi sinh vật của tigecycline đối với XDR-AB. .
Tài liệu tham khảo
- Drugbank, Cefoperazon , truy cập ngày 07/08/2023.
- Pubchem, Cefoperazon, truy cập ngày 07/08/2023.
- Qin, Y., Zhang, J., Wu, L., Zhang, D., Fu, L., & Xue, X. (2018). Comparison of the treatment efficacy between tigecycline plus high-dose Cefoperazon-sulbactam and tigecycline monotherapy against ventilator-associated pneumonia caused by extensively drug-resistant Acinetobacter baumannii. International Journal of Clinical Pharmacology and Therapeutics, 56(3), 120.
Xuất xứ: Ấn Độ
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Hàn Quốc
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Công hòa Síp
Xuất xứ: Ấn Độ
Xuất xứ: Ấn Độ