Chưa có sản phẩm trong giỏ hàng.
Hóa sinh
Hóa học Hemoglobin: Cấu tạo, tính chất, các bệnh di truyền Hemoglobin
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
nhathuocngocanh – Hóa học Hemoglobin: Cấu tạo, tính chất, các bệnh di truyền Hemoglobin
ĐẠI CƯƠNG
- O2 rất cần thiết cho cơ thể người và ĐV, lưu thông trong máu nhưng lại hòa tan rất kém trong máu và không thể vận chuyển hiệu quả đến mô => Cần có cơ chế vận chuyển hiệu quả => Vận chuyển bằng Pr vận chuyển hemoglobin của hồng cầu.
- Trung bình 1 ngày máu vận chuyển 600 lít khí O2 từ phổi đến các mô, trong đó lượng O2 hòa tan rất ít: Cứ 100ml máu chứa 0,39 ml O2 hòa tan.
- Hồng cầu người bình thường có kích thước trung bình khoảng 8 pm ( 6-9 pm), hình đĩa lõm 2 mặt, được hình thành từ những tế bào tiền thân là các nguyên bào máu (hemocytoblast).
- Trong quá trình trưởng thành, nguyên bào máu sinh ra những tế bào con, tạo phần lớn hemoglobin và mất dần các bào quan như nhân, ty thể, lưới nội sinh chất,… => Tế bào hồng cầu trưởng thành là tế bào không hoàn chỉnh, không có nhân và không còn khả năng sinh sản.
- Hồng cầu có đời sống khoảng 120 ngày, có khả năng mang hemoglobin (chiếm khoảng 3234% trọng lượng hồng cầu, tương đương khoảng
- Chức năng chính của hồng cầu là vận chuyển O2 từ phổi tới mô, tham gia vận chuyển CO2 và H+ từ mô đến phổi.
- Trong máu động mạch từ phổi đến mô, khoảng 96% hemoglobin bão hòa với O2, còn máu tĩnh mạch về tim có khoảng 64% hemoglobin bão hòa với O2 do máu đã giải phóng 1/3 lượng O2 nó mang khi qua mô (khoảng 6,5ml O2/100ml máu trên 20ml O2/100ml máu).
CẤU TẠO CỦA HEMOGLOBIN
- Hemoglobin (Hb) có màu đỏ, hình cầu, đường kính khoảng 5,5 nm, trọng lượng phân tử khoảng 64000-65000.
- Là 1 Pr có 4 bán đơn vị, mỗi bán đơn vị có phần Pr thuần là globin và nhóm ngoại là hem.
Hem
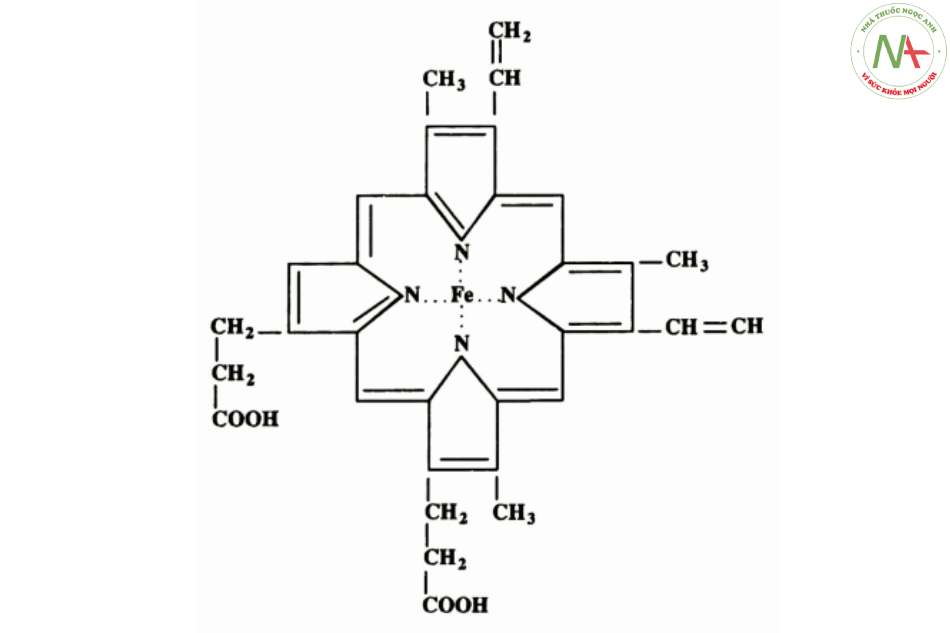
- Bao gồm 1 cấu trúc vòng phức tạp là protoporphyrin III (IX) gắn với 1 nguyên tử sắt ở dạng sắt hóa trị 2 (Fe2+).
- Cấu tạo vòng porphin và porphyrin. Porphin
- Là 1 hợp chất gồm 4 vòng pyrol liên kết với nhau bằng cầu nố’i methylen.
Porphyrin:
– Khi porphin thêm gốc hóa học nhất định ở các đỉnh sẽ tạo nên porphyrin, tùy theo gốc hóa học ở đỉnh mà có các loại porphyrin khác nhau.
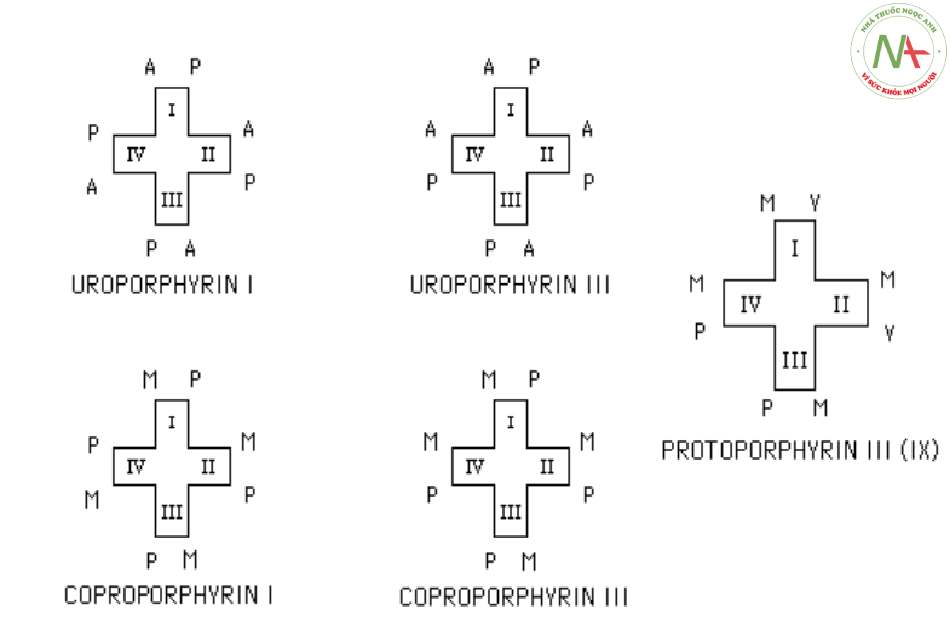
Xét theo cấu trúc hóa học:
+ Dạng porphyrin có nhóm hóa học sắp xếp theo thứ tự (cân xứng, lần lượt) xếp vào nhóm I.
+ Dạng porphyrin có nhóm hóa học sắp xếp theo thứ tự ngược lại xếp vào nhóm III.
Trong tự nhiên chỉ có loại I và III, trong đó loại III phong phú và quan trọng hơn vì có hem.
Protoporphyrin III (IX):
- Được cấu tạo từ porphin (tetrapyrol).
- Có chứa các nhóm thế 2P (acid propionic), 2V (vinyl) và 4 M (methyl) trên 8 vị trí của 4 vòng pyrol (là một dị vòng 5 cạnh).
- Kết hợp với 1 nguyên tử sắt hóa trị II (Fe2+) bằng 4 liên kết với nguyên tử N của vòng pyrol (2 liên kết phối trí và 2 liên kết cộng hóa trị).
| Tên gốc | Công thức | Ký hiệu |
| Methyl | – CH3 | M |
| Ethyl | – CH2-CH3 | E |
| Hydroxyethyl | – CH2-CH2COOH | E – OH |
| Vinyl | -CH=CH2 | V |
| Acetat | – CH2-COOH | A |
| Propyonat | – CH2-CH2-COOH | P |
– Một số porphyrin thường gặp được trình bày ở hình sau:
Hem
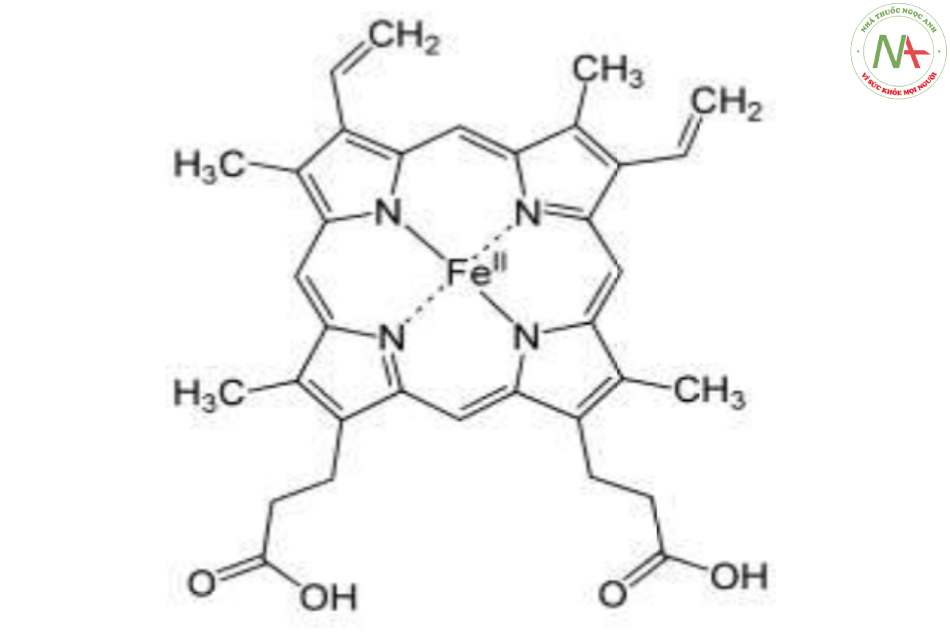
- Bắt nguồn từ protoporphyrin III (IX) gắn với Fe2+.
Tổng kết về hem
- Là 1 phân tử có 4 vòng pyrol nố’i bởi cầu nố’i methylen.
- Mặt phẳng phân tử hấp thụ ánh sáng, làm cho hem có màu đỏ đậm.
- Các gố’c methyl (M), vinyl (V) và propyonat (P) được xếp theo thứ tự M, V, M, V, M, P, P, M.
- Fe2+ ở vị trí trung tâm, liên kết với protoporphyrin III (IX) bằng 2 liên kết cộng hóa trị và 2 liên kết phối trí.
- Fe2+ có thể gắn kết oxy thuận nghịch, trong khi dạng Fe3+ (khi Fe2+ bị oxy hóa, nhân hem thành nhân hematin) không còn khả năng gắn oxy => Mất chức năng sinh học.
Globin
Loại Pr vận chuyển khí, đặc biệt là O2 nhằm cung cấp và vận chuyển khí trong hoạt động hô hấp của tế bào.
Ở người trưởng thành: + Globin của Hb gồm 4 chuỗi polypeptid trong đó có 2 chuỗi chuỗi 0 (mỗi chuỗi gồm 146aa).
+ Gọi là HbA hay HbA1 («202), chiếm 98%.
– Ngoài HbA1 («202), còn có một số’ dạng hemoglobin thường gặp khác là:
HbG I K2S2), HbG II (a2£2), HbP I K2V2). HbP II «2^2):
HbF («2V2): Dạng Hb chủ yế’u của bào thai, chiếm khoảng 0,5% ở người trưởng thành.
HbA2 («262): Dạng Hb chiếm khoảng 2-3% Hb của người trưởng thành.
– Các giai đoạn hình thành globin:
Giai đoan đầu của phôi thai người: Chủ yếu là Z2 £2.
Cuối tháng thứ 3 của thai kỳ: Chuỗi z và £ bị thay thế bằng a và Y, tạo nên HbF – loại Hb của giai đoạn sau bào thai.
3 tháng cuố’i của thai kỳ: Sự tổng hợp chuỗi 0 bắt đầu và dần thay thế cho chuỗi Y để hình thành nên HbA.
Mỗi chuỗi polypeptid bao gồm 7-20 các đoạn xoắn a-helice tùy theo các loại globin khác nhau.
Từ đầu amin tận, các đoạn xoắn đặt tên từ A-H, trong đó đoạn E và F có vị trí gắn với hem.
Toàn bộ chuỗi polypeptid chứa các acid amin không phân cực như Leu, Val, Phe và Met, trừ 2 vị trí ngoại lệ là histidine vị trí số 7 của đoạn E (E7) và histidine ở vị trí số 8 của đoạn F (F8) => Gắn với Fe2+ của hem ở E7 và F8.
Các chuỗi polypeptid khác loại liên kết với nhau rất mạnh => Tạo cấu trúc bậc 4 của Hb:
+ Tương tác Ơ1-01 (cũng như tương tác a2 02): Hơn 30 vị trí.
+ Tương tác Ơ1-02 (cũng như tương tác a2 01): Hơn 19 vị trí.
Các tương tác chủ yếu là tương tác kỵ nước, còn lại là tương tác hydro và cuối cùng là tương tác ion (tuy ít nhưng có vai trò quan trọng).
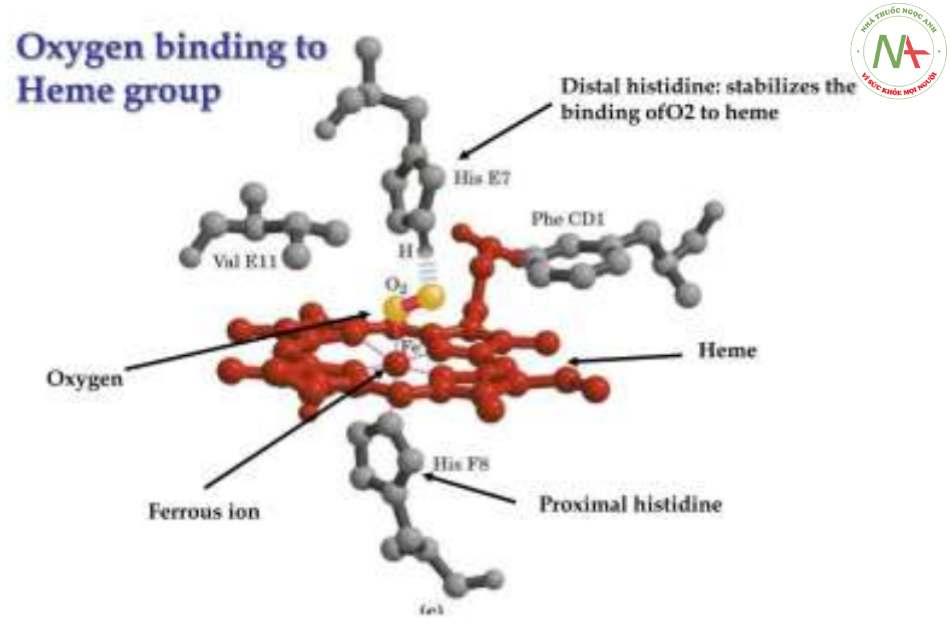
Sự kết hợp giữa hem và globin
Mỗi chuỗi polypeptid của globin gắn với 1 hem bằng 2 liên kết phối trí giữa Fe2+ của hem với N của nhân imidazol thuộc aa histidine E7 và F8, tạo thành 1 bán đơn vị của hemoglobin.
= > Như vậy, nguyên tử Fe2+ trong 1 bán đơn vị của hemoglobin có 6 liên kết, bao gồm:
+ 4 liên kết với N trong protoporphyrin (2 liên kết cộng hóa trị và 2 liên kết phối trí).
+ 2 liên kết với chuỗi polypeptid của globin nằm về hai phía mặt phẳng (2 liên kết phối trí).
Khi Hb kết hợp với O2 thì liên kết của histidine E7 với Fe2+ bị đứt vì nằm xa hơn so với F8 nên liên kết này yếu và dễ gãy hơn tạo điều kiện cho phân tử O2 thế vào vị trí E7.
TÍNH CHẤT CỦA HEMOGLOBIN
Vận chuyển khí oxy
Hb kết hợp thuận nghịch với O2 => Tạo
Đây là phản ứng gắn oxy, không phải phản ứng oxy hóa.
1 nguyên tử Fe2+ của hem gắn với 1 phân tử O2 => 1 phân tử Hb gắn tối đa 4 phân tử O2.
Hb + 4O2-->>Hb(O2)4
Hb có 2 dạng cấu hình chính là dạng T (tense/taut: căng) và dạng R (relaxed: giãn).
Dạng T được ổn định bởi tương tác ion, trong đó có nhiều tương tác a1-02 (cũng như tương tác a2- 01).
Khi gắn O2 vào 1 bán đơn vị dạng T => Thay đổi cấu hình, dạng T thành dạng R.
Sự gắn O2 đầu tiên vào oxyhemoglobin kéo Fe2+ về mặt phẳng vòng porphyrin => Kéo theo His F8 => Liên kết muối giữa các gốc carboxyl 4 bán đơn vị Hb bị gãy => 1 cặp a/p quay 1 trục 15 độ so với cặp còn lại => Thay đổi cấu trúc bậc 2, 3 và 4 cùng ái lực cao với O2 làm hem chuyển từ dạng T sang dạng R.
Ái lực của O2 cao hơn đáng kể ở dạng R (O2 ổn định dạng R), nhưng khi không có O2 thì dạng T ổn định hơn => Dạng T (deoxyhemoglobin) chiếm ưu thế hơn.
Chiều phản ứng gắn O2 vào Hb phụ thuộc phân áp O2 môi trường:
+ Ở phổi có phân áp O2 cao (khoảng 13,3 kPa) => Hb kết hợp O2.
+ Ở mô có phân áp O2 thấp (khoảng 4 kPa) => HbO2 phân ly.
– Ngoài Hb, 1 số Pr có khả năng gắn với O2, VD: Myoglobin (Mb) ở cơ,…
– Xét về ái lực với O2 của Pr: + Nếu Pr có ái lực O2 cao: Dễ gắn O2 ở phổi, khó nhả O2 ở mô.
+ Nếu Pr có ái lực O2 thấp: Khó gắn O2 ở phổi, dễ nhả O2 ở mô.
= > Hb có thể chuyển đổi giữa dạng có ái lực thấp với O2 (dạng T) sang dạng có ái lực cao với O2 (dạng R).
Khi O2 gắn với 1 bán đơn vị của Hb sẽ làm thay đổi ái lực với O2 của bán đơn vị kề bên (O2 gắn vào Hb dễ hơn nếu đã có O2 gắn vào trước đó).
= > Khi gắn O2 vào bán đơn vị thứ nhất thì sự chuyển từ dạng T sang dạng R dễ dàng hơn ở bán đơn vị thứ 2, tiếp tục như đến khi bán đơn vị thứ 4 cũng gắn được với O2.
Sự gắn kết này còn được gọi là tương tác Hem-Hem chứng tỏ vai trò của Hb trong hô hấp là lấy O2 tối đa tại phổi và phân phối O2 tối đa tại mô.
Vận chuyển CO2 và H+
Hb vận chuyển CO2 và H+ từ mô đến phổi.
Hb chuyên chở CO2 dưới dạng carbamate với nhóm amin tự do của globin, đây cũng là phản ứng thuận nghịch.
CO2+ Hb- H3 = 2H*+ Hb—N—C—O”
Chiều phản ứng phụ thuộc phân áp CO2:
+ Ở mô: Phân áp CO2 cao => Tạo HbCO2.
+ Ở phổi: Phân áp CO2 thấp => Nhả CO2.
Carbamate thay đổi điện tích ở đầu amin từ dương sang âm => Tạo điều kiện hình thành các cầu nối muối giữa chuỗi a và p.
Hb carbamate mang khoảng 15% CO2 trong máu tĩnh mạch, còn lại là CO2 dưới dạng HCO3–:
+ Tại hồng cầu, CO2 được hydrat hóa thành H2CO3 dưới xúc tác của enzyme carbonic anhydrase. + Ở pH máu động mạch, H2CO3 phân ly thành HCO3– và H+.
– Hb có vai trò quan trọng trong hệ đệm của máu:
+ Ở mô ngoại biên, nơi pH thấp và có sự hình thành carbamate làm ổn định dạng T => Giải phóng O2.
+ Ở phổi, quá trình xảy ra ngược lại => Giải phóng CO2.
+ Khi O2 gắn vào deoxyhemoglobin, H+ được giải phóng, kết hợp với HCO3- tạo H2CO3, sau đó tạo CO2 và H2O rồi được đẩy ra ngoài.
– Sự gắn kết O2 và H+ có tính tương hỗ này gọi là hiệu ứng Bohr, phụ thuộc vào sự tương tác giữa các hem trong phân tử Hb.
Cơ chế:
+ Khi O2 gắn vào deoxyhemoglobin (Hb dạng T) => Làm gãy các cầu nối muối (gồm His 146 trong chuỗi P) => Nhả H+ từ His 146 => H+ gắn với HCO3- tạo H2CO3.
+ Khi dạng R của Hb nhả O2 => Dạng T và cầu nối muối được tái lập => Tăng pKa của His 146 chuỗi p => Gắn H+.
+ 1 deoxyhemoglobin khi giải phóng 2 phân tử O2 gắn được 1 H+.
Vai trò 2,3-biphosphoglycerate trong điều hòa gắn kế’t O2 vào Hb
– Phân áp O2 thấp ở mô thúc đẩy tổng hợp 2,3-biphosphoglycerate (BPG) ở hồng cầu.
- Mỗi phân tử Hb gắn được 1 phân tử BPG ở trung tâm 4 bán đơn vị, nhưng khoảng cách giữa 2 đoạn xoắn H của 2 chuỗi p đủ rộng cho việc gắn BPG khi Hb ở dạng T => BPG giúp ổn định Hb dạng T bằng cách hình thành cầu nối muối với nhóm amin tận 2 chuỗi p.
- Nếu không có BPG, quá trình chuyển dạng T sang dạng R của Hb sẽ dễ dàng hơn.
Chức năng của BPG:
- Điều hòa ái lực gắn kết O2 của Hb (liên quan đến phân áp oxy ở phổi).
– Đóng vai trò quan trọng trong việc thích ứng với phân áp O2 khi ở vùng núi cao.
VD:
Xét 1 người khỏe mạnh sống ở vùng ngang mực nước biển, đang hoạt động nhẹ:
+ Ở phổi: Hb gần như bão hòa với O2.
+ Ở mô: Khoảng 60% O2 bão hòa => 40% O2 giải phóng cho mô.
Nếu người này đột ngột di chuyển đến vùng núi có độ cao 4500m so với mực nước biển (nơi phân áp oxy thấp) => Lượng oxy cung cấp cho mô chỉ còn 30% (giảm 1/4 so với lúc đầu).
Sau vài giờ ở độ cao đó, nồng độ BPG trong máu tăng => Giảm ái lực Hb với O2 => Ảnh hưởng rất nhỏ đến gắn O2 ở phổi, nhưng đáng kể đến nhả O2 ở mô => Tăng lại lên 40% tổng lượng O2 trong máu ban đầu.
Kết hợp với CO
- Hb kết hợp CO tạo HbCO (carboxyhemoglobin) rất bền vững nhưng không có chức năng vận chuyển O2.
- Do Hb có ái lực cao với CO (hơn 250 lần so với ái lực Hb với O2) => CO có thể đẩy O2 khỏi HbO2.
- HbO2 + CO HbCO + O2
- Ở người khỏe mạnh, <1% Hb ở dạng phức hợp HbCO.
- Ở người hút thuốc lá, 3-8% Hb ở dạng phức hợp HbCO, thậm chí lên đến 15%.
- Hít nhiều CO gây ngộ độc, khi HbCO chiếm khoảng 60% tổng Hb => Gây tử vong.
Methemoglobin
- Hậu quả khi Fe2+ của hem bị oxy hóa thành Fe3+.
- Không thể gắn và vận chuyển O2.
- Được cơ thể khử trở lại Fe2+ nhờ tác dụng của enzym methemoglobin reductase.
- Tăng trong các trường hợp:
+ Hiện diện các chất oxy hóa như sulfonamide, nitrit, clorat, cyanua,…
+ Bệnh Hb M.
+ Giảm hoạt động enzym methemoglobin reductase.
Một số tính chất khác của Hb
– Hb có tính chất như một enzym oxydoreductase xúc tác cho phản ứng oxy hóa-khử ngay cả khi bị biến tính:
H2O2 + AH2 -->> 2H2O + A
– Ngoài ra, Hb còn có hoạt tính như 1 catalase:
H2O2 -->> 2H2O +O2
BỆNH DI TRUYỀN HEMOGLOBIN
Là 1 nhóm bệnh lý đa dạng về mặt sinh lý bệnh học cũng như triệu chứng lâm sàng.
Các biến thể bất thường của Hb
Ngày nay, người ta phát hiện hơn 1000 biến thể Hb.
Tuy nhiên, chỉ có 1/3 số này có đột biến tại các vùng mang chức năng của Hb => Gây ra triệu chứng lâm sàng.
Quan trọng nhất về mặt tần suất và độ nặng của bệnh là 3 loại Hb bất thường sau đây:
HbS: Đột biến làm acid glutamic ở vị trí số’ 6 chuỗi p thay bằng valin.
HbC: Đột biến làm acid glutamic ở vị trí số’ 6 chuỗi p thay bằng lysin.
HbE: Đột biến làm acid glutamic ở vị trí số 26 chuỗi p thay bằng lysin.
Bệnh Thalassemia
Là bệnh di truyền thường gặp nhất trên thế giới.
Do giảm hay mất chuỗi tổng hợp Hb.
Tùy chuỗi globin bị ảnh hưởng mà bệnh Thalassemia khác nhau:
+ a-Thalassemia: Thường gặp nhất.
+ 0-Thalassemia: Có triệu chứng lâm nhất.
= > Đây là 2 thể bệnh được quan tâm nhiều nhất.
Biểu hiện lâm sàng bệnh đa dạng, từ không có triệu chứng đến thiếu máu nặng, tử vong trong những năm đầu đời.
==>> Xem thêm: HÓA HỌC LIPID: THÀNH PHẦN, CẤU TRÚC, PHÂN LOẠI VÀ VAI TRÒ
