Bệnh hô hấp
Hỗ trợ hô hấp cá nhân hóa trong ARDS: Đánh giá sinh lý học đến tại giường
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Bài viết Hỗ trợ hô hấp cá nhân hóa trong ARDS: Đánh giá sinh lý học đến tại giường – tải PDF Tại đây.
J Clin Med. 2023 Jul; 12(13): 4176.
Bản dịch của BS. Đặng Thanh Tuấn – BV Nhi Đồng 1
Tóm tắt
Hội chứng nguy kịch hô hấp cấp tính (ARDS) là nguyên nhân hàng đầu gây ra tàn tật và tử vong trên toàn thế giới, và mặc dù không có biện pháp can thiệp căn nguyên cụ thể nào được chứng minh là giúp cải thiện kết quả, nhưng các chiến lược hỗ trợ hô hấp không xâm lấn và xâm lấn là những biện pháp can thiệp cứu sống, giúp phổi có thời gian phục hồi. Tuy nhiên, việc quản lý không phù hợp các chiến lược này, bỏ qua các đặc điểm riêng của cơ học hô hấp, phổi và thành ngực có thể dẫn đến tiến triển của bệnh, chẳng hạn như bệnh nhân tự gây tổn thương phổi trong quá trình thở tự nhiên hoặc do tổn thương phổi do máy thở gây ra trong quá trình thông khí cơ học xâm lấn. Các đặc điểm của ARDS rất không đồng nhất; Vì vậy, một cách tiếp cận dựa trên sinh lý học được ủng hộ mạnh mẽ để chuẩn độ việc cung cấp và quản lý các chiến lược hỗ trợ hô hấp để phù hợp với đặc điểm của bệnh nhân và nhu cầu hạn chế tiến triển ARDS. Một số công cụ đã được triển khai trong thực hành lâm sàng để hỗ trợ bác sĩ lâm sàng xác định các kiểu hình phụ ARDS dựa trên các đặc thù sinh lý (nỗ lực hít vào, cơ học hô hấp và khả năng huy động), do đó cho phép áp dụng chăm sóc hỗ trợ cá nhân hóa phù hợp. Trong bài đánh giá tường thuật này, chúng tôi cung cấp tổng quan về các chiến lược hỗ trợ hô hấp không xâm lấn và xâm lấn, cũng như thảo luận về cách xác định các kiểu hình phụ của ARDS trong thực hành hàng ngày có thể giúp các bác sĩ lâm sàng cung cấp dịch vụ hỗ trợ hô hấp được cá nhân hóa và có khả năng cải thiện kết quả của bệnh nhân.
Giới thiệu
Hội chứng nguy kịch hô hấp cấp tính (acute respiratory distress syndrome, ARDS) là một dạng suy hô hấp do thiếu oxy cấp tính (acute hypoxemic respiratory failure, AHRF) đe dọa đến tính mạng và nó là nguyên nhân nổi bật khiến việc nhập viện vào các đơn vị chăm sóc đặc biệt (ICU) [1]. Các dấu hiệu nổi bật của ARDS là suy giảm trao đổi khí (chủ yếu là thiếu oxy máu) [2, 3] và tổn thương phổi, được đặc trưng bởi thâm nhiễm viêm lan tỏa, tràn ngập phế nang và xẹp phổi với giảm độ giãn nở của phổi [4]. Định nghĩa về ARDS đã được thay đổi một chút kể từ lần mô tả đầu tiên vào năm 1967 [5] và cách phân loại gần đây nhất bắt nguồn từ “định nghĩa Berlin” vào năm 2012 [6]. Định nghĩa này tập trung vào những điều sau: khởi phát gần đây (trong vòng một tuần kể từ khi biết được thương tổn); giảm oxy máu, được đánh giá ở áp lực dương cuối thì thở ra (PEEP) tối thiểu là 5 cmH2Ơ thông qua áp lực riêng phần O2 động mạch (PaƠ2) với tỷ lệ nồng độ oxy hít vào (FiO2) (được xếp loại là nhẹ (PaO2/FiO2 < 300), trung bình (PaO2/FiO2 < 200) hoặc nghiêm trọng (PaO2/FiO2 < 100)); thâm nhiễm phổi hai bên trong ngực, được đánh giá qua X-quang; và phù phổi không liên quan đến quá tải dịch và không do tim. Từ quan điểm dịch tễ học, nghiên cứu LUNG SAFE [1] tiết lộ rằng ARDS ảnh hưởng đến 23% bệnh nhân bị bệnh nặng và cần thở máy (10% bệnh nhân ICU); hơn nữa, nó chịu gánh nặng bởi tỷ lệ tử vong tại bệnh viện là 46% đối với những trường hợp nghiêm trọng nhất. Tuy nhiên, dữ liệu gần đây [7] cho thấy hơn 93% bệnh nhân mắc AHRF được điều trị bằng oxy lưu lượng cao (HFOT, một phương pháp hỗ trợ hô hấp không xâm lấn không nằm trong tiêu chuẩn chẩn đoán của ARDS) và sau đó tiếp tục được điều trị PaO2/FIO2 <300 sau khi đặt nội khí quản và khi thở máy xâm lấn áp lực dương (IMV), do đó có nghĩa là tỷ lệ mắc ARDS cao hơn so với báo cáo hiện tại [1]. Trong bối cảnh này, cơ sở chính để quản lý ARDS bao gồm các chiến lược hỗ trợ hô hấp không xâm lấn [8] và xâm lấn [9], vai trò cụ thể và tương hỗ của chúng không rõ ràng nhưng phát triển theo sự hiểu biết về sinh học [10], X quang và lâm sàng. tính không đồng nhất (ví dụ, các sự kiện tổn thương, rối loạn chức năng cơ quan thứ cấp và mức độ nghiêm trọng của bệnh) [11, 12, 13] của bệnh.
Trong bài đánh giá tường thuật này, chúng tôi sẽ cung cấp tổng quan về các chiến lược hỗ trợ hô hấp không xâm lấn và xâm lấn trong bối cảnh ARDS. Cụ thể, chúng tôi sẽ tập trung vào các kiểu hình phụ của ARDS có các đặc thù cụ thể về cơ học của hệ thống hô hấp và điều này có thể định hướng cách tiếp cận cá nhân hóa đối với các chiến lược hỗ trợ hô hấp.
Khái niệm về phổi em bé
Khái niệm “phổi em bé” (baby lung) được giới thiệu bởi Gattinoni và Pesenti vào năm 1987 [14], và nó đại diện cho một mô hình để giải thích các đặc điểm cơ học của phổi bị tổn thương trong bối cảnh ARDS. Bằng cách sử dụng CT-scan một cách có hệ thống, các tác giả đã chứng minh rằng lượng mô phổi được thông khí bình thường khi thở ra chủ yếu nằm ở vùng phổi không phụ thuộc: kích thước của nó tương quan với độ giãn nở hô hấp và tương đương về mặt kích thước với kích thước phổi của một đứa trẻ khỏe mạnh. Ngược lại, số lượng mô phổi không được sục khí, đông đặc và xẹp chủ yếu nằm ở vùng phổi phụ thuộc và nó có tương quan với tình trạng thiếu oxy máu, phân suất shunt và tăng huyết áp phổi. Trong bối cảnh này, độ giãn nở hô hấp thể hiện ước tính đáng tin cậy về kích thước phổi em bé, có đặc điểm cơ học gần như bình thường [15, 16, 17]. Mô hình giải phẫu này đã bị thách thức bởi quan sát rằng tư thế nằm sấp dẫn đến sự phân phối lại phổi em bé từ vùng không phụ thuộc sang vùng phụ thuộc [18, 19]. Sinh lý bệnh của hiện tượng này dựa trên sự phân bố rộng rãi của phù viêm, và điều này có nghĩa là trọng lượng phổi tăng lên gây ra áp lực thủy tĩnh (áp lực chồng chất) theo độ dốc trọng trường dọc [4, 20]. Theo đó, các vùng phổi có khí bị ép và nén bởi nhu mô nặng ở trên, do đó biện minh cho sự phân phối lại của phổi em bé sau khi thay đổi vị trí cơ thể [4]. Những phát hiện này đã khiến các nghiên cứu công nhận khái niệm phổi em bé như một mô hình chức năng [4, 20], trong đó về cơ bản phổi hoạt động như một “bọt biển” [21].
Tổn thương phổi do bệnh nhân tự gây ra (P-SILI)
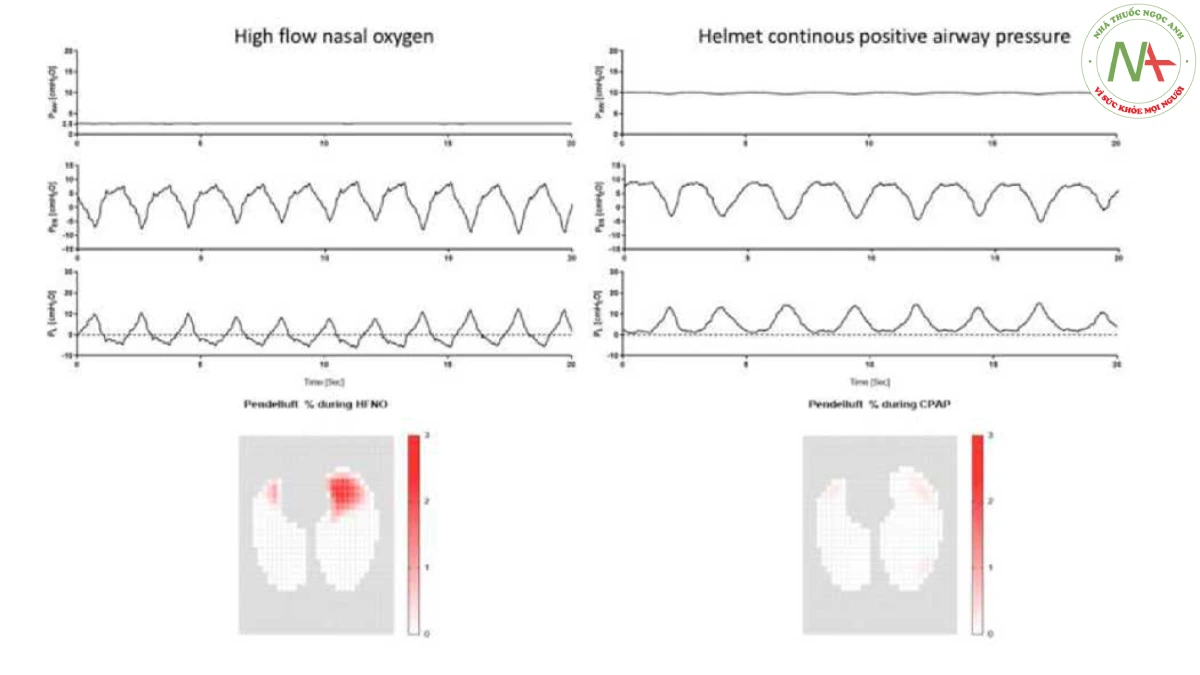
Tổn thương phổi do bệnh nhân tự gây ra (P-SILI) đề cập đến tác hại của việc tự thở đối với phổi bị tổn thương [22, 23, 24], và nó được đặc trưng bởi sự tăng hoạt trung khu hô hấp và nỗ lực hít vào dữ dội (có hoặc không có thở nhanh). Những hiện tượng này, cùng với sự không đồng nhất của khu vực về độ giãn nở của phổi, gây ra sự dao động mạnh mẽ của áp lực xuyên phổi (APl) với sự căng quá mức của khu vực, áp lực xuyên phổi quá mức và chấn thương do xẹp phổi [25, 26, 27]. Cụ thể, tăng cường hít vào tạo ra thể tích khí lưu thông lớn hơn (Vt), dẫn đến căng phồng phổi em bé, hậu quả là biến dạng cơ học và tổn thương [28]. Hơn nữa, sự phân bố không đồng nhất của APl tạo ra chênh lệch áp lực phế nang và sự dịch chuyển khí từ vùng bụng không phụ thuộc vào vùng phổi phụ thuộc vào lưng (tức là, pendelluft) [29], và điều này xảy ra với hậu quả là căng phồng quá mức và tổn thương vùng phổi sau (Hình 1). Cuối cùng, nỗ lực hít vào mạnh mẽ tác động lên khoảng kẽ làm tăng áp lực mạch máu xuyên thành và dẫn đến phù phổi thủy tĩnh [24, 30].
Tổn thương phổi do thở máy (VILI)
Sinh lý bệnh của VILI dựa trên việc quản lý IMV không phù hợp mà bỏ qua các đặc điểm tiến triển của cơ học phổi (kích thước và tính chất đàn hồi), do đó gây ra chấn thương thể tích, chấn thương khí áp và chấn thương do xẹp phổi [31]. Cụ thể, máy thở cơ học tác động một lượng lực nhất định (như thể tích và áp lực) lên cấu trúc khung xương của phổi, cấu trúc này bao gồm elastin có thể mở rộng và collagen không thể mở rộng, do đó dẫn đến sự kéo dài (strain) và căng thẳng (stress) của sợi xơ. Volutrauma gây ra bởi một căng thẳng phi sinh lý do siêu bơm phồng và nó gây ra sự kích hoạt cơ chế thụ thể, sản xuất cytokine và tình trạng viêm nặng hơn [4]. Chấn thương khí áp phát triển khi stress lấn át tính chất căng của các sợi phổi dẫn đến vỡ nhu mô (ví dụ, tràn khí màng phổi [32]). Chấn thương do xẹp phổi gây ra bởi việc đóng mở đường thở và các đơn vị phổi lặp đi lặp lại [33]. Vì những lý do này, cách tiếp cận IMV dựa trên sinh lý học, lấy bệnh nhân làm trung tâm, được cá nhân hóa đã được ủng hộ mạnh mẽ [6, 9].
- Hình 1
Đường cong áp lực đường thở, áp lực thực quản và áp lực xuyên phổi của một bệnh nhân đang được điều trị bằng oxy mũi lưu lượng cao (bảng bên trái) và áp lực đường thở dương liên tục qua mũ bảo hiểm (bảng bên phải). Trong (các bảng dưới cùng), hiệu ứng pendelluft được mô tả: các vùng có màu đỏ tươi biểu thị hiệu ứng pendelluft cao, trong khi các vùng màu trắng biểu thị không có hiệu ứng pendelluft. Tỷ lệ phần trăm liên quan đến tổng thể tích khí lưu thông. Mặc dù bệnh nhân có nỗ lực hít vào tương tự nhau, dẫn đến cùng một áp lực xuyên phổi trong cả giai đoạn lưu lượng cao và giai đoạn mũ bảo hiểm, PEEP được sử dụng qua mũ bảo hiểm đã làm giảm hiệu quả hiệu ứng pendelluft, như thể hiện trong (bảng dưới cùng).
Hỗ trợ không xâm lấn
Lợi ích và tác hại của việc duy trì nhịp thở tự nhiên
Hỗ trợ hô hấp không xâm lấn (Noninvasive respiratory support, NIRS) bao gồm liệu pháp oxy tiêu chuẩn (standard oxygen therapy, SOT), HFOT, áp lực đường thở dương liên tục (continuous positive airway pressure, CPAP) và thông khí không xâm lấn (noninvasive ventilation, NIV) [34]. Các chiến lược này chia sẻ ở chỗ được áp dụng bên ngoài cho đường hô hấp trên, do đó duy trì các cơ chế sinh lý bảo vệ hệ hô hấp (ví dụ: thanh thải khí, ho, huy động chất tiết và dẫn lưu) [35, 36] và thở tự nhiên, với sự thông khí được cải thiện ở vùng lưng, vùng phổi phụ thuộc [37]. Hơn nữa, việc áp dụng NIRS có thể ngăn ngừa các biến chứng lâm sàng liên quan đến đặt nội khí quản và IMV, chẳng hạn như viêm phổi liên quan đến thở máy (ventilator-associated pneumonia, VAP) [36], mê sảng [38], và yếu cơ [39]. Tuy nhiên, đặt nội khí quản và IMV được yêu cầu ở 30-60% bệnh nhân được điều trị ban đầu bằng NIRS. Quan trọng nhất, thất bại của NIRS có liên quan độc lập với tỷ lệ tử vong gia tăng [40, 41, 42], điều này có thể được giải thích hợp lý bởi sự phát triển của P-SILI trong quá trình điều trị.
Chiến lược và cài đặt
Liệu pháp oxy lưu lượng cao
HFOT cung cấp hỗn hợp dòng khí được làm nóng và làm ẩm gồm oxy và không khí lên đến 60 L/phút, với F1O2 được thiết lập lên đến 100% thông qua ống thông mũi có lỗ lớn (nghĩa là liệu pháp oxy qua mũi lưu lượng cao, HFNOT) [34, 43, 44] (Bảng 1). Các tác dụng sinh lý chính của HFOT như sau: phân phối chính xác một F1O2 phù hợp với lưu lượng hít vào tối đa của bệnh nhân và cho phép đánh giá đáng tin cậy tỷ lệ PaO2/FiO2 [7]; rửa sạch khoảng chết ở mũi họng, làm tăng hiệu quả thông khí và giảm công thở; hiệu ứng áp lực dương phụ thuộc vào lưu lượng (3-5 cmH2O), cho phép huy động phổi, cải thiện quá trình oxygen hóa và cải thiện cơ học phổi; chủ động làm ẩm và sưởi ấm đường hô hấp trên, hỗ trợ quá trình hydrat hóa và giải phóng chất tiết; và sự thoải mái của bệnh nhân [45, 46].
Thở áp lực dương liên tục
CPAP cung cấp áp lực dương liên tục cho đường hô hấp trên thông qua các giao diện mặt nạ hoặc mũ bảo hiểm [47] (mô tả chi tiết của nó được tóm tắt trong Bảng 1 [34, 43]). Tóm lại, áp lực dương 5-8 cmH2O đối với mặt nạ (áp lực cao hơn có thể dẫn đến rò rỉ khí tăng lên tương ứng với sự không phù hợp do đó giữa áp lực đặt và áp lực phân phối, điều này có khả năng dẫn đến hiệu quả thấp hơn đối với liệu pháp này) và 10-15 cmH2O cho mũ bảo hiểm được tạo ra bởi bộ tạo dòng (khí nén hoặc tuabin) hoặc hệ thống Venturi cung cấp dòng khí sạch liên tục đến cổng đầu vào trong khi cổng đầu ra được điều chỉnh bằng van PEEP [34, 43]. Trong cài đặt này, lưu lượng khí tối thiểu 40-60 L/phút (>35 L/phút) là cần thiết để giảm nguy cơ thở lại khí CO2 [48]. Theo đó, nên tránh CPAP có nguồn gốc từ máy thở (<30 L/phút), đặc biệt là với giao diện mũ bảo hiểm [47, 48, 49]. Bất cứ khi nào có thể, bạn nên đặt một lưu lượng thích hợp trên máy để khắc phục sự cố này. Hơn nữa, hoạt động làm ẩm là cần thiết để duy trì mức độ ẩm không khí phù hợp (15 mgH2O/L).
CPAP phát huy tác dụng sinh lý có lợi thông qua việc cải thiện dung tích cặn chức năng (functional residual capacity, FRC) và thông qua việc giảm sức cản đường thở (bằng cách tăng áp lực đường thở, do đó ngăn ngừa xẹp đường thở và hạn chế lưu lượng [34]), dẫn đến cải thiện quá trình oxygen hóa [50, 51, 52, 53, 54, 55].
Thông khí không xâm lấn
NIV cho phép áp dụng áp lực đường thở dương hai pha (PEEP + hỗ trợ áp lực, PS). Nó được tạo ra bởi máy thở cơ học và được cung cấp qua giao diện mặt nạ hoặc mũ bảo hiểm [34, 43, 44] (Bảng 1). Làm ẩm chủ động chỉ được khuyến nghị cho NIV đeo mặt nạ, trong khi không bắt buộc đối với NIV mũ bảo hiểm khi tổng thông khí phút của hệ thống vượt quá 40 L/phút [28, 56, 57].
Bảng 1
Các cài đặt chính, lợi ích và cạm bẫy của hỗ trợ hô hấp không xâm lấn ở bệnh nhân mắc AHRF/ARDS.
| Hỗ trợ hô hấp không xâm lấn | Cài đặt | Lợi ích | Cạm bẫy | |
| Liệu pháp oxy lưu lượng cao | – F1O2: 0,21-1
– Lưu lượng khí: 40-100 L/phút – Nhiệt độ khí: 31-37 °C |
– Lưu lượng hít vào của bệnh nhân phù hợp
– Việc cung cấp khí điều hòa đáng tin cậy ở F1O2 do bác sĩ lâm sàng cài đặt – Áp lực đường thở dương (lên đến 4 cmH20) – Rửa sạch khoảng chết mũi họng – Nỗ lực hô hấp giảm bớt – Tăng cường sự thoải mái cho bệnh nhân |
– Cung cấp mức PEEP nhỏ | |
| CPAP/NIV | Mặt nạ | – F1O2: 0,21-1
– PEEP: 5-8 cmH20 – Dòng khí liên tục (>30 L/phút) + van PEEP (chỉ CPAP) – PS: 7-10 cmH20 (chỉ NIV) |
– Việc cung cấp khí điều hòa đáng tin cậy ở F1O2 do bác sĩ lâm sàng cài đặt
– Huy động phế nang liên quan đến PEEP – Dỡ tải các cơ hít vào liên quan đến PS (chỉ NIV) – Giám sát thể tích khí lưu thông (chỉ NIV) |
– Loét da
– Rò rỉ không khí và hậu quả là suy giảm khả năng cung cấp PEEP cao – Nguy cơ liên quan đến PS đồng bộ của dao động Pl dương – Khả năng dung nạp kém, đòi hỏi phải gián đoạn điều trị |
| Mũ bảo hiểm | – F1O2: 0,21-1
– PEEP: 10-12 cmH20 – Lưu lượng khí liên tục (>60 L/phút) + van PEEP (chỉ CPAP) cho các thiết bị hệ thống Venturi – PS: 10-12 cmH20 (chi NIV) – Thời gian điều áp nhanh nhất – Không cần tạo ẩm khi thông khí phút trên 40 L/phút |
– Việc cung cấp khí điều hòa đáng tin cậy ở F1O2 do bác sĩ lâm sàng cài đặt
– Huy động và đồng nhất phế nang liên quan đến PEEP cao – Dỡ tải các cơ hít vào liên quan đến PS (chỉ NIV) – Phòng ngừa dao động Pl dương liên quan đến PS không đồng bộ – Bệnh nhân thoải mái hơn so với phương pháp đeo mặt nạ |
– Không đo thể tích khí lưu thông
– Phù chi trên và nguy cơ huyết khối mạch cao |
|
Chữ viết tắt: CPAP, áp lực đường thở dương liên tục; F1O2, nồng độ oxy hít vào; NIV, thông khí không xâm lấn; PEEP, áp lực dương cuối thì thở ra; và Pl, áp lực xuyên phổi.
Trong NIV, các lợi ích sinh lý do CPAP mang lại được thực hiện bởi PS (8-14 cmH2Ơ)— làm giảm tải các cơ hô hấp, do đó làm giảm nỗ lực hít vào và công thở [51, 58]. Tuy nhiên, đồng bộ hô hấp hoàn toàn có thể làm tăng Pl, APl và Vt [59, 60], do đó làm tăng nguy cơ P-SILI. So với NIV qua mặt nạ, hiện tượng này có thể bị suy giảm trong NIV qua mũ bảo hiểm vì một phần áp lực bị tiêu tan khi làm giãn giao diện. Tình trạng này gây ra độ trễ kích hoạt (0,1-0,5 giây) dẫn đến mất đồng bộ hóa hô hấp, không tối ưu cho việc giải phóng cơ nhưng lại có tác dụng bảo vệ phổi hạn chế biên độ dao động Pl [61], do đó có thể làm giảm nguy cơ P -SILI. Hơn nữa, NIV qua mũ bảo hiểm có liên quan đến quá trình khử đồng bộ thì thở ra, khiến cho bệnh nhân thở ra so với áp lực thở ra trên PEEP đã đặt và điều này có thể góp phần vào việc huy động phế nang [61].
Bằng chứng lâm sàng
Tất cả các chiến lược này đều hiệu quả để cải thiện tình trạng thiếu oxy và không có sự khác biệt đáng kể nào được chứng minh ở những bệnh nhân mắc ARDS nhẹ (PaO2/FiO2 > 200) [62]. Ngược lại, các hướng dẫn hiện tại [8] khuyến nghị sử dụng HFOT như là biện pháp can thiệp đầu tay cho bệnh nhân mắc ARDS từ trung bình đến nặng. Mới đây, Ospina và cộng sự [63] đã so sánh tác dụng của SOT so với HFOT ở những bệnh nhân mắc COVID-19 ARDS nặng. Họ phát hiện ra rằng HFOT làm giảm đáng kể tỷ lệ đặt nội khí quản và rút ngắn thời gian trung bình để phục hồi lâm sàng. Tuy nhiên, bằng chứng ngày càng tăng đã gợi ý vai trò của CPAP và NIV qua mũ bảo hiểm trong việc quản lý bệnh nhân thiếu oxy với tình trạng thiếu oxy từ trung bình đến nặng [64]. Cụ thể, thử nghiệm lâm sàng RECOVERY-RS [65] đã tuyển chọn 1273 bệnh nhân mắc COVID-19 ARDS từ 48 bệnh viện, những người này được chọn ngẫu nhiên để nhận các phương pháp điều trị CPAP, HFOT hoặc SOT. Nghiên cứu này cho thấy CPAP (được cung cấp với nhiều giao diện khác nhau theo quyết định của bác sĩ điều trị) làm giảm đáng kể kết quả tổng hợp về tỷ lệ tử vong và tỷ lệ đặt nội khí quản trong 30 ngày so với SOT [65]. Trên hết, một phân tích tổng hợp mạng [64] trong số 25 thử nghiệm lâm sàng ngẫu nhiên cho thấy NIV qua mũ bảo hiểm có liên quan đến nguy cơ đặt nội khí quản thấp hơn so với SOT (RR, 0,26 [95% CI, 0,14-0,46]), HFOT (RR, 0,35 [CI 95%, 0,18-0,66]) và NIV qua mặt nạ (RR,0,35 [CI 95%, 0,19-0,61]). Những kết quả này đã được xác nhận một phần bởi Grieco và cộng sự [66], người đã chỉ định ngẫu nhiên những bệnh nhân bị bệnh nặng mắc ARDS do COVID-19 từ trung bình đến nặng cho đội NIV qua mũ bảo hiểm so với HFOT, và nhận thấy rằng không có số ngày khác nhau không được hỗ trợ hô hấp (mặc dù ở những bệnh nhân được NIV qua mũ bảo hiểm, tỷ lệ đặt nội khí quản thấp hơn (30% so với 51%, tương ứng, p = 0,03)). Ngược lại, Arabi và cộng sự
- chọn ngẫu nhiên 320 bệnh nhân mắc COVID- 19 AHRF để NIV qua mũ bảo hiểm so với hỗ trợ hô hấp tổng hợp thông thường (kết hợp NIV qua mặt nạ, HFOT và SOT) và không tìm thấy tỷ lệ tử vong khác nhau giữa các nhóm nghiên cứu. Tuy nhiên, ước tính hiệu ứng không chính xác và thiếu so sánh trực tiếp giữa các chiến lược này đã hạn chế khả năng tái tạo và giá trị bên ngoài của kết quả. Một thử nghiệm đa trung tâm, ngẫu nhiên có đối chứng hiện đang được tiến hành và sẽ làm sáng tỏ tác dụng của HFOT, CPAP và NIV đối với tỷ lệ đặt nội khí quản của bệnh nhân bị bệnh nặng với AHRF từ trung bình đến nặng (NCT05089695).
Lý do sinh lý để sử dụng PEEP cao
Những lợi ích liên quan đến CPAP qua mũ bảo hiểm và NIV qua mũ bảo hiểm ở bệnh nhân mắc AHRF và ARDS chủ yếu liên quan đến việc huy động phế nang gây ra bởi PEEP cao (>10 cmH2O) khi áp dụng trong thời gian dài hơn (>48 h), làm tăng FRC và cho phép phân phối đồng nhất Vt, do đó cải thiện Pl, APl và tỷ lệ thông khí-tưới máu
- . Hơn nữa, FRC do PEEP gây ra ngày càng giảm nhẹ chấn thương do xẹp phổi [27], giảm sự xuất hiện của hiện tượng pendelluft [22, 30, 69] và làm phẳng cơ hoành [70], do đó thúc đẩy sự tách rời cơ học thần kinh với việc giảm thiểu strain động cho một động lực hít vào nhất định. Ngoài ra, làm phẳng cơ hoành có thể ngăn ngừa rối loạn chức năng cơ hoành gây ra bởi sự co thắt đồng tâm quá mức do nỗ lực hít vào cao [71], mặc dù điều này cần được làm rõ thêm thông qua nghiên cứu thêm. Hơn nữa, sự giảm thiểu do PS gây ra được tìm thấy trong công hô hấp làm giảm mức tiêu thụ oxy do đó cải thiện tình trạng thiếu oxy trong máu [72, 73].
Làm thế nào để đánh giá sự an toàn của thở tự nhiên
Định nghĩa hiện tại về ARDS dựa trên tác động lâm sàng của tổn thương phổi đối với quá trình trao đổi khí, có đặc điểm phát triển theo thời gian và đòi hỏi các biện pháp can thiệp hỗ trợ cụ thể nhằm giảm thiểu sự tiến triển của P-SILI. Vì lý do này, NIRS nên được định hướng theo cách tiếp cận cá nhân hóa được chuẩn độ dựa trên cường độ của nỗ lực hô hấp được đánh giá bằng cả dao động áp lực màng phổi (APpl), được ước tính bằng dao động áp lực thực quản (APes) [74], và phép đo thay thế (ví dụ: PaCO2 < 35 mmHg) [75]. Cụ thể, Grieco và cộng sự [61] đã tiến hành một nghiên cứu chéo ngẫu nhiên để điều tra tác dụng sinh lý của HFOT so với NIV qua mũ bảo hiểm ở những bệnh nhân bị bệnh nặng với AHRF từ trung bình đến nặng. So với HFOT, NIV qua mũ bảo hiểm làm giảm đáng kể APes, mặc dù nó dẫn đến tăng APl ở những bệnh nhân thể hiện nỗ lực hít vào thấp hơn (APes < 10 cmH2O) lúc ban đầu. Theo những phát hiện này, một phân tích hậu kỳ của thử nghiệm HENIVOT [76] đã xác nhận tác dụng có lợi của NIV qua mũ bảo hiểm so với HFOT ở những bệnh nhân có hoạt động trung khu hô hấp cao (được đánh giá bằng tình trạng giảm CO2 (PaCO2 <35 mmHg)) và PaO2/FIO2 đến thang đánh giá khó thở bằng số <30 ở mức cơ bản. Một thử nghiệm ngẫu nhiên chéo gần đây đã so sánh các tác động sinh lý của CPAP qua mũ bảo hiểm so với NIV qua mũ bảo hiểm so với HFOT ở những bệnh nhân bị bệnh nặng với AHRF [77]: so với HFOT, CPAP qua mũ bảo hiểm và NIV qua mũ bảo hiểm dẫn đến cải thiện oxygen hóa, tăng Vt, và thể tích phổi cuối kỳ thở ra. Tuy nhiên, NIV qua mũ bảo hiểm đã làm giảm APes ở những người có nỗ lực hít vào mạnh mẽ (APes > 10 cmH2O) trước khi bắt đầu điều trị (có thể do giảm khối công của cơ hô hấp), nhưng lại làm tăng Pl và APl ở những người có nỗ lực hít vào thấp (APes < 10 cmH2O) (có thể tạo điều kiện thuận lợi cho sự phát triển của P-SILI). Thật thú vị, các tác giả đã chỉ ra rằng sự không đồng nhất về thông khí do pendelluft gây ra thường xuyên xảy ra trong quá trình thở tự nhiên và có thể được giảm thiểu bằng cách áp dụng PEEP cao thông qua giao diện mũ bảo hiểm. Kết hợp lại với nhau, những phát hiện này ngụ ý rằng HFOT và CPAP có hiệu quả trong việc cải thiện quá trình oxygen hóa ở những bệnh nhân mắc dạng AHRF ít nghiêm trọng hơn, được đặc trưng bởi nỗ lực hít vào thấp (APes < 10 cmH2O) và/hoặc CO2 máu bình thường. CPAP cải thiện việc huy động phế nang và hạn chế sự xuất hiện của pendelluft. Ngược lại, helmet-NIV có thể đóng một vai trò trong việc quản lý bệnh nhân bị AHRF nặng, những người được đặc trưng bởi nỗ lực hít vào dữ dội (APes > 10 cmH2O) và/hoặc giảm CO2 máu (PaCO2 < 35 mmHg). Theo đó, đặc điểm sinh lý của cơ học hô hấp (Hình 2) là mấu chốt để xác định những bệnh nhân được hưởng lợi nhiều nhất từ mỗi chiến lược và điều này là cần thiết để cá nhân hóa việc quản lý hỗ trợ và có khả năng tối ưu hóa kết quả lâm sàng.
Công cụ giám sát thất bại NIRS
Bệnh nhân mắc ARDS và AHRF cần được theo dõi chặt chẽ để phát hiện sớm hơn các dấu hiệu tiến triển của bệnh và việc không nhận được lợi ích từ việc cung cấp NIRS. Điều này là cần thiết để ngăn ngừa tác hại tiềm ẩn do trì hoãn đặt nội khí quản và IMV [78]. Trong bối cảnh này, ngày càng có nhiều bằng chứng chỉ ra rằng việc chậm nhận ra thất bại NIRS có liên quan đến tỷ lệ tử vong gia tăng và điều này có thể là do sự tiến triển của P-SILI [8]. Theo đó, các công cụ lâm sàng cụ thể đã được triển khai trong thực hành hàng ngày để khắc phục vấn đề này và đã được chứng minh là có hiệu quả trong việc nhận biết sớm sự thất bại của NIRS (Hình 3).
Nhịp thở và oxygen hóa máu được theo dõi bằng cả đo oxy xung liên tục và phân tích khí máu động mạch ngắt quãng, và chúng có thể đóng một vai trò quan trọng cho mục đích xác định bệnh nhân có nguy cơ thất bại NIRS [25, 26, 79]. Nhịp thở tăng dần và/hoặc tình trạng oxygen hóa xấu đi theo thời gian tương quan với suy giảm chức năng phổi, và nó đòi hỏi phải đặt nội khí quản và IMV để ngăn chặn sự tiến triển của P-SILI. Mặc dù các thông số này đại diện cho tiêu chuẩn chăm sóc để theo dõi ban đầu đáp ứng AHRF với NIRS tại giường bệnh, nhưng độ nhạy và độ đặc hiệu thấp của chúng để xác định thất bại điều trị ngụ ý việc áp dụng các công cụ tiên tiến để chuẩn độ quản lý lâm sàng:
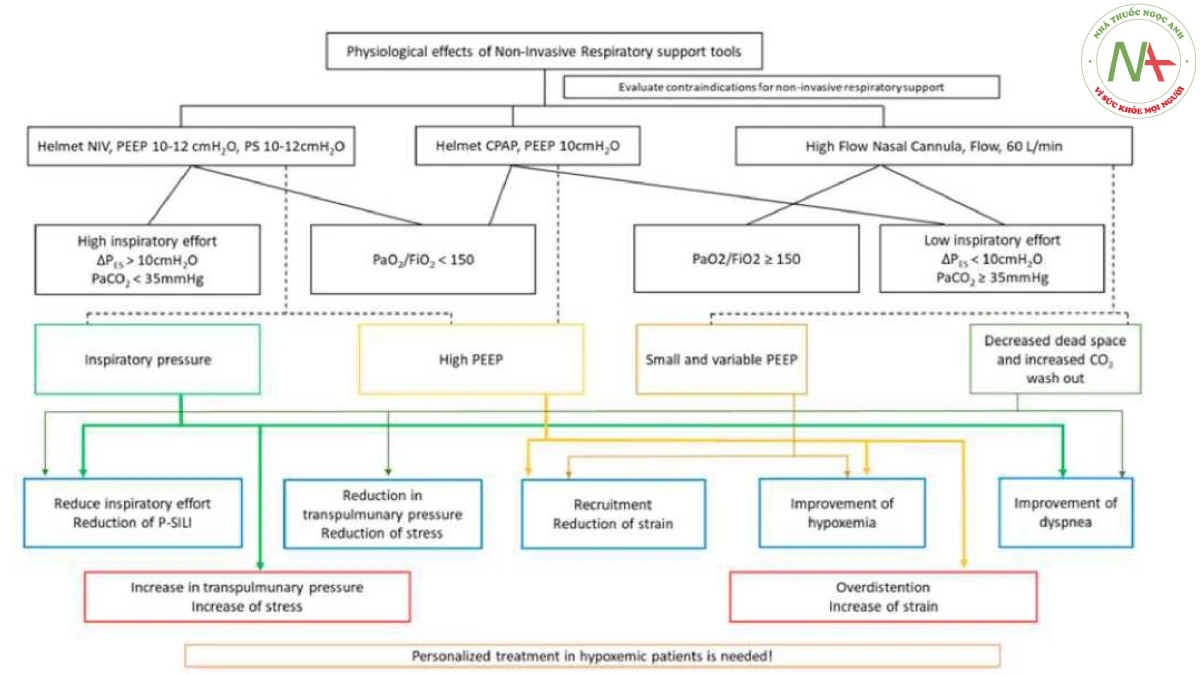
- Hình 2
Hình 2 Lưu đồ về các tác động sinh lý của CPAP qua mũ bảo hiểm, NIV qua mũ bảo hiểm và HFNO. Hình này cho thấy các cài đặt phổ biến nhất và tác dụng sinh lý chính của từng hỗ trợ hô hấp không xâm lấn.
- Thể tích khí lưu thông thở ra > 9-9,5 mL/kg dự đoán trọng lượng cơ thể và có thể dự đoán sự thất bại của NIV qua mặt nạ [80], nhưng nó không được áp dụng trong NIV qua mũ bảo hiểm;
- Nỗ lực hô hấp được đánh giá bằng APes > 15 cmH2Ơ hoặc không giảm APes sớm theo thời gian (trong vòng 2 giờ đầu điều trị) có thể dự đoán thất bại NIV sau 24 giờ [81];
- Chỉ số ROX, được định nghĩa là tỷ lệ SpƠ2 /F1O2 trên nhịp thở, có thể xác định bệnh nhân có nguy cơ thất bại HFOT và cần đặt nội khí quản và thở máy xâm lấn [82]. Ngoài ra, chỉ số ROX gần đây đã được chứng minh là dự đoán vừa phải thất bại NIV ở bệnh nhân mắc AHRF [83];
- Thang đo HACOR tính đến nhịp tim, nhiễm toan, ý thức, oxygen hóa và nhịp thở, với số điểm cao nhất có thể là 25 điểm. Cụ thể, điểm 5 là ngưỡng có độ chính xác chẩn đoán tốt để xác định bệnh nhân có nguy cơ thất bại với NIV trong các nhóm nhỏ khác nhau được phân loại theo chẩn đoán, tuổi, mức độ nghiêm trọng của bệnh và những người ở các mốc thời gian khác nhau. Ở những bệnh nhân có điểm HACOR > 5 lúc 1 giờ sau khi bắt đầu NIV, đặt nội khí quản sớm (< 12 giờ) có thể làm giảm tỷ lệ tử vong tại bệnh viện [79]. Gần đây, Duan và cộng sự [84] đã báo cáo khả năng dự đoán được cải thiện đáng kể đối với thất bại NIV trong phiên bản cập nhật của thang điểm HACOR có tính đến sáu biến số cơ bản (viêm phổi, phù phổi do tim, ARDS phổi, ức chế miễn dịch, sốc nhiễm trùng và điểm số SOFA). Bệnh nhân có điểm HACOR cập nhật <7, 7,5-10,5, 11-14 và >14 được phân loại ở mức xác suất thất bại NIV thấp, trung bình, cao và rất cao.
Trong các tình huống được đặc trưng bởi nỗ lực hít vào cao, thông khí không xâm lấn (NIV) có thể mang lại lợi ích sinh lý như giảm nỗ lực hít vào (có khả năng giảm thiểu P-SILI) và tăng cường tính đồng nhất của phổi (do áp dụng PEEP).
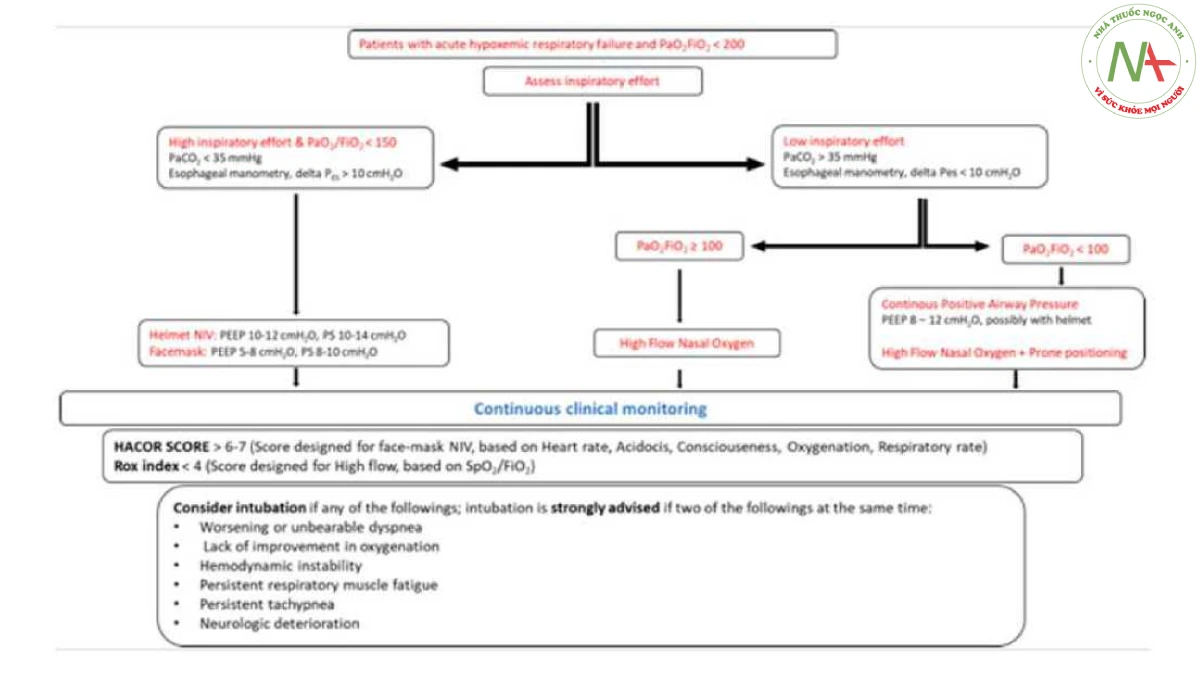
- Hình 3
Hình 3 Sơ đồ này minh họa phác đồ điều trị được đề xuất cho suy hô hấp do thiếu oxy cấp tính, và dựa trên biểu hiện lâm sàng và kiểu hình của bệnh nhân (theo quan điểm của tác giả). Bước đầu tiên đòi hỏi phải đánh giá nỗ lực hít vào, lý tưởng nhất là thông qua các phép đo trực tiếp (thông qua bóng thực quản) hoặc cách khác là thông qua các phép đo gián tiếp (ví dụ: PaCO2 < 35 mmHg trong trường hợp không có nhiễm toan chuyển hóa).
Mặt khác, đối với những trường hợp nỗ lực hít vào thấp, can thiệp được lựa chọn phụ thuộc vào mức độ nghiêm trọng của tình trạng thiếu oxy. Nếu bệnh nhân có biểu hiện thiếu oxy trầm trọng, có thể có những lợi ích tiềm năng từ PEEP cao do CPAP qua mũ bảo hiểm cung cấp hoặc từ tư thế nằm sấp trong quá trình thở tự nhiên; nếu không, nên sử dụng oxy mũi lưu lượng cao.
Thông khí cơ học xâm lấn
Mục đích chính
Đối với bệnh nhân AHRF và ARDS thất bại NIRS, IMV là yếu tố then chốt để cho phép trao đổi khí sinh lý, cũng như bảo vệ phổi và cơ hoành bất cứ khi nào nhu cầu hô hấp (ví dụ: điều hòa trung khu hô hấp) vượt quá khả năng của hệ hô hấp (ví dụ: nỗ lực hít vào). Theo đó, IMV là một biện pháp can thiệp hỗ trợ cho phép thời gian phục hồi phổi đồng thời ngăn chặn sự tiến triển của P-SILI [23]. Mặc dù IMV, kể từ lần đầu tiên được sử dụng trên quy mô lớn trong đại dịch bại liệt năm 1952 [85], đã được sử dụng để cung cấp đủ oxy cho máu (PaƠ2 > 60 mmHg hoặc SpƠ2 trong khoảng 90-94%) và duy trì PaCO2 thích hợp để nhắm mục tiêu cân bằng nội môi và cân bằng axit-bazơ (pH trong khoảng 7,35-7,45), một số nghiên cứu đã chỉ ra rằng nó có thể gây hại cho bệnh nhân bằng cách dẫn đến VILI [5, 32].
Bảng 2 Các công cụ theo dõi và ngưỡng lâm sàng để xác định kịp thời tình trạng thất bại trong hỗ trợ hô hấp không xâm lấn ở bệnh nhân mắc AHRF/ARDS.
| Tham số | Công cụ giám sát | Ngưỡng lâm sàng liên quan đến thất bại | Hạn chế |
| SpO2/FiO2 | đo oxy xung | <120 và/hoặc xu hướng xấu đi | Đánh giá thấp mức độ nghiêm trọng lâm sàng đối với nồng độ PaCO2 thấp |
| PaO2/FIŨ2 | Phân tích khí máu động mạch | <150-200 và/hoặc xu hướng xấu đi | Gián đoạn |
| Nhịp thở | khám lâm sàng | >25-30 và/hoặc không giảm | Tương quan thấp với nỗ lực |
| Thể tích khí lưu thông thở ra | Máy thở cơ học | >9-9,5 mL/kg PBW | Không khả thi trong HFOT ’ và NIV qua mũ bảo hiểm/CPAP |
| APes | Catheter bóng thực quản | Giá trị tuyệt đối > 10-15 cmH2O
Giảm dưới 10 cmH2O sau hai giờ NIV |
Cần một số chuyên môn |
| Chỉ số ROX | (SpOVFIO2)/Nhip thở | <2,85 lúc 2 giờ bắt đầu HFOT
<3,47 lúc 6 giờ bắt đầu HFOT <3,85 lúc 12 giờ bắt đầu HFOT |
Xác thực cho HFOT và NIV |
| Thang hacOr | Nhịp tim, nhiễm toan, ý thức, oxygen hóa và nhịp hô hấp.
Một phiên bản cập nhật có tính đến một số biến số cơ bản như viêm phổi, phù phổi do tim, ARDS phổi, ức chế miễn dịch, sốc nhiễm trùng và điểm số SOFA |
>5 điểm sau 1 giờ bắt đầu NIV.
Điểm HACOR <7, 7,5-10,5, 11-14 và >14 được cập nhật để được phân loại ở mức xác suất thất bại NIV thấp, trung bình, cao hoặc rất cao |
Không liên tục, tốn thời gian và chỉ được xác thực cho NIV |
Các chữ viết tắt: F1O2, nồng độ oxy khí hít vào; HFOT, liệu pháp oxy lưu lượng cao; NIV, thông khí không xâm lấn; PaO2, áp lực riêng phần O2 động mạch; PBW, trọng lượng cơ thể dự đoán; PaCO2, áp lực riêng phần CO2 động mạch; APes, delta áp lực thực quản; và SpO2, độ bão hòa O2 ngoại vi.
Thông khí cơ học kiểm soát
IMV kiểm soát là nền tảng để quản lý ARDS nặng [6], có nghĩa là liệt cơ hô hấp [86] hoặc ngừng thở [87]. Nó được cung cấp để giảm thiểu sự dao động và không đồng nhất của áp lực màng phổi quá mức (Ppl), và những điều này là kết quả của sự tương tác giữa các nỗ lực hít vào (Pmus) và các đơn vị phế nang với độ giãn nở bình thường [4]. Theo phương trình chuyển động bao gồm các thành phần áp lực đàn hồi, cũng như sức cản và và các thành phần áp lực tĩnh, áp lực đường thở (Paw) là kết quả của tổng của Pl và Ppl, có yếu tố quyết định chính là áp lực đàn hồi của thành ngực (Pcw).
Paw = Pl + Ppl
Trong một mô hình thử nghiệm chuyên đề, Dreyfuss và cộng sự [88] đã chứng minh rằng VILI tự nó không được xác định bởi Paw cao mà được phát triển từ tác động bất lợi của việc phổi quá căng và sự gia tăng Pl do Vt lớn gây ra. Điều này nhấn mạnh tầm quan trọng của áp lực đường thở xuyên phổi hơn là tuyệt đối trong việc xác định VILI.
Cách đặt Vt
Giả sử rằng tất cả các phế nang đều mở và sự đóng góp của thành ngực là không đáng kể (ví dụ, bệnh nhân không béo phì), Pl có thể được ước tính bằng áp lực cao nguyên (Pplat) (hinh 4), là Paw được hiển thị bởi máy thở sau khi giữ thời gian hít vào là 0,3 giây. Ở những bệnh nhân ARDS bị bệnh nặng, thông khí có Vt thấp (6 mL/trọng lượng cơ thể dự đoán, PBW) với Pplat thấp (<30 cmH2Ơ) đã được chứng minh là có hiệu quả để giảm tỷ lệ tử vong so với thông khí Vt cao (12 mL/ trọng lượng cơ thể dự đoán) với Pplat cao [89, 90]. Chuẩn độ Vt để đạt giới hạn Pplat cao trong vòng 28 cmH2Ơ đã được chứng minh là có hiệu quả để giảm hơn nữa nguy cơ căng quá mức [91]. Dữ liệu tiếp theo đã chỉ ra rằng chuẩn hóa Vt đối với độ giãn nở của hệ hô hấp thay vì trọng lượng cơ thể dự đoán cho phép người ta đánh giá sự biến dạng cơ học của phổi em bé do Vt gây ra. Thông số này là áp lực đẩy (AP = Vt/Crs) và có thể dễ dàng đo tại đầu giường dưới dạng Pplat – PEEP (hinh 4) [92]. Cụ thể, Amato và cộng sự [93] đã báo cáo về mối liên hệ độc lập giữa AP < 15 cmH2O và khả năng sống sót được cải thiện, và điều này không bị ảnh hưởng bởi PEEP và Vt (Bảng 3). Hơn nữa, Gattinoni và cộng sự [94] đã đưa ra khái niệm về công suất cơ học, là năng lượng được máy thở cơ học truyền đến hệ hô hấp với mục đích tổng hợp tác động của các biến thông khí góp phần vào VILI thành một thước đo duy nhất. Tuy nhiên, mô hình thú vị này đã gây ra một số lo ngại [95, 96, 97] do PEEP là một áp lực tĩnh, “trọng lượng” của từng thông số đối với sự phát triển của VILI và tử vong không được cân bằng, và tác động khác nhau của PEEP giữa những người đáp ứng huy động (tăng FRC do PEEP gây ra) và những người không đáp ứng huy động là không đặc trưng. Hơn nữa, việc tính toán công suất cơ học thiếu tính khả thi tại giường bệnh và không định hướng cho bác sĩ lâm sàng cách quản lý IMV tốt nhất để ngăn chặn gánh nặng của nó. Ngược lại, Costa và cộng sự [96] đã cân nhắc tác động của từng thành phần bằng cách xác định công suất cơ học đối với tỷ lệ tử vong ở bệnh nhân mắc ARDS. Các tác giả nhận thấy rằng công suất cơ học, AP và nhịp thở (RR) là những yếu tố dự báo đáng kể về tỷ lệ tử vong và một mô hình đơn giản hơn (4 X AP + RR) tương đương với công suất cơ học dự đoán tỷ lệ tử vong. Tuy nhiên, lợi ích lâm sàng của giả thuyết sinh lý này đảm bảo chứng minh trong các thử nghiệm lâm sàng ngẫu nhiên trong tương lai.
Cách đặt PEEP
Thông khí Vt thấp có thể gây ra tình trạng giảm huy động phế nang, dẫn đến suy giảm oxygen hóa và về mặt lý thuyết có thể đảo ngược bằng PEEP [98, 99]. Tuy nhiên, ARDS là một hội chứng lâm sàng phức tạp được đặc trưng bởi một số mức độ không đồng nhất của phổi, có các đặc điểm hình thái (lan tỏa so với thâm nhiễm khu trú) và sinh hóa (tăng viêm so với ức chế miễn dịch) có thể xác định các kiểu hình phụ cụ thể với các phản ứng khác nhau với PEEP [13]. Cụ thể, những bệnh nhân mắc ARDS lan tỏa và tình trạng viêm quá mức có nhiều khả năng được hưởng lợi từ mức PEEP cao hơn
- , do đó làm giảm cả strain động và nguy cơ chấn thương do xẹp phổi đối với một Vt nhất định
- . Ngược lại, những bệnh nhân mắc ARDS khu trú và kiểu hình không quá viêm có nhiều khả năng được hưởng lợi từ mức PEEP thấp hơn, giúp giảm thiểu strain động gây ra bởi tình trạng căng quá mức khu vực và suy giảm huyết động do phụ thuộc vào tiền gánh và suy thất phải [102, 103]. Vì những lý do này, một số thử nghiệm lâm sàng thực tế chọn ngẫu nhiên bệnh nhân mắc ARDS để nhận PEEP thấp hơn so với cao hơn dựa trên tiêu chí oxygen hóa [104, 105] và Crs [106, 107] đã không xác định được chiến lược tốt nhất để thiết lập và cá nhân hóa PEEP trong thực tế hàng ngày. Tuy nhiên, một tổng quan hệ thống và phân tích tổng hợp [108] trên 2299 bệnh nhân từ ba thử nghiệm lâm sàng cho thấy rằng việc áp dụng mức PEEP cao hơn ở những bệnh nhân mắc ARDS nặng nhất có liên quan đến khả năng sống sót được cải thiện, trong khi một thử nghiệm ngẫu nhiên có đối chứng [109] đã chứng minh rằng chiến lược máy thở không phù hợp với hình thái phổi có thể làm tăng tỷ lệ tử vong.
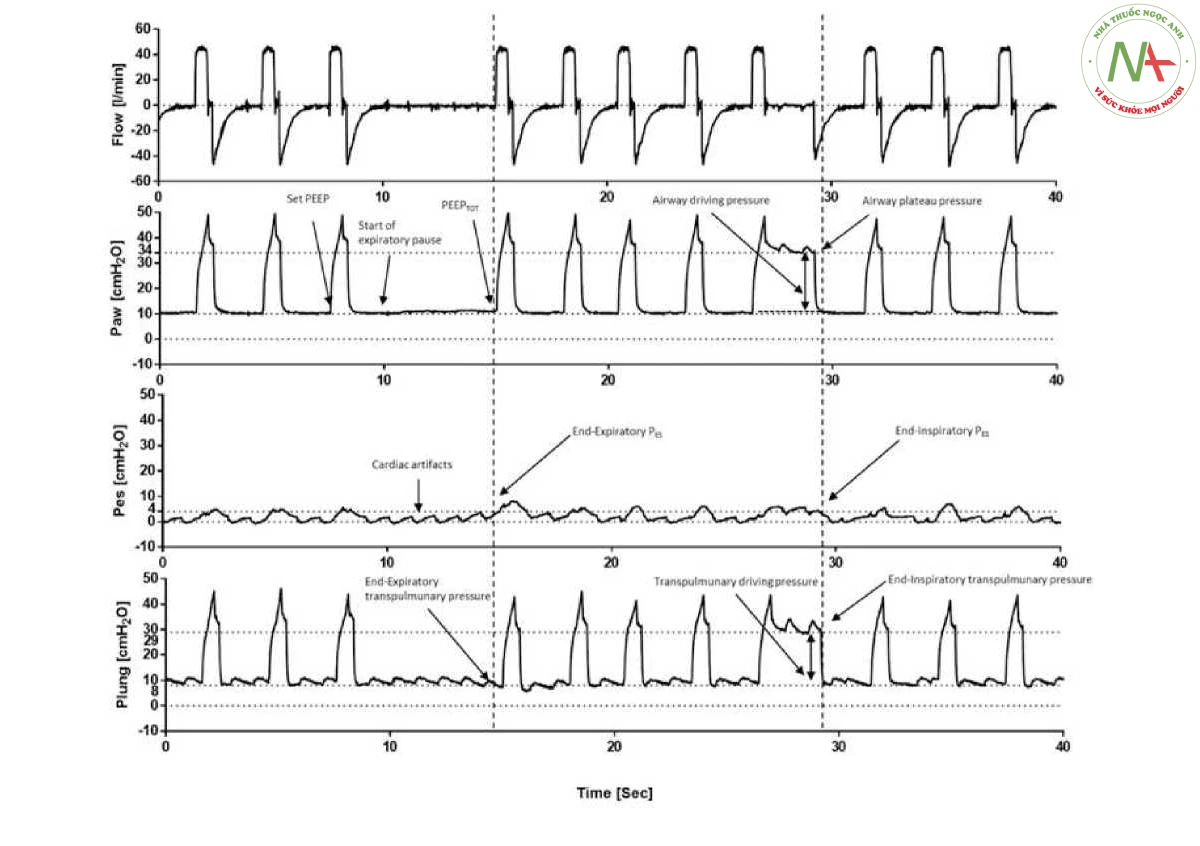
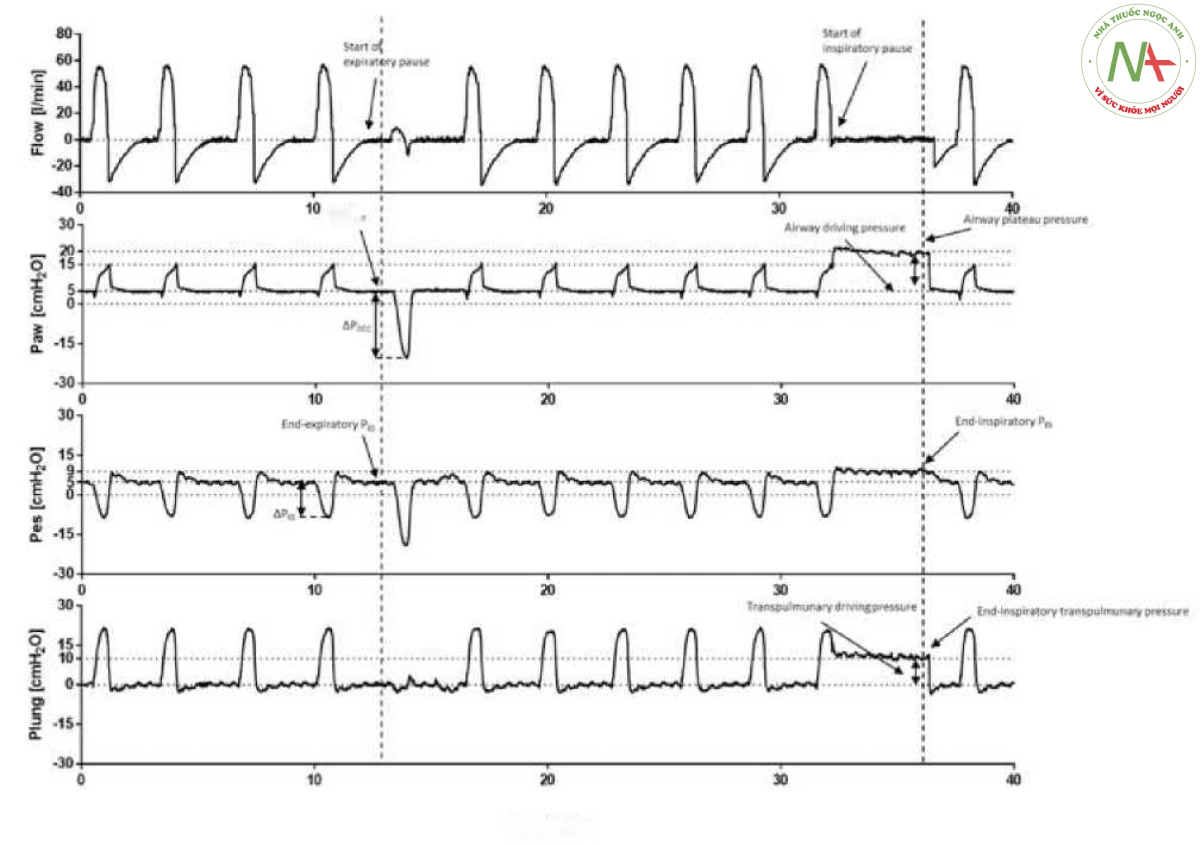
- Hình 4
Hình 4 Cơ học hệ hô hấp trong quá trình thông khí kiểm soát thể tích. Việc giữ ở cuối thì thở ra cho phép đánh giá tổng áp lực dương cuối thì thở ra (PEEP), là kết quả của tổng PEEP được đặt trên máy thở cơ học và PEEP nội tại (PEEPi). Đo áp lực thực quản hiện đại cho thấy áp lực thực quản cuối thì thở ra (Pes), do đó cho phép đo áp lực xuyên phổi (Pl) thông qua phương trình chuyển động. Việc giữ cuối thì hít vào cho phép đánh giá áp lực bình nguyên (Pplat) và áp lực đẩy (AP).
Hiện tại, phương pháp tiêu chuẩn vàng để đánh giá hình thái phổi và khả năng huy động được thể hiện bằng CT-scan (Bảng 3), trong khi việc sử dụng nó trong thực tế hàng ngày có vẻ kém khả thi do thiếu nhân sự, tăng khối lượng công việc và chi phí hệ thống y tế. Vì những lý do này, các công cụ mới để chuẩn độ PEEP tại giường bệnh đã được triển khai trong thực hành lâm sàng (Bảng 3), mặc dù vai trò của chúng phải được làm rõ trong các thử nghiệm lâm sàng trong tương lai:
- Tỷ lệ huy động trên bơm phồng (recruitment /inflation, R/I): chỉ số này phản ánh số lượng đơn vị phổi được huy động được chuẩn hóa thành Crs trong thủ thuật hủy huy động một nhịp thở [110] từ PEEP cao (15 cmH2Ơ) đến PEEP thấp (5 cmH2Ơ) trong khi tính đến áp lực mở đường thở [111]. Tóm lại, tỷ lệ R/I trên 0,5 xác định những bệnh nhân có mức PEEP cao hơn làm tăng FRC với tình trạng siêu căng phồng phế nang không đáng kể, trong khi tỷ lệ
R/I dưới 0,5 xác định những người phát triển tình trạng siêu bơm phồng do PEEP gây ra và có thể được hưởng lợi từ mức PEEP thấp hơn. Một thử nghiệm lâm sàng điều tra xem liệu chiến lược thiết lập PEEP dựa trên tỷ lệ R/I có thể cải thiện kết quả lâm sàng trong ARDS hay không hiện đang diễn ra.
Chụp cắt lớp trở kháng điện (Electrical impedance tomography, EIT): đây là phương pháp hình ảnh không xâm lấn, không bức xạ, theo dõi sự thay đổi thể tích phổi toàn cục và khu vực do PEEP gây ra. EIT cho thấy độ tin cậy tốt trong việc đánh giá huy động phổi so với siêu bơm phồng so với chụp CT [112]. Ví dụ, ở tư thế nằm ngửa, phần trăm đường kính ngực từ lưng đến bụng được biểu thị bằng trung tâm thông khí (center of ventilation, COV) [113], và điều này có thể giúp mô tả sự phân bố của Vt giữa các vùng phổi được sục khí không phụ thuộc vào vùng bụng (COV > 50%) so với vùng phổi không được sục khí phụ thuộc vào vùng lưng (COV < 50%). Theo đó, COV > 50% có thể là dấu hiệu của sự phân bố Vt không đồng nhất có liên quan đến nguy cơ cao căng phồng bụng và xẹp phổi. Hơn nữa, EIT cung cấp thông tin chức năng về sự suy giảm phế nang có thể huy động bằng cách đo lường các thay đổi về độ giãn nở pixel thông qua thử nghiệm PEEP giảm dần: độ giãn nở pixel giảm khi giảm PEEP gợi ý về sự sụp đổ, do đó cho thấy khả năng huy động, trong khi độ giãn nở pixel tăng lên cho thấy sự giãn nở quá mức [112]. Các cuộc điều tra lâm sàng trong tương lai trong bối cảnh này là rất cần thiết.
- Đo áp lực thực quản: phương pháp này đo Pes, là ước tính Ppl ở vùng giữa ngực tiếp giáp với bóng thực quản. Một nghiên cứu kiểm chứng gần đây trên lợn nằm ngửa và xác người [114] cho thấy phổi bị tổn thương biểu hiện độ dốc Ppl dọc, tăng từ vùng không phụ thuộc ở bụng đến vùng phổi phụ thuộc ở lưng. Pl có thể được ước tính bằng phương trình chuyển động thay thế Ppl bằng Pes cuối thì thở ra và bằng phương pháp tính đàn hồi ở cuối thì hít vào, giá trị của nó đại diện cho phần không phụ thuộc của khoang ngực [74, 102]. Trong bối cảnh này, một phân tích hậu kỳ về thử nghiệm EPVent-2 (thông khí hướng dẫn bằng áp lực thực quản 2) [115] đã cho thấy sự cải thiện đáng kể về số ngày không thở máy, không sốc và tỷ lệ sống sót, bất kể nhóm điều trị, trong số những bệnh nhân dùng PEEP và mang lại Pl dương tính ở cuối thì thở ra gần bằng 0 cmH2Ơ. Phát hiện này có thể đặc biệt được quan tâm trong việc kiểm soát bệnh nhân béo phì với độ đàn hồi thành ngực đáng kể dẫn đến AP cao, ngay cả khi Pl vẫn còn trong giới hạn an toàn [116]. Trong bối cảnh này, một chiến lược thiết lập PEEP để đạt được Pl dương tính ở cuối thì thở ra có liên quan đến việc cải thiện khả năng sống sót trong một nghiên cứu đa trung tâm lớn [117].
- Capnography theo thể tích (Vcap) là một công cụ không xâm lấn có thể giúp đánh giá lượng khoảng chết phế nang và đường thở [118], có liên quan trực tiếp đến việc tăng tỷ lệ tử vong ở bệnh nhân mắc ARDS [119]. Ở bệnh nhân ARDS, bằng chứng sơ bộ đã gợi ý vai trò của Vcap trong chuẩn độ PEEP để đạt được độ giãn nở cao nhất kết hợp với tỷ lệ khoảng chết so với Vt thấp nhất [120]. Mặc dù công cụ này có thể cung cấp cái nhìn sâu sắc quan trọng về cơ học phổi, đặc biệt là khi không có sẵn phép đo áp lực thực quản ở đầu giường, nhưng công cụ này cần được nghiên cứu thêm để làm rõ vai trò của nó trong bối cảnh ARDS.
Cách đánh giá mức độ an toàn của thông khí cơ học xâm lấn có hỗ trợ
Việc chuyển đổi từ thở máy kiểm soát sang hỗ trợ nên được thúc đẩy ngay khi nó có vẻ an toàn để ngăn ngừa rối loạn chức năng và teo cơ hô hấp, cũng như các biến chứng khác liên quan đến an thần kéo dài (ví dụ mê sảng, loét do stress, viêm phổi). Tuy nhiên, nên theo dõi cẩn thận các tương tác giữa bệnh nhân và máy thở (Hình 5) để sớm phát hiện sự không đồng bộ [121], giảm thiểu hỗ trợ quá mức và cải thiện tình trạng hỗ trợ dưới mức dẫn đến Pl quá mức và hậu quả là tổn thương phổi. Vì những lý do này, hỗ trợ máy thở nên được điều chỉnh theo nhu động hô hấp, nỗ lực hít vào và cơ chế phổi [122]. Cụ thể, nỗ lực và khả năng điều khiển hô hấp thấp có thể là hậu quả của việc hỗ trợ quá mức và/hoặc dùng thuốc an thần quá mức, hoặc rối loạn chức năng cơ hoành [74]. Trong bối cảnh này, propofol và benzodiazepin đã được chứng minh là có hiệu quả trong việc giảm nỗ lực hô hấp [123, 124], trong khi opioid làm giảm nhịp thở với các tác động hỗn hợp lên nỗ lực [125, 126], và dexmedetomidine không đóng vai trò gì trong việc quản lý trung khu hô hấp [127]. Thông số tiêu chuẩn vàng để đánh giá nỗ lực hô hấp được thể hiện bằng độ lệch âm của Pes, độ lớn của nó ước tính cường độ của nỗ lực. Hơn nữa, tích phân của nó theo thời gian hít vào định lượng mức tiêu hao năng lượng (PTPes) và sự dao động của nó đo lường Pl đẩy, do đó phân tầng nguy cơ P-SILI [128]. Tuy nhiên, đo áp lực thực quản đòi hỏi thiết bị và chuyên môn cụ thể có thể hạn chế việc sử dụng nó trong thực hành lâm sàng hàng ngày. Trong bối cảnh này, thao tác tắc nghẽn (Hình 5) có thể đóng một vai trò nào đó, vì bất kỳ thay đổi Paw nào cũng tuân theo cường độ và thời gian của các biến đổi Ppl và chúng không phụ thuộc vào cơ học hô hấp khi lưu lượng không khí bằng 0 (Bảng 3). Paw giảm trong 100 mili giây đầu tiên của nhịp thở bị tắc (P0.1) là phép đo khả năng điều hòa trung khu hô hấp [129] và nó thường dao động trong khoảng 14 cmH2Ơ, trong khi các giá trị cao hơn có thể được coi là giá trị thay thế của trung khu hô hấp hỗ trợ
dưới mức hoặc rối loạn điều hòa. Ngược lại, điều hòa trung khu hô hấp thấp có thể là dấu hiệu của sự hỗ trợ quá mức. Hơn nữa, Paw giảm trong một nhịp thở bị tắc hoàn toàn (Pocc) là phép đo nỗ lực hít vào và giá trị bình thường của nó nằm trong khoảng từ 10 đến 15 cmH2O [130]. Hơn nữa, việc đánh giá Pplat (Bảng 3) đã được chứng minh là có hiệu quả trong việc phân tầng nguy cơ phì đại và có liên quan trực tiếp đến tỷ lệ tử vong [131].
Việc giữ cuối thì thở ra cho phép đo P0.1 trong vòng 100 mili giây đầu tiên và đối với sự thay đổi áp lực đường thở trong toàn bộ nhịp thở bị tắc (APocc). Những thứ này tương ứng đo động lực hít vào và nỗ lực. Việc giữ cuối thì hít vào cho phép đo áp lực cao nguyên đường thở và áp lực cao nguyên thực quản. Bằng cách tính toán áp lực cao nguyên xuyên phổi và áp lực đẩy xuyên phổi, chúng ta có thể hiểu rõ hơn về chức năng phổi của bệnh nhân và hiệu quả của thông khí hỗ trợ áp lực. Cần lưu ý rằng trong thời gian giữ ở cuối thì hít vào, có sự gia tăng áp lực thực quản trên áp lực cuối thì thở ra, đó là ảnh hưởng của độ đàn hồi của thành ngực (và điều này cho phép người ta tính toán cơ học thành ngực).
- Hình 5
Phong tỏa thần kinh cơ, tư thế nằm sấp và thuốc giãn mạch phổi dạng hít
Bên cạnh việc phân phối NIRS dựa trên sinh lý học và cài đặt máy thở cơ học, các biện pháp can thiệp khác đã được chứng minh là có hiệu quả trong việc cải thiện kết quả của bệnh nhân ARDS.
Chất ức chế thần kinh cơ
Sử dụng thuốc ức chế thần kinh cơ (NMBA) (cụ thể là Cisatracurium) trong 48 giờ đã được chứng minh là có hiệu quả trong việc giảm tỷ lệ tử vong trong 90 ngày ở những bệnh nhân mắc ARDS sớm từ trung bình đến nặng so với giả dược [86]. Ngược lại, thử nghiệm ROSE [87] cho thấy không có sự khác biệt về tỷ lệ tử vong trong 90 ngày giữa những bệnh nhân được chọn ngẫu nhiên để nhận thuốc an thần sâu với Cisatracurium trong 48 giờ hoặc thuốc an thần nhẹ hơn mà không truyền NMBA (các liều tiêm NMBA ngắt quãng được cho phép trong chỉ định lâm sàng). Dựa trên những nghiên cứu này, một hướng dẫn thực hành lâm sàng gần đây [39] đã được đề xuất để tránh truyền NMBA liên tục cho bệnh nhân mắc ARDS ở bất kỳ mức độ nghiêm trọng nào và những người đang được thở máy bằng chiến lược an thần nhẹ hơn. Tuy nhiên, đối với những người cần an thần sâu để kiểm soát nỗ lực hít vào, việc truyền các loại thuốc này trong thời gian ngắn (48 giờ) là một lựa chọn hợp lý để tạo điều kiện thông khí bảo vệ phổi.
Nằm sấp
Các đợt tư thế nằm sấp kéo dài ít nhất 16 giờ đã được chứng minh là có hiệu quả trong việc giảm tỷ lệ tử vong trong 28 ngày ở những bệnh nhân thở máy với ARDS từ trung bình đến nặng so với giả dược [132]. Hơn nữa, những kết quả này đã được xác nhận bằng một phân tích tổng hợp tiếp theo trên tám thử nghiệm ngẫu nhiên có đối chứng (2129 bệnh nhân) [133]. Một lời giải thích sinh lý dựa trên việc huy động các vùng phổi phụ thuộc do tư thế nằm sấp gây ra, và điều này ngụ ý như sau: giảm thiểu thông khí đối với sự không phù hợp tưới máu, dẫn đến cải thiện quá trình oxygen hóa; sự phân bố thể tích khí lưu thông đồng nhất hơn; và cải thiện độ giãn nở của phổi và giảm Pl với điều hòa stress và strain do máy thở gây ra [134].
Thuốc giãn mạch phổi dạng hít
Oxit nitric đã được sử dụng rộng rãi trong thực hành lâm sàng để cải thiện thông khí đối với sự không phù hợp tưới máu và để giảm tăng áp phổi [135]. Một tổng quan hệ thống và phân tích tổng hợp gần đây [136] phát hiện ra rằng sử dụng oxit nitric so với nhóm chứng không làm tăng tỷ lệ sống sót chung (13 thử nghiệm ngẫu nhiên có đối chứng, 1243 bệnh nhân), tỷ lệ sống sót sau 28 ngày (9 thử nghiệm ngẫu nhiên có đối chứng, 1105 bệnh nhân), cũng như biến cố chảy máu (5 thử nghiệm ngẫu nhiên có đối chứng, 614 bệnh nhân). Mặc dù sử dụng oxit nitric cải thiện quá trình oxygen hóa (11 thử nghiệm ngẫu nhiên có đối chứng, 614 bệnh nhân), nó làm tăng nguy cơ suy thận ở người lớn (4 thử nghiệm ngẫu nhiên có đối chứng, 9455 bệnh nhân). Vì những lý do này, bằng chứng không đủ để hỗ trợ sử dụng oxit nitric trong bối cảnh này.
Các vấn đề tiềm ẩn đối với việc thực hiện các chiến lược hỗ trợ hô hấp được cá nhân hóa và các giải pháp cuối cùng
Thử nghiệm LUNG SAFE [1] cho thấy ARDS chưa được chẩn đoán đúng mức (34% trường hợp tại thời điểm đáp ứng các tiêu chí ARDS) và việc công nhận nó thường bị trì hoãn. Các yếu tố liên quan đến việc bác sĩ lâm sàng ghi nhận ARDS là tỷ lệ điều dưỡng trên bệnh nhân cao hơn, tuổi bệnh nhân trẻ hơn, tỷ lệ PaO2/FIO2 thấp hơn và các biến số viêm phổi hoặc viêm tụy, trong khi không có các yếu tố nguy cơ đối với ARDS và suy tim đồng thời dự đoán giảm khả năng nhận biết của bác sĩ lâm sàng. Hơn nữa, nghiên cứu này báo cáo rằng 35,1% bệnh nhân mắc ARDS không được thở máy bảo vệ và chỉ 16,3% bệnh nhân mắc ARDS nặng trải qua tư thế nằm sấp và Pplat được đo kém (40,1% bệnh nhân). Theo đó, bước đầu tiên hướng tới việc thực hiện các chiến lược hỗ trợ hô hấp được cá nhân hóa phụ thuộc vào việc làm cho các bác sĩ lâm sàng nhận thức được các tiêu chí chẩn đoán ARDS để cho phép chẩn đoán sớm và cho phép đưa ra các chiến lược hô hấp phù hợp kịp thời. Hơn nữa, rất đáng để giáo dục các bác sĩ lâm sàng về việc sử dụng các công cụ lâm sàng bên giường bệnh đã thảo luận ở trên, ứng dụng của chúng có thể giúp nhận biết sớm hơn sự thất bại của NIRS và chuẩn độ chính xác cài đặt máy thở cơ học đối với cơ học phổi.
Kết luận
ARDS và AHRF là các tình trạng lâm sàng không đồng nhất được đặc trưng bởi các tính năng đặc biệt của cơ học hệ hô hấp. Việc quản lý các chiến lược hỗ trợ hô hấp xâm lấn và không xâm lấn trong điều kiện bỏ qua sinh lý hệ hô hấp có thể kéo dài sự tiến triển của tổn thương phổi. Phương pháp tiếp cận dựa trên sinh lý học và cá nhân hóa đối với ARDS và AHRF được ủng hộ mạnh mẽ để hạn chế sự tiến triển của tổn thương phổi và cung cấp đủ thời gian để phục hồi. Các thử nghiệm trong tương lai là hợp lý để xác minh giả thuyết này và để kiểm tra xem cách tiếp cận như vậy có thể cải thiện kết quả của các tình trạng lâm sàng đe dọa tính mạng này hay không.