Bệnh tiêu hóa
Điều mà mọi bác sĩ ICU nên biết về vai trò của amoniac trong suy gan
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Bài viết Điều mà mọi bác sĩ ICU nên biết về vai trò của amoniac trong suy gan – tải pdf tại đây.
Bản dịch của Thạc sĩ. Bác sĩ Hồ Hoàng Kim.
Mục đích: Bệnh nhân suy gan cấp tính (ALF) hoặc suy gan cấp tính trên nền mãn tính (ACLF) có tỷ lệ mắc bệnh và tử vong trong thời gian ngắn cao. Trong bối cảnh suy gan, nồng độ amoniac huyết thanh tăng có liên quan đến các kết quả thần kinh tồi tệ hơn, bao gồm bệnh não gan mức độ cao (HE), phù não và tăng áp lực nội sọ. Ngoài độc tính lên hệ thần kinh, tăng amoniac máu có thể góp phần gây ra rối loạn chức năng miễn dịch và nguy cơ nhiễm trùng, nguyên nhân thường xuyên gây suy đa cơ quan ở những bệnh nhân này.
Tài nguyên và phương pháp: Chúng tôi thực hiện đánh giá tường thuật dựa trên tài liệu. Các ấn phẩm có sẵn trong PubMed® cho đến tháng 6 năm 2023 đã được xem xét.
Kết quả: Trong điều trị ICU cho bệnh nhân suy gan, amoniac huyết thanh có thể đóng một vai trò quan trọng. Theo đó, trong bài đánh giá này, chúng tôi tập trung vào những hiểu biết gần đây về chuyển hóa amoniac, chiến lược đo amoniac huyết thanh, giá trị tiên lượng tăng amoniac máu và chiến lược điều trị nhắm mục tiêu amoniac.
Kết luận: Amoniac huyết thanh có thể có giá trị tiên lượng bệnh suy gan. Hiện đã có sẵn các chiến lược điều trị nhắm mục tiêu amoniac hiệu quả, chẳng hạn như thuốc nhuận tràng, rifaximin, L-ornithine-L-aspartate và liệu pháp thay thế thận liên tục.
Keywords: Hyperammonemia; End-stage liver disease; Liver transplant; Critical care
Tại sao nồng độ amoniac huyết thanh tăng khi bị suy gan?
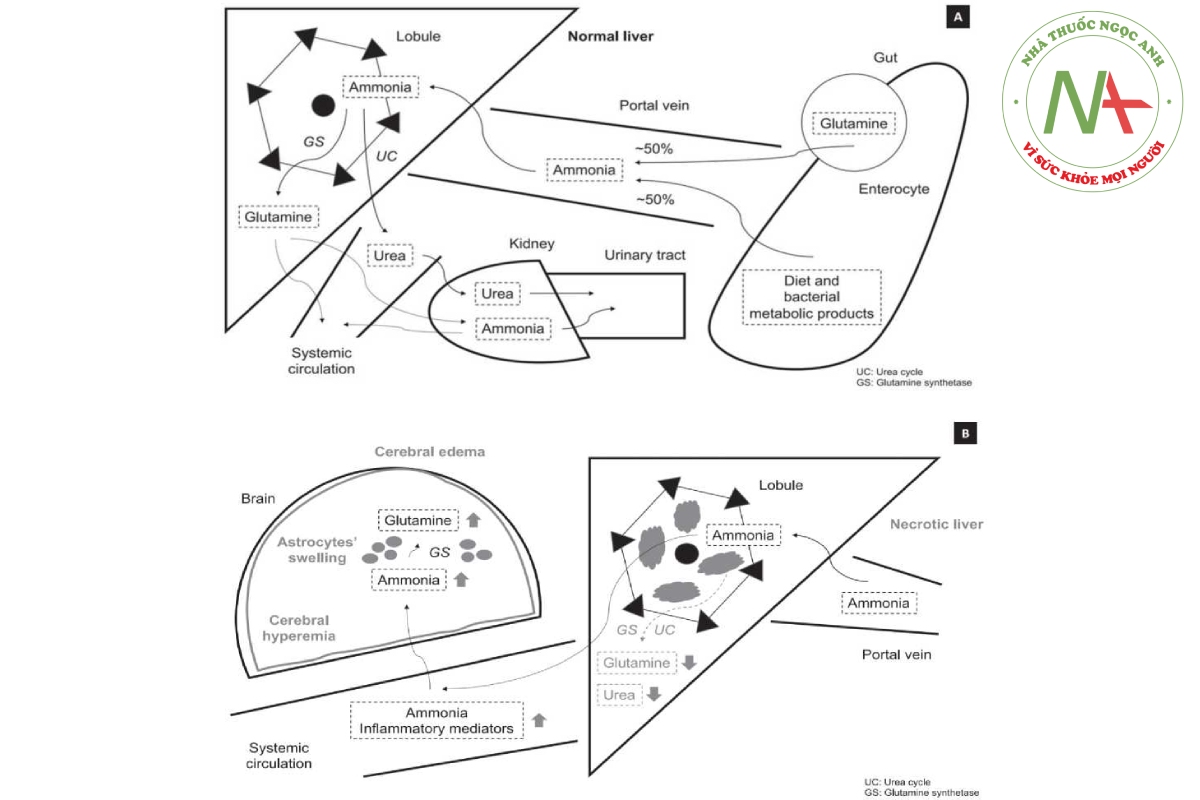
Gan có vai trò quan trọng đối với quá trình chuyển hóa amoniac trong quá trình cân bằng nội môi (Hình 1A). Amoniac (NH4 +/NH3) đến gan chủ yếu qua tĩnh mạch cửa, 50% từ sự chuyển đổi glutamine nội sinh trong tế bào ruột và 50% từ lòng ruột, do sự thoái hóa chất nền nitơ từ chế độ ăn uống hoặc vi khuẩn [1]. Trong tế bào gan, amoniac được chuyển đổi thành urê hoặc glutamine. Các cơ quan khác như não, thận và cơ cũng tham gia vào quá trình chuyển hóa amoniac. Thận không chỉ sản xuất glutamine nội sinh mà còn bài tiết amoniac qua nước tiểu [1].
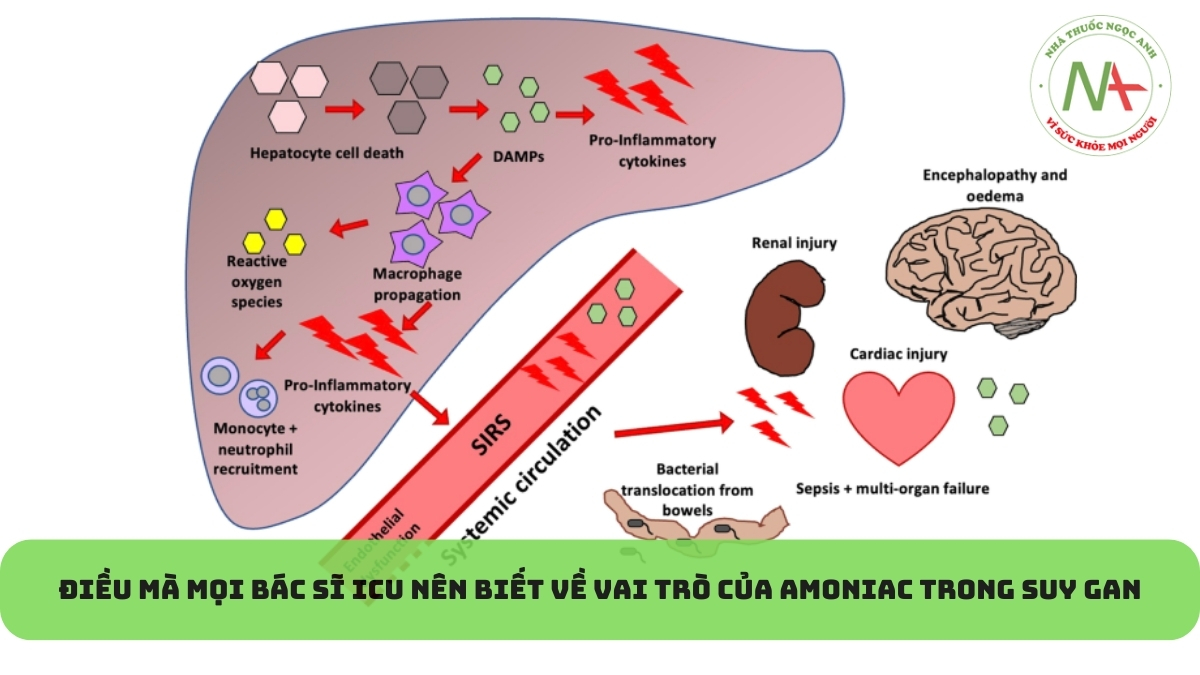
Khi bị suy gan, việc mất các tế bào gan còn sống dẫn đến chuyển hóa amoniac bị suy giảm. Vì vậy, những bệnh nhân này thường bị tăng amoniac máu.
Tăng amoniac huyết thanh ảnh hưởng đến bệnh nhân suy gan như thế nào?
Tăng amoniac máu là nguyên nhân cơ bản gây ra bệnh não gan (HE) [1]. Sự tích tụ của nó trong tế bào hình sao, cùng với các phân tử khác, có thể dẫn đến phù não, tăng huyết áp nội sọ và thoát vị thân não (Hình 1 B) [2]. Ngoài độc tính thần kinh, tăng amoniac máu có thể góp phần gây rối loạn chức năng miễn dịch và nhiễm trùng, nguyên nhân phổ biến gây rối loạn chức năng đa cơ quan ở những bệnh nhân này [3].
Có sự khác biệt nào trong quá trình chuyển hóa amoniac giữa bệnh nhân suy gan cấp tính và bệnh nhân suy gan cấp tính trên nền mãn tính?
Sự chết tế bào gan thường lớn hơn và nhanh hơn trong suy gan cấp tính (ALF) so với suy gan cấp tính trên nền mãn tính (ACLF). Do đó, amoniac huyết thanh thường đạt mức cao hơn trên bệnh nhân ALF so với ACLF (Bảng 1). Cơ chế bù trừ thẩm thấu não ở ACLF phát triển hơn so với bệnh nhân ALF [4]. Rối loạn chức năng thận, cả hai đều phổ biến ở ALF và ACLF, và tình trạng thiểu cơ, phổ biến ở ACLF hơn ALF, cũng góp phần gây ra tình trạng tăng amoniac máu.
=> Tham khảo: QUẢN LÝ VIÊM DẠ DÀY RUỘT CẤP Ở TRẺ EM THEO ESPGHAN và NASPGHAN.
Giá trị chẩn đoán và tiên lượng của amoniac huyết thanh ở bệnh nhân suy gan là gì?
Ở bệnh nhân ALF, tăng amoniac máu (nồng độ amoniac động mạch > 150 pmol/l) có liên quan đến việc tăng nguy cơ biến chứng nặng ở não, bao gồm HE, phù não, tăng huyết áp nội sọ và tử vong [2]. Ở bệnh nhân ACLF, trong khi nguy cơ phù não thấp hơn ở bệnh nhân ALF, tình trạng tăng amoniac máu có liên quan đến việc tăng nguy cơ suy cơ quan ngoài gan và tử vong [3].
| Bảng 1. Sự khác biệt giữa bệnh nhân suy gan cấp và suy gan cấp tính – mạn tính. | ||
| Suy gan cấp | Suy gan cấp – mạn tính | |
| Đặc điểm bệnh nhân trung bình# | ||
| Tuổi (năm) | 40-45 | 55-60 |
| Bệnh đi kèm | Ít gặp | Thường gặp |
| Xơ gan | Không | Có |
| Tăng áp lực tĩnh mạch cửa | Không hoặc ít gặp | Thường gặp |
| Amoniac huyết thanh | Tăng cao | Cao hoặc trung bình |
| Phù não | Ít gặp | Ít gặp |
| Tăng áp lực nội sọ | Ít gặp | không |
| Rối loạn chức năng thận | Thường gặp | Thường gặp |
| Giảm thiểu cơ | Ít | Thường |
| Ghép gan | 25-50% | < 25% |
| Tỷ lệ tử vong tại bệnh viện | 20-40% | 40-60% |
| Chiến lược điều trị hiệu quả trong việc giảm amoniac huyết thanh | ||
| Lactulose, lactitol, or polyethylene glycol | Không rõ | Hiệu quả |
| Rifaximin | Không rõ | Hiệu quả* |
| L-ornithine-L-aspartate | Không rõ | Hiệu quả* |
| L-ornithine-L-phenylacetate | Không rõ | Không rõ |
| Thay thế thận | Hiệu quả | Không rõ |
| Lọc gan | Không rõ | Không rõ |
| Thay huyết tương | Hiệu quả* | Không rõ |
# Trong khi đánh giá này xem xét trung bình các bệnh nhân bị suy gan ở các nước phương Tây điển hình (Bắc Mỹ, Châu Âu và Châu Úc), dịch tễ học có thể khác ở các khu vực khác.
Chúng ta nên đo nồng độ amoniac huyết thanh trong phòng chăm sóc đặc biệt như thế nào?
Nồng độ amoniac trong huyết thanh có thể thay đổi tùy theo lượng protein, não và cơ (thiểu cơ), hấp thu, rối loạn chức năng thận, nhiễm trùng hoặc xuất huyết tiêu hóa. Amoniac động mạch phản ánh tốt hơn những thay đổi cấp tính trong chuyển hóa nitơ so với amoniac tĩnh mạch [1]. Giới hạn trên của nồng độ amoniac huyết thanh bình thường dao động từ 50 đến 70 pmol/l. Mẫu máu tươi được ưa chuộng hơn mẫu đông lạnh [5]. Các phép đo amoniac động mạch nối tiếp có thể mang lại nhiều thông tin hơn so với các phép xác định đơn lẻ theo thời gian cụ thể [6]. Nồng độ amoniac huyết thanh bình thường cho thấy giá trị tiên đoán âm tính cao đối với HE [1].
Có những chiến lược điều trị nào để điều chỉnh amoniac huyết thanh?
Laxatives
Các disacarit không hấp thụ (ví dụ lactulose và lactilol) vẫn là lựa chọn hàng đầu để điều trị và phòng ngừa HE ở bệnh nhân xơ gan [7]. Hiệu quả điều trị của chúng ở bệnh nhân ALF vẫn chưa rõ ràng.
Cơ chế hoạt động của lactulose rất đa dạng: (1) axit hóa đại tràng thúc đẩy chuyển đổi NH3 thành NH4 + không hấp thụ; (2) ức chế sự phát triển của vi khuẩn sinh amoniac; (3) ức chế hấp thu glutamine ở ruột; và (4) giảm thời gian hấp thụ amoniac và tăng bài tiết nitơ qua phân [7]. Các thuốc nhuận tràng khác (ví dụ polyethylene glycol) cũng đã cải thiện HE [7].
Rifaximin
Rifaximin là một loại kháng sinh đường uống chọn lọc ở ruột không hấp thu được khuyên dùng như một phương pháp điều trị bổ sung HE ở bệnh nhân xơ gan [8]. Cơ chế hoạt động của nó là một số: (1) ức chế quá trình hô hấp của hệ vi sinh vật đường ruột và vi khuẩn phân hủy chất nhầy; (2) thúc đẩy các phản ứng tăng cường đối với các mầm bệnh và sửa chữa hàng rào ruột; và (3) giảm nồng độ cytokine tiền viêm trong huyết thanh và nhiễm trùng [8].
Các chất chuyển hoá làm sạch
L-ornithine-L-aspartate (LOLA) có thể làm giảm amoniac huyết thanh bằng cách thúc đẩy chuyển đổi amoniac thành urê trong gan. Ngoài ra, amoniac có thể được chuyển hóa tiếp thành glutamine trong gan hoặc cơ xương. LOLA có thể an toàn và hiệu quả trong điều trị và phòng ngừa HE ở bệnh nhân xơ gan [9]. Tuy nhiên, LOLA dường như không cải thiện nồng độ amoniac huyết thanh hoặc HE ở bệnh nhân ALF.
L-ornithine-L-phenylacetate có thể làm giảm amoniac huyết thanh bằng cách thúc đẩy sự bài tiết qua thận dưới dạng phenylacetylglutamine [9]. Mặc dù hồ sơ an toàn của nó đã được thử nghiệm ở cả bệnh nhân xơ gan và ALF, nhưng tác dụng của nó đối với HE vẫn chưa rõ ràng.
Hỗ trợ màng ngoài cơ thể
Amoniac là một phân tử nhỏ hòa tan trong nước (17 Da) với thể tích phân bố thấp và liên kết với protein tối thiểu [4]. Mặc dù amoniac có cấu trúc giống urê nhưng độ thanh lọc lọc máu của nó là 30-50% so với urê [4].
Thay thế thận
Trong quá trình chạy thận nhân tạo ngắt quãng (IHD), lưu lượng máu và tốc độ thẩm tách cũng như bề mặt quả lọc cao hơn có liên quan đến độ thanh thải amoniac, glutamine và urê cao hơn [4]. Ở những bệnh nhân ALF đang điều trị thay thế thận liên tục (CRRT), tốc độ dòng thải cao hơn và liều tích lũy lớn hơn có liên quan đến độ thanh thải amoniac cao hơn [10]. Không có sự khác biệt về độ thanh thải amoniac giữa các phương thức CRRT khác nhau [11]. Các bộ lọc hấp phụ, chẳng hạn như Cytosorb® hoặc Oxiris®, không mang lại khả năng thanh lọc amoniac hiệu quả [12].
Nhìn chung, CRRT mang lại khả năng thanh thải amoniac lớn hơn IHD vì nó được triển khai trong thời gian 24 giờ. Ở bệnh nhân ALF, trong khi CRRT được chứng minh là có khả năng sống sót tốt hơn, thì IHD lại có liên quan đến khả năng sống sót kém hơn [6]. Có khả năng, IHD có thể dẫn đến rối loạn huyết động thường xuyên hơn [13].
Mặc dù CRRT được bắt đầu sớm và kéo dài trong thời gian dài hơn có thể là phương pháp điều trị tăng amoniac máu bổ sung hữu ích ở bệnh nhân ALF, nhưng điều đó vẫn chưa rõ ràng ở bệnh nhân ACLF [6,10,11].
Lọc máu hỗ trợ gan
Trong số một số thiết bị lọc máu hỗ trợ gan được phát triển, Prometheus® (huyết tương phân đoạn cộng với hấp phụ) và MARS® (lọc máu albumin cộng với hấp phụ) được nghiên cứu nhiều nhất. Tuy nhiên, tác động của chúng đối với kết quả của bệnh nhân ALF và ACLF vẫn chưa rõ ràng [14]. Mặc dù Prometheus® cho thấy độ thanh thải urê cao hơn MARS® nhưng điều đó không đáng kể đối với amoniac [14].
Thay huyết tương
Thay huyết tương ở bệnh nhân ALF, dù với thể tích cao (8-12 l) hay tiêu chuẩn (1,5-2 lần thể tích huyết tương), đã làm giảm nồng độ amoniac huyết thanh ít nhất cũng hiệu quả như CRRT [15]. Dữ liệu tương tự tiềm năng cho bệnh nhân ACLF còn thiếu.
Ý nghĩa thực tiễn và định hướng tương lai
Ở những bệnh nhân suy gan, đặc biệt ở những người được an thần, việc theo dõi amoniac huyết thanh có thể dự đoán nguy cơ biến chứng não. Việc sử dụng thuốc nhuận tràng hoặc rifaximin có thể bị cản trở bởi tắc ruột. Do đó, CRRT tạo thành một chiến lược an toàn và hiệu quả để kiểm soát tình trạng tăng amoniac máu, đặc biệt ở bệnh nhân ALF [6,11,12].
Các nghiên cứu trong tương lai, cả ở bệnh nhân ALF và ACLF, có thể khám phá tình trạng tăng amoniac máu như một dấu hiệu độc lập cho việc bắt đầu CRRT. Hơn nữa, các phương pháp điều trị mới có khả năng làm giảm amoniac huyết thanh, chẳng hạn như cấy ghép hệ vi sinh vật trong phân, vẫn cần được xác nhận thêm.
=> Tham khảo bài viết: QUẢN LÝ BỆNH NHÂN XƠ GAN – Hội tiêu hoá Anh quốc 2023.
Tài liệu tham khảo
- [1] Wright G, Noiret L, Olde Damink SW, Jalan R. Interorgan ammonia metabolism in liver failure: the basis of current and future therapies. Liver Int 2011;31(2):163-75.
- [2] Bernal W, Hall C, Karvellas CJ, Auzinger G, Elizabeth Sizer, Wendon J. Arterial ammonia and clinical risk factors for encephalopathy and intracranial hypertension in acute liver failure. Hepatology 2007;46: 1844-52.
- [3] Cardoso FS, Kim M, Pereira R, Bagulho L, Fidalgo P, Pawlowski A, et al. Early serum ammonia variation in critically ill patients with cirrhosis: a multicentre cohort study. Aliment Pharmacol Ther 2023. https://doi.org/10.1111/apt.17650. Epub ahead of print. PMID: 37470277.
- [4] Naorungroj T, Yanase F, Eastwood GM, Baldwin I, Bellomo R. Extracorporeal ammonia clearance for hyperammonemia in critically ill patients: a scoping review. Blood Purif 2021;50(4- 5):453-61.
- [5] Bajaj JS, Bloom PP, Chung RT, Hassanein TI, Padilla-Martinez M, Kayali Z, et al. Variability and lability of ammonia levels in healthy volunteers and patients with cirrhosis: implications for trial design and clinical practice. Am J Gastroenterol 2020;115(5):783-5.
- [6] Cardoso FS, Gottfried M, Tujios S, Olson JC, Karvellas CJ, US Acute Liver Failure Study Group. Continuous renal replacement therapy is associated with reduced serum ammonia levels and mortality in acute liver failure. Hepatology 2018;67(2): 711-20.
- [7] Rahimi RS, Singal AG, Cuthbert JA, Rockey DC. Lactulose vs polyethylene glycol 3350- electrolyte solution for treatment of overt hepatic encephalopathy: the HELP randomized clinical trial. JAMA Intern Med 2014;174(11):1727-33.
- [8] Patel VC, Lee S, McPhail MJW, Da Silva K, Guilly S, Zamalloa A, et al. Rifaximin-a reduces gut- derived inflammation and mucin degradation in cirrhosis and encephalopathy: RIFSYS randomised controlled trial. J Hepatol 2022;76(2): 332-42.
- [9] Butterworth RF. Ammonia removal by metabolic scavengers for the prevention and treatment of hepatic encephalopathy in cirrhosis. Drugs R D 2021;21(2):123-32.
- [10] Warrillow S, Fisher C, Bellomo R. Correction and control of Hyperammonemia in acute liver failure: the impact of continuous renal replacement timing, intensity, and duration. Crit Care Med 2020;48(2):218-24.
- [11] Fisher C, Baldwin I, Fealy N, Naorungroj T, Bellomo R. Ammonia clearance with different continuous renal replacement therapy techniques in patients with liver failure. Blood Purif 2022;51(10):840-6.
- [12] Liebchen U, Paal M, Gr” afe C, Zoller M, Scharf C, Cyto-SOLVE Study Group. The cytokine adsorber Cytosorb® does not reduce ammonia concentrations in critically ill patients with liver failure. Intensive Care Med 2023;49(3):360-2.
- [13] Davenport A, Will EJ, Davidson AM. Improved cardiovascular stability during continuous modes of renal replacement therapy in critically ill patients with acute hepatic and renal failure. Crit Care Med 1993;21(3):328-38.
- [14] Krisper P, Haditsch B, Stauber R, Jung A, Stadlbauer V, Trauner M, et al. In vivo quantification of liver dialysis: comparison of albumin dialysis and fractionated plasma separation. J Hepatol 2005;43(3):451-7.
- [15] Larsen FS, Schmidt LE, Bernsmeier C, Rasmussen A, Isoniemi H, Patel VC, et al. High-volume plasma exchange in patients with acute liver failure: an open randomised controlled trial. J Hepatol 2016;64(1):69-78.