COVID-19
Chiến lược thở máy xâm nhập và quản lý bệnh nhân COVID-19 trong quá trình thở máy
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Tác giả: Nguyễn Anh Dũng, Phạm Thị Tuyết Dung, Hoàng Bùi Hải
Bài viết Chiến lược thở máy xâm nhập và quản lý bệnh nhân COVID-19 trong quá trình thở máy được trích từ chương 14 trong phần 3 “Hồi sức ở bệnh nhân nặng và nguy kịch” sách Chẩn đoán và điều trị COVID-19.
1. CHIẾN LƯỢC THỞ MÁY XÂM NHẬP Ở BỆNH NHÂN NHIỄM COVID-19 BIẾN CHỨNG ARDS
1.1. GIỚI THIỆU
Tỷ lệ tử vong trên những bệnh nhân COVID-19 đặc biệt cao ở các bệnh nhân điều trị tại các đơn vị chăm sóc tích cực nhất là những bệnh nhân cần thở máy do biến chứng hội chứng suy hô hấp cấp tiến triển (Acute respiratory distress syndrome – ARDS). Trong một phân tích tổng hợp gần đây trên 69 nghiên cứu cho thấy tỷ lệ tử vong trên những bệnh nhân cần thông khí nhân tạo là 45%. Vì vậy, một chiến lược thở máy phù hợp với tổn thương phổi do COVID-19 gây ra là cần thiết trong quá trình điều trị những bệnh nhân này.
Khi virus xâm nhập vào cơ thể gây tổn thương phổi qua các giai đoạn như sau:
- Giai đoạn 1: Virus xâm nhập vào đường hô hấp, tấn công tế bào phổi loại 2 làm ảnh hưởng đến sản xuất surfactant. Virus bám vào và bắt chước receptor ACE2 trong phế nang, xâm nhập vào tế bào.
- Giai đoạn 2: Trong tế bào, các protein nhỏ của virus trong lưới nội chất được sắp xếp và vận chuyển đến bộ máy golgi nơi virus được đóng gói và đưa ra khỏi tế bào tạo thành thế hệ virus mới.
- Giai đoạn 3: Trong quá trình nhân lên virus làm tổn thương các phế nang dẫn đến giải phóng các cytokine viêm như interferon, interleukin
- Giai đoạn 4: Đại thực bào phế nang phát hiện tổn thương tế bào và giải phóng IL-6, IL-1, IL-8, TNF,
- Giai đoạn 5: TNF, IL-6, IL-8 làm tăng tính thấm thành mạch làm rò rỉ dịch ở khoảng kẽ, phế nang, nhu mô phổi.
1.2. HỘI CHỨNG SUY HÔ HẤP CẤP TIẾN TRIỂN
Hội chứng suy hô hấp cấp tiến triển (ARDS) là biến chứng phổ biến nhất của COVID-19 nặng. Nó là một hội chứng lâm sàng đặc trưng bởi tình trạng suy hô hấp nghiêm trọng, giảm oxy máu và phù phổi không do nguyên nhân tim mạch.
1.2.1. Tiêu chuẩn chẩn đoán
Theo định nghĩa Berlin về ARDS đã được công bố vào năm 2012.
Bảng 14.1. Định nghĩa Berlin về hội chứng suy hô hấp cấp ARDS
| Thời gian | Các triệu chứng hô hấp xuất hiện trong vòng một tuần sau một tác động lâm sàng được biết hoặc trong một tuần bệnh nhân xuất hiện thêm các triệu chứng hô hấp mới hoặc triệu chứng hô hấp tiến triển trầm trọng hơn. | |
| Hình ảnh phổi (Xquang hoặc cắt lớp vi tính) | Đám mờ hai bên phổi không thể giải thích đầy đủ do tràn dịch, xẹp phổi hay khối u trong phổi. | |
| Nguồn gốc phù phế nang | Suy hô hấp không thể giải thích đầy đủ là do suy tim hay quá tải dịch. | |
| Phân loại mức độ nặng ARDS | Nhẹ | 200 mmHg < PaO2/FiO2 ≤ 300 mmHg với PEEP hoặc CPAP ≥ 5 cmH2. |
| Trung bình | 100 mmHg < PaO2/FiO2 ≤ 200 mmHg với PEEP hoặc CPAP ≥ 5 cmH20 | |
| Nặng | PaO2/FiO2 ≤ 100 mmHg với PEEP hoặc CPAP ≥ 5 cmH20. | |
Chú thích: ARDS: hội chứng suy hô hấp cấp tiến triển; PEEP: Áp lực dương cuối thì thở ra; CPAP: Thông khí áp lực dương liên tục.
1.2.2. So sánh cơ học phổi trên bệnh nhân C-ARDS và CLASSIC-ARDS
Các nghiên cứu về cơ học phổi ở bệnh nhân ARDS đều bắt nguồn từ các tổn thương ARDS do nguyên nhân nhiễm vi khuẩn từ phổi và các nguyên nhân nhiễm trùng ở ngoài phổi đặc biệt là các nhiễm trùng bắt nguồn từ ổ bụng như viêm tụy cấp, nhiễm trùng đường mật. Trong đại dịch COVID-19, nhiều bệnh nhân đến viện với tổn thương cấp tính, lan tỏa 2 phổi và đã được chẩn đoán ARDS và điều trị theo chiến lược ARDS. Tuy nhiên nhiều tác giả nhận thấy bất kể mức độ giảm oxy hóa nghiêm trọng nào của ARDS thì phổi của bệnh nhân ở giai đoạn đầu của bệnh đều đầy khí. Đồng thời, phổi bị xẹp không chiếm ưu thế nên bệnh nhân thường không đáp ứng với liệu pháp huy động phế nang, đây là điểm khác biệt so với classic-ARDS.
Nghiên cứu về cơ học phổi trên trên bệnh nhân C-ARDS, tác giả Luigi Camporota và cộng sự cho thấy giá trị compliance tĩnh là 41 ml/cmH2O (33-52 ml/cmH2O) cao hơn có ý nghĩa so với classic-ARDS với compliance tĩnh là 32 ml/cmH2O. Trong nghiên cứu này các tác giả nhận thấy trọng lượng phổi không có sự khác biệt giữa 2 nhóm C-ARDS và classic- ARDS.
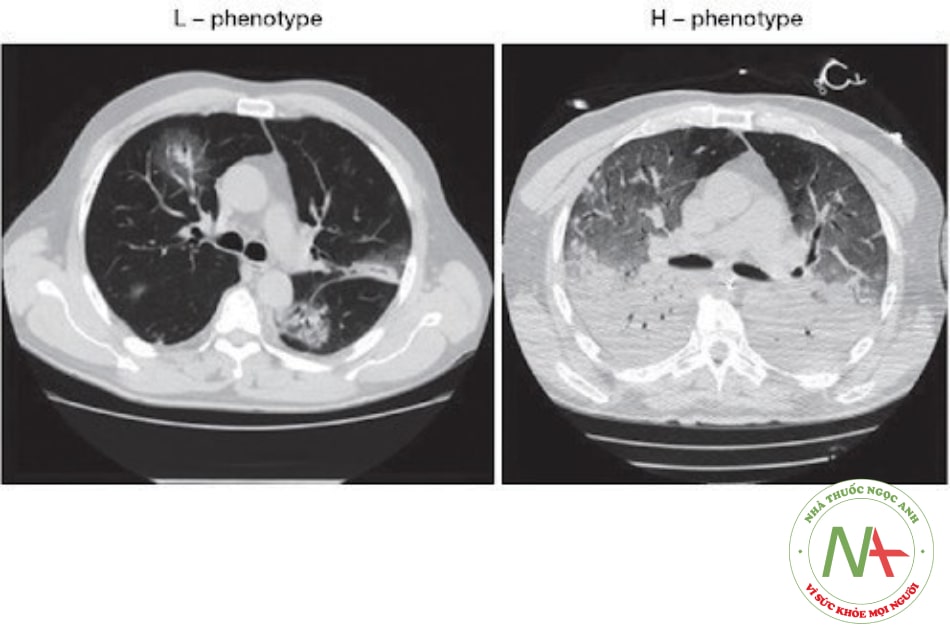
2.3. Phân loại hội chứng suy hô hấp cấp tiến triển liên quan đến nhiễm COVID-19 (CARDS)
Bảng 14.2. Phân loại 2 type tổn thương phổi trong CARDS
| Type L | Type H | |
| Độ đàn hồi | Độ đàn hồi thấp (compliance cao) | Độ đàn hồi cao (compliance thấp) |
| Tỷ lệ thông khí/tưới máu | Tỷ lệ thông khí/ tưới máu (VA/Q) thấp | Tỷ lệ thông khí/tưới máu (VA/Q) cao |
| Trọng lượng phổi | Low lung weight | High lung weight |
| Khả năng huy động phế nang | Low recruitability | High recruitability |
Cụ thể:
- Type L
Lúc đầu, viêm phổi COVID-19 biểu hiện với các đặc điểm sau:
- Độ đàn hồi thấp: độ giãn nở gần như bình thường cho thấy lượng khí trong phổi là gần bình thường.
- Tỷ lệ thông khí/tưới máu (VA/Q) thấp: do thể tích khí gần như bình thường, giảm oxy máu có thể được giải thích là do mất điều hòa tưới máu và thiếu oxy do co mạch. Theo đó, ở giai đoạn này, áp lực động mạch phổi gần như bình thường.
- Trọng lượng phổi thấp: Tổn thương dạng kính mờ xuất hiện trên CT scan, chủ yếu nằm ở vị trí dưới màng phổi và dọc theo các rãnh phổi. Do đó, trọng lượng phổi chỉ tăng ít.
- Khả năng huy động phế nang thấp: do phổi vẫn còn nhiều mô được thông khí.
- Type H
- Độ đàn hồi cao: Sự giảm thể tích khí do tăng phù phổi làm tăng tính đàn hồi phổi.
- Tỷ lệ thông khí/tưới máu cao do xuất hiện shunt từ phải sang trái. Điều này là do một phần của cung lượng tim đến phổi không được thông khí do tổn thương phổi.
- Trọng lượng phổi cao: Phân tích định lượng của CT scan cho thấy phổi tăng đáng kể cân nặng (> 1,5 kg). Tổn thương trên CT scan với biểu hiện đông đặc là chủ yếu, tổn thương tập trung chủ yếu ở phần lưng.
- Khả năng phải huy động phế nang cao: Số lượng mô không được thông khí tăng, tương ứng với mức độ nặng của tổn thương
Một bệnh nhân cũng có thể trải qua quá trình chuyển đổi từ kiểu hình L sang H tương ứng với quá trình chuyển sang dạng nghiêm trọng hơn.
1.3. CHIẾN LƯỢC THỞ MÁY Ở BỆNH NHÂN CARDS
1.3.1. Sinh lý hô hấp
Để duy trì được dòng khí đi vào và đi ra khỏi phổi qua hệ thống cây khí – phế quản, chúng ta không chỉ cần một mức áp lực để thắng được độ đàn hồi của hệ thống hô hấp mà còn cần thêm một áp lực để thắng được lực phát sinh do các phân tử khí di chuyển trên bề mặt đường dẫn khí và lực gắn kết giữa các phân tử này. Các lực này gọi là lực ma sát.
Lực đàn hồi và lực ma sát đóng vai trò quan trọng trong cơ học phổi. Lực đàn hồi này thường được biểu diễn dưới thuật ngữ độ giãn nở (compli- ance [C]) và thông số này là tỉ số của biến thiên thể tích (∆V) và biến thiên áp lực xuyên thành phổi (∆ PLTM). Độ giãn nở có tương quan tỷ lệ nghịch với độ đàn hồi.
C = ∆V / ∆PLTM = 1/E (4.1)
Trong đó:
- E: elastic hay độ đàn hồi
- PLTM : Lung transmural pressure (hay áp lực xuyên thành phổi)
Đo độ giãn nở là một phép đo tĩnh, nó chỉ được tính toán khi không có dòng khí lưu thông.
Lực ma sát được lượng hóa bằng sức cản (R – Resistance). Thông số này là tỉ số gradient áp lực (∆PIM) với tốc độ dòng khí do áp lực đó gây ra ( V*):
R = ∆PIM / V* (4.2)
Trong đó:
- PIM: Intransmural pressure (áp lực bên trong màng phổi)
- V*: Rate of gas flow: tốc độ dòng khí.
Để có dòng khí lưu thông trong thì hít vào và thở ra phải cung cấp một áp lực đủ để thắng lực ma sát và lực đàn hồi của phổi và thành ngực. Ta có công thức:
PAW = PV + PER
Trong đó:
- PAW: Air way pressure – áp lực đường thở cần cung cấp để tạo ra dòng khí lưu thông.
- PV: lực ma sát. Phương trình (4.2) cho chúng ta biết PV bằng tích của sức cản R và dòng chảy V*.
- PER: Elastic recoil pressure: lực đàn hồi của hệ thống hô hấp. Phương trình (4.1) cho chúng ta biết PER bằng sự thay đổi thể tích ∆V chia cho độ giãn nở của hệ thống hô hấp CRS
- (CRS- Compliance of respiratory system): Độ giãn nở của phổi.
Vì vậy phương trình có thể viết lại như sau :
PAW = R x V* + ∆V/CRS
1.3.2. Sinh lý thở máy
Ta có phương trình chuyển động là :
PAW = PV + PAVL = R x V* + ∆V/CRS
Nếu bệnh nhân có nỗ lực hít vào trong một nhịp thở máy thì lực tạo ra do cơ hô hấp (PMUS) cùng áp lực máy thở cung cấp phải cân bằng được với tổng lực đàn hồi và lực ma sát của hệ thống hô hấp.
PAW + PMUS = R x V* + ∆V/CRS (4.3)
Một chu kỳ thở của bệnh nhân thở máy bao gồm 2 giai đoạn:
- Giai đoạn 1: giai đoạn chủ động (máy thở đẩy khí vào bệnh nhân) : thì hít vào.
- Giai đoạn 2: giai đoạn thụ động (máy thở không đẩy khí vào bệnh nhân, bệnh nhân tự đẩy khí ra ngoài hệ thống hô hấp): thì thở
Khi cài đặt áp lực dương cuối thì thở ra (PEEP), phương trình hô hấp trở thành:
PAW + PMUS = R x V* + ∆V/CRS + PEEP (4.4)
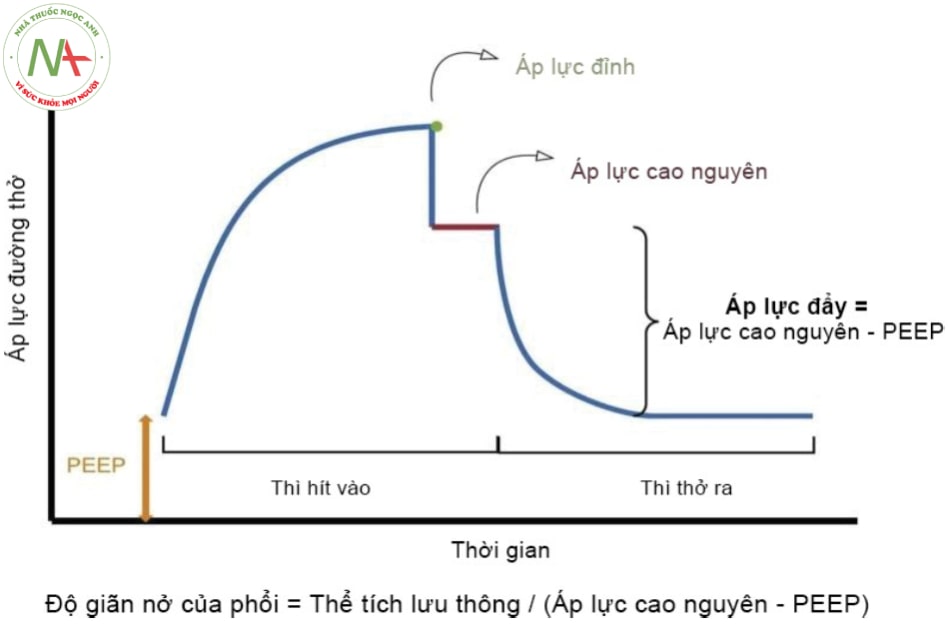
Hình 14.2 biểu diễn dòng và thể tích khí trong một nhịp thở khi máy thở cung cấp dòng khí thở vào hằng định. Khi dòng thở vào dừng lại và thể tích thở vào bị giữ lại trong phổi, PAW giảm nhanh từ áp lực tối đa – áp lực đỉnh (Ppeak) xuống đến áp lực gọi là áp lực cao nguyên (Pplat). Tình trạng tụt giảm áp lực này là do không còn lực ma sát khi không có dòng khí và chỉ cần một áp lực để cân bằng với lực đàn hồi của hệ thống hô hấp. Và khi không có dòng khí chuyển động trong đường thở, áp lực được coi là như nhau trong tất cả vị trí của hệ thống hô hấp. Pplat lúc này phản ánh áp lực trong phế nang (PAVL hay PER) (áp lực cần thiết để thắng lực đàn hồi) tại thời điểm cuối thì thở vào. Khi đó, chênh lệch áp lực giữa Ppeak và Pplat chính là áp lực cần thiết để thắng lực ma sát.
Driving pressure = Pplat – PEEP, phản ánh độ giãn nở của phổi.
R (Resistance) = PV/V* = (Ppeak – Pplat )/V* (cm H2O.L -1.S -1)
C (Compliance) = ∆V/∆P = Vt/Pplat (ml.cm H2O-1)
(Vt: Tidal volume – thể tích lưu thông)
Khi cài đặt áp lực dương cuối thì thở ra thì:
PER = Pplat – PEEP cài đặt
Lúc đó phương trình được viết lại là:
C ( Compliance ) = Vt/(Pplat – PEEP cài đặt)
Khi áp lực cuối thì thở ra lớn hơn PEEP cài đặt, có nghĩa là xuất hiện auto PEEP hay PEEP nội sinh. Khi thời gian cho thì thở ra không đủ, vẫn còn dòng khí ở cuối thì thở ra, nó tạo một áp lực vượt quá PEEP. Áp lực phế nang bổ sung này gọi là PEEP nội sinh (PEEPI) để phân biệt với PEEPE là PEEP ngoại sinh do cài đặt máy thở. Tổng PEEPI và PEEPE gọi là PEEP tổng (PEEPT). Khi có PEEPI, Pplat không còn bằng tổng PER và PEEP cài đặt nữa. Thay vào đó Pplat bằng tổng PER và PEEPT.
Phương trình (4.4) được viết lại là :
PAW + PMUS = R x V* + ∆V/CRS + PEEPT
1.3.3. Cài đặt máy thở ở bệnh nhân CARDS
Khi có dấu hiệu thất bại của thở oxy mask/HFNC/NIV, cần tiến hành đặt ống nội khí quản và thở máy.
Chiến lược thở máy bảo vệ phổi được cá nhân hóa dựa trên phân loại tổn thương phổi như sau:
- L type:
- Cài đặt FiO2 để đạt mục tiêu SpO2 90-96%.
- PEEP cao có thể có tác động bất lợi đến huyết động, PEEP khoảng 8-10 cmH2
- Vt > 6 mL/kg (tối đa 8-9 ml/kg cân nặng lý tưởng).
- Thông khí nằm sấp khi có chỉ định.
- H type: thở máy theo chiến lược ARDS net, thông khí nằm sấp.
1.3.3.1. Cài đặt máy thở ban đầu
- Mode: AC/VC
- Vt: 6 mL/kg cân nặng lý tưởng
- Tần số thở: 20-35 lần/phút (tối đa 35 lần/phút)
- PEEP: 10 cmH2O
- FiO2: 100%
- Thời gian hít vào: 0,5-0,8 giây, cài đặt thời gian hít vào phù hợp để tránh auto-PEEP.
Các chỉ số cần theo dõi: Pplat, compliance, Vt, huyết áp, nhịp tim, SpO2. Mục tiêu ban đầu:
- SpO2 90-96%
- PaO2 55-80 mmHg
- Pplat <= 30 cmH2O
- FiO2 < 70%
- pH 7,3-7,45
Chiến lược: Sử dụng FiO2 nhỏ nhất có thể, nếu Pplat > 30 cmH2O, giảm Vt 1ml/kg (Vt nhỏ nhất là 4 ml/kg cân nặng lý tưởng).
Kiểm tra lại khí máu sau 15-20 phút.
1.3.3.2. Điều chỉnh máy thở
- Mục tiêu: Pplat ≤ 30 cm H2O, PaO2 55-80 mmHg hoặc SpO2 88-95%.
- Kiểm tra Pplat bằng cách dừng thì thở vào 0,5 giây ít nhất bốn giờ một lần và sau mỗi lần thay đổi PEEP hoặc
- Nếu Pplat > 30 cmH2O, giảm Vt 1 mL/kg cân nặng lý tưởng (5 mL/kg cân nặng lý tưởng hoặc nếu cần có thể đến 4 mL/kg cân nặng lý tưởng).
- Nếu Pplat < 25 cmH2O và Vt < 6 mL/kg, tăng Vt thêm 1 mL/kg cân nặng lý tưởng cho đến khi Pplat > 25 cmH2O hoặc Vt = 6 mL/kg.
- Nếu có auto-PEEP hoặc khó thở nặng xảy ra, Vt có thể tăng lên 7 hoặc 8 mL/kg cân nặng lý tưởng nếu Pplat vẫn còn ≤ 30 cmH2
Kiểm tra lại khí máu:
Sử dụng bảng FiO2/PEEP sau đây để cài đặt máy thở đạt được mục tiêu oxy hóa:
| FiO2 | 0,3 | 0,4 | 0,5 | 0,6 | 0,7 | 0,8 | 0,9 | 1,0 |
| PEEP (cmH2O) | 5 | 5-8 | 8-10 | 10 | 10-14 | 14 | 14-18 | 18-24 |
Đánh giá lại đáp ứng của bệnh nhân trong vòng bốn giờ đầu thông khí bằng đánh giá lâm sàng và phân tích khí máu động mạch. Đối với những người đáp ứng tốt (ví dụ, FiO2 < 0,6, PaO2/FiO2 ≥ 150 mmHg) cần tiếp tục thông khí thể tích thấp (LTVV) đơn thuần.
Đối với những bệnh nhân có dấu hiệu suy hô hấp nặng với tỷ lệ PaO2/FiO2 < 150 mmHg mà FiO2 ≥ 0,6 và PEEP ≥ 5 cmH2O thì tiếp tục dùng chiến lược LTVV kết hợp với thông khí nằm sấp.
Đối với những bệnh nhân mà LTVV ở tư thế nằm sấp không thành công hoặc không phù hợp, các chiến lược cứu nguy bao gồm huy động phế nang, PEEP cao, thuốc giãn cơ, thuốc giãn mạch phổi và oxy hóa màng ngoài cơ thể (ECMO).
1.4. CÁC BIỆN PHÁP HỖ TRỢ TRONG QUÁ TRÌNH THỞ MÁY XÂM NHẬP
1.4.1. Tối đa hóa điều trị cho các rối loạn cơ bản
Trong một số trường hợp, không đáp ứng với thông khí thể tích thấp (LTVV) có thể do điều trị không đúng nguyên nhân hoặc bệnh đi kèm. Ví dụ: Bệnh nhân ARDS có đợt cấp của bệnh phổi tắc nghẽn mãn tính có thể được hưởng lợi từ việc giãn phế quản tích cực hơn hoặc tăng cường điều trị bằng glucocorticoid.
1.4.2. Hạn chế dịch
Phù phổi cấp có thể xảy ra ở bệnh nhân ARDS do tăng tính thấm thành mạch, là bản chất của cơ chế bệnh sinh của ARDS, hoặc truyền dịch truyền tĩnh mạch số lượng nhiều. Vấn đề này cần được lưu ý bằng cách ngừng hoặc hạn chế dịch và/hoặc bài niệu.
1.4.3. Điều trị rối loạn đồng bộ bệnh nhân và máy thở
Mất đồng bộ bệnh nhân máy thở có thể dẫn đến tăng nhịp thở, gây khó chịu, và trong một số trường hợp, gây ra auto-PEEP và trao đổi khí kém, cuối cùng dẫn đến thở máy kéo dài, tăng nhu cầu an thần và/hoặc thuốc giãn cơ, và có thể chấn thương phổi. Các yếu tố ảnh hưởng đến tính đồng bộ bao gồm các yếu tố do bệnh nhân (ví dụ: cơ học của hệ thống hô hấp – compliance, sức cản đường thở) và các yếu tố liên quan máy thở bao gồm tần số thở, lưu lượng thở vào và trigger.
1.4.4. Tăng tỷ lệ hít vào/thở ra (I/E)
Tăng tỷ lệ I/E bằng cách kéo dài thời gian thở vào có thể cải thiện quá trình oxy hóa bằng cách cho phép các vùng phổi cần nhiều thời gian hơn để mở và tham gia trong trao đổi khí.
1.4.5. PEEP cao
Ở những bệnh nhân mắc ARDS, các phân tích tổng hợp của các thử nghiệm ngẫu nhiên nhỏ cho thấy rằng, so với PEEP thấp, PEEP cao giúp cải thiện quá trình oxy hóa, với tác động không rõ ràng về tỷ lệ tử vong. Khi xem xét tất cả bệnh nhân được thở máy trong phòng chăm sóc đặc biệt (ICU) cho ARDS, bằng chứng cho thấy rằng không có lợi ích cải thiện tử vong rõ ràng liên quan đến việc sử dụng PEEP cao, đặc biệt ở những người đang điều trị thông khí thể tích thấp (LTVV).
1.4.6. Huy động phế nang
Huy động phế nang (HĐPN) là phương pháp sử dụng mức áp lực đủ cao để mở các phế nang không có thông khí hoặc thông khí kém tham gia vào quá trình trao đổi khí.
Hầu hết các thử nghiệm không cho thấy lợi ích cải thiện tử vong thuyết phục, mặc dù đã cải thiện tình trạng oxy hóa; ngoài ra, một số nghiên cứu cho thấy nguy hiểm tiềm tàng. Do đó nên tránh việc áp dụng thói quen sử dụng HĐPN như một ban đầu chiến lược cho bệnh nhân ARDS và dành nó cho bệnh nhân ARDS nặng, những người khó điều trị với các chiến lược tiêu chuẩn.
1.4.7. Thuốc giãn mạch phổi
Nitric oxide (NO) dạng hít cải thiện oxy hóa máu, nhưng không được chứng minh là làm giảm tỷ lệ tàn tật hoặc tử vong và có liên quan đến nguy cơ suy thận. Việc thiếu các bằng chứng về lợi ích và các tác dụng không mong muốn này của NO khiến việc sử dụng NO không phải thường quy mà chỉ dành để điều trị các bệnh nhân giảm oxy máu dai dẳng không đáp ứng với các biện pháp điều trị khác.
1.4.8. ECMO
Oxy hóa màng qua ngoài cơ thể (ECMO) là một biện pháp hữu ích được sử dụng để cải thiện quá trình oxy hóa ở bệnh nhân CARDS.
2. QUẢN LÝ BỆNH NHÂN TRONG QUÁ TRÌNH THỞ MÁY XÂM NHẬP
2.1. QUẢN LÝ AN THẦN, GIÃN CƠ Ở BỆNH NHÂN THỞ MÁY
Môi trường chăm sóc trong đơn vị hồi sức (ICU) có thể khiến bệnh nhân không thoải mái, gây lo lắng thậm chí hoảng sợ, kích động. Do vậy, việc sử dụng thuốc an thần, giảm đau và giãn cơ là cần thiết để đảm bảo khả năng chịu đựng các can thiệp y tế, sự đồng bộ giữa bệnh nhân – máy thở, ổn định lâm sàng, bảo vệ bệnh nhân khỏi sự vô ý tự hại mình, tăng cường sự thoải mái, hợp tác và giảm bớt lo lắng kích động.
Việc sử dụng an thần, giãn cơ trong thở máy có thể khiến kéo dài thời gian thở máy, tăng thời gian nằm viện, và thậm chí là tử vong. Hơn nữa, có một mối liên hệ chặt chẽ giữa sử dụng an thần và sảng. Những bệnh nhân xuất hiện các cơn mê sảng sau đó có nguy cơ phát triển các rối loạn chức năng nhận thức lâu dài. Do những tác dụng không mong muốn này, nhiều nghiên cứu đã tập trung tìm cách tốt nhất để giảm thiểu việc sử dụng an thần, giãn cơ. Sử dụng thuốc an thần ngắt quãng và dừng thuốc giãn cơ sớm có liên quan đến cải thiện kết cục lâm sàng.
2.1.1. Thuốc an thần
2.1.1.1. Chỉ định an thần cho bệnh nhân thở máy xâm nhập
- Tạo sự đồng bộ giữa bệnh nhân và máy thở : thở gắng sức, không đồng bộ giữa bệnh nhân – máy thở, tần số thở quá cao dẫn đến tăng công thở và tăng lượng oxy sự tiêu thụ. Các lý do khiến mất sự đồng bộ bệnh nhân – máy thở cần được nhanh chóng đánh giá và xử lý. Trong đó điều đầu tiên cần được thực hiện để cải thiện khả năng chịu đựng, tối ưu hóa sự tương tác giữa bệnh nhân – máy thở là điều trị các cơn đau tiềm ẩn và điều chỉnh máy thở.
- Giảm lo lắng và sợ hãi. Lo lắng và sợ hãi là những triệu chứng có thể gặp ở những bệnh nhân nặng còn tỉnh. Tuy nhiên, những các triệu chứng thường khó đánh giá ở những bệnh nhân thở máy. Biểu hiện của lo lắng, sợ hãi bao gồm các dấu hiệu không đặc hiệu như kích động, đập mạnh, vã mồ hôi, nhăn mặt, tăng huyết áp và tăng nhịp tim. Những dấu hiệu không đặc hiệu này cũng có thể là dấu hiệu của cơn đau hoặc mê sảng.
- Giảm kích động. Kích động là cử động liên tục không có mục đích trên giường như đập mạnh, cố gắng loại bỏ ống nội khí quản, nỗ lực rời khỏi giường hoặc các hành vi khác có thể đe dọa bệnh nhân hoặc sự an toàn của nhân viên y tế.
- Khiến bệnh nhân mất trí nhớ tạm thời khi tiến hành các thủ thuật, phẫu thuật và các can thiệp ý tế xâm lấn, chăm sóc gây đau cho bệnh nhân.
2.1.1.2. Các thuốc an thần được sử dụng
- Thuốc an thần tác dụng ngắn:
- Midazolam: bolus tĩnh mạch 0,5–4 mg, có thể nhắc lại sau mỗi 5-15 phút, liều duy trì tiêm tĩnh mạch 20-100 mcg/kg/h.
- Propofol: liều bolus tĩnh mạch 25-50 mg, liều duy trì 0,005–0,05 mg/ kg/phút tiêm tĩnh mạch, tăng dần 0,005 mg/kg/phút mỗi 5 phút theo đáp ứng an thần của bệnh nhân.
- Propofol là một lipid và đóng vai trò như một nguồn cung cấp calo. Nó được sử dụng một cách thận trọng ở những bệnh nhân triglyceride cao và chống chỉ định.
- Ở những người bị dị ứng trứng, thận trọng khi dùng propofol liều cao với các lipid khác. Hội chứng truyền propofol (propofol infusion syndrome (PRIS)) là một biến chứng hiếm gặp nhưng nghiêm trọng với các hiệu ứng khác nhau bao gồm toan chuyển hóa, hạ huyết áp, tăng triglycerid máu và loạn nhịp
- Ketamine: liều tiêm tĩnh mạch chậm 1-4,5 mg/kg, liều duy trì 0,1–0,5 mg/min. Ketamin chống chỉ định ở bệnh nhân tăng áp lực nội sọ (ICP). Ketamin có tác dụng làm giãn phế quản nên là một lựa chọn tốt với những với bệnh nhân Một tác dụng phụ của ketamine là ảo giác; tuy nhiên, điều này có thể được ngăn chặn với việc sử dụng đồng thời các thuốc benzodiazepin. Nó hiếm khi là một thuốc an thần đầu tay được lựa chọn.
- Thuốc an thần tác dụng trung bình:
- Lorazepam: Liều bolus 0,02–0,04 mg/kg, liều tiêm tĩnh mạch ngắt quãng 0,02-0,06 mg/kg mỗi 2-6 giờ, liều duy trì tĩnh mạch 0,01–0,1 mg/kg/h và không quá 10 mg/h. Lorazepam là thuốc benzodiazepin có thể được sử dụng bằng đường uống và tiêm truyền tĩnh mạch như một liều bolus ngắt quãng hoặc truyền liên tục. Khi được cho uống hoặc tiêm bolus ngắt quãng thì thuốc có tác dụng trung gian; tuy nhiên, khi sử dụng dưới dạng truyền liên tục (> 24 giờ), tác dụng của nó dài hơn vì bệnh nhân có thể mất hàng giờ đến vài ngày để thức tỉnh. Lorazepam có thể tích lũy ở những người già và rối loạn chức năng gan nhưng nhìn chung không nghiêm trọng.
- Thuốc an thần tác dụng kéo dài:
- Diazepam: 5-10 mg tiêm bắp hoặc tiêm tĩnh mạch, có thể nhắc lại sau 6-8 giờ, liều duy trì 0,03–0,1 mg/kg mỗi 30 phút đến 6 giờ. Diazepam hiếm khi được sử dụng để an thần tuy nhiên, nó có thể được lựa chọn để điều trị hội chứng
2.1.1.3. Thang điểm an thần
Một số thang điểm đánh giá mức độ an thần của bệnh nhân thường hay được sử dụng trên lâm sàng như thang điểm RASS (Richmond Agitation Sedation Scale) hoặc SAS (Sedation Agitation Scale).
Bảng 14.3. Thang điểm RASS
| Biểu hiện của bệnh nhân | Điểm |
| Hiếu chiến: quá khích, bạo lực, nguy hiểm ngay lập tức cho nhân viên. | +4 |
| Rất kích động: kéo, rút các ống/ống thông, hoặc gây nguy hiểm cho nhân viên. | +3 |
| Kích động: Thường xuyên di chuyển không mục đích hoặc thở chống máy. | +2 |
| Bồn chồn: Lo lắng hoặc sợ hãi nhưng không có biểu hiện hung hăng hoặc quá khích. | +1 |
| Bệnh nhân tỉnh táo, bình tĩnh. | 0 |
| Uể oải: Không tỉnh táo hoàn toàn, nhưng tỉnh liên tục > 10 giây (mở mắt, giao tiếp bằng mắt) với giọng nói. | -1 |
| An thần nhẹ: Nhận thức thời gian ngắn (< 10 giây) với giao tiếp bằng mắt và giọng nói. | -2 |
| An thần vừa: Chuyển động hoặc mở mắt để nói, nhưng không giao tiếp bằng mắt. | -3 |
| An thần sâu: Không phản ứng với giọng nói, nhưng chuyển động mắt hoặc mở mắt khi kích thích đau. | -4 |
| Không thể vận động: Không phản ứng với giọng nói hoặc kích thích vật lý. | -5 |
Điểm RASS từ -2 đến 0 được khuyến nghị ở những bệnh nhân thở máy nhằm giảm thiểu sử dụng thuốc an thần. Điều này đã được chứng minh là giúp giảm thời gian thở máy, giảm tỷ lệ tử vong và thời gian nằm tại ICU.
2.1.2. Thuốc giãn cơ
2.1.2.1. Chỉ định dùng thuốc giãn cơ (Neuromuscular blockade – NMB)
Sử dụng NMB trong ICU thường dành cho các bệnh nhân rất nặng khi thuốc giảm đau và thuốc an thần không đủ để đảm bảo kết quả mong muốn. Trong các trường hợp cử động cơ của bệnh nhân ảnh hưởng đến huyết động, hô hấp, thần kinh thì NMB có thể là một can thiệp cứu sống bệnh nhân.
Chỉ định dùng NMB:
- Điều trị bệnh nhân thở máy với ARDS nặng. Ở bệnh nhân ARDS, các chiến lược thở máy bảo vệ phổi bao gồm thể tích lưu thông thấp, tăng tỷ lệ I/E, và mức PEEP cao có thể cần thiết để ngăn ngừa volutrauma. NMB có thể ngăn ngừa rối loạn đồng bộ máy thở cho bệnh nhân, cải thiện quá trình oxy hóa và giảm nguy cơ chấn thương phổi.
- Đặt ống nội khí quản
- Xử trí run cơ trong hạ thân nhiệt.
- Kiểm soát tăng áp lực nội sọ.
2.1.2.2. Các thuốc giãn cơ
- Thuốc tác dụng ngắn: Succinylcholine liều duy trì 2,5 mg/phút tĩnh mạch. Các tác động bất lợi có thể bao gồm tăng kali máu và tăng thân nhiệt ác tính; nó không nên được sử dụng ở những bệnh nhân có nguy cơ tăng kali máu hoặc có cơ địa bệnh thần kinh cơ.
- Thuốc tác dụng trung bình: Atracurium liều duy trì 0,005–0,01 mg/kg/ phút. Rocuronium liều duy trì 0,01-0,012 mg/kg/phút.
- Thuốc tác dụng kéo dài: Pancuronium liều duy trì 0,1 mg/kg/giờ. Thuốc có thể gây ra nhịp tim nhanh và có thể có chống chỉ định ở những bệnh nhân mắc bệnh tim mạch. Pancuronium được chuyển hóa qua gan và qua thận.
2.2. QUẢN LÝ ÁP LỰC BÓNG CHÈN (CUFF)
Sau khi đặt nội khí quản hoặc mở khí quản, cuff được thổi phồng với lượng không khí vừa đủ với áp suất thấp nhất để có thể ngăn chặn rò rỉ không khí khi thở máy và giảm nguy cơ viêm phổi do hít. Áp suất cuff được duy trì ở mức nhỏ hơn 25 mmHg (30 cmH2O). Áp lực cuff quá cao gây ra thiếu máu cục bộ khí quản, hoại tử, nhuyễn hay xơ hóa thành khí quản. Tuy nhiên, ngay cả cuff được bơm phồng đúng thì nó cũng không hoàn toàn bảo vệ bệnh nhân khỏi viêm phổi do hít.
Có hai kỹ thuật phổ biến quản lý áp lực cuff: kỹ thuật rò rỉ tối thiểu (minimal leak technique – MLT) và kỹ thuật thể tích bít tối thiểu (minimal occlusive volume techniques – MOV).
Kỹ thuật rò rỉ tối thiểu (MLT) phù hợp với bệnh nhân không cần sử dụng áp lực đỉnh hít vào cao hoặc PEEP cao. Bơm không khí vào cuff đồng thời với lắng nghe thanh quản bằng ống nghe khi thở áp lực dương. Thổi phồng cuff từ từ tăng dần thể tích từ 1 đến 2 mL cho đến khi không nghe được tiếng rò rỉ khí. Sau đó từ từ xả cuff cho đến khi chỉ nghe thấy tiếng rò rỉ không khí nhỏ, hoặc một luồng không khí, được nghe qua thanh quản khi áp lực hít vào lớn nhất. Kỹ thuật rò rỉ tối thiểu sẽ dẫn đến không quá 50-100 mL không khí mất mỗi lần thở khi thở máy.
Kỹ thuật thể tích bít tối thiểu (MOV) phù hợp với bệnh nhân cần sử dụng áp lực đỉnh hít vào cao hoặc PEEP cao. Cuff được thổi phồng từ từ cho đến khi âm thanh rò rỉ khí biến mất hoàn toàn. Thể tích khí cần bơm vào cuff cũng như áp lực cuff được ghi nhận trong suốt quá trình bơm cuff và đảm bảo áp lực nội cuff dưới 25 mmHg (30 cmH2O).

2.3. HÚT ĐỜM
Việc loại bỏ chất tiết ở phổi thường được thực hiện bằng ho. Để ho hiệu quả cần phải đóng nắp thanh quản và áp lực trong lồng ngực tăng lên trước khi đột ngột mở nắp thanh quản và tống xuất chất tiết. Sự hiện diện của một đường thở nhân tạo chẳng hạn như một ống nội khí quản ngăn chặn thanh môn đóng do vậy ho không hiệu quả để loại bỏ dịch tiết. Lúc này bệnh nhân cần được hút đờm để loại bỏ dịch tiết.
Hiện nay, người ta thường sử dụng hai phương pháp hút đờm là phương pháp đóng và mở. Phương pháp đóng đề cập đến một thiết bị ống thông hút trong dòng vẫn được gắn vào mạch máy thở, cho phép định kỳ đưa ống thông hút qua màng ngăn để hút mà không cần rút máy thở khỏi bệnh nhân. Trong khi đó, phương pháp hút mở có nghĩa là ngắt kết nối ống nội khí quản và hệ thống dây máy thở trong quá trình hút. Sau khi hút, ống hút đờm được rút vào túi và được lưu trữ cho đến quy trình hút tiếp theo
Chỉ định
Hút đờm được chỉ định khi bệnh nhân ho, tăng áp lực đường thở do đờm và xuất hiện của âm thanh (ran nổ, ran ẩm) trong quá trình nghe phổi.
Hút đờm cũng có thể được thực hiện định kỳ để đảm bảo thông suốt đường thở. Tuy nhiên hút đờm thường chỉ được thực hiện khi có một chỉ định lâm sàng và thường không theo lịch trình thường quy. Khi tiến hành hút đờm, cần tăng FiO2 lên 100% trong tối thiểu 30 giây trước mỗi đợt hút, cho dù sử dụng kỹ thuật hút đờm đóng hay mở. Tăng oxy giúp ngăn ngừa giảm nồng độ oxy trong động mạch trong và sau khi hút.
Các biến chứng liên quan đến hút đờm qua nội khí quản
- Sự sụt giảm PaO2 được ghi nhận đầy đủ khi không tăng FiO2 trước khi hút.
- Rối loạn nhịp tim nghiêm trọng có thể xảy ra khi hút, bao gồm nhịp tim chậm, vô tâm thu, nhịp nhanh thất, block dẫn truyền, nhịp nhanh trên thất…
- Tăng áp lực động mạch
- Tăng áp lực nội sọ
- Co thắt phế quản, tổn thương thành khí quản.
- Viêm phổi bệnh viện
- Nhiều biến chứng trong số này có thể được giảm thiểu bằng cách sử dụng kỹ thuật vô trùng, sử dụng áp lực hút phù hợp, giám sát thận trọng trong và sau khi hút, và tăng FiO2 trước và sau mỗi lần hút.
2.4. LIỆU PHÁP OXY
Các mục tiêu sử dụng oxy bao gồm: điều trị giảm oxy máu, giảm công hô hấp và tối đa hóa oxy cho cơ tim và mô cung cấp.
Các biến chứng
Như với bất kỳ loại thuốc nào, oxy cần được sử dụng một cách thận trọng. Những mối nguy hiểm của lạm dụng oxy bao gồm giảm thông khí phế nang, xẹp phổi, nhiễm độc oxy và có thể đe dọa tính mạng.
- Giảm thông khí phế nang
- Giảm thông khí phế nang là một tác dụng phụ đáng quan tâm ở bệnh nhân COPD với giữ lại carbon dioxide. Người ta từng nghĩ rằng vì bệnh nhân COPD thích nghi với mức độ cao mãn tính của PaCO2, các thụ thể hóa học trong hành não bị mất đáp ứng với mức PaCO2 cao và giảm oxy máu là yếu tố kích thích chính để thông khí. Tuy nhiên, có một số các cơ chế sinh lý khác ở bệnh nhân COPD góp phần làm tăng mức PaCO2 bao gồm cả tình trạng không có khả năng tăng thông khí phút và giảm co mạch do thiếu oxy, dẫn đến tăng thông khí khoảng chết. Do giảm oxy máu là yếu tố kích thích thông khí, khi oxy máu của bệnh nhân COPD quá cao, bệnh nhân sẽ bị giảm thông khí phế
- Do vậy, cần điều chỉnh oxy cung cấp cho bệnh nhân COPD một cách phù hợp. Bên cạnh đó, điều chỉnh tình trạng giảm oxy máu ở bệnh nhân COPD vẫn còn quan trọng với PaO2 mục tiêu từ 55 đến 60 mmHg (SaO2 ~ 90%), bất chấp sự hiện diện của tăng CO2.
- Xẹp phổi: Xẹp phổi xảy ra khi nồng độ O2 cao (> 90%) được cung cấp trong thời gian dài và không có khí N2 trong phổi. Nitơ trong không khí xấp xỉ 79% tổng số khí trong khí quyển, áp suất riêng phần của nitơ trong phế nang giúp giữ cho các phế nang mở vì nó không được hấp thụ. Khi khí thở vào là 90% đến 100% O2, xẹp phế nang xảy ra vì oxy dễ dàng khuếch tán vào mao mạch phổi.
- Ngộ độc oxy
- Tác dụng độc hại của oxy chủ yếu nhắm vào phổi và hệ thống thần kinh trung ương (CNS). Độc tính thần kinh trung ương thường xảy ra với điều trị oxy cao áp. Dấu hiệu và các triệu chứng bao gồm buồn nôn, lo lắng, tê, rối loạn thị giác, giật cơ và co giật toàn thể. Các cơ chế sinh lý chưa được hiểu đầy đủ nhưng có lẽ là liên quan đến những thay đổi thần kinh và sinh hóa tinh vi làm thay đổi hoạt động điện của thần kinh trung ương.
- Nhiễm độc oxy phổi có thể dẫn đến ARDS hoặc loạn sản phế quản phổi. Hai giai đoạn của chấn thương phổi xảy ra khi tiếp xúc lâu dài với mức FiO2 Giai đoạn đầu tiên xảy ra sau 1 đến 4 ngày tiếp xúc với O2 nồng độ cao và được biểu hiện bằng giảm dòng máu đến niêm mạc khí quản, viêm khí phế quản. Dung tích sống giảm do giảm độ giãn nở của phổi và xẹp phổi tiến triển. Hàng rào phế nang mao mạch trở nên suy yếu dần dần, trao đổi khí giảm dần. Giai đoạn thứ hai xảy ra sau 12 ngày tiếp xúc nhiều. Vách phế nang dày lên và ARDS phát triển, kèm theo tỷ lệ tử vong cao.
- Chăm sóc bệnh nhân cần lượng oxy cao yêu cầu sự giám sát chặt chẽ của điều dưỡng chăm sóc cũng như các biện pháp can thiệp để thúc đẩy cung cấp oxy và giảm nhu cầu oxy của bệnh nhân. Theo dõi những bệnh nhân có nguy cơ xẹp phổi và nhiễm độc Các dấu hiệu và triệu chứng bao gồm ho vô cớ, đau ngực dưới xương ức, khó chịu, mệt mỏi, buồn nôn và nôn. Nồng độ oxy 100% (FiO2 = 1,0) được coi là an toàn trong thời gian ngắn (< 24 giờ). Nồng độ oxy lớn hơn 60% cho hơn 24 đến 48 giờ có thể làm tổn thương phổi và hô hấp tồi tệ hơn. Giảm FiO2 ngay khi PaO2 đạt đến mức có thể chấp nhận được về mặt lâm sàng (> 60 mmHg hoặc cao hơn).
2.5. QUẢN LÝ LÀM ẨM VÀ LÀM ẤM ĐƯỜNG THỞ
Thở máy xâm nhập được chỉ định khi các phương thức thở không xâm nhập không hỗ trợ đầy đủ quá trình oxy hóa và/hoặc thông khí. Khi thở máy xâm nhập, bệnh nhân được đặt ống nội khí quản hoặc mở khí quản. Máy thở sau đó được lắp với dây máy thở và kết nối với bệnh nhân thông qua ống nội khí quản hoặc mở khí quản để duy trì một hệ thống khép kín. Khí từ máy thở được dẫn qua máy làm ẩm và thiết bị trao đổi độ ẩm (HME) trước khi đi vào phổi qua ống nội khí quản hoặc mở khí quản. Sau khi hít vào, khí được thở ra một cách thụ động theo dây thở ra của hệ thống.
Máy làm ẩm nằm ở phía dây hít vào là cần thiết để khắc phục hai vấn đề chính. Đầu tiên, sự hiện diện của một đường thở nhân tạo cho phép khí đi vào phổi đã bỏ qua quá trình làm ẩm đường thở trên thông thường. Thứ hai, lưu lượng dòng chảy cao hơn và thể tích khí lớn hơn thường được đẩy vào trong quá trình thông khí cơ học yêu cầu làm ẩm bổ sung để tránh làm khô màng trong phổi quá mức. Các dây máy thở đã kết hợp cốc thu nước để ngăn ngưng tụ từ khí ẩm khỏi tắc nghẽn đường ống. Các máy thở còn chứa dây nóng chạy thông qua các dây hít vào, thở ra. Các dây này duy trì nhiệt độ của khí ở mức hoặc gần với nhiệt độ cơ thể, giảm đáng kể sự ngưng tụ và giảm độ ẩm trong khí, giảm nhu cầu bẫy nước trong dây máy thở. Tránh thay đổi thường xuyên dây máy thở để làm giảm nguy cơ viêm phổi liên quan thở máy (VAP).
2.6. BÁO ĐỘNG MÁY THỞ
Báo động giúp theo dõi chức năng máy thở liên tục là cần thiết để đảm bảo quá trình thở máy hoạt động an toàn và hiệu quả. Cả báo động cao và thấp thường được cài đặt, các giá trị tới hạn sẽ kích hoạt báo động máy thở. Các máy thở theo dõi liên tục nhiều biến số như áp lực đường thở, tốc độ dòng, thể tích và tần số hô hấp. Do tín hiệu báo động quá thường gặp, nhiều điều dưỡng và bác sĩ thường không chú ý đến tín hiệu báo động hoặc nhấn nút tắt âm thanh báo động trên máy thở, do vậy đã bỏ qua một vài báo động quan trọng nguy cơ đe dọa tính mạng bệnh nhân. Chính vì vậy, điều thiết yếu với bác sĩ và điều dưỡng khi chăm sóc bệnh nhân thở máy là phải xác định được lý do gây ra các báo động máy thở và tìm nguyên nhân, xử trí các báo động này.
Một số báo động máy thở quan trọng thường gặp :
Báo động ngắt kết nối (disconnect alarm)
Điều quan trọng là khi xảy ra tuột dây máy thở, nhân viên y tế phải được thông báo. Nói chung, cảnh báo này là một báo động liên tục và được kích hoạt khi máy thở không cảm nhận được mức áp suất thở vào hoặc thông khí phút. Với rò rỉ khí, báo động này cũng vẫn được kích hoạt mặc dù bệnh nhân vẫn có thể nhận được nhịp thở đặt trước.
Báo động áp lực
Báo động áp lực cao được thiết lập trong mode thở thể tích để đảm bảo thông báo về áp suất vượt quá ngưỡng đã chọn. Các báo động này thường được đặt cao hơn 10-15 cmH2O so với áp lực đỉnh thì hít vào (peak inspiratory pressure – PIP). Khi áp lực đường thở vượt quá giới hạn áp lực được cài đặt, máy thở ngay lập tức chuyển từ thì thở vào sang thì thở ra và bệnh nhân không còn nhận được dòng khí cấp nữa. Một số nguyên nhân gây ra cảnh báo áp lực này bao gồm ho, mất đồng thì giữa bệnh nhân và máy thở, chất tiết, nước ngưng tụ trong đường ống, bệnh nhân cắn ống nội khí quản, tăng sức kháng đường thở (co thắt phế quản), giảm compliance phổi (ví dụ: phù phổi, tràn khí màng phổi) và dây thở bị gập, đặt ống vào phế quản gốc phải.
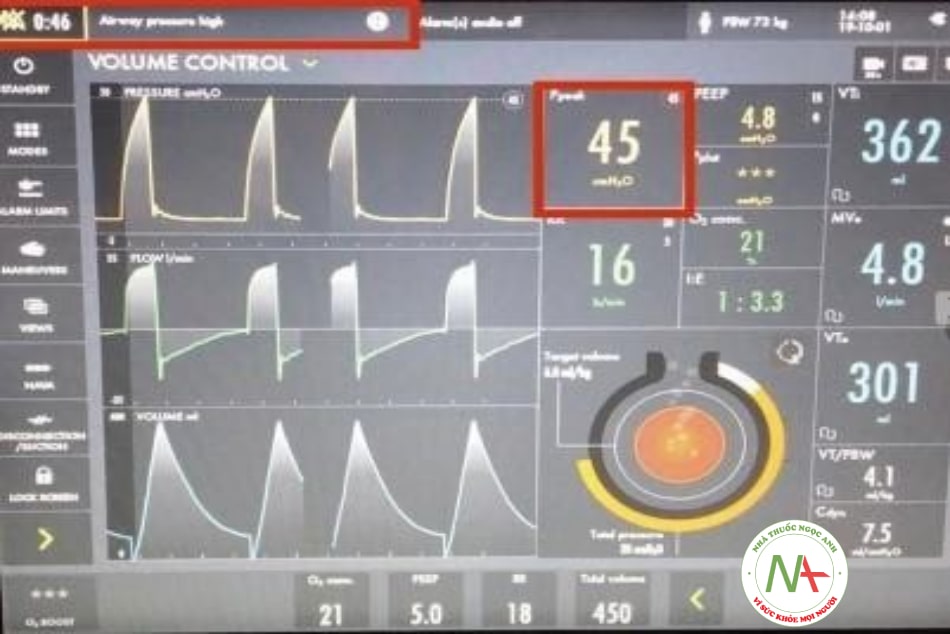
Báo động áp lực thấp được kích hoạt khi áp lực đường thở giảm xuống dưới giới hạn áp lực thấp được cài đặt. Báo động này được sử dụng để nhận biết tình trạng ngắt kết nối, rò rỉ khí, cũng như thay đổi mức sức cản đường thở hay độ giãn nở phổi. Báo động này thường được cài đặt thấp hơn 5-10 cmH2O so với áp lực đỉnh thì hít vào (peak inspiratory pressure – PIP ) hoặc thấp hơn 1-2 cmH2O so với PEEP hoặc cả hai.
Báo động thể tích lưu thông thấp
Báo động thể tích lưu thông thấp thường được cài đặt ở mức thấp hơn 150–200 ml so với giá trị VT được cài đặt. Báo động VT thấp thường đi kèm với báo động áp lực cao, cần phải tìm kiếm ngay nguyên nhân gây ra hiện tượng này. Báo động VT thấp cũng thường được kích hoạt khi có rò khí lớn trên hệ thống dây máy thở. Với kiểu nhịp thở kiểm soát áp lực (PC) và hỗ trợ áp lực (PS), báo động VT thấp thường do tăng sức cản đường thở, giảm độ giãn nở của hệ thống hô hấp, auto-PEEP, bệnh nhân thở kiệt sức hoặc suy chức năng điều hành hô hấp.
Báo động tần số thở cao hoặc thấp
Báo động tần số thở cao trong mode thở CMV và SIMV có nghĩa là bệnh nhân có nhu cầu thông khí phút cao trong khi tần số thở được bác sĩ cài đặt thấp hơn tần số thở tự nhiên của bệnh nhân, dẫn đến thông khí phút giảm và PaCO2 sẽ tăng lên. Vì vậy, tìm nguyên nhân gây tăng nhu cầu thông khí của bệnh nhân, nếu không thể xác định rõ nguyên nhân thì cần tăng tần số thở kiểm soát để đảm bảo thông khí phút an toàn.
Báo động tần số thở thấp thường được cài đặt trong thông khí tự nhiên. Do không có nhịp thở kiểm soát nên báo động này có nghĩa là bệnh nhân không đủ khả năng duy trì thông khí phút – giảm nỗ lực thở hoặc suy chức năng điều hành hô hấp. Do vậy, cần phải chuyển sang mode thở kiểm soát (CMV) cho bệnh nhân.
Báo động im lặng hoặc dừng
Các báo động luôn ở chế độ hoạt động. Tuy nhiên, các máy thở có các tùy chọn im lặng hoặc tạm dừng để nhân viên y tế có thể tạm thời tắt tiếng cảnh báo trong thời gian ngắn (tức là 20 giây). Sau đó, máy thở sẽ tự kích hoạt lại chế độ báo động.
Báo động cung cấp biện pháp bảo vệ quan trọng cho bệnh nhân thở máy. Tuy nhiên, cài đặt ngưỡng không thích hợp làm giảm tính hữu dụng của báo động. Khi chênh lệch ngưỡng quá hẹp, cảnh báo xảy ra không cần thiết và thường xuyên. Ngược lại, các cảnh báo được đặt quá chênh lệch không cho phép đánh giá chính xác tình trạng bất thường của bệnh nhân và máy thở.
2.7. CÁC BIẾN CHỨNG CỦA THỞ MÁY
Các biến chứng đáng kể có thể phát sinh từ thở máy, đáp ứng của bệnh nhân với thở máy hoặc những phát sinh từ trục trặc máy thở. Mặc dù cách tiếp cận để giảm thiểu hoặc điều trị các biến chứng cơ học thở máy liên quan đến nguyên nhân cơ bản, điều quan trọng là đánh giá thường xuyên bệnh nhân, thiết bị máy thở, và đáp ứng của bệnh nhân với máy thở. Nhiều bác sĩ lâm sàng tham gia vào các hoạt động để đánh giá bệnh nhân và máy thở, nhưng trách nhiệm cuối cùng để đảm bảo hỗ trợ thở máy liên tục của bệnh nhân lại thường do điều dưỡng chăm sóc thở máy cho bệnh nhân.
Barotrauma
Barotrauma mô tả tổn thương hệ thống phổi do vỡ phế nang do áp lực đường thở quá cao gây áp lực cao trong phế nang. Khí trong phế nang bị vỡ đi vào kẽ cấu trúc phổi gây tràn khí màng phổi, tràn khí trung thất, tràn khí màng bụng, hoặc tràn khí dưới da. Vì tràn khí màng phổi có thể dẫn đến trụy tim mạch và ngừng tuần hoàn nên đây là một cấp cứu lâm sàng. Tràn khí màng phổi nên được xem xét bất cứ khi nào áp lực đường thở tăng mạnh, giảm rì rào phế nang một bên, hoặc huyết áp giảm đột ngột. Bệnh nhân mắc các bệnh phổi tắc nghẽn mạn tính, hen, bệnh phổi phân bố không đều (ví dụ viêm thùy phổi), hoặc khí phế thũng, nang kén khí ở phổi… có nguy cơ cao đối với barotrauma. Các kỹ thuật để giảm tỷ lệ mắc barotrauma bao gồm việc sử dụng các VT nhỏ, thận trọng sử dụng PEEP, và tránh áp lực đường thở cao và phát triển auto-PEEP ở những bệnh nhân có nguy cơ cao.
Volutrauma
Volutrauma mô tả tổn thương phế nang với áp suất cao do thông khí thể tích lớn ở bệnh nhân ARDS. Một kỹ thuật phổ biến để giảm nguy cơ này là việc sử dụng các VT nhỏ hơn (4-6 mL/kg trọng lượng cơ thể).
PEEP nội sinh (auto-PEEP)
Auto-PEEP xảy ra khi 1 nhịp thở chưa hoàn thành trước khi bắt đầu 1 nhịp thở tiếp theo… Bẫy khí vô tình làm tăng thể tích phổi khiến áp lực cuối kỳ thở ra tăng cao trong phế nang. Sự hiện diện của auto-PEEP làm tăng nguy cơ biến chứng từ PEEP. Thở máy với bệnh nhân COPD (ví dụ: hen suyễn, khí phế thũng) hoặc tần số thở cao có nguy cơ tăng sự phát triển của auto-PEEP. Kỹ thuật đánh giá auto-PEEP thay đổi với các kiểu máy thở khác nhau và các chế độ, nhưng thường liên quan đến việc đo áp lực đường thở cuối thì thở ra. Phương pháp này yêu cầu bệnh nhân hoàn toàn thở theo máy và không được kích hoạt nhịp thở tự nhiên. Một kỹ thuật khác của theo dõi auto-PEEP khi bệnh nhân vẫn đang thông khí là sử dụng đồ thị thời gian – dòng chảy hiển thị trên màn hình máy thở. Nếu dòng chảy không trở lại đường cơ sở khi kết thúc thở ra trước khi hơi thở tiếp theo bắt đầu thì bệnh nhân có auto-PEEP. Auto-PEEP có thể được giảm thiểu bởi:
- Tối đa hóa thời gian thở ra (tăng tốc độ dòng thì hít vào để làm giảm thời gian hít vào).
- Giảm các vật cản đối với dòng thở ra (ví dụ: sử dụng ống ET đường kính lớn hơn, loại bỏ co thắt phế quản và dịch tiết).
- Tránh thông khí quá mức.
Viêm phổi thở máy
Viêm phổi thở máy có liên quan với tăng tỷ lệ bệnh tật và tử vong của bệnh nhân. Phòng ngừa bao gồm giảm thời gian thở máy, tăng cường an toàn cho bệnh nhân trong khi thở máy xâm nhập và các quy trình hiệu quả cho máy thở. Các can thiệp trong quá trình thở máy nhằm mục đích tránh sự xâm nhập của vi khuẩn vào đường thở dưới.
- Độ cao của đầu giường đến 30° đến 45° giúp giảm thiểu việc hít vào miệng và dạ dày dịch tiết.
- Sử dụng ống nội khí quản với một ống hút trên cuff kết hợp một ống chuyên dụng phía trên cuff, cho phép áp suất hút thấp liên tục (-20 mmHg) hoặc hút không liên tục các chất tiết dưới thanh quản bị lưu lại phía trên cuff. Loại bỏ dịch tiết tồn đọng có thể đặc biệt hữu ích trước khi xì hơi cuff. Các nghiên cứu đã chứng minh rằng ứng dụng hút liên tục các chất tiết dưới thanh quản với ống hút trên cuff có thể ngăn chặn hoặc trì hoãn sự khởi phát của
- Ngoài ra, chăm sóc răng miệng bao gồm chlorhexidine gluconate 0,12% súc miệng và đánh răng để loại bỏ mảng bám là quan trọng điều chỉnh để ngăn chặn viêm phổi thở máy.
- Vệ sinh
- Cung cấp độ ẩm cho niêm mạc miệng và môi sau mỗi 2 đến 4 giờ.
- Sử dụng hệ thống thở khép kín.
- Sử dụng kỹ thuật vô trùng để hút đờm.
- Cung cấp hỗ trợ dinh dưỡng.
- Giảm thời gian thở máy.
Bất thường máy thở
Các vấn đề liên quan đến hoạt động bình thường của máy thở, mặc dù hiếm, có thể có hậu quả nghiêm trọng cho bệnh nhân. Nhiều hệ thống báo động trên máy thở được thiết kế để cảnh báo các bác sĩ lâm sàng về hoạt động của máy thở. Các hệ thống báo động này phải được kích hoạt mọi lúc nếu máy thở có vấn đề và phải nhanh chóng được xác định và sửa chữa.
Nhiều “vấn đề” được xác định với máy thở thực sự liên quan đến việc thiết lập hoặc sử dụng không phù hợp các thiết bị. Một số vấn đề liên quan đến người sử dụng máy thở như dây máy thở không được kết nối đúng cách, hệ thống báo động được đặt không đúng hoặc cài đặt máy thở không đầy đủ. Tuy nhiên, có những trường hợp do hệ thống máy thở không hoạt động đúng cách. Ví dụ về trục trặc máy thở bao gồm các van máy thở bị kẹt và dòng khí bị cản trở, phân phối khí không đủ hoặc quá nhiều, mạch điện tử lỗi trong máy thở, vi xử lý, lỗi với tắt máy hoàn toàn và mất điện.
Cách tiếp cận quan trọng nhất đối với sự cố máy thở là duy trì mức độ cảnh giác cao để xác định xem máy thở đang hoạt động tốt hay không. Đảm bảo rằng hệ thống báo động được thiết lập phù hợp mọi lúc, thường xuyên đánh giá hoạt động của máy thở và luôn có sự hỗ trợ của nhân viên bảo trì hệ thống máy thở là một số hoạt động quan trọng nhất để đảm bảo an toàn thở máy. Ngoài ra, bất cứ khi nào máy thở bị nghi ngờ trục trặc, bệnh nhân ngay lập tức được đưa ra khỏi máy thở và được hỗ trợ bằng máy thở khác cho đến khi vấn đề được giải quyết. Bất kỳ thay đổi đột ngột nào trong tình trạng hô hấp hoặc tim mạch của bệnh nhân, người điều dưỡng cần thông báo cho bác sĩ lâm sàng để xử lý. Tình trạng lâm sàng của bệnh nhân cải thiện nhanh chóng sau khi được rút khỏi máy thở gợi ý nguyên nhân do máy thở. Nếu bệnh nhân tiếp tục suy hô hấp sau khi rút khỏi máy thở gợi ý nguyên nhân liên quan đến bệnh nhân.
TÀI LIỆU THAM KHẢO
- Murthy S, Gomersall CD, Fowler Care for Critically Ill Patients With COVID-19. JAMA 2020; 323:1499.
- Respiratory care committee of Chinese Thoracic Society. [Expert consensus on pre- venting nosocomial transmission during respiratory care for critically ill patients infected by 2019 novel coronavirus pneumonia]. Zhonghua Jie He He Hu Xi Za Zhi 2020; 17:E020.
- Centers for Disease Control and 2019 Novel coronavirus, Wuhan, China. In- formation for Healthcare Professionals. https://www.cdc.gov/coronavirus/2019-nCoV/ hcp/index.html (Accessed on February 14, 2020).
- World Health Novel Coronavirus (2019-nCoV) technical guidance. https:// www.who.int/emergencies/diseases/novel-coronavirus-2019/technical-guidance (Ac- cessed on February 14, 2020).
- Alhazzani W, Moller MH, Arabi YM, et Surviving Sepsis Campaign: Guidelines on the Management of Critically Ill Adults with Coronavirus Disease 2019 (COVI-19). Intensive Care Med 2020; (in press).
- NIH COVID-19 Treatment Guidelines https://covid19treatmentguidelines.nih.gov/over- view/management-of-covid-19/ (Accessed on April 22, 2020).
- Alhazzani W, Møller MH, Arabi YM, et Surviving Sepsis Campaign: Guidelines on the Management of Critically Ill Adults with Coronavirus Disease 2019 (COVID-19). Crit Care Med 2020; 48:e440.
- Vitacca M, Nava S, Santus P, Harari Early consensus management for non-ICU acute respiratory failure SARS-CoV-2 emergency in Italy: from ward to trenches. Eur Respir J 2020; 55.
- Bai C, Chotirmall SH, Rello J, et Updated guidance on the management of COVID-19: from an American Thoracic Society/European Respiratory Society coordinated Interna- tional Task Force (29 July 2020). Eur Respir Rev 2020; 29.
- Botta M, Tsonas AM, Pillay J, et Ventilation management and clinical outcomes in invasively ventilated patients with COVID-19 (PRoVENT-COVID): a national, multicentre, observational cohort study. Lancet Respir Med 2021; 9:139.
- Grasselli G, Zangrillo A, Zanella A, et al. Baseline Characteristics and Outcomes of 1591 Patients Infected With SARS-CoV-2 Admitted to ICUs of the Lombardy Region, JAMA 2020; 323:1574.
- Guérin C, Reignier J, Richard JC, et al. Prone positioning in severe acute respiratory distress syndrome. N Engl J Med 2013; 368:2159.
- Sun L, Hymowitz M, Pomeranz Eye Protection for Patients With COVID-19 Under- going Prolonged Prone-Position Ventilation. JAMA Ophthalmol 2021; 139:109.
- Chang SH, Jiang J, Kon ZN, et al. Safety and Efficacy of Bronchoscopy in Critically Ill Patients With Coronavirus Disease 2019. Chest 2021; 159:870.
- Pan C, Chen L, Lu C, et al. Lung Recruitability in COVID-19-associated Acute Respira- tory Distress Syndrome: A Single-Center Observational Am J Respir Crit Care Med 2020; 201:1294.
- Shelhamer MC, Wesson PD, Solari IL, et al. Prone Positioning in Moderate to Severe Acute Respiratory Distress Syndrome Due to COVID-19: A Cohort Study and Analysis of Physiology. J Intensive Care Med 2021; 36:241.
- Weiss TT, Cerda F, Scott JB, et al. Prone positioning for patients intubated for severe acute respiratory distress syndrome (ARDS) secondary to COVID-19: a retrospective ob- servational cohort study. Br J Anaesth 2021; 126:48.
- Lotz C, Muellenbach RM, Meybohm P, et Effects of inhaled nitric oxide in COVID-19- induced ARDS – Is it worthwhile? Acta Anaesthesiol Scand 2021; 65:629.
- American Association of Critical-Care Nurses. (2017). Oral care for acutely and criti- cally ill Critical Care Nurse, 37(3), e19–e21. doi:10.4037/ccn2017179. Retrieved from https://www.aacn.org/~/media/aacn-website/clincial-resources/practice-alerts/ oralcarepractalert2017.pdf.
- Burns, S. M., & Delgado, S. A. (2019). AACN essentials of critical care nursing (4th ed.). New York, NY: McGraw-Hill.
- Morton, G., & Fontaine, D. K. (2018). Critical care nursing: A holistic approach (11th ed.). Philadelphia, PA: Wolters Kluwer.
- Urden, L. , Stacy, K. M., & Lough, M. E. (2020). Priorities in critical care nursing (8th ed.). St. Louis, MO: Elsevier.

