Nhà thuốc Ngọc Anh – Chương 4: Xử lý thu hoạch mỡ
Tác giả: Dr. Mario Goisis, Sara Izzo, AndreaSbarbati, Giamaica Conti và Giovanni Francesco Nicoletti
Nguồn sách: Sách: Quy trình PRP và Tiêm cấy mỡ nâng cao -Tác giả: Dr: Mario Goisis
Các nguyên nhân đằng sau việc xử lý mỡ đã thu hoạch
Vì nó là trường hợp của các thủ tục ngoại trú, có những phương pháp khác nhau để xử lý chất béo. Các phương pháp này tạo ra các kết quả khác nhau, đặc biệt là các kết quả liên quan đến bốn khía cạnh quan trọng nhất của độ bền lâu dài của mảnh ghép.Yếu tố đầu tiên liên quan đến độ bền của mảnh ghép là sự không có chất gây ô nhiễm trong mô được chuyển. Mục đích của tất cả các phương pháp này là loại bỏ các thành phần không thể sống được, gây viêm và độc hại từ mỡ được hút ra, bao gồm các tế bào máu, thuốc tê, các mảnh tế bào mỡ bị vỡ bao gồm các giọt dầu và các mảnh vụn tế bào. Tiếp xúc trực tiếp với không khí cũng có tác động tiêu cực đến tế bào mỡ, vì nó kích thích các phản ứng tiền viêm và tổn thương oxy hóa. Tất cả các yếu tố này đều có tác động tiêu cực đến khả năng sử dụng của mảnh ghép. Hơn nữa, nước trộn với chất béo tạo ra một thể tích giả sẽ biến mất ngay sau khi ghép.
• Mục đích đầu tiên của phương pháp sơ chế và xử lý mảnh ghép là loại bỏ tất cả các chất gây ô nhiễm và nước trong khi tránh tiếp xúc với không khí.Yếu tố thứ hai liên quan đến độ bền lâu dài, rõ ràng là bị thay đổi bởi tính toàn vẹn của chất béo được truyền. Yếu tố này lần đầu tiên được Peer nhấn mạnh trong một bài báo rất quan trọng của ông, xuất bản năm 1955 và được gọi là “lý thuyết sinh tồn của tế bào”. Theo lý thuyết này, mảnh ghép với số lượng lớn nhất các tế bào mỡ không bị phá hủy sẽ có cơ hội bền lâu dài nhất..
• Mục đích thứ hai của phương pháp chuẩn bị mảnh ghép là bảo tồn tính toàn vẹn của tế bào mỡ.Cuối cùng, trong những năm gần đây, nhiều nghiên cứu tập trung vào yếu tố thứ ba, nồng độ của tế bào gốc mô mỡ (ASC). Yếu tố này được gọi là “lý thuyết thay thế vật chủ”: nó quy định rằng hầu hết các tế bào mỡ được ghép sẽ chết sau khi tiêm và chất nền ngoại bào còn lại đóng vai trò như một giá đỡ cho các tế bào thay thế, chúng tái tạo mô. Các ASC đóng một vai trò quan trọng trong quá trình tái tạo này.
Do đó, việc bảo tồn số lượng tế bào gốc mô mỡ (ASC) cao nhất có thể được chứng minh cải thiện khả năng giữ chất béo, cùng với tiềm năng phát triển của tế bào gốc trung mô có nguồn gốc từ mô mỡ được coi là một yếu tố đóng góp chính.
• Mục đích thứ ba của phương pháp chuẩn bị mảnh ghép là bảo tồn và tập trung số lượng tế bào gốc mỡ cao nhất.
Cuối cùng, yếu tố thứ tư cũng đóng một vai trò ưu việt trong việc lựa chọn phương pháp xử lý mảnh ghép: hiệu quả của nó. Hiệu quả của một phương pháp có thể được đánh giá dựa trên mức độ tốn thời gian, hiệu quả chi phí và lượng chất béo bị mất đi trong quá trình chuẩn bị. Yếu tố cuối cùng này rất quan trọng trong các trường hợp điều trị xâm lấn nhỏ ở mặt, cổ và tay.
Trong những trường hợp này, bệnh nhân thường trải qua một đợt thu hoạch chất béo nhỏ, với mục đích tiêm 15-20 cc chất béo này vào vị trí đã chọn. Có một số phương pháp hiệu quả thấp yêu cầu thu hoạch từ 100 cc chất béo trở lên để thu được 20 cc chất béo đã qua xử lý. 80 cc còn lại bị mất trong quá trình xử lý. Cần lưu ý một điều rằng trong khi ở một số bệnh nhân, việc thu hoạch 100 cc rất đơn giản, ở những bệnh nhân gầy khác, có mỡ thừa, phẫu thuật này thì khó hơn và có thể đòi hỏi thời gian thu hoạch từ các khu vực lấy mỡ khác nhau.
Mục tiêu thứ tư của phương pháp chuẩn bị mảnh ghép là hiệu quả về chi phí thủ tục và về tỷ lệ phần trăm chất béo bị lãng phí trong quá trình chuẩn bị.
Các quy trình xử lý mỡ
Hiện có rất nhiều phương pháp được sử dụng để xử lý chất béo thu được. Thường được sử dụng nhất là chiết xuất đơn giản, cuộn gạc bông, ly tâm, rửa, đồng thời rửa và lọc mô.
Quy trình xử lý mỡ Telfa-Rolling
Quy trình Telfa rolling bao gồm việc đổ dịch hút từ ống tiêm lên các mảnh băng lớn (3 × 8-in.) không dính Telfa (do Covidien, Mansfield, MA) (Hình 4.1). Sau đó, chất béo được cuộn và nhào nhẹ trong 5 phút dọc theo miếng gạc bằng cách sử dụng một cán dao mổ vô trùng (Hình 4.2). Chất béo sau đó được nạp bằng thìa nhỏ vào ống tiêm 10 ml và được chuyển bằng bộ chuyển đổi khóa Luer vào ống tiêm 1 ml để tiêm. Do kích thước của các hạt chất béo lớn, nên thường phải bơm chất béo đã thu hoạch và xử lý bằng một ống tiêm lớn hơn (đường kính 1,5 mm trở lên) (Hình 4.3).
Quy trình xử lý mỡ Puregraft
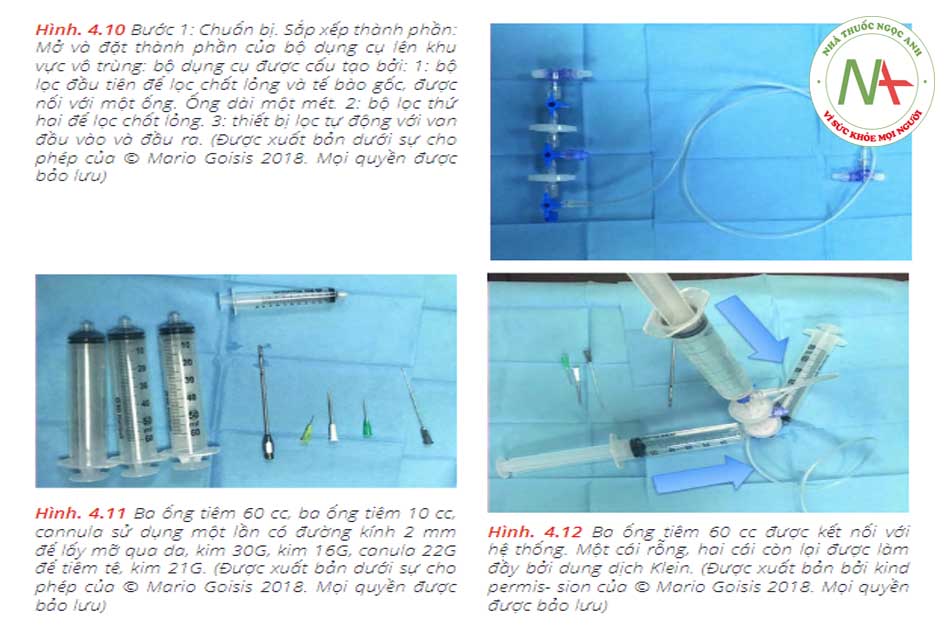
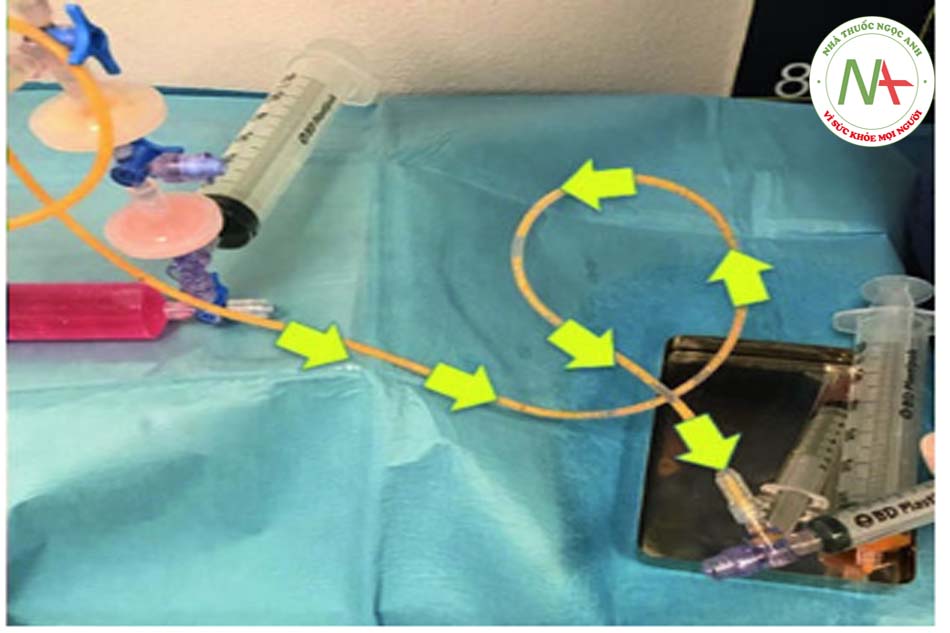
• Bước 1: Chuẩn bị Giai đoạn đầu sẽ được dành để sắp xếp, mở ra và sắp xếp các thành phần của hộp trong khu vô trùng, trong khi bộ manifold được kết nối như sau: Đầu tiên (1), bộ lọc được kết nối với một ống, đặt trong khay nhỏ . Khay được làm đầy với gây tê tại chỗ. Sau đó (2) ống được kết nối với một ống tiêm VacLok © 20 cc. Sau đó, ống tiêm 60 cc rỗng (3) được đổ đầy dung dịch muối (4). Bơm tiêm 60 cc rỗng (xem 5) và ống được nối với bơm tiêm 10cc (xem 6). Khi đó, manifold (xem 7) cần được kết nối với ống tiêm PRP, trong khi manifold (xem 8) sẽ được kết nối với một ống tiêm 60 cc rỗng.
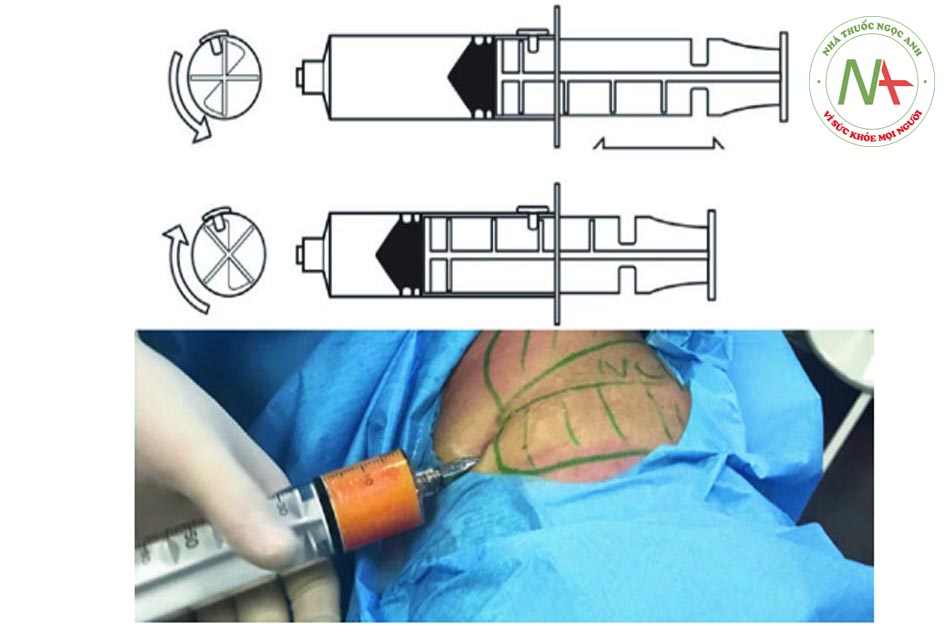
• Bước 2: Gây tê Thuốc gây tê cục bộ được truyền trực tiếp từ khay vào ống tiêm, và khi hệ thống đóng hoàn toàn, nguy cơ nhiễm trùng được giảm bớt. Đặc biệt, khi khóa vòi ở vị trí “a”, khi kéo pít-tông, ống tiêm chứa đầy dung dịch thuốc tê. Bằng cách di chuyển khóa vòi đến vị trí “b”, dung dịch gây tê được tiêm nhanh chóng. Bằng cách này, tất cả sự xâm nhập của thuốc tê mất 5 phút để hoàn thành.

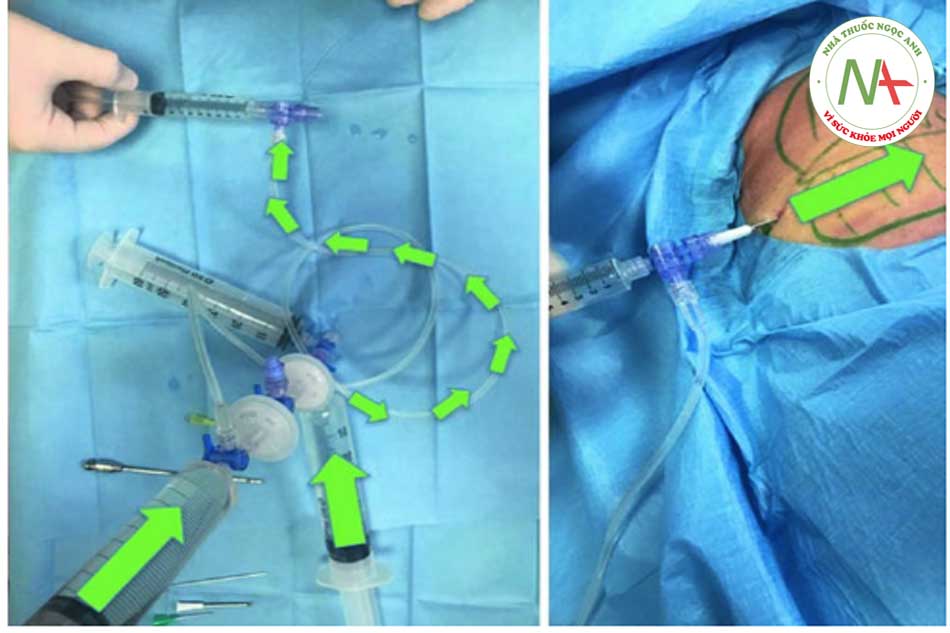
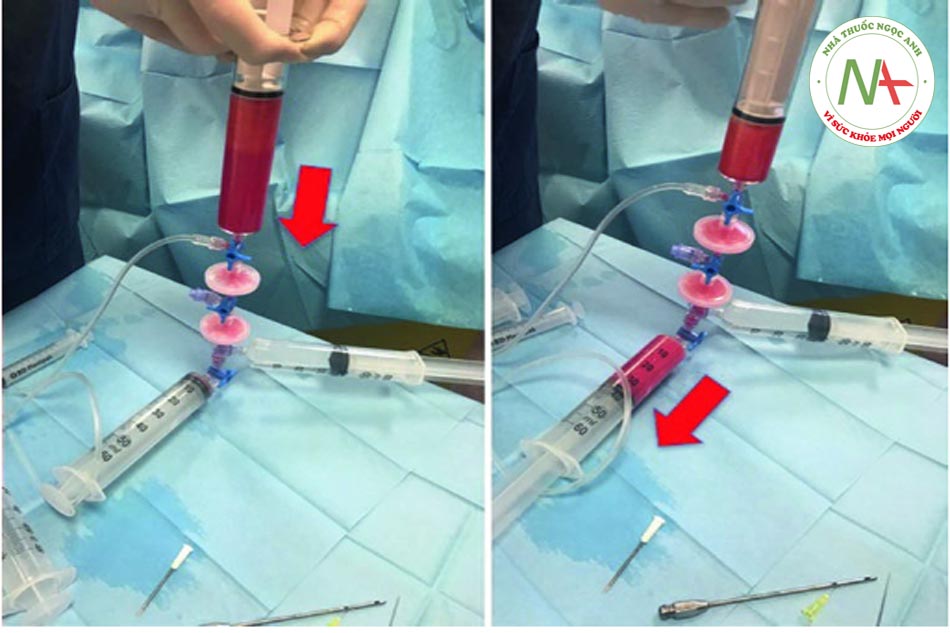
Bước 3: Thu hoạch mỡ Để thu hoạch chất béo, ống tiêm VacLok © được chuyển từ vị trí “trượt bình thường” sang vị trí “khóa để giữ chân không”. Đặc biệt, để khóa ống tiêm, pít tông phải được di chuyển hoàn toàn về phía trước hoặc hoàn toàn về phía sau và pít tông quay để các vây khóa khớp với chốt chặn. Bằng cách này, ống tiêm VacLok cho phép người ta khóa pít-tông ở nhiều vị trí trong một máy hút áp suất âm. Áp suất âm được duy trì và ống tiêm dần dần được làm đầy chất béo. Khóa vòi ở vị trí “b” (xem Hình 4.4, 4.5, 4.6, 4.7, 4.8 và 4.9 bên dưới).



Bước 4: Chuyển chất béo vào hệ thống Khi ống tiêm đã được lấp đầy hoàn toàn, cần chuyển khóa vòi về vị trí “a”. Chất béo, trộn với máu và thuốc tê, sau đó được tống ra ngoài và chuyển trực tiếp từ ống tiêm vào hệ thống.
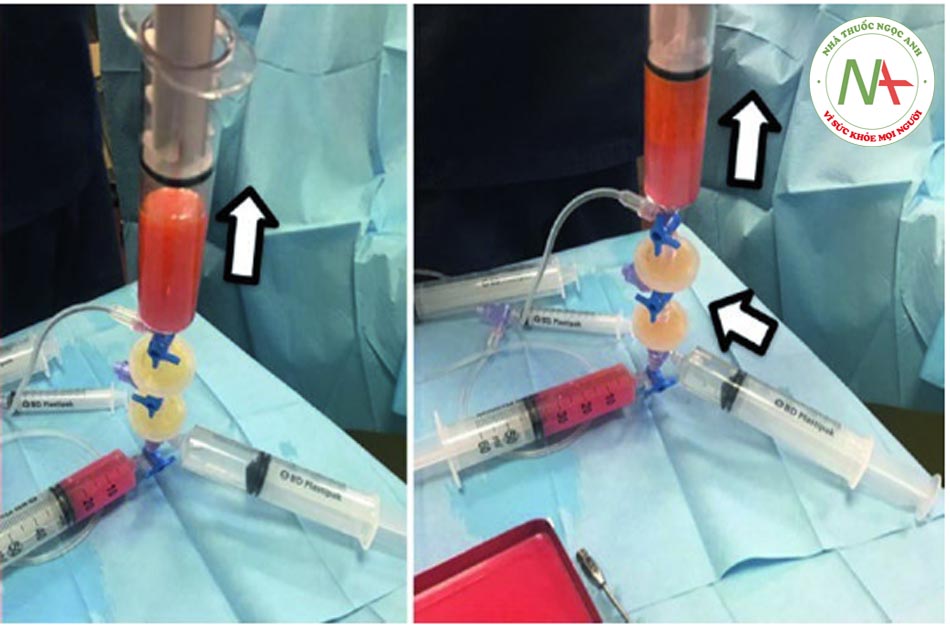
•Bước 5: Tiêm thâm nhập Khóa vòi được di chuyển đến vị trí “b” và khi đó pít tông của ống tiêm 3 có thể được ấn xuống. Vì màng lọc ở vị trí 1 nên hầu hết các tế bào máu và dịch gây tê đều được dẫn vào khay (xem mũi tên đỏ). Ngược lại, các tế bào mỡ được chuyển đến ống tiêm số 5 (xem mũi tên vàng). Quy trình hoàn toàn tự động tránh các chuyển động rườm rà của chốt chặn hoặc van.
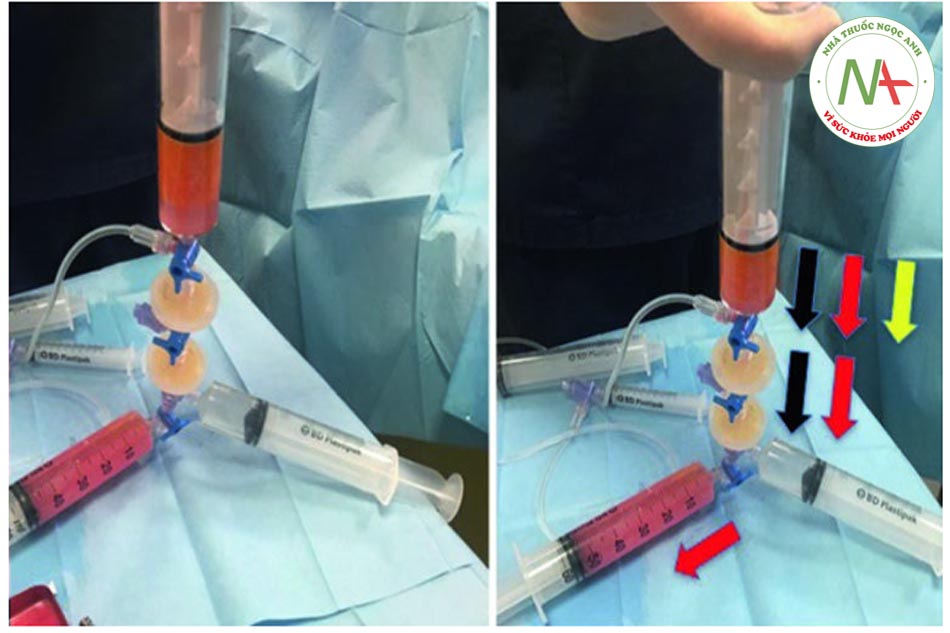
• Bước 6: Rửa Khi kéo pít-tông của ống tiêm 5, nó sẽ tự động hút dung dịch muối từ ống tiêm 4. Sau đó, cần đợi 60 giây trước khi đẩy pít-tông xuống để đẩy hết dung dịch ra khỏi phần dưới của ống tiêm 5. Do bóc tách gây ra bởi trọng lực, máu, nước và chất gây tê cục bộ sẽ lắng đọng ở phần dưới của ống tiêm. Van một chiều tự động hướng các phần tử này đến ống tiêm 3 và đến bộ lọc. Sau 60 giây, quá trình tách chất béo ra khỏi nước hoàn tất và quy trình này có thể được lặp lại để rửa kỹ: màu sắc của chất béo chuyển từ cam sang vàng.
• Bước 7: Tiêm thâm nhập lần thứ 2. Quy trình bây giờ yêu cầu tháo ống tiêm 3. Khi pít tông của ống tiêm 5 được đẩy xuống, nước dư sẽ được ép ra và vào bộ lọc 1 (xem mũi tên màu trắng). Ngược lại, các tế bào chất béo được tự động chuyển sang ống tiêm 8 (xem mũi tên màu vàng).
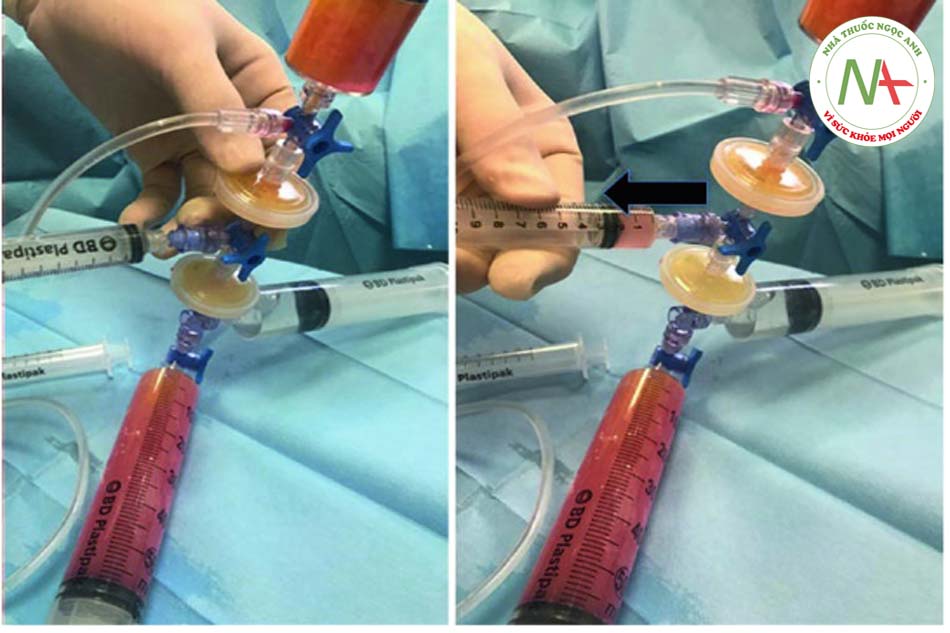
• Bước 8: trộn mỡ với PRP Trộn chất béo với PRP rất đơn giản khi sử dụng hệ thống van; ngay sau khi kéo pít-tông của ống tiêm 8 trở lại, ống tiêm sẽ lấp đầy PRP có trong ống tiêm 7.
• Bước 9: tiêm mỡ với PRP Để tiêm chất béo đã qua xử lý, phải rút ống tiêm 3 ra; khóa vòi của ống tiêm 6 cần được chuyển từ vị trí “b” sang vị trí “a”, cho phép tự động chuyển chất béo cộng với PRP từ ống tiêm 8 sang ống tiêm 6.
• Bước 10: Đổ chất thải Sau khi đậy nắp, drape vô trùng được bọc lại, và hộp được vứt bỏ một cách an toàn và đặt trong thùng rác y tế.
Các sự cân nhắc về quy trình xử lý mỡ
Các phương pháp khác nhau chắc chắn dẫn đến các kết quả khác nhau, đặc biệt là liên quan đến ba yếu tố quan trọng nhất liên quan đến độ bền lâu dài của mảnh ghép. Năm 2012, Gir và cộng sự đã xuất bản một bài tổng quan, nhằm đánh giá các phương pháp xử lý chất béo khác nhau, và trong 4 năm qua, nhiều nghiên cứu lâm sàng và thực ng-hiệm khác đã cố gắng
khảo sát một phương pháp đơn lẻ hiệu quả nhất để xử lý chất béo cho một mảnh ghép tự thân lý tưởng.Condé-Green và cộng sự so sánh quá trình gạn, ly tâm, rửa và tăng tế bào mô đệm mạch máu của các mẫu đã rửa trên một mô hình động vật khỏe mạnh. Họ đã chứng minh rằng các mảnh ghép đã được gạn lọc có khả năng sống kém nhất và biểu hiện những biến đổi nang nghiêm trọng ở 11 tuần sau khi ghép, so với các mảnh ghép ly tâm và rửa sạch. Trong nghiên cứu của họ, ly tâm bằng kỹ thuật Coleman (1200 g trong 3 phút) cho thấy tỷ lệ vôi hóa và xơ hóa cao hơn so với những chế phẩm được chuẩn bị bằng cách rửa.
Cuối cùng Condé-Green đã chứng minh bằng thực nghiệm rằng rửa chất béo tốt hơn so với gạn lọc và ly tâm về hình dạng mô học và khả năng tồn tại lâu dài. Bài báo này xác nhận các quan sát lâm sàng được Condé-Green công bố trước đây với Pitanguy và cộng sự.
Các tác giả đã so sánh hiệu quả lâm sàng của ba kỹ thuật xử lý chất béo (gạn, rửa và ly tâm) ở 20 bệnh nhân. Hút mỡ tiêu chuẩn với một cannula đầu tù ba lỗ với đường kính 3 mm và chiều dài 20 cm đã được thực hiện, tạo ra áp lực âm nhẹ chắc chắn bằng cách sử dụng một ống tiêm Luerlock 10 ml. Mô mỡ hút được chia thành ba mẫu, mỗi mẫu được xử lý bằng cách gạn, rửa hoặc ly tâm. Sau khi xử lý, ba lớp cơ bản được quan sát thấy trong tất cả các mẫu: lớp trên, bao gồm một chất lỏng nhờn; lớp trung tâm, bao gồm một mô màu vàng chắc hơn; và lớp dưới, bao gồm chủ yếu là máu, dịch thấm hoặc chất lỏng rửa.
Gần đây, các hạt nhỏ, có thể được nhận ra ở dưới cùng của mẫu ly tâm.Gạn lọc là phương pháp duy nhất duy trì tính toàn vẹn và số lượng tế bào mỡ, trong khi ly tâm phá hủy phần lớn. Việc rửa cũng làm giảm số lượng tế bào có nhân nguyên vẹn, nhưng kết quả tốt hơn so với việc thu được bằng cách ly tâm. Tuy nhiên, rửa và ly tâm làm giảm hơn 50% số lượng tế bào máu so với mẫu đã gạn lọc.
Lớp giữa hoặc trung tâm của mẫu ly tâm cho thấy số lượng tế bào gốc trưởng thành (hoặc ASC) ít nhất, không có hiện tượng giãn nở trong ống nghiệm sau 10 ngày nuôi cấy. Tuy nhiên, các hạt nhỏ cho thấy số lượng ASC lớn nhất, tập trung ở đáy ống tiêm do lực ly tâm. Kết luận của Pitanguy và cộng sự là lớp giữa của mẫu ly tâm là một mô đặc bao gồm chủ yếu là các tế bào mỡ bị phá hủy, không thể sống được, với rất ít ASC. Mặt khác, lớp giữa của mỡ đã rửa sạch chứa nhiều tế bào gốc trung mô (MSC) hơn đáng kể so với lớp được gạn lọc và lớp giữa mẫu ly tâm. Do đó, các tế bào mỡ hút ra đã rửa sạch đại diện cho lựa chọn ghép tốt hơn: chúng chủ yếu bao gồm các tế bào mỡ nguyên vẹn được loại bỏ hầu hết các tế bào máu ngoại vi, với một số lượng lớn các tế bào nội mô và ADC so với các mẫu đã được gạn lọc, chứa một lượng lớn máu và rất ít ADC. Kết luận này một phần đã được xác nhận bởi Kolle và cộng sự vào năm 2013 trong thử nghiệm mù ba, có đối chứng với giả dược của họ, được công bố trên Lancet. Họ so sánh khả năng sống sót của các mô ghép mỡ không được làm giàu được xử lý bằng kỹ thuật Coleman với chất béo được làm giàu bằng tế bào gốc có nguồn gốc từ mô mỡ tự thân (ASC). Chất béo được xử lý bằng kỹ thuật Coleman giữ lại ít hơn 17% thể tích ban đầu của bolus, so với 80% thu được trong trường hợp chất béo được làm giàu.
Hoareau và cộng sự nhận thấy rằng ly tâm tiêu chuẩn (900g trong 3 phút) dẫn đến tỷ lệ tế bào mỡ chết cao. Trong một mô hình chuột, họ đã chứng minh một tỷ lệ cao đáng kể các nang dầu trong số các mảnh ghép đã được gạn lọc và ly tâm tiêu chuẩn. Plaff và cộng sự đã kiểm tra số lượng tế bào gốc có nguồn gốc từ mỡ trong các mẫu hút mỡ được xử lý bằng phương pháp Rolling Telfa so với ly tâm trong 3 phút ở tốc độ 1500 vòng/phút. Họ đánh giá rằng mảnh ghép Telfa dẫn đến số lượng ASC và tế bào quan trọng cao hơn nhiều.
Salinas cộng sự so sánh lăn tấm gạc với ly tâm. Tất cả các mẫu được rửa sạch bằng nước muối thông thường trước khi được cuộn trên gạc Telfa hoặc ly tâm. Họ chứng minh rằng các kỹ thuật ly tâm tiêu chuẩn (1200 g trong 3 phút) tương đương với việc lăn gạc khi loại bỏ nước khỏi mỡ hút ra và duy trì ADC. Ở những con chuột bach, tỷ lệ duy trì là tương đương đối với các mảnh ghép ly tâm và được cuộn bằng gạc.Zhu et al. so sánh một mẫu đối chứng (không chuẩn bị), với quá trình xử lý bằng cách tách trọng lực, bằng cách ly tâm (như mô tả của Coleman), và bằng cách rửa và lọc mô đồng thời. Xem 6, 12. Mẫu cuối cùng được xử lý bằng hệ thống Puregraft. Chất béo được rửa hai lần bằng dung dịch Ringer’s với tỷ lệ một thể tích dung dịch rửa với hai thể tích mô. Thời gian xả nước sau mỗi lần rửa là khoảng 3 phút
Đánh giá bằng kính hiển vi chỉ ra rằng các mảnh ghép được chuẩn bị bằng cách rửa kết hợp với lọc có hàm lượng hồng cầu thấp hơn cũng như giảm sự hiện diện của các giọt lipid tự do cực nhỏ so với các mảnh ghép được xử lý trước bằng cách sử dụng lắng cặn đơn vị trọng lực hoặc ly tâm. Sự khác biệt này đã được xác nhận sau khi ly tâm các mảnh ghép để tách chúng thành các phần cơ bản của chúng. Đặc biệt, các mảnh ghép được chuẩn bị bằng phương pháp lắng trọng lực cho thấy hàm lượng nước tương đối cao nhất, trong khi các mảnh ghép được chuẩn bị bằng cách ly tâm có hàm lượng nước thấp nhất.
Các mảnh ghép được chuẩn bị bằng cách sử dụng hệ thống Puregraft cho thấy các mức chất lỏng dạng nước ở mức trung bình; các mức này thấp hơn đáng kể so với các mức đối chứng và ghép trọng lực.Về mặt thống kê, mức độ lipid-dầu tự do trong các mảnh ghép được chuẩn bị bằng cách rửa kèm theo lọc, nói chung là thấp hơn đáng kể so với trong các mảnh ghép đối chứng, ghép trọng lực và ghép được chuẩn bị bằng ly tâm. Phân tích các tế bào cho thấy rằng kỹ thuật lắng trọng lực và ly tâm loại bỏ khoảng 50% hồng cầu và 60-70% bạch cầu có trong dịch hút ban đầu. Ngược lại, rửa bằng phương pháp lọc sử dụng hệ thống Puregraft đã loại bỏ hơn 95% cả hai loại tế bào máu.
Tóm lại, tài liệu cho thấy một số phát hiện nhất quán. Quá trình gạn đơn giản đã được chứng minh là có thể bảo tồn một số lượng lớn các tế bào mỡ nguyên vẹn và có nhân. Vấn đề chính là nó cho phép một lượng lớn hơn đáng kể các chất gây ô nhiễm dạng nước và lipid bẩn còn lại trong mẫu, đặc biệt là các tế bào hồng cầu và dầu tự do, là những chất gây viêm, và các chất gây ô nhiễm cục bộ, là những chất độc. Các bằng chứng khoa học gần đây khẳng định điều này, cho thấy tỷ lệ sống sót của mảnh ghép bị gạn thấp hơn so với các mẫu vật được rửa và ly tâm. Có một số dữ liệu cho thấy rằng cuộn gạc sẽ loại bỏ nước, dầu và chất gây ô nhiễm, với tỷ lệ cao của hàm lượng tế bào gốc trung mô có nguồn gốc từ mỡ. Tuy nhiên, kỹ thuật này khá tốn thời gian và công sức.Ly tâm là yếu tố chính của kỹ thuật Cole-man tiêu chuẩn.
Các cài đặt được sử dụng là những cài đặt được mô tả bởi Coleman, theo đó mỡ hút ra được quay ở tốc độ 1200 g (3000 vòng / phút) trong 3 phút, tiếp theo là loại bỏ lớp nước bên dưới và loại bỏ lớp dầu trên cùng bằng cách bọc Telfa. Lớp mỡ ở giữa sau đó được cấy ghép. Tài liệu gần đây đã chứng minh tỷ lệ khả năng sống của mảnh ghép sau khi ly tâm thấp hơn so với rửa.Việc rửa mỡ hút ra đã được chứng minh là bảo tồn được cả một số lượng lớn tế bào gốc trung mô và một số lượng lớn tế bào mỡ.
Cleveland và cộng sự, trong đánh giá cập nhật của họ về tài liệu, đã xác định một số bài báo bổ sung dường như hỗ trợ thêm cho tính bền vững của việc rửa như một kỹ thuật xử lý. Một số công nghệ có sẵn trên thị trường sử dụng các kỹ thuật rửa cùng với lọc (như hệ thống Puregraft và Revolve) cũng có vẻ hứa hẹn cho quá trình xử lý mỡ rút ra hiệu quả.Goisis và cộng sự. (2016 imcas) gần đây đã mô tả một phương pháp rửa kèm theo lọc, có ưu điểm là một hệ thống hoàn toàn khép kín. Việc thu hoạch, xử lý và tiêm chất béo được thực hiện bên trong hệ thống, do đó tránh tiếp xúc với không khí. Việc loại bỏ các thành phần không thể sống được, gây viêm nhiễm và các thành phần độc hại có được bằng 2–4 lần rửa. Tính toàn vẹn và khả năng tồn tại của các tế bào mỡ và sự bảo tồn nồng độ cao nhất của tế bào gốc mỡ được đảm bảo bởi hệ thống rửa [1–14].
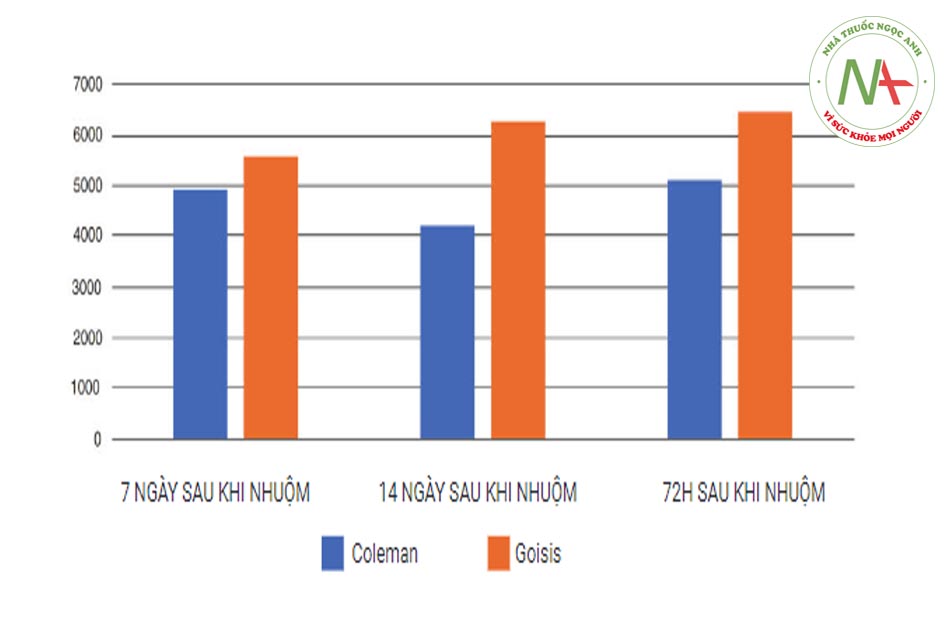
Dữ liệu thử ng-hiệm chứng minh khả năng bảo quản tế bào gốc mỡ (ASC) cao hơn của hệ thống Micro-fat Goisis so với quy trình Coleman được báo cáo trong Bảng 4.1.Phương pháp này có hiệu quả cao về mặt tiết kiệm thời gian, vì nó giảm thời gian của quy trình hoàn chỉnh xuống còn 15 phút từ khi thu hoạch đến khi tiêm. Về mặt hiệu quả và giảm chi phí, thủ thuật có thể được thực hiện bởi một bác sĩ phẫu thuật, trong một phòng mổ nhỏ hoặc cơ sở phẫu thuật y tế. Cuối cùng, sự mất chất béo trong quá trình chuẩn bị là rất thấp về tỷ lệ phần trăm (15%). Đặc biệt, việc thu hoạch 24 cc chất béo là đủ để thu được 20 cc chất béo đã qua xử lý (Hình 4.10, 4.11, 4.12, 4.13, 4.14, 4.15, 4.16, 4.17, 4.18, và 4,19)
Tham khảo thêm
1. Boschert MT, Beckert BW, Puckett CL, Concannon MJ. Analysis of lipocyte viability af-ter liposuction. Plast Reconstr Surg. 2002;109: 761–5.
2. Peer LA. Cell survival theory versus replacement theory. Plast Reconstr Surg (1946). 1955;16:161–8.
3. Eto H, Kato H, Suga H, Aoi N, Doi K, Kuno S, Yoshi- mura K. The fate of adipocytes after nonvascularized fat grafting: evidence of e arly death and replacement of adi- pocytes. Plast Reconstr Surg. 2012;129:1081–92.
4. Zuk PA, Zhu M, Ashjian P, et al. Human adipose tis- sue is a source of multipotent stem cells. Mol Biol Cell. 2002;13:4279–95.
5. Kølle SF, Fischer-Nielsen A, Mathiasen AB, et al. Enrichment of autologous fat grafts with ex-vivo expanded adipose tissue- derived stem cells for graft survival: a randomised placebo controlled trial. Lancet. 2013;382:1113–20.
6. Zhu M, Cohen SR, Hicok KC, Shanahan RK, Strem BM, Yu JC, Arm DM, Fraser JK.
xem thêm: Thu hoạch chất béo trong cơ thể là gì? Cách thức ra sao?
