Bệnh da liễu
Thu hoạch chất béo trong cơ thể là gì? Cách thức ra sao?
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Nhà thuốc Ngọc Anh – Chương 2:Thu hoạch mỡ
Tác giả: Dr. Andrea Sbarbati, Giamaica Conti, Sara Izzo và Giovanni Francesco Nicoletti
Nguồn sách: Sách: Quy trình PRP và Tiêm cấy mỡ nâng cao -Tác giả: Dr: Mario Goisis
Lời giới thiệu
Quy trình ghép chất béo có thể được chia thành ba giai đoạn riêng biệt: thu hoạch chất béo, xử lý chất béo và tiêm chất béo vào vị trí nhận [1]. Khi nói về thu hoạch chất béo, chúng ta đề cập đến quy trình phẫu thuật cho phép chúng ta lấy mô mỡ thông qua việc sử dụng các ống hút hoặc hiếm khi thông qua phẫu thuật cắt bỏ mỡ. Các kỹ thuật xử lý bao gồm ly tâm, lọc, Rolling Telfa và làm sạch chất béo để loại bỏ chất gây mê, dầu, máu và các thành phần khác trong mô mỡ được thu hoạch. Kỹ thuật tiêm khác nhau nhiều, tùy thuộc vào việc lựa chọn ống tiêm và cannula hoặc kim tiêm khác nhau để tiêm chất béo vào vùng nhận. Trong mỗi giai đoạn ghép mỡ, có nhiều biến thể về kỹ thuật và nhiều cuộc thảo luận ủng hộ cái này hơn là cái khác. Bắt buộc phải xây dựng một quy trình tối ưu từ đầu đến cuối.
Sự ảnh hưởng kích thước của các hạt mỡ
Các hạt mỡ có thể được định nghĩa là những hạt cầu nguyên vẹn của tế bào mỡ, liên kết với nhau bằng mô trung mô. Cần lưu ý rằng cấu trúc của từng hạt mỡ không xuất hiện tự nhiên trong mô bản địa mà được tạo ra, đúng hơn là trong quá trình thu hoạch. Phẫu thuật cắt bỏ mô mỡ bằng phẫu thuật En bloc tạo ra các hạt mỡ lớn nhất.
Trong trường hợp hút mỡ bằng cannula, phạm vi của các hạt mỡ liên quan trực tiếp đến đường kính của cannula và kích thước của các cổng trên cannula, với kích thước lớn hơn sẽ phân tách các hạt lớn hơn. Lý thuyết cho rằng kích thước của các hạt mỡ có thể có ảnh hưởng trực tiếp đến sự tồn tại của chất béo được mô tả trong nhiều nghiên cứu khoa học.
Năm 1893, tại Đức, Gustav Neuber đã mô tả sự chuyển đổi của các mẫu bệnh phẩm lipoma từ cẳng tay để lấp đầy những khiếm khuyết trên khuôn mặt do bệnh lao gây ra. Anh ta bóc tách những mảnh mỡ thừa từ bụng thành “cỡ hạt đậu hoặc quả hạnh nhân.” Những mảnh vỡ này được báo cáo là còn sống sót [2]. Năm 1937, Gurney đã xem xét các ca cấy ghép mỡ trung bình là 1,7 mm3 trong thời gian 12 tháng và báo cáo rằng “các mảnh ghép mỡ có thể tồn tại trong ít nhất 1 năm” [3]. Vào giữa những năm 1950, Peer, trên tạp chí Phẫu thuật Tạo hình và Tái tạo đã báo cáo rằng “mô ghép chất béo có kích thước quả óc chó” dường như đã mất 45% thể tích ban đầu sau 1 năm, có thể do chấn thương trong quá trình ghép, cắt tỉa, hoặc thiếu nguồn cung cấp máu [4].
Hút mỡ hiện đại bằng ống thông được Fischer mô tả và Fischer mô tả lần đầu tiên ở Ý vào năm 1974: kỹ thuật này đã mở rộng thành công của kỹ thuật ghép mỡ một cách đáng kể [5, 6]. Kato và cộng sự. gần đây đã công bố một nghiên cứu tiên phong, nhấn mạnh tầm quan trọng của kích thước các hạt chất béo trong việc ghép. Các tác giả đã chứng minh rằng trong một hạt mỡ, các tế bào mỡ sống sót được đặt gần phần bên ngoài của tiểu thùy chất béo hơn. Dựa trên các phát hiện mô học, các hạt chất béo có thể được chia thành ba phần khác nhau:
• Phần sống sót: lớp gần nhất với bề mặt của tiểu thùy. Trong phần này, tất cả các tế bào mỡ đều tồn tại.
• Phần tái sinh: lớp giữa, nơi tế bào mỡ chết đi nhưng được thay thế bằng tế bào gốc tăng sinh.
• Phần hoại tử: nhân trung tâm của hạt mỡ, có biểu hiện hoại tử, nang dầu, xơ hóa.Giới hạn của các vùng sống sót và tái sinh xảy ra bình thường ở 100–300 μm và 600–1200 μm từ bề mặt, tương ứng (Hình 2.1).
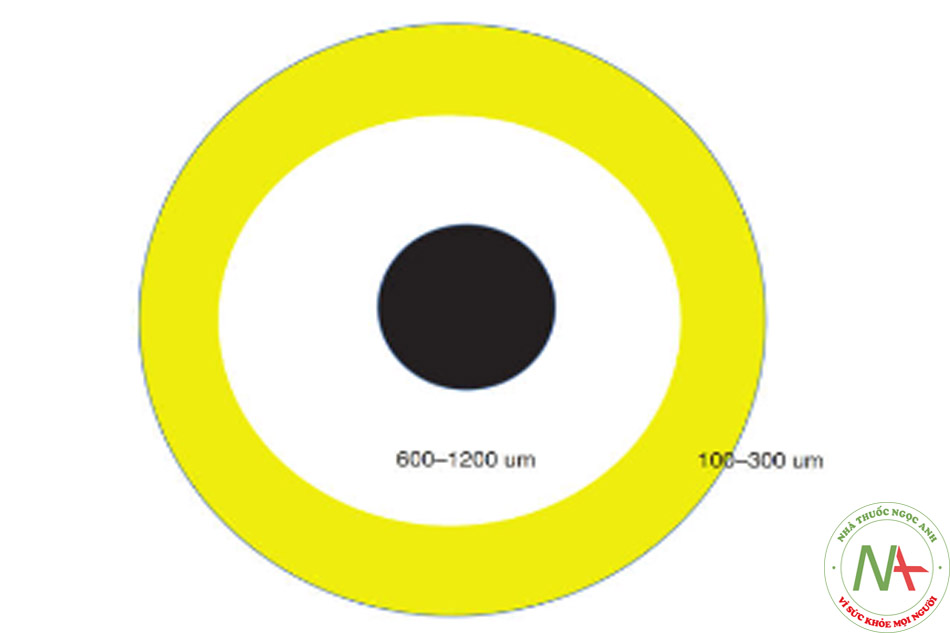
Trước khi phục hồi nguồn cung cấp máu, các phần tử chất béo chủ yếu tồn tại nhờ sự khuếch tán của các chất dinh dưỡng. Khi đường kính của các tiểu thùy ở vị trí trở nên lớn hơn, lý tưởng nhất là vùng hoại tử trung tâm sẽ mở rộng theo giới hạn của sự khuếch tán (Hình 2.2). Do đó, người ta có thể phỏng đoán rằng kích thước của các hạt chất béo có thể ảnh hưởng đến lượng mỡ ghép sống sót cuối cùng [7].
Trước khi phục hồi nguồn cung cấp máu, các phần tử chất béo chủ yếu tồn tại nhờ sự khuếch tán của các chất dinh dưỡng. Khi đường kính của các tiểu thùy ở vị trí trở nên lớn hơn, lý tưởng nhất là vùng hoại tử trung tâm sẽ mở rộng theo giới hạn của sự khuếch tán (Hình 2.2). Do đó, người ta có thể phỏng đoán rằng kích thước của các hạt chất béo có thể ảnh hưởng đến lượng mỡ ghép sống sót cuối cùng [7].
Đường kính cannula và kích thước lỗ của cannula và ảnh hưởng của chúng lên sự tồn tại của mỡ và tế bào gốc
Shiffman và Mirrafati đã so sánh các cannula có đường kính từ 2,5 đến 3,7 mm, để xác định xem chúng có ảnh hưởng đến khả năng tồn tại của tế bào không. Họ không quan sát thấy bất kỳ khác biệt đáng kể nào -[8]. Khi so sánh một cannula 2 mm với một cannula có đường kính 4 mm, Leong và cộng sự đánh giá trạng thái của chất béo được thu hoạch. Nghiên cứu không khẳng định sự khác biệt đáng kể trong chuyển hóa [9]. Theo định nghĩa của Klein, một ống cannula nhỏ có đường kính trong từ 2,0 mm trở xuống.
Trivisonno và cộng sự. đã nghiên cứu liệu kích thước nhỏ của một cannula nhỏ có thể làm giảm việc thu thập chất béo có tổ chức tốt, chủ yếu bao gồm các tế bào mỡ trưởng thành và cải thiện việc thu hoạch nhiều lớp mô mỡ bề ngoài hơn, có liên quan đến tỷ lệ ADSC cao hơn. Họ kết hợp (1) một cannula có đầu tròn có chiều dài 170 mm, đường kính 3 mm và một cổng hút hình elip duy nhất ở phía gần đầu xa của nó (đường kính cổng, 3 × 9 mm) và (2 ) một cannula đầu tròn có chiều dài 170 mm, đường kính 2 mm và 5 cổng tròn được bố trí theo hình xoắn ốc dọc theo các cạnh của trục xa (đường kính mỗi cổng, 1 mm).
Sử dụng cannula 3mm, họ đã phân lập được 1.4 × 105 tế bào/mL, một số lượng tương tự với mô tả của các tác giả khác [10]. Thu hoạch mỡ sử dụng cannula nhỏ liên quan đến số lượng nhiều hơn của tế bào chất và mạch máu, và đạt được tỉ lệ sống cao hơn. Vấn đề chính được báo cáo bởi Trivisonno và cộng sự có liên quan đến thời gian điều trị lâu hơn cần thiết cho việc điều trị bằng cách sử dụng cannula nhỏ so với thời gian cần thiết khi sử dụng cannula tiêu chuẩn. Trên thực tế, việc hút mỡ bằng cannula nhỏ mang lại thể tích mô hút nhỏ hơn với mỗi lần hút và do đó, tốn nhiều thời gian hơn (chậm hơn khoảng hai lần so với hút bằng tay bằng cannula lớn hơn) [11].
Alharbi và cộng sự. [12] đã so sánh việc thu hoạch chất béo bằng cannula Coleman (đường kính 3 mm, đầu tù một lỗ) và thu hoạch chất béo bằng cách sử dụng cannula có đầu tù 2 mm, nhiều lỗ. Họ đã sử dụng các cannula khác nhau trên các khu vực đối diện của cùng một bệnh nhân. Nghiên cứu đã xác định rằng nồng độ yếu tố tăng trưởng, sự di chuyển của tế bào từ các mảnh mô mỡ và tỷ lệ kết dính ASCs tăng lên khi sử dụng cannula nhỏ hơn.Các tác giả kết luận rằng những kết quả tốt hơn này là do kích thước nhỏ hơn và tỷ lệ bề mặt / thể tích khác nhau của các mảnh mô mỡ được thu hoạch bằng cannula nhỏ hơn.
Phát minh mới về cannula nhỏ
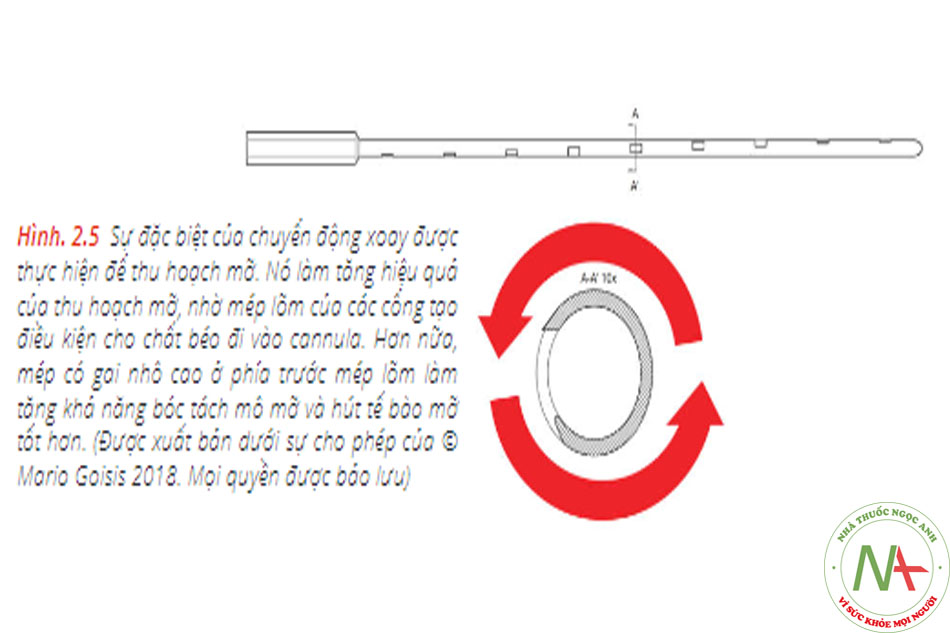
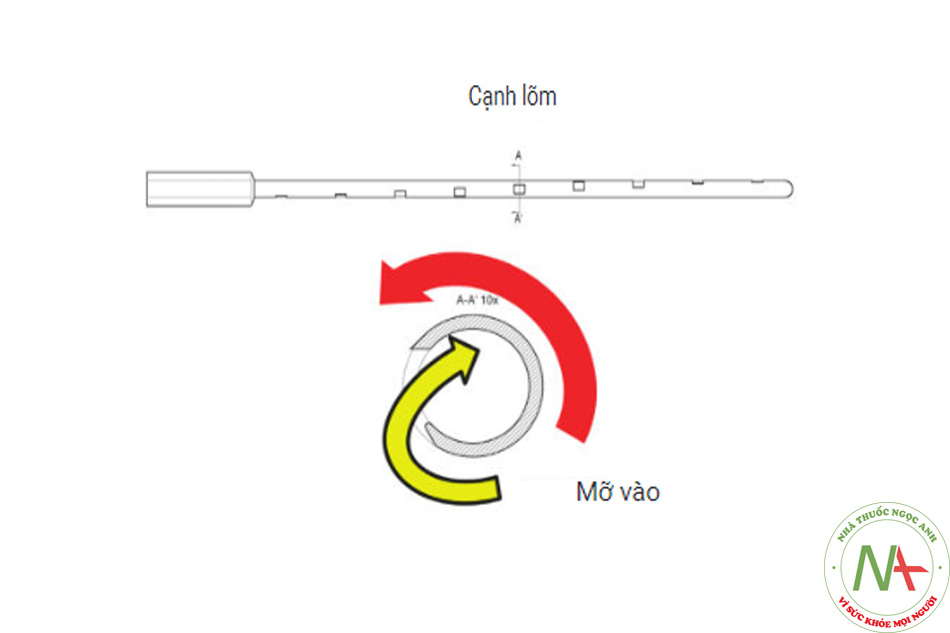
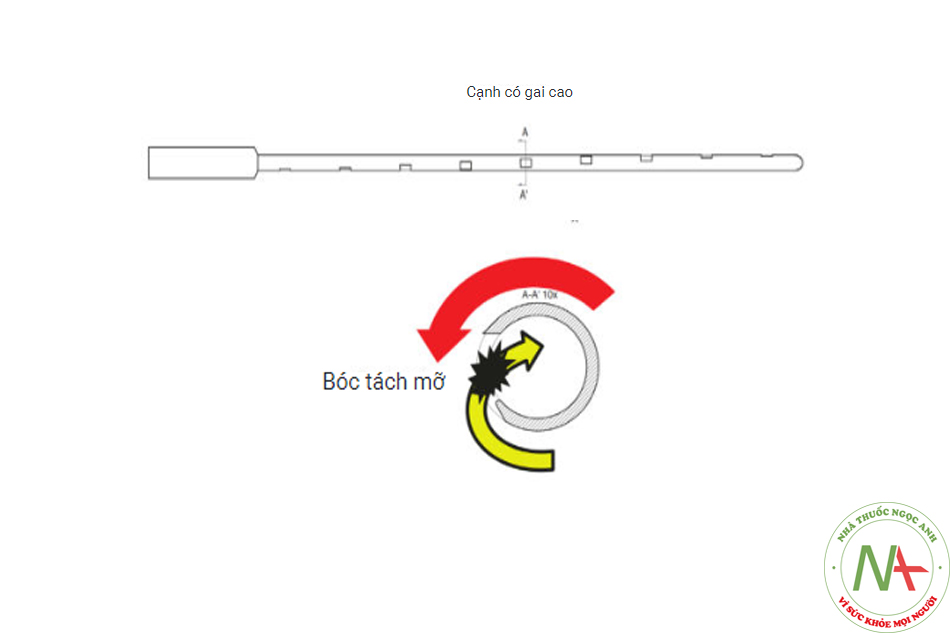
Goisis (Imcas 2015) đã mô tả một cannula nhỏ mới được cấp bằng sáng chế. Cannula này có đường kính nhỏ (2 mm) với một đầu tù và sáu cổng được đặt dọc theo các cạnh của trục (mỗi cổng có đường kính 1 mm). Các cổng này được sắp xếp theo hình xoắn ốc với góc độ thẳng hàng dọc theo trục của cannula (Hình 2.3 và 2.4). Các cổng có dạng hình chữ nhật, với một cạnh nhô lên được bố trí song song với trục của cannula và một cạnh lõm đặt trước cạnh nhô lên.
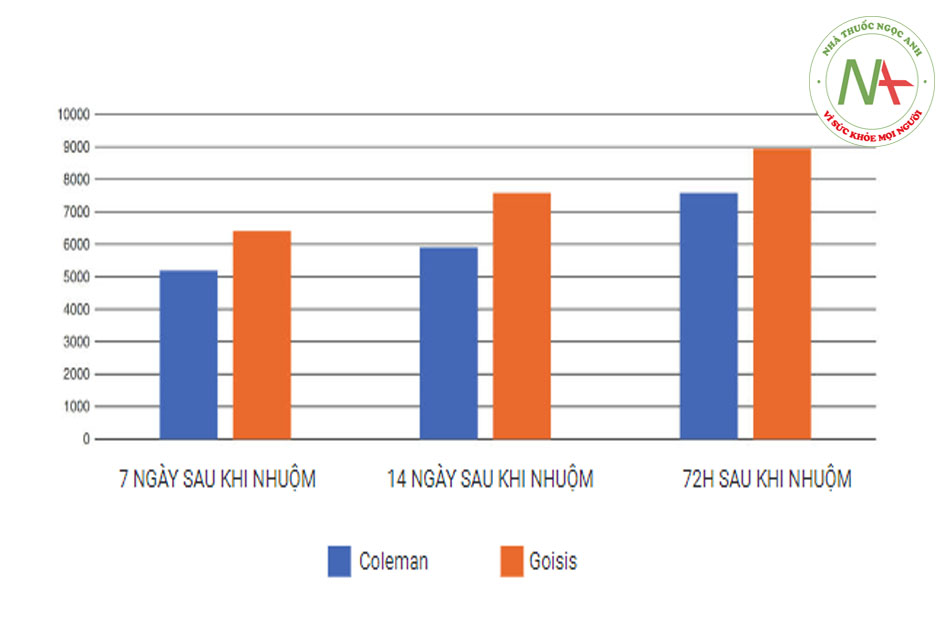
Ưu điểm chính của cannula được thiết kế theo cách này liên quan đến thời gian điều trị nhanh hơn so với các ống cannula nhỏ khác: việc hút mỡ được thực hiện bằng chuyển động quay (xem Hình 2.5, 2.6 và 2.7). Mép lõm thúc đẩy sự xâm nhập của chất béo vào lỗ. Gờ nhô lên tạo điều kiện thuận lợi cho việc bóc tách các hạt chất béo. Bằng cách này, hình dạng của nhiều cổng tạo ra một khối lượng lớn mô hút với mỗi hành trình xoay. Do đó, việc sử dụng cannula Goisis hiệu quả hơn nhiều lần so với cannula Coleman (nhanh hơn khoảng gấp đôi so với cannula 3 mm Coleman).
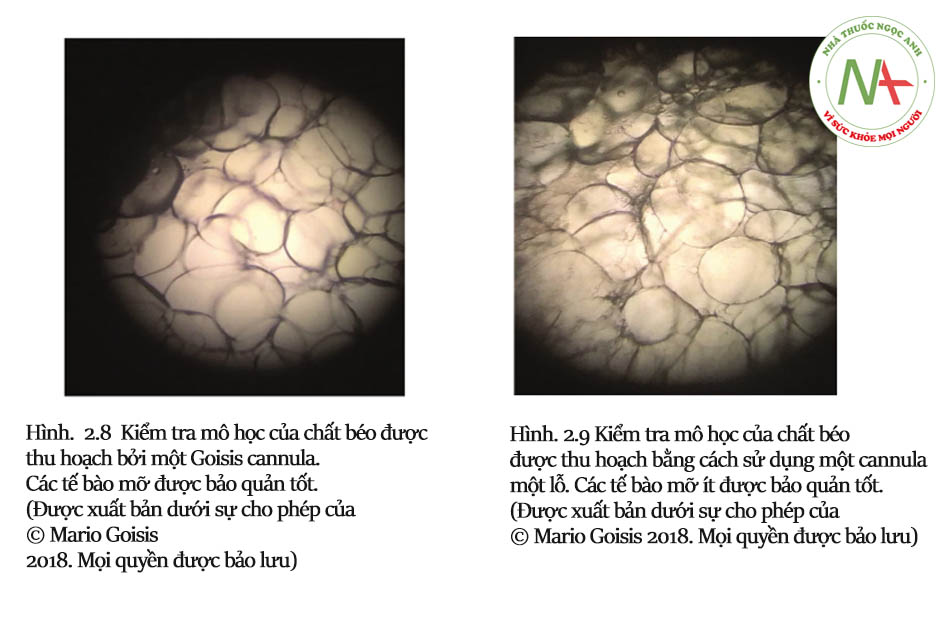
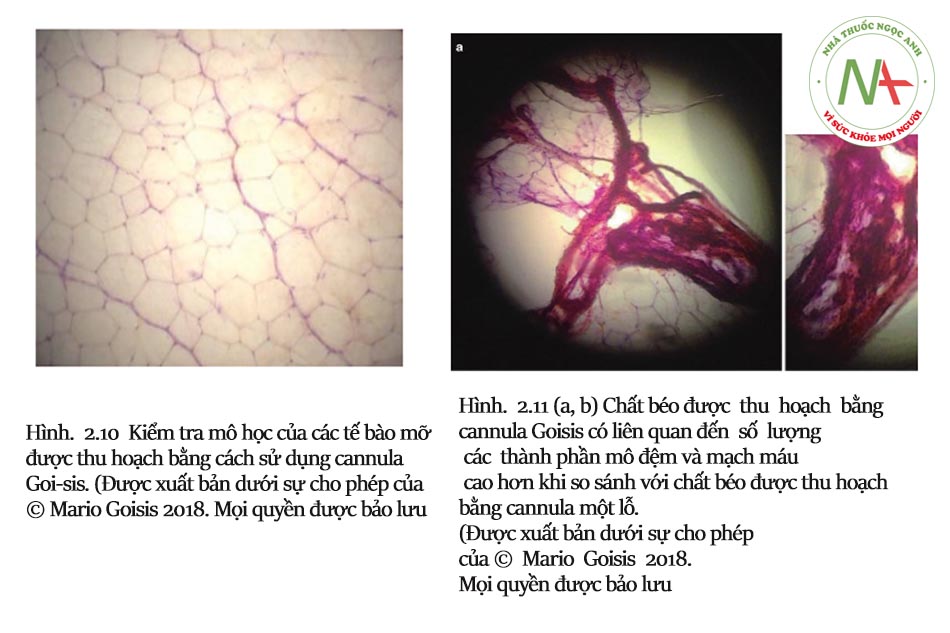
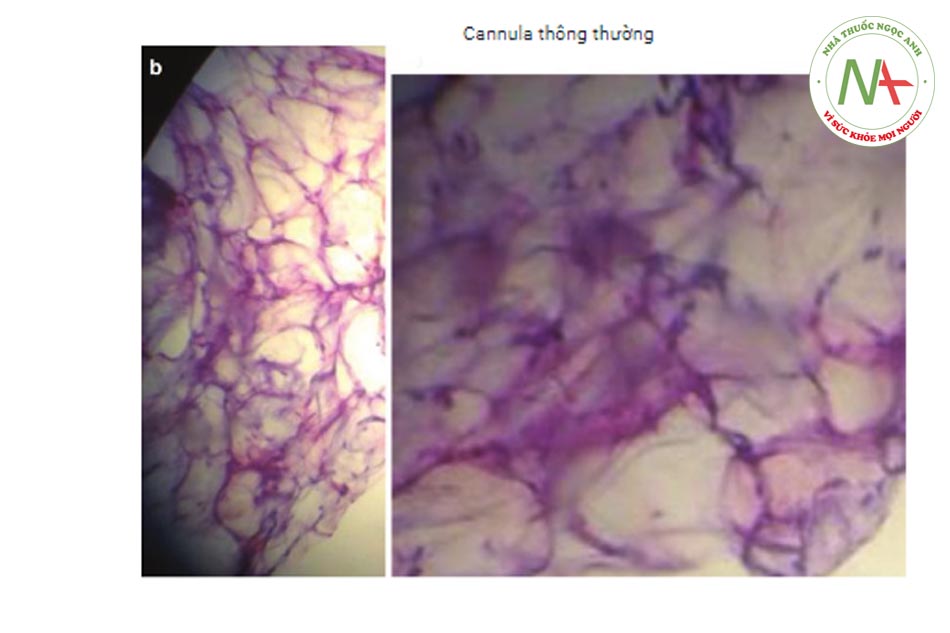
Tác dụng của áp lực âm lên sự tồn tại của mỡ và tế bào gốc
Shiffman và Mirrafati đã so sánh áp suất hút để xác định ảnh hưởng của chúng đối với sự tồn tại của tế bào. Kết quả đáng kể là tổn thương tế bào lớn hơn tương ứng với áp suất hút vượt quá 700 mmHg [8].
Trong nghiên cứu của Cheriyan và cộng sự, khả năng tồn tại của mỡ cao hơn 47% sau khi hút ở áp suất thấp (-250 mmHg) so với khi hút ở áp suất âm cao (-760 mmHg). Ngoài ra, thời gian sống sót của tế bào ở 7 ngày cao hơn đáng kể khi hút áp suất thấp [13]. Nhận định này đã được khẳng định bởi Nguyen và cộng sự. người đã chứng minh rằng chỉ 10% tế bào sống sót sau khi hút mỡ ở 760 mmHg [14].
Quy trình PRP và tiêm cấy mỡ Nâng Caoe-bacsy.com132.5 Tác dụng của áp lực âm lên sự tồn tại của mỡ và tế bào gốcShiffman và Mirrafati đã so sánh áp suất hút để xác định ảnh hưởng của chúng đối với sự tồn tại của tế bào. Kết quả đáng kể là tổn thương tế bào lớn hơn tương ứng với áp suất hút vượt quá 700 mmHg [8].Trong nghiên cứu của Cheriyan và cộng sự, khả năng tồn tại của mỡ cao hơn 47% sau khi hút ở áp suất thấp (-250 mmHg) so với khi hút ở áp suất âm cao (-760 mmHg). Ngoài ra, thời gian sống sót của tế bào ở 7 ngày cao hơn đáng kể khi hút áp suất thấp [13]. Nhận định này đã được khẳng định bởi Nguyen và cộng sự. người đã chứng minh rằng chỉ 10% tế bào sống sót sau khi hút mỡ ở 760 mmHg [14].Mojallal và cộng sự. đã đánh giá tác động của áp lực lên việc thu hoạch tế bào phần mạch máu đệm (SVF). Năm kỹ thuật thu hoạch khác nhau đã được thử nghiệm: bơm hút ở −350, bơm hút ở −700 mmHg, và hút mỡ trợ lực ở −350 và −700 mmHg. Thu hoạch tế bào với áp suất −350 mmHg, có hỗ trợ hoặc không, lớn hơn mức nhận được ở −700 mmHg. Kết luận là -700 mmHg làm giảm số lượng tế bào SVF được thu hoạch [15].
Tham khảo thêm
1. Gause T, Kling R, Sivak W, Marra K, Rubin J, Kokai L. Particle size in fat graft reten-tion: a review on the impact of harvesting tech-niques in surgical lipofilling outcomes. Adipocyte. 2014;3(4):273–9.
2. Neuber G. Fettransplantation. Chir Kongr Verhandl Dsch Gesellch Chir. 1893;22:66.
3. Gurney CE. Experimental study of the behavior of free fat trans- plants. Surgery. 1937;3:679–92.
4. Peer A. The neglected free fat graft. Plast Reconstr Surg. 1956;18:233–50.
5. Fournier P. Liposculpture: the syringe technique. Paris: Arnette Blackwell; 1991. p. 265–6
6. Illouz YG. The fat cell “graft”: a new technique to fill depressions. Plast Reconstr Surg. 1986;78:122–3.
7. Kato H, Mineda K, Eto H, Doi K, Kuno S, Kinoshita K, Kanayama K, Yoshimura K. Degeneration, regeneration, and cicatrization after fat grafting: dynamic total tissue remodeling during the first 3 months. Plast Reconstr Surg. 2014;133:303e–13e.
8. Shiffman MA, Mirrafati S. Fat transfer techniques: the effect of harvest and transfer methods on adipocyte viability and review of the literature. Dermatol Surg. 2001;27:819–26.
9. Leong DT, Hutmacher DW, Chew FT, Lim T-C. Viability and adip- ogenic potential of human adipose tissue processed cell population obtained from pump-assisted and syringe-assist-ed liposuction. J Dermatol Sci. 2005;37:169–76.
10. Harris LJ, Zhang P, Abdollahi H, et al. Availability of adipose- derived stem cells in patients undergoing vascular surgical proce- du-res. J Surg Res. 2010;163:e105–12.
11. Farr ST, Trivisonno A. Differential fat harvesting. Plast Aesthet Res. 2014;1:103–7.
12. Alharbi Z, Opländer C, Almakadi S. Conventional vs. micro-fat harvesting: how fat harvesting technique affects tissue-engineering approaches using adipose tissue-derived stem/stromal cells. J Plast Reconstr Aesthet Surg. 2013;66:1271–8.
13. Cheriyan T, Kao HK, Qiao X, Guo L. Plast Reconstr Surg. 2014;133(6):1365–8.
14. Nguyen P, Desouches C, Gay A, Hautier A, MagalonG. Development of micro-injection as an innovative autologous fat graft technique: the use of adipose tissue as dermal filler. J Plast Reconstr Aesthet Surg. 2012;65:1692–9.
15. Mojallal A, Auxenfans C, Lequeux C, Braye F, Damour
16. Influence of negative pressure when harvesting adipose tissue on cell yield of the stromal-vascular fraction. Biomed Mater Eng. 2008;18(4-5):193–7.
