COVID-19
Ảnh hưởng của thời gian và hiệu giá trong liệu pháp huyết tương hồi phục cho COVID-19
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Nhà thuốc Ngọc Anh – Để tải bài viết Ảnh hưởng của thời gian và hiệu giá trong liệu pháp huyết tương hồi phục cho COVID-19 file PDF xin vui lòng click vào link ở đây.
Tác giả: Paola de Candia, Francesco Prattichizzo, Silvia Garavelli, Rosalba La Grotta, Annunziata De Rosa, Agostina Pontarelli, Roberto Parrella, Antonio Ceriello, and Giuseppe Matarese
Biên dịch: Thạc sĩ, Bác sĩ. Đào Thị Mỹ Vân
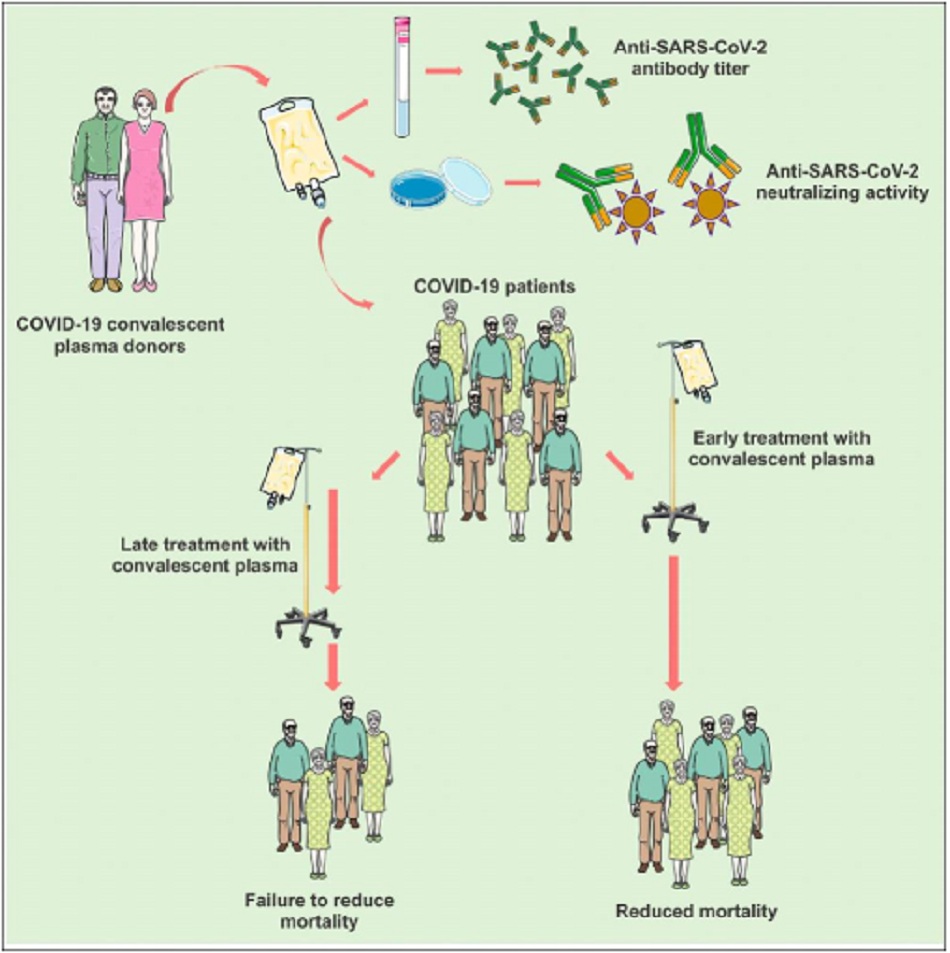
Điểm nổi bật: Lợi ích của huyết tương hồi phục (HTHP) đối với bệnh nhân COVID-19 vẫn còn đang tranh cãi. Chỉ khi được cung cấp ở giai đoạn đầu của bệnh, HTHP giảm tỷ lệ tử vong do COVID-19. Lợi ích HTHP trên tỷ lệ tử vong không tăng khi chọn các hiệu giá kháng thể cao. Điều trị sớm bằng HTHP có thể tối đa hóa lợi ích lâm sàng của nó
TÓM TẮT
Lợi ích lâm sàng của huyết tương hồi phục (HTHP) đối với bệnh nhân mắc bệnh do coronavirus (COVID-19) vẫn còn đang được tranh luận. Tổng quan hệ thống và phân tích tổng hợp này, chúng tôi chọn 10 thử nghiệm lâm sàng ngẫu nhiên (RCT) và 15 nghiên cứu không ngẫu nhiên (tổng số bệnh nhân = 22.591) điều trị HTHP và đánh giá hai bối cảnh khác nhau: (1) giai đoạn bệnh của người nhận huyết tương và (2) hiệu giá kháng thể huyết tương được hiến tặng, xem xét tỷ lệ tử vong do mọi nguyên nhân tại lần theo dõi gần nhất. Kết quả của chúng tôi cho thấy rằng, khi được cung cấp ở giai đoạn đầu của bệnh, HTHP làm giảm đáng kể tỷ lệ tử vong: tỷ lệ rủi ro (RR) 0,72 (0,68, 0,77), p <0,00001, trong khi được cung cấp trong tình trạng nghiêm trọng hoặc nguy kịch thì không (RR : 0,94 [0,86, 1,04], p = 0,22). Mặt khác, lợi ích về tỷ lệ tử vong không tăng khi sử dụng huyết tương có hiệu giá chống cơ thể cao so với huyết tương không được chọn lọc. Phân tích tổng hợp này có thể thúc đẩy việc sử dụng HTHP ở những bệnh nhân có COVID-19 giai đoạn đầu trong các RCT tiếp theo để tối đa hóa lợi ích của nó trong việc giảm tỷ lệ tử vong, đặc biệt là ở các nước ít giàu hơn.
GIỚI THIỆU
Bệnh Coronavirus (COVID) -19 đã ảnh hưởng đến hơn 180.000.000 đối tượng và gây ra gần 4.000.000 ca tử vong, tính đến ngày 1 tháng 7 năm 2021, theo Trung tâm Tài nguyên Coronavirus tại Đại học Johns Hopkins. Bệnh do SARS-CoV-2 gây ra, thường đi kèm với sự phát triển của các triệu chứng giống cúm nhẹ; tuy nhiên, một phần nhỏ bệnh nhân, thường là người cao tuổi và những người có bệnh đi kèm từ trước (như tiểu đường, béo phì và cao huyết áp), phát triển các biến chứng nguy hiểm đến tính mạng, chẳng hạn như viêm phổi nặng, bệnh mạch máu và suy đa cơ quan cuối cùng dẫn đến cái chết (Lu và cộng sự., 2020; Zhou và cộng sự, 2020a, 2020b; Zhu và cộng sự, 2020). Tiêm chủng được coi là chiến lược hiệu quả nhất để bảo vệ dân số ốm yếu nhưng cách tiếp cận dự phòng của nó không được sử dụng trong môi trường điều trị, nơi việc xác định hiệu quả các thuốc kháng vi-rút và các liệu pháp khác có thể hạn chế tác hại gây ra những biến chứng nguy kịch của COVID-19. (Davis và cộng sự, 2020). Trong trường hợp vi rút tạo ra phản ứng miễn dịch kèm theo việc sản xuất các kháng thể trung hòa, việc thu thập huyết tương từ người hiến tặng đang hồi phục và truyền thụ động cho một bệnh nhân khác (một phương pháp được biết đến từ đầu năm 1900) (Marson và cộng sự, 2020) đã được chứng minh là một và chiến lược điều trị khả thi để loại bỏ virus trong máu (Mair-Jenkins và cộng sự, 2015). Việc sử dụng huyết tương của bệnh nhân điều trị với COVID-19 thực sự đã được đề xuất ngay từ đầu như một phương pháp điều trị để ngăn chặn sự tiến triển của vi rút và thúc đẩy các kết quả thuận lợi (Chen và cộng sự, 2020) và được Cục Quản lý Thực phẩm và Dược phẩm (FDA) cho phép như một loại thuốc nghiên cứu để chống lại mầm bệnh mới (https://www.fda.gov/vaccines-blood- biologics/investigational-new- drug-ind-or-device-exemption-ide-process- cber/recommendations-investigational-covid-19- convalescent-plasma).
Tuy nhiên, các thử nghiệm lâm sàng ngẫu nhiên (RCT) và nghiên cứu thuần tập đã đưa ra các kết quả trái ngược nhau và ba phân tích tổng hợp đã tìm thấy lợi ích nhất quán (Klassen và cộng sự, 2020), một bằng chứng chất lượng thấp về giảm tỷ lệ tử vong (Sarkar và cộng sự, 2021), và không có lợi ích đáng kể nào đối với một loạt các kết quả có thể xảy ra (Chai và cộng sự, 2020), tương ứng. Một số lý do đã được đề xuất để giải thích sự khác biệt quan sát được về kết quả của bệnh nhân COVID-19 được điều trị bằng huyết tương phục hồi (HTHP). Đặc biệt, người ta đã đưa ra giả thuyết rằng thời gian từ khi nhập viện đến khi được điều trị HTHP (bệnh càng sớm càng tốt) và/ hoặc lựa chọn trước huyết tương có hiệu giá kháng thể cao (hoặc SARS-CoV-2 được thử nghiệm trong ống nghiệm) hoạt động trung lập hóa) có thể là yếu tố quyết định chính của hiệu quả HTHP (Joyner và cộng sự, 2021; Tobian and Shaz, 2020).
Vì không có phân tích tổng hợp nào trước đây kiểm tra trực tiếp giả thuyết này, chúng tôi ở đây đã tiến hành một đánh giá hệ thống dựa trên cơ sở thực tế và phân tích tổng hợp để kiểm tra tác động của HTHP ở bệnh nhân COVID-19 bằng cách xem xét hai tình huống khác nhau: (1) giai đoạn bệnh của người nhận huyết tương và (2) hiệu giá kháng thể huyết tương được hiến tặng; sau đó chúng tôi đã ngoại suy một kết quả, tức là tỷ lệ tử vong do mọi nguyên nhân trong thời gian theo dõi lâu nhất có thể.
KẾT QUẢ
Quy trình bao gồm được trình bày trong Hình S1. Sau khi xác định 753 bản ghi univocal, chúng tôi đã chọn 40 bản thảo thích hợp. Trong giai đoạn sàng lọc các bản thảo này, 15 bản bị loại trừ: ba nghiên cứu không báo cáo dữ liệu tử vong hoặc so sánh tỷ lệ tử vong với các cơ quan đăng ký quốc gia (Bradfute và cộng sự, 2020; Du- lipsingh và cộng sự, 2020; Perotti và cộng sự, 2020); trong hai nghiên cứu, chúng tôi không thể đánh giá tiêu chí bao gồm của chúng tôi (Anakli và cộng sự, 2021; Skrip và cộng sự, 2020); bảy bản không có nhóm so sánh (Dulipsingh và cộng sự, 2020; Gonza´ lez và cộng sự, 2020; Jaiswal và cộng sự, 2021; Madariaga và cộng sự, 2020; Olivares-Gazca và cộng sự, 2020; Tremblay và cộng sự, 2020; Valentini và cộng sự, 2020); và ba nghiên cứu sử dụng huyết tương không hồi phục từ những người hiến tặng chung (De- Simone và cộng sự, 2021; Faqihi và cộng sự, 2020; Kamran và cộng sự, 2021). Trong số 25 nghiên cứu được đưa vào phân tích tổng hợp định lượng, 10 nghiên cứu là RCT (Agarwal và cộng sự, 2020; AlQahtani và cộng sự, 2020; Avendano-Sola và cộng sự, 2020; Bal- cells và cộng sự, 2021; Gharbharan và cộng sự, 2020; Horby và cộng sự, 2021; Li và cộng sự, 2020a; Libster và cộng sự, 2021; Rasheed và cộng sự, 2020; Simonovich và cộng sự, 2020), trong khi 15 nghiên cứu khác là các nghiên cứu không ngẫu nhiên với các thiết kế khác nhau (Abolghasemi và cộng sự, 2020; Alsharidah và cộng sự, 2021; Altuntas và cộng sự, 2021; Budhiraja và cộng sự, 2021; Donato và cộng sự, 2021; Duan và cộng sự, 2020; Hegerova và cộng sự, 2020; Joyner và cộng sự, 2021; Liu và cộng sự, 2020; Omrani và cộng sự, 2021; Salazar và cộng sự, 2020a; Shenoy và cộng sự, 2021; Xia và cộng sự, 2020; Yoon và cộng sự, 2021; Zeng và cộng sự, 2020), chi tiết như Bảng S1.
Hai nghiên cứu không có nhóm đối chứng; Tuy nhiên, một người đã cung cấp dữ liệu tử vong tương đối dựa trên nhiều so sánh giữa bệnh nhân nhận huyết tương hiệu giá cao và thấp và giữa điều trị sớm (% 3 ngày kể từ ngày nhập viện) và điều trị muộn. (Joyner và cộng sự, 2021), hoặc so sánh tác dụng của điều trị huyết tương tức thời với điều trị huyết tương chỉ khi bệnh nhân xấu đi (điều trị trì hoãn) (Balcells và cộng sự, 2021), và do đó cả hai đều được bao gồm. Tương tự, Salazar và cộng sự cung cấp nhiều so sánh xem xét thời gian điều trị và hiệu giá huyết tương, tất cả đều được so sánh với nhóm đối chứng phù hợp mà không điều trị (Sal- azar và cộng sự, 2020a) và ba nghiên cứu khác chứa dữ liệu phân nhóm để so sánh điều trị sớm và muộn, dựa trên mức độ nghiêm trọng của những bệnh nhân tham gia (Alsharidah và cộng sự, 2021; Donato và cộng sự, 2021; Horby và cộng sự, 2021). Do đó, các chỉ tiêu lâm sàng tử vong thích hợp đã được trích xuất từ các nghiên cứu này theo các bối cảnh khác nhau. Tất cả các nghiên cứu khác không cung cấp dữ liệu từ các phân nhóm tương tự. Do đó, họ được phân loại là (1) điều trị muộn so với sớm; và (2) sử dụng huyết tương hiệu giá cao so với các nghiên cứu chỉ kiểm tra sự hiện diện/ không có kháng thể mà không cần xác định thêm đặc điểm. Để thực hiện phân loại đầu tiên, ưu tiên được dành cho mức độ nghiêm trọng của bệnh tật của dân số đăng ký. Nếu bệnh nhân không thở máy và không cần bổ sung oxy thì việc điều trị được coi là ‘‘sớm’’. Trong trường hợp đăng ký độc quyền đơn vị chăm sóc đặc biệt hoặc bệnh nhân thở máy, việc điều trị thay vào đó được coi là ”muộn”. Trong trường hợp dân số không đồng nhất, thông số phân biệt là thời gian điều trị, được đo bằng số ngày trung bình từ khi nhập viện đến khi điều trị. Với các chỉ định được cung cấp trong một nghiên cứu (Joyner và cộng sự, 2021), chúng tôi đã áp dụng tiêu chí <= 3 ngày để phân loại điều trị sớm. Kết quả là chúng tôi đã thu được 11 nghiên cứu sớm và 16 nghiên cứu muộn (Bảng S1). Chúng tôi không thể phân loại một nghiên cứu (Gharbharan và cộng sự, 2020), vì dân số đăng ký không đồng nhất và chúng tôi không tìm thấy ghi nhận rõ ràng nào từ lúc nhập viện đến thời gian điều trị. Đối với tình huống được chỉ định trước thứ hai, 12 nghiên cứu sử dụng huyết tương hiệu giá cao (không phụ thuộc vào việc huyết tương được kiểm tra trước hay sau khi sử dụng) mặc dù có ngưỡng giới hạn và phương pháp luận khác nhau, 6 nghiên cứu chỉ kiểm tra sự hiện diện/ không có kháng thể, và 4 nghiên cứu khác không kiểm tra (Bảng S1). Như trên, 2 nghiên cứu đã cung cấp các so sánh nội bộ xem xét hiệu giá huyết tương điều trị (Joyner và cộng sự, 2021; Salazar và cộng sự, 2020a); thay vào đó, chúng tôi quyết định không phân loại một nghiên cứu đa trung tâm (Budhiraja và cộng sự, 2021), vì nó chỉ sử dụng huyết tương dương tính hoặc huyết tương hiệu giá cao, tùy thuộc vào trung tâm cụ thể và do đó được coi là không đồng nhất. Việc đánh giá rủi ro sai lệch trong các nghiên cứu bao gồm được tóm tắt trong Bảng S2.
Nhìn chung, chúng tôi thu thập dữ liệu từ 22.591 bệnh nhân, với tỷ lệ nam giới là 63,8% (thông tin giới tính không được cung cấp trong một nghiên cứu (Hegerova và cộng sự, 2020)) và trung bình theo tuổi có trọng số (bằng giá trị trung bình gần đúng với giá trị trung bình trong các nghiên cứu mà chỉ thông số cũ được báo cáo) là 62,3 tuổi (trong ba nghiên cứu tuổi không được cung cấp như trung bình cho mỗi nhóm mà được chia thành các tầng khác nhau và không được đưa vào trong tính toán tuổi trung bình tổng thể) (Budhiraja và cộng sự, 2021; Joyner và cộng sự, 2021; Salazar và cộng sự, 2020a).
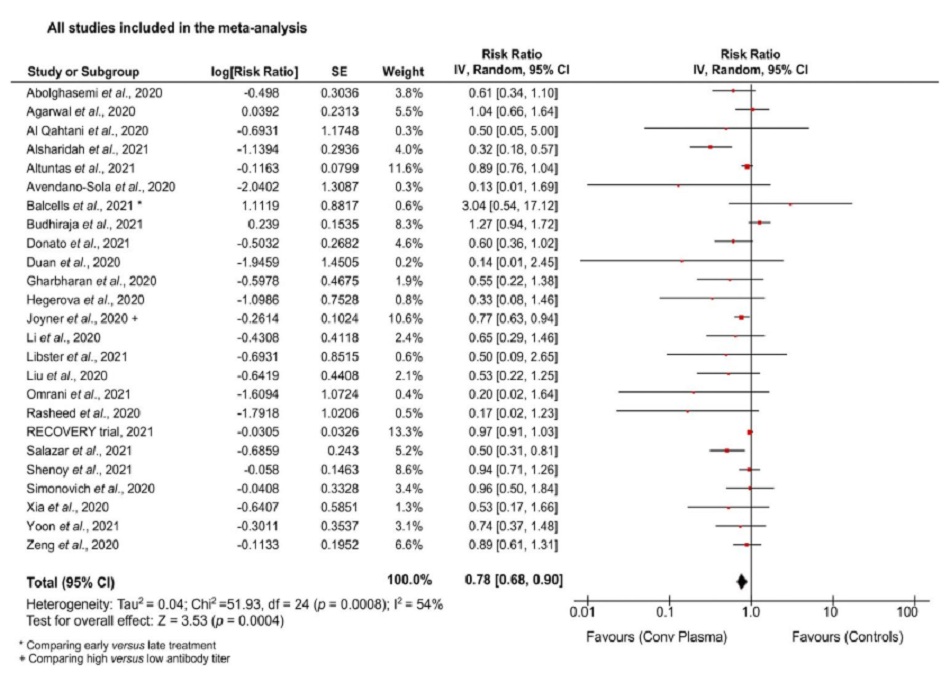
Khi tính đến tổng thể của các nghiên cứu, so với không điều trị, giả dược hoặc chăm sóc tiêu chuẩn, HTHP có thể làm giảm tỷ lệ tử vong theo tỷ lệ rủi ro (RR) là 0,78 (khoảng tin cậy [CI]: 0,68, 0,90, p cho tổng thể ảnh hưởng p = 0,0004) với sự không đồng nhất đáng kể giữa các nghiên cứu (I2 = 54%, p = 0,0008) (Hình 1). Một biểu đồ hình phễu với tất cả các nghiên cứu bao gồm được sử dụng để đánh giá rủi ro sai lệch về công bố (Hình S2); sau đó, một phân tích độ nhạy được thực hiện bằng cách loại trừ các nghiên cứu có thiết kế khác và những nghiên cứu nằm ngoài KTC 95% trong biểu đồ kênh cho thấy tác động ít rõ ràng hơn với dấu hiệu thống kê đường biên (RR: 0,94 [0,89, 1,00], p = 0,04; I2 = 26%, p = 0,13) (Hình S3). Khi chỉ xem xét RCTs (Agarwal và cộng sự, 2020; AlQahtani và cộng sự, 2020; Avendano-Sola và cộng sự, 2020; Balcells và cộng sự, 2021; Gharbharan và cộng sự, 2020; Horby và cộng sự, 2021; Li và cộng sự, 2020a; Libster và cộng sự, 2021; Rasheed và cộng sự, 2020; Simonovich và cộng sự, 2020), HTHP không cho thấy bất kỳ ảnh hưởng đáng kể nào đến tỷ lệ tử vong (RR: 0,96 [0,91, 1,03], p = 0,24; I2 = 13%, p = 0,32) (Hình S4A).
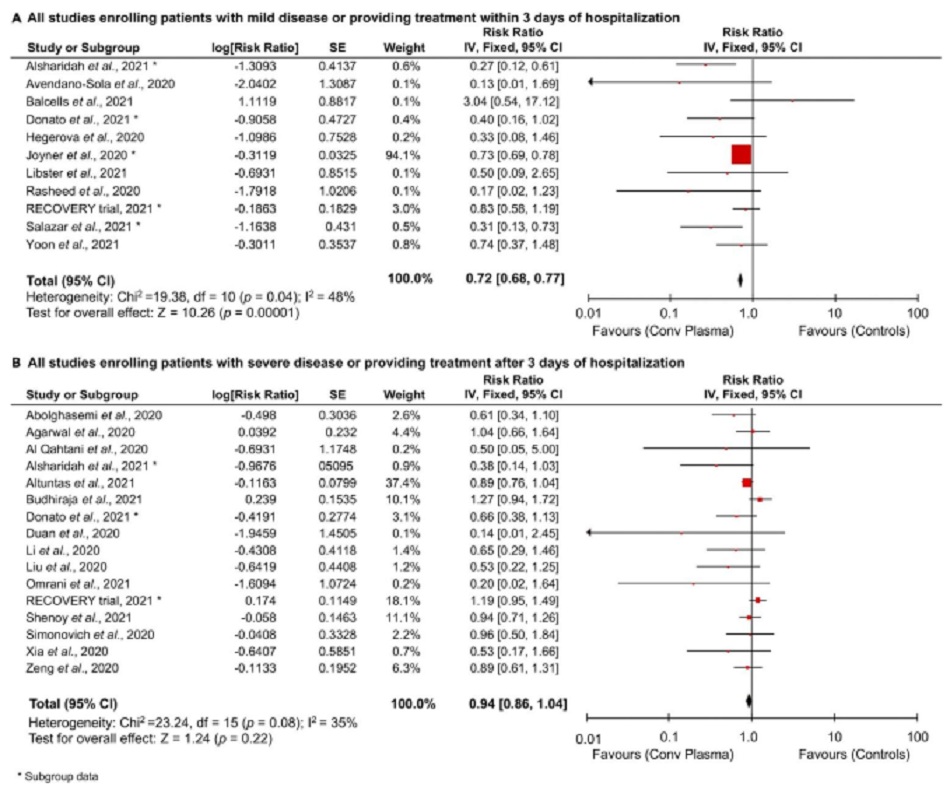
Mặt khác, khi được cung cấp ở giai đoạn đầu của bệnh hoặc trong vòng 3 ngày kể từ ngày nhập viện, HTHP có thể làm giảm đáng kể tỷ lệ tử vong (RR: 0,72 [0,68, 0,77], p <0,00001; I2 = 48%, p = 0,04) (Hình 2A), trong khi được cung cấp ở giai đoạn sau của bệnh (tình trạng nặng hoặc nguy kịch) hoặc sau 3 ngày nhập viện, không cho thấy bất kỳ hiệu quả nào trong việc giảm tỷ lệ tử vong (RR: 0,94 [0,86, 1,04], p = 0,22; I2 = 35%, p = 0,08) (Hình 2B). Kết quả tương tự cũng thu được khi RCTs được phân tầng dựa trên thời gian điều trị, với việc giảm tỷ lệ tử vong rời rạc, mặc dù không đáng kể đối với các nghiên cứu cung cấp điều trị sớm nhưng không muộn, các giai đoạn của bệnh. (RR: 0.79 [0.57, 1.11], p = 0.17; I2 = 42%, p = 0.14) so sánh với (RR: 1.07 [0.89, 1.29], p = 0.47; I2 = 0%, p = 0.43) (Hình S4B và S4C).
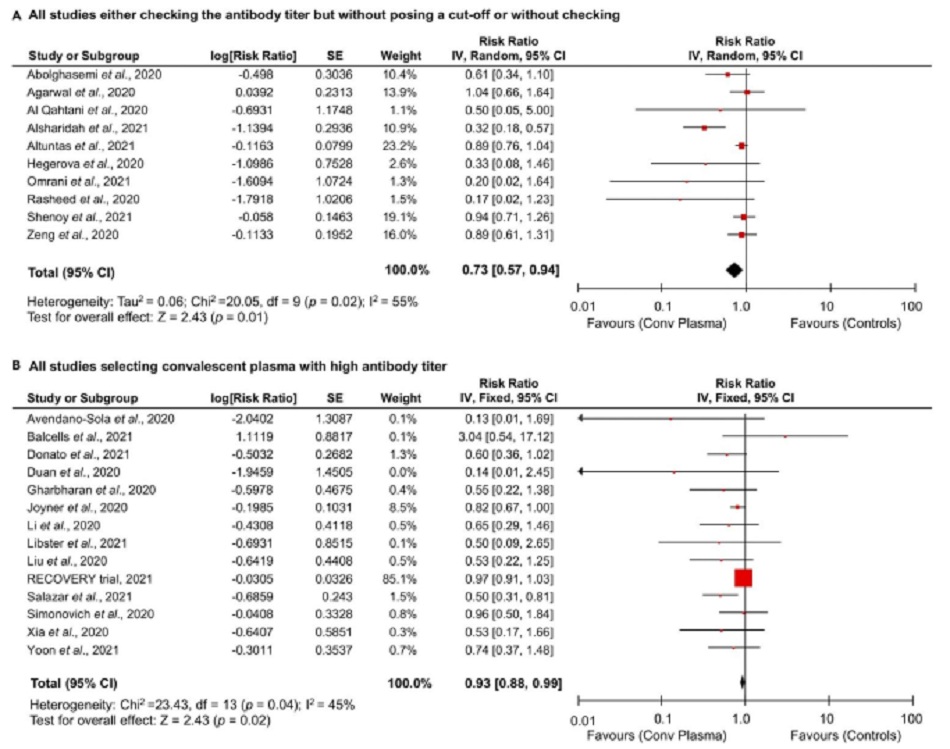
Để kiểm tra giả thuyết rằng việc sử dụng huyết tương hiệu giá cao có thể mang lại hiệu quả cao hơn so với huyết tương chỉ được sàng lọc sự hiện diện của kháng thể, chúng tôi đã phân tích riêng các nghiên cứu có đặc tính khác nhau này. Khi xem xét tất cả các nghiên cứu, lợi ích điều trị trên tỷ lệ tử vong không khác nhau đối với các nghiên cứu trong đó huyết tương chỉ được sàng lọc sự hiện diện của kháng thể (hoặc không được kiểm tra) so với các nghiên cứu trong đó lựa chọn huyết tương dựa trên ngưỡng giới hạn cao cụ thể (RR: 0.73 [0.57, 0.94], p = 0.01; I2 = 55%, p = 0.02) so với (RR: 0.93 [0.88, 0.99], p = 0.02; I2 = 45%, p = 0.04) (Hình 3A và 3B).
Các kết luận tương tự đã đạt được khi chúng tôi hạn chế cách tiếp cận với RCT và không nhận thấy sự khác biệt đáng kể (RR: 0.93 [0.60, 1.43], p = 0.74; I2 = 40%, p = 0.19 để RCT không đặt ra ngưỡng và RR: 0.80 [0.61, 1.04], p = 0.10; I2 = 0%, p = 0.45 cho các RCT khác) (Hình S4D và S4E)
THẢO LUẬN
Đại dịch SARS-CoV-2 đang diễn ra đang ảnh hưởng đến hàng triệu người trên toàn cầu và hệ thống y tế trên toàn thế giới đang phải vật lộn để tìm ra giải pháp liên quan đến việc kiềm chế sự lây lan của tác nhân truyền nhiễm mới này và nhanh chóng phát triển các chiến lược chăm sóc hiệu quả. Cho đến ngày nay, một số lựa chọn điều trị đã chứng minh được lợi ích hữu hình đối với các kết quả khó khăn (Nhóm hợp tác PHỤC HỒI và cộng sự, 2021). Trong khi liệu pháp HTHP đã được đề xuất ngay từ đầu như một công cụ tiềm năng để giảm thiểu hậu quả của COVID-19, các kết quả cuối cùng về hiệu quả của nó vẫn
chưa được cung cấp (Chai và cộng sự, 2020). Tình huống khẩn cấp đã thúc đẩy việc thiết kế nghiên cứu khẩn trương, với các kết quả chính đa dạng và không có sự giám sát kỹ lưỡng các quần thể đăng ký tham gia; do đó, các kết quả mâu thuẫn có thể được gán cho sự không đồng nhất rõ rệt của các thử nghiệm và báo cáo quan sát.
Trước hết, việc xác định thời điểm điều trị thích hợp nhất có thể chưa được xem xét đúng mức trong mọi trường hợp. Sự tiến triển của COVID-19 hiện được cho là đặc trưng bởi các giai đoạn khác nhau: giai đoạn đầu tiên được biểu thị bằng sự sao chép cấp tính của vi rút, sau đó, trong trường hợp thanh thải vi rút không hiệu quả, giai đoạn thứ hai có thể được đánh dấu bằng phản ứng miễn dịch không bình thường chuyển thành siêu phản ứng viêm hiện được cho là nguyên nhân chính dẫn đến kết quả tồi tệ nhất; sau đó, bệnh nhân có thể hồi phục hoặc bị rối loạn chức năng nội tạng và tử vong (Bonafe và cộng sự, 2020). Về mặt trực giác, phương pháp ức chế miễn dịch phù hợp với giai đoạn thứ hai của COVID-19, trong khi liệu pháp nhằm thúc đẩy quá trình thanh thải vi rút, chẳng hạn như với HTHP, nên được cung cấp càng sớm càng tốt trong suốt quá trình lây nhiễm. Tất cả những lý do nữa, vì sự sụt giảm liên tục tải lượng vi rút trong giai đoạn thứ hai của bệnh đã được báo cáo ở những bệnh nhân nặng với COVID-19 (Cevik và cộng sự, 2021) và có những phát hiện gây tranh cãi về sự hiện diện thực tế của SARS-CoV-2 RNA trong suy đa cơ quan mà thay vào đó có thể được gây ra bởi mức độ không ổn định của các chất trung gian gây viêm (cơn bão cytokine), rối loạn chức năng nội mô và bất thường đông máu. (Huang và cộng sự, 2020).
Mặt khác, một RCT, được công khai ngay sau ngày kết thúc phân tích tổng hợp của chúng tôi, cho thấy rằng HTHP có thể làm giảm đáng kể mức interleukin-6, yếu tố hoại tử khối u-a và interferon (IFN) -g, kêu gọi nhiều nghiên cứu hơn về tác dụng điều hòa miễn dịch của phương pháp điều trị này đối với cơn bão cytokine liên quan đến COVID- 19 (Pouladzadeh và cộng sự, 2021). Hơn nữa, một nghiên cứu hồi cứu rất gần đây cho thấy lợi ích sống sót khi sử dụng HTHP cũng cho bệnh nhân COVID-19 bị ung thư huyết học (Thompson và cộng sự, 2021).
Ở đây chúng tôi đã phân tích hai thông số liên quan đến điều trị HTHP: thời gian và sàng lọc kháng thể trước khi sử dụng lâm sàng. Thông qua kịch bản đầu tiên (tức là thời gian điều trị, hoặc bệnh nhân nhận huyết tương ở giai đoạn nào của bệnh), phân tích tổng hợp hiện tại chứng minh khuôn khổ lâm sàng của truyền huyết tương sớm cho bệnh nhân nhiễm SARS-CoV-2. Sự thiếu ý nghĩa quan sát được khi chỉ giới hạn phân tích này đối với RCTs có thể là do số lượng các sự kiện được báo cáo trong các thử nghiệm như vậy thấp. Tuy nhiên, quan sát rằng 4 trong số 5 RCT có xu hướng không có ý nghĩa đối với lợi ích cho HTHP chứng thực cho việc thiết kế các thử nghiệm tiếp theo để đánh giá giả thuyết này. Ngoài ra, kết quả này phù hợp với kinh nghiệm tích lũy được với cả nhiễm trùng SARS-CoV-1 và cúm nặng cho thấy bệnh nhân được truyền HTHP sớm sau khi bắt đầu có triệu chứng có kết quả tốt hơn như thế nào và cho thấy bằng chứng nhất quán về việc giảm tỷ lệ tử vong. (Cheng và cộng sự, 2005; Mair-Jenkins và cộng sự, 2015). Đáng lưu ý, hiện tại, việc thiết kế các thử nghiệm kiểm tra tác dụng của kháng thể đơn dòng ở bệnh nhân với COVID-19 đang tập trung hoàn toàn vào tác dụng của các liệu pháp này ở bệnh nhân giai đoạn đầu của bệnh. (Cohen, 2021).
Mặt khác, thông qua kịch bản được xem xét thứ hai, tức là hiệu giá kháng thể huyết tương được hiến tặng, nghiên cứu của chúng tôi không ủng hộ ý kiến rằng các mẫu huyết tương có hiệu giá kháng thể SARS-CoV-2 cao hơn có thể có hiệu quả rõ rệt hơn so với huyết tương không được sàng lọc. Tuy nhiên, điều quan trọng cần nhấn mạnh ở đây là 5 (Duan và cộng sự, 2020; Li và cộng sự, 2020b; Liu và cộng sự, 2020; Simonovich và cộng sự, 2020; Yoon và cộng sự, 2021) trong số 14 nghiên cứu (36%) được phân loại là sử dụng hiệu giá kháng thể cao trong Hình 3B, bắt đầu điều trị huyết tương ở giai đoạn muộn của bệnh, có thể làm nhiễu hiệu quả sạch của việc chọn lọc huyết tương. Hơn nữa, mặc dù hai nghiên cứu được đánh giá ở đây (một RCT (Simonovich và cộng sự, 2020) và một nghiên cứu thuần tập quan sát (Donato và cộng sự, 2021)) cho thấy mối tương quan đáng kể giữa hiệu giá tổng số và giá trị của kháng thể kháng SARS – CoV-2 trung hòa trong ống nghiệm, giả thuyết rằng huyết tương có chứa tổng lượng kháng thể hiệu giá cao hơn có thể hiệu quả hơn trong việc trung hòa nhiễm trùng vẫn chưa được kiểm tra đầy đủ, do đó sự liên quan về chức năng của những quan sát này vẫn còn nghi vấn. Trên thực tế, các kháng thể trung hòa virus và kháng protein chống tăng đột biến ở những người hiến tặng huyết tương gần đây được tìm thấy rất khác nhau và tương quan kém với nhau (Janaka và cộng sự, 2021). Khả năng bệnh nhân có các triệu chứng lâm sàng tồi tệ nhất, được báo cáo là tạo ra hiệu giá kháng thể cao hơn (Benner và cộng sự, 2020; Boonyaratanakornkit và cộng sự, 2021; Bosnjak và cộng sự, 2020; Dogan và cộng sự, 2021; Klein và cộng sự, 2020; Mehew và cộng sự, 2020; Salazar và cộng sự, 2020b; Terpos và cộng sự, 2020; Wardhani và cộng sự, 2021), có thể là người hiến huyết tương phù hợp hơn, cũng cần được đánh giá đầy đủ. Các tài liệu hiện có về các yếu tố tiên đoán lâm sàng của kháng thể trung hòa hiệu giá cao cho thấy rõ ràng rằng tuổi già, giới tính nam và nhập viện là những yếu tố chính để lựa chọn tuyển dụng người hiến huyết tương. (Focosi và Franchini, 2021; Gontu và cộng sự, 2021). Các giả thuyết bổ sung được đưa ra để tăng hiệu quả của huyết tương cũng dựa trên giả định rằng việc gộp huyết tương hoặc các chiến lược khác để tăng sự đa dạng của các kháng nguyên SARS-CoV-2 được nhắm mục tiêu bởi các kháng thể được truyền sẽ làm tăng hiệu quả của liệu pháp huyết tương (Focosi và cộng sự, 2020). Hơn nữa, vì các kháng thể trung hòa và đặc hiệu tăng đột biến cao hơn đáng kể sau khi tiêm vắc xin một lần sau khi nhiễm COVID-19, so với giá trị được thấy khi chỉ nhiễm COVID-19, những đối tượng được tiêm vắc xin COVID-19 đã hồi phục có thể là ứng cử viên lý tưởng để hiến tặng HTHP. (Vickers và cộng sự, 2021).
Trong số các nghiên cứu được đánh giá ở đây, chỉ có 3 bản thảo báo cáo việc sử dụng huyết tương được tổng hợp từ nhiều người hiến tặng (Agarwal và cộng sự, 2020; Simonovich và cộng sự, 2020; Yoon và cộng sự, 2021); do đó, cần có nhiều nghiên cứu hơn để xác định lợi thế tiềm năng của các phương pháp này và việc phát triển các xét nghiệm định lượng mạnh mẽ là cần thiết để đánh giá huyết tương phù hợp nhất để truyền điều trị ở bệnh nhân COVID-19.
Sau khi lựa chọn nghiên cứu, chúng tôi nhận ra rằng trong 4 bản thảo được chọn (Budhiraja và cộng sự, 2021; Horby và cộng sự, 2021; Joyner và cộng sự, 2021; Yoon và cộng sự, 2021), các tác giả đã thực hiện phân tầng dựa trên tuổi của người nhận huyết tương: 2 cho thấy hiệu quả chống tử vong của HTHP giảm khi tuổi của người nhận huyết tương ngày càng tăng (Joyner và cộng sự, 2021; Yoon và cộng sự, 2021) và một tác giả khác cho thấy lợi ích nhất quán nhất trong khoảng 60-74 tuổi (Budhiraja và cộng sự, 2021); bản thảo còn lại, tức là RCT duy nhất chứa so sánh như vậy, cho thấy xu hướng không có ý nghĩa đối với lợi ích có thể có ở bệnh nhân> 80 tuổi (Horby và cộng sự, 2021). Mặc dù tuổi tác có thể trở thành một thông số quan trọng khác (ngoài mức độ nghiêm trọng của bệnh) để lựa chọn những bệnh nhân thích hợp nhất cho phương pháp điều trị này, cần có thêm dữ liệu và nhiều nghiên cứu để đưa ra kết luận.
Một trở ngại khác trong quá trình phát triển liệu pháp này có thể làm giảm hoạt động của HTHP của người hiến tặng bị nhiễm một biến thể SARS-CoV-2 cụ thể chống lại các dòng virus đang lưu hành khác. Biến thể có tên 501Y.V1 (còn được gọi là B.1.1.7), phát sinh ở Anh vào cuối năm 2020 chứa 9 thay đổi axit amin trong mức tăng đột biến và cho thấy khả năng lây truyền gia tăng, đã không được quan sát để thoát khỏi các kháng thể được tạo ra bởi tự nhiên sự nhiễm trùng (Supasa và cộng sự, 2021; Wang và cộng sự, 2021b). Mặt khác, biến thể có tên 501Y.V2 (còn được gọi là B.1.351, được đặc trưng bởi sự thay thế trong hai thành phần miễn dịch chiếm ưu thế của protein đột biến) đã thống trị các nhiễm trùng của làn sóng thứ hai ở Nam Phi và nó đã được huyết tương vô hiệu hóa một cách hiệu quả từ những người đã bị nhiễm trong đợt thứ hai nhưng chỉ được trung hòa chéo bởi huyết tương từ những người bị nhiễm đợt thứ nhất (Cele và cộng sự, 2021; Wibmer và cộng sự, 2021). Thật vậy, HTHP từ những bệnh nhân bị nhiễm SARS-CoV-2 từ giai đoạn đầu của đại dịch cho thấy hiệu quả chống lại biến thể B.1.351 giảm đáng kể, đe dọa đến hiệu quả bảo vệ của các liệu pháp dựa trên HTHP (Wang và cộng sự, 2021b). Một biến thể mới nổi khác từ Brazil, P.1, trong đó sự thay đổi cấu trúc của một trong các miền liên kết thụ thể được biết là tạo điều kiện thuận lợi cho liên kết ACE2, cũng có khả năng chống lại sự trung hòa của HTHP cao hơn. (Wang và cộng sự, 2021a). Những trường hợp cần quan tâm này có thể cần thiết để lựa chọn huyết tương điều trị với các chức năng mong muốn cụ thể (Morgenlander et al., 2021).
Kết luận, phân tích tổng hợp này thúc đẩy một chuyển đổi mô hình trong việc thiết kế các RCT tiếp theo, cho thấy rằng việc sử dụng huyết tương hồi phục ở giai đoạn đầu của bệnh có thể rất quan trọng để tối đa hóa hiệu quả của liệu pháp này đối với tử vong do COVID-19 gây ra. Lưu ý, những cân nhắc này cũng có liên quan đến các liệu pháp sắp tới với các IgG được phân lập trong huyết tương kháng SARS-CoV-2 tổng hợp (Stasi và cộng sự, 2020), vì cơ sở hợp lý của việc sử dụng chúng về cơ bản là chồng chéo và có thể giúp thiết kế tốt hơn phương pháp này, điều quan trọng là có thể giá cả phải chăng cũng ở các nước đang phát triển.
HẠN CHẾ CỦA NGHIÊN CỨU
Các kết quả hiện tại nên được coi là khám phá, thay vì kết luận. Đặc biệt, thực tế là lợi ích về tỷ lệ tử vong của RCTs thu nhận bệnh nhân mắc bệnh nhẹ hoặc điều trị trong vòng 3 ngày kể từ ngày nhập viện không có ý nghĩa thống kê, có thể phụ thuộc vào số lượng nghiên cứu giảm và số lượng bệnh nhân được đánh giá tổng thể vẫn còn thấp. Ngoài ra, do tính chất khẩn cấp của đại dịch và nhu cầu về các liệu pháp cứu sống với lợi ích đã được chứng minh, chúng tôi đã chọn cách tiếp cận thực dụng, bằng cách chỉ trích xuất một kết quả và bằng cách phân loại các nghiên cứu theo dân số đăng ký và phương pháp luận được sử dụng để sàng lọc huyết tương mẫu. Phương pháp này bị ép buộc do thiếu dữ liệu phân nhóm từ các nghiên cứu đã thu thập, ngoại trừ 5 bản thảo (Alshar- idah và cộng sự, 2021; Donato và cộng sự, 2021; Horby và cộng sự, 2021; Joyner và cộng sự, 2021; Salazar và cộng sự, 2020a). Một hạn chế khác của nghiên cứu là, mặc dù ở mức độ định tính, có vẻ hợp lý khi đánh giá cao rằng liệu pháp huyết tương có thể hỗ trợ tốt hơn trong trường hợp các đối tượng có hệ thống miễn dịch kém hiệu quả hơn (lớn tuổi hơn so với những người trẻ bị nhiễm SARS-CoV-2 bệnh nhân), số lượng nghiên cứu giảm và sự phân tầng không đồng nhất (dựa trên các ngưỡng tuổi khác nhau) làm cho phân tích định lượng về tác động của tuổi không khả thi. Cuối cùng, các tiêu chí được sử dụng để phân loại bản thảo, mặc dù được chỉ định trước và định hướng theo tỷ lệ, đều mang tính kinh nghiệm. Do đó, chúng ta không thể suy ra chính xác thời điểm, giai đoạn bệnh hoặc hiệu giá kháng thể tạo ra HTHP một liệu pháp hiệu quả cũng như không thể khám phá xem việc đặt ra các tiêu chí khác nhau có mang lại kết quả khác nhau hay không.
PHƯƠNG PHÁP STAR
BẢNG NGUỒN LỰC CHÍNH
| THUỐC THỬ hay NGUỒN LỰC | NGUỒN | ĐỊNH DANH |
| Dữ liệu đã ký gửi | ||
| Giao thức xem xét có hệ thống | Tài liệu này | Prospero: CRD42021236146 |
| Phần mềm và Thuật toán | ||
| Đánh giá quản lý 5.4.1 | Cochrane Collaboration, London, UK | https://www.cochranelibr ary.com |
NGUỒN LỰC SẴN CÓ
Đầu mối liên hệ
Yêu cầu cung cấp thêm thông tin cần được hướng dẫn và sẽ được thực hiện bởi người liên hệ chính, Giáo sư Giuseppe Matarese (giuseppe.matarese@unina.it)
Vật liệu sẵn có
Nghiên cứu này không tạo ra thuốc thử duy nhất mới.
Tính khả dụng của dữ liệu và mã
- Quy trình đánh giá có hệ thống của chúng tôi đã được đăng ký tại Cơ quan Đăng ký Triển vọng Quốc tế về Đánh giá Hệ thống (Prospero). Tài liệu tham khảo nghiên cứu được liệt kê trong bảng nguồn lực chính.
- Giấy này không báo cáo mã gốc.
- Bất kỳ thông tin bổ sung nào cần thiết để phân tích lại dữ liệu được báo cáo trong bài báo này đều có sẵn từ đầu mối liên hệ theo yêu cầu.
CHI TIẾT VỀ PHƯƠNG PHÁP
Tìm kiếm nội dung và lựa chọn tài liệu
Chúng tôi đã tìm kiếm thông qua PubMed, Embase, Scopus và cơ sở dữ liệu Cochrane cho đến ngày 31 tháng 3 năm 2021, không giới hạn ngôn ngữ. Chúng tôi đã sử dụng các thuật ngữ ” COVID-19 ” {Điều khoản MeSH}, ” SARS-CoV-2 ” {Điều khoản MeSH}, ” huyết tương phục hồi ” {Tất cả các lĩnh vực}, ” liệu pháp huyết tương ” {Tất cả các lĩnh vực }, ” tỷ lệ tử vong ” {Tất cả các trường}, và ” chết ” {Tất cả các trường} dưới dạng từ khóa. Ví dụ về chiến lược tìm kiếm, các chuỗi được sử dụng trong PubMed cũng được đính kèm như thông tin bổ sung. Chúng tôi cũng đã xem xét kỹ lưỡng danh sách tham khảo của các phân tích tổng hợp trước đây và các nghiên cứu bao gồm (Chai và cộng sự, 2020; Klassen và cộng sự, 2020; Sarkar và cộng sự, 2021). Vì đại dịch COVID-19 là một tình huống phát triển nhanh chóng, chúng tôi cũng đã xem xét dữ liệu chưa được Ban Hội thẩm thông qua trong Clinicaltrial.gov và trong một kho lưu trữ in sẵn, cụ thể medRxiv.org. Nhìn chung, 753 bản tóm tắt đã được xem xét.
Hai nhà điều tra (F.P. và P.d.C.) đã xem xét độc lập các bản tóm tắt đã xác định để xác định tính đủ điều kiện của các nghiên cứu để đưa vào phân tích tổng hợp. Tiêu chí đủ điều kiện cho tất cả các nghiên cứu là: 1 – ghi danh bệnh nhân với COVID-19 đã được phòng thí nghiệm xác nhận; 2 – điều trị bệnh nhân bằng huyết tương thu được từ những bệnh nhân phục hồi từ COVID-19; 3 – báo cáo rõ ràng về số ngày từ khi bắt đầu có triệu chứng hoặc nhập viện đến khi điều trị và mô tả rõ ràng về mức độ nghiêm trọng của bệnh ở những bệnh nhân được điều trị; 4 – mô tả rõ ràng về phương pháp được sử dụng để kiểm tra, lựa chọn hoặc đặc trưng cho các mẫu huyết tương được truyền (trước hoặc sau quy trình); 5 – báo cáo dữ liệu về tỷ lệ tử vong ở bất kỳ thời gian theo dõi nào. Không có hạn chế nào được đặt ra đối với phương pháp điều trị so sánh cũng như thời gian theo dõi. Tiêu chí loại trừ là: 1 – báo cáo dữ liệu từ một số đối tượng gần nhau (tức là <10 bệnh nhân được ghi danh); 2 – thiếu dữ liệu tử vong; 3 – không đủ chi tiết về tiêu chí ghi danh, thời gian điều trị, hoạt động của huyết tương được truyền và mô tả về nhóm so sánh. Điểm cuối duy nhất được xem xét là tử vong do mọi nguyên nhân ở bất kỳ thời gian theo dõi nào. Trong trường hợp có nhiều thời điểm theo dõi, dữ liệu từ thời điểm gần nhất sẽ được trích xuất. Sự khác biệt liên quan đến việc đưa vào các bản thảo cụ thể đã được giải quyết bởi các tác giả cấp cao (A.C. và G.M.). Giao thức có sẵn trên Prospero (CRD42021236146) và được đăng ký trong osf.io (https://osf.io/kvqj3). Danh sách kiểm tra PRISMA được đính kèm trong thông tin bổ sung.
Khai thác dữ liệu và đánh giá chất lượng
Một biểu mẫu thu thập tiêu chuẩn, được chỉ định trước (trang tính Excel) được sử dụng để trích xuất dữ liệu ước tính chung và tóm tắt của các nghiên cứu được đưa vào. Thông tin thu thập được bao gồm loại nghiên cứu, số lượng bệnh nhân trong mỗi nhóm, tuổi và giới tính của bệnh nhân đăng ký, so sánh điều trị, mức độ nghiêm trọng của bệnh, ngày trung bình hình thành các triệu chứng khởi phát hoặc nhập viện điều trị, nguồn gốc của huyết tương (nếu nó là từ một một bệnh nhân hoặc gộp chung từ nhiều bệnh nhân), huyết tương có được kiểm tra hoạt tính trung hòa vi rút trong ống nghiệm và / hoặc hiệu giá kháng thể (cả hai thông số được đánh giá trước hoặc sau can thiệp) và, đồng thời, hiệu giá được sử dụng, và ngày trong thời gian theo dõi dài nhất với tỷ lệ nguy cơ (RR) tử vong tương ứng cùng với khoảng tin cậy (CI) 95%. Dữ liệu được trích xuất độc lập bởi hai tác giả (F.P. và P.d.C) và được kiểm tra độ chính xác bởi một điều tra viên bổ sung (S.G.). Hai tác giả (F.P và S.G.) đã đánh giá chuyên sâu chất lượng của các nghiên cứu được đưa vào ở cấp độ kết cục (tỷ lệ tử vong) bằng cách sử dụng công cụ Rủi ro sai lệch 2.0 và ROBINS-I cho RCT và các nghiên cứu không ngẫu nhiên, tương ứng. Sự khác biệt về đánh giá của các mục đã chọn đã được giải quyết bởi một tác giả thứ ba (P.d.C.).
PHÂN TÍCH ĐỊNH LƯỢNG VÀ THỐNG KÊ
RR trích xuất từ các nghiên cứu được sử dụng để tính toán log RR với 95% CI cho mọi hạng mục. Khi RR không được cung cấp, chúng được tính toán từ số lượng các sự kiện thô. Chúng tôi sử dụng phương pháp thống kê Phương sai nghịch đảo với RR làm thước đo hiệu quả để kiểm tra tác động của huyết tương hồi phục lên tỷ lệ tử vong ở các chỉ tiêu lâm sàng. Các tác động cố định hoặc ngẫu nhiên được áp dụng làm mô hình phân tích tùy thuộc vào sự không đồng nhất giữa các nghiên cứu. Sự không đồng nhất về thống kê giữa các thử nghiệm được đánh giá bằng thống kê I2. Ý nghĩa của tính không đồng nhất được đặt ở I2> 50% hoặc p <0,1, trong trường hợp đó, mô hình tác động ngẫu nhiên được sử dụng để phân tích. Tại p> 0,1 và I2 <50%, chúng tôi coi tính không đồng nhất là không đáng kể và mô hình hiệu ứng cố định đã được sử dụng. Các phân tích tổng hợp khác nhau được thực hiện theo các tình huống khác nhau với cơ sở tương đối, được chỉ định trước, như được trình bày chi tiết trong kết quả. Cách tiếp cận này được lựa chọn thay vì phân tích nhóm con vì không có nghiên cứu nào được thu thập báo cáo dữ liệu cho các phân nhóm bệnh nhân. Các phân tích được thực hiện bằng trình quản lý đánh giá 5.4.1 (Cộng tác Cochrane, Luân Đôn, Vương quốc Anh).
THÔNG TIN BỔ SUNG
Thông tin bổ sung có thể được tìm trực tuyến thông qua: https://doi.org/10.1016/j.isci.2021.102898.
SỰ NHÌN NHẬN
Công việc này đã được hỗ trợ bởi Bộ Y tế Ý – Ricerca Corrente đến IRCCS MultiMedica;
G.M. và R.P. được hỗ trợ bởi Khu vực Campania POR-FESR 2014-2020 Grant n. 7 ” Ipercovid ”.
SỰ ĐÓNG GÓP TỪ CÁC TÁC GIẢ
F.P., P.d.C., A.C., R.P. và G.M. hình thành ý tưởng, đóng góp để nghiên cứu thiết kế, thu thập dữ liệu, phân tích thống kê, giải thích dữ liệu và soạn thảo bản thảo. S.G., R.L.G., A.D.R. và A.P. đã tham gia vào việc thu thập dữ liệu, giải thích dữ liệu và đánh giá phê bình bản thảo. Tất cả các tác giả đã chấp thuận phiên bản cuối cùng và đồng ý chịu trách nhiệm cho tất cả các khía cạnh của tác phẩm.
TUYÊN BỐ QUYỀN LỢI
F.P. báo cáo các khoản phí cá nhân từ Berlin-Chemie/ Menarini, ngoài công việc đã nộp. A.C. báo cáo các khoản phí cá nhân từ Bayer, Ely Lilly, Novo Nordisk, Theras và Berlin Chemie; trợ cấp và phí cá nhân từ Roche Diagnostics; tài trợ từ Mitsubishi, trong quá trình thực hiện nghiên cứu. G.M. báo cáo nhận hỗ trợ tài trợ nghiên cứu từ Merck, Biogen và Novartis và phí ban cố vấn từ Merck, Biogen, Novartis và Roche. Anh ấy cũng cộng tác với Kedrion Biopharma trong các sáng kiến và nghiên cứu hội thảo trên web.
Ngày Nhận: 20/5/2021 Ngày Sửa đổi: 18/6/2021
Ngày Được chấp nhận: 19/7/2021 Ngày Xuất bản: 20/8/2021
THÔNG TIN THAM KHẢO
Abolghasemi, H., Eshghi, P., Cheraghali, A.M., Imani Fooladi, A.A., Bolouki Moghaddam, F., Imanizadeh, S., Moeini Maleki, M., Ranjkesh, M., Rezapour, M., Bahramifar, A., et al. (2020). Clinical efficacy of convalescent plasma for treatment of COVID-19 infections: results of a multicenter clinical study. Transfus. Apher. Sci. 59, 102875.
Agarwal, A., Mukherjee, A., Kumar, G., Chatterjee, P., Bhatnagar, T., Malhotra, P., and Collaborators, P.T. (2020). Convalescent plasma in the management of moderate covid-19 in adults in India: open label phase II multicentre randomised controlled trial (PLACID Trial). BMJ 371, m3939.
AlQahtani, M., Abdulrahman, A., Almadani, A., Alali, S.Y., Al Zamrooni, A.M., Hejab, A.H., Conroy, R.M., Wasif, P., Atkin, S.L., Otoom, S.,et al. (2020). Randomized controlled trial of convalescent plasma therapy against standard therapy in patients with severe COVID-19 disease. medRxiv.
Alsharidah, S., Ayed, M., Ameen, R.M., Alhuraish, F., Rouheldeen, N.A., Alshammari, F.R., Embaireeg, A., Almelahi, M., Adel, M., Dawoud, M.E., et al. (2021). COVID-19 convalescent plasma treatment of moderate and severe cases of SARS- CoV-2 infection: a multicenter interventional study. Int. J. Infect. Dis. 103, 439–446.
Altuntas, F., Yigenoglu, T.N., Bascı, S., Dal, M.S., Korkmaz, S., Turgut, B., and Erkurt, M.A. (2021). Convalescent plasma therapy in patients with COVID-19. Transfus. Apher. Sci. 60, 103017.
Anakli, I., Ergin Ozcan, P., Polat, O., Orhun, G., Alay, G.H., Tuna, V., Celiksoy, E., Kilic, M., Mercan, M., Ali, A., et al. (2021). Prognostic value of antithrombin levels in COVID-19 patients and impact of fresh frozen plasma treatment: a retrospective study. Turk J. Haematol. 38, 15–21.
Avendano-Sola, C., Ramos-Martinez, A., Munez- Rubio, E., Ruiz-Antoran, B., Malo de Molina, R., Torres, F., Fernandez-Cruz, A., Callejas-Diaz, A., Calderon, J., Payares-Herrera, C., et al. (2020). Convalescent Plasma for COVID-19: a multicenter, randomized clinical trial. medRxiv. Balcells, M.E., Rojas, L., Le Corre, N., Martinez- Valdebenito, C., Ceballos, M.E., Ferres, M., Chang, M., Vizcaya, C., Mondaca, S., Huete, A., et al. (2021). Early versus deferred anti-SARS-CoV- 2 convalescent plasma in patients admitted for COVID-19: a randomized phase II clinical trial. PLoS Med. 18, e1003415.
Benner, S.E., Patel, E.U., Laeyendecker, O., Pekosz, A., Littlefield, K., Eby, Y., Fernandez, R.E., Miller, J., Kirby, C.S., Keruly, M., et al. (2020). SARS-CoV-2 antibody avidity responses in COVID-19 patients and convalescent plasma donors. J. Infect. Dis. 222, 1974–1984.
Bonafe, M., Prattichizzo, F., Giuliani, A., Storci, G., Sabbatinelli, J., and Olivieri, F. (2020). Inflamm- aging: why older men are the most susceptible to SARS-CoV-2 complicated outcomes. Cytokine Growth Factor Rev. 53, 33–37.
Boonyaratanakornkit, J., Morishima, C., Selke, S., Zamora, D., McGuffin, S., Shapiro, A.E., Campbell, V.L., McClurkan, C.L., Jing, L., Gross, R., et al. (2021). Clinical, laboratory, and temporal predictors of neutralizing antibodies against SARS-CoV-2 among COVID-19 convalescent plasma donor candidates. J. Clin. Invest. 131, e144930.
Bosnjak, B., Stein, S.C., Willenzon, S., Cordes, A.K., Puppe, W., Bernhardt, G., Ravens, I., Ritter, C., Schultze-Florey, C.R., Godecke, N., et al. (2020). Low serum neutralizing anti-SARS-CoV-2 S antibody levels in mildly affected COVID-19 convalescent patients revealed by two different detection methods. Cell. Mol. Immunol. 18, 936– 944.
Bradfute, S.B., Hurwitz, I., Yingling, A.V., Ye, C., Cheng, Q., Noonan, T.P., Raval, J.S., Sosa, N.R., Mertz, G.J., Perkins, D.J., et al. (2020). Severe acute respiratory syndrome coronavirus 2 neutralizing antibody titers in convalescent plasma and recipients in New Mexico: an open treatment study in patients with coronavirus disease 2019. J. Infect. Dis. 222, 1620–1628. Budhiraja, S., Dewan, A., Aggarwal, R., Singh, O., Juneja, D., Pathak, S., Singh, Y.P., Gupta, A., Rai, R., Indrayan, A., et al. (2021). Effectiveness of convalescent plasma in Indian patients with COVID-19. Blood Cells Mol. Dis. 88, 102548.
Cele, S., Gazy, I., Jackson, L., Hwa, S.H., Tegally, H., Lustig, G., Giandhari, J., Pillay, S., Wilkinson, E., Naidoo, Y., et al. (2021). Escape of SARS-CoV- 2 501Y.V2 from neutralization by convalescent plasma. Nature 593, 142–146.
Cevik, M., Tate, M., Lloyd, O., Maraolo, A.E., Schafers, J., and Ho, A. (2021). SARS-CoV-2, SARS-CoV, and MERS-CoV viral load dynamics, duration of viral shedding, and infectiousness: a systematic review and meta-analysis. Lancet Microbe 2, e13–e22.
Chai, K.L., Valk, S.J., Piechotta, V., Kimber, C., Monsef, I., Doree, C., Wood, E.M., Lamikanra, A.A., Roberts, D.J., McQuilten, Z., et al. (2020). Convalescent plasma or hyperimmune immunoglobulin for people with COVID-19: a living systematic review. Cochrane Database Syst. Rev. 7, CD013600.
Chen, L., Xiong, J., Bao, L., and Shi, Y. (2020). Convalescent plasma as a potential therapy for COVID-19. Lancet Infect. Dis. 20, 398–400.
Cheng, Y., Wong, R., Soo, Y.O.Y., Wong, W.S., Lee, C.K., Ng, M.H.L., Chan, P., Wong, K.C., Leung, C.B., and Cheng, G. (2005). Use of convalescent plasma therapy in SARS patients in Hong Kong. Eur. J. Clin. Microbiol. Infect. Dis. 24, 44–46.
Cohen, M.S. (2021). Monoclonal antibodies to disrupt progression of early covid-19 infection.N. Engl. J. Med. 384, 289–291.
Davis, M.R., McCreary, E.K., and Pogue, J.M. (2020). That escalated quickly: remdesivir’s place in therapy for COVID-19. Infect. Dis. Ther. 9, 525–536.
DeSimone, R.A., Costa, V.A., Kane, K., Sepulveda, J.L., Ellsworth, G.B., Gulick, R.M., Zucker, J., Sobieszcyk, M.E., Schwartz, J., and Cushing, M.M. (2021). Blood component utilization in COVID-19 patients in New York City: transfusions do not follow the curve. Transfusion 61, 692–698.
Dogan, M., Kozhaya, L., Placek, L., Gunter, C., Yigit, M., Hardy, R., Plassmeyer, M., Coatney, P., Lillard, K., Bukhari, Z., et al. (2021). SARS-CoV-2 specific antibody and neutralization assays reveal the wide range of the humoral immune response to virus. Commun. Biol. 4, 129.
Donato, M.L., Park, S., Baker, M., Korngold, R., Morawski, A., Geng, X., Tan, M., Ip, A., Goldberg, S., Rowley, S., et al. (2021). Clinical and laboratory evaluation of patients with SARS-CoV-2 pneumonia treated with high-titer convalescent plasma. JCI Insight 6, e143196.
Duan, K., Liu, B., Li, C., Zhang, H., Yu, T., Qu, J., Zhou, M., Chen, L., Meng, S., Hu, Y., et al. (2020). Effectiveness of convalescent plasma therapy in severe COVID-19 patients. Proc. Natl. Acad. Sci. U S A 117, 9490–9496.
Bradfute, S.B., Hurwitz, I., Yingling, A.V., Ye, C., Cheng, Q., Noonan, T.P., Raval, J.S., Sosa, N.R., Mertz, G.J., Perkins, D.J., et al. (2020). Severe acute respiratory syndrome coronavirus 2 neutralizing antibody titers in convalescent plasma and recipients in New Mexico: an open treatment study in patients with coronavirus disease 2019. J. Infect. Dis. 222, 1620–1628. Budhiraja, S., Dewan, A., Aggarwal, R., Singh, O., Juneja, D., Pathak, S., Singh, Y.P., Gupta, A., Rai, R., Indrayan, A., et al. (2021). Effectiveness of convalescent plasma in Indian patients with COVID-19. Blood Cells Mol. Dis. 88, 102548.
Cele, S., Gazy, I., Jackson, L., Hwa, S.H., Tegally, H., Lustig, G., Giandhari, J., Pillay, S., Wilkinson, E., Naidoo, Y., et al. (2021). Escape of SARS-CoV- 2 501Y.V2 from neutralization by convalescent plasma. Nature 593, 142–146.
Cevik, M., Tate, M., Lloyd, O., Maraolo, A.E., Schafers, J., and Ho, A. (2021). SARS-CoV-2, SARS-CoV, and MERS-CoV viral load dynamics, duration of viral shedding, and infectiousness: a systematic review and meta-analysis. Lancet Microbe 2, e13–e22.
Chai, K.L., Valk, S.J., Piechotta, V., Kimber, C., Monsef, I., Doree, C., Wood, E.M., Lamikanra, A.A., Roberts, D.J., McQuilten, Z., et al. (2020). Convalescent plasma or hyperimmune immunoglobulin for people with COVID-19: a living systematic review. Cochrane Database Syst. Rev. 7, CD013600.
Dulipsingh, L., Ibrahim, D., Schaefer, E.J., Crowell, R., Diffenderfer, M.R., Williams, K., Lima, C., McKenzie, J., Cook, L., Puff, J., et al. (2020). SARS-CoV-2 serology and virology trends in donors and recipients of convalescent plasma. Transfus. Apher. Sci. 59, 102922.
Faqihi, F., Alharthy, A., Alodat, M., Kutsogiannis, D.J., Brindley, P.G., and Karakitsos, D. (2020).
Therapeutic plasma exchange in adult critically ill patients with life-threatening SARS-CoV-2 disease: a pilot study. J. Crit. Care 60, 328–333. Focosi, D., Anderson, A.O., Tang, J.W., and Tuccori, M. (2020). Convalescent plasma therapy for COVID-19: state of the art. Clin. Microbiol. Rev. 33, e00072–20.
Focosi, D., and Franchini, M. (2021). Clinical predictors of SARS-CoV-2 neutralizing antibody titers in COVID-19 convalescents: implications for convalescent plasma donor recruitment. Eur. J. Haematol. 107, 24–28.
Gharbharan, A., Jordans, C.C.E., Geurtsvankessel, C., den Hollander, J.G., Karim, F., Mollema, F.P.N., Stalenhoef-Schukken, J.E., Dofferhoff, A., Ludwig, I., Koster, A., et al. (2020). Convalescent Plasma for COVID-19. A randomized clinical trial. medRxiv.
Gontu, A., Srinivasan, S., Salazar, E., Nair, M.S., Nissly, R.H., Greenawalt, D., Bird, I.M., Herzog, C.M., Ferrari, M.J., Poojary, I., et al. (2021).
Limited window for donation of convalescent plasma with high live-virus neutralizing antibody titers for COVID-19 immunotherapy. Commun. Biol. 4, 267.
Gonza´ lez, S.E., Regairaz, L., Ferrando, N.S., Gonza´ lez Martı´nez, V.V., Salazar, M.R., and Estenssoro, E. (2020). [Convalescent plasma therapy in COVID-19 patients, in the province of buenos aires]. Medicina (B Aires) 80, 417–424.
Hegerova, L., Gooley, T.A., Sweerus, K.A., Maree, C., Bailey, N., Bailey, M., Dunleavy, V., Patel, K., Alcorn, K., Haley, R., et al. (2020). Use of convalescent plasma in hospitalized patients with COVID-19: case series. Blood 136, 759–762.
Horby, P.W., Estcourt, L., Peto, L., Emberson, J.R., Staplin, N., Spata, E., Pessoa-Amorim, G., Campbell, M., Roddick, A., Brunskill, N.E., et al. (2021). Convalescent plasma in patients admitted to hospital with COVID-19 (RECOVERY): a randomised, controlled, open-label, platform trial. medRxiv.
Huang, C., Wang, Y., Li, X., Ren, L., Zhao, J., Hu, Y., Zhang, L., Fan, G., Xu, J., Gu, X., et al. (2020). Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet 395, 497–506.
Jaiswal, V., Nasa, P., Raouf, M., Gupta, M., Dewedar, H., Mohammad, H., Al Rais, Z., Ali Baqer, M., Alsabbah, A., Ibrahim, Y., et al. (2021). Therapeutic plasma exchange followed by convalescent plasma transfusion in critical COVID-19-An exploratory study. Int. J. Infect. Dis. 102, 332–334.
Janaka, S.K., Hartman, W., Mou, H., Farzan, M., Stramer, S.L., Goodhue, E., Weiss, J., Evans, D., and Connor, J.P. (2021). Donor anti-spike immunity is related to recipient recovery and can predict the efficacy of convalescent plasma units. medRxiv.
Joyner, M.J., Carter, R.E., Senefeld, J.W., Klassen, S.A., Mills, J.R., Johnson, P.W., Theel, E.S., Wiggins, C.C., Bruno, K.A., Klompas, A.M., et al. (2021). Convalescent plasma antibody levels and the risk of death from covid-19. N. Engl. J. Med. 384, 1015–1027.
Kamran, S.M., Mirza, Z.E., Naseem, A., Liaqat, J., Fazal, I., Alamgir, W., Saeed, F., Saleem, S., Nisar, S., Yousaf, M.A., et al. (2021). Therapeutic plasma exchange for coronavirus disease-2019 triggered cytokine release syndrome; a retrospective propensity matched control study. PLoS One 16, e0244853.
Klassen, S.A., Senefeld, J.W., Johnson, P.W., Carter, R.E., Wiggins, C.C., Shoham, S., Grossman, B.J., Henderson, J.P., Musser, J., Salazar, E., et al. (2020). Evidence favoring the efficacy of convalescent plasma for COVID-19 therapy. medRxiv.
Klein, S.L., Pekosz, A., Park, H.S., Ursin, R.L., Shapiro, J.R., Benner, S.E., Littlefield, K., Kumar, S., Naik, H.M., Betenbaugh, M.J., et al. (2020). Sex, age, and hospitalization drive antibody responses in a COVID-19 convalescent plasma donor population. J. Clin. Invest. 130, 6141–6150. Li, L., Zhang, W., Hu, Y., Tong, X., Zheng, S., Yang, J., Kong, Y., Ren, L., Wei, Q., Mei, H., et al. (2020a). Effect of convalescent plasma therapy on time to clinical improvement in patients with severe and life-threatening COVID-19: a randomized clinical trial. JAMA 324, 460–470.
Li, S., Jiang, L., Li, X., Lin, F., Wang, Y., Li, B., Jiang, T., An, W., Liu, S., Liu, H., et al. (2020b). Clinical and pathological investigation of severe COVID- 19 patients. JCI Insight 5, e138070.
Libster, R., Perez Marc, G., Wappner, D., Coviello, S., Bianchi, A., Braem, V., Esteban, I., Caballero, M.T., Wood, C., Berrueta, M., et al. (2021). Early high-titer plasma therapy to prevent severe covid-19 in older adults. N. Engl. J. Med. 384, 610–618.
Liu, S.T.H., Lin, H.-M., Baine, I., Wajnberg, A., Gumprecht, J.P., Rahman, F., Rodriguez, D., Tandon, P., Bassily-Marcus, A., Bander, J., et al. (2020). Convalescent plasma treatment of severe COVID-19: a propensity score–matched control study. Nat. Med. 26, 1708–1713.
Lu, R., Zhao, X., Li, J., Niu, P., Yang, B., Wu, H., Wang, W., Song, H., Huang, B., Zhu, N., et al. (2020). Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding. Lancet 395, 565–574.
Madariaga, M.L.L., Guthmiller, J.J., Schrantz, S., Jansen, M.O., Christensen, C., Kumar, M., Prochaska, M., Wool, G., Durkin-Celauro, A., Oh, W.H., et al. (2020). Clinical predictors of donor antibody titer and correlation with recipient antibody response in a COVID-19 convalescent plasma clinical trial. medRxiv.
Mair-Jenkins, J., Saavedra-Campos, M., Baillie, J.K., Cleary, P., Khaw, F.M., Lim, W.S., Makki, S., Rooney, K.D., Nguyen-Van-Tam, J.S., and Beck, C.R. (2015). The effectiveness of convalescent plasma and hyperimmune immunoglobulin for the treatment of severe acute respiratory infections of viral etiology: a systematic review and exploratory meta-analysis. J. Infect. Dis. 211, 80–90.
Marson, P., Cozza, A., and De Silvestro, G. (2020). The true historical origin of convalescent plasma therapy. Transfus. Apher. Sci. 59, 102847.
Mehew, J., Johnson, R., Roberts, D., and Harvala, H. (2020). Convalescent plasma for COVID-19: male gender, older age and hospitalisation associated with high neutralising antibody levels, England, 22 April to 12 May 2020. Euro Surveill. 25, 2001754.
Morgenlander, W.R., Henson, S.N., Monaco, D.R., Chen, A., Littlefield, K., Bloch, E.M., Fujimura, E., Ruczinski, I., Crowley, A.R., Natarajan, H., et al. (2021). Antibody responses to endemic coronaviruses modulate COVID-19 convalescent plasma functionality. J. Clin. Invest. 131, e146927.
Olivares-Gazca, J.C., Priesca-Marin, J.M., Ojeda- Laguna, M., Garces-Eisele, J., Soto-Olvera, S., Palacios-Alonso, A., Izquierdo-Vega, J., Chacon- Cano, R., Arizpe-Bravo, D., Lopez-Trujillo, M.A., et al. (2020). Infusion of convalescent plasma is associated with clinical improvement in critically ill patients with covid-19: a pilot study. Rev. Invest. Clin. 72, 159–164.
Omrani, A.S., Zaqout, A., Baiou, A., Daghfal, J., Elkum, N., Alattar, R.A., Bakdach, D., Abusriwil, H., Mostafa, A.M., Alhariri, B., et al. (2021).
Convalescent plasma for the treatment of patients with severe coronavirus disease 2019: a preliminary report. J. Med. Virol. 93, 1678–1686.
Perotti, C., Baldanti, F., Bruno, R., Del Fante, C., Seminari, E., Casari, S., Percivalle, E., Glingani, C., Musella, V., Belliato, M., et al. (2020). Mortality reduction in 46 severe Covid-19 patients treated with hyperimmune plasma. A proof of concept single arm multicenter trial. Haematologica 105, 2834–2840.
Pouladzadeh, M., Safdarian, M., Eshghi, P., Abolghasemi, H., bavani, A.G., Sheibani, B., Moradi Choghakabodi, P., Feghhi, A., Ghafourian Boroujerdnia, M., Forouzan, A., et al. (2021). A randomized clinical trial evaluating the immunomodulatory effect of convalescent plasma on COVID-19-related cytokine storm.
Intern. Emerg. Med. 1–11. Rasheed, A.M., Fatak, D.F., Hashim, H.A., Maulood, M.F., Kabah, K.K., Almusawi, Y.A., and Abdulamir, A.S. (2020). The therapeutic potential of convalescent plasma therapy on treating critically-ill COVID-19 patients residing in respiratory care units in hospitals in Baghdad, Iraq. Infez Med. 28, 357–366.
RECOVERY Collaborative Group, Horby, P., Lim, W.S., Emberson, J.R., Mafham, M., Bell, J.L., Linsell, L., Staplin, N., Brightling, C., Ustianowski, A., et al. (2021). Dexamethasone in hospitalized patients with covid-19 – preliminary report.
Engl. J. Med. 384, 693–704. Salazar, E., Christensen, P.A., Graviss, E.A., Nguyen, D.T., Castillo, B., Chen, J., Lopez, B.V., Eagar, T.N., Yi, X., Zhao, P., et al. (2020a). Treatment of coronavirus disease 2019 patients with convalescent plasma reveals a signal of significantly decreased mortality. Am. J. Pathol. 190, 2290–2303.
Salazar, E., Kuchipudi, S.V., Christensen, P.A., Eagar, T., Yi, X., Zhao, P., Jin, Z., Long, S.W., Olsen, R.J., Chen, J., et al. (2020b). Convalescent plasma anti-SARS-CoV-2 spike protein ectodomain and receptor-binding domain IgG correlate with virus neutralization. J. Clin. Invest. 130, 6728–6738.
Sarkar, S., Soni, K.D., and Khanna, P. (2021). Convalescent plasma is a clutch at straws in COVID-19 management! A systematic review and meta-analysis. J. Med. Virol. 93, 1111–1118.
Shenoy, A.G., Hettinger, A.Z., Fernandez, S.J., Blumenthal, J., and Baez, V. (2021). Early mortality benefit with COVID-19 convalescent plasma: a matched control study. Br. J. Haematol. 192, 706–713.
Simonovich, V.A., Burgos Pratx, L.D., Scibona, P., Beruto, M.V., Vallone, M.G., Vazquez, C., Savoy, N., Giunta, D.H., Perez, L.G., Sanchez, M.D.L., et al. (2020). A randomized trial of convalescent plasma in covid-19 severe pneumonia. N. Engl. J. Med. 384, 619–629.
Skrip, L., Derra, K., Kabore, M., Noori, N., Gansane, A., Valea, I., Tinto, H., Brice, B.W., Gordon, M.V., Hagedorn, B., et al. (2020). Clinical management and mortality among COVID-19 cases in sub-Saharan Africa: a retrospective study from Burkina Faso and simulated case analysis. Int. J. Infect. Dis. 101, 194–200.
Stasi, C., Fallani, S., Voller, F., and Silvestri, C. (2020). Treatment for COVID-19: an overview. Eur. J. Pharmacol. 889, 173644. Intern. Emerg. Med. 1–11. Rasheed, A.M., Fatak, D.F., Hashim, H.A., Maulood, M.F., Kabah, K.K., Almusawi, Y.A., and Abdulamir, A.S. (2020). The therapeutic potential of convalescent plasma therapy on treating critically-ill COVID-19 patients residing in respiratory care units in hospitals in Baghdad, Iraq. Infez Med. 28, 357–366.
Supasa, P., Zhou, D., Dejnirattisai, W., Liu, C., Mentzer, A.J., Ginn, H.M., Zhao, Y., Duyvesteyn, H.M.E., Nutalai, R., Tuekprakhon, A., et al. (2021). Reduced neutralization of SARS-CoV-2 B.1.1.7 variant by convalescent and vaccine sera. Cell 184, 2201–2211 e2207.
Terpos, E., Politou, M., Sergentanis, T.N., Mentis, A., Rosati, M., Stellas, D., Bear, J., Hu, X., Felber, B.K., Pappa, V., et al. (2020). Anti-SARS-CoV-2 antibody responses in convalescent plasma donors are increased in hospitalized patients; subanalyses of a phase 2 clinical study. Microorganisms 8, 1885.
Thompson, M.A., Henderson, J.P., Shah, P.K., Rubinstein, S.M., Joyner, M.J., Choueiri, T.K., Flora, D.B., Griffiths, E.A., Gulati, A.P., Hwang, C., et al. (2021). Association of convalescent plasma therapy with survival in patients with hematologic cancers and COVID-19. JAMA Oncol. https://doi. org/10.1001/jamaoncol.2021.1799.
Tobian, A.A.R., and Shaz, B.H. (2020). Earlier the better: convalescent plasma. Blood 136, 652–654. Tremblay, D., Seah, C., Schneider, T., Bhalla, S., Feld, J., Naymagon, L., Wang, B., Patel, V., Jun, T., Jandl, T., et al. (2020). Convalescent plasma for the treatment of severe COVID-19 infection in cancer patients. Cancer Med. 9, 8571–8578.
Valentini, R., Ferna´ ndez, J., Riveros, D., Pa´ lizas, F., Solimano, J., Sau´ l, P., Medina, J., Falasco, V., Dupont, M.L., Laviano, J., et al. (2020). [Convalescent plasma as a therapy for severe COVID-19 pneumonia]. Medicina (B Aires) 80 (Suppl 6 ), 9–17.
Vickers, M.A., Sariol, A., Leon, J., Ehlers, A., Locher, A.V., Dubay, K.A., Collins, L., Voss, D., Odle, A.E., Holida, M., et al. (2021). Exponential increase in neutralizing and spike specific antibodies following vaccination of COVID-19 convalescent plasma donors. Transfusion 61, 2099–2106.
Wang, P., Casner, R.G., Nair, M.S., Wang, M., Yu, J., Cerutti, G., Liu, L., Kwong, P.D., Huang, Y., Shapiro, L., et al. (2021a). Increased resistance of SARS-CoV-2 variant P.1 to antibody neutralization. Cell Host Microbe 29, 747– 751.e744.
Wang, P., Nair, M.S., Liu, L., Iketani, S., Luo, Y., Guo, Y., Wang, M., Yu, J., Zhang, B., Kwong, P.D., et al. (2021b). Antibody resistance of SARS-CoV-2 variants B.1.351 and B.1.1.7. Nature 593, 130–135. Wardhani, S.O., Fajar, J.K., Nurarifah, N., Hermanto, D.H., Fatonah, S., Djajalaksana, S., Fatoni, A.Z., Arsana, P.M., Wulandari, L., Soegiarto, G., et al. (2021). The predictors of high titer of anti-SARS-CoV-2 antibody of convalescent plasma donors. Clin. Epidemiol. Glob. Health 11, 100763.
Wibmer, C.K., Ayres, F., Hermanus, T., Madzivhandila, M., Kgagudi, P., Oosthuysen, B., Lambson, B.E., de Oliveira, T., Vermeulen, M., van der Berg, K., et al. (2021). SARS-CoV-2 501Y.V2escapes neutralization by South African COVID- 19 donor plasma. Nat. Med. 27, 622–625.
Xia, X., Li, K., Wu, L., Wang, Z., Zhu, M., Huang, B., Li, J., Wang, Z., Wu, W., Wu, M., et al. (2020). Improved clinical symptoms and mortality among patients with severe or critical COVID-19 after convalescent plasma transfusion. Blood 136, 755–759.
Yoon, H.A., Bartash, R., Gendlina, I., Rivera, J., Nakouzi, A., Bortz, R.H., 3rd, Wirchnianski, A.S., Paroder, M., Fehn, K., Serrano-Rahman, L., et al. (2021). Treatment of severe COVID-19 with convalescent plasma in Bronx, NYC. JCI Insight 6, e142270.
Zeng, F., Chen, X., and Deng, G. (2020). Convalescent plasma for patients with COVID-19. Proc. Natl. Acad. Sci. U S A 117, 12528.
Zhou, F., Yu, T., Du, R., Fan, G., Liu, Y., Liu, Z., Xiang, J., Wang, Y., Song, B., Gu, X., et al. (2020a). Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet 395, 1054– 1062.
Zhou, P., Yang, X.L., Wang, X.G., Hu, B., Zhang, L.,Zhang, W., Si, H.R., Zhu, Y., Li, B., Huang, C.L., et al. (2020b). A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature 579, 270–273.
Zhu, N., Zhang, D., Wang, W., Li, X., Yang, B., Song, J., Zhao, X., Huang, B., Shi, W., Lu, R., et al. (2020). A novel coronavirus from patients with pneumonia in China, 2019. N. Engl. J. Med. 382, 727–733
Xem thêm:
COVID-19 và Thuốc kháng đông: Liều điều trị hay Liều dự phòng?