Sản xuất Dược phẩm
Xây dựng và thẩm định quy trình định lượng Desloratadin và Natri benzoat trong siro ho
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
NGUYỄN VIẾT CHÍNH (Trường Đại học Y Dược Hải Phòng, LÊ QUANG THẢO (Viện Kiểm nghiệm thuốc Trung ương)
Đặt vấn đề
Siro là dạng chế phẩm lỏng đường uống rất phổ biến trên thị trường do có tính ưu việt hơn so với những dạng bào chế thông thường khác như: viên nén, viên nang… Các thuốc dưới dạng bào chế này vừa có khả năng hấp thu nhanh, vừa có thể sử dụng được cho nhiều đối tượng người dùng khác nhau nhờ khả năng che giấu mùi vị của nhiều dược chất khó chịu.
Hiện nay, một số loại siro ho có chứa desloratadin được sử dụng nhiều để điều trị các bệnh dị ứng, viêm mũi dị ứng theo mùa,… Desloratadin là thuốc kháng histamine H1 thế hệ 2 có hiệu quả trong việc điều trị dứt điểm các triệu chứng do dị ứng gây ra. Tuy nhiên, trong công thức siro thường có chứa hàm lượng đường cao, đây là điều kiện thuận lợi để vi sinh vật xâm nhập và phát triển. Do đó, trong công thức đòi hỏi phải có thêm thành phần chất bảo quản. Natri benzoat là một chất bảo quản được sử dụng rộng rãi trong mỹ phẩm, thực phẩm và dược phẩm. Natri benzoat được sử dụng với hàm lượng 0,02 – 0,5 % ở dạng thuốc uống [6]. Theo FDA khuyến nghị nên kiểm tra hàm lượng, giới hạn chất bảo quản trong các chế phẩm siro để đảm bảo chất lượng và bảo vệ người tiêu dùng [3], [4]. Hiện nay, các tài liệu trong nước và một số tài liệu nước ngoài chúng tôi tham khảo, chưa có nhiều tài liệu công bố về qui trình định lượng đồng thời hai chất này [1], [2], [7] hoặc quy trình còn phức tạp [5].
Nhằm góp phần nâng cao công tác giảm sát chất lượng thuốc phục vụ sức khỏe cộng đồng, nhóm nghiên cứu đã tiến hành xây dựng và thẩm định quy trình định lượng đồng thời desloratadin và chất bảo quản natri benzoat trong siro ho nghiên cứu (NC01) bằng kỹ thuật HPLC.
2. Thực nghiệm
2.1. Thiết bị, dụng cụ, hóa chất, chất chuẩn
2.1.1. Thiết bị, dụng cụ
Các thiết bị, dụng cụ đã được hiệu chuẩn, đáp ứng yêu cầu của ISO/IEC 17025 và GLP, bao gồm:
- Cân phân tích MS 105 độ chính xác 0,01 mg;
- Máy sắc ký lỏng hiệu năng cao Water ARC;
- Máy đo pH Mettler Toledo;
- Cột phân tích Phenomenex C8 (250 x 4,6 mm; 5 µm);
- Các thiết bị, dụng cụ khác: máy lắc siêu âm, các dụng cụ thủy tinh chính xác class A
2.1.2. Hóa chất, dung môi và chất chuẩn
- Hóa chất: Ortho – kali dihydro phosphate (PA), natri hexansulfonat (PA) của Merck
- Dung môi: Methanol (HPLC), acetonitrile (HPLC), acid ortho – phosphoric 85 % (PA) của Merck, nước RO của Viện Kiểm nghiệm Thuốc Trung ương
- Chất chuẩn: Desloratadin (C19H19ClN2) hàm lượng: 99,80 % (nguyên trạng), SKS: F006W0 và natri benzoat (C7H5NaO2), hàm lượng: 98,59 % (nguyên trạng), SKS: 0115314.01 của Viện Kiểm nghiệm thuốc Trung ương.
2.2. Đối tượng và phương pháp nghiên cứu
2.2.1. Đối tượng nghiên cứu
- Mẫu chế phẩm siro ho desloratadin có chứa natri benzoat đang lưu hành trên thị trường: T01 và
- Mẫu siro ho nghiên cứu (NC01), số lô 010621, được công ty cung cấp chứa desloratadin 0,5 mg; natri benzoat 2,0 mg và tá dược trong vừa đủ 1 ml.
- Mẫu placebo (1): Mẫu giả dược được chuẩn bị như một lô mẫu thử nhưng không có thành phần natri Mẫu placebo gồm glycerin, saccarose, dung dịch sorbitol 70 %, acid citric, natri citrat, dinatri edetat, màu tartrazin, tinh dầu cam, ethanol 96 %, nước tinh khiết.
- Mẫu placebo (2): Mẫu giả dược được chuẩn bị như một lô mẫu thử nhưng không có thành phần Mẫu placebo gồm glycerin, saccarose, dung dịch sorbitol 70 %, acid citric, natri citrat, dinatri edetat, màu tartrazin, tinh dầu cam, ethanol 96 %, nước tinh khiết.
- Phương pháp nghiên cứu
- Phương pháp phân tích
- Sử dụng sắc ký lỏng pha đảo với cột sắc ký C8 (250 x 4,6 mm; 5 µm) và hệ pha động acetonitril – đệm.
2.2.2. Phương pháp chuẩn bị mẫu chuẩn
- Dung dịch chuẩn gốc: Pha dung dịch chuẩn gốc desloratadin (0,1 mg/ml) và natri benzoat (0,4 mg/ml) trong dung môi pha mẫu.
- Dung dịch chuẩn hỗn hợp: Hút chính xác 1,0 ml dung dịch chuẩn gốc desloratadin 0,1 mg/ml và 1,0 ml dung dịch chuẩn gốc natri benzoat 0,4 mg/ml vào bình định mức 10 ml. Thêm dung môi pha mẫu vừa đủ đến vạch, lắc kỹ.
- Dung dịch thử: Cân chính xác khoảng 2,60 g chế phẩm cho vào bình định mức 100 Thêm 60 ml dung môi pha mẫu, lắc siêu âm trong 10 phút. Sau đó để yên trong 10 phút cho dung dịch trở về nhiệt độ phòng rồi thêm dung môi pha mẫu đến vạch, lắc kĩ. Dung dịch thu được đem lọc qua màng lọc 0,45 mm loại bỏ 20 ml dịch lọc đầu. Sử dụng dịch lọc.
Kiểm tra tính thích hợp của hệ thống: Tiến hành sắc ký với dung dịch chuẩn hỗn hợp, thứ tự rửa giải của 2 píc lần lượt là natri benzoat và desloratadin; độ phân giải của 2 pic không được nhỏ hơn 2,0; độ lệch chuẩn tương đối của các diện tích pic đáp ừng từ 6 lần tiêm lặp lại dung dịch chuẩn hỗn hợp không được lớn hơn 2,0 %.
Tiêm 50 μl dung dịch placebo, dung dịch chuẩn hỗn hợp và dung dịch thử và hệ thống sắc ký. Ghi lại sắc ký đồ và đáp ứng của píc chính trong dung dịch chuẩn hỗn hợp và dung dịch thử.
3. Kết quả và bàn luận
3.1. Lựa chọn điều kiện sắc ký
3.1.1. Lựa chọn cột sắc ký
Qua nghiên cứu các tài liệu về định lượng desloratadin và natri benzoat [5], [8], cùng các đặc điểm về tính chất lý hóa và công thức cấu tạo cùng với điều kiện hiện có của phòng thí nghiệm, chúng tôi lựa chọn cột phân tích hiện có là cột sắc ký Phenomenex C8 (250 mm x 4,6 mm, 5 µm).
3.1.2. Lựa chọn bước sóng phát hiện
Thực hiện quét phổ UV mẫu chuẩn đơn của hai chất ở dải bước sóng 200 – 400 nm. Kết quả thu được như sau:
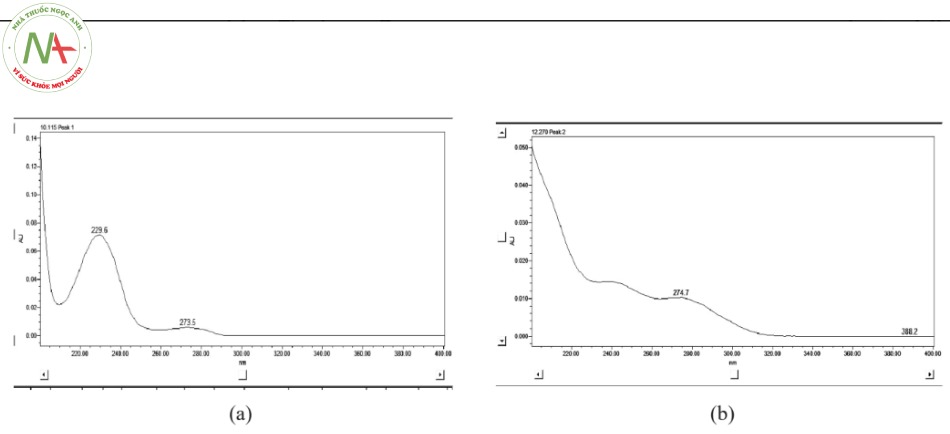
Kết quả cho thấy cả hai chất desloratadin và natri benzoat đều có cực đại hấp thụ tại bước sóng khoảng 273 nm – 274 nm. Do đó nhóm nghiên cứu lựa chọn bước sóng 274nm để phân tích đồng thời hai chất trên, giảm thiểu tránh các sai số ảnh hưởng do độ lệch của bước sóng.
3.1.3. Lựa chọn pha động
Căn cứ vào giá trị pKa của desloratadin và natri benzoat lần lượt là 9,73 và 4,25 tiến hành lựa chọn pha động có thành phần đệm pH < 4,0 để hai chất phân tích không bị chuyển dạng ion trong dung dịch, có thể được lưu giữ và rửa giải theo thời gian khác nhau.
Qua các tài liệu nghiên cứu được [5], [8] kết hợp với sự có sẵn của hóa chất, dung môi hiện có của phòng thí nghiệm. Nhóm nghiên cứu lựa chọn pha động 1 gồm acetonitril và đệm phosphat ( KH2PO4 0,01 M) với tỉ lệ 30 : 70 để khảo sát.
Tiến hành khảo sát chương trình đẳng dòng với pha động gồm acetonitril và đệm phosphat 0,01 M được điều chỉnh pH tới giá trị 3,0 bằng acid ortho-phosphoric 0,1 % trên dung dịch thử. Kết quả thu được như hình 2:
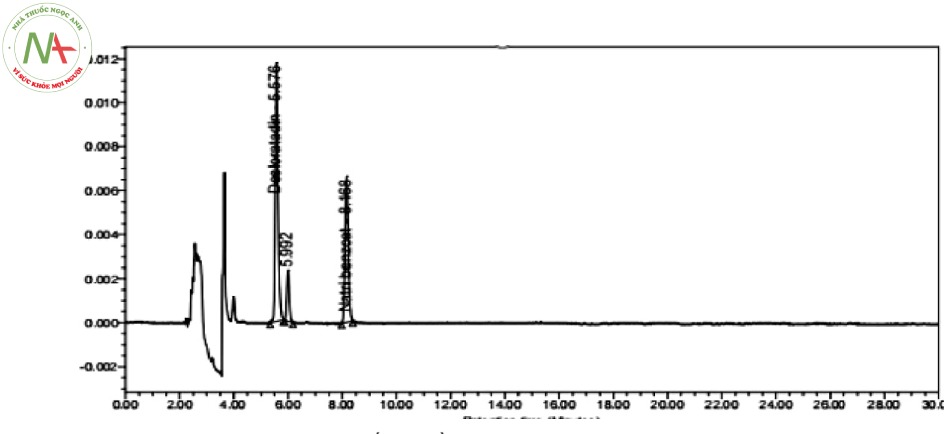
Từ hình ảnh sắc ký đồ thu được sau khi khảo sát pH = 3,0 của dung dịch đệm, thấy rằng tại đệm pH = 3,0 có xuất hiện pic của hai chất phân tích với thời gian lưu hợp lý. Tuy nhiên, pic desloratadin và pic tá dược chưa tách tốt vẫn còn bị dính chân và pic desloratadin cũng có hiện tượng bị kéo đuôi.
Vì vậy, để giảm hiện tượng kéo đuôi pic desloratadin cũng nhưng tăng hiệu suất tách của cột sắc ký, chúng tôi tiến hành sử dụng thêm chất tạo cặp ion natri hexansulfonat trong pha động. Sau khi chuẩn bị xong dung dung dịch đệm phosphat 0,01 M, pH = 3,0 có thêm chất tạo cặp ion natri hexansulfonat, chúng tôi tiến hành khảo sát tiếp pha động 2. Kết quả thu được như hình 3:
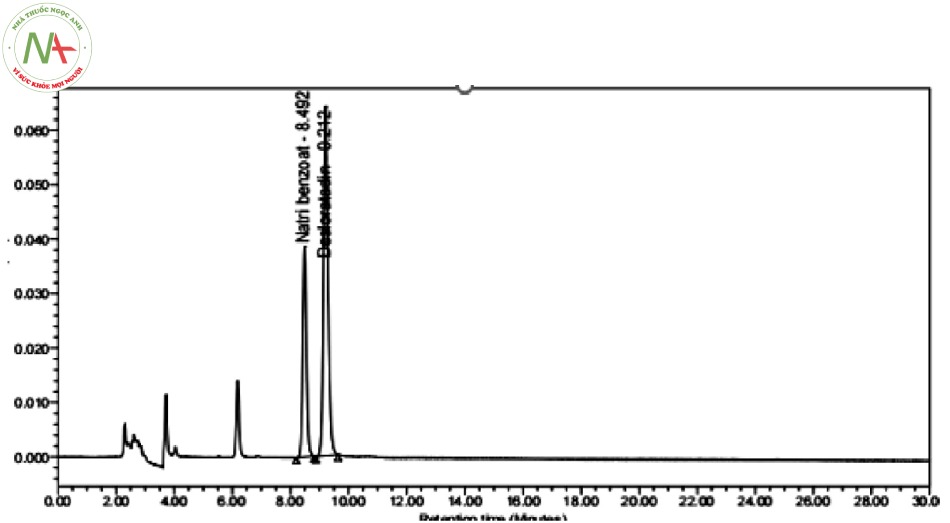
Nhận thấy, các pic cân đối không còn hiện tượng bị kéo đuôi, độ tinh khiết của hai pic đều đạt và pic tá dược đã tách khỏi pic hai chất phân tích. Tuy nhiên, hai pic chất phân tích có hiện tượng dính chân pic. Vì vậy, có thể lựa chon hệ đệm này trong thành phần pha động để phân tích, nhưng cần khảo sát thêm tỉ lệ pha động để các pic có thể tách nhau tốt hơn.
3.1.4. Tỉ lệ pha động và tốc độ dòng
Tiến hành khảo sát pha động gồm acetonitril: đệm phosphat (KH2PO4 0,01 M, natri hexansulfonat pH = 3,0) ở các tỷ lệ (35 : 65) và (25 : 75). Tốc độ dòng để ở mức 1 ml/phút. Kết quả thu được như hình 4:
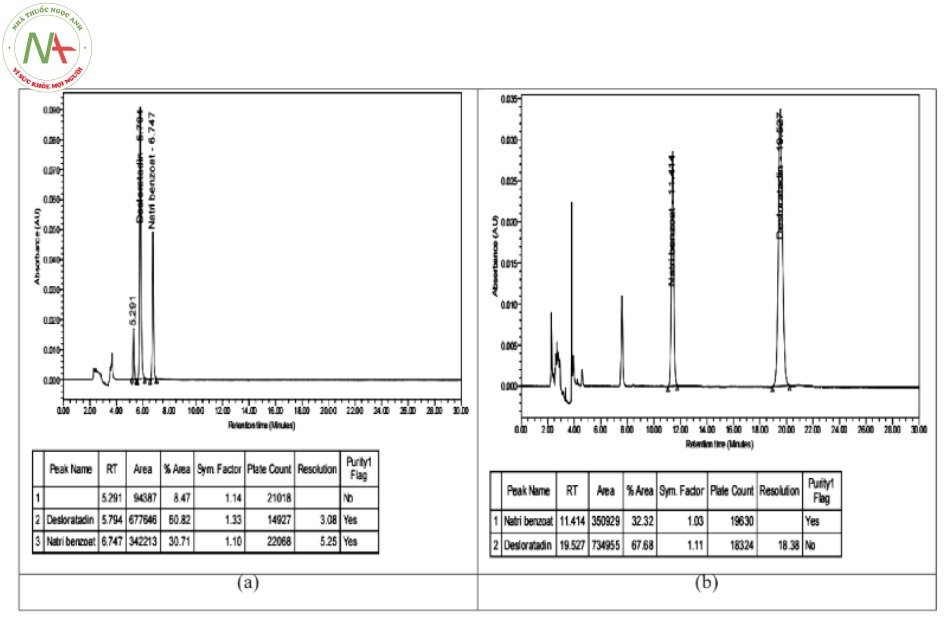
Từ kết quả sắc ký đồ, nhận thấy:
- Ở tỉ lệ pha động 3 (35 : 65) pic desloratadin bị kéo đuôi và bị dính chân pic tá dược, khả năng tách các pic kém.
- Ở tỉ lệ pha động 4 (25 : 75) các pic tách tốt không còn bị dính chân nhưng thời gian lưu của pic desloratadin bị kéo dài và có hiện tượng bị doãng pic.
Để khắc phục những hạn chế ở trên, nhóm nghiên cứu chuyển chương trình chạy đẳng dòng sang chương trình gradient dung môi (hệ pha động 5) như sau:
| Thời gian (phút) | % Pha động A | % Pha động B |
| 0 | 75 | 25 |
| 0 – 20 | 75 → 60 | 25 → 40 |
| 20 – 25 | 60 → 75 | 40 → 25 |
Kết quả chạy chương trình gradient dung môi như hình 5:
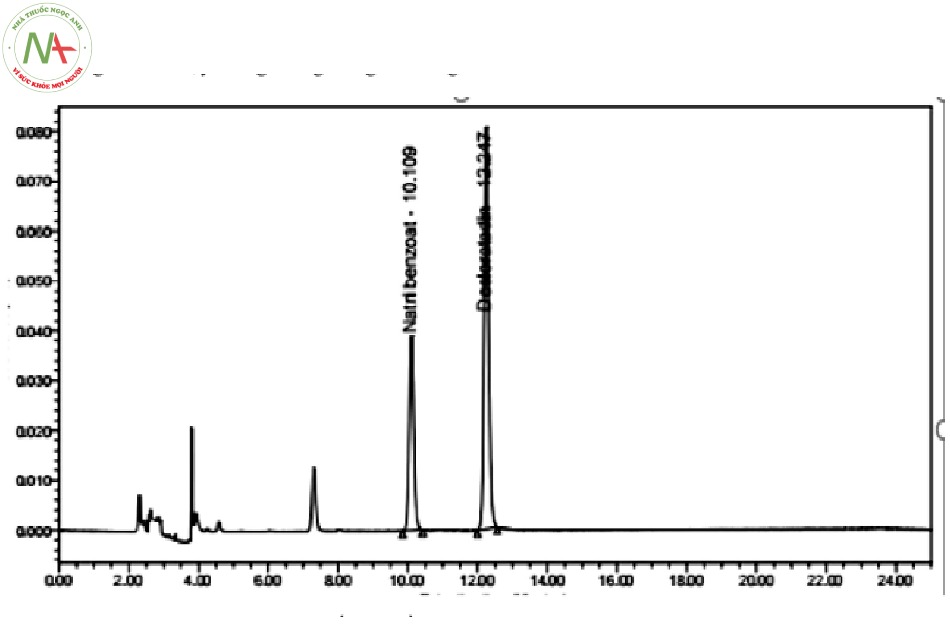
Nhận thấy, với chương trình gradient ở trên các pic gọn không còn hiện tượng bị kéo đuôi, tách hoàn toàn, thời gian lưu hợp lý.
Như vậy, qua quá trình khảo sát hực nghiệm, chúng tôi đã lựa chọn được điều kiện sắc ký như sau:
- Cột sắc ký Phenomenex C8 (250 x 4,6 mm, 5 µm), nhiệt độ cột: 50 o
- Pha động:
+ Pha A: Đệm phosphat pH = 3,0: Hòa tan 1,36 g kali dihydrophosphat và 0,96 g natri hexansulfonat trong 950 ml nước, điều chỉnh đến pH = 3,0 bằng acid phosphoric 0,1 %, thêm nước đủ 1000 ml, lắc đều.
+ Pha B: Acetonitril
Chương trình gradient dung môi:
| Thời gian (phút) | % Pha động A | % Pha động B |
| 0 | 75 | 25 |
| 0 – 20 | 75 → 60 | 25 → 40 |
| 20 – 25 | 60 → 75 | 40 → 25 |
- Tốc độ dòng: 1,0 ml/phút;
- Thể tích tiêm: 50 μl;
- Bước sóng ghi: 274 nm;
- Dung môi pha mẫu methanol – nước (50 : 50).
Với điều kiện sắc ký như trên, thứ tự rửa giải của 2 pic lần lượt là natri benzoat và desloratadin; 2 pic thu được tách rõ ràng, đối xứng và gọn. Như vậy việc lựa chọn các điều kiện sắc ký là phù hợp.
3.2. Thẩm định phương pháp phân tích
3.2.1. Độ đặc hiệu
Tiến hành tiêm vào hệ thống sắc ký lần lượt các dung dịch sau: dung dịch placebo (1), (2); dung dịch thử và dung dịch chuẩn hỗn hợp.
Kết quả cho thấy:
- Trên sắc ký đồ của dung dịch placebo (1) chỉ xuất hiện pic natri benzoat, dung dịch placebo (2) chỉ xuất hiện pic desloratadin
- Sắc ký đồ của dung dịch thử cho pic có thời gian lưu (10,453 phút) và phổ UV tương ứng với thời gian lưu và phổ UV của pic desloratadin (10,453 phút); pic có thời gian lưu (9,271 phút) và phổ UV tương ứng với thời gian lưu và phổ UV của pic natri benzoat (9,277 phút) thu được trên sắc ký đồ của dung dịch chuẩn hỗn hợp.
Vì vậy, phương pháp có tính đặc hiệu để định tính và định lượng đồng thời desloratadin và natri benzoat trong chế phẩm siro ho.
3.2.2. Độ thích hợp hệ thống
Tiêm vào hệ thống sắc ký 6 lần lặp lại dung dịch chuẩn hỗn hợp ở mức nồng độ 100 %. Ghi lại các giá trị về thời gian lưu, diện tích pic, hệ số phân giải giữa 2 pic. Kết quả khảo sát độ thích hợp hệ thống được trình bày ở Bảng 1.
Bảng 1. Kết quả khảo sát độ thích hợp hệ thống
|
STT |
Pic natri benzoat | Pic desloratadin |
Hệ số phân giải giữa 2 pic |
||
| Thời gian lưu (phút) | Diện tích pic (mAU.s) | Thời gian lưu (phút) | Diện tích pic (mAU.s) | ||
| 1 | 9,226 | 52808 | 10,454 | 95604 | 6,0 |
| 2 | 9,265 | 52619 | 10,454 | 95770 | 6,0 |
| 3 | 9,267 | 52703 | 10,453 | 95550 | 6,0 |
| 4 | 9,273 | 52747 | 10,456 | 95192 | 6,0 |
| 5 | 9,272 | 52142 | 10,456 | 95772 | 6,0 |
| 6 | 9,272 | 53051 | 10,455 | 96700 | 6,0 |
| TB | 9,269 | 52678 | 10,455 | 95765 | 6,0 |
| RSD (%) | 0,04 | 0,57 | 0,01 | 0,53 | 0 |
3.2.3. Độ tuyến tính
Từ các dung dịch chuẩn gốc desloratadin (0,1 mg/ ml) và natri benzoat (0,394 mg/ml) pha loãng chính xác với dung môi pha mẫu để thu được 06 dung dịch chuẩn có nồng độ khoảng 40 %, 60 %, 80 %, 100 %, 120 %, 150 % so với dung dịch chuẩn hỗn hợp. Tiến hành sắc ký theo điều kiện trên. Kết quả được trình bày trong Bảng 2.
Bảng 2. Kết quả khảo sát độ tuyến tính của phương pháp
|
STT |
Nồng độ dung dịch chuẩn gốc (mg/ml) |
Desloratadin | Natri benzoat | ||
| Nồng độ dung dịch (mg/ml) | Diện tích pic (mAU.s) | Nồng độ dung dịch (mg/ml) | Diện tích pic (mAU.s) | ||
| 1 | 40 % | 0,004 | 37610 | 0,016 | 21502 |
| 2 | 60 % | 0,006 | 57409 | 0,024 | 31618 |
| 3 | 80 % | 0,008 | 75070 | 0,032 | 41728 |
| 4 | 100 % | 0,010 | 96033 | 0,039 | 52813 |
| 5 | 120 % | 0,012 | 114233 | 0,047 | 62532 |
| 6 | 150 % | 0,015 | 143625 | 0,059 | 79005 |
| Phương trình hồi quy | Y = 9595051,546 x – 687,639 | Y = 1320863,664 x + 452,307 | |||
| Hệ số tương quan | 0,99987 | 0,99989 | |||
| % Hệ số chắn | 0,716 | 0,856 | |||
Kết quả khảo sát cho thấy có sự tương quan tuyến tính giữa diện tích pic và nồng độ từng chất phân tích trong khoảng nồng độ khảo sát với hệ số tương quan r gần bằng 1.
3.2.4. Độ chính xác
- Độ lặp lại của phương pháp: Tiến hành định lượng trên chế phẩm siro ho, lặp lại thí nghiệm với 6 mẫu thử. Kết quả được trình bày trong Bảng 3.
Bảng 3. Kết quả khảo sát độ lặp lại
|
TT |
Lượng mẫu thử đã sử dụng (g) |
Diện tích pic desloratadin (mAU.s) | Hàm lượng desloratadin (mg/ml) | Diện tích pic natri benzoat (mAU.s) | Hàm lượng natri benzoat (mg/ml)) |
| Dung dịch chuẩn: 0,01 mg desloratadin/ ml; 0,0394 mg natri benzoat/ml | 95764,67 | 52678,33 | |||
| 1 | 2,5441 | 92869 | 0,495 | 52421 | 2,008 |
| 2 | 2,5943 | 94037 | 0,492 | 53323 | 2,003 |
| 3 | 2,6108 | 96867 | 0,503 | 52813 | 1,972 |
| 4 | 2,6051 | 95447 | 0,497 | 54238 | 2,029 |
| 5 | 2,5885 | 93830 | 0,492 | 53481 | 2,014 |
| 6 | 2,5845 | 94522 | 0,496 | 53006 | 1,999 |
| Trung bình | 0,496 mg; n = 6; RSD = 0,86 % | 2,004 mg; n = 6; RSD = 0,96 % | |||
Kết quả ở Bảng 3 cho thấy phương pháp có độ lặp lại tốt đối với cả 2 hoạt chất (RSD < 2 %).
Độ chính xác trung gian: Xác định độ chính xác trung gian bằng cách xác định hàm lượng các hoạt chất trong 6 mẫu thử bởi kiểm nghiệm viên khác, thời điểm khác. Kết quả được trình bày trong Bảng 4.
Bảng 4. Kết quả khảo sát độ chính xác trung gian
|
TT |
Lượng mẫu thử đã sử dụng (g) |
Diện tích pic desloratadin (mAU.s) | Hàm lượng desloratadin (mg/ml) | Diện tích pic natri benzoat (mAU.s) | Hàm lượng natri benzoat (mg/ml) |
| Dung dịch chuẩn: 0,01 mg desloratadin/ml; 0,0392 mg natri benzoat/ml | 93989,33 | 52786,17 | |||
| 1 | 2,5994 | 92333 | 0,496 | 52665 | 1,961 |
| 2 | 2,5953 | 93891 | 0,505 | 53557 | 1,997 |
| 3 | 2,6009 | 93199 | 0,500 | 52922 | 1,969 |
| 4 | 2,5376 | 91885 | 0,506 | 52601 | 2,006 |
| 5 | 2,5939 | 94438 | 0,508 | 54338 | 2,027 |
| 6 | 2,5911 | 94490 | 0,509 | 54178 | 2,024 |
| Trung bình | 0,504 mg; n = 6; RSD = 1,00% | 1,997 mg; n = 6; RSD = 1,38 % | |||
| 2 KNV (n = 12) | RSD = 1,23 % | RSD = 1,14 % | |||
Kết quả ở bảng 4 cho thấy, phương pháp có độ chính xác tốt theo hướng dẫn ICH.
3.2.5. Độ đúng
Chuẩn bị 3 mẫu tự tạo ở mức nồng độ 70 %, 100 % và 130 % so với nồng độ định lượng bằng cách thêm vào một lượng chính xác mỗi chất chuẩn vào mẫu placebo. Tại mỗi mức nồng độ thực hiện trên 3 mẫu độc lập và đem phân tích theo điều kiện đã chọn. Tính lượng thu hồi của các chất phân tích. Kết quả được trình bày trong Bảng 5.
Bảng 5. Kết quả khảo sát độ đúng của phương pháp
|
TT |
%
thêm vào so với hàm lượng ghi trên nhãn |
Diện tích pic desloratadin (mAU.s) | %
thu hồi desloratadin |
Diện tích pic natri benzoat (mAU.s) | %
thu hồi natri benzoat |
| 1 | 70 % | 66310 | 98,92 | 36715 | 98,57 |
| 2 | 70 % | 66853 | 100,74 | 37009 | 101,87 |
| 3 | 70 % | 66894 | 99,29 | 36884 | 99,52 |
| 4 | 100 % | 96209 | 100,46 | 52597 | 98,85 |
| 5 | 100 % | 95154 | 100,37 | 52403 | 100,97 |
| 6 | 100 % | 95720 | 99,46 | 51998 | 98,21 |
| 7 | 130 % | 122114 | 98,09 | 67928 | 98,20 |
| 8 | 130 % | 121990 | 98,98 | 68602 | 101,68 |
| 9 | 130 % | 125771 | 100,52 | 68181 | 99,06 |
|
Trung bình (n = 9) |
99,65 % RSD = 0,92 % | 99,66 % RSD = 1,47 % | |||
Kết quả ở Bảng 5 cho thấy, phương pháp có độ đúng cao với trung bình phần trăm tỷ lệ thu hồi ở mỗi mức nồng độ đều thỏa mãn điều kiện từ 98,0 – 102,0 % và RSD < 2,0 %. Do đó, đảm bảo cho việc định lượng desloratadin và natri benzoat trong chế phẩm.
3.2.6. Khoảng xác định
Từ kết quả khảo sát độ đúng và độ tuyến tính, suy ra khoảng xác định của quy trình định lượng đã xây dựng là từ 0,007 – 0,013 mg/ml desloratadin và 0,02758 – 0,05122 mg/ml natri benzoat.
3.3. Ứng dụng định lượng các mẫu siro trên thị trường
Nhóm nghiên cứu thực hiện mua mẫu siro ho T01 và T02 có chứa đồng thời desloratadin và chất bảo quản natri benzoat của 02 công ty tại các nhà thuốc trên địa bàn Thành phố Hà Nội. Tiến hành định lượng đồng thời desloratadin và natri benzoat trong các mẫu theo phương pháp đã xây dựng.
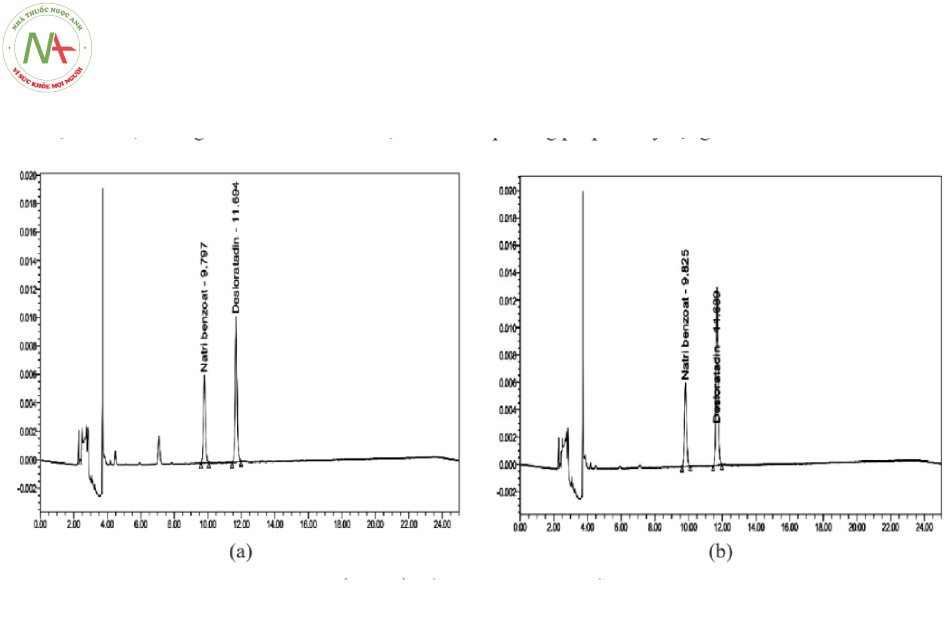
Kết quả hàm lượng desloratadin và natri benzoate trong 2 mẫu thử được trình bày trong Bảng 6.
Bảng 6. Kết quả định lượng các mẫu siro T01 và T02.
|
Mẫu thử |
Desloratadin | natri benzoat | |||||
| Hàm lượng (mg/ml) | Hàm lượng TB (mg/ml) | RSD
% |
Hàm lượng (mg/ml) | Hàm lượng TB (mg/ml) | RSD
% |
||
|
T01 |
T01.1 | 0,467 |
0,462 |
1,36 |
2,35 |
2,40 |
1,87 |
| T01.2 | 0,464 | 2,41 | |||||
| T01.3 | 0,455 | 2,44 | |||||
|
T02 |
T02.1 | 0,496 |
0,493 |
1,55 |
1,99 |
1,95 |
1,85 |
| T02.2 | 0,484 | 1,94 | |||||
| T02.3 | 0,498 | 1,92 | |||||
4. Kết luận
Qua khảo sát thực nghiệm, chúng tôi đã xây dựng được phương pháp định lượng đồng thời desloratadin và chất bảo quản natri benzoat trong siro bằng HPLC với điều kiện sắc ký đơn giản, dễ dàng, tiết kiệm có thể áp
dụng được ở các Trung tâm Kiểm nghiệm, các phòng thí nhiệm có máy HPLC. Phương pháp đã xây dựng có độ chính xác cao, độ đúng tốt, khoảng tuyến tính rộng để có thể phân tích đồng thời desloratadin và natri benzoat trong các chế phẩm siro ho đang lưu hành trên thị trường.
Tài liệu tham khảo
- Hội đồng Dược điển Việt Nam (2017), Dược điển Việt Nam V, 654-655.
- Medicines and Healthcare products Regulatory Agency (2021), British Pharmacopoeia, pp. 728-729.
- FDA (2003), Stability testing of new drug substances and products, Guidance for industry, Q1A (R2), Rockville,
- ICH (2003), Q1A (R2), Stability Testing of new Drug Substances and Products.
- Kumar Navneet, Sangeetha Dhanaraj, SUNIL REDDY Pingili, Prakash Lakkireddy (2012), “A validated stability- indicating RP-UPLC method for simultaneous determination of desloratadine and sodium benzoate in oral liquid pharmaceutical formulations”, Scientia pharmaceutica, 80(1), pp. 153-166.
- Rowe Raymond C, Sheskey Paul, Quinn Marian (2009), Handbook of pharmaceutical excipients, 627-629.
- The United States Pharmacopeial Convention (2021), The United States Pharmacopoeia, volume II, IV, pp. 3655- 3658,7876.
- Razib BM Mahbubul Alam, Ullah Md Ashik, et (2006), “Validation and application of a modified RP-HPLC method for the quantification of desloratadine in pharmaceutical dosage forms”, Dhaka University Journal of Pharmaceutical Sciences, 5(1), pp. 1-4.
