Bệnh hô hấp
Trao đổi khí trong hội chứng nguy kịch hô hấp cấp tính
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Bài viết Trao đổi khí trong hội chứng nguy kịch hô hấp cấp tính – tải file PDF Tại đây.
Bản dịch của BS. Đặng Thanh Tuấn – BV Nhi Đồng 1
Tóm tắt
Hội chứng nguy kịch hô hấp cấp tính (ARDS) được đặc trưng bởi sự suy giảm nghiêm trọng khả năng trao đổi khí. Giảm oxy máu chủ yếu là do shunt trong phổi, trong khi đó khoảng chết phế nang tăng lên giải thích sự thay đổi của thanh thải CO2. Đánh giá mức độ nghiêm trọng của suy giảm trao đổi khí là điều cần thiết để mô tả đặc điểm của hội chứng và đánh giá mức độ nghiêm trọng của nó. Các yếu tố gây nhiễu liên quan đến tình trạng huyết động có thể ảnh hưởng lớn đến mối quan hệ giữa mức độ nghiêm trọng của tổn thương phổi và mức độ thiếu oxy và/hoặc ảnh hưởng của việc cài đặt máy thở đến trao đổi khí. Ngoài các tình huống điều trị cấp cứu, mục tiêu trao đổi khí tối ưu trong ARDS đã trở nên ít được ưu tiên hơn so với việc ngăn ngừa thương tích. Một câu hỏi phức tạp đối với các bác sĩ lâm sàng là phải hiểu khi nào việc cải thiện oxygen hóa và thông khí phế nang có liên quan đến mức độ thấp hơn hoặc nguy cơ tổn thương phổi. Về vấn đề này, sự hiểu biết đầy đủ về cơ chế trao đổi khí trong ARDS là bắt buộc để hỗ trợ triệu chứng cá nhân cho bệnh nhân mắc ARDS.
Nội dung
Sinh lý bệnh trao đổi khí trong ARDS
Khái niệm về tỷ lệ thông khí-tưới máu
Khoảng chết
Phương trình khí phế nang
Hỗn hợp tĩnh mạch và shunt trong phổi
Đánh giá phân bổ của Éa/Ộ
Hình ảnh phân bổ của Éa/Ộ
Tác dụng của trọng lực
Trương lực mạch phổi
Các yếu tố ngoài phổi
Shunt ngoài phổi
Ứng dụng lâm sàng
Chẩn đoán và đánh giá mức độ nghiêm trọng
Mục tiêu điều trị
Biện pháp điều trị
Điều chỉnh cá nhân cài đặt máy thở
Giảm oxy máu và suy giảm khả năng thanh thải CO2 là đặc điểm của hội chứng nguy kịch hô hấp cấp tính (ARDS) (1 – 3). Tài liệu phong phú đã khám phá các cơ chế trao đổi khí bất thường trong ARDS. Bởi vì trao đổi khí vẫn là bất thường sinh lý chính được bác sĩ lâm sàng đánh giá, hiểu được sự phức tạp của các yếu tố tác động vẫn là nền tảng trong việc quản lý ARDS. Bài viết này xem xét các nguyên tắc cơ bản của trao đổi khí ở phổi, sinh lý bệnh của sự thay đổi trao đổi khí trong ARDS (Bảng 1), tác dụng của các biện pháp điều trị khác nhau (Bảng 2 và 3) và cách sử dụng đánh giá trao đổi khí để hỗ trợ triệu chứng cho từng cá nhân.
Bảng 1. Cơ chế sinh lý bệnh chính của tình trạng trao đổi khí bị suy giảm trong Hội chứng nguy kịch hô hấp cấp tính
| Rối loạn | Cơ chế chính |
| Thiếu oxy máu | Qs/Qt
Va/Q thấp PỸO2 thấp Shunt trong tim (ví dụ PFO) |
| tăng CO2 máu | Tăng Vd/Vt
Sự phân bố thông khí không đồng nhất (Va/Q cao) Tăng VCO2 |
Định nghĩa các chữ viết tắt: PFO = lỗ bầu dục; PVÚ2 = áp lực riêng phần O2 tĩnh mạch hỗn hợp; Qs/Qt = shunt phải sang trái trong phổi.
Bảng 2. Các biện pháp điều trị tình trạng thiếu oxy máu
| Điều trị | Tác động có lợi | Nguy cơ |
| F1O2 cao | Tăng PaO2, PaO2, và PνO2 | Xẹp phổi tái hấp thu Độc tính oxy |
| PEEP | Huy động phế nang với sự giảm Qs/Qt | Phổi quá căng Giảm Qt |
| Thở tự nhiên (ARDS nhẹ-vừa, giai đoạn sau cấp tính) | Huy động phế nang được cải thiện phù hợp Va/Q (chuyển hướng lưu lượng máu phổi đến các vùng được thông khí hơn) | Phổi quá căng VILI |
| Thủ thuật huy động | Huy động tạm thời và giảm Qs/Qt | Giảm thoáng qua Qt Chấn thương khí áp |
| Nằm sấp | Phân phối thông khí đồng nhất (cải thiện thông khí ở vùng lưng). Giảm Qs/Qt (tưới máu không thay đổi, chủ yếu hướng đến vùng lưng) | — |
| Định vị dọc | Huy động phế nang Tăng thể tích phổi | Hiệu ứng không thể đoán trước. Giảm Qt |
| Hít NO | Giảm Qs/Qt (cải thiện tưới máu vùng phổi được thông khí với mức tỷ lệ Va/Q bình thường) | Hiệu ứng nhất thời Hồi phục khi ngưng |
| Hít PGI2 | Giảm Qs/Qt (cải thiện tưới máu vùng phổi được thông khí với mức tỷ lệ Va/Q bình thường) | Hiệu ứng nhất thời Hồi phục khi ngưng |
| Almitrine tiêm tĩnh mạch | Giảm Qs/Qt (tăng trương lực mạch máu phổi) | Tăng hậu tải PAP và
RV |
Định nghĩa chữ viết tắt: ARDS = hội chứng nguy kịch hô hấp cấp tính; NO = oxit nitric; PaO2 = áp suất riêng phần oxy phế nang; PaO2 = áp suất riêng phần oxy động mạch; pap = áp lực động mạch phổi; peep = áp lực dương cuối thì thở ra; PGI2 = prostacyclin; PvO2 = áp lực riêng phần O2 tĩnh mạch hỗn hợp; Qs/Qt = shunt phải sang trái trong phổi; Qt = cung lượng tim; RV = tâm thất phải; VILI = tổn thương phổi do máy thở.
Bảng 3. Các biện pháp điều trị chứng tăng CO2 máu
| Điều trị | Tác động có lợi | Nguy cơ |
| An thần ± liệt cơ | Giảm VCO2 | Cai máy thở muộn |
| Kéo dài thời gian tạm dừng hít vào | Cải thiện tính đồng nhất của phân phối thông khí | Tăng PEEPi và PEEPtot (rút ngắn thời gian thở ra) |
| Tăng nhịp hô hấp | Tăng Ve | Tăng PEEPi và PEEPtot (rút ngắn thời gian thở ra) |
| Giảm khoảng chết của dụng cụ | Giảm Vd/Vt | — |
| TGI | Giảm Vd/Vt do giảm khoảng chết đường thở | Tăng PEEPi và PEEPtot Đo Vt không chính xác Tổn thương khí quản |
| Nằm sấp | Đồng nhất hóa phân phối thông khí | Hiệu ứng khó lường |
Định nghĩa các chữ viết tắt: peep = áp lực dương cuối thì thở ra; PEEPi = peep nội tại; PEEPtot = tổng PEEP; TGI = Phụt khí khí quản.
Sinh lý bệnh trao đổi khí trong ARDS
Khái niệm về tỷ lệ thông khí-tưới máu
Khái niệm về tỷ lệ thông khí/tưới máu phế nang (Va/Q) ngụ ý rằng cần có một tỷ lệ tối ưu để đạt được sự trao đổi khí bình thường và sự mất cân bằng trong tỷ lệ toàn cục và/hoặc khu vực này là một trong số ít lý do cơ bản giải thích việc trao đổi khí bất thường: tỷ lệ Va/Q thấp (tức là vùng phổi nơi tưới máu vượt quá thông khí rõ rệt) gây ra tình trạng thiếu oxy máu và tỷ lệ Va/Q cao (tức là các vùng phổi nơi thông khí vượt quá tưới máu rõ rệt) gây ra chứng tăng CO2 máu. Sự khuếch tán bị suy giảm là một cơ chế khác có thể xảy ra ở bề mặt phân cách khí-máu. Tuy nhiên, ở những khu vực được thông khí trong ARDS, do hệ số khuếch tán CO2 cao và gradient khuếch tán O2 tăng do F1O2 cao gây ra, sự cân bằng áp suất riêng phần khí giữa pha máu và pha khí hoàn tất trong một đơn vị trao đổi khí chức năng (tức là phế nang và mao mạch tương ứng). Do đó, sự khuếch tán kém qua hàng rào khí-máu dường như không đóng bất kỳ vai trò nào trong các bất thường trao đổi khí trong ARDS (4, 5). Do đó, với một FiO2 cho trước, tổng cung lượng tim (Qt), nồng độ Hb và tỷ lệ trao đổi hô hấp (respiratory exchange ratio, RER; tỷ lệ sản xuất CO2 và tiêu thụ O2 toàn cơ thể, VCO2/VO2, thường là 0,8 khi nghỉ ngơi với chế độ ăn bình thường), trao đổi khí bị suy giảm được giải thích bằng sự thay đổi phân bố thông khí và tưới máu phế nang (Va/Q) (6 – 8).
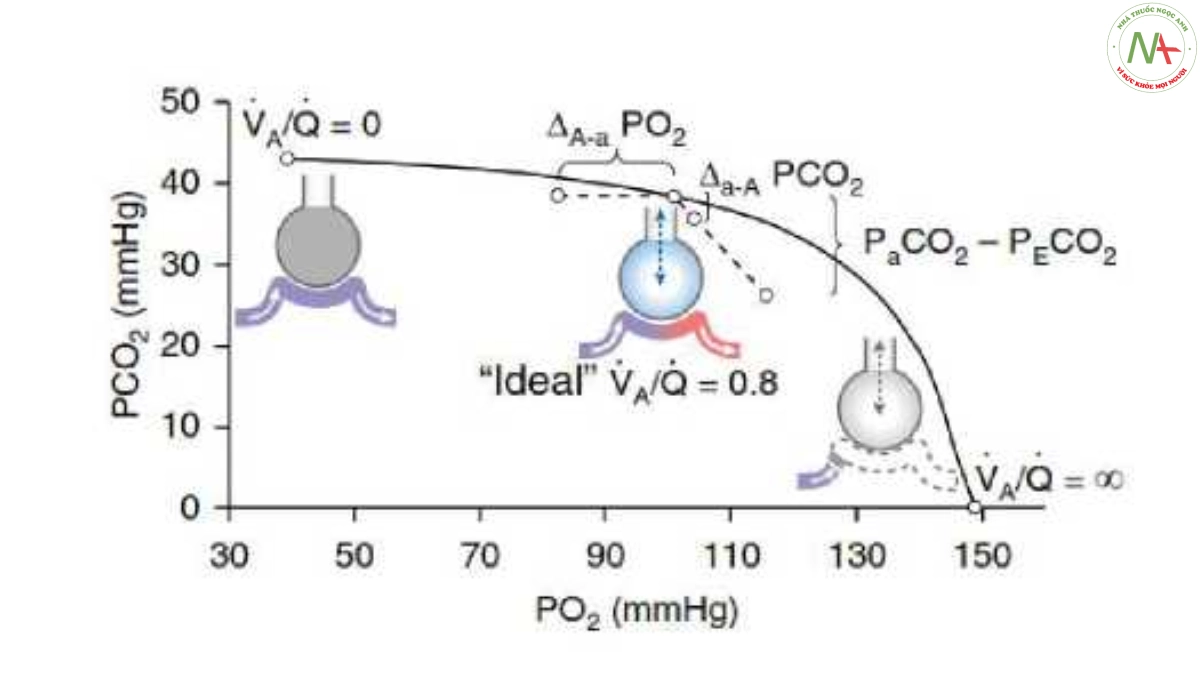
Tỷ lệ Va/Q có thể thay đổi từ 0 (phế nang được tưới máu nhưng không được thông khí; áp suất riêng phần khí là áp lực của máu tĩnh mạch hỗn hợp), còn được gọi là shunt, đến vô cực (o>) (phế nang thông khí nhưng không được tưới máu; áp suất riêng phần khí là áp suất của khí hít vào), được gọi là khoảng chết (Hình 1). Trong một phổi đồng nhất (tức là có tỷ lệ Va/Q [i] lý tưởng tương ứng với RPR), áp suất riêng phần khí động mạch (a) và phế nang trung bình (a) bằng nhau (Hình 1). Tuy nhiên, ngay cả một lá phổi khỏe mạnh cũng bao gồm các vùng có tưới máu vượt quá thông khí (tức là 0 < Va/Q < i) và khi thông khí vượt quá tưới máu (tức là 1 < Va Q</). Bởi vì máu động mạch là tổng lượng máu từ tất cả các đơn vị trao đổi khí, bất kỳ sự không tương xứng Va/Q sẽ gây ra sự chênh lệch áp suất riêng phần khí phế nang-động mạch (A-a). Càng nhiều tưới máu vượt quá thông khí, PaƠ2 sẽ giảm càng nhiều, làm tăng P(A-a)O2. Để mô tả không khí phế nang lý tưởng và phân tích mối quan hệ thông khí-tưới máu trong phổi, Riley và Cournand đã mô tả một mô hình đơn giản với ba ngăn (tỷ lệ bình thường [tức là, Va/Q = RER], shunt [tức là, Va/Q = 0] và khoảng chết [tức là Va/Q = O)]), được hiển thị trong Hình 2(9). Tăng tỷ lệ Va/Q bằng cách tăng thông khí phút (Ve) không thể bù đắp cho ảnh hưởng này, vì (1) đóng góp tương đối nhỏ vào Qt vùng phổi nơi thông khí vượt quá tưới máu rõ rệt (nghĩa là Va/Q > 10), và (2) nồng độ O2 trong máu cuối mao mạch hầu như không thay đổi do đường cong phân ly Hb-O2 sigmoid ở những vùng này. Do đó, tăng F1O2 và /hoặc tái thông khí các vùng phổi không được thông khí là nền tảng trong việc kiểm soát tình trạng thiếu oxy trong ARDS. Ngược lại, P(A-a)CO2 sẽ chỉ phát triển khi phế nang có nồng độ rất cao.Tỷ lệ Va/Q góp phần vào tổng thông khí. Nói cách khác PaCO2 sẽ chỉ tăng khi Ve tỷ lệ thuận với VCO2 không còn có thể bù đắp cho sự phân bổ thông khí trong phổi không đồng nhất.
Tóm lại, ở những bệnh nhân mắc ARDS, nguyên nhân ở phổi dẫn đến suy giảm trao đổi khí hầu như chỉ liên quan đến rối loạn sự tương xứng Va và Q giữa các cơ quan trong cơ thể. (6 – 8, 10). Trong khi tình trạng thiếu oxy máu là kết quả của lưu lượng máu đến các vùng phổi không được thông khí và/hoặc giảm thông khí, thì khả năng đào thải CO2 bị suy giảm chủ yếu là do sự góp phần của các vùng không được và/hoặc bị giảm tưới máu (7, 8, 10).
Hình 1. Biểu đồ PO2/PCO2 cho đơn vị trao đổi khí đơn tại FiO2 = 0,21 và tỷ lệ trao đổi CO2/O2, (tức là tỷ lệ trao đổi hô hấp [RER] = VCO2/VO2 = 0,8). Với bất kỳ nồng độ FiO2, Hb và RER nào cho trước, mỗi tỷ lệ Va/Q trong một đơn vị trao đổi khí được liên kết với một cặp giá trị PO2 và PCO2. Tỷ lệ Va/Q có thể thay đổi từ 0 (phế nang được tưới máu nhưng không được thông khí; áp suất riêng phần khí của chúng là áp suất của máu tĩnh mạch hỗn hợp) đến (phế nang được thông khí nhưng không được tưới máu; áp suất riêng phần khí của chúng là áp suất riêng phần của khí hít vào); một đường nối các giá trị cực trị này có thể được vẽ qua tất cả các cặp PO2/PCO2 có thể có. Trong một phổi không có tính không đồng nhất, áp suất riêng phần khí động mạch (a) và phế nang trung bình (A) sẽ được đặt ở mức tỷ lệ Va/Q “lý tưởng ” (i) tương ứng với RER. Máu động mạch là tổng lượng máu từ tất cả các đơn vị trao đổi khí riêng lẻ, nghĩa là những nơi mà tưới máu (tức là lưu lượng máu) vượt quá thông khí hoặc nơi không có thông khí nào cả (tức là 0 < Va/Q < i), cũng như những nơi thông khí vượt quá tưới máu hoặc không có tưới máu nào cả (tức là i < Va/Q < w). Do đó, các cặp giá trị thực của áp suất riêng phần động mạch và khí phế nang trung bình di chuyển ra khỏi đường này, dẫn đến sự phát triển của chênh lệch (A) áp suất riêng phần động mạch-phế nang (a-A). PeCO2 = áp suất riêng phần CO2 thở ra hỗn hợp; Va = thông khí phế nang. Được điều chỉnh theo sự cho phép từ Tài liệu tham khảo 6.
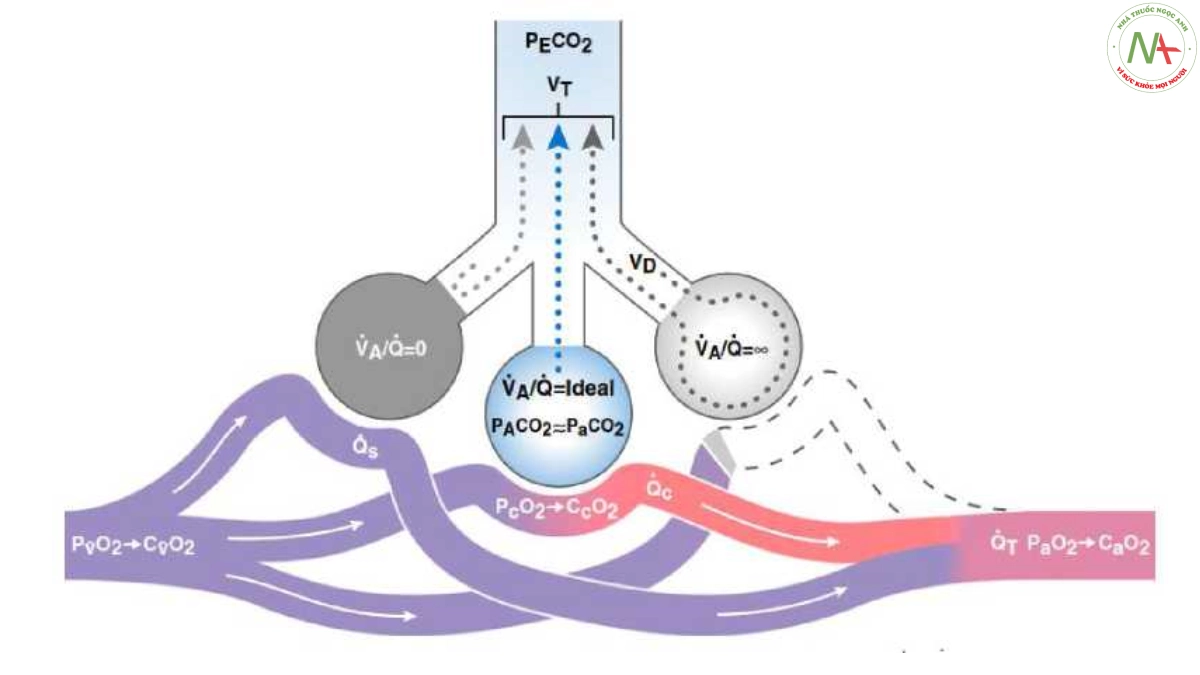
Hình 2. Mô hình ba ngăn của Riley và Cournan (9). Tỷ lệ Va/Q thấp (tức là các vùng phổi nơi tưới máu vượt quá thông khí rõ rệt) và các vùng phổi hoàn toàn không được thông khí được biểu diễn cùng nhau dưới dạng lưu lượng máu bị shunt (“lãng phí”) (shunt từ phải sang trái, Qs/Qt), trong khi cao Va/Q các tỷ lệ (tức là các vùng phổi nơi thông khí vượt quá tưới máu rõ rệt) và các vùng phổi hoàn toàn không được tưới máu được biểu thị cùng nhau là thông khí “lãng phí” (khoảng chết, Vd/Vt), hay nói cách khác, là các vùng phổi không tham gia trao đổi khí phế nang. CaỠ2 = nồng độ O2 động mạch; CcỠ2 = nồng độ O2 mao quản lý tưởng; CỮO2 = nồng độ O2 tĩnh mạch hỗn hợp; PaCO2 = áp suất riêng phần CO2 phế nang; PcO2 = áp suất riêng phần máu mao mạch lý tưởng O2; PeCO2 = áp suất riêng phần CO2 thở ra hỗn hợp; PvO2 = PO2 tĩnh mạch hỗn hợp; Qc = lưu lượng máu mao mạch lý tưởng; Qs = lưu lượng máu shunt; Qt = tổng lưu lượng máu; ỹA = thông khí phế nang. Minh họa của Jacqueline Schaffer.
Khoảng chết
Một nhịp thở khí lưu thông, Vt và thể tích thở ra trên một đơn vị thời gian, Ve, bao gồm một thành phần không góp phần trao đổi khí, khoảng chết (Vd và Vd tương ứng), cũng như thể tích khí được cung cấp cho phế nang (Va và Va, tương ứng):
Vt = Vd + Va (1A)
và
Ve = Vd + Va (1B)
Thông khí khoảng chết bao gồm thành phần giải phẫu (đường dẫn khí) và thành phần phế nang (phế nang được thông khí nhưng không được tưới máu và/hoặc phế nang được thông khí quá mức so với tưới máu). Theo mô hình nêu trên của Riley và Cournand (9), khoảng chết có thể được coi là thông khí “lãng phí”. Vì CO2 bị loại bỏ trong khí thở ra (VCO2) chỉ có thể bắt nguồn từ các bộ phận trao đổi khí của phổi, Ve là tổng lượng khí thở vào không tham gia trao đổi khí (Vd) được thêm vào khí phế nang vận chuyển CO2 (Va). vì F1CO2 ~ 0 và PaCO2 – PaCO2, VCO2 = Ve X FeCO2 = Vd X F1CO2 + Va X FaCO2, (2)
(trong đó FeCO2, F1CO2, và FaCO2 lần lượt là các tỷ lệ hỗn hợp CO2 thở ra, hít vào và phế nang), thay
thế Va và viết lại phương trình 2 theo hiệu suất
PCO2
Vd/Ve = Vd/Vt = (PaCO2 – FECO2)/PaCO2 (3)
Phương trình này thể hiện sự định lượng đơn giản của Vd/Vt tổng thể theo Enghoff (11). Nếu PaCO2 thực sự bằng PaCO2 — điều này thường không xảy ra, đặc biệt là trong ARDS — Vd/Vt, theo Enghoff (11), bằng khoảng chết giải phẫu. Trên cơ sở các giả định nêu trên rằng F1CO2 ~ 0 và PaCO2 ~ PaCO2, Phương trình 2 có thể được viết lại:
VCO2 = Va X k X PaCO2 (4)
(k = 0,863 đối với mm Hg và ml, k = 2,561 đối với đơn vị SI) hoặc, đối với một giá trị nhất định của VCO2,
Va ~1/PaCO2 (5)
(Va tỷ lệ nghịch với PaCO2). Nói cách khác, PaCO2 là hàm của Va tỷ lệ với VCO2. Do đó, (1) với một Va, VCO2 chuyển hóa xác định PaCO2, và (2) bất kỳ sự gia tăng nào trong Vd/Vt yêu cầu đều tăng theo Ve để duy trì PaCO2.
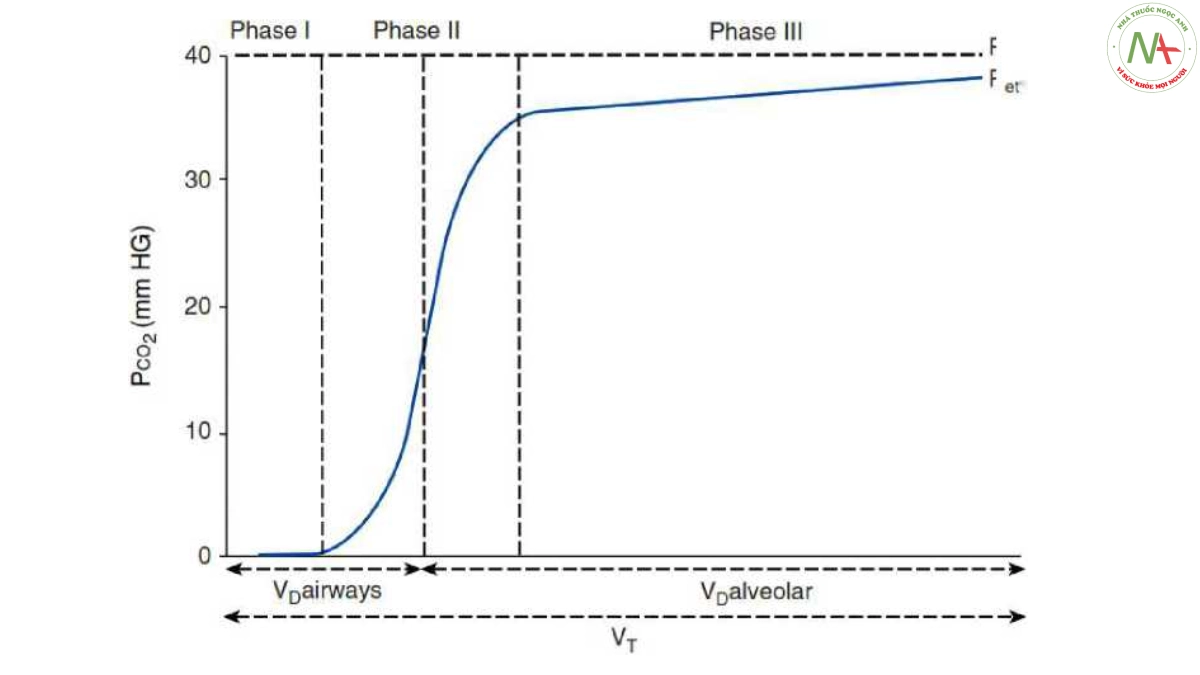
Khoảng chết được chia cổ điển thành hai thành phần, khoảng chết đường thở và khoảng chết phế nang (12). Áp dụng phương pháp do Fowler đề xuất cho N2 (13) thành CO2, Fletcher và Jonson đã đề xuất một phân tích đồ họa về áp suất CO2 riêng phần thở ra hỗn hợp (PeCO2)/Ve.
Hình 3: PCO2 thở ra là hàm số của thể tích thở ra. “Giai đoạn I” dùng để chỉ khí không có CO2 từ đường dẫn khí. “Giai đoạn II” đề cập đến phần dốc hình chữ S của đường cong PCO2 thở ra (nghĩa là sự chuyển tiếp giữa khí từ đường thở và khí phế nang), trong khi “Giai đoạn III” đề cập đến giai đoạn phế nang gần bình nguyên cho đến khi kết thúc- đạt được PCO2 cuối triều (PETCO2), cho phép tính Vd/Vt bằng phương trình Enghoff (11) và phân chia khoảng chết giữa đường thở (giải phẫu) và thành phần phế nang theo Fletcher và đồng nghiệp (14). PaCO2 = áp suất riêng phần CO2 phế nang. Được điều chỉnh theo sự cho phép từ Tài liệu tham khảo 248.
Đường cong có tên là “capnography theo thể tích”, cho phép tính Vd/Vt bằng phương trình Enghoff và sự phân chia giữa đường thở (giải phẫu) và khoảng chết phế nang (Hình 3) (14).
Tóm lại, ở những bệnh nhân mắc ARDS, độ thanh thải CO2 bị suy giảm chủ yếu là do tăng Vd/Vt (tức là thông khí “lãng phí”) ở các vùng phổi được thông khí nhưng không được tưới máu (9). Do đó, ngày càng tăng Ve và/hoặc giảm Vd (xem bên dưới) có thể cho phép duy trì PaCO2; tăng CO2 sẽ xảy ra khi tăng Ve tỷ lệ thuận với VCO2 chuyển hóa không còn có thể bù đắp cho sự phân bố thông khí không đồng nhất (7 – 9).
Phương trình khí phế nang
Như đã đề cập, PaCO2 thường được sử dụng làm đại diện thay thế cho PaCO2, mặc dù cách tính gần đúng này là sai, đặc biệt là trong ARDS nặng, khi P(A-a)CO2 từ 10 đến 15 mm Hg có thể phát triển. Trong điều kiện bình thường, P(A-a)O2 có độ lớn như vậy, nhưng trong ARDS, P(A-a)O2 này có thể cao hơn nhiều lần và nó phản ánh định nghĩa ARDS yêu cầu tăng FiO2.
Về mặt lý thuyết, để định lượng P(A-a)O2, PaO2 có thể được tính sau khi thay PaCO2 cho PaCO2 và hiệu chỉnh cho RER # 1:
PaO2 = P1O2 – PaCO2 X [F1O2 + (1 – PiO2)/RER] (6)
(trong đó PiO2 là áp suất riêng phần oxy hít vào). PAO2 được tính toán này đề cập đến PO2 trung bình phế nang lý tưởng tổng thể của một phổi đồng nhất. Tuy nhiên, trong ARDS, PaO2 có thể thay đổi đáng kể ở các vùng phổi khác nhau do sự phân bố thông khí phế nang không đồng nhất. Do đó, trong thực hành lâm sàng, việc hiệu chỉnh phức tạp này đối với phép tính PaO2 là không cần thiết, do đó chỉ cần xấp xỉ giá trị là đủ, đặc biệt ở mức FiO2 cao (15):
PaO2 ~ P1O2 – PaCO2/0,8 (7)
Hỗn hợp tĩnh mạch và shunt trong phổi
Lưu lượng máu phổi (“tưới máu”) đảm bảo CO2 và O2 được vận chuyển từ các mô đến phổi và ngược lại. Tuần hoàn phổi là duy nhất vì (1) tổng cung lượng tim (Qt) đi qua một cơ quan; và (2) do áp suất thấp nên sự phân bố dòng chảy và do đó sức cản mạch máu phổi phụ thuộc vào áp lực phế nang xung quanh.
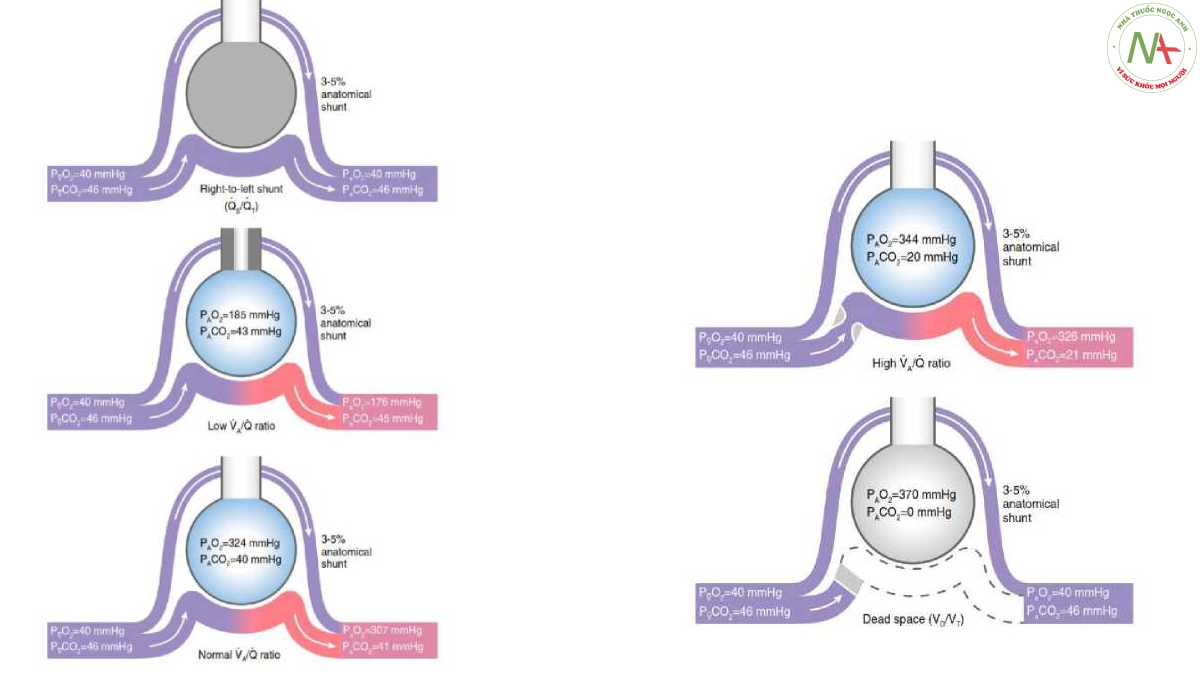
Lưu lượng máu phổi (Qt) bao gồm dòng chảy qua các vùng phổi được thông khí bình thường và thành phần “shunt”, thành phần sau bao gồm các cấu trúc giải phẫu không tiếp xúc với khí phế nang (tĩnh mạch Thebesian và tĩnh mạch phế quản), và thành phần phế nang có nguồn gốc từ không được thông khí (shunt từ phải sang trái, Qs) và/hoặc phế nang giảm thông khí. Thành phần phế nang này được gọi là “shunt sinh lý” hoặc “hỗn hợp tĩnh mạch” (Qva). Theo mô hình của Riley và Cournand (9) và tương tự với Vd/Vt, nó có thể được coi là lưu lượng máu phổi “lãng phí”: áp suất riêng phần khí máu từ các vùng này bằng hoặc chỉ cao hơn một chút so với các tĩnh mạch hỗn hợp, và do đó là nguyên nhân gây thiếu oxy động mạch. Qva có thể được định lượng theo giả định rằng tổng lưu lượng máu phổi (Qt) là tổng của Qva và máu mao mạch đến từ phế nang với tỷ lệ Va/Q lý tưởng (Qc) (9) (Hình 2):
Qt = Qva + Qc, (8A)
hoặc viết lại dưới dạng lượng O2 được vận chuyển:
Qt X CaO2 = Qva X CvO2 + Qc X CcO2, (8B) với CaO2, CVO2 và CcO2 lần lượt là giá trị nồng độ O2 trong động mạch, tĩnh mạch hỗn hợp và mao mạch lý tưởng. Để tính CcO2, PaO2 được tính gần đúng bằng Công thức 6 hoặc 7, và ở những bệnh nhân mắc ARDS, độ bão hòa Hb-O2 mao mạch lý tưởng có thể được giả định là 100%, vì thường FiO2 lớn hơn 0,3 đến 0,4. Hợp nhất các phương trình 8A và 8B sẽ thu được phương trình Berggren (16):
Qva/Qt = (CcO2 – CaO2)/(CcO2 – CVO2). (9)
Định lượng của Qva/Qt yêu cầu đặt ống thông tim phải để lấy mẫu máu động mạch phổi. Hơn thế nữa, Qva/Qt không thể phân biệt giữa phế nang hoàn toàn không được thông khí (Qs) và vùng phổi bị giảm thông khí với mức độ tỷ lệ Va/Q thấp (thường được định nghĩa là Va/Q< 0,1). Sự khác biệt này hoàn toàn không mang tính học thuật: trong khi áp suất riêng phần khí máu ở các phế nang không được thông khí không phản ứng với sự gia tăng FiO2, FiO2 cao hơn sẽ cho phép điều chỉnh ít nhất một phần tình trạng thiếu oxy động mạch ở các vùng phổi bị giảm thông khí (Hình 4). Về mặt lý thuyết, việc chuyển từ thông khí FiO2 duy trì sang thông khí O2 tinh khiết cho phép tách biệt hai nguyên nhân chính ở phổi gây ra tình trạng thiếu oxy máu động mạch: việc thải N2 từ phế nang được thông khí sẽ điều chỉnh đối với bất kỳ tình trạng thiếu oxy máu nào liên quan đến các vùng phổi có mức độ tỷ lệ Va/Q thấp. Tuy nhiên, thời gian cần thiết để khử nitơ hoàn toàn vẫn chưa được xác định do sự phân bố không đồng nhất sâu sắc của Va (ví dụ, đặc biệt ở bệnh nhân mắc ARDS). Hơn nữa, sự điều động này có thể làm tăng Qs (17, 18): (1) trong phế nang “không ổn định” với mức độ tỷ lệ Va/Q rát thấp, xẹp phổi tái hấp thu có thể phát triển (19) khi lượng khí vào phế nang thấp hơn lượng khí hấp thu vào máu (20); và (2) sự gia tăng do tăng oxy máu của cả áp suất riêng phần O2 tĩnh mạch hỗn hợp (PỸO2) và PaO2 có thể ức chế sự co mạch phổi do thiếu oxy (21 – 24) và do đó làm suy giảm quá trình trao đổi khí. Về mặt lý thuyết, phân tích gradient áp suất riêng phần N2 động mạch-phế nang (P[A-a]N2) cho phép phân biệt giữa Qs/Qt và Va/Q thấp, nhưng quyết tâm của nó là không thực tế về mặt kỹ thuật ở đầu giường (25).
Cần lưu ý rằng mức độ cao của Qs/Qt cũng sẽ làm tăng P(A-a)CO2 và do đó Vd/Vt được tính bằng công thức Enghoff, vì PCO2 của máu có nguồn gốc từ các vùng phổi này là PCO2 tĩnh mạch hỗn hợp (PỸCO2) (26). Hiệu ứng này được thể hiện rõ rệt ở mức Qt thấp, thiếu máu và/hoặc nhiễm toan chuyển hóa do chênh lệch tăng giữa PỸCO2 và PaCO2 (27).
Tóm lại, ở bệnh nhân mắc ARDS, tình trạng thiếu oxy máu là do tăng Qva/Qt (tức là tưới máu “lãng phí” có nguồn gốc từ không- [Qs/Qt hoặc shunt] và/hoặc vùng phổi giảm thông khí [tỷ lệ Va/Q thấp]) (10).
Hình 4. Các giá trị hỗn hợp điển hình của PO2 và PCO2 tĩnh mạch, phế nang (A), và động mạch ở các vùng phổi không có thông khí (shunt phải sang trái, Qs/Qt), trong đó tưới máu (tức là lưu lượng máu) vượt quá thông khí (tức là 0 < Va/Q < Va/Q bình thường; tức là tỷ lệ Va/Q “thấp”), trong đó thông khí vượt quá tưới máu (nghĩa là tỷ lệ Va/Q bình thường < Va/Q < m; tức là Va/Q “cao” hoặc ở nơi hoàn toàn không có tưới máu (khoảng chết, Vd/Vt) ở nồng độ O2 hít vào FiO2 = 0,5, nồng độ Hb = 150 g/L và tỷ lệ trao đổi hô hấp = 0,8. PVCO2 = PCO2 tĩnh mạch hỗn hợp; PvO2 = PO2 tĩnh mạch hỗn hợp. Minh họa của Jacqueline Schaffer.
Tăng tỷ lệ Va/Q bằng cách tăng Ve không thể bù đắp cho tác động này, và do đó, việc tăng FiO2 và /hoặc tái thông khí các vùng phổi không được thông khí là nền tảng trong việc kiểm soát tình trạng thiếu oxy trong ARDS. Mặc dù Qs/Qt không đáp ứng với việc tăng FiO2, FiO2 cao hơn cho phép điều chỉnh ít nhất một phần tình trạng thiếu oxy máu động mạch do Va/Q thấp (6 – 8, 10).
Đánh giá phân bổ của Va/Q
Như đã đề cập ở trên, mô hình ba ngăn (9) biểu thị tất cả thông khí “lãng phí” dưới dạng Vd/V t (tức là các vùng phổi được thông khí nhưng không được tưới máu) và tất cả tưới máu “lãng phí” như Qs/Qt, (tức là lưu lượng máu qua các vùng phổi không được thông khí). Phân bổ thông khí/tưới máu hầu như liên tục giả định mô hình phổi 50 ngăn bao trùm toàn bộ phạm vi các tỷ lệ Va/Q có thể được mô tả bằng “kỹ thuật loại bỏ nhiều khí trơ” (MIGET) (28, 29). MIGET sử dụng động học liên quan đến độ hòa tan của các khí trơ về mặt sinh lý, chỉ hòa tan về mặt vật lý ở nồng độ vết. Trong quá trình truyền liên tục hỗn hợp khí có hệ số phân chia khí-máu trong phạm vi năm bậc duy trì độ lớn (R = Pa/PV) và bài tiết (E = Pe/PV) được xác định theo nguyên lý bảo toàn khối lượng:
Pa/PV = X/(X + Va/Q), (10)
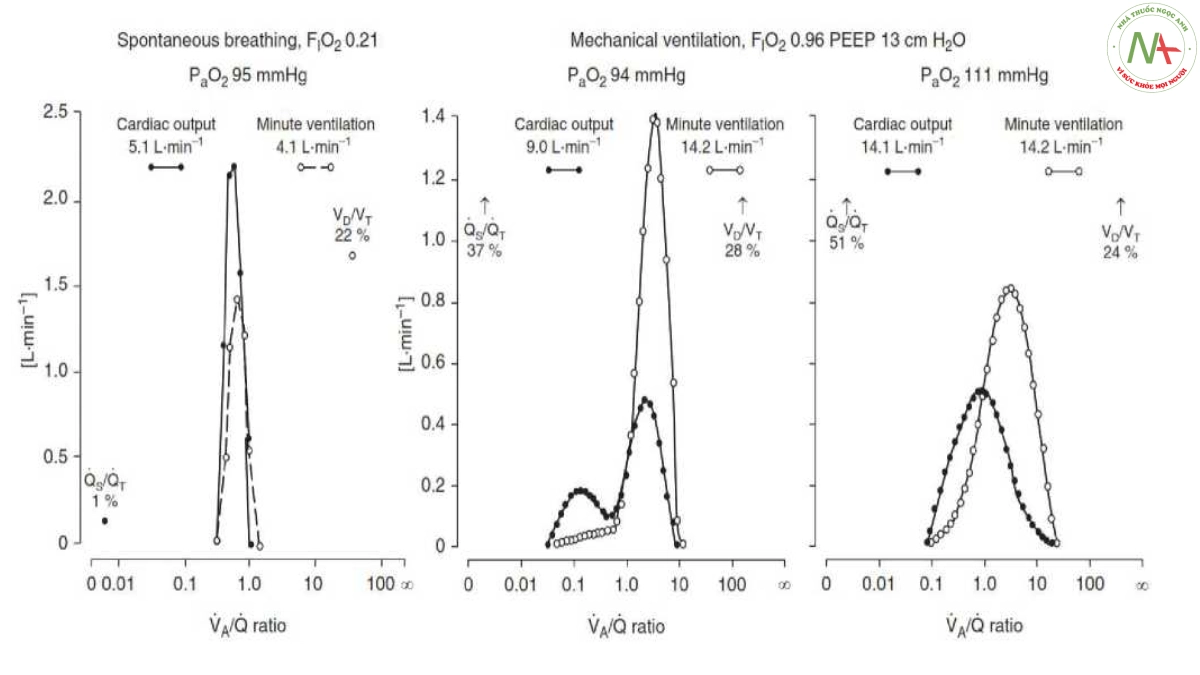
với Pa, Pa, PV và Pe là áp lực khí trơ phế nang, động mạch, tĩnh mạch hỗn hợp và hỗn hợp thở ra và X là hệ số phân chia khí-máu đặc trưng của chất (30). Các ví dụ điển hình về một tình nguyện viên trẻ khỏe mạnh và một bệnh nhân mắc ARDS (trước và trong khi truyền tĩnh mạch prostacyclin) được thể hiện trong Hình 5. Lấy mẫu động mạch phổi, và do đó đặt ống thông tim phải, là không bắt buộc, vì với cung lượng tim sẵn có, khí trơ PV có thể được tính từ các giá trị Pe và Pa bằng nguyên lý Fick (28). MIGET đã chứng minh rằng bệnh nhân mắc ARDS có sự phân bố hai chiều của cả lưu lượng máu phổi và thông khí phế nang (Hình 5) (9): thiếu oxy máu là do tỷ lệ máu chảy đến vùng phổi có shunt phải sang trái cao (Qs/Qt) (ví dụ, phế nang bị xẹp và/hoặc bị ngập) cùng với mức Va/Q thấp (Va/Q< 0,1) ở một số bệnh nhân. Sự suy giảm khả năng loại bỏ CO2 là do thông khí khoảng chết thực sự (Vd/Vt) cộng với một số thông khí “lãng phí” bổ sung ở các vùng phổi bị giảm tưới máu (9, 31 – 41).
Hình ảnh phân bổ của Va/Q
MIGET chỉ có thể đưa ra các phân tích định lượng mà không có thông tin địa hình về tỷ lệ thông khí/tưới máu (42). Nhiều kỹ thuật hình ảnh khác nhau đã được đề xuất, chẳng hạn như kết hợp hít 133Xe hoặc 81mKr và sau đó truyền các khí này hòa tan trong dung dịch (43, 44); cộng hưởng từ sử dụng mật độ proton, tạo ảnh siêu phân cực 3He, hoặc 129Xe (45 – 47); Chụp cắt lớp phát xạ positron sử dụng nước đánh dấu H215O, 13N2 hòa tan trong nước muối hoặc 18F-fluoro-2-deoxy-glucose phát hiện chuyển hóa tế bào viêm (48 – 50); và chụp cắt lớp trở kháng điện (51 – 54). Những kỹ thuật này cung cấp thông tin về phân bố không gian và cho phép đánh giá độc lập về giá trị tuyệt đối V và Q (tức là không chỉ về sự phân bố của tỷ lệ V/Q). Hình ảnh định lượng tương ứng V và Q khó có được sự phân bố, đặc biệt là do việc lập bản đồ có độ phân giải không gian cao bắt buộc của cùng một vùng phổi. Hơn nữa, những kỹ thuật này rất tốn kém và cần phải vận chuyển bệnh nhân. Do đó, ngoại trừ chụp cắt lớp trở kháng điện, chúng khó có thể đạt được tiềm năng theo dõi tại giường bệnh (55 – 57).
Tác dụng của trọng lực
Lực hấp dẫn là yếu tố chính quyết định sự phân bố thông khí và tưới máu: ở tư thế thẳng đứng, lưu lượng máu tăng gần như tuyến tính từ đỉnh phổi đến đáy do lực hấp dẫn. Thông khí phế nang cũng theo mô hình này, độ dốc phẳng hơn nhiều. Sự thay đổi liên quan đến lực hấp dẫn này của sự phân bố của tỷ lệ Va/Q có thể được hình dung bằng cách sử dụng kỹ thuật hình ảnh (55 – 57). Bởi vì sự thay đổi phụ thuộc vào trọng lực của lưu lượng máu phổi này rõ rệt hơn so với thông khí phế nang, tỷ lệ Va/Q giảm từ đỉnh đến đáy phổi, hoặc ở tư thế nằm ngửa, từ vùng bụng đến vùng lưng phổi. Ở những người tình nguyện khỏe mạnh ở tư thế nửa nằm, tỷ lệ Va/Q có thể dao động từ 0,3 đến 2,1 từ đỉnh đến đáy (58), trong khi bệnh nhân mắc ARDS biểu hiện mức độ biến thiên lớn hơn nhiều. Do đó, tỷ lệ Va/Q thấp nhất và Qs/Qt thường hiện diện ở các vùng phổi phụ thuộc. Dữ liệu thu được ở tư thế nằm sấp phù hợp với khái niệm về ảnh hưởng của trọng lực: thủ thuật này thực sự làm giảm Qs/Qt có lợi cho việc tăng lưu lượng máu đến các vùng phổi được thông khí tốt (32, 59, 60). Ở một số bệnh nhân, tác dụng này được tăng cường hơn nữa bằng cách thêm oxit nitric dạng hít (NO) và/hoặc truyền almitrine (61 – 65).
Một số cơ chế đã được xác định để giải thích tác dụng có lợi của tư thế nằm sấp đối với quá trình oxygen hóa. Đầu tiên, tư thế nằm sấp làm giảm chênh lệch áp lực màng phổi và đồng nhất áp lực xuyên phổi qua phổi (66 – 68). Một số yếu tố có thể giải thích tác động này của tư thế nằm sấp, bao gồm sự đảo ngược độ dốc trọng lượng phổi do trọng lực (69, 70), loại bỏ lực nén của tim lên vùng lưng phổi (71, 72) và giải phóng lực nén của các tạng trong ổ bụng ở vùng đuôi của phổi sau (73, 74). Hiệu ứng thực sự là sự đồng nhất hóa của bơm phồng phổi theo vùng, tăng ở vùng lưng phổi và giảm ở vùng bụng (75). Ngoài ra, cả nghiên cứu trên động vật và người đều cho thấy rằng sự phân bố lưu lượng máu phổi, phổ biến ở phổi lưng ở tư thế nằm ngửa, không thay đổi đáng ngạc nhiên khi bệnh nhân nằm sấp (76 – 79). Do đó, sự cải thiện lượng oxygen hóa ở tư thế nằm sấp là do giảm Qs/Qt là kết quả của sự gia tăng đồng thời thông khí ở các vùng phổi phía sau, với việc huy động vùng lưng lớn hơn sự mất huy động ở vùng bụng và sự tưới máu phổi tốt hơn ở những vùng này.
Tóm lại, có một sự biến đổi khu vực liên quan đến lực hấp dẫn rõ rệt của tỉ lệ Va/Q, với Qs/Qt đặc biệt hiện diện ở các vùng phổi phụ thuộc. Tác dụng trao đổi khí có lợi của tư thế nằm sấp chủ yếu là do lưu lượng máu phổi cao hơn ở những vùng được thông khí tốt hơn ở tư thế nằm sấp (32).
Trương lực mạch phổi
Trương lực mạch máu phổi có thể gây ra các triệu chứng sự khác biệt Va/Q rõ rệt theo vùng, đặc biệt là do co mạch phổi do thiếu oxy (80): tình trạng thiếu oxy ở phế nang cục bộ gây ra co mạch khu vực và do đó làm giảm tưới máu đến các vùng phổi thiếu oxy và/hoặc không thông khí, do đó cải thiện trao đổi khí (31). Ở những bệnh nhân mắc ARDS, trương lực mạch máu phổi tăng đã cải thiện trao đổi khí (38, 61 – 65, 81), trong khi đó việc giảm áp lực động mạch phổi do tăng oxy máu và/hoặc thuốc giãn mạch tiêm tĩnh mạch càng làm tình trạng thiếu oxy trầm trọng hơn (34 – 36). Ngược lại, giãn mạch phổi chọn lọc bằng cách sử dụng thuốc giãn mạch dạng hít đã cải thiện trao đổi khí: thuốc giãn mạch dạng hít tác dụng ngắn (ví dụ NO hoặc prostacyclin) chỉ có hiệu quả ở những vùng phổi được thông khí (Hình 6). Do đó, chúng sẽ phân phối lại lưu lượng máu phổi ra khỏi phế nang không được thông khí và do đó làm giảm Qs/Qt (39 – 41, 82). Kết hợp thuốc co mạch phổi tiêm tĩnh mạch (ví dụ almitrine) và thuốc giãn mạch dạng hít thậm chí còn cải thiện hơn nữa quá trình oxygen hóa động mạch ở một số bệnh nhân mà không làm nặng thêm hậu tải thất phải (83 – 85).
Tóm lại, việc tăng trương lực mạch máu phổi thường cải thiện phân bổ Va/Q. Giãn mạch phổi chọn lọc bằng cách sử dụng các hợp chất tác dụng ngắn, dạng hít có thể cải thiện phân bố Va/Q, vì chúng chỉ có hiệu quả ở những vùng phổi thông khí (86).
Các yếu tố ngoài phổi
Ngoài mức độ Va/Q thấp và Qs/Qt, các yếu tố ngoài phổi ảnh hưởng đến trao đổi khí, cụ thể là FiO2 (xem bên dưới “FiO2 cao”), cung lượng tim (Qt) và VO2 (87). QT ảnh hưởng đến trao đổi khí một cách gián tiếp bởi tác động của nó lên quá trình chiết xuất O2 và do đó lên PữO2 và trực tiếp bằng cách sửa đổi phân phối Va/Q. Điều phức tạp là những yếu tố này có thể có nhiều tác động khác nhau, có khả năng ảnh hưởng đến quá trình oxygen hóa theo hướng ngược lại. Theo nguyên tắc Fick:
VO2 = Qt X (CaO2 – CVO2)
CvO2 = CaO2 — VO2/QT. (11)
Tức là CVO2 và do hình dạng dốc, gần như tuyến tính của đường cong phân ly Hb-O2, PVO2 liên quan trực tiếp đến nồng độ O2 trong động mạch và VO2 và liên quan nghịch với Qt. Do đó, các biến thể của QT sẽ ảnh hưởng trực tiếp đến PaO2 do sự tương tác giữa Qt và VO2 và PVO2. Do đó, đối với một VO2 và Qs/Qt, có mối quan hệ tuyến tính giữa PaO2 và sự chênh lệch giữa CaO2 và CVO2 (Hình 7) (88, 89). Nói cách khác, bất kỳ sự gia tăng nào của PVO2 cũng nên tăng PaO2. Ở những bệnh nhân
được điều trị bằng phương pháp loại bỏ CO2 ngoài cơ thể, PỸO2 bằng cách tăng F1O2 của màng phổi có liên quan đến sự gia tăng song song của PaO2, trong khi toàn bộ cơ thể VO2, Qt, Qs/Qt và phân phối Va/Q vẫn không thay đổi (90). Tuy nhiên, trong điều kiện lâm sàng, mức độ ảnh hưởng này có thể phụ thuộc vào nồng độ PỸO2 ban đầu và các yếu tố khác. Thật vậy, các phương pháp tiếp cận dược lý (ví dụ, thuốc tăng co bóp và/hoặc thuốc vận mạch) hoặc không dùng thuốc (điều trị áp lực dương cuối thì thở ra [PEEP], tư thế bệnh nhân) thường ảnh hưởng đến Qt và VO2 cũng vậy, và do đó, PỸO2. Hơn nữa, một yếu tố khác được thể hiện cả trong các mô hình thử nghiệm và ở bệnh nhân mắc ARDS là thực tế là những thay đổi Qt gây ra những thay đổi song song trong Qs/Qt (91 – 93), kể cả khi được gây ra bằng cách tăng PEEP hoặc Vt (94). Lời giải thích khả dĩ nhất dường như là sự thay đổi của tình trạng co mạch phổi do thiếu oxy gây ra bởi sự thay đổi nồng độ PvO2 (95, 96). Các biến thể của PỸO2 cũng có thể ảnh hưởng trực tiếp Qs/Qt do thay đổi trương lực mạch máu phổi: ở bệnh nhân ARDS được điều trị bằng oxygen hóa qua màng ngoài cơ thể, Qs/Qt cho thấy sự phụ thuộc tuyến tính, trực tiếp vào cả lưu lượng máu phổi và sức cản mạch máu phổi được tính toán (91). Do đó, bất kỳ biến thể nào của Qt có thể ảnh hưởng đến quá trình oxygen hóa động mạch theo các hướng khác nhau. Vì vậy, ở từng bệnh nhân, tác dụng của sự biến đổi của Qt trên PaO2 thường không thể đoán trước được và sẽ là hệ quả của sự tương tác giữa các tác động lên Qs/Qt, phân phối Va/Q, VO2, và PỸO2 (Hình 8) (86, 87, 97).
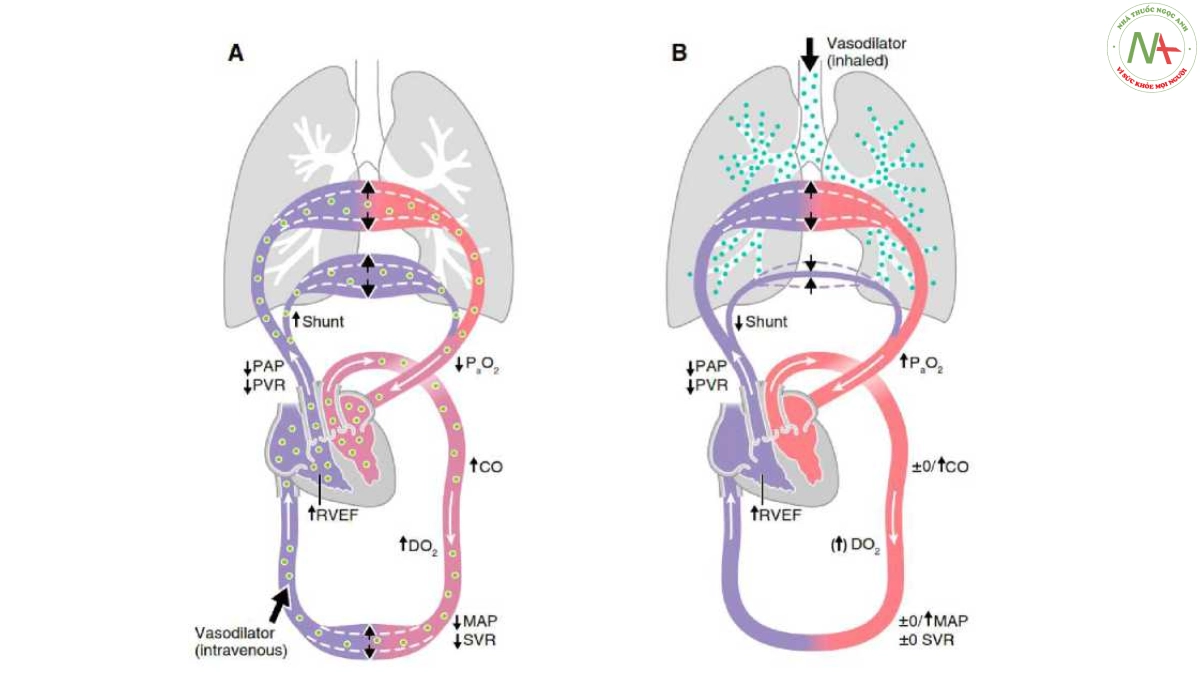
Hình 6. Tác dụng của prostacyclin tiêm tĩnh mạch (iv) (A) và hít (B) lên huyết động hệ thống và phổi và trao đổi khí ở bệnh nhân mắc hội chứng nguy kịch hô hấp cấp tính. CO = cung lượng tim; DO2 = cung cấp O2 toàn thân; MAP = huyết áp trung bình; PAP = áp lực động mạch phổi; PVR = sức cản mạch máu phổi; RVEF = phân suất tống máu thất phải; SVR = sức cản mạch máu toàn thân. Minh họa của Jacqueline Schaffer.
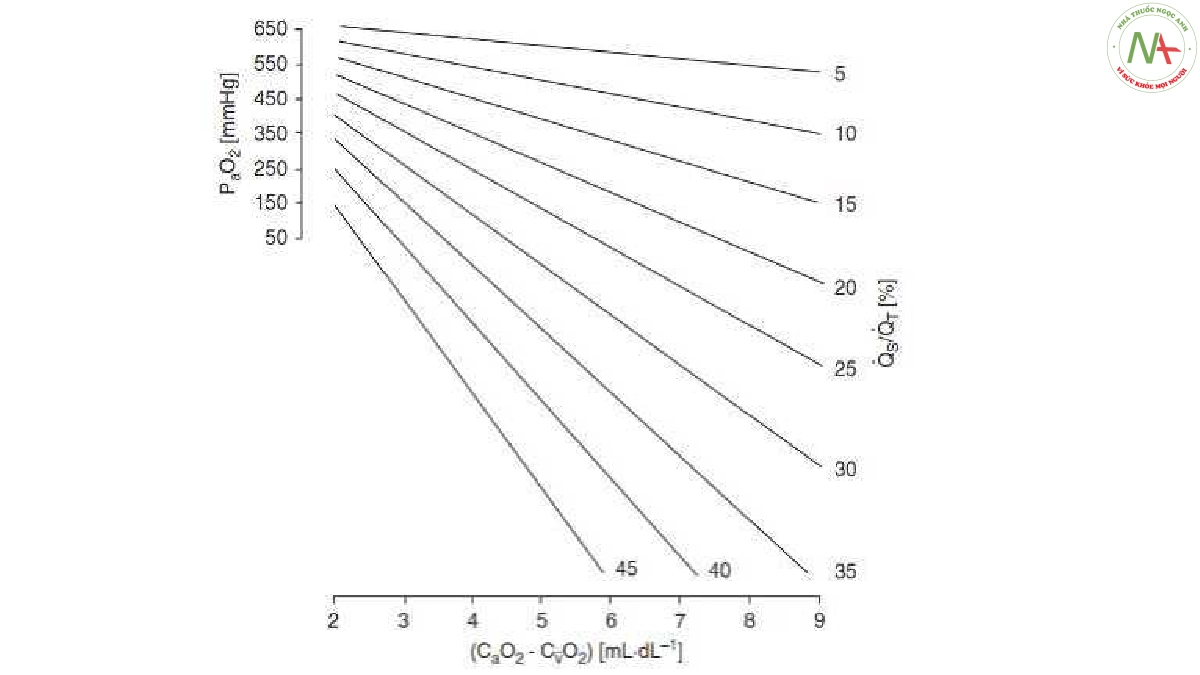
Hình 7. PO2 động mạch trong quá trình thở O2 tinh khiết, được biểu thị như là một hàm của chênh lệch nồng độ O2 hỗn hợp động mạch-tĩnh mạch (tính bằng ml/dl) để tăng dần mức Qs/Qt (tính theo phần trăm của tổng lưu lượng máu phổi). Lưu ý rằng với bất kỳ mức Qs/Qt, chênh lệch nồng độ O2 hỗn hợp giữa động mạch và tĩnh mạch càng cao thì PO2 trong tĩnh mạch hỗn hợp càng thấp và do đó PaO2 càng thấp. CaO2 = nồng độ O2 động mạch; CvO2 = nồng độ O2 tĩnh mạch hỗn hợp. Được điều chỉnh theo sự cho phép từ Tài liệu tham khảo 249.
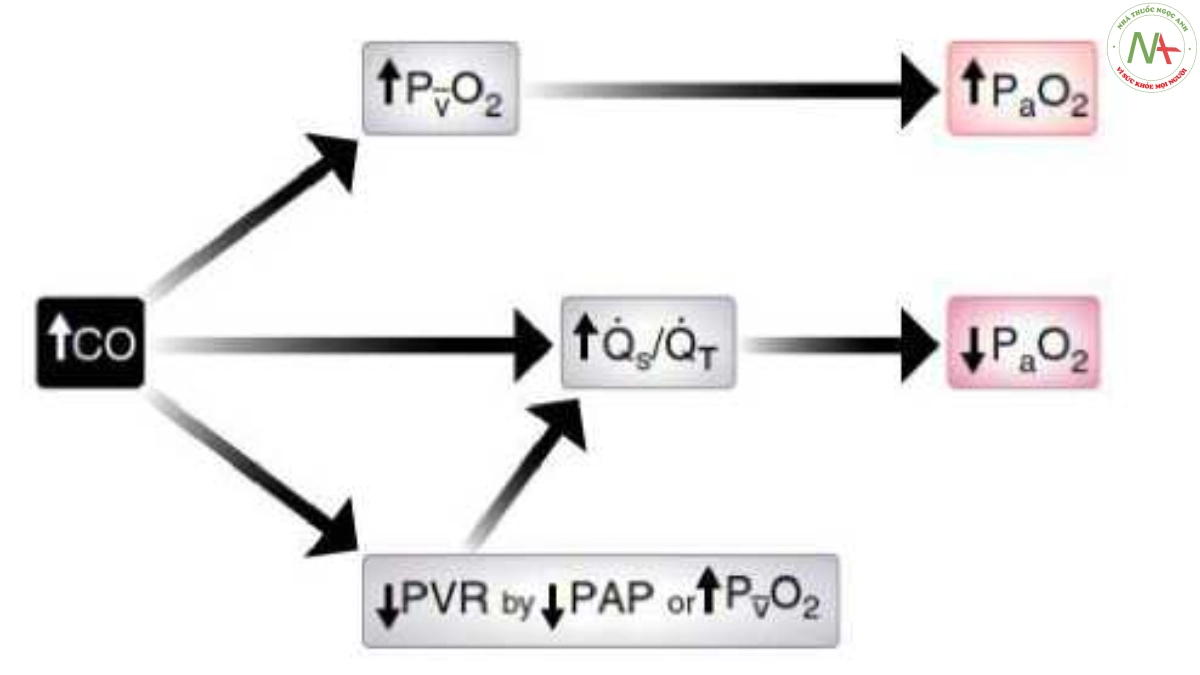
Hình 8. Ảnh hưởng của việc tăng cung lượng tim (CO) lên PaO2. Lưu ý rằng việc tăng cung lượng tim có thể dẫn đến tăng PaO2 do tăng PvO2 (xem thêm Hình 5, 7 và 10). Mặt khác, bất kỳ sự gia tăng nào thậm chí có thể làm giảm PaO2 do tăng shunt phải sang trái (Qs/Qt), trực tiếp (91 – 93) và/hoặc do giảm trương lực mạch máu phổi (34 – 41). PAP = áp lực động mạch phổi; PvO2 = PO2 tĩnh mạch hỗn hợp; PVR = sức cản mạch máu phổi. Minh họa của Jacqueline Schaffer.
Mặc dù ở mức độ thấp hơn do sự khác biệt nhỏ giữa mức độ tĩnh mạch động mạch và tĩnh mạch hỗn hợp, điều này cũng đúng đối với bất kỳ tác động nào của Qt và PỸCO2 tương ứng trên PaCƠ2: về mặt lý thuyết, bất kỳ sự gia tăng nào về Qt sẽ làm giảm PaCO2. Tuy nhiên, tác dụng của các biến thể của PaCO2 cũng có thể hoạt động theo các hướng khác nhau; ví dụ, sự giảm dự kiến của PaCO2 do sự gia tăng nồng độ thuốc giãn mạch gây ra. Qt có thể được bù đắp bằng sự gia tăng đồng thời của Qs/Qt và đặc biệt là Vd/Vt. Điều thứ hai có thể được gây ra bởi sự giảm áp lực động mạch phổi do thuốc giãn mạch, có thể dẫn đến “mất huy động” mạch máu phổi: như đã đề cập ở trên, sức cản mạch máu phổi và do đó, sự phân phối lưu lượng máu phổi phụ thuộc vào mối quan hệ giữa trong mạch máu (tức là động mạch [Pa], tĩnh mạch [Pv], và áp lực phế nang [Pa]) (58). Bất kỳ sự giảm áp lực nội mạch nào cũng có thể làm biến đổi các vùng “vùng II” của phổi (với Pa > Pa > Pv) vào cái gọi là vùng “vùng I” của phổi, vùng này không được tưới máu vì Pa > Pa (58).
Các yếu tố ngoài phổi, cụ thể là F1O2, cung lượng tim (Qt), VO2, và, là kết quả của PỸO2, cũng sẽ ảnh hưởng trực tiếp đến PaO2.
Shunt ngoài phổi
Shunt trong tim thông qua lỗ bầu dục (patent foramen ovale, PFO) cũng có thể góp phần làm tổn hại quá trình trao đổi khí trong ARDS. Trong điều kiện bình thường, PFO không ảnh hưởng đến trao đổi khí, bởi vì sự chênh lệch giữa áp lực nhĩ trái và phải ngăn cản sự di chuyển máu đáng kể từ tĩnh mạch sang động mạch. Tuy nhiên, tăng áp động mạch phổi là hiện tượng thường gặp ở bệnh nhân mắc ARDS và có thể dẫn đến bệnh tâm phế cấp tính (98 – 100). Tỷ lệ PFO trong ARDS đã được báo cáo ở khoảng 15 đến 19% bệnh nhân và thường liên quan đến bệnh tâm phế cấp tính (101, 102). Thông thường, khi có dòng PFO từ trung bình đến lớn, phản ứng oxygen hóa kém đối với PEEP. PEEP cao có thể làm tăng thêm áp lực nhĩ phải, do đó làm tăng sự xuất hiện và mức độ nghiêm trọng của shunt phải sang trái do PFO (60, 101, 103, 104). Giảm PEEP và/hoặc NO hít có thể làm giảm tăng áp phổi, do đó làm giảm hoặc loại bỏ shunt bên phải ở một số bệnh nhân (~14%), do đó cải thiện quá trình oxygen hóa (103, 104).
Ứng dụng lâm sàng
Bác sĩ lâm sàng tại giường gặp khó khăn thực sự trong việc giải thích chính xác những bất thường về trao đổi khí trong ARDS. Đặc biệt, các thủ thuật khác nhau có thể ảnh hưởng đến quá trình trao đổi khí thông qua các cơ chế khác nhau; ví dụ, quá trình oxygen hóa được cải thiện có thể phản ánh sự phân phối lại lưu lượng máu thuần túy (xem thuốc giãn mạch dạng hít), thay đổi nồng độ O2 trong tĩnh mạch hỗn hợp và/hoặc mở lại các đơn vị phổi không được thông khí trước đó (xem Huy động). Do đó, những tác động tương tự lên quá trình trao đổi khí có thể cho thấy sự thay đổi thực sự trong chức năng phổi do một hoạt động cụ thể hoặc do cách giải quyết tự nhiên của bệnh, một tác dụng “mỹ phẩm” đơn giản mà không làm thay đổi chức năng phổi hoặc thậm chí làm tình trạng căng phổi trở nên trầm trọng hơn với giảm cung lượng tim và dẫn đến shunt. Vì vậy, việc giải thích cẩn thận cần có cách tiếp cận lâm sàng đa phương thức và lập luận cẩn thận.
Chẩn đoán và đánh giá mức độ nghiêm trọng
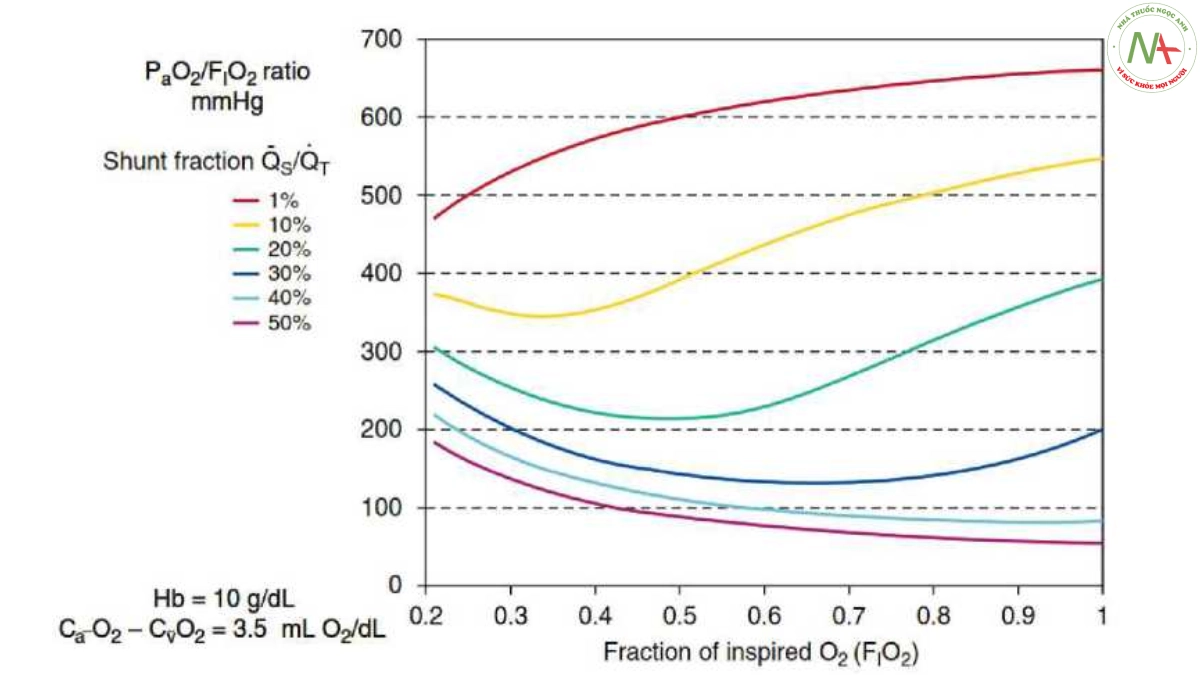
Giảm oxy máu là thành phần trung tâm của chẩn đoán ARDS. Một số chỉ số đã được đề xuất để mô tả tình trạng thiếu oxy máu, chẳng hạn như Qva/Qt, P(A-a)O2, chỉ số oxygen hóa và tỷ lệ PaO2/FiO2. Các chỉ số này bị ảnh hưởng bởi nhiều yếu tố, chẳng hạn như cài đặt máy thở (Vt, nhịp thở, PEEP) và huyết động học (Qt và PỸO2). Do tính đơn giản của nó, tỷ lệ PaO2/FiO2 đã được áp dụng trong thực hành thường quy và được sử dụng để mô tả mức độ nghiêm trọng của ARDS (1). Việc sử dụng tỷ lệ PaO2/FiO2 được nhấn mạnh bởi sự cần thiết phải đánh giá tình trạng thiếu oxy một cách độc lập với FiO2. Thật không may, do mối quan hệ toán học phức tạp giữa nồng độ Hb, đường cong phân ly Hb- O2 và chênh lệch nồng độ O2 hỗn hợp động mạch- tĩnh mạch, mối quan hệ giữa PaO2/FiO2 và FiO2 là phi tuyến và phụ thuộc vào Qs/Qt nền (105, 106) (Hình 9).
Vì vậy, bất kể tác động có thể có của FiO2 đối với Qs/Qt (xẹp phổi do mất nitơ), bất kỳ sự thay đổi nào của FiO2 cũng có thể làm thay đổi PaO2/FiO2. Sự biến đổi này của PaO2/FiO2 cho thấy rằng việc sử dụng nó nên thận trọng ở từng bệnh nhân mắc ARDS, khi cài đặt máy thở được sửa đổi. Bất chấp những hạn chế này, việc phân loại bệnh nhân mắc ARDS theo ba loại mức độ nghiêm trọng theo PaO2/FiO2 (“nhẹ” đối với 300 < PaO2/FiO2 < 200, “trung bình” đối với 200 < PaO2/FiO2 < 100 và “nghiêm trọng” đối với PaO2/FiO2 < 100 mm Hg) cho phép xác định bệnh nhân có thời gian thở máy và tử vong khác nhau (1, 107). Hơn nữa, PaO2 trong quá trình thông khí O2 tinh khiết được chứng minh là có mối tương quan chặt chẽ với tỷ lệ phần trăm định lượng của chụp cắt lớp vi tính (CT) của phổi không được sục khí (108). Cuối cùng, chỉ số đơn giản này dường như hữu ích trong việc xác định những bệnh nhân có thể được hưởng lợi từ các biện pháp can thiệp điều trị bổ sung, chẳng hạn như PEEP cao, tư thế nằm sấp và/hoặc phong tỏa thần kinh cơ (109 – 111). Như Villar và cộng sự đã chỉ ra, giá trị tiên lượng của PaO2/FiO2 phụ thuộc rất lớn vào thời gian và điều kiện đo, việc phân tầng nguy cơ tử vong tốt hơn với PEEP > 10 cm H2O và FiO2 > 0,5 sau 24 giờ thở máy bảo vệ (112, 113). Tỷ lệ độ bão hòa Hb-O2 động mạch qua da (SpO2) và FiO2 (SpO2/FiO2) được đề xuất như một công cụ sàng lọc ARDS khi không có khí máu động mạch (114).
Hình 9. Tỷ lệ PaO2/FiO2 được vẽ dưới dạng hàm của FiO2 nằm trong khoảng từ 0,21 (không khí) đến 1,0 (O2 tinh khiết) cho Qs/Qt dao động từ 1 đến 50% ở nồng độ Hb không đổi = 100 g/L và chênh lệch nồng độ O2 hỗn hợp giữa động mạch và tĩnh mạch = 3,5 ml/dl. CaO2 = nồng độ O2 động mạch; CỮO2 = nồng độ O2 tĩnh mạch hỗn hợp. Được điều chỉnh theo sự cho phép từ Tài liệu tham khảo 106.
Thật không may, do độ chính xác kém, phương pháp không xâm lấn này không thể được sử dụng để đánh giá tác động của các biện pháp can thiệp trị liệu đối với quá trình oxygen hóa (115). Cuối cùng, gần đây người ta đề xuất rằng một phương trình phi tuyến đưa ra ước tính đáng tin cậy hơn về tỷ lệ PaO2/FiO2 (116).
Khả năng loại bỏ CO2 bị suy giảm cũng là một dấu hiệu đặc trưng của ARDS. Ở những bệnh nhân mắc ARDS có mức độ nghiêm trọng khác nhau, Vd/Vt đo được trên PEEP 5 cm H2O có mối tương quan cao với định lượng quét CT về thông khí phổi không đồng nhất, cho thấy Vd/Vt có thể hữu ích để đánh giá nguy cơ ở từng cá nhân về tổn thương phổi do máy thở (VILI) (117). Phù hợp với quan sát này, Vd/Vt được đo trong điều kiện tiêu chuẩn ở giai đoạn đầu hoặc giai đoạn giữa dự đoán tỷ lệ tử vong một cách độc lập (3, 118). Tính Vd/Vt với công thức Enghoff yêu cầu xác định PeCO2 và/hoặc FeCO2, đây không phải là thực hành lâm sàng thông thường. Một số phương pháp đã được đề xuất để ước tính Vd/Vt mà không cần đo FeCO2 hoặc để tính các chỉ số phản ánh hiệu quả thông khí: Ve được chuẩn hóa ở PaCO2 là 40 mm Hg (Vecorr = Ve X PaCO2/40) (119), tỷ lệ thông khí = (Ve X PaCO2)/(VE dự đoán X 37,5) với Ve dự đoán = 100 ml/kg trọng lượng cơ thể dự đoán (PBW)/phút (120). Phân tích hồi cứu cơ sở dữ liệu mạng ARDS cho thấy rằng cả Vd/Vt, sử dụng tính toán tiêu hao năng lượng của Harris-Benedict và tỷ lệ thông khí đều có thể dự đoán tỷ lệ tử vong (121 – 123). Mặc dù không bắt buộc đối với chẩn đoán, việc đánh giá khả năng loại bỏ CO2 bị suy yếu bằng cách sử dụng Vd/Vt và/hoặc tính toán chỉ số thay thế phải là một phần trong đánh giá ban đầu về mức độ nghiêm trọng của ARDS.
Mục tiêu điều trị
PO2 động mạch
Mặc dù ngăn ngừa tử vong do thiếu oxy máu là mục tiêu chính của thở máy ở bệnh nhân mắc ARDS, nhưng rất ít nghiên cứu đề cập đến câu hỏi về mục tiêu oxygen hóa tối ưu. Có nhiều bằng chứng từ các nghiên cứu ngoài lĩnh vực ARDS cho thấy nên tránh tăng oxy máu (PaƠ2 > 120-150 mm Hg) trong bệnh hiểm nghèo (124, 125). Trong hầu hết các thử nghiệm ngẫu nhiên có đối chứng lớn về hỗ trợ triệu chứng trong ARDS, mục tiêu oxygen hóa được khuyến nghị là PaƠ2 từ 55 đến 80 mm Hg và/hoặc SpƠ2 từ 88 đến 95%. Điều thú vị là dữ liệu được báo cáo trong các nghiên cứu này cho thấy giá trị trung bình của PaƠ2 hầu hết đều gần hoặc thậm chí cao hơn giới hạn mục tiêu trên (111, 126 – 130). Quan sát này rất phù hợp với dữ liệu từ các nghiên cứu quan sát cho thấy giá trị PaO2 và/hoặc SpO2 cao thường được quan sát thấy ở những bệnh nhân bị bệnh nặng và cho thấy các nhà điều tra không cảm thấy thoải mái khi PaO2 và/hoặc SpO2 thấp hơn các giá trị. Điều này có lẽ là do mối quan tâm nhiều hơn về nguy cơ thiếu oxy hơn là nhiễm độc O2 ở phổi và/hoặc tác hại của tăng oxy máu (131). Sự an toàn của mức độ oxygen hóa vừa phải đã được đặt câu hỏi khi quan sát mối liên quan giữa mức độ oxygen hóa thấp hơn và suy giảm tâm thần kinh lâu dài ở một nhóm nhỏ những người sống sót sau ARDS (132). Tuy nhiên, trong ARDS, mức SpO2 và PaO2 “tối ưu” vẫn chưa được xác định, bởi vì dữ liệu thực nghiệm cho thấy tình trạng tăng oxy máu có thể làm trầm trọng thêm VILI (133), và thở máy với F1O2 từ 0,6 trở lên trong 3 ngày trở lên là liên quan đến sự gia tăng độ dày của hàng rào máu- khí và tổn thương tế bào nội mô (134). Hơn nữa, một phân tích hồi cứu đã chứng minh rằng số ngày tăng oxy máu được xác định với PaO2 lớn hơn 120 mm Hg là một yếu tố nguy cơ độc lập đối với viêm phổi liên quan đến máy thở (135). Thêm bằng chứng về độc tính của tình trạng tăng oxy máu được cung cấp bởi các thử nghiệm ngẫu nhiên có đối chứng O2-ICU (O2-ICU (Lượng oxy tối ưu trong phòng chăm sóc đặc biệt) và HYPER2S (Hyperoxia và nước muối ưu trương trong sốc nhiễm trùng) (136, 137). Thử nghiệm O2-ICU so sánh PaO2 mục tiêu 120 (“thông thường”) so với 75 mm Hg (“bảo tồn”) mm Hg ở 434 bệnh nhân ICU tổng quát có thời gian nằm viện dự kiến lớn hơn 72 giờ: phương pháp bảo tồn có liên quan đến việc giảm 50% tỷ lệ tử vong chung (11,6 so với 11,6 so với 20). 20,2%, P = 0,01); các tác giả kết luận rằng những phát hiện này phải được xem xét sơ bộ vì việc chấm dứt thử nghiệm sớm do khó khăn trong việc tuyển chọn bệnh nhân. Hơn nữa, chỉ có 67% bệnh nhân được thở máy khi đưa vào (136). Thử nghiệm HYPER2S so sánh mục tiêu thông khí SpO2 88 đến 95% so với thông khí O2 tinh khiết trong 24 giờ đầu ở bệnh nhân sốc nhiễm trùng đã bị dừng sơ bộ vì lý do an toàn sau khi tuyển chọn 442 bệnh nhân (137). Trong nghiên cứu này, 50% bệnh nhân mắc ARDS với PaO2/FiO2 dưới 200 mm Hg lúc ban đầu. Tỷ lệ tử vong không khác biệt đáng kể ở Ngày 28 và 90, nhưng tình trạng tăng oxy máu có liên quan đến tỷ lệ mắc các tác dụng phụ nghiêm trọng cao hơn đáng kể, với số lượng bệnh nhân bị yếu và xẹp phổi mắc phải ở ICU cao hơn có ý nghĩa lâm sàng.
PCO2 động mạch
Các nghiên cứu thực nghiệm đã chỉ ra rằng tăng CO2 và/hoặc nhiễm toan hô hấp có thể có nhiều tác dụng có lợi cho tế bào và sinh lý, chẳng hạn như giảm viêm phổi, bảo vệ chống lại VILI và tổn thương phổi do oxygen hóa (138 – 140), cải thiện phân phối Va/Q thông qua tăng cường co mạch phổi do thiếu oxy (141), tăng Qt và O2 được cung cấp thứ phát từ việc giải phóng catecholamine (142, 143), cải thiện vi tuần hoàn (144) và tạo điều kiện thuận lợi cho việc giải phóng O2 ngoại vi thông qua hiệu ứng Bohr (sự dịch chuyển sang phải của đường cong phân ly Hb-O2) (145). Mặt khác, tăng CO2 làm giảm độ thanh thải dịch phế nang (146), và tác dụng chống viêm của nó có thể liên quan đến việc suy giảm khả năng phòng vệ của vật chủ kháng khuẩn (147) và làm chậm quá trình lành vết thương tế bào (148). Hơn nữa, sự gia tăng hậu tải thất phải liên quan đến tăng CO2 máu có thể góp phần gây ra bệnh tâm phế cấp tính (149), từ đó làm tăng tỷ lệ tử vong (150). Trong bối cảnh lâm sàng, hầu như không thể tách biệt tác động của chứng tăng CO2 máu với tác động của việc giảm tổn thương phổi cơ sinh học do giảm Ve. Một phân tích hậu kiểm về kết quả của thử nghiệm ARMA (Thử nghiệm tiền cứu, ngẫu nhiên, đa trung tâm Thông khí áp lực dương thể tích khí lưu thông 12 ml/kg so với 6 ml/kg để điều trị tổn thương phổi cấp tính và Hội chứng nguy kịch hô hấp cấp tính) cho thấy rằng ở những bệnh nhân được cung cấp thể tích khí lưu thông “thông thường” (12 ml/kg PBW), nhiễm toan hô hấp vừa phải có liên quan độc lập với tỷ lệ chênh lệch tử vong thấp hơn vào Ngày 28, cho thấy tác dụng bảo vệ của chứng tăng CO2 máu chống lại VILI (151). Cuối cùng, phân tích thứ cấp của ba nghiên cứu đoàn hệ bao gồm 1.889 bệnh nhân mắc ARDS cho thấy PaCO2 lớn hơn 50 mm Hg có liên quan độc lập với tăng tỷ lệ tử vong (152). Do đó, mặc dù việc bình thường hóa PaCO2 và/hoặc pH động mạch không còn được coi là ưu tiên tuyệt đối nữa, nhưng tính an toàn của chứng tăng CO2 cho phép dường như vẫn còn nhiều nghi vấn (148, 152). Do đó, nhiều thử nghiệm ngẫu nhiên khuyến nghị duy trì PaCO2 dẫn đến độ pH từ 7,30 đến 7,40.
Biện pháp điều trị
Một số biện pháp điều trị đã được đề xuất để điều chỉnh trao đổi khí trong ARDS (Bảng 2 và 3). Trong mô tả ban đầu về ARDS, Ashbaugh và đồng nghiệp là những người đầu tiên báo cáo về việc tăng F1O2 và PEEP (153). Trong một thời gian dài, điều chỉnh tình trạng thiếu oxy máu là mục tiêu chính của thở máy. Các phương pháp tiếp cận khác đề xuất và/hoặc sử dụng các chiến lược thông khí nhân tạo khác nhau, thủ thuật dược lý đối với trương lực mạch máu phổi và sau đó là tư thế bệnh nhân. Bởi vì trong quá trình oxygen hóa qua màng ngoài cơ thể, cả quá trình oxygen hóa động mạch và loại bỏ CO2 chủ yếu phụ thuộc vào thiết bị ngoài cơ thể nên kỹ thuật này không được thảo luận trong tổng quan này.
F1O2 cao
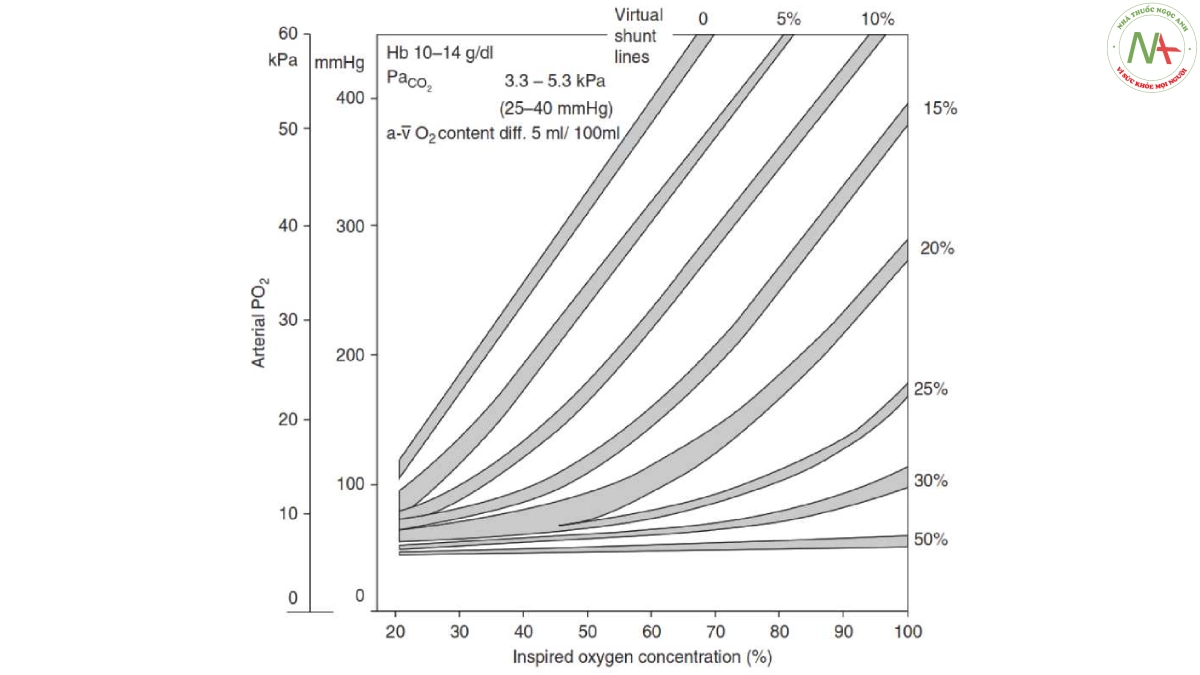
Mặc dù cơ chế then chốt của tình trạng thiếu oxy máu trong ARDS là Qs/Qt, FiO2 cao là thông lệ. Đúng như mong đợi với sự hiện diện của Qs/Qt cao, tác dụng của việc tăng FiO2 lên PaO2 thường rất khiêm tốn, đặc biệt ở những bệnh nhân thiếu oxy nặng (Hình 4 và 10). Ngoài ra, như đã đề cập ở trên, một số tác giả đã báo cáo sự gia tăng Qs/Qt trong khi thở 100% O2 do sự phát triển của quá trình xẹp phổi tái hấp thu do quá trình khử nitơ của các đơn vị có mức tỷ lệ Va/Q thấp, có thể được ngăn ngừa bằng PEEP hoặc thủ thuật huy động (19, 20, 154). Ở những bệnh nhân mắc ARDS được thở máy với Vt thấp (6 ml/kg) và PEEP thấp (khoảng 5 cm H2O), Aboab và các đồng nghiệp đã báo cáo rằng việc tăng FiO2 từ 0,6 lên 1,0 đã làm giảm PaO2/FiO2 và tình trạng mất huy động phổi có thể được ngăn ngừa bằng PEEP khoảng 15 cm H2O (19). Mặt khác, thở O2 tinh khiết không ảnh hưởng đến tình trạng co mạch phổi do thiếu oxy ở bệnh nhân mắc ARDS (154), gợi ý rằng tình trạng co mạch phổi do thiếu oxy đã giảm đi.
PEEP
ARDS được đặc trưng bởi sự giảm thể tích phổi thông khí do xẹp phổi, phù phổi, tắc nghẽn đường thở nhỏ và rối loạn chất hoạt động bề mặt (155). Việc sử dụng PEEP để điều chỉnh tình trạng suy giảm trao đổi khí trong ARDS ban đầu được đề xuất bởi Ashbaugh và đồng nghiệp (153) và vẫn là nền tảng trong quản lý thông khí cho những bệnh nhân này. Dữ liệu mở rộng hỗ trợ việc sử dụng PEEP để cải thiện quá trình oxygen hóa trong suy hô hấp do thiếu oxy, một mình (trong áp lực đường thở dương liên tục) hoặc kết hợp với các chế độ máy thở khác nhau (156 – 163). Một số cơ chế có thể giải thích tác dụng của PEEP đối với trao đổi khí, cơ chế chính là số lượng phế nang tăng lên vẫn được thông khí ở cuối thì thở ra (tức là huy động phế nang), do đó, giảm Qs/Qt (37). Các định luật vật lý và dữ liệu từ các nghiên cứu trên động vật cho thấy PEEP cũng có thể cân bằng xu hướng xẹp phế nang ngày càng tăng do lực bề mặt tăng lên liên quan đến nhiễu loạn chất hoạt động bề mặt. Mặc dù chưa được chứng minh rõ ràng ở bệnh nhân, nhưng có khả năng hiện tượng này có thể đóng vai trò giải thích tác dụng của PEEP đối với việc huy động phổi (164). Mặc dù còn nghi ngờ (165), một số nghiên cứu đã báo cáo mối quan hệ trực tiếp giữa sự cải thiện nồng độ oxy và việc huy động phổi do PEEP gây ra (159, 161, 166, 167).
Hình 10. Biểu đồ đẳng hướng thể hiện tác động của việc tăng FiO2 (trục x) lên PaO2 (trục y) đối với các mức shunt trong phổi khác nhau. Một hàm lượng (a-v) O2 khác nhau = chênh lệch nồng độ O2 hỗn hợp giữa động mạch và tĩnh mạch. Được điều chỉnh theo sự cho phép từ Tài liệu tham khảo 250.
Tuy nhiên, mối tương quan này có thể quá yếu để cho phép, ở một bệnh nhân riêng lẻ, đánh giá việc huy động do PEEP gây ra bởi ảnh hưởng của nó đối với quá trình oxygen hóa. Việc thiếu phương pháp tại giường để định lượng huy động do PEEP gây ra luôn hạn chế việc giải thích nồng độ oxy như một dấu hiệu huy động. Một số nghiên cứu cho rằng PEEP có thể bảo vệ chống lại sự phát triển của phù phổi (168 – 171), một phần do đồng thời làm giảm Qt (172). Mặc dù sự gia tăng thể tích phổi là cơ chế chính gây ra những thay đổi về oxygen hóa do PEEP gây ra, nhưng sự giảm nhẹ về Qt cũng giảm Qs/Qt và do đó có thể cải thiện PaƠ2 (94). Nhiều nghiên cứu cho thấy PEEP trên thực tế không làm giảm lượng nước phổi ngoài mạch mà chủ yếu phân phối lại tình trạng phù nề (173, 174). Bằng cách huy động các phế nang không được sục khí và ổn định đường thở, PEEP cũng có thể ảnh hưởng đến sự phân bổ thông khí lưu thông theo khu vực (175 – 177): khi tác dụng chủ yếu của PEEP là huy động, thông khí phế nang dự kiến sẽ trở nên đồng nhất hơn, đặc biệt là ở các vùng phụ thuộc và mang lại tác dụng bảo vệ chống lại VILI. Những bệnh nhân bị tăng PEEP trong khi dùng dopamine để duy trì cùng một cung lượng tim cho thấy sự giảm đáng kể về Qs/Qt, gợi ý rằng việc huy động phế nang, thay vì giảm Qt (94, 178), là cơ chế chiếm ưu thế để cải thiện quá trình oxygen hóa do tăng PEEP (179).
Tác dụng của PEEP đối với việc loại bỏ Vd/Vt và CO2 rất phức tạp. Một mặt, việc huy động phế nang do PEEP gây ra có thể làm giảm Vd/Vt sinh lý do sự phân bố Vt đồng nhất hơn và do đó giảm Qs/Qt (26, 27, 156). Tuy nhiên, mặt khác, PEEP có thể tạo điều kiện cho tình trạng căng quá mức của các phế nang đã được thông khí tốt trước đó, dẫn đến tăng Vd/Vt sinh lý (10, 174). Nhìn chung, tác động của PEEP lên Vd/Vt và PaCO2 thường khiêm tốn (180 – 183). PaCO2 tăng có thể cho thấy siêu bơm phồng chiếm ưu thế.
Thủ thuật huy động
Thủ thuật huy động có thể cải thiện quá trình oxygen hóa ở nhiều bệnh nhân mắc ARDS (184). Những thủ thuật này là một phần không thể thiếu của “chiến lược mở phổi” nhằm mục đích huy động tối đa (184). Tuy nhiên, tính an toàn của các thủ thuật này còn đang được tranh luận và hơn nữa, trừ khi kết hợp với mức PEEP tăng, tác dụng của chúng thường rất thoáng qua, kéo dài từ 15 đến 20 phút (185). Một số tác giả cho thấy hầu hết tác dụng đạt được sau 10 giây, trước khi tác dụng phụ xảy ra, cho thấy rằng những thủ thuật này có thể bị hủy bỏ nhanh chóng (185).
Chế độ thông khí
Có ý kiến cho rằng, do sự phân bố Vt đồng nhất hơn, đặc tính dòng giảm tốc của thông khí nhắm mục tiêu theo áp lực có thể dẫn đến trao đổi khí được cải thiện so với lưu lượng sóng vuông thường được sử dụng trong chế độ nhắm mục tiêu theo thể tích (186). Tuy nhiên, một số nghiên cứu đã chứng minh rằng, khi các cài đặt chính (Vt, PEEP) tương đương nhau, thông khí kiểm soát áp lực và thể tích có tác động tương tự đến trao đổi khí (187, 188).
Kéo dài thời gian hít vào để tăng áp lực đường thở trung bình mà không làm tăng áp lực đỉnh phế nang đã được coi là một cách tiếp cận hấp dẫn để cải thiện quá trình oxygen hóa và giảm nguy cơ chấn thương khí áp (189, 190). Do đó, thông khí có tỷ lệ nghịch đảo (tức là tỷ lệ thời gian hít vào và thở ra > 1) được đề xuất như một giải pháp thay thế cho thông khí thông thường trong ARDS. Một số nghiên cứu không được kiểm soát đã báo cáo quá trình oxygen hóa được cải thiện với thông khí tỷ lệ nghịch đảo (191, 192). Tuy nhiên, các nghiên cứu có kiểm soát không tìm thấy lợi thế của tỷ lệ nghịch đảo so với thông khí thông thường về mặt oxygen hóa khi tổng áp lực cuối thì thở ra được giữ không đổi (187, 188, 193). Kéo dài thời gian hít vào bằng cách kéo dài thời gian tạm dừng thì hít vào làm giảm nhẹ Vd/Vt và do đó PaCO2 do cải thiện sự trộn lẫn khí cuối thì hít vào giữa phế nang và đường thở (194 – 196). Mặc dù thường có cường độ nhỏ nhưng hiệu ứng này có thể cho phép giảm Vt và do đó áp suất ổn định với PaCO2 không thay đổi (196). Thời gian hít vào kéo dài cũng có thể làm tăng hậu tải thất phải (193).
Dao động tần số cao đã được đề xuất như một phương pháp thay thế cho thông khí thông thường ở những bệnh nhân mắc ARDS nặng (197). Ở chế độ này, quá trình oxygen hóa phụ thuộc chủ yếu vào áp lực đường thở trung bình và F1O2, trong khi việc loại bỏ CO2 phụ thuộc vào tần số, biên độ dao động và thời gian hít vào trên tỷ lệ thời gian thở ra. Kết quả tiêu cực của hai thử nghiệm ngẫu nhiên có đối chứng lớn đã dẫn đến việc ngừng sử dụng kỹ thuật này ở người lớn mắc ARDS (198, 199). Liệu các tác động huyết động của áp lực đường thở trung bình và trong lồng ngực cao có giải thích được những kết quả tiêu cực này hay không vẫn còn đang được đặt câu hỏi (200).
Vt và Ve
Vt thấp là yếu tố chính của thông khí bảo vệ phổi nhằm giảm tỷ lệ tử vong (126). Trong thử nghiệm ARMA, nhánh Vt thấp có liên quan đến mức độ oxygen hóa thấp hơn nhánh Vt cao (126). Khi so sánh với Vt “thông thường” ở tần số hô hấp và PEEP không thay đổi, việc giảm Vt làm tăng PaCƠ2 do giảm Ve và tăng lên Qs/Qt do tăng Qt và ngừng huy động các đơn vị hô hấp kém thông khí (các đơn vị có tỷ lệ Va/Q rất thấp) (201). Do sự gia tăng đồng thời của PỸO2 liên quan đến tăng Qt, sự gia tăng trong Qs/Qt liên quan đến việc giảm Vt dẫn đến sự giảm nhỏ và không ổn định của PaO2 (141, 201). Giảm Vt gắn liền với giảm Vd, thường dẫn đến Vd/Vt không thay đổi (141, 201). Do Vd/Vt cao, Ve yêu cầu để đạt được mức bình thường là cao bất thường (3). Do đó, khi sử dụng Vt là 6 ml/kg PBW, nhịp thở từ 25 đến 35 lần/phút thường là cần thiết để đạt được PaCO2 với pH động mạch từ 7,30 đến 7,45 (126).
Giảm khoảng chết
Ở những bệnh nhân thở máy, khoảng chết của dụng cụ góp phần vào tổng Vd/Vt. vì Va = Vt – Vd nên tác động của khoảng chết của thiết bị lên PaCO2 hoặc lên yêu cầu Ve đặc biệt có ý nghĩa khi sử dụng Vt thấp. Một số nghiên cứu lâm sàng đã chỉ ra rằng ở những bệnh nhân mắc ARDS được thở máy với Vt thấp, việc giảm khoảng chết của thiết bị bằng cách thay thế bộ trao đổi nhiệt và độ ẩm bằng máy tạo độ ẩm hoạt động đã làm giảm đáng kể PaCO2 (202, 203).
Phụt khí khí quản (tracheal gas insufflation) bao gồm việc bơm khí tươi liên tục hoặc thở ra vào đường thở trung tâm thông qua ống thông nội khí quản, để đẩy CO2 ra khỏi khoảng chết của đường thở và do đó làm giảm khoảng chết giải phẫu (204). Một số nghiên cứu đã chỉ ra rằng việc bơm khí vào khí quản làm giảm đáng kể PaCO2 và/hoặc cho phép giảm Vt ở mức PaCO2 không đổi (205, 206). Do các vấn đề an toàn và khó khăn kỹ thuật (tăng PEEP nội tại, đo Vt không chính xác hoặc khó khăn).và áp lực đường thở, làm ẩm khí tươi được bơm vào, theo dõi vị trí của ống thông, tổn thương khí quản), kỹ thuật này khó áp dụng trong thực hành hàng ngày và dần mất đi sự quan tâm. De Robertis và Jonson đã phát triển một kỹ thuật hút và xả khoảng chết của đường thở trong thì thở ra, cho phép họ giảm đáng kể nhu cầu thông khí mà không làm tăng PEEP nội tại (207, 208). Kỹ thuật này yêu cầu một thiết bị cụ thể được đồng bộ hóa với máy thở và do đó chưa có sẵn để sử dụng lâm sàng.
Thở tự nhiên so với liệt cơ
Mặc dù liệt cơ và thở máy có kiểm soát đã được sử dụng một cách cổ điển ở bệnh nhân mắc ARDS, việc cho phép thở tự nhiên trong khi thở máy đã ngày càng được quan tâm trong những năm gần đây. Trong quá trình thở máy được hỗ trợ, nỗ lực hít vào của bệnh nhân sẽ kích hoạt bắt đầu cung cấp dòng khí bằng máy thở, được duy trì cho đến khi đáp ứng tiêu chí chấm dứt được xác định trước. Ngược lại, trong quá trình thở tự nhiên không được hỗ trợ, bệnh nhân thở tự do trong hệ thống dòng chảy theo nhu cầu hoặc liên tục mà không cần bất kỳ sự hỗ trợ cụ thể nào của nỗ lực hít vào (tức là trong khi áp lực đường thở dương liên tục hoặc thông khí giải phóng áp lực đường thở, APRV).
Các nghiên cứu thực nghiệm (209 – 213) và lâm sàng (214 – 217) đã chứng minh rằng thở tự nhiên trong quá trình thở máy có thể cải thiện quá trình oxygen hóa. Hai cơ chế đã được công nhận về tác dụng có lợi của việc thở tự nhiên bổ sung trong quá trình trao đổi khí: (1) huy động các vùng xẹp phổi trong phế nang, chủ yếu ở các phần phụ thuộc của phổi, được giảm bớt nhờ sự co bóp bảo tồn của cơ hoành; và (2) chuyển lưu lượng máu phổi về phía phổi có tỷ lệ Va/Q cao hơn (215, 218). Khi nhịp thở tự nhiên được duy trì trong quá trình thở máy, áp lực do cơ hô hấp tạo ra sẽ cộng thêm áp lực do máy thở cung cấp, do đó làm tăng áp lực xuyên phổi (219, 220). Ngoài ra, tình trạng căng quá mức cục bộ ở các vùng phổi phụ thuộc có thể xảy ra, khi sự gia tăng áp lực xuyên phổi cục bộ gây ra sự dịch chuyển không khí phế nang từ các phần không phụ thuộc sang các phần phụ thuộc của phổi (tức là pendelluft) (221). Thông qua các cơ chế này, việc thở tự nhiên có thể làm tăng nguy cơ mắc VILI. vì vậy, cần cân nhắc ba điểm khi cho phép thở tự nhiên trong quá trình thở máy: (1) mức độ nghiêm trọng của ARDS, (2) giai đoạn tiến triển của bệnh và (3) mức độ đồng bộ giữa hỗ trợ máy thở và nỗ lực hô hấp của bệnh nhân. Hầu hết các nghiên cứu cho thấy lợi ích của việc thở tự nhiên được thực hiện ở những bệnh nhân mắc ARDS nhẹ đến trung bình chỉ cần thở máy ở mức độ trung bình và/hoặc sau giai đoạn cấp tính của bệnh. Ở những bệnh nhân mắc ARDS nặng, việc sử dụng thuốc ức chế thần kinh cơ trong 48 giờ đầu tiên đã cải thiện quá trình oxygen hóa và cuối cùng là khả năng sống sót (111). Cuối cùng, sự đồng bộ giữa hỗ trợ máy thở và nỗ lực hít vào của bệnh nhân cũng quyết định hiệu quả trao đổi khí của nhịp thở tự nhiên. Khi so sánh tác động của hỗ trợ áp lực (chế độ thông khí hỗ trợ nhắm mục tiêu áp lực được đồng bộ hóa hoàn toàn) và APRV (chế độ thông khí nhắm mục tiêu áp lực không đồng bộ cho phép thở tự nhiên không được hỗ trợ) với thông khí kiểm soát áp lực, Putensen và đồng nghiệp đã cho thấy ở những bệnh nhân mắc ARDS rằng APRV đã tăng Qt lên và cải thiện oxygen hóa do sự tương xứng Va/Q tốt hơn do giảm Qs/Qt và Vd/Vt. Hỗ trợ áp lực không có tác dụng có lợi (215). Điều thú vị là, những tác dụng có lợi này của nhịp thở tự nhiên không được hỗ trợ trong APRV vẫn đạt được mặc dù hoạt động thở tự nhiên khá nhỏ.
Tóm lại, thở tự nhiên có thể cải thiện quá trình oxygen hóa trong ARDS, nhưng cách tiếp cận này có lẽ nên giới hạn ở những bệnh nhân không biểu hiện nỗ lực hô hấp mạnh, sau khi cải thiện giai đoạn cấp tính hoặc thậm chí trong giai đoạn đầu của ARDS nhẹ hoặc trung bình (222). Trong các chế độ máy thở hỗ trợ, nhắm mục tiêu áp lực, việc theo dõi Vt là bắt buộc để ước tính nỗ lực hít vào và do đó gián tiếp áp lực xuyên phổi (220). Việc sử dụng chế độ không đồng bộ có thể hữu ích để hạn chế Vt và áp lực xuyên phổi. Cuối cùng, nên tránh nỗ lực sử dụng máy thở quá mức dẫn đến tăng tốc độ chuyển hóa của cơ hô hấp và do đó làm tăng nhu cầu máy thở.
Tư thế bệnh nhân
Tư thế nằm sấp đã được sử dụng để cải thiện quá trình oxygen hóa ở bệnh nhân mắc ARDS từ những năm 1970 (223, 224). Một số nghiên cứu đã chứng minh rằng tư thế nằm sấp giúp cải thiện quá trình oxygen hóa (được định nghĩa là tăng PaƠ2 > 20% hoặc PaO2/FiO2 > 20 mm Hg, so với nằm ngửa) ở khoảng 75% bệnh nhân (110, 225 – 227). Bằng cách huy động phổi và thông khí phế nang đồng nhất, về mặt lý thuyết, tư thế nằm sấp cũng sẽ làm giảm PaCO2 và Vd/Vt (228, 229). Tuy nhiên, ảnh hưởng của tư thế nằm sấp lên PaCO2 ít có thể dự đoán được và hầu như được coi là ít quan trọng hơn ảnh hưởng đến quá trình oxygen hóa. Tuy nhiên, việc giảm PaCO2, thay vì tăng PaO2/FiO2, có liên quan đến việc huy động được cải thiện và kết quả tốt hơn với tư thế nằm sấp (230, 231). Ngoài tác dụng lên quá trình trao đổi khí, tư thế nằm sấp còn làm giảm stress và strain ở phổi và ngăn ngừa VILI (232 – 234). Do đó, nó dường như cải thiện kết quả của những bệnh nhân mắc ARDS nặng nhất (110, 130,235, 236).
Dữ liệu hạn chế gợi ý rằng định vị theo chiều dọc cũng có thể cải thiện quá trình oxygen hóa (237, 238). Richard và các đồng nghiệp đã chỉ ra rằng, so với tư thế nằm ngửa, tư thế thẳng đứng (thân nâng cao 45° và chân hạ xuống 45°) đã cải thiện quá trình oxygen hóa ở 11 trong số 16 bệnh nhân mắc ARDS (237). Quá trình oxygen hóa được cải thiện có liên quan đến thể tích phổi tăng lên, cho thấy sự gia tăng huy động phổi. Do đó, bằng cách giảm sức ép của bụng lên đáy phổi, việc dựng đứng có thể cho phép cơ hoành dịch chuyển về phía dưới và do đó thúc đẩy việc huy động các vùng phổi phụ thuộc. Những kết quả này đã được xác nhận bởi Dellamonica và các đồng nghiệp, họ phát hiện ra rằng tư thế thẳng đứng đã cải thiện quá trình oxygen hóa, tăng thể tích phổi cuối thì thở ra và giảm strain phổi ở 13 trong số 40 bệnh nhân mắc ARDS (238). Tuy nhiên, đáp ứng oxygen hóa của từng cá nhân đối với tư thế thẳng đứng không liên quan đến những thay đổi về thể tích phổi, cho thấy rằng các cơ chế khác ngoài việc huy động, chẳng hạn như thay đổi cung lượng tim, cũng góp phần cải thiện quá trình oxygen hóa khi định vị theo chiều dọc.
Tác động của thuốc lên phân bổ ẽa/Ộ
Hít khí NO làm giảm Qs/Qt do sự giãn mạch khu vực của các đơn vị hô hấp được thông khí tốt (39). Ở hầu hết bệnh nhân mắc ARDS, nồng độ từ 1 đến 10 ppm là đủ để đạt được hiệu ứng NO đối với quá trình oxygen hóa (239). Nồng độ NO hít vào thấp này cho phép tránh hình thành mức độ NO2 có hại và tránh xuất hiện methemoglobin huyết. Sự cải thiện oxygen hóa liên quan đến NO hít thường là thoáng qua (<72 giờ) (240), và nguy cơ hồi phục đòi hỏi phải ngừng dần dần (241). Cuối cùng, quá trình oxygen hóa được cải thiện tạm thời này không liên quan đến kết quả được cải thiện (242). Prostacyclin dạng khí dung là một chất thay thế cho NO dạng hít mang lại sự cải thiện tương tự về quá trình oxygen hóa (40, 41, 82, 86). Bằng cách tăng cường co mạch do thiếu oxy, almitrine tiêm tĩnh mạch, một chất co mạch phổi chọn lọc, phân phối lại lưu lượng máu từ các đơn vị shunt đến các đơn vị thông khí và do đó có thể cải thiện quá trình oxygen hóa (83, 85). Almitrine tiêm tĩnh mạch liều thấp (4 pg/kg/phút) làm tăng PaO2 tương đương với 5 ppm NO dạng hít, sự kết hợp của hai loại thuốc cuối cùng dẫn đến tác dụng phụ (83 – 85). Điều thú vị là, sự kết hợp của NO hít vào cho phép bù đắp sự gia tăng áp lực động mạch phổi do almitrine gây ra (84).
Điều chỉnh cá nhân cài đặt máy thở
Hiện tại, các chiến lược được đề xuất để điều chỉnh Vt chủ yếu dựa trên PBW và/hoặc các chỉ số ứng suất (stress) của phổi, chẳng hạn như áp lực cao nguyên, áp lực xuyên phổi hoặc áp lực đẩy. Giảm Vt đi kèm với giảm Vd (201, 243). Hiệu quả tổng hợp đến hiệu quả loại bỏ CO2 được đánh giá bằng Vd/Vt là khác nhau. Vd/Vt giảm được cho là dấu hiệu của tình trạng bơm phồng quá mức giảm nhẹ (140). Tuy nhiên, những thay đổi trong Vd/Vt thứ cấp sau những thay đổi trong Vt thường khá nhỏ (201,243), và tác động lâm sàng của chiến lược bao gồm đo Vd/Vt cho các cài đặt riêng lẻ của Vt cho đến nay vẫn chưa được đánh giá.
Giảm Vt ở mức PEEP không đổi sẽ tăng Qs/Qt do mất huy động phế nang và tăng Qt (141, 201, 244, 245). Như đã đề cập ở trên, tác động thực lên PaO2 phụ thuộc vào mức độ thay đổi tương ứng Qs/Qt và PỸO2. Bất kỳ sự gia tăng nào của Qs/Qt gây ra bởi việc giảm Vt dễ dàng được cân bằng bằng cách tăng PEEP (160).
Mặc dù tác dụng của PEEP đối với quá trình oxygen hóa không thể được coi là ước tính chính xác về tác dụng của nó đối với việc huy động phế nang (159, 165), dữ liệu từ các nghiên cứu sinh lý học và từ các thử nghiệm ngẫu nhiên có đối chứng lớn cho thấy rằng nên tính đến oxygen hóa khi chuẩn độ PEEP cho từng cá nhân (109). Các nghiên cứu từ nhóm của Gattinoni đánh giá hiệu quả của PEEP bằng chụp CT chứng minh rõ ràng mối quan hệ giữa PaO2/FiO2 đo được khi PEEP thấp (5 cm H2O) và số lượng mô phổi có thể được huy động và bảo vệ khỏi khí lưu thông. mở và đóng với PEEP cao, đại lượng này quan trọng hơn nhiều ở những bệnh nhân có PaO2/FiO2 dưới 150 mm Hg trên PEEP 5 cm H2O so với những bệnh nhân bị thiếu oxy ít nghiêm trọng hơn (174, 245). Cùng với phát hiện này, một phân tích tổng hợp riêng lẻ của ba thử nghiệm lâm sàng ngẫu nhiên lớn so sánh PEEP cao và PEEP trung bình ở bệnh nhân ARDS được thở máy với Vt thấp (127 – 129) đã chứng minh rằng tác động của PEEP cao đến tỷ lệ tử vong thay đổi tùy theo PaO2/FiO2 (109). PEEP cao có liên quan đến giảm tỷ lệ tử vong ở bệnh nhân có PaO2/FiO2 dưới 200 mm Hg (ARDS trung bình hoặc nặng), trong khi xu hướng tác dụng ngược lại được quan sát thấy ở những bệnh nhân thiếu oxy ít nghiêm trọng hơn (200 < PaO2/FiO2 < 300 mm Hg). Một lập luận khác về việc tính đến oxygen hóa cho cài đặt PEEP được đưa ra bởi Goligher và các đồng nghiệp, họ đã phân tích hồi cứu kết quả của các thử nghiệm LOVS (Nghiên cứu thông khí mở phổi) và ExPress (Nghiên cứu áp suất thở ra) (246): tác động của việc tăng PEEP đối với quá trình oxygen hóa rất khác nhau và mức độ tăng PaO2/FiO2 do PEEP gây ra có liên quan chặt chẽ với việc giảm tỷ lệ chênh lệch điều chỉnh đối với tử vong.
Phép đo Vd/Vt đã được đề xuất như một công cụ để xác định mức PEEP tối ưu (155), nhưng mức độ thay đổi của PaCO2 thứ cấp so với PEEP thường quá nhỏ để cho phép dễ dàng xác định mức tối ưu (181, 182). Cuối cùng, Caironi và các đồng nghiệp đã báo cáo rằng sự kết hợp tốt nhất của các thông số sinh lý dự đoán việc huy động rõ rệt hơn được đo bằng CT scan là PaO2/FiO2 dưới 150 mm Hg trên PEEP 5 cm H2O, cùng với việc tăng độ giãn nở của hệ hô hấp và giảm Vd/Vt khi PEEP tăng từ 5 lên 15 cm H2O (247).
Nhìn chung, những phát hiện này gợi ý mạnh mẽ rằng việc chuẩn độ PEEP riêng lẻ ở bệnh nhân mắc ARDS nên tính đến các tác động lên cả quá trình oxygen hóa và thải trừ CO2.