Hóa sinh
TỔNG QUAN VỀ CHUYỂN HÓA NĂNG LƯỢNG SINH HỌC TRONG CƠ THỂ
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
nhathuocngocanh.com – Bài viết TỔNG QUAN VỀ CHUYỂN HÓA NĂNG LƯỢNG SINH HỌC TRONG CƠ THỂ
ĐẠI CƯƠNG
Nhắc lại một số khái niệm về nhiệt động học
Joule (jun)
– Ký hiệu là J, lấy tên theo nhà vật lý học người anh Prescott Joule.
Định nghĩa: 1 jun là NL thực hiện khi có 1 lực 1 N (Newton) tác dụng lên vật thể và điểm đặt lực lên vật thể chuyển dời được 1 mét (hoặc có thể định nghĩa là 1 giây thực hiện công với công suất 1 W (Watt)).
| Tiền tố’ | Kết hợp đơn vị Jun | Giá trị | Cách đọc bội số |
| Y | YJ | 1×1024 J | Yôtajun |
| Z | ZJ | 1×1021 J | Zêtajun |
| E | EJ | 1×1018 J | Êxajun |
| P | PJ | 1×1015 J | Pêtajun |
| T | TJ | 1×1012 J | Têrajun |
| G | GJ | 1×109J | Gigajun |
| M | MJ | 1×106J | Megafun |
| k | kJ | 1×103J | Kilôjun |
Calorie (cal)
Định nghĩa: Là nhiệt lượng cần thiết để đun nóng 1g nước lên thêm 10C, ở trong điều kiện bình thường.
- Có thể chuyển đổi giữa jun với calorie theo tỷ lệ: 1 cal = 4,186 J.
Enthalpy (H)
Được đưa ra bởi nhà vật lý học Hà Lan Heike Kamerlingh Onnes những năm đầu thế kỷ 20.
Định nghĩa: Là sự biến thiên nhiệt lượng khi 1 mol của 1 chất phản ứng hoàn toàn với O2 ở 2980K và 1 atm.
Khi 1 chất hữu cơ bị đốt cháy hoàn toàn sẽ giải phóng NL, đó là NL toàn phần chứa trong hợp chất, và NL không thể sử dụng để tạo ra công có ích trực tiếp.
Entropy (S)
Định nghĩa: Trong cơ học thống kê, entropy là 1 đơn vị đo lường khả năng mà 1 hệ có thể rơi vào trạng thái độ trong 1 tình trạng, thường được gọi là “sự lộn xộn” hay “tính bừa” thể hiện trong 1 hệ.
Đây cũng là 1 đơn vị đo nhiệt năng phát tán, hấp thu khi 1 hệ vật lý chuyển trạng thái tại 1 nhiệt độ tuyệt đối xác định T.
Đại lượng phản ánh trạng thái nội tại của phân tử trong 1 số’ trường hợp:
+ S của hệ thống biệt lập (kín) tăng khi độ vô trật tự tăng.
+ Trong điều kiện tự nhiên (không có sự can thiệp từ bên ngoài hệ thống), S chỉ có thể tăng.
NL tự do Gibbs (G)
Được Josiah William Gibbs nêu ra đầu tiên, ký hiệu là G.
Định nghĩa: Là NL vốn có của một hệ thống, khi cần nó được dùng để thực hiện công dưới các điều kiện và áp suất nhất định.
Đây cũng là NL có khả năng biến thành công có ích khi chất đó bị biến đổi trong quá trình sinh hóa học.
Mối tương quan giữa các đại lượng G, H và S
G, H và S liên hệ với nhau bởi hệ thức sau đây:
G = H – TS (T được tính theo độ Kelvin)
Từ hệ thức trên, ta có các kết luận sau:
+ G của 1 chất luôn bé hơn H của chất đó.
+ Sự khác biệt G và H thay đổi theo nhiệt độ, và là 1 hàm số phụ thuộc S.
+ G của 1 chất tăng cùng với H và giảm khi S lớn.
Cũng từ hệ thức trên, mà ta có hệ thức biến thiên của G như sau:
AG = AH – TAS (T được tính theo độ Kelvin)
Với: AG: Biến thiên G (Kcal).
AH: Biến thiên H, NL toàn phần (Kcal).
T: Nhiệt độ tuyệt đối (K). AS: Biến thiên S (Kcal/K).
Biện luận về giá trị của AG, AH và AS
Biên luận về enthalpy (AH):
- AH < 0: Nhiệt lượng phóng thích ra từ các phân tử, phản ứng dễ xảy ra.
- AH > 0: Nhiệt lượng hấp thu từ môi trường, phản ứng khó xảy ra.
Biên luận về entropy (AS):
- AS < 0: Giảm độ hỗn độn, giảm chuyển động va chạm của các phân tử, tăng mức NL của hệ thống, phản ứng khó xảy ra.
- AS > 0: Tăng độ hỗn độn, tăng chuyển động va chạm của các phân tử, giảm mức NL của hệ thống, phản ứng dễ xảy ra.
Biên luận về NL tự do Gibbs (AG):
- Do AG phụ thuộc vào AH và AS, ta có bảng sau:
| AS < 0 | AS > 0 | |
| AH < 0 | AG không xác định được. | AG < 0, phản ứng dễ xảy ra (phản ứng phát năng). |
| AH > 0 | AG > 0, phản ứng khó xảy ra (phản ứng thu năng). | AG không xác định được. |
Ngoài các trường hợp trên, ta còn có trường hợp AG = 0 (AH = TAS), lúc này phản ứng xảy ra không thu cũng không phát NL (phản ứng ở trạng thái cân bằng).
AG trong phản ứng hóa sinh
AG của 1 phản ứng phụ thuộc vào bản chất, điều kiện, tỷ lệ nồng độ các chất:
AG = AG0 + RTln® (với AG0 là biến thiên chuẩn ở 250C, pH = 0, [A] = [B] = 1,0M)
Từ phương trình trên, ta có các kết luận sau:
+ AG của 1 phản ứng phụ thuộc vào AG0.
+ Bản chất hóa học của phản ứng tỷ lệ với nồng độ chất tham gia và tạo thành, không phụ thuộc vào con đường chuyển hóa.
+ Đối với các phản ứng sinh học, AG và AG0 lúc này sẽ được đo ở nhiệt độ 250C, pH = 7 (AG’ và AG0‘).
Khi phản ứng sinh học tại thời điểm cân bằng ([A] = [B], AG = 0), lúc này ta có phương trình:
AG0′ = – RTln(K’) (với K’ là hệ số’ cân bằng phản ứng trong điều kiện sinh học)
Hệ số’ cân bằng K cũng từ phương trình trên có thể được tính như sau:
K’ = 10-AG°’/1,36
Với 2 hệ thức trên, ta có các trường hợp:
+ Nếu trạng thái cân bằng của phản ứng xác lập => K’ = 1 => AG0′ = 0 => Phản ứng không xảy ra trong điều kiện sinh học.
+ Nếu trạng thái cân bằng của phản ứng được xác lập với nhiều sản phẩm hơn chất tham gia = > K’ > 1 => AG0′ < 0 => Phản ứng chắc chắn phát năng trong điều kiện sinh học.
PHẢN ỨNG OXY HÓA KHỬ
Định nghĩa
Là những phản ứng có sự vận chuyển điện tử từ cơ chất nhường điện tử (chất khử) sang chất thu điện tử (chất oxy hóa).
Phản ứng oxy hóa:
Phản ứng khử:
Chất oxy hóa + n e– (điện tử) -> Chất khử
Hệ thống oxy hóa-khử
Phản ứng oxy hóa-khử là phản ứng có sự nhường/nhận điện tử; có/không sự tham gia trực tiếp của nguyên tử oxy.
Trong phản ứng oxy hóa-khử có sự tham gia của từng cặp (hoặc từng hệ thống) oxy hóa-khử được ký hiệu bởi cách viết “Chất oxy hóa/chất khử”, VD: Fe3+/Fe2+,
Trong 1 hệ thống hay 1 phản ứng oxy hóa-khử của phản ứng thuận nghịch (VD: Fe3+/Fe2+ hoặc Cu2+/Cu+ trong phản ứng Fe2+ + Cu2+ ~ Fe3+ + Cu+), dựa vào thế năng oxy hóa-khử của từng cặp oxy hóa-khử sẽ phán đoán được chiều của phản ứng.
Thế năng oxy hóa-khử
| Quá trình đồng hóa | Quá trình dị hóa |
| – Là quá trình biến đổi các đại phân tử từ thức ăn thành các đại phân tử của cơ thể, cần sử dụng NL lấy từ quá trình dị hóa.
– VD: Trong tế bào, acetyl-CoA từ thức ăn được sử dụng như là nguyên liệu để tổng hợp thành |
– Là quá trình biến đổi các đại phân tử từ thức ăn hay từ cơ thể thành chất trung gian cuối cùng là acetyl-CoA và tạo ATP dự trữ.
– VD: Thức ăn sẽ được tiêu hóa và hấp thụ tại ruột non, sau đó các đại phân tử (glucid, lipid, |
Quá trình đồng hóa và quá trình dị hóa những phân tử tiền chất (acid amin, glucose, acid béo,…), các phân tử tiền chất này được tế bào sử dụng để tổng hợp thành Pr, lipid và acid nucleic.
Các cách vận chuyển hydro và điện tử trong tế bào
Trực tiếp dưới dạng e–: VD: Fe2+ + Cu2+ Fe3+ + Cu+.
Dưới dạng ion hybrid (H–, điện tử chuyên chở từ chất cho sang chất nhận dưới dạng ion hybrid (bao gồm 2e– và H+)):
VD:
NAD+ + H+ + 2e- NADH
NAD+ + 2H+ + 2e- NADH + H+
Dưới dạng liên kết với oxy: Như dạng oxy hóa 1 ion hydrocarbon thành alcol:
R-CH3 + 1/2O2 – R-CH2-OH
Thế năng oxy hóa-khử
- Trong 1 dung dịch hiện diện 2 cặp oxy hóa-khử, điện tử (hay hydro) sẽ chuyển từ chất cho điện tử sang chất nhận điện tử.
- Thế năng oxy hóa-khử là 1 đại lượng đo lường khả năng oxy hóa của 1 hợp chất, cho biết chiều của phản ứng, được tính như sau:
Trong điều kiện chuẩn (Phương trình Nernst):

Trong điều kiện sinh học:

– Trong 2 phương trình trên:
E:Thế năng oxy hóa-khử
E0 : Thế năng oxy hóa-khử ở 00C, pH = 0 và [Nhận e–] = [Cho e–] E0‘: Thế năng oxy hóa-khử ở 250C, pH = 7 (Điều kiện sinh học) n: Số’ e– di chuyển (mỗi phân tử)
R: Hằng số’ khí lý tưởng (8315 J/mol.K = 1987 cal/mol.K)
T: Nhiệt độ tuyệt đối Kelvin (25 + 273 = 2980K)
F: Hằng số’ Faraday (96500 V/J.mol)
– Từ 2 phương trình trên, ta có các kết luận sau:
+ 1 cặp oxy hóa-khử được xác định bởi 1 cặp thế’ năng oxy hóa-khử chuẩn E0‘.
+ Hệ thống có khả năng oxy hóa-khử thấp dễ cho điện tử (và ngược lại).
+ Điện tử (hay hydro) sẽ di chuyển từ hệ thống có thế năng oxy hóa-khử thấp đến hệ thống có oxy hóa-khử cao (từ chất khử sang chất oxy hóa).
+ Các phản ứng oxy hóa-khử trong cơ thể sẽ đi theo chiều nhất định, được quy định bởi thế năng oxy hóa-khử chuẩn của từng cặp oxy hóa-khử. VD: Trong chuỗi hô hấp tế bào, e– sẽ vận chuyển từ hệ thống NAD/NADH+ đến FAD/FADH2.
| Nửa phản ứng | E0‘ |
| 72O2 + 2H+ + 2e– -> H2O | 0,816 |
| Fe3+ + e– -> Fe2+ | 0,771 |
| Cytochrome a3 (Fe3+) + e– -> Cytochrome a3 (Fe2+) | 0,35 |
| O2 + 2H+ + 2e– -> H2O2 | 0,295 |
| Cytochrome a (Fe3+) + e– -> Cytochrome a (Fe2+) | 0,29 |
| Cytochrome c (Fe3+) + e– -> Cytochrome c (Fe2+) | 0,254 |
| Cytochrome ci (Fe3+) + e– -> Cytochrome ci (Fe2+) | 0,22 |
| Cytochrome b (Fe3+) + e– -> Cytochrome b (Fe2+) | 0,077 |
| Ubiquinone + 2H+ + 2e– -> Ubiquinol + H2 | 0,045 |
| Furamate2- + 2H+ + 2e– -> Succinate2- | 0,031 |
| Oxaloacetate2- + 2H+ + 2e– -> Malate2- | -0,166 |
| Pyruvate– + 2H+ + 2e– -> Lactate– | -0,185 |
| FAD + 2H+ + 2e– -> FADH2 | -0,219 |
| Glutahion + 2H+ + 2e -> 2 glutahion khử | -0,23 |
| S + 2H+ + 2e– -> H2S | -0,243 |
| NAD+ + H+ + 2e– -> NADH | -0,32 |
| NADP+ + H+ + 2e– -> NADPH | -0,324 |
| Acetoacetate + 2H+ + 2e– -> 0-hydroxybutyrate | -0,346 |
| a-ketoglutarate + CO2 + 2H+ + 2e– -> Isocitrate | -0,38 |
Liên quan giữa AG0‘ và AE0‘
Ta có hệ thức sau:
AG0‘ = -nFAE0‘
Trong hệ thức trên: n: Số e– di chuyển (mỗi phân tử)
F: Hằng số’ Faraday (96500 V/J.mol)
= > Ta kết luận rằng các phản ứng oxy hóa-khử xảy ra luôn đi kèm sự phát năng:
+ Một phần sử dụng tùy nhu cầu tế bào.
+ Phần còn lại tích trữ trong các liên kết giàu NL.
CÁC LOẠI LIÊN KẾT PHOSPHATE
Phosphoryl hóa và khử phosphoryl
Định nghĩa
– Là phản ứng gắn gốc phosphate (-H2PO4), ký hiệu là ® vào hợp chất hữu cơ hay khử từ hợp chất hữu cơ.
| Quá trình phosphoryl hóa | Quá trình khử phosphoryl |
| – Tạo liên kết phosphate.
– Cơ chất là phosphate vô cơ hoặc hữu cơ. – Tích trữ NL, hoạt hóa chất, enzyme (thu năng). |
– Cắt đứt liên kết phosphate.
– Tạo phosphate vô cơ, chuyển gốc từ chất này sang chất khác. – Giải phóng NL, hoạt hóa enzyme (phát năng). |
Hai quá trình này thường xảy ra đồng thời, gọi là phản ứng liên hợp.
NL của liên kết
– Là mức chênh lệch NL tự do giữa hợp chất chứa liên kết này và hợp chất sau khi liên kết này bị cắt đứt.
Dựa vào mức NL giải phóng mà ta có 2 loại sau:
| Liên kết phosphate giàu NL | Liên kết phosphate nghèo NL |
| – Nếu giải phóng NL tự do > 6,6 kcal/mol khi bị thủy phân cắt đứt liên kết.
– Tương đối kém bền, ký hiệu là ~® (hay ~P). – Gồm 4 nhóm liên kết phosphate và liên kết thioeste: + Acyl-phosphate (1,3 diphosphoglycerate) + Enol-phosphate (phosphoenolpyruvate) + Pyrophosphate (ATP và ADP) + Phosphamid (Creatin-phosphate) + Thioester (Acetyl-CoA và acyl-CoA) |
– Nếu giải phóng NL tự do < 5 kcal/mol khi bị thủy phân cắt đứt liên kết.
– Tương đối bền, ký hiệu là -® (hay -P). – Một số’ liên kết nghèo NL thường gặp trong cơ thể là: + Liên kết ester-phosphate (hexose-phosphate) + Liên kết carboxyl-ester (glycerid) + Liên kết glycoside (polysaccharide) + Liên kết peptide (Pr) |
| Hợp chất mang liên kết | NL tự do (AG0‘) | |
| KJ/mol | Kcal/mol | |
| Phosphoenolpyruvate | -61,9 | -14,8 |
| 1,3-diphosphoglycerate (^3–phosphoglycerate + Pi) | -49,3 | -11,8 |
| Creatin phosphate | -43,0 | -10,3 |
| ADP ( -> AMP + Pi) | -32,8 | -7,8 |
| ATP (-> ADP + Pi) | -30,5 | -7,3 |
| ATP (-> AMP + Pi) | -45,6 | -10,9 |
| AMP (-> adenosine + Pi) | -14,2 | -3,4 |
| PPi (^ 2 Pi) | -19,2 | -4,0 |
| Acetyl-CoA | -31,4 | -7,5 |
| Glucose 1-phosphate | -20,9 | -5,0 |
| Fructose 6-phostphate | -15,9 | -3,8 |
| Glucose 6-phosphate | -13,8 | -3,3 |
| Glycerol 3-phosphate | -9,2 | -2,2 |
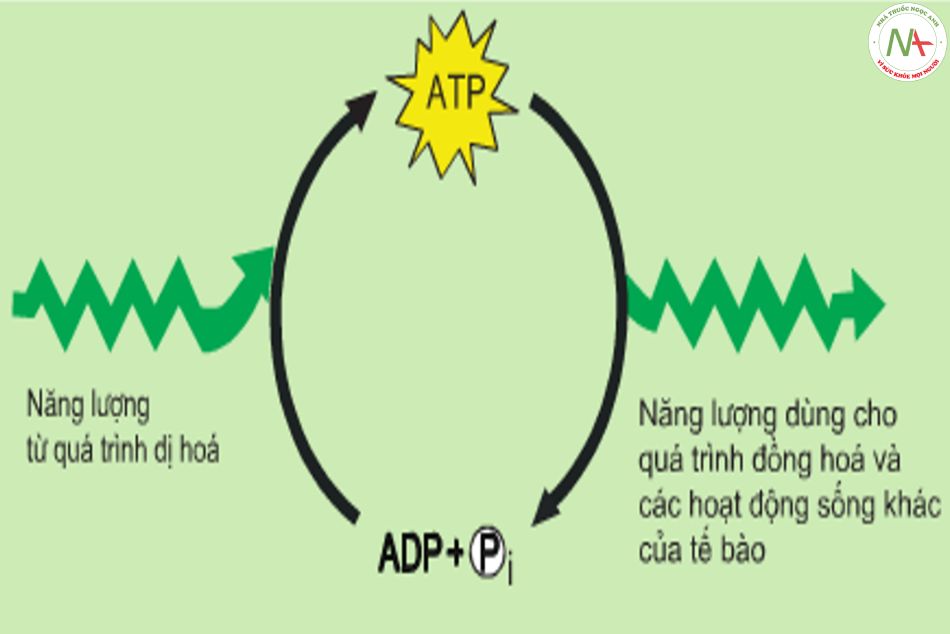
Adenosine triphosphate (ATP)
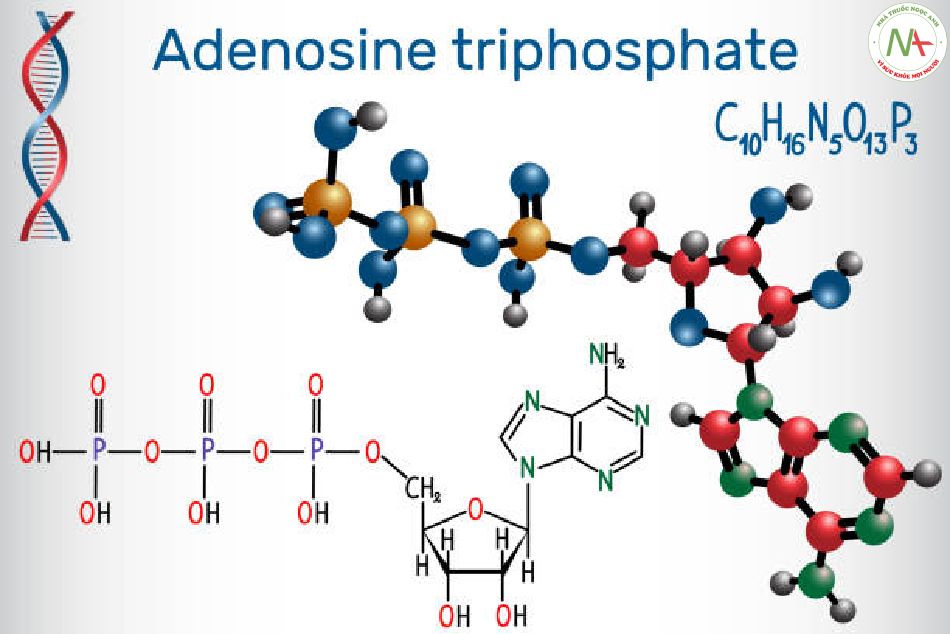
- NL từ các phản ứng phát năng của tế bào dùng để tổng hợp ATP = > ATP có vai trò dự trữ NL của tế bào.
- Quá trình tổng hợp ATP xảy ra tại ty thể, tuy nhiên lượng ATP trong tế bào không nhiều => Không tích trữ đủ NL cần thiết cho tế bào.
- Vai trò trung tâm trong chuyển hóa NL là do hệ thống ATP-ADP.
Vai trò của phosphoryl hóa và khử phosphoryl
Tích trữ NL
- Khi nồng độ ATP cao, ATP được khử phosphoryl và NL giải phóng được tích trữ trong liên kết phosphamid của creatine phosphate.
- Khi tế bào cần NL, creatine phosphate được khử phosphoryl, chuyển liên kết phosphate sang ADP (ADP -> ATP):
Creatine + ATP ⇔ ADP + Creatine phosphate
Sử dụng NL:
- Tế bào sử dụng NL trực tiếp từ ATP, tất cả NL khác đều phải biến đổi thành ATP để tế bào sử dụng.
- ATP được khử phosphoryl thành ADP và Pi (P vô cơ).
- Creatine phosphate được coi là hệ trữ NL thứ hai của cơ thể, có nhiều ở cơ vân – mô sử dụng nhiều NL.
CHUỖI HÔ HẤP TẾ BÀO
Bản chất chuỗi hô hấp tế bào
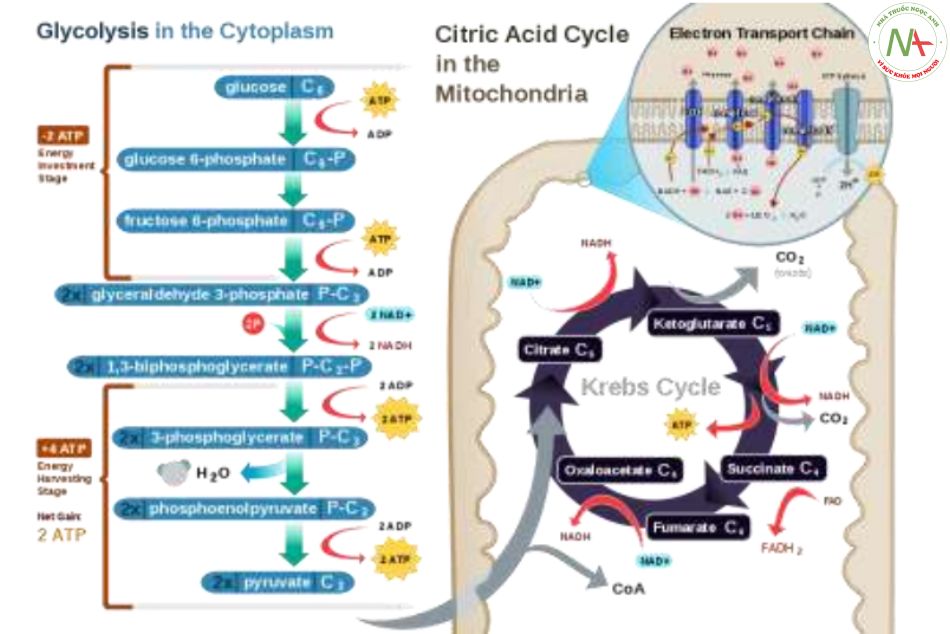
– Việc đốt cháy các phân tử hữu cơ ngoài cơ thể sẽ tạo ra NL, H2O và CO2, xảy ra trực tiếp với O2
khí trời và có thể có ngọn lửa.
- Bên trong cơ thể, việc tạo ra NL cũng cần O2 và quá trình diễn ra bên trong tế bào ở 370C và pH tế bào, đó là những phản ứng vận chuyển hydro và điện tử tạo H2O, NL và phản ứng carboxyl tạo CO2.
= > Chuỗi hô hấp ở tế bào là sự “đốt cháy” các chất hữu cơ trong cơ thể, hay còn gọi là oxy hóa-khử tế bào hay sự oxy hóa sinh học.
- Tổng quát về chuỗi hô hấp tế bào: A B C D E.
- Quá trình oxy hóa các chất hữu cơ do sự tách dần từng cặp nguyên tử hydro (2H), cặp nguyên tử H này sẽ được vận chuyển qua 1 hệ thống enzyme ở ty thể để tạo thành H2
– Trong quá trình trên, có sự tạo thành những acid hữu cơ trung gian, sau đó sẽ được khử carboxyl nhờ decarboxylase => Tạo thành CO2.
– Vì quá trình hô hấp tế bào là 1 quá trình oxy hóa khử trong điều kiện sinh học, NL sẽ được giải phóng dần trong quá trình và tích trữ trong các phân tử ATP.
Các yếu tố tham gia chuỗi hô hấp tế bào
– Chuỗi hô hấp tế bào xảy ra ở màng trong ty thể, với sự tham gia của 1 số’ chất giữ vai trò vận chuyển H => Tạo thành 1 “dây chuyền hô hấp”:
+ Cơ chất cung cấp H: 1 số’ chất trung gian của quá trình chuyển hóa.
+ Dehydrogenase có coenzyme là NAD+ ; FAD hoặc FMN (FlaviPr).
+ Ubiquinone (còn gọi là coenzyme Q).
+ ETFP (Electron Transferring FlavoPr hay Fe-S Pr).
+ Hệ thống cytochrome, gồm cytochrome a, b, c.
+ O2.
+ 1 số enzyme khác: Peroxidase, supeoxyd dimutase, catalase,…
Các chất này có khả năng:
+ Trực tiếp vận chuyển điện tử (hệ thống cytochrome có chứa Fe3+ /Fe2+).
+ Chuyên chở nguyên tử hydro (H+ + e–).
+ Chuyên chở ion hydrit (H:–, liên kết với 2e–). + Trực tiếp kết hợp với oxy hít vào.
Sự vận chuyển hydro hay e– nhờ các enzyme của chuỗi hô hấp tế bào sẽ theo trật tự từ chất có thế năng oxy hóa-khử thấp đến chất có thế năng oxy hóa-khử cao.
Mô tả chuỗi hô hấp tế bào
– Các enzyme của chuỗi hô hấp tế bào nằm ở màng trong ty thể, gồm 4 phức hợp enzyme, trong đó chỉ có ubiquinone và cytochrome c là ở dạng hòa tan.
– Quá trình vận chuyển H+ và e– diễn ra như sau:
+ Đối với 1 số cơ chất (như proline, glutamate, malate, citrate, 3- hydroacyl CoA,…), 2H+ và 2e– từ cơ chất được NAD+ trong phức hợp I tiếp nhận, chuyển cho FMN => 2e– được vận chuyển qua trung tâm Fe-S của ETFP đến ubiquinone (Q), hình thành dạng khử QH2.
+ Quá trình luân chuyển điện tử này tạo thuận lợi cho sự tống xuất 4 proton H+ (tương ứng với mỗi cặp e–) từ trong chất nền ra khoang giữa màng đôi của ty thể (cơ chế này vẫn chưa rõ) => Dòng H+ sản sinh ra 1 thế năng oxy hóa-khử giữa 2 bên màng trong ty thể (chất nền có điện thế âm hơn), thúc đẩy sự tổng hợp ATP.
+ Đối với 1 số cơ chất (như succinate, choline, glycerol-3-phospate,…), 2H+ và 2e– từ cơ chất được tiếp nhận bởi FAD trong phức hợp II => Điện trường cũng di chuyển tương tự như phức hợp I nhưng không kèm theo sự tống xuất proton H+ ra khoang giữa màng ty thể.
+ QH2 (dạng khử của ubiquinone) mang điện tử và proton từ phức hợp I và II chuyển đổi phức hợp III theo thứ tự tiếp nhận của các bán đơn vị : cytochrome b Fe-S cytochrome c => Tạo thuận lợi cho sự tống xuất 4 proton H+ (tương ứng mỗi cặp e–) từ trong chất nền ra khoang giữa màng đôi ty thể, tương tự như ở phức hợp I.
+ Dòng e– từ bán đơn vị cytochrome c của phức hợp III được vận chuyển đến phức hợp IV, theo thứ tự tiếp nhận của các bán đơn vị: Của cytochrome a3
Cub, lúc này O2 trong khí hít vào sẽ gắn với nhân heme a3 => Tạo H2O. Quá trình này sử dụng 2 proton H+ của chất nền và thúc đẩy sự tống xuất 2H+ từ chất nền ra khoang giữa màng đôi của ty thể (cơ chế vẫn chưa rõ).
– Với phức hợp I là NADH-Q oxidoreductase, phức hợp III là Q-cytochrome c oxidoreductase và phức hợp IV là cytochrome c oxidase, ta có các phương trình phản ứng sau:
Tai phức hợp I: Các điện tử được chuyển từ NADH đến coenzyme Q:
NADH + Q + 5H+ -> NAD+ + QH2 + 4H +
Tai phức hợp II: Các điện tử được vận chuyển từ QH2 qua cytochrome c:
QH2 + 2Cyto-c + 2H+ Q + 2Cyto-c + 4H+
Tai phức hợp IV: Các điện tử được vận chuyển sẽ kết hợp với O2 để tạo thành H2O: 4Cyto-c + O2 + 8H+ 4Cyto-c + 2H2O + 4H+
NL tạo thành từ chuỗi hô hấp tế bào – Hoạt động của ATP synthase
Sự vận chuyển dòng điện tử qua các phức hợp của chuỗi hô hấp tế bào trong ty thể là các phản ứng oxy hóa, đã thúc đẩy sự tống xuất H+ từ trong chất nền ra khoang giữa màng đôi của ty thể, dòng H+ này sản sinh 1 thế năng oxy hóa- khử giữa 2 bên màng trong ty thể (chất nền có điện thế âm hơn) => Thúc đẩy tổng hợp ATP.
Phản ứng oxy hóa nào có NL phóng thích >7,3 kcal/mol và gắn với việc vận chuyển 4H+ ra khoang giữa màng đôi ty thể sẽ gắn với sự phosphoryl hóa 1 ADP để tạo thành 1 ATP.
Enzyme F0F1 ATP synthase gồm 2 bán đơn vị:
+ F0 gắn vào màng trong ty thể, hoạt động như 1 kênh vận chuyển H+ từ khoang giữa màng đôi vào chất nền.
+ F1 bên trong chất nền ty thể, hoạt động như 1 “nhà máy” phosphoryl hóa ADP thành ATP.
Quá trình vận chuyển điện tử dọc chuỗi hô hấp tế bào cùng với vận chuyển proton H+ từ trong chất nền ty thể ra khoang giữa màng đôi đã tạo lực điện từ và lực hóa học thúc đẩy chuyển proton H+ theo hướng ngược lại (từ khoang giữa vào lại chất nền): Mỗi 4 proton H+ được vận chuyển từ chất nền ty thể ra khoảng giữa sẽ thúc đẩy 3 proton H+ từ khoảng giữa vào chất nền ty thể (qua bán đơn vị F0 xuyên màng đi vào bán đơn vị F1 nằm trong chất nền ty thể).
Khi 3 proton H+ di chuyển vào enzyme ATP synthase (nằm trong F1) sẽ tạo được 1 phân tử ATP nhờ sự xoay vòng của các cặp bán đơn vị a-0 của enzyme này.
Cơ chế hoạt động này được trao giải thưởng Nobel hóa học năm 1997 cho 3 nhà bác học Paul D. Boyer, John E Walker và Jens C Skou.
Quá trình trên được gọi là quá trình phosphoryl oxy hóa, kết hợp với việc vận chuyển điện tử (tạo thế năng điện tử với chất nền ty thể có thế năng âm hơn), từ đó thúc đẩy việc vận chuyển proton H+ từ màng trong ty thể ra khoang giữa màng đôi; đồng thời tạo sự thay đổi pH ở 2 bên màng trong ty thể (chất nền ty thể kiềm hơn) => Phát sinh NL hóa học thúc đẩy phản ứng tổng hợp ATP nhờ enzyme ATP synthase.
Cơ chế ghép điện hóa được trao giải thưởng Nobel hóa học 1978 cho nhà bác học Peter D Michell.
Như vậy, nếu cơ chất được tiếp nhận H+ và e– từ NAD+ sẽ tống xuất lần lượt 4H+ (phức hợp I), 4H+ (phức hợp III) và 2H+ (phức hợp IV) ra khoang giữa màng đôi, thúc đẩy tạo được 1 ATP, 1 ATP và 0,5 ATP, tổng cộng là 2,5 ATP. Trong trường hợp cơ chất tiếp nhận H+ và e– từ FAD sẽ tóng xuất lần lượt 4H+ (phức hợp III) và 2H+ (phức hợp IV) và thúc đẩy tạo được 1 ATP và 0,5 ATP, tổng cộng là 1,5 ATP.
Tỷ số phosphoryl oxy hóa (P/O): Là tỷ số’ giữa phân tử phosphate vô cơ được sử dụng để phosphoryl hóa ADP thành ATP trên số’ nguyên tử oxy được sử dụng (khi 1 nguyên tử oxy bị khử thành O2-).
+ Tỷ số’ P/O đối với NADH,H+ là 2,5 (được chấp nhận là 3).
+ Tỷ số’ P/O đối với FADH2 là 1,5 (được chấp nhận là 2).
Điều hòa hoạt động của chuỗi hô hấp tế bào
Hoạt động của chuỗi hô hấp tế bào phụ thuộc vào nhu cầu NL của tế bào, thể hiện thông qua 2 chỉ số là nồng độ ADP nội bào và tỷ số giữa [ATP]/[ADP].[Pi].
4 yếu tố kiểm soát nồng độ ATP và ADP nội bào là:
+ Hoạt động ATP synthase.
+ Hoạt động chu trình Krebs (cung cấp cơ chất).
+ Hoạt động hô hấp (cung cấp O2).
+ Hoạt động của quá trình ly giải đường (chu trình HDP, nhằm cung cấp cơ chất acetyl-CoA).
Các chất ức chế chuỗi hô hấp tế bào
1 số chất tác động ức chế đặc hiệu sự vận chuyển điện tử trong chuỗi hô hấp tế bào và được sử dụng để nghiên cứu quá trình vận chuyển điện tử:
+ Rotenon và amytal ức chế vận chuyển điện tử từ phức hợp I do ức chế sự oxy hóa NADH, tuy nhiên điện tử vẫn được chuyển từ FADH2 đến ubiquinone (phức hợp II).
+ Antimycin A ức chế sự vận chuyển điện tử ở cytochrome bc (phức hợp III). + CN- hoặc CO ức chế cytochrome oxidase (phức hợp IV).
+ Ngoài ra còn 1 số acid amin tham gia vào ức chế quá trình (VD: thyroxine,…).
– Bên cạnh đó, sự phá ghép còn ức chế sự phosphoryl hóa => Chuỗi truyền điện tử vẫn xảy ra bình thường, nhưng
NL không thể dự trữ trong các phân tử ATP.
Các quá trình oxy hóa khác trong tế bào
Bên cạnh chuỗi hô hấp tế bào, trong tế bào còn có 1 số’ quá trình oxy hóa khác, có sự vận chuyển H+ và e– nhưng không tạo ATP (VD: Hoạt động của glutathion hoặc các phần tử được xúc tác bởi các enzyme oxidase hoặc oxygenase trong cơ thể).
Glutathion là 1 tripeptide của chứa cysteine-SH => Có thể cho nhận e- để luân chuyển giữa 2 dạng khử và oxy hóa, có vai trò bảo vệ enzyme có nhóm -SH hoạt động khỏi bị ức chế bởi tác nhân oxy hóa (peroxide) hay những chất có thể liên kết với nhóm -SH, bảo vệ màng hồng cầu khỏi vỡ.
CHU TRÌNH ACID CITRIC
Sơ lược về quá trình dị hóa
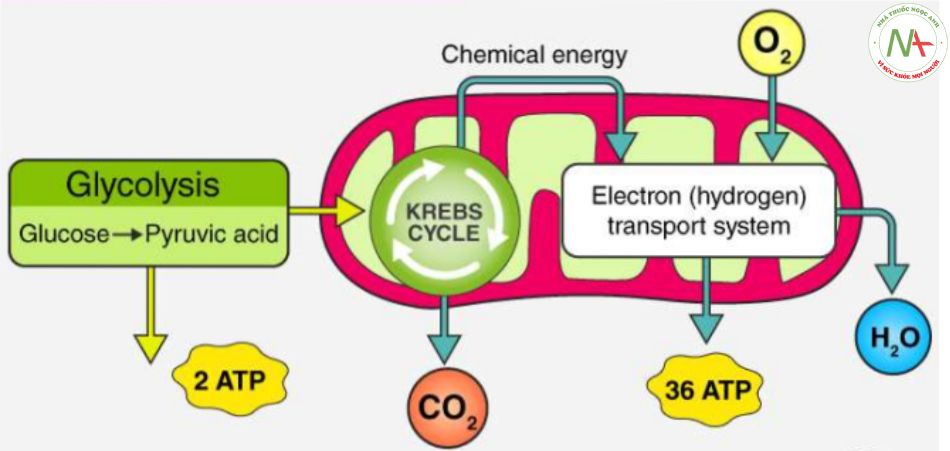
– Quá trình dị hóa gồm 3 giai đoạn chính:
Tao acetyl-CoA: Glucose, acid béo và acid amin được thoái hóa theo những con đường riêng để tạo chất trung gian chuyển hóa chung là acetyl-coenzyme (CH3-CO- CoA).
Oxy hóa acetyl-CoA: Acetyl-CoA được chuyển hóa trong chu trình acid citric để tạo thành những cơ chất cho H+.
Vãn chuyển điện tử và phosphoryl-oxy hóa: Những cơ chất cho H+ sẽ vận chuyển H+ và e–qua chuỗi hô hấp tế bào đến O2 hít vào và tạo ATP.
Khái niệm về chu trình acid citric
Chu trình acid citric (còn gọi là chu trình Krebs hoặc chu trình tricarboxylic acid – TCA) là 1 giai đoạn trung gian của quá trình tạo NL từ glucid, lipid và protid (giai đoạn thoái hóa cuối cùng của chung glucid, lipid và protid).
Các giai đoạn của chu trình acid citric
- Chu trình acid citric xảy ra trong ty thể (chất nền ty thể) của tế bào có nhân (hoặc bào tương của tế bào nhân sơ), gồm 8 giai đoạn ứng với 9 phản ứng, trong đó chỉ có phản ứng số’ 1, số’ 3 và số’ 4 là phản ứng 1 chiều, còn lại là các phản ứng thuận nghịch:
- Tạo thành citrate từ acetyl-CoA và oxalate nhờ enzyme citrate synthase.
- , (2′): Tạo thành isocitrate nhờ enzyme aconitase qua 2 phản ứng chuyển citrate thành cis-aconitate rồi thành isocitrate.
- Khử carboxyl hóa isocitrate để tạo thành a-ketoglutarate nhờ enzyme isocitrate dehydrogenase và coenzyme NAD+ và NADP+ (tùy isoenzyme).
- Khử carboxyl a-ketoglutarate thành succinyl-CoA nhờ phức hợp enzyme a- ketoglutarate dehydrogenase và coenzyme NAD+.
- Chuyển succinyl-CoA thành succinate và tạo 1 GTP nhờ enzyme succinyl-CoA synthetase, GTP sau đó nhanh chóng được chuyển thành ATP.
- Oxy hóa succinate thành fumarate nhờ enzyme succinate dehydrogenase và coenzyme FAD.
- Hydrat hóa fumarate thành malate.
- Oxy hóa malate thành oxaloacetate nhờ enzyme malate dehydrogenase, oxaloacetate lại tham gia vào chu trình mới.
Vai trò của chu trình acid citric
Tạo NL
1 phân tử acetyl-CoA tham gia vào chu trình acid citric sau khi bị oxy hóa sẽ dự trữ 10 ATP:
+ Tại vị trí phản ứng số 3, số 4 và số 8, H+ và e– được tích trữ trong 3 phân tử NADH, H+, qua chuỗi hô hấp tế bào tạo thành 3 x 2,5 = 7,5 ATP.
+ Tại vị trí phản ứng số 6, H+ và e– được tích trữ trong 1 phân tử FADH2, qua chuỗi hô hấp tế bào tạo thành 1 x 1,5 = 1,5 ATP.
+ Tại vị trí phản ứng số 5, từ 1 GTP nhanh chóng được chuyển thành 1 ATP.
Tổng hợp các chất
Các sản phẩm trung gian là tiền chất cho các quá trình chuyển hóa khác:
+ Oxaloacetate là chất trung gian trong tân tạo glucose và tổng hợp aspartate, asparagine (tiền chất tạo base pyrimidine).
+ Citrate là tiền chất tạo acid béo.
+ Succinyl-CoA là tiền chất tạo porphyrin (trong tổng hợp Hb).
+ a-ketoglutarate là tiền chất tạo glutamate và base purine.
Điều hòa chu trình acid citric
Các yếu tố điều hòa chu trình acid citric bao gồm:
+ Phức hợp pyruvate dehydrogenase: là phức hợp enzyme biến đổi pyruvate tạo ra trong quá trình đường phân thành acetyl-CoA.
+ 3 enzyme của các phản ứng không thuận nghịch (1, 3 và 4) là citrate synthase, isocitrate dehydrogenase và a-ketoglutarate dehydrogenase.
| Phân tử được điều hòa | Yếu tố gây ức chế | Yếu tố gây hoạt hóa |
| Pyruvate dehydrogenase (PHD) | ATP, NADH, H+, acetyl-CoA và acid béo (dấu hiệu cho thấy tế bào dư NL, ATP sẽ hoạt hóa 1 loại Pr kinase giúp phosphoryl hóa PHD, làm bất hoạt enzyme). | AMP, CoA, NAD+, Ca2+ (dấu hiệu cho thấy tế bào thiếu NL, phosphatase sẽ khử phosphate của PDH khiến nó trở thành dạng hoạt động). |
| Citrate synthase | NADH, H+, ATP Succinyl-CoA | ADP (ADP chính là chất hoạt hóa dị lập thể citrate synthase). |
| Isocitrate dehydrogenase | ATP | Ca2+, ADP |
| a-ketoglutarate dehydrogenase | Succinyl-CoA, NADH, H+ | Ca2+ |