Bệnh hô hấp
Theo dõi hô hấp trong quá trình thông khí cơ học: Hiện tại và Tương lai
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Bài viết Theo dõi hô hấp trong quá trình thông khí cơ học: Hiện tại và Tương lai – tải pdf tại đây.
Bản dịch của BS. Đặng Thanh Tuấn – BV Nhi Đồng 1.
Tóm tắt
Việc tăng cường áp dụng thở máy, nhận thức về tác hại của nó và sự quan tâm đến việc cá nhân hóa đã làm tăng nhu cầu theo dõi hiệu quả. Ngày càng có nhiều công cụ và phương thức theo dõi được giới thiệu trong 2 thập kỷ qua cùng với sự hiểu biết ngày càng sâu sắc về sự không đồng bộ, cơ học của phổi và thành ngực, nỗ lực hô hấp và trung khu điều hòa hô hấp. Chúng nên được sử dụng theo cách bổ sung hơn là độc lập. Một chiến lược hợp lý có thể hướng dẫn giảm các tác dụng phụ như tổn thương phổi do máy thở, rối loạn chức năng cơ hoành do máy thở, sự không đồng bộ giữa bệnh nhân và máy thở và giúp cai máy thở sớm. Tuy nhiên, sự đa dạng, phức tạp, thiếu chuyên môn và chi phí liên quan khiến việc xây dựng chiến lược theo dõi phù hợp trở thành một thách thức đối với các bác sĩ lâm sàng. Thông thường, một lượng lớn dữ liệu được cung cấp cho các bác sĩ lâm sàng khiến việc giải thích trở nên khó khăn. Vì vậy, điều cơ bản là bác sĩ hồi sức phải nhận thức được nguyên tắc, ưu điểm và hạn chế của từng công cụ. Đánh giá phân tích này bao gồm phần tường thuật đơn giản về các máy theo dõi hô hấp cơ bản và nâng cao thường được sử dụng cùng với các giới hạn và triển vọng trong tương lai của chúng.
Giới thiệu
Lịch sử thở máy (mechanical ventilation – MV) diễn ra song song với lịch sử của y học chăm sóc đặc biệt (intensive care medicine – ICM), thậm chí được coi là nền tảng của ICM.1 Một phần ba đến một nửa số bệnh nhân trong phòng chăm sóc đặc biệt (intensive care unit – ICU) nhận được MV không chỉ phản ánh vai trò cơ bản của nó mà còn tác động lớn đến chi phí và nguồn lực của ICU.2-4
Hít thở là một quá trình phức tạp bao gồm hệ thần kinh trung ương, dây thần kinh ngoại biên, thành ngực, cơ, nhu mô phổi và đường thở. Ở một người khỏe mạnh, nó được điều chỉnh tinh vi để đáp ứng nhu cầu chuyển hóa. Mặc dù việc theo dõi thường cần phải đa cơ quan và đa phương thức, nhưng đánh giá này sẽ tập trung chủ yếu vào các khía cạnh hô hấp của việc theo dõi trong ICU.
Mục đích và mục tiêu của việc theo dõi
Mục đích của MV có thể được tóm tắt như sau:
- Để đảm bảo trao đổi khí (cung cấp đủ oxy và loại bỏ carbon dioxide (CO2));
- Để giảm công thở (WOB);
- Để nghỉ ngơi và bảo vệ phổi và cơ hoành; và
- Giải phóng sớm khỏi MV.
Tổn thương phổi do thở máy (ventilator- induced lung injury – VILI) là một tác dụng phụ đã được chứng minh rõ ràng của MV. Hơn nữa, rối loạn chức năng cơ hoành do máy thở (ventilator-induced diaphragmatic dysfunction – VIDD) đã thu hút sự chú ý trong những năm qua.5 Để đảm bảo MV được cung cấp theo cách tối đa hóa lợi ích và giảm thiểu nguy cơ, việc theo dõi tập trung vào:
- Trao đổi khí đầy đủ;
- Tối ưu hóa WOB;
- Tối ưu hóa cơ học hô hấp (ví dụ: huy động phổi);
- Đồng bộ bệnh nhân-máy thở;
- Tránh thông khí có hại (ví dụ VILI và VIDD); và
- Phản hồi lại đáp ứng với các biện pháp can thiệp (ví dụ: nằm sấp, chuẩn độ áp lực dương cuối thì thở ra [PEEP], v.v.).
Việc theo dõi có thể là cơ bản (tức là bắt buộc đối với mọi bệnh nhân) hoặc nâng cao (tức là cần thiết ở những bệnh nhân phức tạp và khó thông khí hơn) (Hình 1). Một máy theo dõi lý tưởng sẽ đơn giản để áp dụng và giải thích (thân thiện với người dùng), không tốn kém, không xâm lấn, di động, cung cấp dữ liệu thời gian thực, chính xác và giúp cá nhân hóa việc quản lý (Bảng 1).
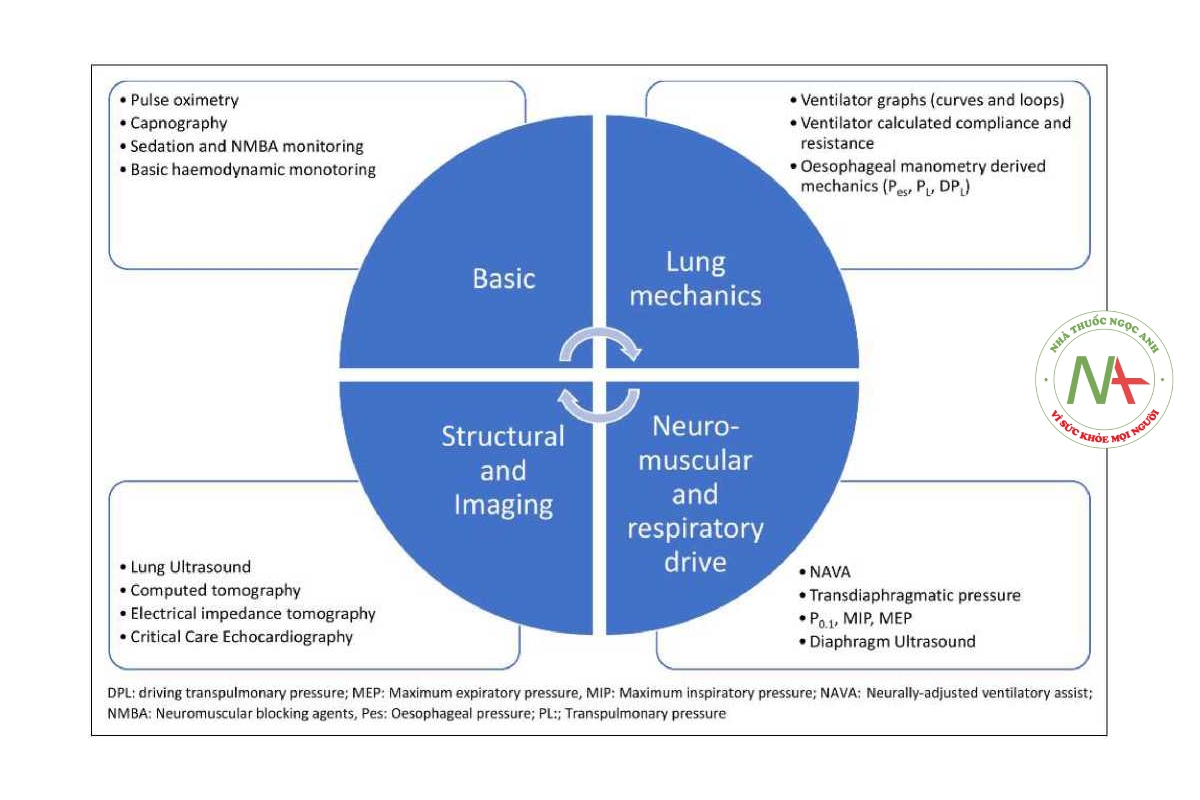
Bảng 1. Các công cụ theo dõi hô hấp phổ biến trong thở máy.
| Dụng cụ | Các thông số và phép đo | Vai trò | Lợi thế | Giới hạn |
| Đo oxy xung | SpO2 | Theo dõi cơ bản quá trình trao đổi khí (mức độ oxy trong máu) | Không xâm lấn, đơn giản, rẻ tiền, nhỏ, di động, thời gian thực và liên tục |
|
| Capnography | Biểu đồ capnography (độ dốc pha III)
ETCO2 |
Theo dõi cơ bản trao đổi khí
Theo dõi thuốc chẹn thần kinh cơ và co thắt phế quản Tính toán khoảng chết Xác nhận vị trí ETT |
Không xâm lấn, đơn giản, rẻ tiền, nhỏ, di động, thời gian thực và liên tục |
|
| Máy thở | RR
Áp lực, thể tích khí lưu thông Đường cong (áp lực, thể tích, lưu lượng) Vòng lặp (áp lực/thể tích, thể tích/lưu lượng) Độ giãn nở hệ thống hô hấp Sức cản đường thở |
Theo dõi các biến số hô hấp (áp lực, thể tích, lưu lượng, RR)
Theo dõi đáp ứng của phổi với các thủ thuật (ví dụ, nằm sấp) Không đồng bộ bệnh nhân-máy thở |
|
|
| Công cụ P/V | Khả năng huy động Chuẩn độ PEEP |
|
|
|
| MIP, Po 1 | Sức mạnh cơ hô hấp Trung khu hô hấp | Dự đoán kết quả cai máy |
|
|
| Siêu âm | Siêu âm màng phổi
Siêu âm phổi Siêu âm cơ hoành (chuyển động, dày lên và độ dày) |
Chẩn đoán tràn dịch màng phổi, tràn khí màng phổi, đông đặc và phù phổi.
Cấu trúc và chức năng cơ hoành |
|
|
| Đo áp lực thực quản | Pes
Pl DPl PTP APdi |
peep và chuẩn độ áp lực khác
Định lượng stress phổi Định lượng công thở Đồng bộ bệnh nhân- máy thở |
|
|
| NAVA | Edi | Theo dõi hoạt động điện của cơ hoành |
|
|
| EIT | Thông khí khu vực tưới máu phổi | Thông khí khu vực và stress
Tưới máu phổi |
|
|
Chữ viết tắt: COHb, carboxyhemoglobin; DPl, áp lực đẩy xuyên phổi; EIT, chụp cắt lớp sức cản điện; ETT, ống nội khí quản; ETCO2, carbon dioxide cuối thì thở ra; MetHb, methemoglobin; MIP, áp lực hít vào tối đa; NAVA, Hỗ trợ thông khí được điều chỉnh bằng thần kinh; APdi, áp lực xuyên cơ hoành; Pes, áp lực thực quản; APl, áp lực đẩy xuyên phổi; Pl, áp lực xuyên phổi; peep, áp lực dương cuối thì thở ra; PTP, tích số áp lực thời gian; RR, nhịp thở.
Theo dõi cơ bản
Trao đổi khí
Đảm bảo trao đổi khí đầy đủ là mục tiêu chính của MV (tức là loại bỏ CO2 và cải thiện sự khuếch tán O2). Nó có thể được thực hiện chính xác nhất bằng cách lấy mẫu khí máu động mạch (arterial blood gas – ABG). Mặc dù có độ chính xác cao nhưng thủ thuật này mang tính xâm lấn, không liên tục và yêu cầu lấy mẫu máu để có kết quả hơi chậm. Điều này đã thúc đẩy sự quan tâm cách đây 2 thập kỷ đối với các cảm biến nội mạch liên tục theo dõi ABG. Điều này cuối cùng đã không được áp dụng rộng rãi vào thực hành lâm sàng do lo ngại về độ chính xác, chi phí, độ giòn (brittleness) của thiết bị, độ lệch so với oxy mô và sự quan tâm ngày càng tăng đối với việc theo dõi không xâm lấn.6
Hai máy theo dõi không xâm lấn có thể thay thế ABG với độ chính xác hợp lý: đo độ bão hòa oxy mạch nẩy và chụp capnography mang lại lợi thế bổ sung là liên tục, thời gian thực, không xâm lấn và giảm khối lượng công việc của nhân viên.
=> Đọc thêm: Tìm kiếm áp lực dương cuối thì thở ra tối ưu để thông khí bảo vệ phổi.
Đo oxy mạch nẩy
Đo độ bão hòa oxy mạch nẩy đo độ bão hòa oxy qua da dựa trên 2 nguyên tắc: tín hiệu mạch đập và quang phổ hấp thụ ánh sáng riêng biệt của oxyhemoglobin so với hemoglobin khử.7 Phương pháp này rẻ tiền, không xâm lấn, sử dụng đơn giản và có thể áp dụng ở mọi nơi từ nhà đến ICU. Trong đại dịch COVID- 19, nó đã nhận được sự quan tâm đặc biệt vì nhiều bệnh nhân bị thiếu oxy máu thầm lặng.8
Độ bão hòa oxy đo được bằng phép đo oxy mạch nẩy (SpO2) là đại diện của SaO2 của ABG, trong khi mối quan hệ của chúng với áp lực riêng phần của oxy động mạch (PaO2) được minh họa bằng đường cong phân ly oxy.
Độ chính xác của phép đo oxy giảm đi đáng kể khi SaO2 giảm xuống 80%. Sự tưới máu thấp, các nhiễu do cử động (ví dụ như bệnh nhân bị kích động), màu da, sơn móng tay; tất cả đều gây ra kết quả đọc không chính xác. Máy đo nồng độ oxy đánh giá quá cao độ bão hòa oxy ở những bệnh nhân có làn da sẫm màu, có nguy cơ bỏ qua các đợt thiếu oxy.9,10 Hơn nữa, Hb bất thường (carboxyhemoglobin [COHb] và methemoglobin [MetHb]) có thể ảnh hưởng đến kết quả đo. Cuối cùng, khả năng hạn chế trong việc phân biệt các giá trị PaO2 cao khi hemoglobin đã bão hòa hoàn toàn (tức là SpO2= 100%) có thể bỏ qua tình trạng tăng oxy máu và bất kỳ tác hại liên quan nào.11,12
Gần đây, các thiết bị đa bước sóng cho phép đo COHb, MetHb (8 bước sóng) và tổng huyết sắc tố (12 bước sóng).13,14 Ngoài ra, các thiết bị mới hơn có thể đọc tốt hơn trong trường hợp chuyển động và tưới máu thấp.13 Mối tương quan SpO2 với FiO2 đã được đề xuất để theo dõi thông khí không xâm lấn (NIV).15 Cuối cùng, chỉ số biến đổi Pleth dựa trên phương pháp đo oxy mạch nẩy sẽ chuyển sự thay đổi về kích thước ngón tay thành một công cụ huyết động không xâm lấn về trạng thái thể tích và khả năng đáp ứng dịch (fluid responsiveness – FR).13
Mặc dù đã được sử dụng nhiều năm, điểm lâm sàng quan trọng nhất vẫn là cá nhân hóa SpO2 mục tiêu. Semler và cộng sự cho thấy cả tỷ lệ tử vong và số ngày không thở máy đều không khác nhau với SpO2 nằm trong khoảng từ 88% đến 100%.16 Ngoài ra, độ bão hòa oxy tĩnh mạch hạ lưu (ví dụ, độ bão hòa oxy tĩnh mạch hỗn hợp, độ bão hòa oxy tĩnh mạch cảnh [SjvO2]) hoặc mô oxygen hóa đã được khám phá như là mục tiêu theo dõi bổ sung. Độ bão hòa tĩnh mạch phản ánh sự cân bằng giữa cung cấp và tiêu thụ oxy, trong khi chỉ số oxy của mô cho thấy lượng oxy sẵn có. Trong chấn thương não cấp tính, việc theo dõi bao gồm SjvO2, quang phổ cận hồng ngoại (NIRS) và áp lực riêng phần của oxy trong mô não (PbtO2).17,18 PbtO2 < 20 mmHg được coi là yếu tố kích hoạt can thiệp.18 NIRS cũng có thể được sử dụng để nhắm mục tiêu oxygen hóa mô não và cơ (StO2) ở bệnh nhân ngừng tim, phẫu thuật và nhiễm trùng nhưng bằng chứng còn mâu thuẫn.19-21
Theo dõi CO2
Vai trò thứ hai của hệ hô hấp là cung cấp thông khí (tức là loại bỏ CO2). CO2 được tạo ra trong quá trình chuyển hóa của tế bào, được vận chuyển bởi hệ tuần hoàn và được đào thải qua phổi. Do đó, giá trị CO2 cuối thì thở ra (CO2 cuối thì thở ra [ETCO2]) đại diện cho kết quả cuối cùng tổng hợp của quá trình chuyển hóa, tuần hoàn và hô hấp.22 Sự thay đổi đột ngột về chỉ số thường phản ánh bệnh lý hô hấp hoặc tuần hoàn (ví dụ: vấn đề về đường thở, đột ngột thay đổi cơ học của phổi [ví dụ, co thắt phế quản], khoảng chết [ví dụ, tắc mạch phổi] hoặc hệ thống tuần hoàn [ví dụ, sốc, ngừng tim]). Ngoài ETCO2, capnography còn hữu ích cho nhiều vai trò khác: đặt và đặt đúng vị trí của ống nội khí quản, theo dõi sức cản đường thở và phong tỏa thần kinh cơ, v.v. Cần lưu ý rằng PetCO2 có thể không chính xác trong trường hợp pha cao nguyên hoặc cao nguyên ngắn của phương pháp chụp capnography (ví dụ, trong thông khí giải phóng áp lực đường thở).
Khoảng chết (VDphys) là phần thể tích khí lưu thông (Vt) không tham gia trao đổi khí dẫn đến giảm thông khí. Về mặt lâm sàng, nó phát sinh do sự căng quá mức của phế nang hoặc suy giảm tưới máu phổi và có liên quan đến tỷ lệ tử vong trong hội chứng nguy kịch hô hấp ở người trưởng thành (ARDS). Theo đó, việc theo dõi VDphys sẽ rất được quan tâm.23 Vì việc đo VDphys tại giường rất phức tạp nên việc sửa đổi Enghoff của phương trình Bohr được đề xuất để ước tính nó dựa trên dữ liệu có sẵn từ capnography và ABG như sau:
VDphys/Vt = (PaCO2 – PETCO2)/PaCO2
Việc tăng cường sử dụng NIRS trong ICU đòi hỏi phải có các giải pháp theo dõi mới. Những tiến bộ gần đây bao gồm việc kết hợp capnography vào NIV, mặt nạ và ống thông mũi.24 Tuy nhiên, các phép đo gặp khó khăn (đặc biệt là trong suy hô hấp cấp tính (acute respiratory failure – ARF)) do pha loãng khí thở ra, kiểu thở và hướng lấy mẫu.25 Một điều khác giải pháp là theo dõi CO2 qua da (TcCO2) thông qua cảm biến chuyên dụng; tuy nhiên, độ chính xác vẫn còn nhiều nghi vấn.26 Điều thú vị là ngoài vai trò theo dõi hô hấp của nó, khoảng cách giữa PaCO2 và TcCO2 có thể là dấu hiệu của sự tưới máu mô.27 Những thay đổi của PetCO2 cũng được nghiên cứu như một thông số của FR. AEtC02 khoảng 5% đến 6%, hoặc giá trị tuyệt đối là 2 mmHg trong thử nghiệm nâng cao chân thụ động ở bệnh nhân MV, có hiệu suất vừa phải trong việc phát hiện FR với độ nhạy 0,79 và độ đặc hiệu là 0,90,28
Cần lưu ý rằng oxy cuối kỳ thở ra (ETO2) cũng có thể được đo và coi là trị số thay thế cho nồng độ phế nang. Nó chủ yếu được sử dụng để theo dõi tình trạng tiền oxygen hóa (pre-oxygenation) trong quá trình đặt nội khí quản trong phòng mổ, trong khi việc sử dụng nó trong ICU vẫn hiếm do lo ngại về độ chính xác của nó trong trường hợp có khoảng chết đáng kể.29 Trong những trường hợp này, một tỷ lệ O2 phế nang không được chia sẻ trong trao đổi khí và ETO2 không phản ánh chính xác những gì có sẵn cho quá trình oxygen hóa mô.11 Cuối cùng, một số máy thở mới kết hợp phương pháp đo thể tích để đo khoảng chết.30,31
Theo dõi cơ bản khác
Thuốc an thần nhẹ rút ngắn thời gian của MV.32 Để theo dõi thuốc an thần, các thiết bị lấy điện não đồ khác nhau đã được giới thiệu để khắc phục tính chất chủ quan của điểm số lâm sàng. Chỉ số lưỡng cực (bispectral index – BIS) chuyển các tín hiệu điện não đồ thành một giá trị số trên thang điểm từ 0 (an thần hoàn toàn) đến 100 (hoàn toàn tỉnh táo). Mục tiêu trong ICU thường nằm trong khoảng từ 40 đến 60, nhưng tốt hơn nên được cá nhân hóa. Mặc dù đáng tin cậy hơn, khách quan hơn và liên quan đến khối lượng công việc ít hơn, bằng chứng về tính ưu việt của nó so với điểm số lâm sàng ít thuyết phục hơn.33 Một đánh giá hệ thống của Cochrane cho thấy không có sự khác biệt so sánh cả về thời gian nằm MV hoặc ICU, nhưng bằng chứng thấp đến rất thấp.34
Các thuốc phong tỏa thần kinh cơ (neuromuscular blocking agents – NMBA) đôi khi được truyền để tạo điều kiện thuận lợi cho việc đặt nội khí quản hoặc MV. Hướng dẫn của Hiệp hội Y học Chăm sóc Đặc biệt khuyến nghị kết hợp đánh giá lâm sàng và kích thích dây thần kinh ngoại biên (chuỗi bốn [train of four – T0F]) để theo dõi NMBA.33 T0F phụ thuộc vào đáp ứng của cơ đối với 4 kích thích điện phản ánh mức độ phong tỏa thần kinh cơ (điểm T0F 0 nghĩa là không có đáp ứng với cả 4 kích thích và liệt hoàn toàn). Mặc dù là một công cụ đơn giản nhưng nó có nhiều hạn chế: liên quan đến thiết bị (loại, điện áp), liên quan đến nhân viên (đào tạo, kinh nghiệm) hoặc liên quan đến bệnh nhân (hạ thân nhiệt, phù nề, vị trí áp dụng, lưu lượng máu).33,35 Các bác sĩ lâm sàng nên lưu ý rằng có thể tồn tại sự khác biệt giữa tác dụng của NMBA trên cơ ngoại biên và cơ hô hấp.33 Cần phải dùng thuốc an thần sâu trong quá trình sử dụng NMBA, nhấn mạnh hơn vào BIS mặc dù không có khuyến nghị chính thức và không đủ bằng chứng.33
Theo dõi nâng cao
Màn hình máy thở cơ học
Bản thân máy thở cơ học có thể là thiết bị theo dõi hô hấp tốt nhất. Các nhà sản xuất liên tục áp dụng những tiến bộ về sinh lý phổi để nâng cấp máy thở. Máy thở hiện đại ghi lại và hiển thị nhiều biến số hô hấp có liên quan đến lâm sàng (tức là thể tích, áp lực, lưu lượng) bằng cách sử dụng cảm biến và thuật toán xử lý tín hiệu kỹ thuật số.36,37 Chúng có thể được hiển thị theo thời gian (đường cong) hoặc giữa chúng với nhau (vòng lặp áp lực-thể tích [PV] và vòng lặp lưu lượng-thể tích). Các biến khác được tính toán và hiển thị (ví dụ: độ giãn nở hô hấp và sức cản đường thở).
MV có thể được đặt ở chế độ được kiểm soát hoặc hỗ trợ. Điều đặc biệt quan trọng là phải theo dõi quá trình chuyển đổi từ chế độ kiểm soát sang chế độ hỗ trợ, vì nó có thể liên quan đến việc tăng nguy cơ mất đồng bộ giữa bệnh nhân và máy thở, tổn thương phổi và cơ hoành.
Chế độ và cài đặt
Chế độ máy thở được chia thành chế độ thể tích và áp lực. Người vận hành cài đặt đầu vào được chuyển thành đầu ra tùy thuộc vào cơ học của phổi (ví dụ: ở chế độ thể tích, thể tích và lưu lượng là đầu vào, trong khi áp lực là đầu ra). Mối quan hệ như vậy có thể được đơn giản hóa bằng phương trình chuyển động mô tả mối quan hệ giữa thể tích, áp lực, sức cản đường thở và độ đàn hồi (hoặc độ giãn nở) của hệ hô hấp:
Pvent + Pmus = (V/C) + (R X F)
trong đó Pvent và Pmus lần lượt là áp lực do máy thở hoặc bệnh nhân tạo ra, V là thể tích, R sức cản đường thở, F lưu lượng và C độ giãn nở của hệ hô hấp.
Sự khác biệt giữa áp lực bình nguyên và PEEP được gọi là áp lực đẩy (DPaw) và có liên quan đến tỷ lệ tử vong trong ARDS.38 Ở chế độ hỗ trợ và tự phát, khi bệnh nhân bắt đầu thở, nhịp thở (RR) trở thành một biến số được theo dõi. Các bác sĩ nên lưu ý rằng máy thở hiển thị RR có thể khác với nhịp thở của bệnh nhân trong trường hợp tự động kích hoạt hoặc nỗ lực không hiệu quả. RR không phải là sự phản ánh xuất sắc của WOB, và mặc dù sự đóng góp của thể tích và áp lực vào thông khí gây tổn thương đã được biết rõ, nhưng ngày càng có nhiều bằng chứng trên động vật và con người cho thấy RR cũng có thể liên quan đến tổn thương phổi và cơ hoành.39,40
Đồ thị máy thở
Kiểm tra biểu đồ máy thở giúp hiểu cơ học phổi, phát hiện sự không đồng bộ của bệnh nhân-máy thở hoặc hiếm gặp là rối loạn chức năng máy thở.41 Một trong những mục tiêu của MV là huy động phổi, giúp phổi giãn nở và thanh thải CO2 tốt hơn. Vòng lặp PV đặc biệt hữu ích, hiển thị phạm vi áp lực an toàn để tránh mất huy động và căng quá mức (giữa điểm uốn dưới và trên). Lu và cộng sự đã chỉ ra rằng lưu lượng chậm không đổi (3-9 L/phút) dẫn đến áp lực sức cản không đáng kể và đường cong PV tương tự với các phương pháp tắc thì hít vào tham chiếu và siêu ống tiêm.42 Sử dụng nguyên lý lưu lượng thấp (2-5 cmH2O/s), một số nhà sản xuất đã giới thiệu Công cụ thông khí bảo vệ (Công cụ P/V) để kiểm tra khả năng huy động và đặt mức PEEP. Độ trễ là sự khác biệt giữa phần bơm phồng và phần thở ra của vòng PV. Đó là một thông số khác để đánh giá khả năng huy động và có thể được đo lường ở một số máy thở mới.43
Sức cản đường thở có thể được theo dõi trên các vòng lặp lưu lượng-thể tích. Quan sát đường cong lưu lượng-thời gian, nếu lưu lượng cuối thì thở ra không đạt giá trị 0, nó biểu thị PEEP tự động.
Sự không đồng bộ của bệnh nhân-máy thở
Sự không đồng bộ phát sinh từ sự không phù hợp giữa kiểm soát hô hấp nội tại của bệnh nhân và cài đặt máy thở. Nó liên quan đến cảm giác khó chịu, tăng WOB, trao đổi khí kém, tổn thương cơ hoành, suy giảm giấc ngủ, tăng sử dụng thuốc an thần và NMBA, thời gian MV dài hơn và tăng tỷ lệ tử vong.44-47 Sự không đồng bộ có thể liên quan đến lưu lượng không đồng bộ (không đồng bộ lưu lượng) hoặc xảy ra trong quá trình kích hoạt (kích hoạt muộn, nỗ lực không hiệu quả và kích hoạt tự động) hoặc chu kỳ (chu kỳ sớm, chu kỳ muộn và kích hoạt kép).
Những tiến bộ gần đây
Máy thở đầu tiên không được trang bị cảm biến nhưng đã phát triển kể từ đó để theo dõi cơ học hô hấp và phù hợp với nhu cầu của bệnh nhân. Báo động được đưa ra để thu hút sự chú ý đến các cài đặt có hại. Thật không may, điều này đã lên đến đỉnh điểm cái gọi là “sự mệt mỏi cảnh báo” (alarm fatigue), đề cập đến việc giảm sự chú ý và không có khả năng nhận biết đúng và sai, gây nguy hiểm cho bệnh nhân.48 Các thuật toán sau đó đã được giới thiệu để cho phép tự động điều chỉnh MV thông qua phản hồi vòng kín cũng phục vụ cho mục tiêu thông minh và cá nhân hóa của MV.36 Điều này có nghĩa là các cài đặt được kiểm soát tự động theo nhu cầu của bệnh nhân và tạo điều kiện cai máy tự động. Họ nhắm mục tiêu WOB thấp nhất bằng cách tối đa hóa thông khí phế nang trong thể tích phút mục tiêu.49 Với việc ứng dụng trí tuệ nhân tạo (artificial intelligence – AI) ngày càng tăng, xu hướng như vậy có thể sẽ trở thành chuẩn mực trong tương lai.
Ví dụ: ở chế độ thông khí hỗ trợ thích ứng (adaptive support ventilation – ASV), người vận hành đặt thể tích phút mục tiêu để máy thở điều chỉnh RR và Vt để đạt được sự kết hợp tốt nhất trong hộp an toàn. Các nghiên cứu cho thấy khả năng dung nạp tốt và cai máy nhanh hơn.49,50 Một bước nữa là INTELLiVENT-ASV, trong đó phản hồi vòng kín từ capnography và pulse oximeter giúp điều chỉnh cài đặt cho các bệnh lý phổi khác nhau (ví dụ, bệnh phổi tắc nghẽn mạn tính và ARDS). Những tiến bộ như vậy có thể làm giảm khối lượng công việc trong ICU, đảm bảo sự chuyển đổi suôn sẻ từ thông khí thụ động sang chủ động và đảm bảo quản lý MV và thông khí bảo vệ phổi nhất quán hơn theo hướng tiếp cận cá nhân hóa hơn. Tuy nhiên, chế độ này vẫn có khả năng theo dõi các tín hiệu nhiễu.
Tóm lại, máy thở đang ngày càng cung cấp nhiều dữ liệu theo dõi. Mặc dù đây là một cơ hội tuyệt vời, nhưng thật không may, việc đào tạo và kiến thức của các nhà chuyên sâu vẫn còn thiếu, và việc đào tạo từng bước có thể mang lại lợi ích.51,52
Đo áp lực thực quản
Một mục đích của MV là tránh chấn thương khí áp bằng cách hạn chế áp lực do máy thở (Paw) cung cấp. Paw tính tổng áp lực sức cản (để khắc phục lực cản lưu lượng qua đường thở) và áp lực đàn hồi (tổng độ đàn hồi của thành ngực và của phổi). Bằng cách áp dụng thủ thuật giữ thì hít vào (inspiratory hold), lưu lượng trở về 0, loại bỏ sự đóng góp của áp lực sức cản (xem phương trình chuyển động). Áp lực màng phổi (Ppl) trừ đi áp lực phản hồi do thành ngực tạo ra từ Paw. Áp lực xuyên phổi (Pl) là chênh lệch giữa Paw và Ppl (Pl = Paw – Ppl). Dreyfus và cộng sự đã chỉ ra rằng việc băng ép ngực của chuột (tức là tăng Paw chứ không phải PL) dẫn đến VILI ít hơn so với những con chuột tiếp xúc với Vt cao.53 Trong thông khí hỗ trợ, Ppi trở nên âm tính (nỗ lực của bệnh nhân) và Pl trở thành tổng của Pl âm tính gây ra do co cơ và Paw. Rõ ràng, bệnh nhân càng nỗ lực thì Paw càng ít trở thành đại diện cho Pl.54 VILI phát sinh từ stress và strain của phổi và được định lượng tốt hơn bằng Pl cũng như mối quan hệ giữa Vt và thể tích phổi cuối thì thở ra.55,56 Để đạt được mục đích này, kiến thức về Ppl và do đó Pl giúp tránh đánh giá thấp mức độ stress của phổi và VILI sau đó (nếu chỉ xem xét Paw).
Áp lực khoang màng phổi không đồng nhất và không thể đo trực tiếp ở người sống.57 Mặc dù có sự thay đổi theo vùng như vậy, áp lực thực quản (Pes) được coi là đáng tin cậy để phản ánh Ppl trung bình khi một quả bóng được đặt chính xác vào giữa thực quản.58-60 Nó có thể được kết nối với một thiết bị cụ thể hoặc trực tiếp với máy thở. Một số ống thông có thêm bóng dạ dày cho phép đo áp lực xuyên cơ hoành. Nhìn chung, đo áp lực thực quản được coi là kỹ thuật tham khảo để theo dõi nỗ lực hô hấp và mức độ stress toàn bộ phổi trong MV.39 Nó có thể phục vụ 3 mục đích 61,62:
- Mô tả cơ học hô hấp, hướng dẫn chuẩn độ PEEP và hạn chế áp lực xuyên phổi cuối thì hít vào;
- Theo dõi hoạt động cơ hô hấp của bệnh nhân (WOB); và
- Theo dõi sự đồng bộ của bệnh nhân-máy thở.
Pes có thể hướng dẫn chuẩn độ PEEP để tránh xẹp phế nang cuối thì thở ra (Pl = 0).62,63 EPVent và EPVent-2 lần lượt là 2 thử nghiệm so sánh PEEP được chuẩn độ Pes với PEEP thấp và cao theo kinh nghiệm ở bệnh nhân mắc Ards.64,65 peep cao hơn chỉ đạt được ở nhóm được hướng dẫn bằng Pes khi nhóm kiểm soát tuân theo chiến lược PEEP thấp nhưng không cao (tức là trong EPVent chứ không phải EPVent-2). Sau đó, Pes hướng dẫn PEEP cao hơn đã dẫn đến cải thiện oxygen hóa, độ giãn nở của phổi và xu hướng tỷ lệ tử vong tốt hơn.64 Ngược lại, không có sự khác biệt về PEEP, Pl, tỷ lệ tử vong hoặc số ngày không thở máy trong EPVent-2.65 Cả hai thử nghiệm gợi ý rằng Pes có thể có ích nếu nó mang lại PEEP cá nhân hóa tốt hơn. Trong những môi trường mà bác sĩ thận trọng về PEEP cao, Pes có thể đưa ra sự đảm bảo và hướng dẫn cài đặt PEEP được cá nhân hóa hơn.61 Cuối cùng, một phân tích hậu kiểm về EPVent-2 cho thấy lợi ích về tỷ lệ tử vong ở nhóm có ít rối loạn chức năng đa cơ quan hơn, điều này có thể phản ánh tác động từ xa của PEEP cao (ví dụ: tương tác tim phổi).66
Các thông số kiểm soát khác bao gồm Pl cuối thì hít vào để bảo vệ chống lại stress quá mức của phổi và áp lực đẩy xuyên phổi (DPl) (Pl cuối thì hít vào – Pl cuối thì thở ra).62 Các phép đo này có thể có giá trị đặc biệt ở những bệnh nhân béo phì có độ giãn nở của thành ngực thấp.67 Tuy nhiên, một nghiên cứu đa trung tâm tiến cứu gần đây cho thấy DPaw và DPl ngang nhau trong việc dự đoán kết quả.68 Nói chung, khuyến nghị Pl không vượt quá 20-25 cmH2O và nhắm mục tiêu DPaw <15 cmH2O và DPl <12 cmH2O.54’61’68
Khi WOB quá mức, nó có thể dẫn đến Pl âm tính và phù phổi.69 Bellani và cộng sự đã đề xuất áp dụng thủ thuật giữ cuối thì hít vào trong thông khí hỗ trợ để bộc lộ áp lực đẩy thực sự và stress của phổi.70 Có thể ước tính WOB hít vào và sự co cơ hoành bởi tích số áp lực-thời gian và sự thay đổi áp lực xuyên cơ hoành (APdi), tương ứng.61 Cuối cùng, phép đo áp lực thực quản nhạy hơn với sự không đồng bộ so với biểu đồ máy thở.
Bóng thực quản là công cụ giúp chúng ta hiểu biết về cơ học phổi qua nhiều năm nghiên cứu; tuy nhiên, chúng vẫn được sử dụng rất hạn chế trong thực hành lâm sàng.71 Điều này có lẽ là do thiếu chuyên môn và bằng chứng hỗ trợ. Garegnani và cộng sự đã tiến hành đánh giá có hệ thống về việc sử dụng Pes bao gồm 301 người tham gia từ 4 thử nghiệm cho thấy không có lợi ích về thời gian nằm lại ICU, tỷ lệ tử vong, số ngày MV hoặc tác dụng phụ nhưng có độ chắc chắn thấp.72 Trong khi đó, Chen và cộng sự cho thấy rằng các buổi giáo dục, các quy trình được tiêu chuẩn hóa và các biểu mẫu điện tử đã giúp các nhà cung cấp dịch vụ chăm sóc sức khỏe mới vào nghề thực hiện đo áp lực thực quản đạt được mức oxygen hóa tốt hơn.73
Hình ảnh
Hình ảnh không phải là một công cụ liên tục theo thời gian thực. Nó bao gồm chụp X quang ngực, siêu âm phổi và chụp cắt lớp vi tính (CT) có vai trò chẩn đoán không thể nghi ngờ, nhưng vai trò theo dõi ít rõ ràng hơn.
CT đóng vai trò chính trong việc tìm hiểu tổn thương cấu trúc không đồng nhất trong ARDS (ví dụ như phổi trẻ em) và để đánh giá khả năng huy động.74,75 Tuy nhiên, việc chuyển sang máy quét không phải lúc nào cũng khả thi khiến việc sử dụng nó mang tính thử nghiệm hơn là lâm sàng.
Siêu âm ngực ngày càng trở nên phổ biến. Nó không xâm lấn, nhanh chóng, có thể thực hiện tại giường, di động và có chi phí thấp. Nó có thể được sử dụng ở bất kỳ đâu trong bệnh viện (hoặc thậm chí trong cộng đồng), khiến nó trở thành một giải pháp thay thế hấp dẫn trong những môi trường có nguồn lực hạn chế. Tuy nhiên, nó phụ thuộc vào sự sẵn có của đội ngũ nhân viên đã được đào tạo, phụ thuộc vào người vận hành và có thể bỏ sót bệnh lý khu trú nếu không khảo sát một cách có hệ thống tất cả các vùng phổi. Quét nối tiếp có thể phát hiện và theo dõi nhiều bệnh lý phổi, giúp đánh giá tiến triển, hướng dẫn và theo dõi đáp ứng với điều trị (ví dụ tràn dịch màng phổi, xẹp phổi, đông đặc, phù phổi, tràn khí màng phổi). Cuối cùng, siêu âm tim trong chăm sóc tích cực có thể giúp xác định nguyên nhân gây suy hô hấp hoặc cai máy (ví dụ, suy thất trái và áp lực đổ đầy cao) và đánh giá bệnh lý phổi và tác động của cài đặt MV lên tim phải. Điều này giúp kết hợp quá trình oxygen hóa máu tốt hơn với sự cung cấp đầy đủ của hệ thống tim mạch.76,77 Siêu âm không được khuyến khích như một công cụ độc lập nhưng đặc biệt hữu ích khi được xem xét cùng với khám lâm sàng và các thiết bị theo dõi khác.
Theo dõi khu vực
Hầu hết các máy theo dõi hô hấp đều coi toàn bộ phổi hoạt động tương tự. Hình ảnh trong một thời gian dài là cách duy nhất để mô tả sự không đồng nhất về cấu trúc (nhưng không phải chức năng). Các bệnh về phổi khi không đồng nhất (ví dụ ARDS, xẹp phổi và đông đặc thùy) tạo ra trạng thái không đồng nhất cơ học vùng.78,79 Theo đó, việc áp dụng cài đặt MV thống nhất trên các vùng không đồng nhất sẽ dẫn đến các tác động khác nhau và đôi khi không thể đoán trước, từ xẹp phổi, huy động đến căng quá mức, có nguy cơ làm xấu đi quá trình trao đổi khí và VILI. Nếu sự không đồng nhất theo khu vực này có thể được xác định và phản hồi lại cho bác sĩ lâm sàng thì có thể theo đuổi một phương pháp quản lý cá nhân hóa.
Chụp cắt lớp trở kháng điện (electrical impedance tomography – EIT) là một công cụ chụp ảnh liên tục, thời gian thực, không xâm lấn tại giường bệnh và không có bức xạ phát ra. Nó dựa trên sự thay đổi độ dẫn điện thứ cấp do sự thay đổi theo chu kỳ của thể tích phổi và máu. Bằng trung bình 16 điện cực (phạm vi 8-64), EIT đo điện áp trên bề mặt cơ thể, cung cấp cho bác sĩ lâm sàng hình ảnh cường độ màu 2 chiều.80-82 Nó đã được xác nhận dựa trên hình ảnh thông thường (ví dụ: CT) và phép đo phế dung. Nó còn có thêm ưu điểm là liên tục cung cấp hình ảnh động.79 EIT có thể cung cấp thông tin về cả hai: thông khí và tưới máu phổi. Loại thứ hai đóng vai trò cơ bản nhưng thường bị bỏ qua trong trao đổi khí và cơ chế bệnh sinh của tổn thương phổi.83
Về mặt lâm sàng, EIT có thể giúp chuẩn độ MV (PEEP và Vt) và đánh giá đáp ứng với các thủ thuật huy động và thay đổi tư thế. Điều đặc biệt quan tâm là khả năng phát hiện Vt có hại theo khu vực do hiện tượng “pendelluft” trong quá trình thông khí hỗ trợ.80’84
EIT cũng có thể được sử dụng ở những bệnh nhân không đặt nội khí quản để theo dõi tổn thương phổi bệnh nhân tự gây ra (patient self-inflicted lung injury – P-SILI). Strain tương đối vùng động là tỷ lệ thay đổi trở kháng theo chu kỳ so với sức cản phổi cuối thì thở ra trong mỗi vùng phổi và được đề xuất để theo dõi P-SILI.85
EIT không phải là không có hạn chế: Béo phì và chuyển động có thể ảnh hưởng đến hình ảnh. Không nên bôi lên vùng da bị tổn thương hoặc trong trường hợp chấn thương cột sống. Cuối cùng và mặc dù nó được dự định là hình ảnh khu vực, hình ảnh cắt ngang bao phủ chiều rộng 5-10 cm chứ không phải toàn bộ phổi.86 Mặc dù rất hứa hẹn trong nghiên cứu, việc sử dụng EIT trên lâm sàng vẫn còn hạn chế. Tuy nhiên, sự quan tâm của các nhà sản xuất có thể dẫn đến việc sử dụng rộng rãi hơn tại giường trong tương lai.82
=> Tham khảo thêm: Sự khác biệt thực tế giữa thông khí kiểm soát áp lực và thông khí kiểm soát thể tích.
Theo dõi trung khu hô hấp và thần kinh cơ
Hỗ trợ thông khí được điều chỉnh theo thần kinh
Hỗ trợ thông khí được điều chỉnh theo thần kinh (neurally adjusted ventilatory assist – NAVA) là một ví dụ khác về việc tích hợp theo dõi vào MV. Bằng một ống thông mũi dạ dày đặc biệt, hoạt động điện của cơ hoành (electrical activity of the diaphragm – Edi) được ghi lại để khớp với thời gian thần kinh hô hấp của bệnh nhân với thời gian của máy thở. Điều quan trọng là phải hiểu rằng Edi phản ánh hoạt động điện chứ không phải là sức co bóp của cơ hoành.54 Phạm vi Edi bình thường nằm trong khoảng từ 5 đến 30 pV.87 Người vận hành vẫn kiểm soát mức NAVA để chuyển hoạt động điện Edi thành áp lực có thể được giảm dần cho đến khi cai máy.
Sự không đồng bộ là phổ biến trong quá trình kích hoạt và chu kỳ, và bằng cách kiểm soát 2 biến đó, NAVA tránh được sự không phù hợp do cài đặt mù.88 Edi cũng có thể phát hiện sự không đồng bộ tốt hơn so với biểu đồ của máy thở.89
Áp lực tắc nghẽn đường thở
Áp lực tắc nghẽn đường thở (airway occlusion pressure) (P0.1) được đo 0’1 giây sau khi hít vào khi đường thở bị tắc.90 Phép đo sớm của nó có nghĩa là việc ghi lại xảy ra trước khi bắt đầu lưu lượng khí và sau đó không bị ảnh hưởng bởi cơ học phổi. Nó phản ánh trung khu hô hấp và do đó có thể hướng dẫn quyết định cai máy.91 Beloncle và cộng sự đã chỉ ra rằng các máy thở thường được sử dụng đã sử dụng các kỹ thuật khác nhau để đo P0.1.92 Vị trí thử nghiệm thường ở máy thở hơn là ở cấp độ đường thở, dẫn đến đánh giá thấp của P0.1 so với phương pháp tham chiếu. Tuy nhiên, những thay đổi của P0.1 với cường độ hô hấp khác nhau tương quan tốt với giá trị tham chiếu, cho thấy rằng việc theo dõi xu hướng P0.1 có thể tốt hơn một giá trị tuyệt đối.92
Công suất cơ bắp
MV có thể gây tổn thương cơ hoành (VIDD) do hỗ trợ quá mức hoặc dưới mức dẫn đến thất bại cai máy. Vì những lý do đó’ chúng tôi khuyên bạn nên theo dõi nỗ lực hô hấp trong MV.39 Việc cai máy thành công đòi hỏi các cơ hô hấp chỉ tạo ra áp lực cần thiết để thông khí (phù hợp với trung tâm điều hòa hô hấp). Theo đó, các chỉ số định lượng sức mạnh cơ hô hấp được coi là rất hữu ích để lập kế hoạch thử nghiệm cai máy. Nhiều máy thở đã được nâng cấp để kiểm tra công suất cơ hô hấp (respiratory muscle power) và cơ quan điều hòa hô hấp.
Tuyên bố của Hiệp hội Lồng ngực Hoa Kỳ (ATS)/Hiệp hội hô hấp Châu u (ERS) về kiểm tra cơ hô hấp khuyến nghị áp lực hít vào tối đa (maximal inspiratory pressure – MIP) và áp lực thở ra tối đa (maximal expiratory pressure – MEP) là chỉ số về công suất cơ hô hấp toàn cục.93 MIP là áp lực tối đa được tạo ra trong quá trình hít vào chống lại một đường thở bị tắc. Nó có khả năng tái tạo kém, nhưng vẫn có một loạt các bản ghi được coi là đại diện cho tình trạng yếu cơ và có thể dự đoán việc cai máy thành công từ MV.94-96 MIP < -20 đến -30 cmH2Ơ đã được đề xuất làm ngưỡng để cai máy thành công với độ nhạy cao nhưng độ đặc hiệu thấp. Tỷ lệ Po.1 so với MIP đôi khi được sử dụng để cải thiện độ chính xác.97
Hình ảnh của cơ hoành
Cơ hoành là cơ hô hấp chính và dễ bị chấn thương cơ, rối loạn chức năng và teo cơ trong quá trình MV. Không có gì ngạc nhiên khi siêu âm cơ hoành ngày càng trở nên phổ biến trong ICU. Đó là một phương thức siêu âm khác mang những ưu điểm và nhược điểm tương tự như đã đề cập ở trên. Hoạt động co bóp (phần dày lên), thay đổi độ dày theo thời gian và mức độ di chuyển trong nhịp thở chủ động là 3 thông số được nghiên cứu nhiều nhất.98 Phần dày được tính như sau: (độ dày ở cuối thì hít vào – độ dày ở cuối thì thở ra)/(độ dày ở cuối thì thở ra). Giá trị < 30% khi hít vào tối đa biểu thị yếu cơ.99 Siêu âm cơ hoành cũng cho thấy hứa hẹn dự đoán kết quả cai máy.5 Một sự đồng thuận đã được công bố về phương pháp kỹ thuật mở đường cho nhiều nghiên cứu hơn và thực hành dựa trên bằng chứng.98 Lưu ý, cơ hoành siêu âm loại trừ các cơ hô hấp khác có vai trò đáng kể trong trường hợp suy hô hấp hoặc yếu cơ hoành.
Khác
Cung lượng tim liên tục dựa vào chỉ số xung đường viền (Pulse index Contour Continuous Cardiac output – PiCCO) là một công cụ huyết động xâm lấn. Nó đo lượng nước phổi ngoài mạch (extravascular lung water – EVLW) và tính thấm của mạch máu phổi (pulmonary vascular permeability – PVP). EVLW định lượng sự sung huyết phổi. PVP giúp phân biệt phù phổi do tim và không do tim. Tuy nhiên, PiCCO được sử dụng chủ yếu để theo dõi huyết động hơn là theo dõi hô hấp. Tuy nhiên, khi có, những thông số đó có thể hữu ích cho việc theo dõi hô hấp.
Theo dõi bệnh nhân được hỗ trợ hô hấp không xâm lấn
NIRS (non-invasive respiratory support) bao gồm NIV và oxy mũi lưu lượng cao (high flow nasal oxygen – HFNO). Cả hai đều được sử dụng ngày càng nhiều để tránh những tác hại liên quan đến MV xâm lấn (IMV), và đôi khi được coi là mức chăm sóc tối đa ở những bệnh nhân yếu.100,101 Trong khi thành công và tránh IMV là có lợi, thì khi thất bại, NIV có liên quan đến tỷ lệ tử vong tăng lên.102 Hô hấp quá mức nỗ lực được đưa ra giả thuyết là gây ra P-SILI và đạt được Vt thấp trong NIV thường khó khăn ở những bệnh nhân nguy kịch hô hấp.39,103,104 Vì những lý do này, việc theo dõi chặt chẽ và nhanh chóng chuyển sang IMV là rất quan trọng khi áp dụng NIRS.
Theo dõi NIRS khó khăn hơn IMV. Đầu tiên, chúng thường được áp dụng ở ICU, nơi thiếu nhân lực và theo dõi xâm lấn. Sự hợp tác là một vấn đề vì bệnh nhân không được dùng thuốc an thần, có thể lo lắng, nguy kịch hoặc mê sảng. Cuối cùng, giao diện giữa bệnh nhân và máy thở (tức là ống thông mũi, mặt nạ hoặc mũ bảo hiểm có lưu lượng cao) có thể bị rò rỉ khiến dữ liệu được máy thở hiển thị ít phản ánh những gì thực sự đến phổi.
Trong NIV, quan sát WOB, hoặc đơn giản là Vt > 9,5 mL/kg có thể dự đoán thất bại trong suy hô hấp thiếu oxy cấp tính.103 Trong ARDS, nhiều đặc điểm rất hữu ích để dự đoán thất bại NIV: tuổi, ARDS và mức độ nghiêm trọng của bệnh, tỷ lệ PaO2:FiO2, suy tim và gan mãn tính, bệnh ác tính và RR.105 Chỉ số ROX là điểm kết hợp SpO2, RR và FiO2 và được xác nhận để dự đoán suy HFNO.106 Nó cho thấy giá trị tiên đoán vừa phải trong NIV.107
Tương lai
Ngày càng có nhiều mối quan tâm đến việc cá nhân hóa việc quản lý bệnh nhân nguy kịch, bao gồm cả MV. Việc theo dõi cơ học phổi và các thành phần của nó là điều cần thiết và hy vọng sẽ có mặt trên giường bệnh.
Với việc ứng dụng AI trong y học ngày càng tăng, dự kiến máy theo dõi hô hấp và máy thở sẽ dần hợp nhất thành một thiết bị thông minh duy nhất. Nghiên cứu MV AI đang tập trung chủ yếu vào việc bắt đầu, loại bỏ, biến chứng và đồng bộ hóa MV nhưng vẫn gặp phải những hạn chế về mặt phương pháp.108 Mặc dù các chuyên gia ICU đang hoan nghênh việc sử dụng AI nhưng nó vẫn đang trong giai đoạn thử nghiệm và nguyên mẫu với nhiều rào cản cần vượt qua.109
COVID-19 đã thúc đẩy việc ứng dụng NIRS ra khỏi ICU ngày càng tăng, nơi việc theo dõi là một thách thức cần có giải pháp. Điều này mở rộng sang máy thở gia đình ngày càng được áp dụng cho những trường hợp phức tạp hơn. Theo dõi từ xa và AI có thể cảnh báo sớm tình trạng hư hỏng và cần can thiệp kịp thời.
Kết luận
Số lượng ngày càng tăng các công cụ có sẵn để theo dõi thở máy nên được sử dụng theo cách bổ sung để phù hợp với nhu cầu rất khác nhau của mỗi bệnh nhân. Các thiết bị thông minh hơn kết hợp theo dõi vào MV sẽ giảm nhu cầu can thiệp của bác sĩ lâm sàng nhưng không phải theo dõi. Cá nhân hóa và tránh sự không đồng bộ giữa bệnh nhân và máy thở là những khía cạnh quan trọng để tránh VILI và VIDD. Cuối cùng, việc tăng cường sử dụng hỗ trợ hô hấp không xâm lấn tạo ra nhu cầu về các giải pháp theo dõi mới.

