Bệnh tim mạch
Teo tịt van động mạch phổi kèm thông liên thất hoặc lách vách liên thất
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Nguồn: Sách Lâm sàng tim bẩm sinh
Chủ biên
PGS.TS.BS. Nguyễn Lân Hiếu
Tham gia biên soạn
Nguyễn Lân Hiếu
Nguyễn Thị Minh Lý
Lê Minh Ngọc
Lê Nhật Cường
Đỗ Quốc Hiển
TEO TỊT VAN ĐỘNG MẠCH PHỔI KÈM THÔNG LIÊN THẤT
ĐẠI CƯƠNG
Thuật ngữ và định nghĩa
Pulmonary atresia with ventricular septal defect (PA-VSD) trong tiếng Anh hay Atrésie pulmonaire avec septum ouvert (APSO) trong tiếng Pháp (tạm dịch: teo tịt van động mạch phổi kèm thông liên thất) là thuật ngữ dùng để chỉ bệnh tim bẩm sinh tím có tắc nghẽn hoàn toàn đường ra của thất phải dưới động mạch phổi dẫn đến không có máu lưu thông qua van động mạch phổi, kèm theo thông liên thất lớn và động mạch chủ cưỡi ngựa trên mào vách liên thất. Bệnh còn có các tên gọi khác là TOF/ PA (Tetralogy of Fallot/Pulmonary atresia) – “tứ chứng Fallot kèm teo tịt van động mạch phổi” (vì được coi là biến thể hình thái nặng nhất của tứ chứng Fallot) và pseudotruncus arteriosus – “giả thân chung động mạch” (trước đây được xếp là thân chung động mạch type IV theo Collett & Edwards do chỉ nhận diện được một đại động mạch đi ra từ khối tâm thất).
Điểm khác biệt lớn nhất trong PA-VSD so với Fallot là sự mất nguồn cấp máu kép cho phổi trong thời kỳ phôi, dẫn tới các bất thường rất phức tạp của cấu trúc động mạch phổi, ảnh hưởng trực tiếp đến chiến lược phẫu thuật và tiên lượng của bệnh.
Độc giả có thể xem thêm: Các bệnh tim bẩm sinh: Teo tịt van ba lá.
Dịch tễ học và di truyền học
PA-VSD chiếm khoảng 2% tổng số bệnh tim bẩm sinh (khoảng 1/10.000 trẻ đẻ sống). Tương tự tứ chứng Fallot (tetralogy of Fallot), PA-VSD có xu hướng thường gặp ở nam hơn nữ. Trong một số báo cáo, PA-VSD chiếm từ 10-20% trong tất cả các dạng của tứ chứng Fallot.
Tương tự các bất thường thân – nón khác, tình trạng mẹ bị đái tháo đường, phenylketon niệu, phơi nhiễm với acid retinoic và trimethadione là các yếu tố nguy cơ của PA-VSD. Nghiên cứu BWIS cho thấy những đứa trẻ có mẹ bị đái tháo đường có nguy cơ mắc PA-VSD tăng gấp 10 lần.
Yếu tố di truyền cũng có vai trò trong bệnh sinh của PA-VSD: một số gia đình có nhiều thành viên cùng bị PA-VSD và các thể bất thường thân – nón khác; khoảng 8% trẻ bị PA-VSD có bất thường nhiễm sắc thể; 10% trẻ bị mất đoạn nhỏ trên nhiễm sắc thể 22 (22q11.2 microdeletion) trong hội chứng DiGeorge/ hầu-tim-mặt (DGS/VCFS) có PA-VSD (thường kèm theo bất thường mạch máu nhiều hơn, động mạch phổi nhỏ hơn và tiên lượng tồi hơn so với trường hợp không bị mất đoạn). Tỷ lệ mất đoạn 22q11 là 34% trên tổng số các trường hợp PA-VSD và 65% ở nhóm PA-VSD có các động mạch bàng hệ chủ – phổi chính (major aortopulmonary collateral arteries – MAPCAs). Một số trẻ trisomy 13 (ba nhiễm sắc thể 13) và trisomy 18 (ba nhiễm sắc thể 18) cũng có thể có PA-VSD với tiên lượng rất tồi.
HÌNH THÁI HỌC VÀ SINH LÝ BỆNH
Phôi thai học
Vào tuần thứ 5 của phôi, tại tim diễn ra quá trình hình thành vách ngăn tại thân động mạch và hành tim. Bắt đầu bằng việc xuất hiện một cặp gờ thân (truncal ridges) (thành trong của thân động mạch) và cặp gờ hành (bulbar ridges) (thành trong của hành tim). Từng cặp gờ này phát triển và hòa nhập với nhau theo hướng xoắn ốc tạo ra vách động mạch chủ – động mạch phổi (aorticopulmonary septum). Kết quả là thân động mạch và phần đầu hành tim (nón tim) được chia thành đoạn lên của quai động mạch chủ và thân động mạch phổi, thân động mạch phổi cuốn quanh quai động mạch chủ (Hình 1).
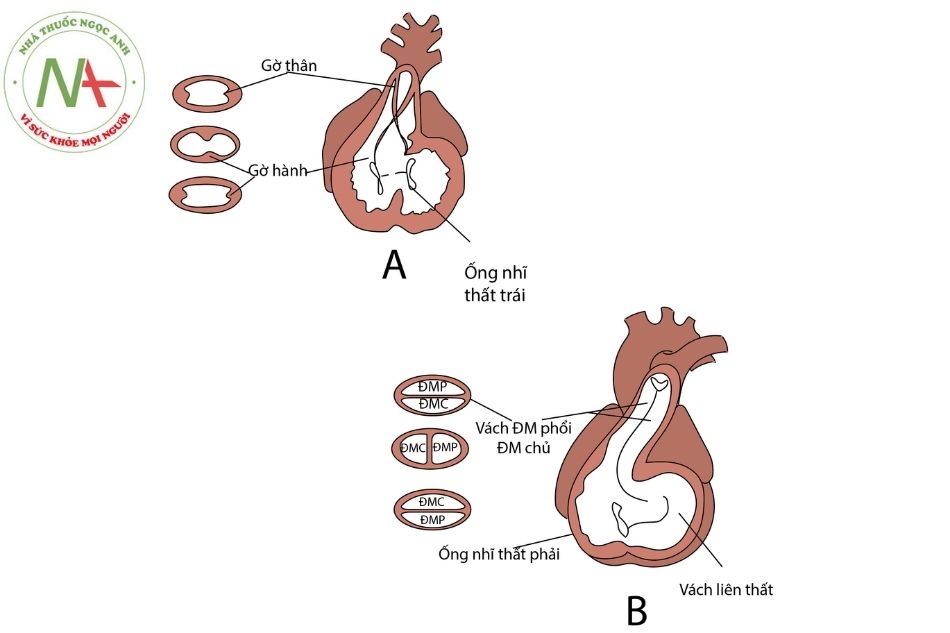
Chú thích: ĐMC: Động mạch chủ; ĐMP: Động mạch phổi; ĐM: Động mạch.
Bản chất các cặp gờ trên là các tế bào mào thần kinh tạo tim (cardiac neural crest cells) có nguồn gốc từ mép của các nếp thần kinh ở não sau di cư qua cung họng số 3,4 và 6 tới. Chúng đóng vai trò chính trong việc hình thành vách ngăn tại thân động mạch và nón tim (Hình 2). Giả thiết cho rằng các dị tật tại tim trong bệnh PA-VSD là do bất thường quá trình di chuyển các tế bào mào thần kinh tạo tim ở trên.
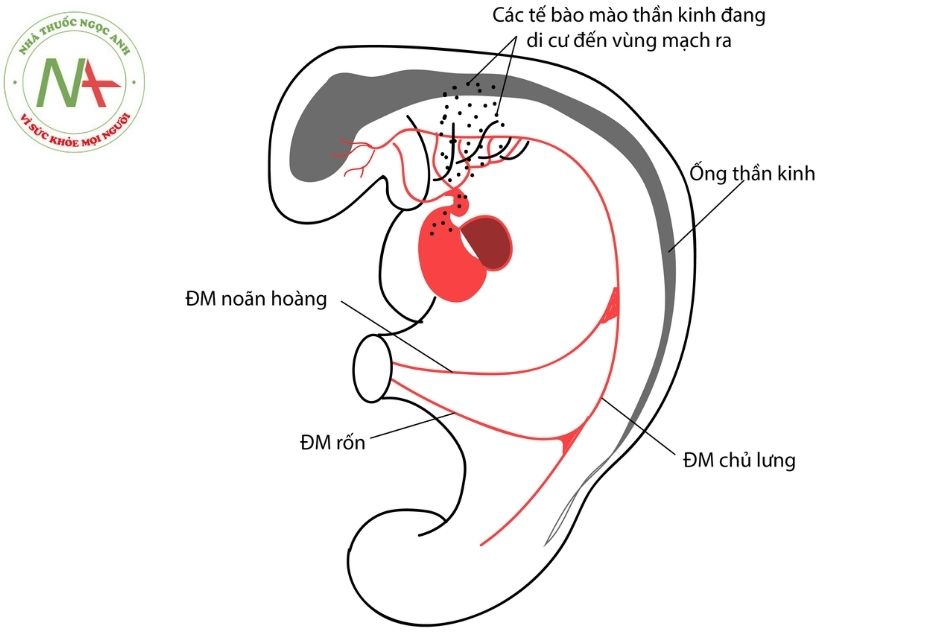
(Nguồn Robert M. Freedom, Leland N. Benson, Jeffrey F. Smallhorn. Neonatal heart disease, 16, 229.)
Chú thích: ĐM: Động mạch.
Tại phổi, thời kỳ này được cấp máu bởi 2 nguồn, gọi là nguồn cấp máu kép (dual blood supply), gồm: đám rối phổi là một phần của đám rối mạch máu tạng (splanchnic vascular plexus) của ruột trước với nguồn cấp máu là các nhánh động mạch gian đốt nguyên thủy xuất phát từ cặp động mạch chủ lưng; và các nhánh động mạch của cung động mạch chủ thứ sáu (aortic arch VI). Bình thường, động mạch phổi trung tâm từ cung động mạch chủ thứ sáu phát triển dần để cấp máu cho phổi, và các nhánh động mạch từ động mạch chủ xuống (hình thành từ động mạch chủ lưng) sẽ dần thoái triển (chỉ để lại các động mạch phế quản là các nhánh nhỏ dinh dưỡng cho phổi).
Trong PA-VSD, nếu nguồn cấp máu cho động mạch phổi trung tâm bị giảm nghiêm trọng (do teo tịt van động mạch phổi và dòng máu qua ống động mạch bị hạn chế), các kết nối chủ – phổi từ động mạch chủ không thoái triển được và hình thành MAPCAs.
Giải phẫu bệnh
Tổn thương tại tim
Các tổn thương trong tim gần giống với tứ chứng Fallot. Thông liên thất (ventricular septal defect – VSD) có thể ở phần màng hoặc phần phễu. Do cơ chế là sự lệch ra trước, lên trên và sang trái của vách nón (hay outlet septum – vách thoát) so với các chân của bè vách – bờ, lỗ thông liên thất thường lớn và kèm theo động mạch chủ cưỡi ngựa trên mào vách liên thất. Động mạch chủ kết nối với tâm thất nằm phía sau của đường ra thất phải bị teo tịt. Trong trường hợp vị trí thất bình thường, động mạch chủ thường lệch về phía thất phải nhiều hơn so với tứ chứng Fallot. Động mạch chủ lên thường giãn, đôi khi có thể giãn vòng van nhiều gây hở động mạch chủ.
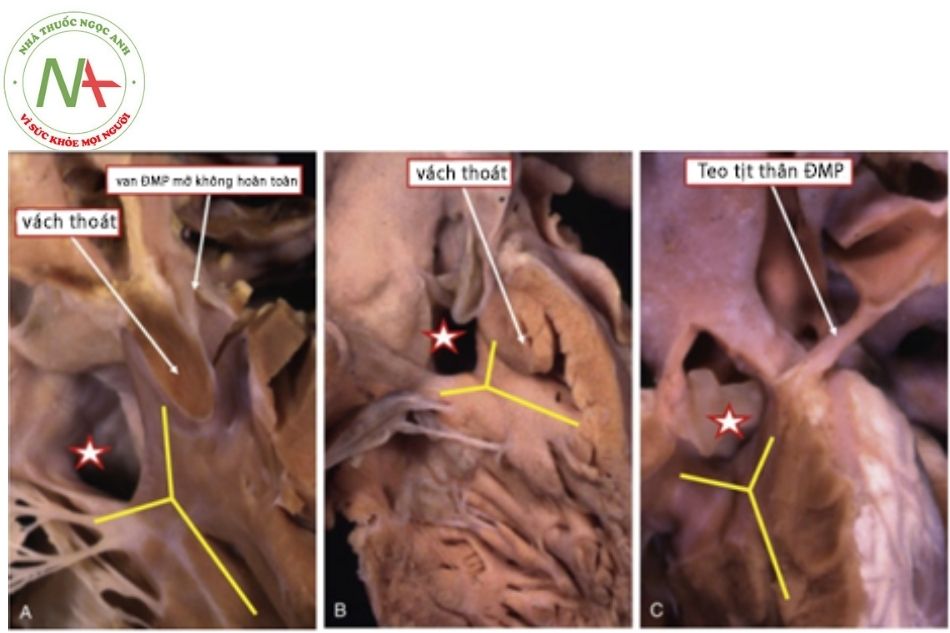
Hình ảnh vách thoát (outlet septum) dịch chuyển lên trên, ra trước, sang trái và gắn với trụ trên của bè vách bờ (chữ Y vàng). Mức độ teo tịt thay đổi từ không thủng tại van động mạch phổi (A) đến teo tịt một phần đường ra thất phải (B) và teo tịt hoàn toàn phễu dưới động mạch phổi (C). Dấu sao chỉ lỗ thông liên thất phần quanh màng (A), có gờ sau dưới là phần cơ (B) và ở vị trí dưới các đại động mạch (C).
Chú thích: ĐMP: Động mạch phổi.
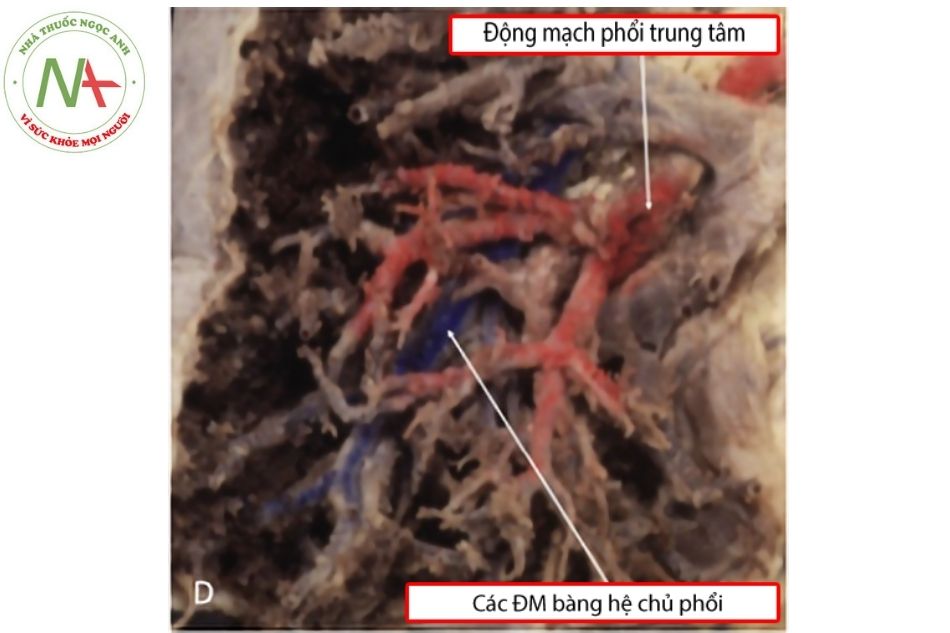
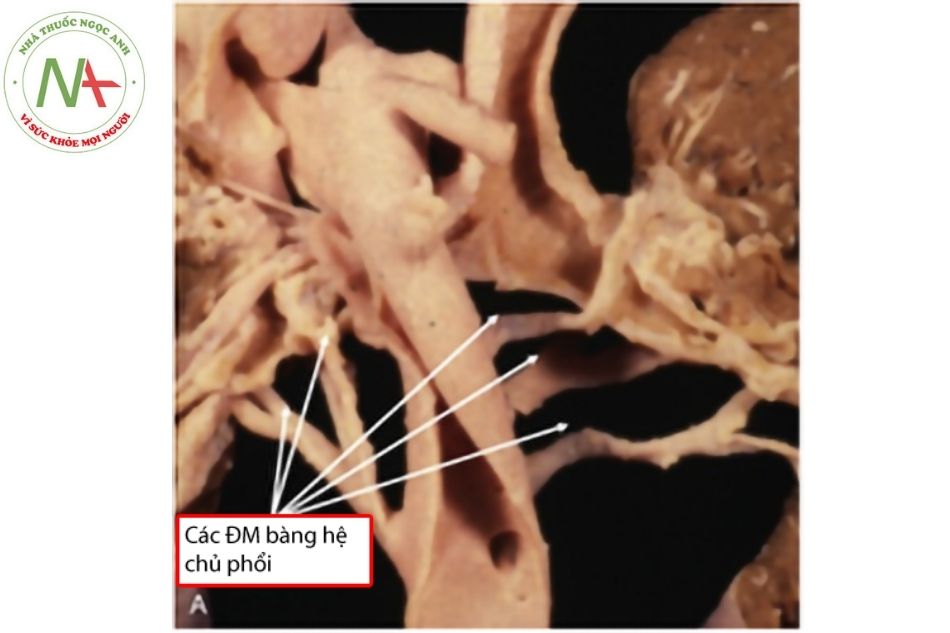
- MAPCAs xuất phát từ mặt sau động mạch chủ xuống.
- Động mạch chủ được kéo ra trước cho thấy cấp máu phổi đơn nguồn từ ống động mạch bên trái qua các động mạch phổi hội lưu.
- Phẫu tích cho thấy đường đi của MAPCAs bám theo cây phế quản để vào nhu mô phổi.
- Phẫu tích thùy dưới phổi phải cho thấy cấp máu kép từ động mạch phổi trung tâm (màu đỏ) và các MAPCAs (màu xanh).
Chú thích: ĐMP: Động mạch phổi; ĐM: Động mạch.
Các cấu trúc tim trái thường bình thường. Thất phải và nhĩ phải thường phì đại, tuy nhiên van ba lá có xu hướng bình thường. Hiếm khi gặp lá vách của van ba lá dính một phần vào lỗ thông liên thất và làm cho lỗ thông liên thất hạn chế. Đường ra thất phải (phễu) bị bịt kín đoạn xa và có chiều dài thay đổi, tùy thuộc vào mức độ dịch chuyển của vách phễu. Trong phần lớn các trường hợp, chỗ nối tâm thất – động mạch phổi bị bịt kín do vách thoát hòa nhập trực tiếp với cơ ở thành tự do đường ra thất phải. Sự hòa nhập này có thể xảy ra muộn trong giai đoạn sau của thời kỳ bào thai do một số trường hợp tứ chứng Fallot có hẹp động mạch phổi trong bào thai có thể tiến triển thành PA-VSD thực sự khi trẻ sinh ra. Một số trường hợp phễu thất phải bị thiểu sản nặng, làm lá van động mạch chủ tiếp xúc trực tiếp với thành thất phải, tạo ra hình ảnh rất giống thân chung động mạch (common arterial trunk) và thậm chí không thể phân biệt với thân chung động mạch nếu không còn di tích động mạch phổi đoạn trong màng ngoài tim.
Hệ thống động mạch vành thường bình thường. Các bất thường có thể gặp là nhánh nón to hơn, lỗ động mạch vành xuất phát cao hơn, hoặc động mạch vành phải xuất phát từ xoang vành trái và chạy ngang mặt trước của phễu thất phải (tương tự trong tứ chứng Fallot). Đôi khi có thể gặp rò động mạch vành – động mạch phổi.
Hệ thống nút (gồm nút xoang, nút nhĩ thất) và các mốc giải phẫu của hệ thống dẫn truyền trên thất thường bình thường. Tương tự tứ chứng Fallot, bó His thường chạy ở rìa sau – dưới của lỗ thông liên thất (sát rìa trong trường hợp thông liên thất phần quanh màng). Nhánh trái tỏa ra dạng quạt, chạy dưới nội mạc bên trái của vách liên thất như tim bình thường, trong khi nhánh phải dạng dải có thể chia đôi hoặc có vài nhánh lạc chỗ trên đường đi tới dải vách (septal band) của bè vách – bờ (septomarginal trabecular).
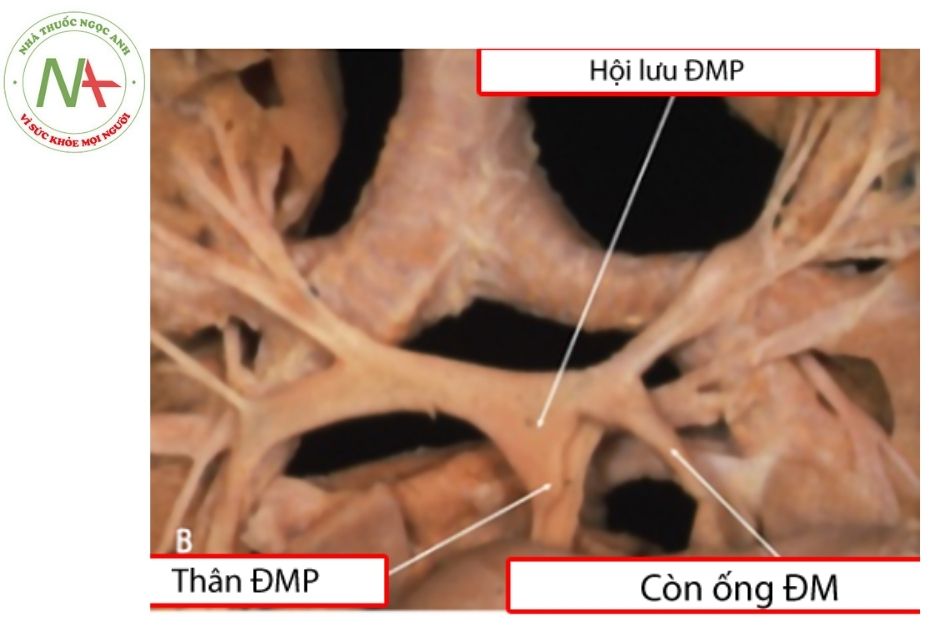
Thuật ngữ động mạch phổi trung tâm được dùng với các đoạn động mạch phổi ở ngoài nhu mô phổi. Trong PA-VSD, hiếm khi chỉ có teo tịt tại van động mạch phổi (van động mạch phổi không thủng) mà thường gặp cả đoạn gần động mạch phổi teo nhỏ như dây chun, trong đó khoảng 25% không thể xác định được động mạch phổi đoạn trong màng ngoài tim. Các động mạch phổi phải và trái và/ hoặc các động mạch phổi phân thùy có thể thông thương tự do với nhau (hội lưu) hoặc không thông thương (không hội lưu). Đoạn động mạch phổi hội lưu này thường bị kéo căng về phía khối tâm thất bởi thân động mạch phổi thiểu sản và tạo nên hình ảnh chim hải âu (flying seagull) trên phim chụp mạch.
Kích thước của động mạch phổi trung tâm sẽ liên quan trực tiếp với lưu lượng và vị trí tưới máu cho nó: kích thước động mạch phổi trung tâm thường bình thường nếu được cấp máu đủ bởi ống động mạch hoặc tuần hoàn bàng hệ với vị trí kết nối ở gần trung tâm hoặc ở các nhánh thùy và có thể thiểu sản nặng nếu vị trí kết nối ở xa hơn ở các nhánh phân thùy hoặc dưới phân thùy.
Cấp máu cho phổi
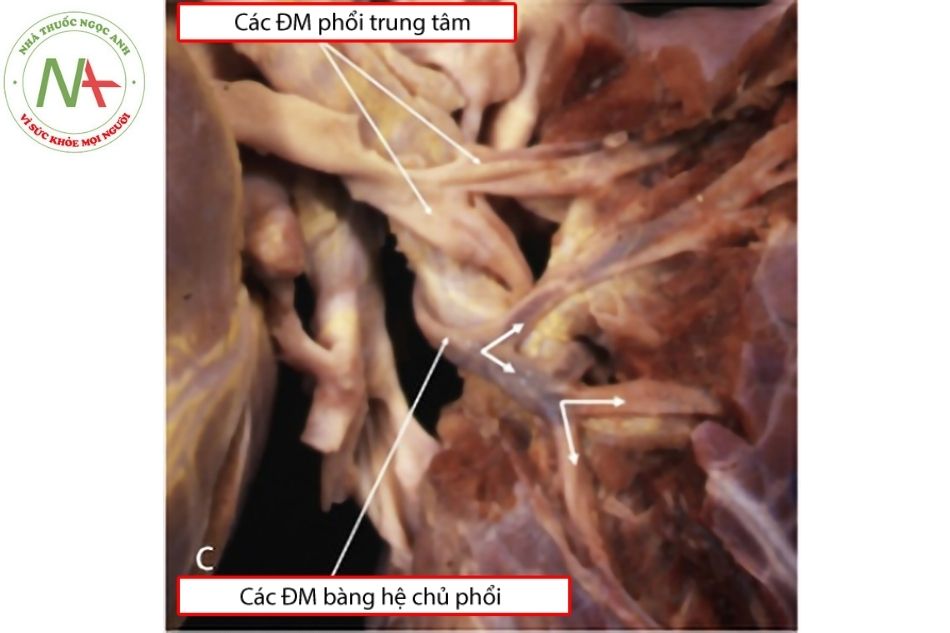
Trong PA-VSD, nguồn cấp máu cho phổi từ thất phải bị gián đoạn hoàn toàn, do đó toàn bộ nguồn cấp máu cho phổi sẽ từ động mạch hệ thống (có thể qua ống động mạch hoặc MAPCAs; ít hơn là từ động mạch vành hoặc các động mạch màng phổi). Khái niệm cấp máu đơn nguồn (unifocal) được dùng khi một phổi được cấp máu từ một nguồn động mạch hệ thống duy nhất (thường là từ ống động mạch), còn nếu các phần của phổi được tưới máu từ các nguồn khác nhau, cấp máu cho phổi được gọi là đa nguồn (multifocal) (thường là từ các MAPCAs).
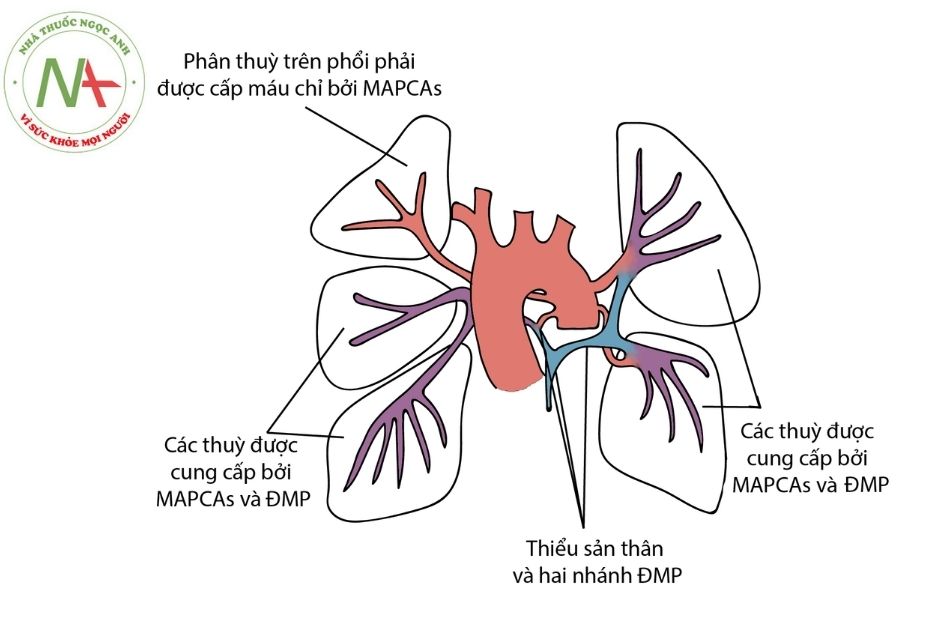
Ba phân thùy của thùy trên phải được cấp máu toàn bộ từ MAPCAs. Các phân thùy phế quản – phổi còn lại được cấp máu từ động mạch phổi trung tâm nhưng được kết nối thêm với các MAPCAs tại các vị trí rốn phổi, thùy và phân thùy.
Chú thích: MAPCAs: Các động mạch bàng hệ chủ – phổi chính; ĐMP: Động mạch phổi.
Còn ống động mạch (patent ductus arteriosus)
Ống động mạch là một nguồn cấp máu cho phổi quan trọng nhưng không ổn định. Ống thường xuất phát từ ngay sau nguyên ủy động mạch dưới đòn trái hoặc động mạch dưới đòn phải (với trường hợp ống bên phải, thường kèm cung động mạch chủ bên phải) để đến hội lưu động mạch phổi trung tâm.
Ở tim bình thường trong giai đoạn bào thai, máu chảy từ động mạch phổi sang ống động mạch để qua động mạch chủ xuống đi nuôi nửa dưới cơ thể, do đó ống động mạch sẽ tạo với động mạch chủ xuống một góc tù quay xuống dưới. Trong PA-VSD, do tắc nghẽn hoàn toàn dòng máu đi từ tâm thất lên động mạch phổi, trong thời kỳ bào thai, toàn bộ cung lượng tim kết hợp của hai tâm thất sẽ được bơm vào động mạch chủ lên và cung động mạch chủ. Sự thay đổi huyết động này sẽ dẫn tới thay đổi về cấu trúc của các mạch máu, làm giãn động mạch chủ lên và rất hiếm khi xảy ra hẹp eo động mạch chủ. Đồng thời do dòng máu trong ống động mạch bắt buộc phải chảy ngược so với tim bình thường dẫn tới thay đổi định hướng của ống, làm ống tạo với động mạch chủ xuống một góc nhọn quay xuống dưới. Tình trạng này gọi là ống động mạch định hướng ngược (reverse – oriented ductus arteriosus).
Ống động mạch và tuần hoàn bàng hệ có thể cùng tồn tại trên một bệnh nhân, nhưng hiếm khi cùng tồn tại ở cùng một bên phổi. Anderson đề xuất một quy tắc thực hành dễ nhớ: nếu một bên phổi được cấp máu bởi MAPCAs, ống động mạch sẽ không tồn tại ở bên đó. Thường gặp nhất là trường hợp ống động mạch tồn tại ở một bên với tỷ lệ động mạch phổi hội lưu trên 80%. Tuy nhiên, khi các động mạch phổi trung tâm không hội lưu, bên phổi được cấp máu bởi ống động mạch (thường là bên trái) sẽ có cấp máu đơn nguồn và phân bố mạch máu bình thường, trong khi phổi đối diện sẽ có cấp máu đa nguồn và phân bố động mạch phổi rời rạc. Tình trạng này gọi là arborization abnormality – với chữ “arbor” trong tiếng latin nghĩa là “cái cây” – tạm dịch là bất thường chia nhánh cây động mạch.
Nếu không có ống động mạch, cấp máu cho phổi sẽ phụ thuộc hoàn toàn vào tuần hoàn bàng hệ chủ – phổi và bất thường chia nhánh cây động mạch sẽ xảy ra ở cả hai phổi. Trong trường hợp này, MAPCAs có thể cấp máu trực tiếp cũng như gián tiếp cho phổi qua chỗ nối với hội lưu động mạch phổi (khi đó thùy phổi sẽ có nguồn cấp máu kép).
Hiếm khi gặp hai ống động mạch ở hai bên cấp máu độc lập cho hai phổi qua các động mạch phổi không hội lưu. Do ống động mạch mở thông rộng rãi trong thời kỳ bào thai, hệ thống động mạch phổi của trẻ có thể bình thường khi sinh ra và sẽ trở nên hẹp dần do ống động mạch co thắt sau sinh làm giảm lượng máu lên phổi.
Bàng hệ chủ – phổi
MAPCAs (major aortopulmonary collateral arteries: động mạch bàng hệ chủ – phổi chính) được định nghĩa là các mạch máu hệ thống tận hết trong nhu mô phổi. MAPCAs có thể gặp ở các bệnh tim bẩm sinh khác có điểm chung là hạn chế nặng nguồn cấp máu trung tâm cho phổi (như chuyển gốc đại động mạch, thất phải hai đường ra, thân chung động mạch…) tuy nhiên thường gặp nhất là trong PA-VSD.
Ở giai đoạn sơ sinh, MAPCAs có thể có thành trơn nhẵn và khẩu kính đều, tuy nhiên khi trẻ lớn lên, MAPCAs gần như luôn luôn có bất thường như thành dày lên, hẹp không đều, đường đi xoắn vặn, thiểu sản các nhánh, hoặc bất thường trong chia nhánh cây động mạch (arborization). MAPCAs thường xuất phát từ mặt trước động mạch chủ xuống, ít gặp hơn là từ động mạch dưới đòn, động mạch chủ bụng hoặc từ động mạch vành. Nếu xuất phát từ động mạch chủ, đường đi của nó thường sau thực quản. Đôi khi MAPCAs có thể xuất phát từ cung động mạch chủ và kết nối với động mạch phổi trung tâm làm việc phân biệt với ống động mạch khó khăn (gọi là tuần hoàn bàng hệ trung tâm giống ống – central duct-like collateral). Trong trường hợp này có thể phân biệt MAPCAs với ống động mạch dựa vào đặc điểm giải phẫu và phôi thai học: ống động mạch thường xuất phát từ một vị trí hằng định của cung động mạch chủ (đối diện với thân tay đầu hoặc động mạch dưới đòn) và được vòng quanh bởi thần kinh thanh quản quặt ngược.
Số lượng MAPCAs thường thay đổi từ 1 đến 6, đường kính từ 1 đến 20 mm. Có khoảng 40% MAP- CAs sẽ kết nối với động mạch phổi trung tâm ở rốn phổi hoặc trong phổi. 60% MAPCAs còn lại sẽ đi vào trong rốn phổi, đi cùng phế quản giống như các động mạch phổi để cấp máu cho các phân thùy phế quản – phổi (một số tác giả cho rằng MAPCAs có nguyên ủy, đường đi và có lẽ cả nguồn gốc phôi thai giống với động mạch phế quản).
Các bất thường đi kèm khác
Các bất thường khác đi kèm bao gồm cung động mạch chủ bên phải (26-50%, thường gặp hơn so với tứ chứng Fallot), thông liên nhĩ (atrial septal defect)/còn lỗ bầu dục (patent foramen ovale) (khoảng 50%), tồn tại tĩnh mạch chủ trên trái, bất thường đổ về tĩnh mạch phổi toàn phần/bán phần (total/partial anomalous pulmonary venous return), teo tịt van ba lá (tricuspid atresia) (type Ia, IIa), chuyển gốc đại động mạch (transposition of the great arteries) và hội chứng đồng dạng phải.
Phân loại
- Phân loại của Dự án Danh pháp Phẫu thuật Tim Bẩm sinh (Congenital Heart Surgery Nomenclature and Database Project – CHSNP), dựa vào đặc điểm cấp máu cho phổi:
- Type A: Cấp máu phổi từ ống động mạch qua hội lưu động mạch phổi trung tâm.
- Type B: Cấp máu phổi kép từ cả hội lưu động mạch phổi trung tâm và
- Type C: Động mạch phổi trung tâm và ống động mạch không tồn tại. Phổi được cấp máu bởi
- Phân loại Castaneda dựa theo các đặc điểm giải phẫu của động mạch phổi:
- Type I: Động mạch phổi có van không thủng, thân động mạch phổi và hội lưu các động mạch phổi trung tâm có kích thước gần bình thường. Cấp máu phổi qua ống động mạch. Không có
- Type II: Không có thân động mạch phổi. Hội lưu các động mạch phổi trung tâm và được cấp máu bởi ống động mạch. Không có
- Type III: Hội lưu động mạch phổi trung tâm kèm MAPCAs nhưng không có ống động mạch.
- Type IV: Động mạch phổi trung tâm không có hội lưu hoặc vắng mặt. Có
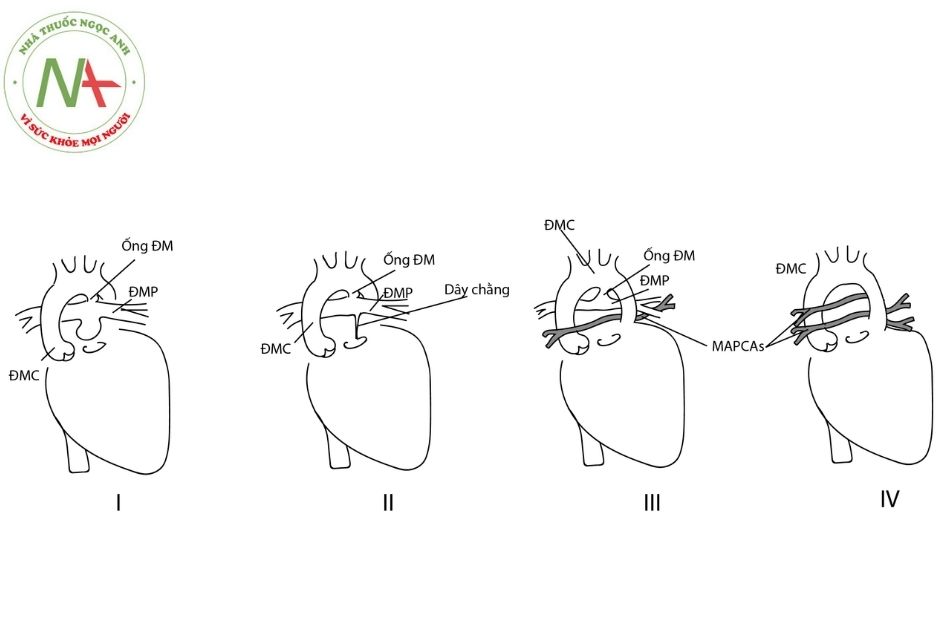
Chú thích: ĐMC: Động mạch chủ; ĐMP: Động mạch phổi; ĐM: Động mạch; MAPCAs: các tuần hoàn bàng hệ chủ – phổi chính.
CHẨN ĐOÁN
Lâm sàng
Tương tự cơ chế tím trong Fallot, ngoài việc là hậu quả của quá trình trộn máu dưới van động mạch chủ (tím do luồng thông), một yếu tố ảnh hưởng lớn đến mức độ tím đó là tưới máu phổi (tím do bất tương xứng thông khí – tưới máu). Trong PA-VSD có vị trí (situs) thất bình thường, do sự mất hoàn toàn thông thương giữa thất phải và động mạch phổi, tưới máu phổi sẽ phụ thuộc hoàn toàn vào nguồn cung từ động mạch hệ thống. Vì vậy ngoài những triệu chứng của tổn thương tại tim, diễn biến lâm sàng của PA-VSD còn phụ thuộc vào tình trạng của ống động mạch cũng như số lượng và kích thước của MAPCAs.
Trường hợp động mạch phổi nhỏ, ít MAPCAs (type I hoặc II)
Trẻ mới sinh thường biểu hiện tím sớm do ống động mạch không đủ lớn để cấp máu đầy đủ cho phổi. Trong PA-VSD, ống động mạch có xu hướng đóng muộn hơn so với trẻ bình thường. Tuy nhiên, sau vài tuần, hiện tượng co thắt ống động mạch vẫn xảy ra, trẻ sẽ có biểu hiện tím tiến triển (thậm chí là dao động do ống động mạch co thắt rồi lại giãn từng đợt), trẻ kích thích, bú kém, thở nhanh sâu do thiếu oxy mô và toan máu. Khám lâm sàng thấy tim không to nhưng có ổ đập mạnh ở nửa dưới bờ trái xương ức do thất phải phì đại. Nghe tim thấy T1 mạnh, click tống máu do lưu lượng cao tống vào động mạch chủ lên, tiếng T2 đơn độc (do chỉ còn thành phần A2), nghe rõ ở điểm giữa bờ trái xương ức do van động mạch chủ bị di lệch sang phải. Khác với Fallot, trong PA-VSD không có âm thổi tống máu qua đường ra thất phải ở vùng cạnh ức trái mà thường thấy thổi liên tục của ống động mạch ở vùng dưới đòn trái (hoặc dưới đòn phải nếu ống bên phải).
Trường hợp nhiều MAPCAs (thường là type III)
Bệnh nhân có biểu hiện của tăng tuần hoàn phổi chưa xuất hiện ngay sau sinh do sức cản phổi ở trẻ sơ sinh còn cao. Trẻ có thể tím mức độ vừa khi sinh, nhưng sau vài tuần (thường là 4-6 tuần tuổi), khi sức cản phổi giảm xuống, dòng máu lên phổi tăng lên, tím sẽ giảm và triệu chứng suy tim xuất hiện. Khám lâm sàng thấy tim to, mỏm tim đập mạnh, nghe tim thấy tiếng T1 mạnh, T2 đơn độc, click tống máu. Thổi liên tục có thể nghe thấy ở nhiều vùng khác nhau trên ngực, lan từ sau lưng hoặc lan khắp ngực. Mạch nảy mạnh chìm sâu do cung lượng tim lớn và máu thoát qua MAPCAs thì tâm trương (tương tự mạch Corrigan trong còn ống động mạch lớn). Do tình trạng hẹp của MAPCAs có thể chỉ xuất hiện sau sinh và tiến triển theo thời gian, sau vài tháng, trẻ có thể bớt biểu hiện suy tim và tím nhiều hơn. Nhiều trẻ vẫn có thể sống tới tuổi trưởng thành dù tím nặng và khả năng gắng sức hạn chế.
Cận lâm sàng
Điện tâm đồ
Trong PA-VSD, điện tâm đồ ít có giá trị chẩn đoán xác định, nhưng có thể thấy một số dấu hiệu gợi ý: trục QRS sang phải, sóng R lớn do phì đại thất phải. Một số trường hợp tuần hoàn chủ – phổi nhiều, máu lên phổi và về tim trái nhiều sẽ có các dấu hiệu tăng gánh các buồng tim trái.
Xquang ngực
Biểu hiện trên Xquang đa dạng. Có thể thấy tim “hình hia” (coeur en sabot) với mỏm tim hếch lên, cung động mạch phổi lõm (giống trong Fallot), cung động mạch chủ bên phải (25%). Tưới máu phổi giảm hoặc có thể không đồng nhất nếu có cấp máu đa nguồn.Trường hợp ống động mạch lớn và động mạch phổi hội lưu, có thể thấy bóng động mạch phổi trung tâm lớn hơn và dấu hiệu tăng tuần hoàn phổi chủ động ở cả hai phổi.
Siêu âm tim
Là công cụ rất hữu ích trong chẩn đoán. Ở mặt cắt dưới sườn và cạnh ức trục dài, có thể thấy hình ảnh thông liên thất lệch hàng lớn và đại động mạch cưỡi ngựa trên mào vách liên thất. Kích thước và chênh áp qua lỗ thông liên thất được khảo sát để khẳng định thông liên thất không hạn chế.
Mặt cắt trục ngắn qua van động mạch chủ cho thấy vách thoát bị lệch ra trước và lên trên, hòa nhập với thành tự do đường ra thất phải làm đường ra thất phải bị bịt kín. Doppler màu cho thấy không có dòng chảy đi qua vị trí van động mạch phổi. Thân và hai nhánh động mạch phổi thiểu sản và tính chất hội lưu của chúng có thể khảo sát ở mặt cắt này, tuy nhiên thường dễ thấy hơn ở mặt cắt cạnh ức cao (nhờ tính chất truyền âm tốt của tuyến ức) (Hình 7).
Mặt cắt cạnh ức cao và trên hõm ức cho phép khảo sát tình trạng các động mạch phổi trung tâm, vị trí của cung động mạch chủ so với khí quản. Dòng trào ngược trên Doppler động mạch chủ xuống gợi ý cung lượng bàng hệ chủ – phổi lớn. Đôi khi có thể thấy được nguyên ủy và đường đi của đoạn gần các động mạch vành.
Ngoài ra siêu âm tim còn cho phép đánh giá và theo dõi bệnh nhân sau mổ: tắc nghẽn tồn dư, thông liên thất tồn lưu (residual ventricular septal defect), chức năng thất phải và ước tính áp lực động mạch phổi.
Nhược điểm của siêu âm là khảo sát các MAPCAs kém do cửa sổ siêu âm không thuận lợi. Mục tiêu thực tế hơn khi siêu âm là cố gắng xác định các nguyên ủy của MAPCAs (có thể từ động mạch chủ xuống, động mạch chủ bụng, thân tay đầu hoặc các động mạch vành) để rút ngắn thời gian tìm kiếm trên thông tim và chụp mạch vành. Một số MAPCAs có thể bị bỏ sót trong chẩn đoán trước mổ và được phát hiện bằng siêu âm qua thực quản trong mổ. Một yếu tố khác cũng góp phần gợi ý sự hiện diện của MAPCAs đó là kích thước động mạch phổi trung tâm: nghiên cứu của Mackie và cộng sự cho thấy khi động mạch phổi trung tâm càng nhỏ, xác suất có mặt của MAPCAs sẽ càng cao. Khi lấy điểm cắt của Z-score động mạch phổi là ≤ -2.5, độ nhạy và độ đặc hiệu trong việc tiên đoán có ít nhất 1 MAPCAs tồn tại lần lượt là 88% và 100%.
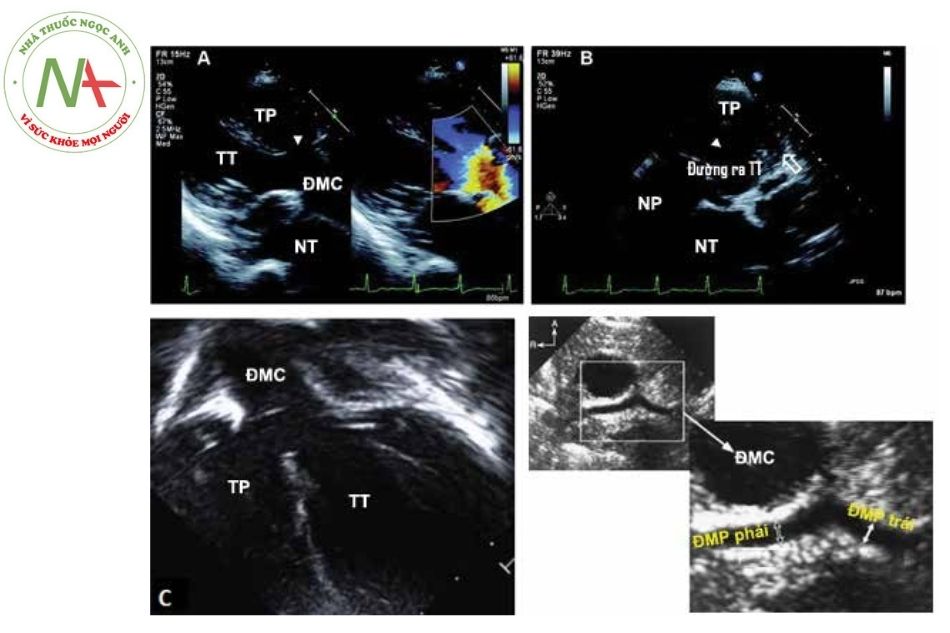
Mặt cắt cạnh ức trục dài (A) và dưới sườn trục dài (C) cho thất thông liên thất lớn, động mạch chủ giãn cưỡi ngựa trên vách liên thất và thất phải phì đại. Doppler màu cho thấy hiện tượng dòng rối (aliasing) do tăng tốc dòng máu qua van động mạch chủ khi động mạch chủ tiếp nhận cung lượng tim từ cả hai thất.
(B): mặt cắt cạnh ức trục ngắn cho thấy đường ra thất phải bị bịt kín (mũi tên trắng).
(D): mặt cắt cạnh ức cao cho thấy hội lưu động mạch phổi và hai nhánh động mạch phổi thiểu sản.
Chú thích: ĐMC: Động mạch chủ; ĐMP: Động mạch phổi; TP: Thất phải; TT: Thất trái; NP: Nhĩ phải; NT: Nhĩ trái.
Dưới đây là các mục tiêu cần đạt được trong siêu âm trước mổ PA-VSD:
- Vị trí tim, vị trí tạng và vị trí nhĩ, đánh giá sự hiện diện của tuyến ức.
- Các kết nối tĩnh mạch hệ thống và tĩnh mạch phổi. Tình trạng vách liên nhĩ.
- Hình thái và chức năng van nhĩ thất.
- Hình thái lỗ thông liên thất: vị trí, mức độ lan rộng, liên quan với các van Đánh giá mức độ hạn chế của lỗ thông. Loại trừ các lỗ thông liên thất phần cơ khác đi kèm.
- Động mạch phổi: xác định mức độ teo tịt (tại van, tại thân), kích thước, đặc điểm hội lưu, phân bố (tính chỉ số Z-score, McGoon, Nakata).
- Đánh giá kích thước và mức độ cưỡi ngựa của van động mạch chủ, tình trạng hở động mạch chủ, vị trí cung động mạch chủ.
- Đánh giá hình thái ống động mạch và các MAP- CAs có thể quan sát được.
- Đánh giá vị trí xuất phát và đường đi của các động mạch vành.
- Tổn thương phối hợp khác.
Thông tim và chụp mạch
Do tính chất phức tạp của giải phẫu mạch máu phổi trong PA-VSD và hạn chế của siêu âm tim trong việc đánh giá các nhánh ngoại vi của tuần hoàn phổi, thông tim và chụp mạch có ý nghĩa rất quan trọng trong việc khảo sát kích thước, phân bố và đánh giá mức độ cấp máu từ bàng hệ cho phổi, từ đó lập bản đồ cấu trúc mạch máu phổi để phục vụ cho phẫu thuật cũng như đánh giá sau phẫu thuật.
Ống thông có thể được đưa qua lỗ bầu dục để khảo sát tĩnh mạch phổi và các buồng tim trái. Động mạch chủ lên có thể được tiếp cận theo đường thất phải qua lỗ thông liên thất, tuy nhiên cũng có thể tiếp cận ngược dòng động mạch chủ. Thông tim đo áp lực cho thấy sóng a của nhĩ phải thường cao hơn và sóng a của nhĩ trái thường thấp hơn so với tim bình thường. Ít khi gặp sóng v lớn do hở van ba lá nhiều. Áp lực của thất phải và thất trái cân bằng nếu thông liên thất không bị hạn chế. Huyết áp hiệu số trong động mạch chủ sẽ lớn nếu lượng máu qua bàng hệ lên phổi nhiều.
Tỷ lệ Qp/Qs có thể tính theo phương pháp Fick, với phương trình tính Qp bằng thương số giữa mức tiêu thụ oxy và chênh lệch lượng oxy trong máu hậu mao mạch phổi và máu tiền mao mạch phổi. Trong tứ chứng Fallot, do có sự trộn lẫn giữa máu từ thất phải qua van động mạch phổi với máu từ các luồng thông trái -> phải, rất khó để ước tính lượng oxy trong máu tiền mao mạch phổi. Ngược lại trong PA- VSD, toàn bộ lượng máu lên phổi có nguồn gốc từ động mạch chủ, do vậy có thể tính được lưu lượng máu vào động mạch phổi theo công thức sau, với nồng độ O2 máu động mạch phổi chính là nồng độ O2 máu động mạch chủ:
Qp = VO2/(Nồng độ O2 máu tĩnh mạch phổi – Nồng độ O2 máu động mạch phổi)
Chụp mạch máu và các buồng tim: kỹ thuật xác định thông liên thất kinh điển là chụp buồng thất trái ở góc chếch trước trái 70o và nghiêng về phía đầu 20o. Thông thường, có thể khảo sát hệ động mạch vành không chọn lọc bằng cách chụp gốc động mạch chủ ở cùng góc chụp này (do chụp chọn lọc động mạch vành ở trẻ nhỏ có thể khó và nhiều biến chứng). Khi có dự kiến tái lập thông thương giữa thất phải và động mạch phổi, việc khảo sát mạch vành là cần thiết vì có khoảng 5% bệnh nhân có động mạch vành phải xuất phát bất thường từ xoang vành trái chạy ngang mặt trước đường ra thất phải và việc quan sát động mạch vành trong khi mổ có thể khó do hậu quả dính màng ngoài tim từ lần mổ trước.
Kỹ thuật chụp các tuần hoàn bàng hệ cho phổi thường được tiếp cận ngược dòng động mạch chủ để dễ thao tác. Chụp động mạch chủ lên và cung động mạch chủ cho phép thấy ống động mạch xuất phát từ động mạch chủ theo góc nhọn quay xuống dưới. Nhờ được định hướng trước bằng siêu âm tim hoặc chụp mạch cắt lớp vi tính, thời gian chiếu tia để tìm nguyên ủy các MAPCAs có thể được giảm xuống. Các chi tiết cần khảo sát đó là động mạch phổi trung tâm có hội lưu hay không; số lượng, kích thước, đường đi, tính chất hẹp và đặc điểm cấp máu cho các phân thùy phổi của các MAPCAs; số lượng các phân thuỳ phổi được cấp máu bởi động mạch phổi tự nhiên; và các phân thuỳ phổi có nguồn cấp máu kép. Có thể tiến hành can thiệp như nong bóng, đặt stent với các chỗ hẹp MAPCAs hoặc bít MAPCAs thừa bằng coil nếu phân thùy phổi được khảo sát có nguồn cấp máu kép. Nếu có hội lưu, bàng hệ chủ – phổi có thể kết nối trực tiếp với hội lưu hoặc gián tiếp qua nhánh động mạch phổi ngoại vi. Dấu hiệu “rửa thuốc” có thể gợi ý còn dòng chảy cạnh tranh từ một MAPCAs khác vào hội lưu động mạch phổi (Hình 8A). Trong một số trường hợp khó xác định hội lưu động mạch phổi, có thể thực hiện kỹ thuật chụp tĩnh mạch phổi bít ngược dòng để hiện hình động mạch phổi trung tâm thiểu sản (Hình 8).
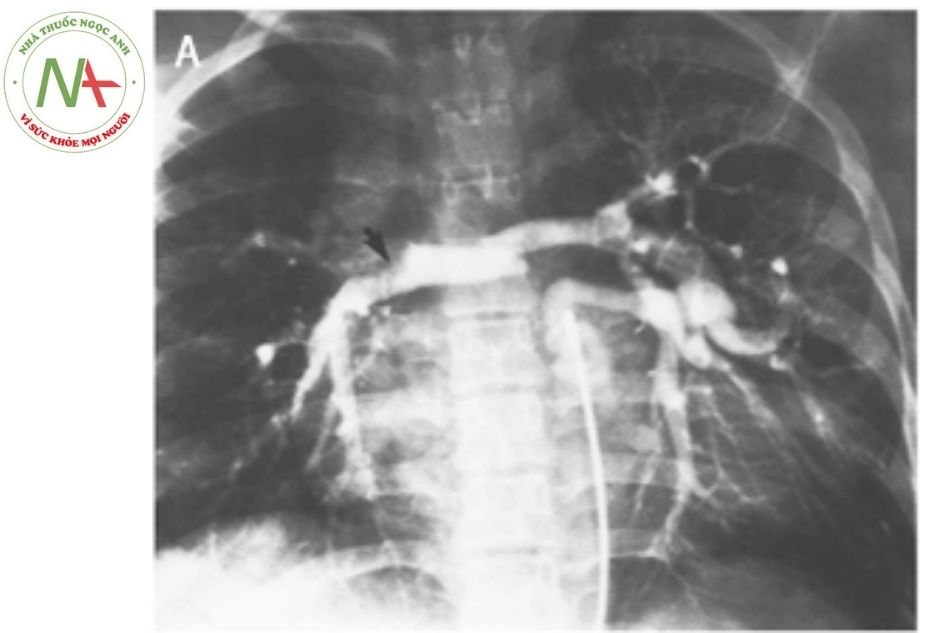
Chụp chọn lọc MAPCAs xuất phát từ đoạn giữa động mạch chủ xuống cho thấy thông thương giữa MAPCAs và hội lưu động mạch phổi trung tâm. Mũi tên đen cho thấy hình ảnh rửa thuốc cản quang do có dòng máu cạnh tranh từ kết nối với một MAPCAs khác ở động mạch phổi phải.
Nhược điểm của chụp mạch xâm lấn là thời gian thủ thuật kéo dài và tiêu tốn nhiều thuốc cản quang. Để tránh các biến chứng như tắc mạch, tăng áp lực thẩm thấu máu và suy thận do thuốc cản quang, không nên dùng quá 5 ml thuốc cản quang/kg cân nặng trong một thủ thuật và nên chia thành 2 thủ thuật cách nhau ít nhất 24 giờ nếu cần chụp nhiều mạch máu.
Chụp mạch cắt lớp vi tính và chụp cộng hưởng từ tim
Mặc dù thông tim và chụp mạch xâm lấn là tiêu chuẩn vàng trong đánh giá MAPCAs, những năm gần đây, chụp mạch cắt lớp vi tính (CTA) đã được ứng dụng vào việc lập bản đồ mạch máu phổi trong PA-VSD.
Ưu điểm của chụp mạch cắt lớp vi tính là cho phép đánh giá các bàng hệ khó tiếp cận cũng như tương quan với các cấu trúc xung quanh, đánh giá đường dẫn khí, sử dụng liều bức xạ ít hơn và tương quan tốt trong việc đánh giá các động mạch phổi trung tâm so với chụp mạch xâm lấn.
Tuy nhiên, CTA có hạn chế trong việc đánh giá các tuần hoàn bàng hệ nhỏ và đòi hỏi thông tim và chụp mạch trước mổ để có chẩn đoán chính xác.
Chụp cộng hưởng từ tuy không có độ phân giải cao như CTA nhưng có ưu điểm trong đánh giá thể tích và chức năng thất phải, cũng như mức độ hở ống nối có van (conduit) sau phẫu thuật.
Diễn tiến tự nhiên
Gần một nửa số trẻ sẽ tử vong trong năm đầu tiên nếu không được điều trị. Tiên lượng rất tồi nếu trẻ có cấp máu phổi phụ thuộc ống động mạch. Một số bệnh nhân không phụ thuộc ống và có cấp máu phổi tăng nhưng không quá nhiều có thể sống đến 30-40 tuổi dù không phẫu thuật. Bệnh nhân người lớn thường suy thất trái tiến triển dần và kèm theo hở động mạch chủ. SpO2 cũng thường giảm dần khi tuổi tăng.
Các biến chứng có thể gặp tương tự các tim bẩm sinh tím khác: đa hồng cầu, áp xe não, tắc mạch nghịch thường, viêm nội tâm mạc nhiễm khuẩn.
Chẩn đoán xác định
Chẩn đoán PA-VSD dựa vào các dấu hiệu lâm sàng và cận lâm sàng sau:
Lâm sàng
Tùy thuộc vào kích thước ống động mạch cũng như số lượng MAPCAs mà biểu hiện hai bệnh cảnh lâm sàng khác nhau:
- Bệnh tim bẩm sinh có tím, ít máu lên phổi: khi ống động mạch nhỏ, số lượng MAPCAs ít: bệnh cảnh của nhóm tim bẩm sinh tuần hoàn phổi phụ thuộc ống động mạch (tím nhiều nhưng ít biểu hiện khó thở, không có suy tim).
- Bệnh tim bẩm sinh có tím, nhiều máu lên phổi: gặp trong trường hợp ống động mạch lớn hoặc nhiều MAPCAs (tím, các biểu hiện của suy tim sung huyết).
- Thổi tâm thu khoang liên sườn 3, 4 đường cạnh ức trái do thông liên thất.
Xquang ngực
- Cung động mạch phổi lõm.
- Nhóm nhiều máu lên phổi: bóng tim to, phổi ứ huyết không đồng đều.
- Nhóm ít máu lên phổi: phổi sáng, giảm tưới máu.
Siêu âm tim: kết hợp nhiều mặt cắt nhắm đánh giá:
- Thông liên thất: vị trí, kích thước, luồng thông.
- Hệ động mạch phổi: có còn van động mạch phổi không, có thân động mạch phổi không, hai nhánh động mạch phổi có còn hợp lưu không, mức độ thiểu sản hai nhánh động mạch phổi.
- Ống động mạch, MAPCAs
- Đánh giá các tổn thương kèm theo.
ĐIỀU TRỊ
Nội khoa
Chiến lược điều trị nội khoa sẽ phụ thuộc vào đặc điểm huyết động và biểu hiện lâm sàng của trẻ. Đồng thời, nên chuyển bệnh nhân tới trung tâm chuyên điều trị bệnh tim bẩm sinh.
PA-VSD có tuần hoàn chủ – phổi ít là bệnh tim bẩm sinh phụ thuộc ống. Trẻ sẽ tím nặng nếu ống động mạch đóng dần.
Về điều trị cần xử trí cơn tím, đó là cho trẻ nằm yên tránh các kích thích bằng cách sử dụng thuốc an thần, bù đủ dịch để đảm bảo đủ khối lượng tuần hoàn, không nên cho thở oxy 100% (lợi ích không quá nhiều do hạn chế dòng máu lên phổi do ống động mạch có thể bị đóng lại).
Truyền tĩnh mạch prostaglandin E1 (PGE1) để mở và giữ ống động mạch. Trẻ sinh non có nguy cơ ngừng thở khi truyền PGE1 có thể cần phải đặt nội khí quản và thông khí nhân tạo trong khi chuyển viện. Tác dụng của prostaglandin E1 cũng xuất hiện ở cả những trẻ không có ống động mạch, có lẽ do tác dụng giảm sức cản mạch phổi và tăng lưu lượng máu lên phổi, mặc dù hiệu quả không nổi bật như tác dụng trên ống động mạch.
Toan chuyển hóa nặng có thể cần điều trị bằng natri bicarbonate.
Trường hợp trẻ lớn hơn có đa hồng cầu nhiều và triệu chứng tăng độ nhớt máu, cần được chỉ định chích máu tĩnh mạch (tuy nhiên phương pháp này ít hiệu quả), bù sắt và bù khối lượng tuần hoàn.
Trẻ có bàng hệ chủ – phổi nhiều có thể ít biểu hiện tím nhưng có suy tim trái tiến triển và cần được điều trị suy tim với lợi tiểu, ức chế men chuyển và thuốc kiểm soát nhịp. Tuy nhiên phẫu thuật nên được tiến hành sớm do nguy cơ hẹp và xoắn vặn các MAPCAs sẽ gia tăng khi trẻ lớn, làm khả năng sửa chữa toàn bộ thương tổn sẽ giảm theo thời gian.
Can thiệp và phẫu thuật
Can thiệp tim mạch nhằm mục đích:
- Mở rộng vách liên nhĩ bằng bóng (làm giảm áp lực thất phải) vì PA-VSD với lỗ thông liên thất lớn ít có chỉ định phá vách liên nhĩ, trừ trường hợp teo tịt van động mạch phổi kèm lành vách liên thất (PA-IVS).
- Mở van động mạch phổi khi giải phẫu thân và hai nhánh tốt (tránh được một cuộc phẫu thuật).
- Đặt stent ống động mạch nếu sử dụng prostaglandin E1 kéo dài có tác dụng phụ.
- Chẩn đoán tồn tại MAPCAs và động mạch phổi nguyên thủy.
- Đo sức cản mạch máu phổi và các chỉ số huyết động khác.
Điều trị phẫu thuật
Phẫu thuật là phương pháp điều trị nền tảng đối với PA-VSD. Phẫu thuật sửa chữa toàn bộ (complete repair) được định nghĩa là đóng tất cả các lỗ thông ở vách, cắt đứt tất cả các nguồn cấp máu ngoài tim cho động mạch phổi, và tái lập thông thương giữa thất phải và động mạch phổi bằng cách kết nối ít nhất 14 động mạch phổi phân thùy với thất phải.
Các trường hợp không thể sửa chữa toàn bộ sẽ được can thiệp hoặc phẫu thuật giảm nhẹ tùy vào biểu hiện lâm sàng và sinh lý bệnh: làm tăng lượng máu lên phổi bằng cầu nối chủ – phổi (Blalock-Taussig cải tiến, cầu nối Melbourne, phẫu thuật đơn nguồn hóa hoặc đặt stent ống động mạch) với trường hợp ít máu lên phổi; hoặc giảm lượng máu lên phổi với trường hợp nhiều máu lên phổi (phẫu thuật loại bỏ các MAPCAs không cần thiết, bít MAPCAs bằng dụng cụ qua đường ống thông). Mấu chốt trong việc lựa chọn phương án phẫu thuật đó là phải khảo sát và lập bản đồ cấu trúc mạch máu phổi chi tiết trước mổ.
Các MAPCAs sẽ được tách ra khỏi nguyên ủy từ động mạch chủ và ghép lại với động mạch phổi trung tâm (nếu có) và với các miếng vá mạch nhân tạo để tạo ra động mạch phổi mới (neo-PA). Kỹ thuật này được gọi là đơn nguồn hóa (unifocalization) và được thực hiện bằng cách tập hợp lại nhiều MAPCAs cùng bên nhất có thể. Động mạch phổi mới này có thể được nối với thất phải qua ống nối có van (valved conduit) trong trường hợp sửa chữa toàn bộ.
Trước đây, phẫu thuật PA-VSD thường được tiến hành qua nhiều giai đoạn (multiple stages) và được thực hiện ở trẻ lớn. Vấn đề thường gặp là tình trạng hẹp các MAPCAs làm phẫu thuật đơn nguồn hóa gặp khó khăn, trong khi ở các phân thùy phổi được tưới máu bởi các MAPCAs không bị hẹp lại xuất hiện bệnh lý tăng áp mạch máu phổi (pulmonary hypertension). Vì vậy, tỷ lệ phẫu thuật thành công không cao do sau mổ sức cản động mạch phổi tăng, thất phải bị suy và không thể đóng được lỗ thông liên thất.
Năm 1995, Reddy và McElhinney đề xuất một cách tiếp cận mới: phẫu thuật đơn nguồn hóa sớm một giai đoạn. Thời điểm phẫu thuật lý tưởng có lẽ là từ 4 đến 7 tháng tuổi. Dưới lứa tuổi này, sụn đường thở của trẻ chưa trưởng thành, dẫn tới nhiều biến chứng hô hấp sau mổ và nguy cơ nằm viện lâu hơn. Trên lứa tuổi này, bệnh lý mạch máu phổi có thể xảy ra ở các phân thùy phổi không được bảo vệ. Một số trường hợp đặc biệt có thể cần phải mổ sớm hơn thậm chí từ giai đoạn sơ sinh bao gồm: 1) trẻ ít tím, chậm lớn và có triệu chứng suy tim nhiều (do nhiều máu lên phổi và về tim trái, vì vậy hệ thống mạch phổi sau mổ có thể thích nghi được với cung lượng từ tim phải); hoặc 2) những trường hợp tím nặng (SaO2 < 75%) có MAPCAs phức tạp có thể cần phẫu thuật đơn nguồn hóa sớm. Các trường hợp có hệ động mạch phổi tương đối hoàn chỉnh (ví dụ như cấp máu qua ống động mạch, hoặc tồn tại động mạch phổi trung tâm tương đối phát triển), có thể can thiệp giúp máu lên phổi tốt hơn (như đặt stent ống động mạch, làm cửa sổ chủ – phế kiểu Melbourne), tạo điều kiện cho hệ động mạch phổi tiếp tục lớn lên.
Sau khi thực hiện đơn nguồn hóa, quyết định sửa chữa tổn thương trong tim sẽ phụ thuộc vào đánh giá huyết động trong mổ. Nếu sức cản và áp lực động mạch phổi thấp, áp lực thất phải không cao (được định nghĩa là áp lực động mạch phổi trung bình dưới 25 mmHg khi bơm máu vào động mạch phổi mới với lưu lượng 2,5 L/phút/m2 BSA và tỷ số áp lực thất phải/áp lực thất trái < 0,7), có thể đóng lỗ thông liên thất và đặt ống nối có van (conduit) giữa thất phải và động mạch phổi. Nếu sức cản mạch phổi và áp lực thất phải còn cao, có thể lựa chọn phương pháp mở cửa sổ miếng vá thông liên thất hoặc nối động mạch phổi mới với động mạch chủ (luồng thông chủ – phổi trung tâm) và đánh giá lại xét phẫu thuật triệt để sau 6 -12 tháng.
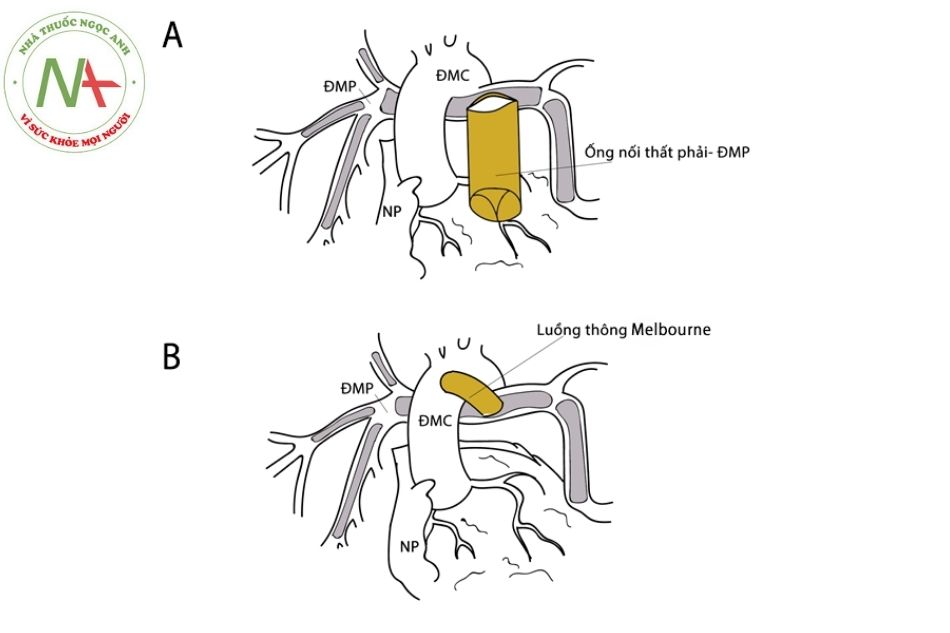
- Sửa chữa toàn bộ, bao gồm đóng lỗ thông liên thất và đặt ống nối có van (conduit) từ thất phải tới động mạch phổi mới;
- Kết nối động mạch phổi trung tâm với động mạch chủ trong trường hợp chưa thể sửa chữa toàn bộ để cung cấp lưu lượng máu nhiều hơn lên phổi giúp hệ thống mạch máu phổi phát triển. Chú thích: ĐMC: Động mạch chủ; ĐMP: Động mạch phổi; NP: Nhĩ phải; MAPCAs: Các động mạch bàng hệ chủ – phổi chính.
Các biến chứng sớm sau mổ bao gồm block nhĩ thất, hở van động mạch chủ (hiếm), tăng áp động mạch phổi trung tâm và suy thất phải sau mổ. Biến chứng muộn có thể là tái hẹp hệ thống mạch máu phổi ở các vị trí khâu nối hoặc trên các MAPCAs trước đây. Có thể hạn chế tình trạng tái hẹp này bằng cách sử dụng tối đa các miệng nối giữa mô sống với nhau để tạo điều kiện phát triển mạch máu, tránh dùng vật liệu nhân tạo trên toàn bộ chu vi mạch máu; và ưu tiên các miệng nối với MAPCAs ở đoạn xa (do cấu trúc của đoạn xa MAPCAs có thành mỏng giống động mạch phổi, còn đoạn gần lại có cấu trúc cơ giống động mạch hệ thống dễ gây tái hẹp sau mổ).
Theo dõi sau mổ động mạch chủ
Trẻ được sử dụng aspirin 3-5 mg/kg/ngày ít nhất trong năm đầu tiên sau mổ. Đánh giá định kỳ mỗi 3 tháng bằng siêu âm tim để đánh giá áp lực thất phải và độ thông thoáng của ống nối có van (conduit). Nếu có điều kiện nên làm xạ hình tưới máu phổi. Thông tim và chụp mạch có thể tiến hành ở thời điểm 1 năm sau mổ. Các chỗ hẹp tái phát có thể được sửa chữa bằng nong bóng, kể cả khi áp lực động mạch phổi trung tâm bình thường. Trường hợp tắc nghẽn nặng kèm theo tăng áp động mạch phổi trung tâm không thể giải quyết được bằng can thiệp qua da có thể cân nhắc xử trí bằng phẫu thuật.
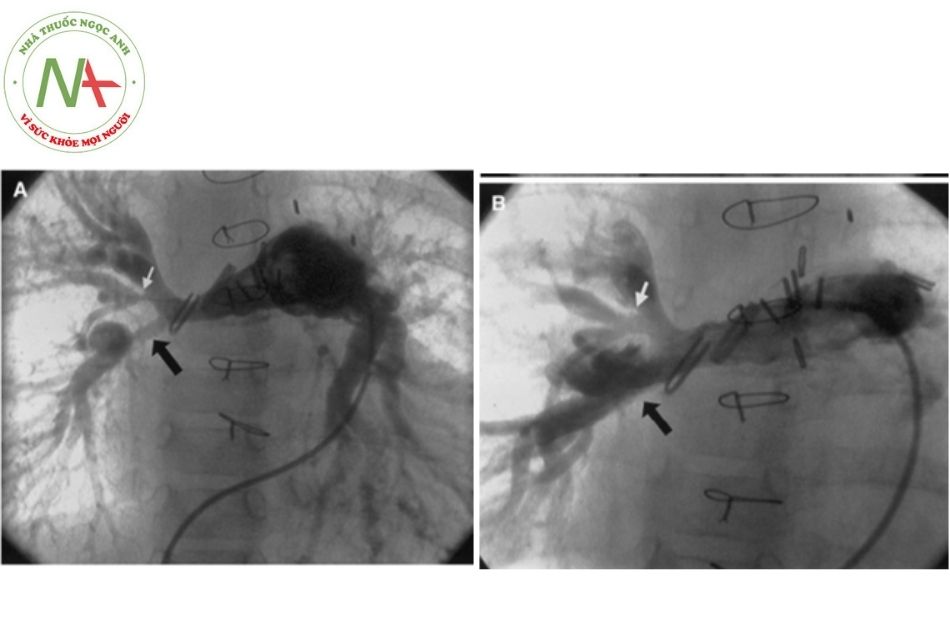
CÁC VẤN ĐỀ CẦN LƯU Ý KHÁC
Theo dõi
- Bệnh nhân PA-VSD nên được theo dõi định kỳ tại các trung tâm chuyên khoa bệnh tim bẩm sinh ở người lớn chuyên biệt ít nhất mỗi năm một lần.
- Bệnh nhân bị tăng áp lực động mạch phổi từng đoạn có thể được xem xét để điều trị hạ áp lực động mạch phổi.
- Cần chú ý đến các triệu chứng như khó thở, tím nặng lên, thay đổi tiếng thổi của luồng thông, suy tim hoặc rối loạn nhịp tim nhằm đánh giá sớm để can thiệp
Tập luyện thể dục thể thao
- Bệnh nhân có huyết động tốt nên được khuyến khích tập thể dục thường xuyên, chỉ tránh tập thể dục quá sức. Bệnh nhân có huyết động kém nên hạn chế vận động nặng. Nên tránh gắng sức quá mức, nhưng nên khuyến khích thường xuyên hoạt động thể chất cường độ thấp (đi bộ, bơi lội, thậm chí đi xe đạp
Vấn đề mang thai
- Nguy cơ trong thai kỳ ở bệnh nhân đã điều trị khỏi có huyết động tốt và không có tiền sử loạn nhịp tim là thấp. Nguy cơ tăng ở nhóm bệnh nhân có bão hoà oxy máu thấp, tăng áp lực động mạch phổi, rối loạn chức năng thất, có biểu hiện suy tim hay có rối loạn loạn nhịp
- Do mất đoạn 22q11 khá phổ biến trong bệnh lý này, bệnh nhân nên được sàng lọc di truyền trước khi mang thai.
Dự phòng viêm nội tâm mạc nhiễm khuẩn
- Chỉ được khuyến cáo cho những bệnh nhân có nguy cơ cao (bao gồm tất cả những bệnh nhân chưa được sửa chữa).
TEO TỊT VAN ĐỘNG MẠCH PHỔI KÈM LÀNH VÁCH LIÊN THẤT
ĐẠI CƯƠNG
Teo tịt van động mạch phổi kèm lành vách liên thất (pulmonary atresia with intact ventricular septum – PA-IVS) là một dị tật bẩm sinh hiếm gặp thuộc nhóm bất thường sự nối tiếp thất – đại động mạch, trong đó van động mạch phổi teo gây tắc nghẽn hoàn toàn dòng máu từ thất phải lên động mạch phổi cùng với sự nguyên vẹn của vách liên thất, khi đó dòng máu cung cấp cho tuần hoàn phổi thông qua sự tồn tại của ống động mạch dẫn máu từ động mạch chủ sang động mạch phổi. Teo tịt van động mạch phổi kèm lành vách liên thất được xếp vào nhóm bệnh tim bẩm sinh tuần hoàn phổi phụ thuộc ống.
Khác với teo tịt van động mạch phổi kèm thông liên thất (PA-VSD) chủ yếu gây ra các tổn thương thân và nhánh động mạch phổi (teo và thiểu sản), với cấu trúc buồng tim phải bình thường. Trong teo tịt van động mạch phổi kèm lành vách liên thất thì thân động mạch phổi và hai nhánh động mạch phổi có kích thước gần như bình thường, bệnh chủ yếu gây ảnh hưởng lên cấu trúc thất phải (hội chứng thiểu sản tim phải (hypoplastic right heart syndrome)), hở van ba lá mức độ nặng, rò động mạch vành vào thất phải (coronary artery – left ventricular fistula) và tuần hoàn vành phụ thuộc thất phải (right ventricle-dependent coronary circulation: RVDCC).
Tỷ lệ mắc teo tịt van động mạch phổi kèm lành vách liên thất chiếm 0,083/1000 trẻ đẻ sống, đứng thứ 3 trong nhóm các bệnh tim bẩm sinh có tím sau chuyển gốc đại động mạch và teo tịt van động mạch phổi kèm thông liên thất.
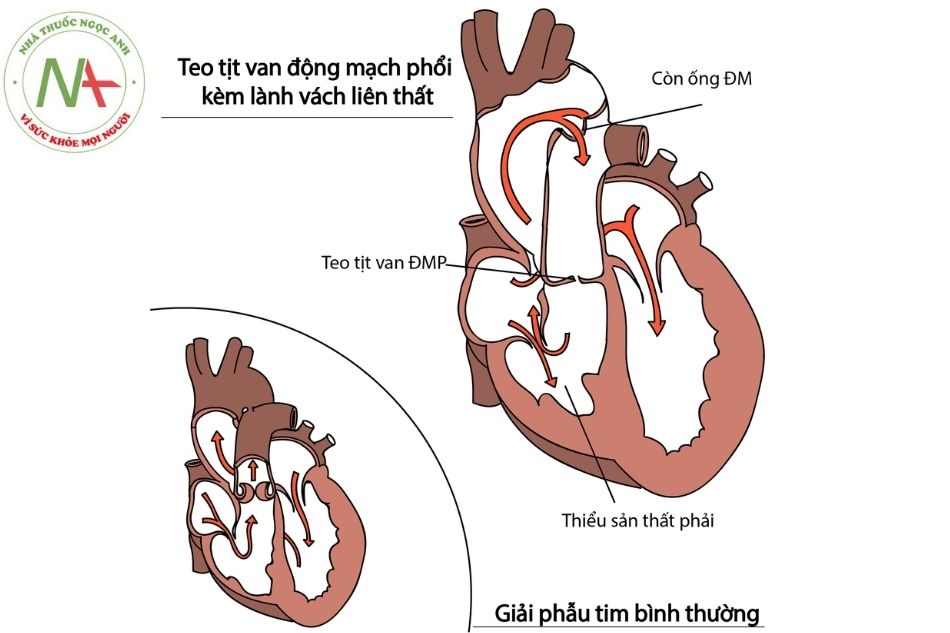
Chú thích: ĐM: Động mạch; ĐMP: Động mạch phổi.
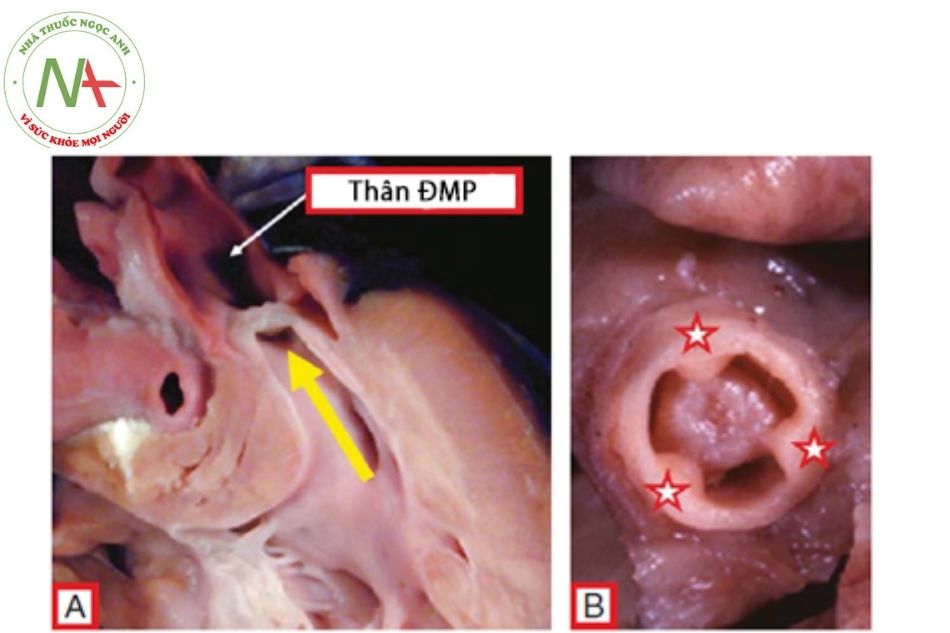
Chú thích: ĐMP: Động mạch phổi
HÌNH THÁI HỌC VÀ SINH LÝ BỆNH
Phôi thai học
Khác với cơ chế của teo tịt van động mạch phổi kèm thông liên thất (PA-VSD) khi các bất thường phát sinh ở giai đoạn sớm của phôi, teo tịt van động mạch phổi kèm lành vách liên thất (PA-IVS) được cho là xảy ra tương đối muộn trong thai kỳ, sau khi quá trình tạo vách liên thất hoàn thành.
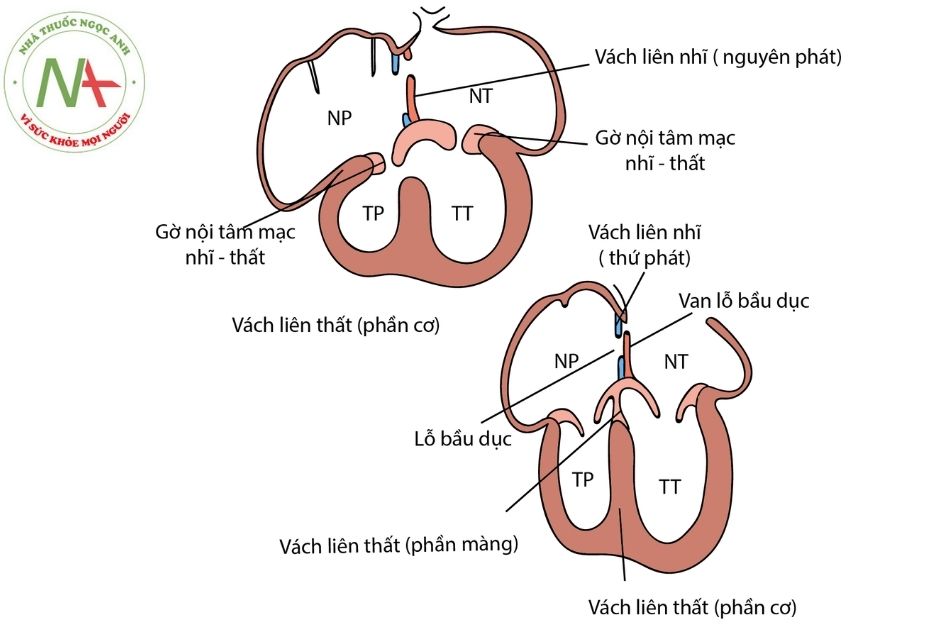
Chú thích: NP: Nhĩ phải; NT: Nhĩ trái; TP: Thất phải; TT: Thất trái
Các giả thuyết trước đây nhấn mạnh tầm quan trọng của teo tịt van động mạch phổi là nguyên nhân chính cho sự thiểu sản của thất phải. Lỗ rò động mạch vành vào thất phải được giải thích do sự quá tải áp suất của thất phải khi van động mạch phổi bị teo tịt, tuy nhiên thời gian gần đây nó được coi như là một cơ chế đơn độc khác.
Các giả thuyết hiện nay ủng hộ quan điểm rằng thiểu sản thất phải là do sự bất thường quá trình phát triển của chính thất phải. Điều này được củng cố thêm dựa trên các bằng chứng khi siêu âm thai: khi một hẹp động mạch phổi nhẹ có thể nhanh chóng tiến triển thành teo tịt van động mạch phổi rồi thiểu sản thất phải sau đó. Giải phẫu bệnh cũng chỉ ra có rối loạn ở các tế bào cơ tim và mao mạch tại chỗ trong PA-IVS. Dường như có mối quan hệ giữa rối loạn cơ tim, mao mạch và mức độ nghiêm trọng của PA-IVS: càng rối loạn thì PA-IVS càng nghiêm trọng.
Bệnh nhân teo tịt van động mạch phổi kèm lành vách liên thất sẽ được chia thành 2 nhóm chính phụ thuộc vào hình thái thất phải:
- Nhóm 1: teo tịt van động mạch phổi kèm lành vách liên thất với thất phải thiểu sản (van ba lá hở rất ít hoặc không hở, buồng tim phải thiểu sản, có tồn tại rò động mạch vành vào thất phải).
- Nhóm 2: teo tịt van động mạch phổi kèm lành vách liên thất với thất phải bình thường hoặc giãn (hở van ba lá mức độ nặng, không thiểu sản buồng tim phải, tuần hoàn vành bình thường).
Đối với trẻ bị teo tịt van động mạch phổi kèm lành vách liên thất, tim có thể không to nhiều. Trong trường hợp này, nhĩ phải giãn lớn chèn ép vào phổi gây thiểu sản phổi ở các mức độ khác nhau, thất phải nhỏ hơn so với bình thường. Có thể quan sát thấy các bất thường mạch vành từ bề mặt, nhưng không phải lúc nào cũng xuất hiện và không liên quan nhiều với các bất thường mạch vành dưới thượng tâm mạc. Đặc điểm của van động mạch phổi ở các bệnh nhân teo tịt van động mạch phổi kèm lành vách liên thất là các lá van, vòng van tương đối phát triển. Khi phần phễu phát triển bình thường thì không ảnh hưởng đến van động mạch phổi. Trong trường hợp có teo phễu thì van động mạch phổi có thể kém phát triển.
Ở các bệnh nhân teo tịt van động mạch phổi kèm lành vách liên thất, van ba lá thường có các tổn thương với các mức độ khác nhau như: loạn sản van; van ba lá bám thấp (Ebsteinoid displacement); bất thường vòng van từ dạng thiểu sản nặng đến giãn lớn vòng van. Về mặt chức năng có thể có hở van ba lá hoặc hẹp van ba lá. Các nghiên cứu cho thấy, kích thước vòng van ba lá và phần buồng nhận có tương quan chặt chẽ với sự phát triển của thất phải. Z-score vòng van ba lá là một trong các chỉ số quan trọng nhất đánh giá mức độ phát triển thất phải và có giá trị trong tiên lượng cũng như lựa chọn phương pháp phẫu thuật ở các bệnh nhân teo tịt van động mạch phổi kèm lành vách liên thất.
Đánh giá mức độ phì đại cũng như thiểu sản của thất phải trong teo tịt van động mạch phổi kèm lành vách liên thất giúp đưa ra lựa chọn phẫu thuật. Các dạng hình thái của tâm thất phải trong bệnh nhân teo tịt van động mạch phổi kèm lành vách liên thất bao gồm:
- Dạng Tripartite (thất phải gồm 3 thành phần): cả 3 thành phần của thất phải phát triển tốt, cơ phì đại ít. (Hình 14)
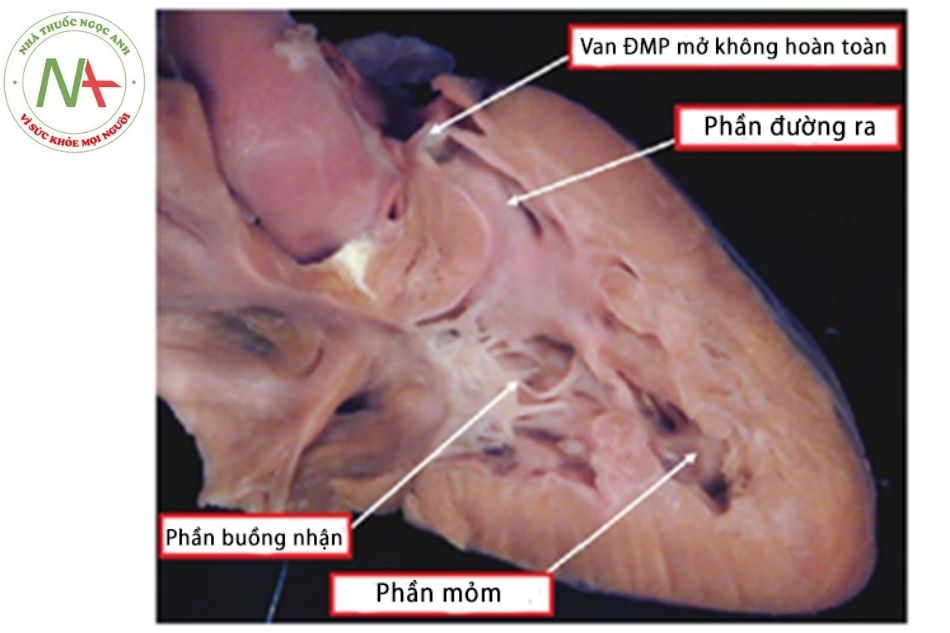
Chú thích: ĐMP: Động mạch phổi.
- Dạng Bipartite (thất phải gồm 2 thành phần): cơ phì đại nhiều ở phần mỏm, buồng thất phải thật sự tạo bởi phần buồng nhận và phần đường ra (hay còn gọi buồng tống máu). (Hình 15)
- Dạng Monopartite (thất phải chỉ gồm 1 thành phần): cơ phì đại nhiều ở phần mỏm và phần phễu, buồng thất phải chỉ còn phần buồng nhận nhưng cũng bị thiểu sản. (Hình 16)
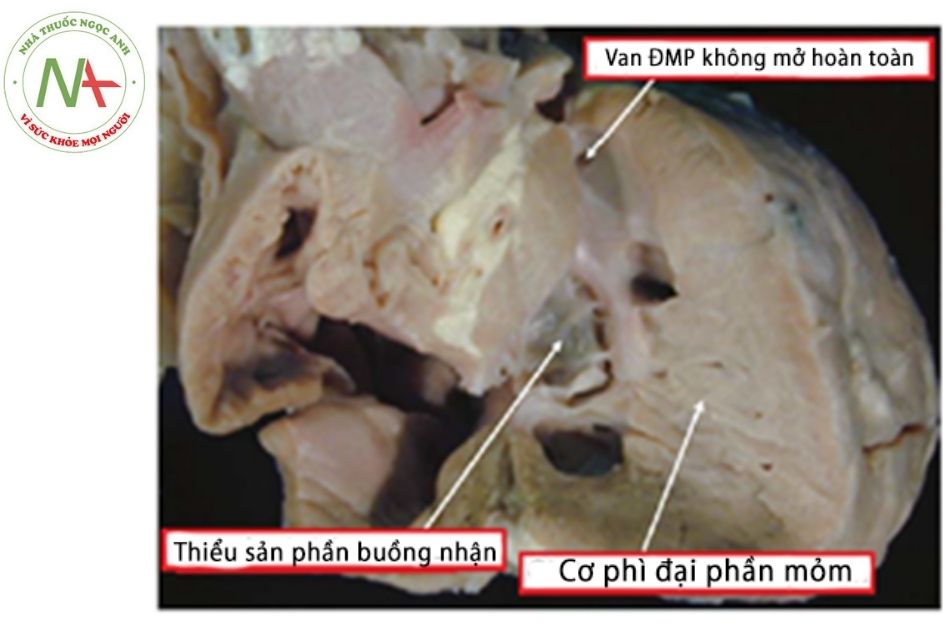
Chú thích: ĐMP: Động mạch phổi.
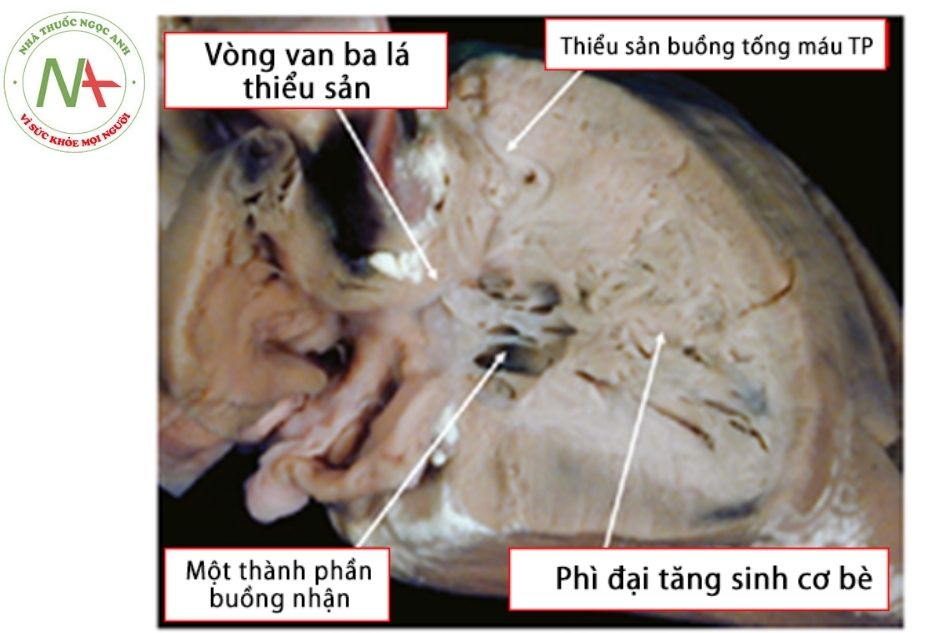
Chú thích: TP: Thất phải.
Phần phễu tương đối phát triển ở dạng van động mạch phổi dính mép (atretic valvar membrane) gặp 75% số ca. Các lá van của động mạch phổi thường dính nhau ở các mép van. Phần phễu thiểu sản nặng hoặc không có phần phễu khi cơ thất phải phì đại nhiều (muscularized atresia). Tuy nhiên, không có tương quan giữa mức độ phát triển của phễu với hệ thống mạch phổi. Việc đánh giá mức độ thiểu sản phần phễu có ý nghĩa quan trọng để đưa ra quyết định điều trị (một số quan điểm đưa ra phương pháp lựa chọn cách tiếp cận điều trị dựa trên hình thái phễu).
Hợp lưu hai nhánh động mạch phổi hay gặp trong teo tịt van động mạch phổi kèm lành vách liên thất, các nhánh động mạch phổi có kích thước bình thường hoặc thiểu sản nhẹ, ít xuất hiện dạng thiểu sản nặng. Thân động mạch phổi thường thiểu sản nhẹ hoặc có kích thước bình thường, dạng thiểu sản nặng hiếm gặp.
Trong teo tịt van động mạch phổi kèm lành vách liên thất, cấp máu cho phổi chủ yếu qua ống động mạch trái. Mức độ phát triển của các động mạch phổi thường không có liên quan với mức độ thiểu sản thất phải.
Tuần hoàn mạch vành phụ thuộc thất phải là tình trạng một vùng cơ tim được cấp máu hoàn toàn bởi buồng thất phải (bão hòa oxy thấp với áp lực cao trong thì tâm thu). Trong các trường hợp đó, các phương pháp điều trị làm giảm áp lực thất phải có thể gây nên các tổn thương thiếu máu cơ tim cục bộ, nhồi máu cơ tim hoặc tử vong (mức độ nặng nhẹ tùy thuộc vào vùng cơ tim bị phụ thuộc tưới máu vào thất phải). Mức độ thiểu sản thất phải và van ba lá càng nặng thì tỉ lệ gặp các bất thường động mạch vành càng cao và ngược lại. Các bất thường mạch vành là một phần cơ bản, rất quan trọng cần được xem xét khi chuẩn bị kế hoạch điều trị cho bệnh nhân teo tịt van động mạch phổi kèm lành vách liên thất.
Trong thời kỳ bào thai, tuần hoàn của bệnh teo tịt van động mạch phổi kèm lành vách liên thất phụ thuộc vào sự tồn tại của lỗ bầu dục và ống động mạch. Dòng máu từ nhĩ phải chủ yếu được hướng tới nhĩ trái, thất trái và động mạch chủ đi nuôi cơ thể.
Lượng máu đi qua eo động mạch chủ sẽ tăng hơn bình thường, do đó khác với tuần hoàn thai bình thường, kích thước eo động mạch chủ trong teo tịt van động mạch phổi kèm lành vách liên thất có thể bằng động mạch chủ xuống. Một lượng ít máu từ động mạch chủ qua ống động mạch vào phổi. Áp lực trong động mạch phổi ở thời kỳ bào thai của bệnh chịu ảnh hưởng lớn bởi kích thước của ống động mạch, nhưng cũng có thể ảnh hưởng một phần bởi sức cản mạch phổi.
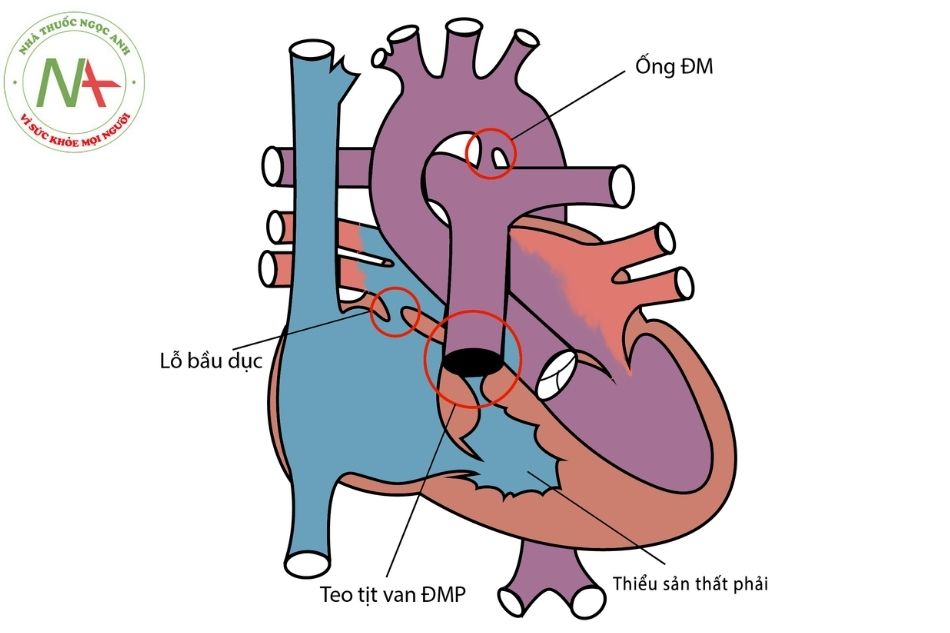
Chú thích: ĐM: Động mạch; ĐMP: Động mạch phổi.
Khi đứa trẻ được sinh ra, tiếng khóc chào đời làm phổi nở và bắt đầu hoạt động. Vì ống động mạch có xu hướng nhỏ dần rồi đóng lại hoàn toàn trong 7-10 ngày và lỗ bầu dục cũng nhỏ dần nên đối với bệnh nhân teo tịt van động mạch phổi kèm lành vách liên thất, máu từ thất phải không lên được phổi, trẻ sẽ tím và chết do suy hô hấp, suy tuần hoàn, toan chuyển hóa. Nếu không phát hiện sớm để điều trị giữ ống động mạch hoặc đặt stent ống động mạch thì khó có thể cứu được trẻ.
CHẨN ĐOÁN
Lâm sàng
- Triệu chứng lâm sàng phụ thuộc sự tồn tại của ống động mạch. Tím sau sinh với nhiều mức độ, tăng dần tùy thuộc luồng thông ống động mạch, quá trình tự đóng ống động mạch.
- Thường không khó thở cho đến khi có toan chuyển hóa và cung lượng tim giảm, hoặc bệnh nhân có thiểu sản mạch phổi.
- Nhịp tim thường nhanh.
- Tiếng T2 đơn độc.
- Thổi toàn tâm thu ở ổ van ba lá do hở van ba lá.
- Thổi tâm thu hoặc thổi liên tục do luồng thông qua ống động mạch.
- Gan thường không to trừ khi có hở van ba lá nặng hoặc còn lỗ bầu dục hạn chế.
- Giảm bão hòa oxy máu động mạch và không đáp ứng với liệu pháp oxy; toan chuyển hóa thường là dấu hiệu nặng báo hiệu tử vong nếu không được can thiệp sớm.
Cận lâm sàng
Xquang ngực
Trong teo tịt van động mạch phổi kèm lành vách liên thất thường thấy bóng tim to, chỉ số tim ngực lớn. Thấy hình ảnh phổi quá sáng vì ít máu lên phổi, trừ trường hợp còn ống động mạch lớn.
- Tim to, chỉ số tim/ngực lớn (bình thường: sơ sinh < 0,6; nhũ nhi < 0,55; trẻ lớn hơn < 0,5).
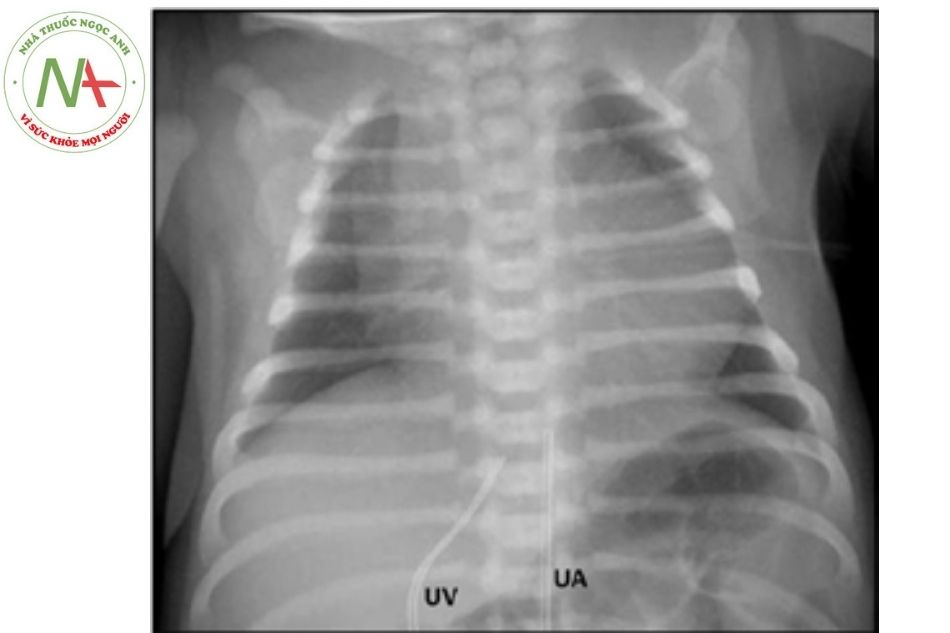
(Nguồn: Pulmonary Atresia with Intact Ventricular Septum – Dr. Pradeep Sreekumar)
Điện tim
Điện tâm đồ có thể cho thấy trục QRS bình thường, nhịp tim nhanh và hình ảnh dày nhĩ phải, dày thất phải. ST chênh xuống, có hoặc không có đảo ngược sóng T có thể được xem là hình ảnh thiếu máu cục bộ dưới nội tâm mạc do áp suất cao trong thất phải. (Hình 3.19)
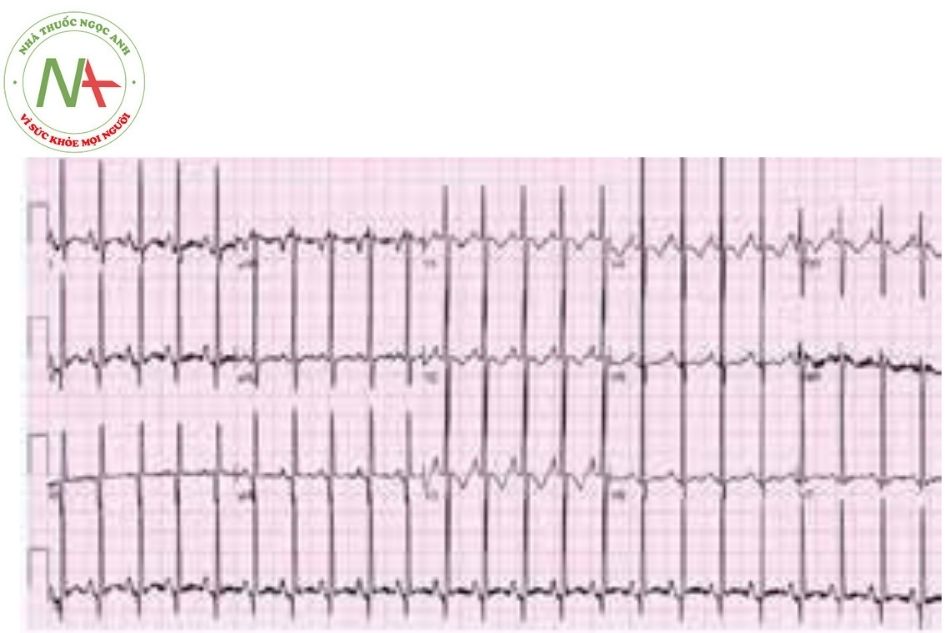
(Nguồn: Pulmonary Atresia with Intact Ventricular Septum – Dr. Pradeep Sreekumar)
Siêu âm tim
Cũng như trong hầu hết các bệnh lý tim bẩm sinh khác, siêu âm tim là công cụ rất hữu ích để chẩn đoán bệnh teo tịt van động mạch phổi kèm lành vách liên thất.
Siêu âm tim thai được thực hiện ở tuần thai từ 19 đến 21 có thể phát hiện được bệnh teo tịt van động mạch phổi kèm lành vách liên thất. Tại mặt cắt 4 buồng thấy thay đổi kích thước các buồng tim như giãn thất phải và nhĩ phải, cũng có thể thiểu sản thất phải; không thấy luồng thông (shunt) lên phổi, tăng tốc dòng chảy qua van 2 lá và động mạch chủ, thay đổi tín hiệu dòng chảy qua ống động mạch và vách liên thất nguyên vẹn.
Siêu âm tim đánh giá được hình thái 4 buồng tim. Trong teo tịt van động mạch phổi kèm lành vách liên thất không có máu qua van động mạch phổi, van động mạch phổi dày và dính các mép van, cũng có ít trường hợp thiểu sản các lá van kèm thiểu sản cả phần buồng thoát.
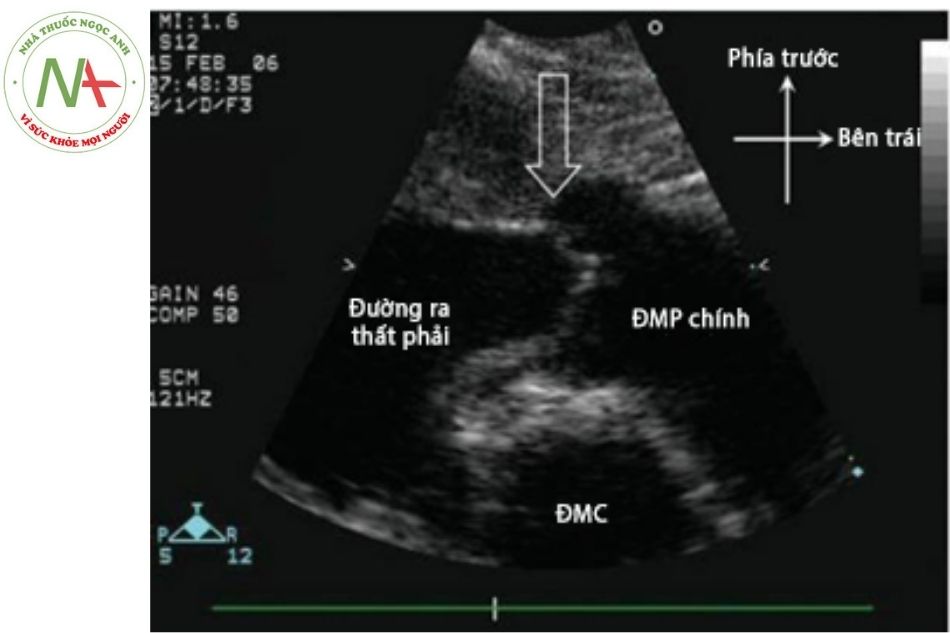
Chú thích: ĐMC: Động mạch chủ; ĐMP: Động mạch phổi.
Buồng thất phải giãn hoặc phì đại, thấy được các thành phần của thất phải như phần buồng nhận, phần buồng thoát và phần cơ bè thường hay thiểu sản.
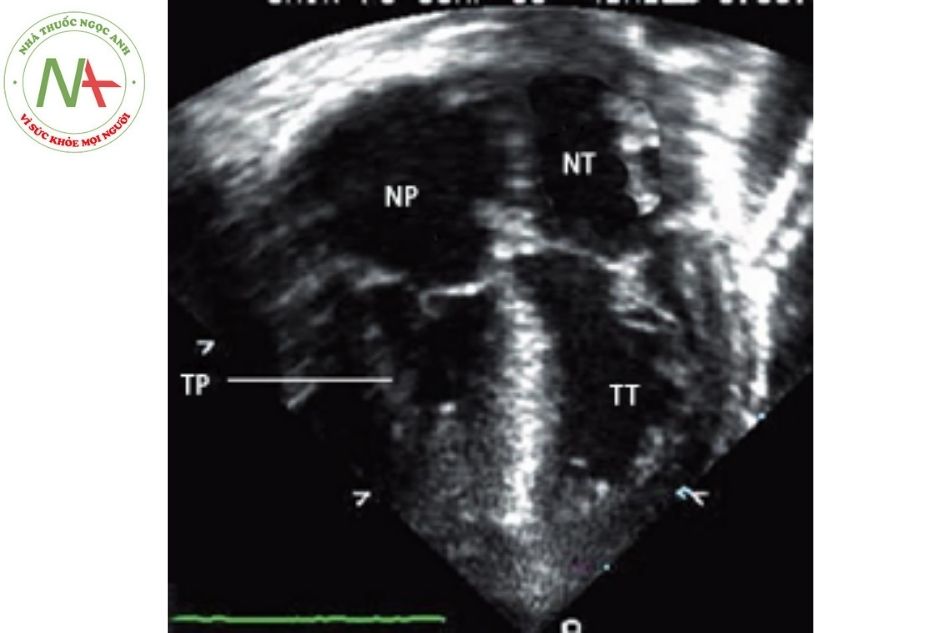
Chú thích: NP: Nhĩ phải; NT: Nhĩ trái; TT: Thất trái; TP: Thất phải.
Siêu âm còn đánh giá mức độ hở van ba lá trong teo tịt van động mạch phổi kèm lành vách liên thất, cũng như thiểu sản van ba lá. Mức độ thiểu sản van ba lá có ý nghĩa quyết định điều trị sau này.
Siêu âm còn thấy luồng thông (shunt) qua ống động mạch, thấy được tuần hoàn vành phụ thuộc thất phải và phần thân, nhánh phổi bình thường, cũng có thể thấy giãn nhẹ phần thân phổi.
Siêu âm Doppler tim có thể mang lại hầu hết các thông tin để chẩn đoán bệnh. Điểm hạn chế của siêu âm là đánh giá các cấu trúc mạch máu ngoài tim. Để đánh giá chính xác giải phẫu tuần hoàn phổi cần phối hợp với các phương pháp khác.
Thông tim
Trong bệnh lý teo tịt van động mạch phổi kèm lành vách liên thất, vai trò của thông tim chụp mạch chẩn đoán vẫn là không thể thay thế. Ngoài việc khảo sát các tổn thương giải phẫu trong và ngoài tim đã được xác nhận bởi siêu âm tim, các mục đích chính của thông tim chẩn đoán trước một bệnh nhân teo tịt van động mạch phổi kèm lành vách liên thất là:
- Thông tim phải nhằm đo các thông số huyết động như áp lực, lấy khí máu tĩnh mạch chủ trên, tĩnh mạch chủ dưới để tính toán các thông số lưu lượng và sức cản phổi nếu có chỉ định. Đồng thời tiến hành chụp tĩnh mạch chủ trên, tĩnh mạch chủ dưới, buồng thất phải để đánh giá kích thước buồng thất phải, mức độ teo của van động mạch phổi.
- Thông tim trái để đo áp lực buồng tim trái, động mạch chủ và tiến hành chụp buồng thất trái, gốc động mạch chủ để thấy động mạch vành (đặc biệt phát hiện tuần hoàn vành phụ thuộc thất phải), động mạch chủ ngang trên eo, động mạch chủ xuống để thấy ống động mạch, tuần hoàn bàng hệ. Có thể luồn qua ống động mạch để đánh giá động mạch phổi phải và trái.
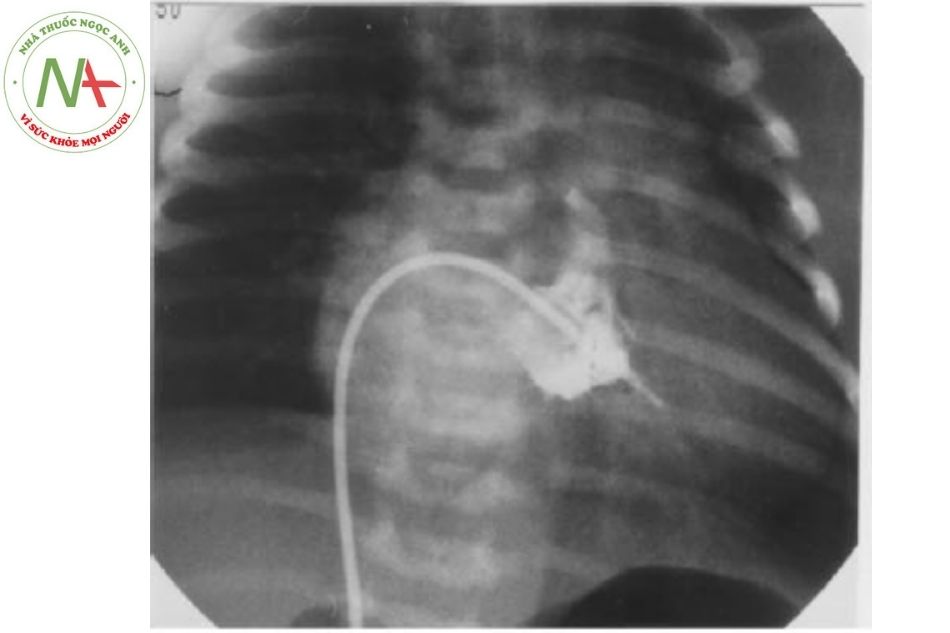
Chụp cắt lớp vi tính đa dãy
Dựng lại hình ảnh giải phẫu của tim và các mạch máu tương đối chính xác khi so sánh với thông tim chụp mạch.
Chụp cộng hưởng từ hạt nhân tim (Magnetic Resonance Imaging – MRI)
Cũng giống như MSCT, MRI tim giúp dựng lại hình ảnh giải phẫu của tim và các mạch máu.
MRI tim còn có thể phát hiện hợp lưu động mạch phổi trong trường hợp nó quá nhỏ, không có hoặc lưu lượng máu quá thấp không phát hiện được bằng các phương pháp khác ngay cả thông tim chụp mạch. Đồng thời cũng giúp khảo sát các tuần hoàn bàng hệ và phạm vi cấp máu của chúng cho phổi.
Chẩn đoán xác định
Chẩn đoán PA-IVS dựa vào các dấu hiệu lâm sàng và cận lâm sàng sau:
Lâm sàng: bệnh cảnh của nhóm bệnh tim bẩm sinh tuần hoàn phổi phụ thuộc ống động mạch:
- Tím trung ương xuất hiện ngay sau sinh, không có tím khác biệt.
- Thông thường không có suy tim.
- Trong trường hợp còn lỗ bầu dục hạn chế: bệnh nhân có thể biểu hiện sốc tim, do đó cần phát hiện để có chỉ định phá vách liên nhĩ cấp cứu.
- T2 đơn độc.
- Thổi tâm thu ổ van ba lá do hở van ba lá, thổi liên tục ở khoang liên sườn 2 đường giữa đòn trái do ống động mạch.
Cận lâm sàng:
- Xquang ngực thẳng: phổi sáng, giảm tuần hoàn phổi, cung động mạch phổi lõm.
- Siêu âm tim: giúp chẩn đoán xác định, đồng thời đánh giá toàn diện đầy đủ các tổn thương:
- Van động mạch phổi: dính mép van, dày lá van, van dạng màng ngăn, không có dòng máu qua trên Doppler màu.
- Ống động mạch: vị trí, kích thước ống.
- Buồng tim phải: thành phần, kích thước, mức độ thiểu sản.
- Mức độ hở van ba lá.
- Tuần hoàn vành phụ thuộc thất phải, rò động mạch vành có hay không.
- Các tổn thương kèm theo khác.
ĐIỀU TRỊ
Đánh giá bệnh nhân, điều trị nội khoa và can thiệp ban đầu
Tất cả bệnh nhân PA-IVS cần được đánh giá đầy đủ các vấn đề trước khi quyết định điều trị:
- Kích thước ống động mạch: bệnh nhân PA-IVS thuộc nhóm bệnh tim bẩm sinh có tuần hoàn phổi phụ thuộc ống động mạch nên cần đánh giá kích thước cũng như lưu lượng dòng máu qua ống. Cần truyền PGE1 để duy trì ống động mạch, với bệnh nhân ống động mạch đã đóng cần dùng PGE1 liều khởi đầu cao để mở ống. Trong một số trường hợp có thể đặt stent ống động mạch (tuy nhiên bệnh nhân có nguy cơ hẹp nhánh động mạch phổi trái sau này. Duy trì ống động mạch đảm bảo lượng máu lên phổi cân bằng, với Qp/Qs ~ 1/1 và SpO2 xung quanh 80%.
- Đánh giá lỗ thông liên nhĩ và còn lỗ bầu dục: bệnh nhân PA-IVS cần sự tồn tại của kết nối hai tâm nhĩ (qua lỗ bầu dục hoặc lỗ thông liên nhĩ) đủ rộng để đảm bảo tiền gánh thất trái. Trong trường hợp kết nối nhĩ không đủ lớn bệnh nhân có thể xuất hiện tình trạng shock tim. Khi đó bệnh nhân cần được xử trí:
- Hồi sức ban đầu ổn định tình trạng bệnh: đảm bảo huyết áp (truyền dịch đẳng trương nhanh, sử dụng thuốc vận mạch, đảm bảo thăng bằng kiềm toan, đặt nội khí quản đảm bảo thông khí, duy trì Hemoglobin từ 130-140 g/l).
- Song song với việc hồi sức ban đầu bệnh nhân cần được phá vách liên nhĩ cấp cứu qua can thiệp để đảm bảo tiền gánh cho thất trái.
- Đánh giá đầy đủ hình thái, thành phần, kích thước buồng thất phải và kích thước vòng van ba lá qua siêu âm tim:
- Hình thái, kích thước thất phải có vai trò quan trọng trong quyết định phẫu thuật: khi thất phải đủ lớn, đầy đủ thành phần có thể phẫu thuật sửa hai thất. Khi thất phải thành phần không đầy đủ, kích thước bé cần phẫu thuật sửa chữa một thất (phẫu thuật Fontan), hoặc một – một phần hai thất (phẫu thuật Rastelli và Glenn).
- Mức độ thiểu sản vòng van hai lá có tương quan với tần suất xuất hiện rò động mạch vành vào thất phải, khi vòng van ba lá thiểu sản càng nặng bệnh nhân càng có nguy cơ cao của rò động mạch vành vào thất phải. Đây là một tổn thương yêu cầu phải điều trị bằng ghép tim trong bệnh nhân PA-VSD.
- Một số bệnh nhân nặng có thể cần sử dụng oxy hóa màng ngoài cơ thể (ECMO) trong lúc chờ đợi phẫu thuật hoặc ghép tim.
- Đánh giá có hay không sự tồn tại của tuần hoàn vành phụ thuộc thất phải: đây là tổn thương cần đánh giá trên thông tim. Các bệnh nhân có tuần hoàn vành phụ thuộc thất phải cũng cần yêu cầu ghép tim.
- Có thể mở van động mạch phổi bằng bóng thông qua can thiệp qua da trong trường hợp van động mạch phổi dạng dính mép van và cấu trúc thân và hai nhánh động mạch phổi hoàn toàn bình thường. Lưu ý khi mở van động mạch phổi có thể gây hở phổi nặng kèm theo còn ống động mạch lớn sẽ gây luồng thông vòng (dòng màu từ động mạch chủ qua ống động mạch sang động mạch phổi, xuống thất phải qua hở van động mạch phổi rồi sang nhĩ trái gây rối loạn huyết động nghiêm trọng).
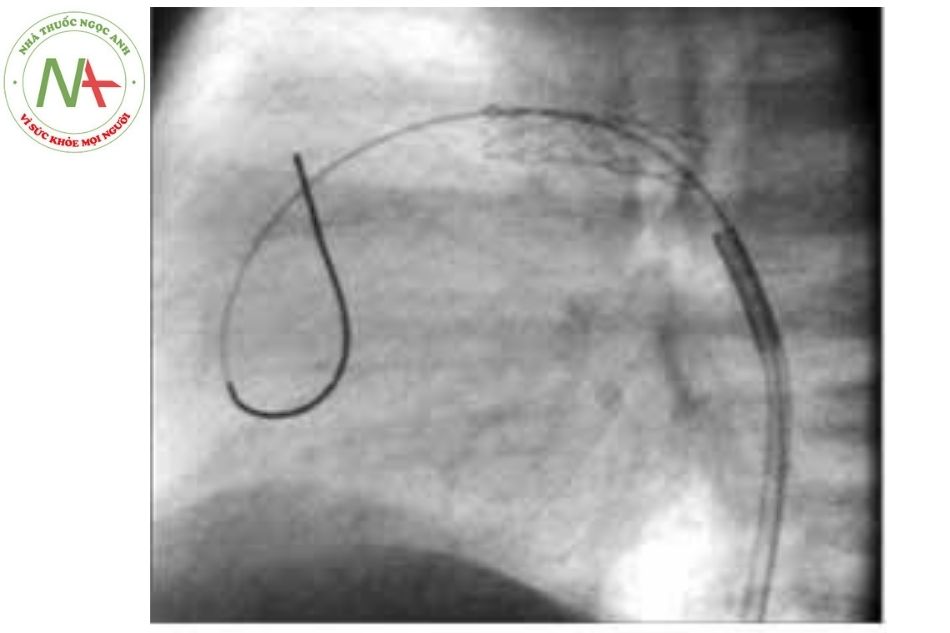
Phẫu thuật
Với bệnh nhân PA-IVS có 2 yếu tố chính quyết định lựa chọn phương pháp phẫu thuật đó là hình thái kích thước thất phải (đánh giá mức độ thiểu sản thất phải) và tuần hoàn vành (có hay không tuần hoàn vành phụ thuộc thất phải).
Với bệnh nhân có tuần hoàn vành phụ thuộc thất phải thì vấn đề phẫu thuật ghép tim cần được đặt ra.

Chú thích: VLT: Vách liên thất; ĐMP: Động mạch phổi; ĐMC: Động mạch chủ; ĐMV: Động mạch vành, P: phải; RVDCC (right ventricle-dependent coronary circulation): Tuần hoàn vành phụ thuộc thất phải); ÔĐM: Ống động mạch.
Phẫu thuật tuần hoàn một thất
Phẫu thuật tuần hoàn một thất được chỉ định cho nhóm bệnh nhân có mức độ thiểu sản thất phải nặng nhưng không có tuần hoàn vành phụ thuộc thất phải. Bệnh nhân trải qua 3 thì phẫu thuật
Xem thêm: Các bệnh tim bẩm sinh phức tạp có sinh lý tuần hoàn tim một thất.
- Luồng thông Blalock–Taussig hoặc luồng thông trung tâm: Làm tăng lượng máu lên phổi. Ngoài ra có một số biện pháp cung cấp máu cho tuần hoàn phổi như đặt stent ống động mạch.
- Luồng thông Glenn: luồng thông nối tĩnh mạch chủ trên với động mạch phổi phải
- Luồng thông Fontan: luồng thông nối tĩnh mạch chủ dưới với động mạch phổi phải.
Phẫu thuật hai thất
Phẫu thuật hai thất được chỉ định cho nhóm bệnh nhân không có tuần hoàn vành phụ thuộc thất phải và mức độ thiểu sản thất phải cũng như thiểu sản van ba lá không quá nặng.
Đầu tiên bệnh nhân được nong van động mạch phổi qua da đảm bảo cung cấp lượng máu lên phổi giúp phát triển mạch máu phổi cũng như giảm áp buồng thất phải. Thông thường, nong van động mạch phổi được thực hiện bằng bóng nong có đường kính tương tự với đường kính động mạch phổi của bệnh nhân. Sau nong van, bệnh nhân sẽ được đặt stent tại vị trí nong để tránh hẹp đường ra thất phải do phì đại cơ phễu.
Tiếp theo bệnh nhân sẽ được phẫu thuật thay van động mạch phổi khoảng lúc 1 tuổi. Tùy vào hình giải phẫu van, thân và hai nhánh động mạch phổi mà có các biện pháp phẫu thuật phù hợp.
Phẫu thuật một – một phần hai thất
Trong trường hợp hình thái và chức năng thất phải không đủ để đảm bảo phẫu thuật hai thất, lựa chọn phẫu thuật một – một phần hai (1 ½ ) thất để tránh suy thất phải sau phẫu thuật.
Trong phẫu thuật một – một phần hai thất: máu từ tĩnh mạch chủ dưới đi về thất phải lên động mạch phổi, máu từ tĩnh mạch chủ trên về động mạch phổi phải thông qua luồng thông Glenn, lỗ thông liên nhĩ có thể đóng lại ngay tại thời điểm phẫu thuật hoặc đóng qua da sau này.
CÁC VẤN ĐỀ CẦN LƯU Ý KHÁC
Theo dõi
Việc theo dõi phải kéo dài suốt đời. Đối với những người được phẫu thuật hai thất và mức độ rối loạn huyết động ở mức tối thiểu, nên khám bác sĩ tim mạch từ 1 đến 3 năm một lần. Khi rối loạn huyết động còn đáng kể, nên theo dõi hàng năm bởi bác sĩ tim mạch chuyên về bệnh tim bẩm sinh người lớn. Tương tự, những bệnh nhân có tuần hoàn một một phần hai thất hoặc một thất phải được theo dõi chăm sóc thường xuyên. Đối với bệnh nhân có luồng thông chủ – phổi hoặc phẫu thuật Fontan, cần cân nhắc sử dụng thuốc chống đông đầy đủ, đặc biệt nếu nghi ngờ có bất thường động mạch vành.
Tập luyện thể dục thể thao
Các giới hạn tập luyện cần được xem xét trên cơ sở từng cá thể tùy thuộc vào lộ trình phẫu thuật được thực hiện, loại phẫu thuật được thực hiện, tình trạng huyết động cơ sở và tình trạng tổng thể của bệnh nhân.
Vấn đề mang thai
Tất cả các bệnh nhân nên được theo dõi trước khi mang thai bởi bác sĩ tim mạch chuyên về bệnh tim bẩm sinh ở người lớn và bác sĩ sản khoa có kinh nghiệm về thai kỳ có nguy cơ cao trong thai kỳ và chu sinh. Trường hợp quyết định mang thai, bệnh nhân cần được tư vấn và giải thích các nguy cơ cho mẹ và thai nhi.
Tuần hoàn hai thất: Các trường hợp mang thai thành công đã được báo cáo ở phụ nữ bị teo tịt van động mạch phổi kèm lành vách liên thất sau khi phẫu thuật hai thất. Không có sự gia tăng tỷ lệ vô sinh hoặc rối loạn kinh nguyệt.
Tuần hoàn hai thất với hẹp hay hở van động mạch phổi tồn dư: Tăng lưu lượng huyết động trong thai kỳ có thể dẫn đến suy tim phải, rối loạn nhịp nhĩ, hoặc hở van ba lá. Nong van ĐMP bằng bóng có thể được thực hiện trong thời kỳ mang thai (tốt nhất là sau giai đoạn hình thành cơ quan), tuy nhiên nên điều trị trước khi mang thai.
Tuần hoàn một thất: Tăng nguy cơ tắc nghẽn tĩnh mạch hệ thống, suy giảm chức năng thất, loạn nhịp nhĩ, huyết khối và thuyên tắc mạch nếu như có thông thương tầng nhĩ. Tuy nhiên, việc mang thai thành công là có thể trong trường hợp theo dõi sát và có kế hoạch của bác sĩ sản khoa và tim mạch. Nếu phải dùng thuốc chống đông, sẽ có thêm nguy cơ cho thai nhi. Nguy cơ biến chứng tim mạch ở mẹ, sinh non và tử vong của thai nhi, đặc biệt khi bão hoà oxy khi nghỉ ngơi ban đầu của mẹ thấp hơn 85%.
Dự phòng viêm nội tâm mạc nhiễm khuẩn
Tất cả bệnh nhân nên được khuyến cáo về tầm quan trọng của việc vệ sinh răng miệng trong việc giảm nguy cơ viêm nội tâm mạc.
Dự phòng bằng kháng sinh còn tranh luận: hiện tại không còn được khuyến cáo thường quy trong các khuyến cáo.
TÀI LIỆU THAM KHẢO
1.Hugh Allen DD, Robert Shaddy, Timothy Feltes. Moss and Adams’ Heart Disease in infants, children, and adolescents: Including the fetus and young adult. 8th ed: Lippincott Williams & Wilkins;
2. Ritu Asija MM, Lisa Wise-Faberowski, Laura Presnell, Robert H., Anderson DBM, Frank L. Hanley. Pediatric Cardiology. In: Wernovsky G, editor. Anderson’s Pediatric Cardiology: Elsevier;
3. Đỗ Kính. Phôi thai học – Thực nghiệm và ứng dụng lâm sàng. Hà Nội: Nhà xuất bản Y học;
4. W Sadler. Langman’s Medical Embryology, 14th Ed 2018, 13, 190
5. Hanley FL. MAPCAs, bronchials, monkeys, and men. European journal of cardio-thoracic surgery : official journal of the European Association for Cardio-thoracic Surgery. 2006;29(5):643-.
6. Simcha Yagel NS, Ulrich Gembruch. Fetal Cardiology: CRC press;
7. Berning RA, Silverman NH, Villegas M, Sahn DJ, Martin GR, Rice MJ. Reversed shunting across the ductus ar- teriosus or atrial septum in utero heralds severe congenital heart disease. J Am Coll Cardiol. 1996;27(2):481-6.
8. Trương Thanh Hương, Đỗ Thu Trang, Phạm Thu Thủy, Nguyễn Thị Phẫu thuật sửa chữa toàn bộ một thì dị tật teo tịt động mạch phổi kèm thông liên thất ở bệnh nhân trưởng thành. Tạp chí tim mạch học Việt Nam. 2014.
9. Aggarwal N, Sreedhar R, Gadhinglajkar SV, Dharan BS, Babu S, Pillai MN, et al. Intraoperative Diagnosis of Major Aortopulmonary Collateral Arteries by Transesophageal Echocardiography. Journal of Cardiothoracic and Vascular Anesthesia. 2018;32(4):1794-9.
10. Mackie AS, Gauvreau K, Perry SB, del Nido PJ, Geva Echocardiographic predictors of aortopulmonary collaterals in infants with tetralogy of fallot and pulmonary atresia. Journal of the American College of Cardi- ology. 2003;41(5):852.
11. Fukui D, Kai H, Takeuchi T, Gondo T, Oba T, Mawatari K, et al. Longest survivor of pulmonary atresia with ventricular septal defect: well-developed major aortopulmonary collateral arteries demonstrated by multide- tector computed tomography. Circulation. 2011;124(19):2155-7.