Bệnh tim mạch
Teo tịt van ba lá bẩm sinh: Biểu hiện lâm sàng, chẩn đoán, điều trị
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Nguồn: Sách Lâm sàng tim bẩm sinh
Chủ biên
PGS.TS.BS. Nguyễn Lân Hiếu
Tham gia biên soạn
Nguyễn Lân Hiếu
Nguyễn Thị Minh Lý
Lê Minh Ngọc
Lê Nhật Cường
Dương Công Nguyên
Nhà thuốc Ngọc Anh xin gửi đến quý bạn đọc chủ đề các bệnh tim mạch bẩm sinh thường gặp trong lâm sàng tim bẩm sinh: Teo tịt van ba lá.
ĐẠI CƯƠNG
Vài nét về thuật ngữ
Theo từ điển y học Merriam-Webster, thuật ngữ atresia được sử dụng lần đầu trong tiếng Anh vào năm 1790, có nguồn gốc từ “atresis” là một từ Latin gốc Hy Lạp, được tạo thành bởi tiền tố phủ định a- (nghĩa là “không có”) và hậu tố -tresis (nghĩa là lỗ thủng, xuyên qua). Thuật ngữ này được dùng để mô tả tình trạng đóng hoặc biến mất của các con đường tự nhiên trong cơ thể. Ví dụ trong tim bẩm sinh: aortic atresia, pulmonic atresia, tricuspid atresia được dùng để chỉ tình trạng không có máu lưu thông qua các van động mạch chủ, van động mạch phổi và van ba lá tương ứng.
Theo từ điển Tiếng Việt của Giáo sư Hoàng Phê và Viện ngôn ngữ học, từ “teo” có nghĩa là: thu nhỏ lại, bé dần lại; trong khi đó từ “tịt” với nghĩa chỉ trạng thái có thể có các nghĩa: 1) ở trạng thái bị bịt kín hoàn toàn, không có lỗ hở thông ra bên ngoài (lấp tịt lỗ hang); 2) hoạt động bị chặn lại (pháo tịt ngòi). Các nghĩa này có một sắc thái chung, đó là thể hiện ý nghĩa phủ định, không thể thoát ra.
Về định nghĩa, tricuspid atresia là tình trạng vắng mặt hoàn toàn van ba lá kèm theo không có thông thương trực tiếp giữa nhĩ phải và thất phải. Thuật ngữ tricuspid atresia được dịch ra tiếng Việt theo nhiều cách. Các nhà lâm sàng nhi khoa miền Bắc dịch là “teo van ba lá”, Đỗ Kính (phôi thai học) dịch là “tịt van ba lá”. Trong miền Nam, Phạm Nguyễn Vinh dịch sát nghĩa gốc hơn là “không lỗ van ba lá”. Theo quan điểm của chúng tôi, cách dịch “teo van ba lá” là không phù hợp vì có thể làm người nghe (kể cả các bác sĩ tim mạch không chuyên về tim bẩm sinh) dễ hiểu nhầm thành tình trạng van ba lá giảm kích thước. Cách dịch “không lỗ van ba lá” có ưu điểm là sát với nghĩa trong từ gốc Latin và nói lên được tình trạng không có máu chảy qua van ba lá, tuy nhiên không ngắn gọn lắm.
Có lẽ cách dịch tricuspid atresia thành “tịt van ba lá” của giáo sư Đỗ Kính là hàm súc nhất. Mặc dù vậy, trong khi chờ một sự thống nhất về mặt thuật ngữ trên toàn quốc, và để độc giả là bác sĩ lâm sàng đỡ lạ lẫm, trong tài liệu này, chúng tôi vẫn tạm dịch tricuspid atresia là “teo tịt van ba lá”.
Định nghĩa
Teo tịt van ba lá (tricuspid atresia) được định nghĩa là tình trạng vắng mặt hoàn toàn van ba lá kèm theo không có thông thương trực tiếp giữa nhĩ phải và thất phải, dẫn tới thiểu sản một hoặc nhiều thành phần của thất phải.
Hậu quả của teo tịt van ba lá là dòng máu đi từ tĩnh mạch hệ thống đến tuần hoàn phổi sẽ phải đi qua thông thương giữa nhĩ phải với tim trái (luồng thông phải -> trái qua lỗ thông liên nhĩ hoặc lỗ bầu dục) và thông thương giữa tuần hoàn chủ với động mạch phổi (thường qua thông liên thất hoặc qua ống động mạch trong trường hợp teo tịt van động mạch phổi).
Dịch tễ và di truyền học
Dị tật teo tịt van ba lá được mô tả lần đầu bởi Kreyszig vào năm 1817. Đây là dị tật tim không phổ biến, với tỷ lệ ít hơn 3% tổng số dị tật tim bẩm sinh (0,056 trên 1000 trẻ đẻ sống) trong báo cáo của Chương trình Tim Trẻ em vùng New England trong thời gian từ 1968 đến 1974.
Cho đến nay, nguyên nhân cũng như các dấu ấn di truyền đặc hiệu của dị tật vẫn chưa được xác định.
HÌNH THÁI HỌC VÀ SINH LÝ BỆNH
Phôi thai học
Teo tịt van ba lá có cơ chế bệnh sinh phức tạp và chưa được hiểu rõ hoàn toàn. Cuối tuần thứ tư của thời kỳ phôi thai, ống tim nguyên thủy vẫn giữ hình dạng thẳng nhưng đã xuất hiện những rãnh (ở mặt ngoài) và nếp (ở mặt trong) chia ống tim nguyên thủy thành 5 đoạn với thứ tự đầu – đuôi: hành động mạch chủ -> hành tim -> tâm thất nguyên thủy -> tâm nhĩ nguyên thủy -> xoang tĩnh mạch.
Ống tim nguyên thủy tiếp tục phát triển, dài ra và gấp khúc tại các rãnh, đồng thời bên trong sẽ tạo ra các vách ngăn để chia tim thành các buồng (Hình 1).
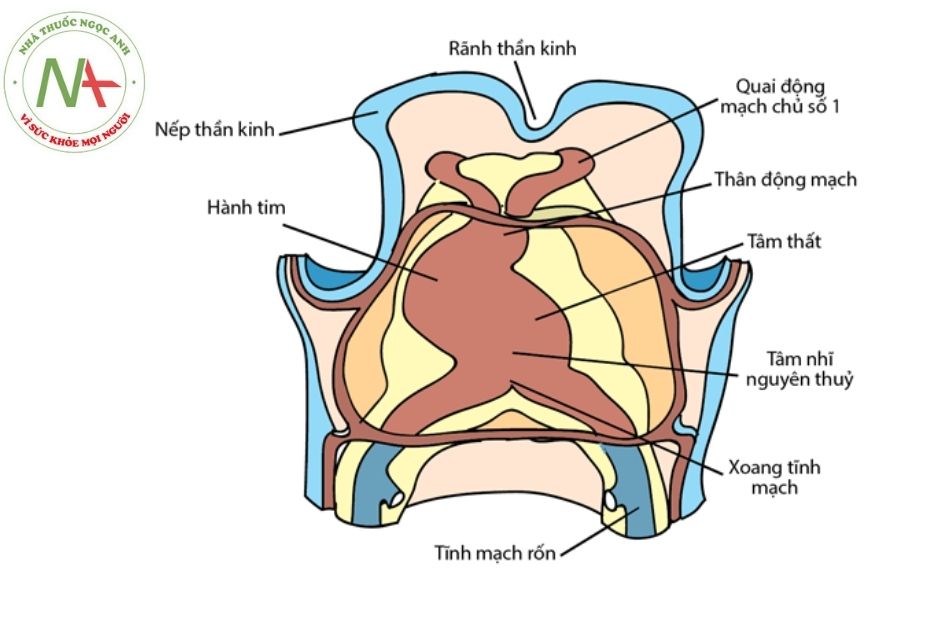
Ban đầu kết nối nhĩ thất sẽ từ tâm nhĩ nguyên thủy đến thất trái qua một cấu trúc gọi là kênh nhĩ thất (atrioventricular canal), và không có kết nối trực tiếp từ nhĩ phải đến thất phải. Sau đó, kênh nhĩ thất tăng kích thước, dịch chuyển dần sang phải để đổ vào cả thất trái và thất phải.
Cuối tuần thứ 4, có hai gờ trung mô gọi là gờ nội tâm mạc nhĩ – thất (endocardial cushion) xuất hiện ở mép bụng (dưới) (inferior endocardial cushion) và lưng (trên) (superior endocardial cushion) của ống nhĩ thất. Hai gờ này phát triển lồi vào lòng ống, tiến
về phía đối diện để sát nhập vào nhau giúp ngăn chia ống nhĩ – thất chung thành ống nhĩ – thất phải và trái. Lỗ nhĩ thất phải này về sau sẽ phát triển thành lỗ van ba lá. Và gờ nội tâm mạc bao quanh các lỗ nhĩ thất (vốn có nguồn gốc trung mô) sẽ được dàn mỏng (nhờ áp lực máu chảy từ nhĩ xuống thất) và xơ hóa để tạo ra các lá van nhĩ – thất (Hình 2).
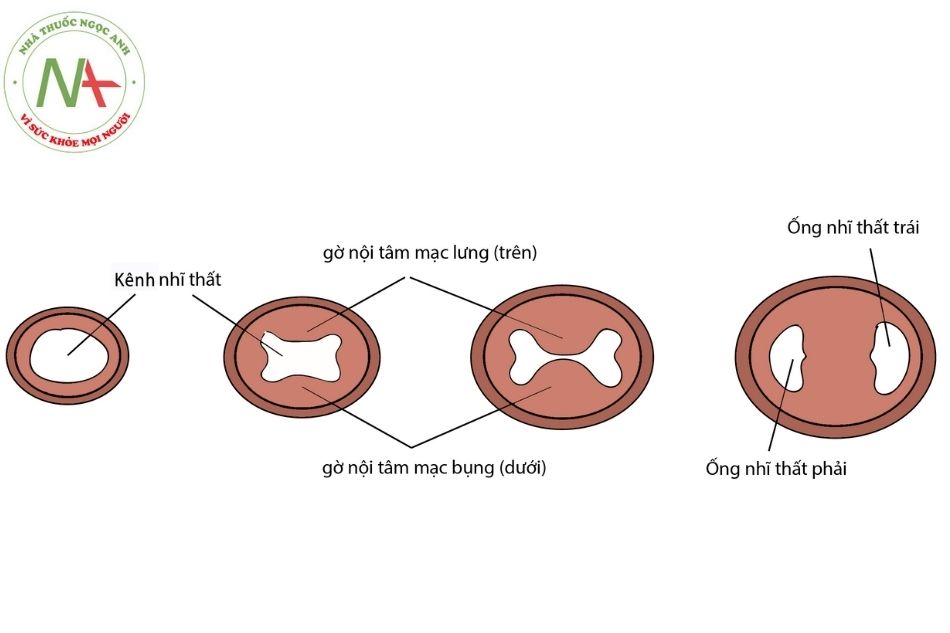
Những bất thường làm kênh nhĩ thất không dịch chuyển sang phải, hoặc bất thường trong hình thành và phát triển của các gờ nội tâm mạc nhĩ – thất có thể dẫn tới teo tịt van ba lá. Một nguyên nhân ít gặp hơn của teo tịt van ba lá là khi các lá của van ba lá (van nhĩ – thất phải) được tạo thành bình thường nhưng dính lại hoàn toàn với nhau ở giai đoạn muộn của quá trình thai nghén, nguyên nhân chưa rõ. Nếu việc dính các lá van không hoàn toàn sẽ gây ra hẹp van ba lá (tricuspid stenosis).
Giải phẫu bệnh và phân loại
Trong teo tịt van ba lá, gần như không còn vết tích của bộ máy van tại vị trí bình thường của van ba lá. Ngăn cách giữa nhĩ phải và thất phải là một vách ngăn. Vách ngăn này có thể cấu tạo bằng cơ hoặc màng, đôi khi là một phần cơ và một phần màng. Một số ít trường hợp có thể gặp cấu trúc giống như van nhưng không có thông thương qua van mà chỉ có một chỗ lõm tương ứng với vị trí lỗ van.
Theo quy luật “no flow, no grow”, do không còn dòng máu đi qua van ba lá, phần buồng nhận thất phải (right ventricular inlet) sẽ bị thiểu sản. Sự phát triển của các phần còn lại của thất phải sẽ phụ thuộc vào dòng máu cung cấp cho thất phải. 90% các trường hợp teo tịt van ba lá sẽ có kèm theo thông liên thất (ventricular septal defect) với kích thước thay đổi. Trong teo tịt van ba lá, lỗ thông liên thất có thể ở phần quanh màng hoặc phần cơ, hoặc là kiểu lệch hàng. Lỗ thông liên thất càng lớn, lưu lượng máu cung cấp cho thất phải sẽ càng lớn, phần cơ bè và đường ra thất phải sẽ càng phát triển. Ngược lại, trong trường hợp không có thông liên thất, toàn bộ thất phải, van và thân động mạch phổi sẽ bị thiểu sản nặng: thất phải tồn tại dưới dạng khe hẹp (slit – like), teo tịt van động mạch phổi (pulmonary atresia) và thân động mạch phổi rất bé.
Lỗ thông liên thất sẽ có xu hướng nhỏ đi sau sinh, đặc biệt trong 2-3 năm đầu tiên. Đây là đặc điểm cần chú ý khi theo dõi các trẻ có teo tịt van ba lá kèm chuyển gốc đại động mạch (transposition of the great arteries) (teo tịt van ba lá type II) sau phẫu thuật Fontan, vì xu hướng tắc nghẽn dưới van động mạch chủ có thể xảy ra.
Do không còn đường thoát máu qua lỗ van ba lá, máu từ nhĩ phải bắt buộc phải đi sang nhĩ trái qua lỗ thông liên nhĩ (atrial septal defect) hoặc qua lỗ bầu dục (patent foramen ovale). Vì toàn bộ cung lượng tim trở về nhĩ phải sẽ đi qua lỗ thông ở vách liên nhĩ, do đó lỗ bầu dục hoặc lỗ thông liên nhĩ thường có kích thước lớn.
Ở tim bình thường trong thời kỳ bào thai, van Eustache đóng vai trò hướng dòng máu từ tĩnh mạch chủ dưới đổ về lỗ bầu dục sang nhĩ trái và thường thoái triển sau khi sinh. Trong teo tịt van ba lá, thường gặp van Eustache lớn. Biến đổi giải phẫu này có thể đóng vai trò trong cơ chế bệnh sinh của teo tịt van ba lá (bằng cách tăng dòng máu qua lỗ bầu dục, gián tiếp giảm dòng máu qua van ba lá), nhưng cũng có thể là hậu quả do teo tịt van ba lá làm thay đổi dòng chảy trong nhĩ phải.
Chuyển gốc đại gốc động mạch (transposition of the great arteries) là bất thường có thể kèm theo teo tịt van ba lá, với tỷ lệ khoảng một phần tư các trường hợp. Dựa trên tính chất chuyển gốc đại động mạch, kích thước lỗ thông liên thất và ảnh hưởng của dòng máu qua thông liên thất lên sự phát triển của tim phải, Kuhne và Tandon đề xuất một hệ thống phân loại teo tịt van ba lá như sau:
Bảng 1. Phân loại teo tịt van ba lá theo Kuhne và Tandon
| Type I | Tương quan đại động mạch bình thường |
| a. Vách liên thất nguyên vẹn kèm teo tịt van động mạch phổi. | |
| b. Thông liên thất nhỏ kèm hẹp động mạch phổi (pulmonary stenosis). | |
| c. Thông liên thất lớn không kèm hẹp động mạch phổi. | |
| Type III | Chuyển gốc đại động mạch |
| a. Thông liên thất kèm teo tịt động mạch phổi. | |
| b. Thông liên thất kèm hẹp động mạch phổi. | |
| c. Thông liên thất không kèm hẹp động mạch phổi. | |
| Type III | Chuyển gốc đại động mạch hoặc vị trí đại động mạch bất thường. Các tổn thương phối hợp phức tạp: thân chung động mạch, kênh nhĩ thất. |
Type I: đề cập đến các bệnh nhân có tương quan đại động mạch bình thường và chiếm khoảng 70%. Type I và type II được phân thành các dưới nhóm dựa vào đặc điểm thông liên thất.
- Type Ia là các bệnh nhân không có thông liên thất, do đó không có nguồn cấp máu đáng kể cho thất phải, thất phải thiểu sản rất nặng kèm theo teo tịt van động mạch phổi.
- Type Ib có lỗ thông liên thất nhỏ, dòng máu lên phổi hạn chế, động mạch phổi hẹp.
- Type Ic có thông liên thất lớn, dòng máu lên phổi không bị hạn chế, động mạch phổi không bị hẹp.
Lưu ý: thông liên thất có thể nhỏ đi theo thời gian và do đó có thể thay đổi phân loại của bệnh nhân.
Type II: bệnh nhân có kèm theo chuyển gốc đại động mạch type D, chiếm khoảng 25%. Trong type II, phân loại dưới nhóm sẽ dựa vào mức độ giới hạn dòng máu lên phổi từ buồng thất trái.
- Type IIa mô tả các bệnh nhân kèm teo tịt van động mạch phổi.
- Type IIb là các bệnh nhân có hẹp động mạch phổi.
- Type IIc không có cản trở máu lên động mạch phổi.
Điểm hạn chế của phân loại này là không đề cập đến vai trò của kích thước thông liên thất trong type II (do ở type II không còn tương quan lưu lượng chặt chẽ giữa máu đi qua thông liên thất và máu đi lên động mạch phổi như ở type I, vì vậy không thể phân loại dựa trên kích thước động mạch phổi để gián tiếp nói lên kích thước lỗ thông liên thất), trong khi đó, thông liên thất là yếu tố quyết định lượng máu đi vào động mạch chủ và liên quan chặt chẽ đến các thay đổi sinh lý và huyết động của type II.
Type III: Rất ít gặp nên không có phân loại dưới nhóm.
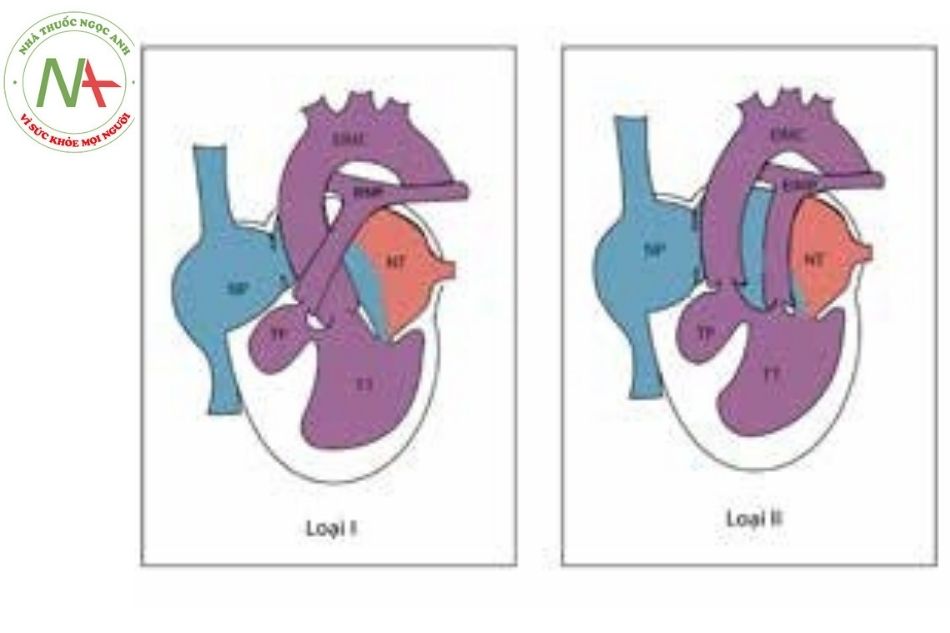
Chú thích: ĐMC: Động mạch chủ; ĐMP: Động mạch phổi; NP: Nhĩ phải; NT: Nhĩ trái; TP: Thất phải; TT: Thất trái.
Các bất thường khác đi kèm ít gặp trong type I hơn. Bất thường hay gặp kèm theo nhất là hẹp eo động mạch chủ (coarctation of the aorta) (trong khoảng 8% bệnh nhân). Các tổn thương khác bao gồm tồn tại tĩnh mạch chủ trên trái, các tiểu nhĩ có vị trí cạnh nhau, và cung động mạch chủ bên phải.
Sinh lý bệnh
Teo tịt van ba lá là bệnh tim bẩm sinh thuộc nhóm tim một thất chức năng, trong đó tâm thất trái đóng vai trò chủ đạo bơm máu vào cả tuần hoàn phổi và tuần hoàn chủ, còn thất phải thiểu sản có ít hoặc gần như không có vai trò bơm máu.
Trong teo tịt van ba lá, đường thoát máu duy nhất của nhĩ phải là qua vách liên nhĩ (qua lỗ bầu dục và/hoặc thông liên nhĩ). Máu tĩnh mạch hệ thống sẽ được trộn hoàn toàn với máu tĩnh mạch phổi đổ về trong tâm nhĩ trái, sau đó đi qua van hai lá vào buồng thất trái và được bơm vào các đại động mạch. Do máu được trộn lẫn hoàn toàn ở tầng nhĩ, tương quan thất – đại động mạch không có vai trò quyết định mức độ tím ở tuần hoàn ngoại biên như các trường hợp chuyển gốc đại động mạch đơn thuần hay thất phải hai đường ra, mà ảnh hưởng đến lưu lượng máu lên các đại động mạch thông qua vai trò hạn chế dòng máu của thông liên thất:
- Với type I: kích thước của thông liên thất đóng vai trò quyết định lưu lượng máu lên động mạch phổi.
- Với type II: kích thước của thông liên thất đóng vai trò quyết định lưu lượng máu lên động mạch chủ.
Trong type I (tương quan đại động mạch bình thường): mức độ tím sẽ phụ thuộc lượng máu lên phổi để trao đổi oxy, do đó sẽ phụ thuộc vào kích thước thông liên thất và mức độ tắc nghẽn của động mạch phổi. Dòng máu lên phổi càng ít hạn chế, bệnh nhân càng ít tím nhưng nguy cơ quá tải tuần hoàn phổi sẽ cao lên, đặc biệt khi sức cản mạch phổi giảm xuống. Trong type Ia, vách liên thất kín và van động mạch phổi bị teo tịt, do đó nguồn cấp máu cho phổi sẽ qua ống động mạch và được quyết định bởi kích thước ống động mạch.
Trong type II (chuyển gốc đại động mạch): thường gặp type IIc, nghĩa là ít gặp hẹp dưới van động mạch phổi (subvalvular pulmonary stenosis), do đó hay gặp quá tải tuần hoàn phổi xảy ra sớm. Tuy nhiên thường gặp xu hướng hẹp dưới van động mạch chủ (subvalvular aortic stenosis) do máu từ thất trái muốn lên động mạch chủ phải đi qua lỗ thông liên thất hạn chế, làm tưới máu hệ thống giảm, trẻ có thể bị tụt huyết áp, sốc tuần hoàn và toan chuyển hóa.
Các đặc điểm sinh lý bệnh khác tùy thuộc vào bất thường đi kèm. Bệnh nhân có lỗ thông liên nhĩ (atrial septal defect) hạn chế có thể xuất hiện các triệu chứng ứ trệ tuần hoàn ngoại biên và giảm máu lên phổi. Nếu kèm theo hẹp eo động mạch chủ có thể có tưới máu chi dưới kém và mạch chi dưới khó bắt.
CHẨN ĐOÁN
Biểu hiện lâm sàng
Tím (cyanosis) là biểu hiện hầu như luôn gặp ở trẻ teo tịt van ba lá do sự trộn máu hoàn toàn ở tầng nhĩ.
- Tím có thể chưa được ghi nhận ngay sau sinh, nhưng hầu hết bệnh nhi sẽ có tím rõ sau tuần đầu tiên.
- Mức độ tím phụ thuộc vào lưu lượng máu lên phổi. Ở những trẻ có hạn chế luồng máu lên phổi, có thể gặp những cơn tím nặng do giảm kích thước của lỗ thông liên thất hoặc hẹp phễu động mạch phổi với cơ chế tương tự như tứ chứng Fallot (tetralogy of Fallot).
- Tím trong thời gian dài có thể có ngón tay dùi trống.
- Một số trường hợp không có tắc nghẽn dòng máu lên phổi sẽ không có tím, tuy nhiên những trẻ này sẽ sớm bị suy tim khi sức cản mạch máu phổi giảm.
Khám lâm sàng:
- Có thể nghe thấy tiếng thổi toàn tâm thu do dòng máu qua lỗ thông liên thất và thành phần thổi tống máu (giữa tâm thu) có thể nổi trội hơn do đường ra thất phải bị tắc nghẽn.
- Tiếng T1 đơn độc và mạnh. Có thể nghe thấy hai thành phần của tiếng T2 nếu van động mạch phổi còn tương đối bình thường. Trong trường hợp máu lên phổi nhiều, có thể nghe thấy tiếng T3 và rung tâm trương lưu lượng do máu về thất trái nhiều.
- Gan to gặp trong trường hợp lỗ thông liên nhĩ hạn chế.
- Mạch chi dưới khó bắt nếu có hẹp eo động mạch chủ kèm
Với các bệnh nhân teo tịt van ba lá type II, thường gặp các triệu chứng của tăng tuần hoàn phổi do ít khi gặp hẹp động mạch phổi. Với các trường hợp type II có thông liên thất lớn và không có cản trở máu lên phổi (type IIc), không thể phân biệt được với các trường hợp type Ic dựa trên biểu hiện lâm sàng.
Trong teo tịt van ba lá type I mức độ máu lên phổi phụ thuộc vào kích thước của lỗ thông liên thất và mức độ thiểu sản đường ra thất phải. Với bệnh nhân teo tịt van ba lá với lỗ thông liên thất lớn và không có hẹp đường ra thất phải sẽ có tăng lưu lượng máu lên phổi. Còn các bệnh nhân teo tịt van ba lá với thông liên thất bé hoặc hẹp đường ra thất phải nặng dẽ có giảm lưu lượng máu lên phổi.
Xem thêm: Một số hội chứng thường gặp liên quan đến bất thường tim bẩm sinh
Cận lâm sàng
Điện tâm đồ
Trong teo tịt van ba lá, nhịp tim thường là nhịp xoang. Có thể gặp nhịp nhanh trên thất (nhanh nhĩ, cuồng nhĩ, rung nhĩ…) ở các bệnh nhân có lỗ thông liên nhĩ hạn chế. Rối loạn nhịp nhĩ cũng xảy ra nhiều trong trường hợp bệnh đã lâu, kể cả sau mổ Fontan.
Điện tâm đồ có thể góp phần gợi ý trong việc chẩn đoán phân biệt trẻ tím sau sinh:
- Hầu hết các bệnh tim bẩm sinh tím sẽ có trục QRS lệch phải do thất phải phì đại.
- Ở bệnh nhân teo tịt van ba lá, thành phần vector điện học thất phải bị giảm mạnh làm trục QRS lệch về phía trên trái (trong teo tịt van ba lá type I có thể gặp 85% trường hợp là trục trên trái).
Lượng máu lên phổi cũng có thể làm thay đổi điện tâm đồ: trường hợp nhiều máu lên phổi làm tăng gánh thất trái thường có sóng R cao ở V6, trong khi trường hợp ít máu lên phổi sẽ có R ở V6 thấp.
Xquang ngực
Trong trường hợp teo tịt van ba lá kèm hạn chế máu lên phổi, bóng tim thường bình thường, kèm theo dấu hiệu giảm tuần hoàn phổi.
Bóng tim to kèm theo hình ảnh tăng đậm mạch máu phổi có thể gặp trong các trường hợp không có hạn chế máu lên phổi làm tăng gánh thể tích các buồng tim trái. Bóng tim thường có dạng hình cầu với chỗ lõm ở vị trí thân động mạch phổi.
Cung dưới phải có thể lớn do giãn nhĩ phải, đặc biệt ở trẻ lớn.
Siêu âm tim
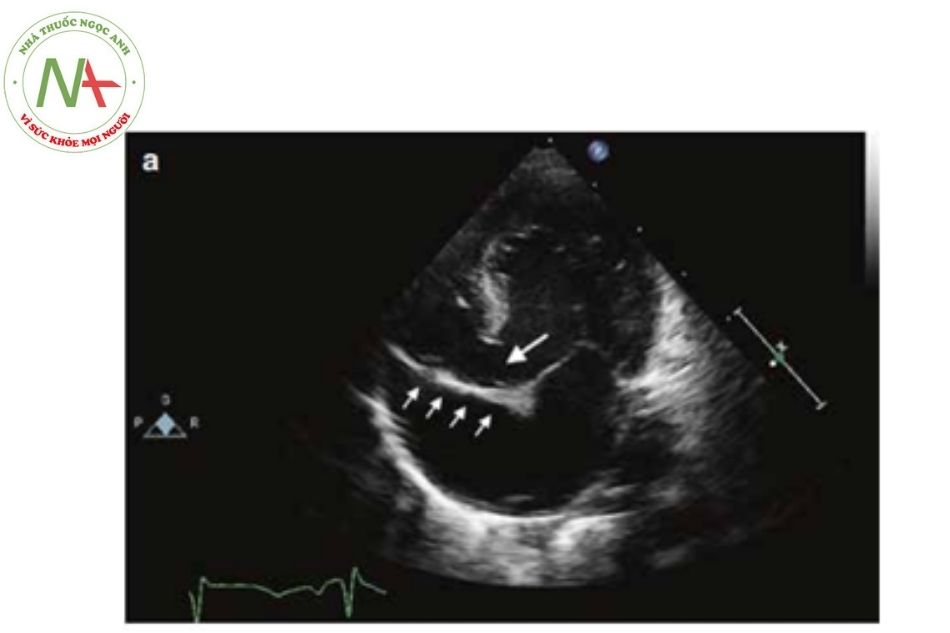
(Nguồn: Doppler Echocardiography in Infancy and Childhood)
- Kích thước của thông liên nhĩ và chênh áp qua lỗ thông này có thể đánh giá ở mặt cắt bốn buồng dưới sườn. Nếu có hạn chế dòng máu qua lỗ thông liên nhĩ, có thể cần phải thông tim và mở vách liên nhĩ bằng bóng.
- Tình trạng và cơ chế hở van hai lá cần được khảo sát vì đó là yếu tố quan trọng cần phải điều chỉnh trong phẫu thuật.
- Có thể thấy buồng thất trái giãn do tăng gánh thể tích kéo dài. Chức năng tâm thu thất trái có thể giảm ở trẻ lớn không được điều trị do hậu quả của quá tải thể tích mạn tính và thiếu oxy máu.
Chiến lược điều trị sẽ thay đổi theo tương quan của các đại động mạch, do đó cần xác định vị trí các đại động mạch, tương quan với thông liên thất.
Cần thiết phải khảo sát tất các yếu tố gây tắc nghẽn dòng máu hệ thống (bao gồm tình trạng hẹp dưới van động mạch chủ và hẹp eo động mạch chủ kèm theo), cũng như giải phẫu của các động mạch phổi (kích thước thân, chỗ chia đôi và hai nhánh động mạch phổi).
Siêu âm còn có giá trị trong việc theo dõi các cấu trúc phẫu thuật giảm nhẹ như cầu nối Blalock – Taussig và phẫu thuật siết bớt động mạch phổi (pulmonary artery banding), cũng như theo dõi các biến chứng sau phẫu thuật Fontan.
Thông tim và chụp mạch
Các kỹ thuật chụp mạch máu và chụp buồng tim để xác định chẩn đoán teo tịt van ba lá (như chụp buồng nhĩ phải hoặc chụp tĩnh mạch chủ trên) hiện nay rất ít khi được áp dụng và đã được thay thế bằng siêu âm tim. Thông tim được chỉ định để khảo sát các thông số chưa thu thập được chính xác bằng siêu âm hoặc được thực hiện kèm theo các thủ thuật can thiệp.
- Ống thông (catheter) từ tĩnh mạch đùi sẽ được đưa lên nhĩ phải, sau đó sẽ dễ dàng đi qua thông liên nhĩ vào nhĩ trái (do không còn đường thoát máu qua van ba lá). Ống thông sẽ tiếp tục được đưa vào thất trái. Dùng dây dẫn có thể giúp đưa ống thông lên đại động mạch phía
- Có thể đưa ống thông vào thất trái qua đường động mạch bằng cách luồn dây dẫn qua van động mạch chủ. Nếu lỗ thông liên thất nhỏ, có thể khó khăn trong việc đưa ống thông qua lỗ thông liên thất và lên đại động mạch phía trước.
- Chụp buồng thất trái cho phép xác định vị trí lỗ thông liên thất và tương quan với các đại động mạch để định hướng dây dẫn và ống thông vào thất phải. Chụp động mạch phổi thì muộn cho phép đánh giá tình trạng máu trở về tim trái và phát hiện hẹp tĩnh mạch phổi đi kèm nếu có.
Áp lực nhĩ phải thường tăng nhẹ so với nhĩ trái. Có thể thấy sóng a rõ, đặc biệt trong trường hợp thông liên nhĩ hạn chế. Áp lực cuối tâm thu và cuối tâm trương của thất trái thường bình thường. Trong trường hợp thông liên thất lớn không kèm theo hạn chế máu lên phổi (type Ic), khi sức cản mạch phổi giảm xuống, áp lực cuối tâm trương thất trái có thể tăng.
Do hậu quả của độ bão hòa oxy trong máu động mạch thấp, bão hòa oxy máu tĩnh mạch đổ về cũng giảm. Trong trường hợp không có bệnh lý phổi kèm theo, bão hòa oxy trong máu tĩnh mạch phổi sẽ bình thường. Tuy nhiên, do sự trộn máu bắt buộc trong nhĩ trái với máu từ nhĩ phải qua, bão hòa oxy máu của nhĩ trái và thất trái sẽ giảm.
Sức cản mạch phổi (pulmonary vascular resistance) là thông số rất quan trọng trong việc quyết định thành công của phẫu thuật Fontan. Thông tim cho phép ước tính chính xác sức cản mạch phổi bằng phương pháp pha loãng nhiệt hoặc phương pháp Fick. Áp lực hậu mao mạch chính là áp lực nhĩ trái. Áp lực tiền mao mạch hay áp lực động mạch phổi có thể được khảo sát bằng cách đưa ống thông tới động mạch phổi qua luồng thông chủ – phổi hoặc qua vị trí siết động mạch. Trong trường hợp không thể tiếp cận động mạch phổi, áp lực động mạch phổi sẽ được ước tính bằng cách đo áp lực tĩnh mạch phổi bít. Ở các bệnh nhân sau mổ Glenn, ống thông có thể được đưa vào các tĩnh mạch phần trên cơ thể (dưới đòn, cành trong, cánh tay) qua miệng nối Glenn vào động mạch phổi.
Chụp mạch và chụp buồng tim cũng được dùng để khảo sát vị trí và kích thước lỗ thông liên thất cũng như các nguồn cấp máu cho phổi. Chụp động mạch phổi là cần thiết vì cho phép đánh giá kích thước cũng như sự xoắn vặn của động mạch phổi do lần mổ trước (làm cầu nối chủ – phổi hoặc phẫu thuật siết bớt động mạch phổi). Đây là các yếu tố ảnh hưởng đến phẫu thuật Glenn sau đó. Chụp mạch cũng cho phép khảo sát các nguồn cấp máu khác cho phổi (thường là các động mạch bàng hệ từ động mạch chủ xuống), đặc biệt trong trường hợp trẻ lớn chưa được phẫu thuật trước đó. Tuy nhiên, các đặc điểm giải phẫu này hiện nay có thể được khảo sát bằng MSCT hoặc MRI, do đó thông tim và chụp mạch chủ yếu được sử dụng trong các trường hợp có dự kiến can thiệp qua da hơn là chỉ có vai trò chẩn đoán.
ĐIỀU TRỊ
Teo tịt van ba lá là bệnh tim bẩm sinh tím thuộc nhóm tim một thất chức năng, được đặc trưng bởi buồng thất phải thiểu sản. Trẻ không được điều trị sẽ chết do các biến chứng của bệnh tim bẩm sinh tím và các biến chứng khác tùy thuộc vào lượng máu lên phổi nhiều hay ít, với tỷ lệ sống sót sau năm đầu tiên nếu không được phẫu thuật khoảng 10%. Vấn đề lớn nhất trong điều trị teo tịt van ba lá là vẫn chưa có bất cứ một phương pháp nào có thể tái tạo và phục hồi chức năng của thất phải thiểu sản, do đó việc sửa chữa để tim hoạt động với hai vòng tuần hoàn nối tiếp như bình thường cho đến nay là bất khả thi.
Trước năm 1970, các phương pháp phẫu thuật chỉ giới hạn ở việc giúp kiểm soát lượng máu lên phổi (cầu nối Blalock – Taussig hoặc phẫu thuật siết bớt động mạch phổi) mà không giải quyết triệt để được các hậu quả của tuần hoàn song song: đó là quá tải thể tích của tâm thất trái và hiện tượng trộn lẫn máu giàu oxy với máu ít oxy. Do đó kể cả khi được phẫu thuật giảm nhẹ với cầu nối chủ – phổi hay phẫu thuật siết bớt động mạch phổi, chỉ có dưới một nửa các ca teo tịt van ba lá có thể sống tới tuổi trưởng thành.
Năm 1971, Fontan và Baudet lần đầu tiên mô tả phương pháp phân lập tuần hoàn phổi và tuần hoàn hệ thống, bằng cách kết nối tĩnh mạch hệ thống với động mạch phổi, nối tắt qua thất thiểu sản, tạo ra một hệ tĩnh mạch cửa mới theo thứ tự: mao mạch hệ thống – tĩnh mạch hệ thống và động mạch phổi – mao mạch phổi. Động lực cho dòng máu chảy qua hệ thống tĩnh mạch cửa mới này là nhờ áp lực tĩnh mạch hệ thống cao hơn áp lực tĩnh mạch phổi và năng lượng tồn dư hậu mao mạch hệ thống. Ưu điểm của kết nối tĩnh mạch chủ – động mạch phổi đó là tránh được hiện tượng trộn máu, do đó bão hòa oxy máu gần như bình thường. Ngoài ra hệ thống này còn làm giảm dòng máu quẩn từ tâm thất lên động mạch phổi, về tĩnh mạch phổi rồi lại về tâm thất, dẫn tới giảm tăng gánh thể tích mạn tính lên tâm thất chức năng đơn độc.
Trong 50 năm qua, đã có rất nhiều cải tiến phẫu thuật trong điều trị tim một thất chức năng, tuy nhiên theo quy ước, tất cả các phẫu thuật đổi hướng hoàn toàn dòng máu tĩnh mạch hệ thống về động mạch phổi mà không đi qua tâm thất đều được gọi là phẫu thuật Fontan. Hiện nay đích đến cuối cùng của điều trị teo tịt van ba lá là phẫu thuật Fontan. Mục tiêu của các phẫu thuật trước phẫu thuật Fontan đó là bảo vệ giải phẫu động mạch phổi một cách tối ưu bằng cách: a) cung cấp một lượng máu lên phổi đủ để tránh hiện tượng giảm oxy máu nặng hoặc b) giảm lượng máu lên phổi để tránh suy thất trái và bệnh mạch máu phổi tắc nghẽn.
Điều trị trước khi tạo kết nối tĩnh mạch chủ – động mạch phổi
Trẻ mới sinh nếu lượng máu lên phổi giảm nặng, cần truyền prostaglandin E1 (với liều 0,025-0,1 mg/ kg/phút) để duy trì ống động mạch. Tác dụng phụ của prostaglandin bao gồm ngừng thở (có thể cần phải đặt nội khí quản thở máy), co giật, sốt, tụt huyết áp do giãn mạch ngoại biên. Truyền prostaglandin giúp duy trì dòng máu lên phổi tối thiểu để chuẩn bị cho phẫu thuật tạm thời trong thời kỳ sơ sinh.
Khi tương quan đại động mạch bình thường (type I), cần đánh giá tình trạng tưới máu phổi để có kế hoạch điều chỉnh phù hợp. Các trường hợp rất ít máu lên phổi (type Ia, Ib) sẽ được làm tăng lưu lượng máu lên phổi bằng phẫu thuật cầu nối Blalock – Taussig cải tiến (dùng ống Gore-tex) đủ để tím nặng không xảy ra. Các kỹ thuật Blalock – Taussig kinh điển, cầu nối Waterson hay Pott đều có hạn chế trong việc kiểm soát lượng máu lên phổi và có thể làm xoắn vặn động mạch phổi gây khó khăn cho phẫu thuật Fontan sau này nên hiện tại không còn được ứng dụng. Trường hợp không có tắc nghẽn giữa thất trái và động mạch phổi (type Ic) dẫn tới máu lên phổi rất nhiều sẽ được làm giảm lượng máu lên phổi bằng cách phẫu thuật siết bớt động mạch phổi (pulmonary artery banding). Đôi khi dòng máu qua lỗ thông liên thất lên phổi bị tắc nghẽn ở mức độ vừa đủ: không quá ít để trẻ không quá tím, cũng như không quá nhiều để gây ra suy tim. Các trường hợp này có thể theo dõi sát tuy nhiên luôn luôn cần quan tâm đến sự giảm lưu lượng máu lên phổi do lỗ thông liên thất sẽ có xu hướng nhỏ dần theo thời gian.
Với các trường hợp có chuyển gốc đại động mạch type D, thường gặp type IIc (tức là không có tắc nghẽn dòng máu lên phổi), cần phải phẫu thuật siết bớt động mạch phổi để giảm áp lực phổi và ngăn ngừa tổn thương tiểu động mạch phổi. Một yếu tố quan trọng nữa cần phải cân nhắc trong phẫu thuật đó là kích thước của lỗ thông liên thất, vì có thể gặp lỗ thông liên thất nhỏ gây tắc nghẽn dòng máu lên động mạch chủ. Tắc nghẽn này có thể giải quyết bằng cách khoét rộng trực tiếp lỗ thông liên thất hoặc tạo một miệng nối giữa thân động mạch phổi và động mạch chủ lên (phẫu thuật Damus – Kaye – Stansel, viết tắt là DKS). Trong phẫu thuật DKS, các nhánh động mạch phổi được cắt rời khỏi thân động mạch phổi và được cấp máu từ động mạch chủ qua cầu nối chủ – phổi. Máu từ thất trái sẽ đi qua cả lỗ thông liên thất hạn chế và qua thân động mạch phổi để vào động mạch chủ lên.
Phẫu thuật Glenn tạo kết nối tĩnh mạch chủ – động mạch phổi (cavopulmonary anastomosis)
Năm 1965, Glenn mô tả phương pháp phẫu thuật nối tĩnh mạch chủ trên với đoạn xa động mạch phổi phải. Tĩnh mạch chủ trên được cắt rời khỏi nhĩ phải. Động mạch phổi phải được cắt rời khỏi thân động mạch phổi và được nối với tĩnh mạch chủ trên theo kiểu tận – tận. Như vậy phổi phải sẽ nhận toàn bộ máu ít oxy từ nửa trên cơ thể đổ về qua tĩnh mạch chủ trên, còn phổi trái sẽ nhận máu trộn qua thân động mạch phổi. Phẫu thuật Glenn cho phép máu từ nửa trên cơ thể được oxy hóa hoàn toàn bởi phổi phải và làm trẻ đỡ tím hơn. Tuy nhiên trẻ vẫn còn các nguy cơ của luồng thông phải → trái (right-to- left shunt) của dòng máu từ tĩnh mạch chủ dưới đổ về nhĩ trái.
Phương pháp Fontan nguyên thủy kinh điển
Năm 1971, Fontan và Baudet báo cáo phương phẫu thuật sửa chữa trên ba bệnh nhân teo tịt van ba lá. Động mạch phổi phải được cắt rời và tạo miệng nối tận – tận với tĩnh mạch chủ trên (cầu nối Glenn). Tiểu nhĩ phải được nối với động mạch phổi bởi đoạn ống dẫn có van đồng loài, chỗ nối tĩnh mạch chủ dưới – nhĩ phải cũng được đặt thêm van tổ chim đồng loài. Lỗ thông liên nhĩ được đóng lại, phân tách hoàn toàn máu tĩnh mạch hệ thống và máu tĩnh mạch phổi. Như vậy máu từ nửa trên cơ thể qua tĩnh mạch chủ trên sẽ dẫn lưu về phổi phải, trong khi đó máu từ nửa dưới cơ thể sẽ qua tĩnh mạch chủ dưới, nhĩ phải, qua ống dẫn có van để về động mạch phổi và đổ về phổi trái.
Lý luận của Fontan khi lắp thêm hai van một chiều vào các miệng nối nhĩ phải đó là tận dụng khả năng co bóp của nhĩ phải như một bơm đẩy (pushing pump) để tạo động lực cho máu lên phổi dễ hơn (thất hóa nhĩ phải). Cùng chung ý tưởng này, ở Buenos Aires (Argentina), Kreutzer và cộng sự cũng tiến hành nối tâm nhĩ phải với động mạch phổi qua van tổ chim đồng loài trên một bệnh nhân 3 tuổi có teo tịt van ba lá type Ib kèm theo huyết khối động mạch phổi phải và bắc cầu Waterson. Điểm khác biệt giữa kết nối nhĩ – phổi của Kreutzer so với phương pháp của Fontan đó là động mạch phổi phải không bị cắt rời để làm miệng nối Glenn, cũng như không đặt van tĩnh mạch chủ dưới.
Tuy nhiên, cấu trúc cơ tâm nhĩ mỏng và được thiết kế chủ yếu cho nhát bóp nhĩ (hay “atrial kick”) để giải quyết nốt lượng máu ứ đọng ở tâm nhĩ vào cuối giai đoạn tâm trương. Do vậy, tâm nhĩ thích hợp với vai trò là một bơm hút (sucking pump) hơn là một bơm đẩy (pushing pump). Việc sử dụng co bóp của tâm nhĩ để đẩy máu lên phổi dẫn tới hậu quả là cơ tâm nhĩ phì đại, buồng tâm nhĩ giãn, dễ triệt tiêu năng lượng tồn dư hậu mao mạch, tạo dòng máu quẩn, gây tăng đông và rối loạn nhịp nhĩ.
Phương pháp Fontan cải tiến
Để tránh các biến chứng liên quan đến tâm nhĩ và sự xoắn vặn động mạch phổi khi cắt rời động mạch phổi phải, kỹ thuật mổ với tim một thất chức năng hiện nay hướng đến việc tạo kết nối hoàn toàn tĩnh mạch chủ – động mạch phổi (TCPC Fontan). Kỹ thuật được tiến hành trong hai bước: ban đầu tạo cầu nối Glenn hai hướng (bidirectional Glenn) giữa tĩnh mạch chủ trên với động mạch phổi phải; sau đó tuần hoàn Fontan được hoàn thiện bằng cầu nối tĩnh mạch chủ dưới với mặt dưới động mạch phổi phải.
Cầu nối này có thể thực hiện thông qua đường hầm bên (lateral tunnel) được tạo bởi thành sau xoang tĩnh mạch của nhĩ phải và miếng vá đổi hướng (baffle), hoặc bằng ống dẫn Gore-tex ngoài tim (extracardiac conduit). Phẫu thuật viên sẽ tạo một cửa sổ (fenestration) giữa khoang tĩnh mạch hệ thống với nhĩ phải. Cửa sổ này đóng vai trò giảm áp tĩnh mạch hệ thống nhờ luồng thông phải -> trái khi áp lực tĩnh mạch hệ thống quá cao.
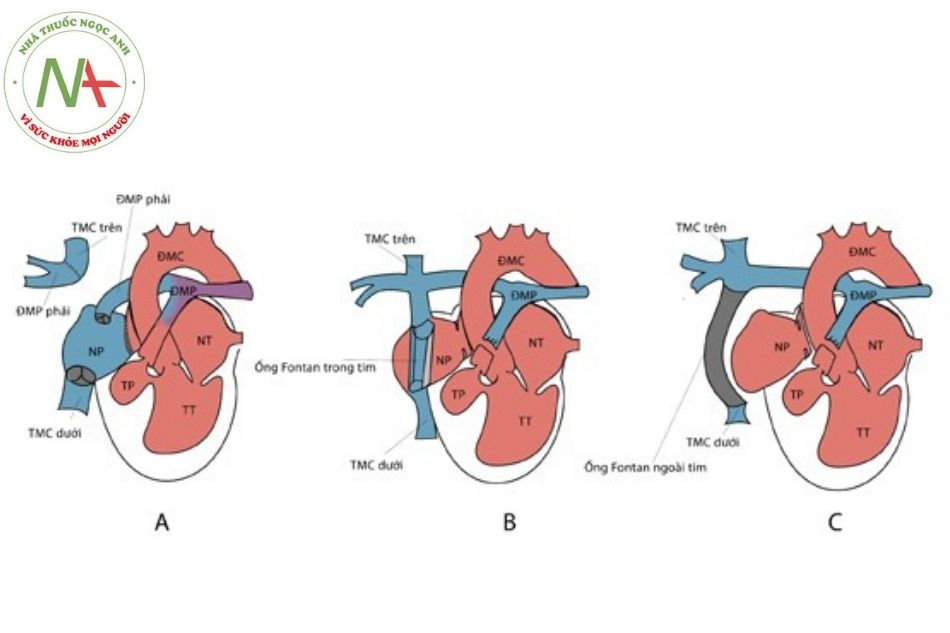
- Phẫu thuật Fontan nguyên thủy bao gồm (i) nối tĩnh mạch chủ trên với động mạch phổi phải (Glenn shunt) và nối tiểu nhĩ phải với hệ động mạch phổi trái qua đoạn mạch có van đồng loài, (ii) đặt van tổ chim đồng loài ở chỗ nối tĩnh mạch chủ dưới – nhĩ phải, (iii) đóng thông liên nhĩ.
- Phẫu thuật Fontan cải tiến với đường hầm bên của nhĩ phải dẫn máu từ tĩnh mạch chủ dưới lên miệng nối tĩnh mạch chủ trên với mặt dưới động mạch phổi phải. Dòng máu tĩnh mạch chủ trên đã được dẫn lưu về động mạch phổi phải nhờ cầu nối Glenn hai hướng trước đó.
- Phẫu thuật Fontan cải tiến sử dụng ống dẫn ngoài
Chú thích: ĐMC: Động mạch chủ; ĐMP: Động mạch phổi; TMC: Tĩnh mạch chủ; NP: Nhĩ phải; NT: Nhĩ trái; TP: Thất phải; TT: Thất trái.
Năm 1978, Choussat và cộng sự mô tả 10 tiêu chuẩn để có kết quả tối ưu sau phẫu thuật Fontan, bao gồm:
- Tuổi: từ 4 đến 15 tuổi.
- Nhịp xoang.
- Kết nối tĩnh mạch hệ thống bình thường.
- Kích thước nhĩ phải bình thường.
- Áp lực động mạch phổi bình thường (áp lực trung bình ≤ 15mmHg).
- Kháng lực mạch phổi thấp (dưới 4 đơn vị Woods/m2).
- Kích thước động mạch phổi thích hợp (≥ 75% đường kính động mạch chủ).
- Chức năng tâm thu thất trái bình thường (EF ≥ 60%).
- Không có hở van hai lá.
- Không có các biến chứng từ các phẫu thuật trước đó (như xoắn vặn động mạch phổi).
Nhờ các tiến bộ về kỹ thuật mổ Fontan và hồi sức sau mổ, các tiêu chuẩn trước mổ để đạt được tuần hoàn Fontan tối ưu không còn giống với 10 tiêu chuẩn mà Choussat mô tả. Hiện nay phẫu thuật Fontan có thể được tiến hành ở trẻ dưới 3 tuổi, có kết nối tĩnh mạch hệ thống bất thường, áp lực động mạch phổi tăng ở mức ranh giới. Tuy nhiên các đặc điểm sức cản động mạch phổi thấp và không có hở van hai lá có ý nghĩa kèm theo vẫn là các yếu tố tiên lượng quan trọng với thành công của tuần hoàn Fontan.
Biến chứng của tuần hoàn Fontan
So với tuần hoàn hai thất, tuần hoàn một thất sẽ có áp lực tĩnh mạch hệ thống cao hơn kèm theo cung lượng tim thấp hơn. Do thiếu mất một tâm thất có vai trò đẩy máu, động lực cho dòng máu từ tĩnh mạch hệ thống đi lên mạch máu phổi và trở về tâm nhĩ là nhờ năng lượng tồn dư hậu mao mạch hệ thống và sự chênh lệch áp lực giữa tĩnh mạch hệ thống và tĩnh mạch phổi. Vì vậy, khác với nguyên nhân suy tuần hoàn hai thất thường là do các tổn thương đủ lớn để gây rối loạn chức năng tim, trong tuần hoàn một thất bất cứ sự thay đổi nhỏ nào của trở kháng hệ mạch máu cũng có thể dẫn tới ứ máu tĩnh mạch, giảm cung lượng tim và cuối cùng dẫn tới suy tuần hoàn Fontan. Các biến chứng có thể xảy ra do tăng áp lực tĩnh mạch hệ thống bao gồm tràn dịch màng phổi, bệnh lý ruột mất protein, viêm phế quản dạng nhựa dẻo (plastic bronchitis)…
Bão hòa oxy máu của bệnh nhân sau mổ Fontan có thể giảm do luồng thông qua cửa sổ Fontan quá lớn hoặc do hiện tượng mở các tuần hoàn bàng hệ từ nhĩ phải hoặc tĩnh mạch chủ (kiểu phải – trái). Ngược lại, động mạch chủ cũng có thể phát sinh các tuần hoàn bàng hệ đi tới hệ động mạch phổi (APCA mắc phải), cạnh tranh với dòng máu áp lực thấp đi qua kết nối tĩnh mạch chủ – động mạch phổi và có thể gây quá tải thể tích thất trái. Các tắc nghẽn trong tuần hoàn Fontan và các tuần hoàn bàng hệ cần được theo dõi và có thể can thiệp qua da trong chương trình quản lý các bệnh nhân sau mổ Fontan.
CÁC VẤN ĐỀ CẦN LƯU Ý KHÁC
Theo dõi
Tất cả các bệnh nhân nên được theo dõi định kỳ về tim mạch tại một trung tâm chuyên về tim bẩm sinh. Việc theo dõi và đánh giá định kỳ hàng năm để phát hiện các biến chứng.
Tập luyện thể dục thể thao
Phần lớn bệnh nhân có hạn chế khả năng gắng sức và hầu hết tự bản thân bệnh nhân đã biết hạn chế khả năng vận động của mình. Bệnh nhân cần hạn chế vận động quá mức, đặc biệt phải tránh mất nước. Nếu phải sử dụng kháng vitamin K, các môn thể thao đối kháng có thể gây chấn thương nên được hạn chế.
Vấn đề mang thai
Đối với bệnh nhân chưa phẫu thuật hoặc chỉ phẫu thuật sửa chữa tạm thời:
Nguy cơ thai kỳ phụ thuộc vào chức năng tâm thất và mức độ tím. Nguy cơ đối với mẹ tăng lên nếu suy chức năng tâm thất hoặc có hở van động mạch chủ đáng kể.
Vấn đề tím không phải là nguy cơ tử vong đáng kể đối với bệnh nhân (trừ khi liên quan đến tăng áp động mạch phổi), tuy nhiên luồng thông từ phải sang trái có thể dẫn đến tắc mạch nghịch thường và những thay đổi về mặt huyết học liên quan đến bệnh tim có tím khiến bệnh nhân có nguy cơ với cả bệnh lý huyết khối và xuất huyết sau sinh.
Với thai nhi, tím là một yếu tố nguy cơ lớn: chỉ có 12% trường hợp trẻ sống khi độ bão hòa oxy khi nghỉ ngơi của mẹ thấp hơn 85%.
Đối với bệnh nhân sau phẫu thuật Fontan:
Nguy cơ thai kỳ của người mẹ phụ thuộc vào chức năng tâm thất, tình trạng lưu thông của tuần hoàn Fontan và mức độ hở van nhĩ thất. Các rối loạn nhịp tim có thể tăng lên trong quá trình mang thai.
Nguy cơ ở người mẹ dường như thấp hơn ở những phụ nữ có khả năng tập luyện tốt trước khi mang thai. Tuy nhiên, sảy thai tự nhiên có thể xảy ra ở khoảng một phần ba các trường hợp mang thai.
Cần xem xét ảnh hưởng của một số thuốc đối với thai nhi khi tư vấn trước khi mang thai:
- Heparin trọng lượng phân tử thấp nên được thay thế cho kháng vitamin K khi đã xác định có thai.
- Ngừng điều trị bằng thuốc ức chế men chuyển do tăng nguy cơ dị tật
- Amiodarone có thời gian bán hủy dài, cần phải ngừng thuốc vài tháng trước khi mang thai để đảm bảo không hoặc ít tiếp xúc với thai nhi. Tuy nhiên, hầu hết bệnh nhân chỉ dùng amiodarone nếu các thuốc chống loạn nhịp tim khác không kiểm soát được các rối loạn nhịp tim nghiêm trọng. Nguy cơ đối với thai nhi là block nhĩ thất bẩm sinh, suy giáp bẩm sinh, chậm phát triển
- Thuốc lợi tiểu có nguy cơ thai chậm phát triển, suy thai.
Dự phòng viêm nội tâm mạc nhiễm khuẩn
Tất cả bệnh nhân nên được khuyến cáo về tầm quan trọng của việc vệ sinh răng miệng trong việc giảm nguy cơ viêm nội tâm mạc.
Dự phòng bằng kháng sinh còn tranh luận: hiện tại không còn được khuyến cáo thường quy trong các khuyến cáo.
TÀI LIỆU THAM KHẢO
1.https://wmerriam-webster.com/dictionary/atresia#medicalDictionary.
2. Hoàng Phê. Từ điển Tiếng Việt. học VNN, Đà Nẵng: Nhà xuất bản Đà Nẵng; 1993.
3. Đỗ Kính. Phôi thai học – Thực nghiệm và ứng dụng lâm sàng. Hà Nội: Nhà xuất bản Y học;
4. Phạm Nguyễn Bệnh học tim mạch. Thành phố Hồ Chí Minh: Nhà xuất bản Y học; 2003.
5. Hugh Allen DD, Robert Shaddy, Timothy Feltes. Moss and Adams’ Heart Disease in infants, children, and adolescents: Including the fetus and young adult. 8th ed: Lippincott Williams & Wilkins;
6. Rudolph A. Congenital Diseases of the Heart – Wiley Blackwell
7. Sarkozy A, Conti E, D’Agostino R, Digilio M, Formigari R, Picchio F, et al. ZFPM2/FOG2 and HEY2 genes anal- ysis in nonsyndromic tricuspid atresia. American journal of medical genetics Part A. 2005;133A:68-70.
8. Dick M, Fyler DC, Nadas AS. Tricuspid atresia: clinical course in 101 patients. The American journal of cardi- ology. 1975;36(3):327-37.
9. Fontan F, Baudet E. Surgical repair of tricuspid atresia. Thorax. 1971;26(3):240-8.
10. Gewillig M, Brown SC. The Fontan circulation after 45 years: update in physiology. 2016;102(14):1081-6.
11. Kreutzer GO, Schlichter AJ, Kreutzer C. The Fontan/Kreutzer procedure at 40: an operation for the correc- tion of tricuspid atresia. Seminars in thoracic and cardiovascular surgery Pediatric cardiac surgery annual. 2010;13(1):84-90.
12. Buber J, Schwaegler RG, Mazor Dray E. Echocardiographic evaluation of univentricular physiology and cavopulmonary shunts. Echocardiography (Mount Kisco, NY). 2019;36(7):1381-90.
