Tác giả: Giáo sư. Tiến sĩ Dược sĩ Thái Nguyễn Hùng Thu.
Bài viết Phương pháp phân lập các chất độc trích trong chương 2 sách Độc chất học – giáo trình đào tạo dược sĩ đại học bộ môn Độc chất học trường Đại học Dược Hà Nội.
Mục tiêu học tập
- Trình bày được nguyên tắc chung trong phân tích các chất độc.
- Trình bày được nguyên tắc của các phương pháp vô cơ hóa mẫu, ưu nhược điểm và ứng dụng của chúng trong phân tích các kim loại và nguyên tố độc.
- Trình bày được nguyên tắc, cách tiến hành và ứng dụng của phương pháp cất kéo hơi nước trong phân tích độc chất.
- Trình bày được nguyên tắc của các phương pháp phân lập các chất độc hữu cơ từ dung dịch nước hay còn ở các pH thích hợp.
1. Nguyên tắc chung trong phân tích các chất độc
Khi bị ngộ độc, phân tích chất độc giúp cho việc chẩn đoán, phát hiện nhanh nguyên nhân ngộ độc để có biện pháp cấp cứu điều trị chính xác kịp thời. Phân tích độc chất nhằm xác định loại và nồng độ chất độc trong dịch sinh học như máu, nước tiêu…
Mẫu phân tích các chất độc rất phức tạp, hàm lượng các chất độc trong mẫu thường thấp nên phải tiến hành lấy mẫu phù hợp, có biện pháp phân lập chất độc, làm sạch và phân tích thích họp để có kết quả nhanh và chính xác nhất. Quá trinh phân tích các chất độc thường qua các giai đoạn: lây mẫu, phân lập chất độc từ mẫu và phân tích chất độc.
1.1. Cách lấy mẫu và bảo quản mẫu cho quá trình phân tích
Các chất độc có mức độ phân bố chuyên hóa và thải trừ khác nhau trong cơ thể nên việc lấy mẫu phải phù hợp với việc phân bố và thải trừ của chất độc cần phân tích. Các mẫu phân tích thường được lây là nước tiêu, dịch dạ dày hoặc nước rửa dạ dày, máu.
Nước tiểu:
Mẫu nước tiểu rất cần thiết cho phân tích chất độc. Mẫu loại này có thể lấy một thể tích đủ lớn và nồng độ chất độc trong mẫu thường cũng cao hơn trong máu. Sự có mặt của các chất chuyên hóa của chất độc trong nước tiểu có thể cản trở việc xác định hàm lượng nhưng lại có thêm thông tin giúp cho việc xác định loại chất độc được chinh xác hơn.
Mầu nước tiểu được lấy càng sớm càng tốt, đặc biệt là trước khi sử dụng thuốc để xử trí và điều trị ngộ độc. Thể tích mẫu lấy khoảng 50mL (với người lớn) và không thêm chất bảo quản.
Dịch dạ dày:
Mẫu dịch dạ dày có thể lấy từ dịch nôn của nạn nhân hay từ dịch hút rửa dạ dày. Mẫu dịch dạ dày chứa nhiều thức ăn, phân bố chất độc thường không đồng đều nên cần phải tiến hành lọc hay ly tâm trước khi phân tích.
Mẫu cũng nên được lấy sớm để có lượng chất độc lớn và không có chất chuyển hóa. Khi lấy từ dịch rửa dạ dày cũng nên lấy ngay ở phần đầu vì phần sau nồng độ chất độc thường loãng. Thể tích mẫu lấy khoảng 20mL và không thêm chất bảo quản.
Máu:
Mẫu máu, huyết tương cũng thường được dùng để phân tích chất độc. Ở người lớn, mẫu máu được lấy khoảng 10mL và đựng trong ống có heparin để chống đông. Khi lấy mẫu trong trường hợp nghi ngờ ngộ độc carbon monoxyd tránh để khoảng không khí phía trên ống đựng mẫu và sử dụng mẫu máu toàn phần (gồm cả huyết tương và huyết cầu) để định lượng.
Ngoài các mẫu trên trong phân tích độc chất người ta còn lấy các loại mẫu khác như phủ tạng (gan) hay các bộ phận khác của cơ thể (tóc, móng tay, xương…)
1.2. Chiết chất độc từ mẫu
Chọn dung mồi thích hợp để chiết chất độc ra khỏi mẫu. Tỷ lệ dung môi thường gấp 5-25 lần thể tích mẫu. Để tăng khả năng hòa tan của chất độc vào dung môi có thể dùng riêng rẽ hay phối hợp các biện pháp sau:
Xay với dung môi:
Thường được dùng khi mẫu cần phân tích là các tổ chức, mô hay thức ăn chứa chất độc. Cho mẫu và dung môi vào máy xay, xay trong 5-15 phút. Lấy riêng phần dung môi đã hòa tan chất độc ra.
Lắc với dung môi:
Có thể tiến hành với máy lắc hay lắc bằng tay với bình chiết. Phương pháp này có ưu điểm là có thể làm trong thời gian dài, dễ thực hiện nhiều lần.
Chiết liên tục bằng dung môi hay chiết siêu tới hạn: .
Có thể dùng một dung môi hay hỗn hợp dung môi để chiết Soxhlet. Nguyên tắc là dùng một lượng dung môi nhất định qua hệ thống hồi lưu để chiết nhiều lần chất cần thiết với dung môi luôn được làm nóng và mới.
Phương pháp chiết siêu tới hạn ngày càng được phát hiển với nhiều tính năng ưu việt.
1.3. Phân lập các chất độc
Rất nhiều chất hữu cơ là chất độc. Dựa vào đặc điểm lý hóa của chúng người ta chia các phương pháp phân lập thành các nhóm chính sau: các chất độc có thể phân lập bằng phương pháp cất; các chất độc không bay hơi phân lập bằng phương pháp chiết hai môi trường và các chất độc cần phương pháp tách riêng biệt.
Độc tính của các chất độc hữu cơ thường thể hiện bằng cả phân tử. Khi thay đổi một nhóm chức nào đó độc tính của phân tử cũng thay đổi (giảm độc tính hoặc ngược lại). Trái lại cả kim loại lần muối của nó thường đều mang tính độc nên trong phân tích chung chỉ cần tìm xem có thấy nguyên tố gây độc hay không. Vô cơ hóa là quá trình cần thiết trước khi phân tích kim loại trong mẫu thử vì các muối kim loại nặng thường có khả năng kết hợp với protein động vật hoặc thực vật tạo ra những hợp chất bền vững kiểu albuminat. Kết thúc quá trình vô cơ hóa các kim loại tôn tại dưới dạng lon trong dung dịch.
Các phương pháp phân lập các chất độc thường được dùng trong phân tích chất độc là:
- Vô cơ hóa và phân lập các kim loại.
- Phân lập các chất độc hữu cơ bay hơi bằng phương pháp cất và phương pháp cất kéo hơi nước.
- Chiết bằng dung môi hữu cơ các chất độc không bay hơi trong nước (hoặc cồn) được acid hóa (hoặc kiềm hóa).
Nguyên tắc của các phương pháp phân lập và cách tiến hành phân lập một sô chất độc sẽ được giới thiệu chi tiết trong các phần và chương tiếp theo.
1.4. Phân tích các chất độc
Trước hết làm các phản ứng định tính để xác định chất độc. Việc phát hiện ra loại chất độc là rất quan trọng giúp các nhà chuyên môn có phương hướng xử trí ngộ độc kịp thời, đúng hướng và hiệu quả. Việc định tính các chất độc thường dựa vào các tính chất lý hóa của chúng trong đó phản ứng tạo màu với các thuốc thử đặc trưng thường được sử dụng.
Hàm lượng chất độc trong mẫu được định lượng bằng phương pháp thích hợp. Thông thường các phương pháp phân tích dụng cụ có đủ độ nhạy được chọn để xác định hàm lượng các chất độc có trong mẫu. Một trong những phương pháp được ưu tiên chọn lựa do không yêu cầu thiết bị phức tạp, đắt tiền là phương pháp đo quang sau khi tạo màu hoặc chiết. Phương pháp này có thể áp dụng được với cả các chất độc vô cơ và hữu cơ. Tuy nhiên hạn chế của phương pháp là độ nhạy thấp và độ đặc hiệu không cao. Để giảm sai số do các tạp chất có trong mẫu gây ra, kỹ thuật định lượng vi sai cũng thường được triển khai.
Với các chất độc vô cơ, các phương pháp quang phổ nguyên tử (như AAS, ICP…) thường được áp dụng (sau khi mẫu được vô cơ hóa). Cực phổ cũng là một phương pháp được chọn lựa trong phân tích các chất độc vô cơ.
Với các chất độc hữu cơ, các phương pháp sắc ký lỏng, khí và lớp mỏng, điện di mao quản đều có thể triển khai để phân tích các chất độc. Đặc biệt là việc kết nối sắc ký khối phổ làm cho khả năng phân tích các chất độc tăng lên một cách rõ rệt.
2. Vô cơ hóa và phương pháp phân lập các kim loại
Vô cơ hóa là quá trình oxy hóa đốt chay chất hữu cơ để giải phóng kim loại dưới dạng ion. Trong một số trường hợp, quá trình vô cơ hóa không đốt cháy hoàn toàn được chất hữu cơ thành H20, CO2 mà chỉ tạo ra được các hợp chất đơn giản hơn, kém bền vững hơn, dễ dàng bị phá hủy hơn. Các phương pháp vô cơ hóa phổ biến là vô cơ hóa khô (hay phương pháp đốt) và vô cơ hóa ướt (dùng acid với các tác nhân oxy hóa khác nhau).
Mẫu thử trong độc chất có thể là máu, nước tiểu, thực phẩm,… Nếu mẫu thử là máu, nước tiểu thì phải đong nước, nếu cần có thể cho thêm một ít natri carbonat rồi cô đến khô trên cách thủy. Nếu mẫu thử rắn như thức ăn, phủ tạng,.. thù phải nghiền nhỏ. Mẫu thử có cồn thì phải loại cồn bằng cách đun cách thủy ở nhiệt độ thấp (40-50°C) để tránh gây nổ khi vô cơ hóa bằng hỗn hợp HCl và KClO3
2.1. Phương pháp vô cơ hóa ướt
2.1.1. Vô cơ hóa bằng clor mới sinh
Phương pháp này sử dụng hỗn hợp HCl và KClO3 để tạo ra clor mới sinh theo nguyên tắc: KClO3+ 6HCl —» KCl + 3Cl2 + 3H2O
Clor mới sinh tác dụng với nước tạo ra oxy nguyên tử sẽ phá hủy chất hữu cơ chuyển hóa thành CO2 và H2O, các kim loại được giải phóng dưới dạng muôi clorid:
Cl2+ H2O ⇔ 2HCl + O
Trong thực tế phương pháp này ít được dùng vì nó có nhiều nhược điểm như: thời gian vô cơ hóa tương đối dài, mất nhiều thời gian đuổi clor dư; vô cơ hóa không được hoàn toàn và có thể gây mất mát một số nguyên tố như: As, Hg, Pb, Cu…
2.1.2. Vô cơ hóa bằng chất oxy hóa mạnh trong acid sulfuric
Trong phương pháp này, người ta dùng hỗn hợp của H2SO4 với các chất oxy hóa mạnh như HNO3, HClO4, H2O2, muối nitrat… Nhiều người cho rằng dùng hỗn hợp của H2SO4 và HNO3 là thích hợp hơn cả.
Vô cơ hóa bằng hỗn hợp H2SO4 và HNO3 (phương pháp sulfonitric):
Hiện nay phương pháp sulfonitric là phương pháp dùng phổ biến nhất để vô cơ hóa. Phương pháp thuận lợi để phân tích đa số các kim loại độc trong mẫu thử hữu cơ.
Vai trò của acid sulfuric và nitric là oxy hóa các chất hữu cơ. Acid sulfuric có thế năng oxy hóa thấp thể hiện vai trò oxy hóa trước. Nhưng sau khi mẫu thử bị mất nước nên nhiệt độ sôi của hỗn hợp được tăng lên và làm tăng tác dụng oxy hóa của acid nitric. Ngoài ra, acid sulfuric còn làm biến dạng các phân tử của các chất trong mẫu thử. Ở giai đoạn sau, khi nồng độ acid sulfuric tăng đến 67-70% và nhiệt độ của hỗn hợp cao hơn 110°C thì acid sulfuric cũng tham gia trực tiếp vào việc oxy hóa các chất hữu cơ. Cơ chế oxy hóa của hỗn hợp này có thể giải thích theo các phản ứng sau:
H2SO4 ⇒ H2SO3 + O
H2SO3 ⇒ SO2 + H2O
2HNO3 ⇒ H2O + 2NO + 3O
2NO ⇒ N2 + 2O
Qúa trình vô cơ hóa các chất hữu cơ với sự tham gia của acid sulfuric và nitric không tránh khỏi các phản ứng phụ kèm theo. Ví dụ acid sulfuric, đặc biệt khi nhiệt độ thấp và nồng độ cao (xấp xỉ 100%) sẽ sulfua hóa chất hữu cơ, còn acid nitric đặc biệt trong sự có mặt của lưu huỳnh sẽ nitro hóa chúng.
Người ta cho khoảng 100g mẫu thử vào 75mL hỗn hợp đồng lượng nước, H2SO4 và HNO3, đun nhỏ lửa. Quá trình phá hủy chất hữu cơ qua hai giai đoạn:
– Giai đoạn làm nhuyễn khoảng 30- 40 phút. Không được đun mạnh để tránh trào làm mất mẫu. Kết thúc giai đoạn này sẽ thu được chất lỏng trong suốt màu vàng hoặc nâu.
– Giai đoạn hai: đặt bình vô cơ hóa trực tiếp trên lưới và đốt, chú ý không để cháy đen. Cho từ từ HNO3 vào (tránh cho nhiều HNO3 gây lãng phí và độc hại). Đốt tiếp tục khoảng 3-4 giờ cho đến khi thu được chất lỏng trong suốt, không màu hoặc vàng nhạt.
Khi có khói SO2 màu trắng xuất hiện, quá trình vô cơ hóa kết thúc. Nếu có mặt các ion màu (Cu2+, Cr3+…) thì dịch vô cơ hóa sẽ có màu, có mặt các ion Pb2+, Ca2+, Ba2 sẽ có kết tủa lắng xuống đáy bình sau khi pha loãng băng nước.
Ưu điểm của phương pháp: Thời gian phá hủỵ hoàn toàn chất hữu cơ tương đôi ngắn; độ nhạy cao đối với nhiều cation so với một số phương pháp vô cơ hóa khác; thể tích dịch vô cơ hóa thu được tương đối nhỏ.
Nhược điểm của phương pháp là có thể làm mất một lượng đáng kể mẫu dễ bay hơi như các hợp chất chứa thủy ngân (cần dùng phương pháp khác).
Vô cơ hóa bằng hỗn hợp acid sulfuric, nitric và percloric:
Phương pháp vô cơ hóa bằng hỗn hợp acid sulfuric, nitric và percloric đầu tiên được sử dụng ra để vô cơ hóa mẫu thử khi tìm các hợp chất của arsenic và kim loại nặng. Hiện nay phương pháp vô cơ hóa này cũng được sử dụng rộng rãi cùng với phương pháp sulfonitric.
Tác dụng oxy hóa của acid percloric thể hiện chủ yếu ở giai đoạn cuối của quá trình vô cơ hoá. Khi nhiệt độ lên cao (trên 200°C) làm tăng khả năng oxy hóa để phá hủy chất hữu cơ của acid percloric. Cơ sở của phương pháp là các phản ứng sau:
2HNO3 ⇒ NO2 ↑ + H2O2
H2SO4 ⇒ SO2 ↑ + H2O2
HClO4 ⇒ Cl2O6+ H2O2
Người ta thêm vào bình vô cơ hóa có chứa sẵn mẫu 25 mL acid nitric đặc, 25 mL acid sulfuric đặc và 35 mL acid percloric 37% (hoặc 42%). Sự oxy hóa chất hữu cơ diễn ra khi tăng dần nhiệt độ. Khi dịch vô cơ hóa bị đen lại (do hóa than) thì thêm từ từ acid nitric đậm đặc. Sự than hóa sấp tăng lên thể hiện trên bề mặt chất lỏng xuất hiện hơi anhydric percloric thì ngừng đun hoặc đun rất nhẹ và thêm từng giọt dung dịch acid nitric 35-45%. Khi dịch vô cơ hóa trong suốt thì kiểm tra độ hoàn toàn của quá trình oxy hóa.
Để kiểm tra sự hoàn toàn của quá trình vô cơ hóa, người ta lấy vài giọt dịch vô cơ hoá, để nguội rồi pha loãng với nước. Thêm vài giọt dung dịch amoniac 25%. Nếu quá trình oxy hóa kết thúc thì dung dịch sẽ có màu vàng nhạt, không được có màu da cam (phản ứng cua mọt so acid amin kho oxy hóa như phenylalanin, tyrosin, tryptophan). Nếu dịch vô cơ hóa có crom thì khi kết thúc phản ứng có sự thay đổi màu từ xanh lá cay sang vàng do Cr3+ bị oxy hóa thành Cr6+.
Ưu điểm của phương pháp này là: oxy hóa được gần như hoàn toàn các chất hữu cơ (99%); oxy hóa được đa số các ion nhiều hóa trị đến hóa trị cao nhất; rút ngắn được 2,5-3 lần thời gian so với phương pháp vô cơ hóa sulfonitric; tốn ít tác nhân oxy hóa; thể tích dịch vô cơ hóa nhỏ.
Cũng như phương pháp sulfonitric, nhược điểm của phương pháp là làm mất một lượng lớn thủy ngân.
Vô cơ hóa bằng hỗn hợp NH4NO3 và H2SO4 :
Amoni nitrat trong acid sulfuric cũng tạo thành acid nitric nên cơ chế cũng tương tự như dùng hỗn hợp H2SO4 và HNO3 nhưng có ưu điểm là đỡ nguy hiểm cho người làm việc.
Vô cơ hóa bằng hỗn hợp H2O2 và H2SO4:
Cơ sở của phương pháp là: H2O2 ⇒ H2O + O
Nghiền nhỏ mẫu thử cho vào bình vô cơ hóa, thêm acid sulfuric đặc vào bình cho ngập mẫu thử. Đun nóng từ từ, chất hữu cơ sẽ tan ra thành chất lỏng sẫm màu. Thêm từng giọt nước oxy già khi chất lỏng sẫm màu trở lại. Cứ thế tiếp tục cho đến khi thu được chất lỏng trong suốt có khói SO2 màu trắng thì ngừng đun.
Phương pháp vô cơ hóa này có ưu điểm nổi bật là ít toả khí độc. Nhược điểm cơ bản của phương pháp này là giá thành cao.
2.2. Phương pháp vô cơ hóa khô
Để vô cơ hóa theo phương pháp này người ta tiến hành nung mẫu thử với một số muối có tính oxy hóa ở dạng bột như: KNO3, NH4NO3 , có thể trộn thêm than. Người ta cũng có thể vô cơ hóa bằng cách đốt đơn giản.
Đốt vơi hỗn hợp Na2CO3 và NaNO3:
Phương pháp vô cơ hóa này ít được sử dụng vì chỉ thực hiện được với lượng mẫu thử nhỏ (5-10g). Một số kim loại khi đốt ở nhiệt độ cao sẽ bị mất.
Thường thường phương pháp này hay được dùng để bổ sung cho phương pháp “clor mới sinh” để tìm As5+, Ag+… Có thể tìm một số chất độc trong mọt khối lượng nhỏ mẫu thử như tìm arsenic trong nước tiểu, tóc, móng tay…
Đốt đơn giản:
Phương pháp này ít được dùng, có thể dùng để xác định sự có mặt các muối: bismuth, kẽm, đồng, mangan, acid fluosilicic, các iodid.
2.3. Phương pháp loại chất oxy hóa khỏi dịch vô cơ hoá
Không phụ thuộc vào phương pháp tiến hành vô cơ hoá, chất lỏng thu được sau khi vô cơ hóa trong đa sô trường hợp đều chứa một lượng chất óxy hóa thừa gây cản trơ cho việc tiên hành phân tích tiếp theo. Cho nên việc loại chất oxy hóa khỏi dịch vo cơ hoá là cần thiết.
Chất lỏng thu được sau khi vô cơ hóa băng acid nitric, acid sulfunc thường có chứa nitrogen oxyd và vết acid nitric. Xác định sự có mặt của các chất này bằng phản ứng với dung dịch diphenylamin cho hợp chất màu xanh. Có thể loại chất oxy hóa thừa bằng các cách sau:
- Dùng formaldehyd: Đun nóng dịch vô cơ hóa tới 110 – 150°C, thêm vài giọt formol, thỉnh thoảng khuấy trộn sẽ xuất hiện khí màu nâu (NO và N2). Thường chuyển sang màu da cam (NO bị oxy hóa bởi oxy không khí thành NO2). Formaldehyd thừa sẽ loại bằng cách đun nóng 5-10 phút hoặc thêm vào dung dịch vài giọt H2O2.
- Dùng ure: Đun dịch vô cơ hóa thu được đến nhiệt độ 135 – 145°c, thêm một ít bột ure (tránh thừa), khuấy đều: 2HNO2 + NH2-CO-NH2 = CO2 + 2N2 + 3H2O, ure thừa sẽ bị acid sulfuric nóng phân hủy.
- Dùng natri sulfit: Đun dịch vồ cơ hóa khoảng 30 – 40 phút, thêm nước cho tới khi đạt nồng độ acid sulfuric 40-50%. Đun tới 110°c và thêm từ từ dung dịch natri sulfit rồi khuấy đều. Loại SO2 thừa bằng cách đun nóng hoặc bằng H2O2.
3. Phân lập các chất độc hữu cơ bằng cất kéo hơi nước
3.1. Cơ sở của phương pháp cất kéo hơi nước
Phương pháp cất kéo hơi nước là một kỹ thuật cơ bản của phòng thí nghiệm để phân lập các chất độc hữu cơ dễ bay hơi từ mẫu phân tích. Cơ sở của phương pháp như sau:
Khi đun hỗn hợp hai chất không hoà tan vào nhau thì áp suất hơi riêng phần của chúng tăng lên và không phụ thuộc vào nhau. Khi tổng áp suất hơi riêng phần trên bề mặt hỗn họp bằng áp suất khí quyển thì hỗn hợp đó sôi. Như vậy mỗi chất ở trong hỗn họp sẽ sôi ở nhiệt độ thấp hơn nhiệt độ sôi của nó.
Ví dụ hỗn hợp hai chất A và B có khối lượng phân tử là MA và MB. Áp suất hơi trên bề mặt hỗn họp P bằng tổng áp suất hơi riêng phần của A và B là PA và PB.
Giả thiết hỗn hợp khí tuân theo định luật khí lý tưởng, áp dụng phương trình Clapeyron-Mendeleev: P.V= v.R.T = (m/M).R.T (trong đó v là số mol khí, m và M là khối lượng và khối lượng mol của khí) thì:
PA= (mA/ MA) x (RT/V)
PB = (mB/ MB) x (RT/V)
mA và mB là khối lượng tính bằng g của khí A và B trong hỗn hợp.
Có thể tính được tỉ lệ phần trăm C (%) khối lượng cảu A và B trong pha hơi:
CA = (PA MA)/(PA MA + PBMB) x100
CB (%) = (PBMB /PA MA + PBMB) x100
Khối lượng các chất trong pha hơi phụ thuộc vào áp suất hơi riêng phần của chúng. Nếu A là chất cần phân lập và B là dung môi, muốn tỷ lệ A càng nhiều trong pha hơi, thì PB và mB càng nhỏ càng tốt. Do vậy người ta thường dùng nước làm dung môi vì áp suất hơi của nước nhỏ.
Dụng cụ cất kéo hơi nước gồm ba phần chính:
- Bình sinh hơi làm bàng đồng hoặc thép không gỉ (1).
- Bình đựng mẫu thử (2) đặt trong nồi cách thủy (3).
- Ống sinh hàn (4) ngưng tụ pha hơi đưa vào bình chứa mẫu (5).
Mẫu thử được xay nhỏ nếu cần thiết, rồi cho vào bình (2). Thêm nước cất để có hỗn hợp sền sệt như cháo. Sau khi đun sôi bình (1), nhanh chóng acid hóa mẫu thử bằng acid tartric hoặc acid oxalic 10% (thử bằng giấy quì xanh, không dùng acid vô cơ để vô cơ hóa vì có thể gây ra sự phá hủy một số chất độc). Sau đó cho bình (2) vào nôi cách thủy và nối với bình sinh hơi (1). cất nhỏ lửa để bốc hơi từ từ.
3.2. Cách lấy mẫu để phân tích các chất độc từ dịch cất được
Nếu chất độc trong mẫu thử đã xác định được thì lấy ngay dịch cất để phân tích. Nếu chưa xác định được chất độc cụ thể thì tần lấy riêng dịch cất vào nhiều bình theo các cách lấy và thể tích khác nhau. Ví dụ:
Theo Svaicova: dịch cất được hứng vào bốn bình:
- Bình 1 (có sẵn 2 mL dung dịch NaOH 5%), cất lấy 15mL để xác định cyanid và một số chất khác.
- Sau đó cất tiếp vào ba binh khác, mỗi bình lấy 25- 50 mL.
Nếu thấy kết quả dương tính với chất nào thì cất cho đến khi không còn phản ứng chất đó trong dịch cất.
Thứ tự phân tích như sau: dùng dịch cất ở bình một để xác định cyanid và dẫn xuất halogen mạch thẳng (cloral hydrat, carbon tetraclorid), methanol, ethanol, aldehyd, benzen, anilin, phenol… Các dịch cât ở các bình sau dùng để kiểm tra lại khi cần.
Theo Kohn-Abrest:
Tiến hành với 300g mẫu thử để lấy 300mL dịch cất. Nhận xét màu, mùi dịch cất. Lấy khoảng 50 mL (1/6) dịch cất để tìm dẫn xuất halogen mạch thẳng, cloral hydrat, crezol, phenol.
Phần còn lại cất lần thứ hai lấy 100mL. Sau đó cất thêm lần thứ ba lấy 35mL. Lấy nửa dịch cất lần cuối để xác định cyanid, phenol, cloroform, formol, benzen, nửa còn lại xác định rượu.
4. Phương pháp chiết bằng dung môi hữu cơ
4.1. Nguyên tắc chung chiết xuất chất độc hữu cơ
Chiết là một quá trình đặc biệt phân bố một chất giữa hai pha lỏng không trộn lẫn vào nhau, thương la giữa các dung môi hữu cơ và nước. Để chiết xuất người ta thêm vào nước một dung môi thực tế không tan hoặc ít tan trong nước. Để tăng tốc độ phân bố chất tan giữa hai chất lỏng người ta lắc hỗn hợp. Khi lắc hai chất lỏng phân tán vào nhau. Tuy nhiên quá trình lắc cũng phải ở mức độ thích họp để quá trình phân bố chất độc giữa hai pha và việc phân pha được thuận lợi. Khi đạt đến trạng thái cân bằng, ngưng lắc, để hai chất lỏng lại được phân chia và tách riêng dung môi chiết.
Hiệu suất chiết chất độc từ một mẫu thử phụ thuộc vào nhiều yếu tố. Tuỳ tính chất của chất độc và đặc điểm của mẫu thử người ta chọn điều kiện chiết thích hợp.
Quá trình chiết thường bao gồm các giai đoạn sau:
Xử lý sơ bộ mẫu thử:
Có nhiều mẫu thử không phải qua giai đoạn này mà được chiết thẳng bằng dung môi hữu cơ như đa số các trường hợp mẫu nước tiểu hay xác định dư lượng một số thuốc trừ sâu trong thực phẩm…
Giai đoạn này tạo điều kiện cho chất độc có thể dễ dàng chuyển sang dung môi hữu cơ hơn. Ví dụ chất độc nằm ở dạng liên kết với protein thì cần thủy phân cắt dây nôi đó như: chiết morphin trong nước tiểu cần thủy phân trong dung dịch acid hydrocloric. Khi chất độc nằm trong một khối lượng mẫu thử quá lớn cân qua giai đoạn này để tách sơ bộ băng dung môi thích hợp nhằm làm giầu chất phân tích như: cồn – acid, nước – acid…
Chọn điều kiện cho quá trình chiết xuất:
Sau khi xử lý sơ bộ mẫu thử, chất độc được chuyển vào dung dịch nước. Bước tiếp theo cần chọn được pH, loại dung môi chiết và thể tích thích họp.
Các chất độc hữu cơ thường gặp hầu hết có tính acid hoặc base yếu. Vì vậy giai đoạn đầu chiết ở pH acid nhẹ (thử với giấy quỳ) thường dùng các acid hữu cơ để acid hoá. Ở pH này chiết được tất cả các acid yếu thường gặp. Sau đó đưa pH sang vùng kiềm nhẹ bằng cách kiềm hóa với amoniac hoặc natri hydrocarbonat. Ở pH này, chiết được hàu hết các alcaloid và base tổng hợp.
Dung môi hữu cơ thường dùng có thể là ether hoặc cloroform. Ether hoà tan được nhiều chất nhưng có nhược điểm là bay hơi quá nhanh, dễ bắt lửa. Cloroform cũng là dung môi tốt, có tỷ trọng lớn hơn so với nước nên dễ tách pha nhưng có nhược điểm là dễ tạo nhũ dịch.
Quá trình chiết để xác định chất độc thường được tiến hành ở cả môi trường acid và môi trường kiêm. Việc chiết xuất ở môi trường acid có thể sẽ có nhiều tạp chất. Tuy nhiên nếu chất phân tích không chiết ở môi trường này thì vẫn nên loại bỏ bớt tạp chất bằng cách chiết qua pH acid trước khi chiết ở môi trường kiềm.
Loại tạp chất:
Dịch chiết ether hoặc cloroform thường có nhiều tạp chất nên việc loại bớt tạp chất có trong dịch chiết là cần thiết. Có nhiều cách để thực hiện quá trình này như:
– Cho qua cột than hoạt tính hoặc cột ionit.
– Thăng hoa để lấy chất độc (barbiturat).
– Chiết lại từ dung môi bằng dung dịch nước acid (để lấy base yếu) hoặc dung dịch nước kiềm (để lấy acid yếu).
4.2. Một số phương pháp chiết chất độc
4.2.1. Chiết bằng dung môi
Chiết bằng dung môi (solvent extraction, SE) là kỹ thuật sử dụng dung mồi hữu cơ để chiết chất phân tích từ mẫu đã làm nhỏ. Thồng thường, các mẫu rắn có thể được đồng nhất trước khi chiết bằng phương pháp nghiền, xay, trộn… Một phần mẫu được xay hoặc lắc với dung môi hữu cơ sau đó cho thêm natri sulfat khan đê loại nước (có trong mẫu). Tỷ lệ giữa mẫu và dung môi có thể thay đổi tùỵ theo từng loại nên mẫu. Thông thường, 50 mL dung mồi có thể được sử dụng để chiết khoảng 5-10g mẫu. Có thể sử dụng một số tác nhân vật lý hỗ trợ như lắc cơ học, khuấy trộn siêu tốc, sóng siêu âm…
Trong kỹ thuật chiết bằng dung môi, yếu tố cần quan tâm nhất là độ phân cực của dung môi phải phù hợp với chất phân tích. Khi cần thiết phải phối hợp các loại dung môi đế thay đổi độ phân cực, độ nhớt, lực dung môi.
Chiết với sự hỗ trợ của vi sóng (Microwave-assisted extraction, MAE) là phương pháp chiết bằng dung môi có sự hỗ trợ của vi sóng. Năng lượng vi sóng giúp hỗ trợ, đẩy nhanh quá trình hòa tan các chất phân tích từ mẫu vào dung môi chiết. Trong quá trình chiết, thể tích dung môi cần phải ngập mẫu nhưng không quá nhiều vì có thể ảnh hưởng đến tác động của vi sóng đến mẫu.
Chiết Soxhlet là một phương pháp chiết bằng dung môi, trong đó dung môi mới nóng sẽ tiếp xúc với mẫu theo đợt và giúp chiết kiệt chất phân tích trong mẫu đã làm nhỏ. Dung môi chiết được chọn theo tính chất của chất độc cần phân tích. Có thể là hỗn hợp aceton với hexan hoặc với ether dầu hỏa. Aceton thường được sử dụng do đồng tan với nước, có điểm sôi thấp làm giảm nhiệt độ sôi và tăng khả năng thấm vào mẫu.
4.2.2. Chiết siêu tới hạn
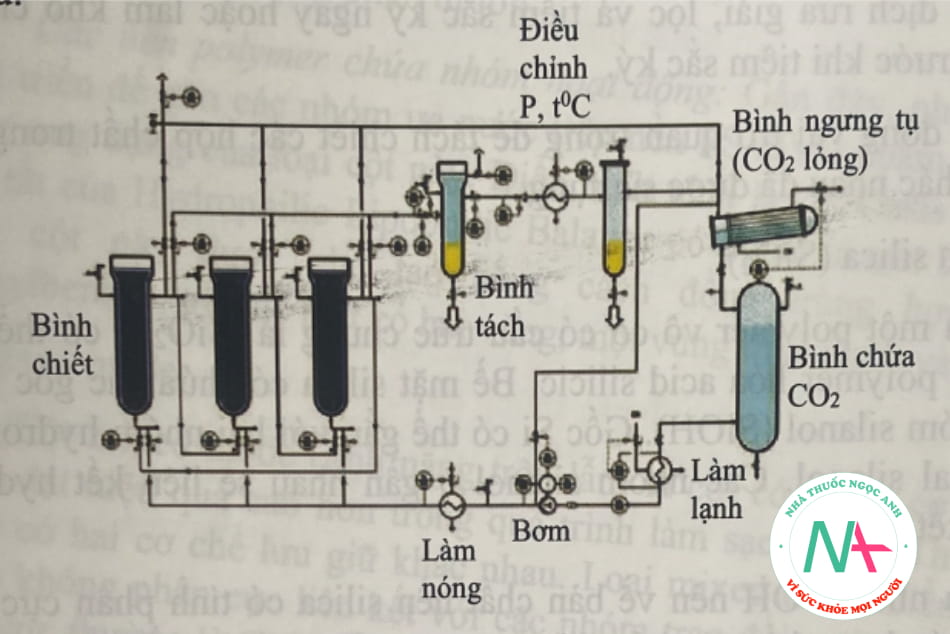
Chiết siêu tới hạn (Supercritical-fluid extraction, SFE) là phương pháp chiết bằng dung môi đặc biệt ở trạng thái siêu tới hạn. Một chất sẽ ở trạng thái siêu tới hạn khi có nhiệt độ và áp suất cao hơn giá trị tới hạn. Ở trạng thái siêu tới hạn, các chất không con ở thể lỏng nhưng vẫn chưa thành thể khí.
Trong chiết siêu tới hạn, CO2 thường được sử dụng vì có thể dễ dàng đạt được nhiệt độ và áp suất tới hạn. Giá trị nhiệt độ và áp suất tới hạn của CO2 là 31°c và 73 atm. Ngoài ra, đây là họp chất có giá thành rẻ, bền về mặt hóa học, không độc không cháy, độ nhớt thấp, độ tinh khiết cao, khả năng khuếch tán cao, dễ loại ra khỏi dịch chiết và có thể pha vào các dung mội khác. Tuy nhiên, coi là chất kém phân cực do đó không phù họp để chiết các chất phân cực.
Quá trình chiết gồm các bước như hình 2.1:
– Mẫu được nạp vào bình chiết.
– Dòng CO2 lỏng qua bình ngưng tụ rồi đến bơm nén và bộ gia nhiệt. Khi đạt nhiệt độ và áp suất CO2 chuyển sang trạng thái siêu tới hạn.
– Dòng CO2 siêu tới hạn vào bình chiết. Các chất theo CO2 đến bình tách.
– Điều chỉnh nhiệt độ và áp suất thích hợp, CO2 chuyển về dạng khí, sản phẩm sẽ lắng xuống, thu riêng.
– CO2 dạng khí có thể được nén lạnh, hóa lỏng và đưa trở lại bình chứa cho các lần phân tích sau.
4.2.3. Chiết pha rắn
Chiết pha rắn (Solid phase extraction, SPE) là một phương pháp chiết dựa vào sự phân tán của chất phân tích giữa hai pha lỏng và răn, trong đó các chât được chiết từ pha lỏng vào pha rắn. Pha rắn thường là các hạt nhỏ, xốp được đóng vào các ống nhỏ. Pha lỏng chảy qua ống, các chất phân tích tương tác với pha rắn sẽ được giữ lại trên ống. Các chất này được rửa giải khỏi pha rắn băng một dung môi khác phù họp. Thông thường thể tích dung môi rửa giải nhỏ hơn nhiều so với thể tích dịch ban đầu. Vì thế qua SPE ngoài tác dụng làm sạch có thể kết hợp với việc làm giàu mẫu. Ngoài ra, người ta có thể sử dụng luồng khí nóng đê rửa giải các chất từ pha rắn, đây là cách thuận tiện để chuyển các chất vào phân tích trên sắc ký khí.
Hiện nay, người ta có thể thực hiện chiết cùng lúc vài chục mẫu thậm chí có những thiết bị có thể thực hiện chiết tự động hoặc dịch chiết được kết nối online với hệ thống sắc ký.
Quá trình chiết pha rắn đầy đủ trải qua bốn giai đoạn:
- Hoạt hóa cột chiết: Cho dung môi phù hợp đi qua pha rắn để làm ướt các nhóm hoạt động, đồng thời loại bỏ khí trong cột và thay thể vào đó là dung môi.
- Nạp mẫu: Trước khi nạp mâu vào cột, nếu cần phải xử lý mẫu sơ bộ để đưa mẫu vào môi trường phù hợp sao cho lưu giữ được toàn bộ chất phân tích trên cột. Chất phân tích cùng một số chất khác được giữ lại trên cột, các tạp chất đi ra khỏi cột càng nhiều càng tốt để tránh cạnh tranh và ảnh hưởng đến quá trình tương tác của chất phân tích với pha tĩnh.
- Rửa tạp chất: Sau khi nạp mẫu, trên cột vẫn còn nhiều tạp chất khác có liên kết với pha tĩnh. Phải chọn được dung môi rửa tạp sao cho có thể hòa tan và kéo được các tạp chất khỏi cột mà không kéo theo chất phân tích.
- Rửa giải: Chất phân tích lưu giữ trên cột được hòa tan và kéo ra khỏi cột bằng một dung môi phù hợp. Cần phải tối ưu loại dung môi, pH dung môi, thể tích dung môi, tốc độ rửa giải… để có thể rửa giải được tối đa chất phân tích nhưng rửa giải tối thiểu các tạp chất còn trên cột.
Thu lấy dịch rửa giải, lọc và tiêm sắc ký ngay hoặc làm khô chuyển sang dung môi phù hợp trước khi tiêm sắc ký.
Pha rắn đóng vai trò quan trọng để tách chiết các họp chất trong SPE. Có nhiều loại pha rắn khác nhau đã được sử dụng:
Pha rắn nền silica (SiO2):
Silica là một polymer vồ cơ có cấu trúc chung là (SiO2)x có thể được tạo thành nhờ quá trình polymer hóa acid silicic. Bề mặt silica có chứa các gốc hydroxyl (-OH) còn gọi là nhóm silanol (SiOH). Gốc Si có thể gắn với hai nhóm hydroxyl để tạo thành nhóm germinal silanol. Các nhóm silanol ở gần nhau sẽ liên kết hydro tạo ra nhóm silanol dạng kết họp.
Vì chứa nhóm -OH nên về bản chất nền silica có tính phân cực mạnh, dễ dàng liên kết với các họp chất có tính phân cực cao. Tuy nhiên nền silica đơn thuần dễ bị nhiêm các tạp chất, đặc biệt là nước. Khi liên kết với nước, các gôc hoạt động trên nên sẽ bị bất hoạt làm mất tác dụng hấp phụ. Vì có bản chất phân cực nên silica không thể dùng cho các chất kém và không phân cực. Do đó, các nhóm silanol được gắn thêm các nhóm chức hữu cơ khác nhăm tăng độ bền, điêu chỉnh tính phân cực hoặc bổ sung một số đặc tính đặc biệt. Tùy theo đặc tính của pha liên kết mà có thể chia thành các loại pha đảo, pha thuận và trao đổi ion.
Trong các loại cột SPE có nền silica, C18 là loại cột được sử dụng phổ biến nhất do tính sẵn có, ổn định và khả năng ứng dụng rộng. Tuy nhiên, C18 là loại cột không chọn lọc, do đó hiệu quả làm sạch không thực sự tốt.
Pha rắn florisil (magnesi silicat):
Magnesi silicat (MgSiO3) là các loại hạt có đường kính từ 25 – 200 μm, kích thước thông thường từ 60-100 μm. Đây là loại chất hấp phụ ít phân cực và tính acid yếu hơn so với silica. Vì có bản chất phân cực yêu nên florisil thường được dùng cho các chất độc rất phân cực, những chất mà không thể sử dụng cột silica do liên kết quá mạnh với các nhóm silanol.
Pha rắn graphite carbon (than chì):
Nền than chì cũng đã được một số tác giả nghiên cứu làm pha rắn trong SPE Than chì là chất kỵ nước bởi vì câu trúc bao gồm các lớp carbon phẳng dạng lục giác. Bề mặt có dạng xốp, cũng có các nhóm hoạt động như nhom hyroxyl, nhóm carbonyl và các nhóm acid vì thế có thể hấp phụ các chất khác. Bề mặt này cung có thể gắn các nhóm tương tự như đối với nền silica. Tuy nhiên, đa số các ứng dụng chủ yếu dựa vào bản chất kỵ nước của than chì. Điểm bất lợi nhất của nền than chì là bản chất kỵ nước quá mạnh. Do đó, đối với các chất độc không phân cực hoặc có khối lượng phân tử lớn hay các chất có vòng thơm thường thu được hiệu suất thu hồi thấp.
Pha rắn nền polymer hữu cơ tồng hợp:
Các loại nền có bản chất tự nhiên dễ bị ảnh hưởng bởi môi trường, có thể bị bất hoạt bởi các yếu tố bên ngoài như không khí, nước, pH. Để thay thế, ngaỵ naỵ người ta sử dụng các loại nền polymer hữu cơ tổng họp trên cơ sở trùng hợp một số chất hữu cơ. Những chất này có diện tích bề mặt lớn, dung lượng hấp thu lớn vì tỷ lệ carbon cao hơn và bề mặt kỵ nước hơn. Hơn nữa, khoảng pH làm việc rộng hơn so với nên silica.
PS-DVB: Nền PS-DVB thu được khi đồng trùng họp styren và divinyl benzen, có diện tích bề mặt lớn nên dung lượng của cột rất cao, hoạt động ở bất kỳ khoảng pH nào vì không có nhóm silanol. Đây là pha rắn thích họp cho các chất kém phân cực, không phân cực có khối lượng phân tử lớn.
Các nền polymer chứa nhóm hoạt động: Gần đây, nhiều tác giả đã nghiên cứu phát triển để gắn các nhóm ưa nước trên nền PS-DVB nhằm tăng tính chọn lọc và khả năng ứng dụng của loại cột này. Điển hình nhất là cột Oasis HLB® của Waters. HLB viêt tăt của Hydrophilic Lipophilic Balance có nghĩa là cân bằng thân nước, thân dầu. Loại cột này được chế tạo bằng cách đồng trùng hợp N-vinylpyrrolỵdon và divinylbenzen, trên bề mặt có hai vùng, một vùng thân nước và một vùng thân dầu.
Mixed mode:
Cột mixed mode (tính năng trộn lẫn) là cột có nhiều cơ chế lưu giữ khác nhau, nhằm đạt hiệu quả cao hơn trong quá trình làm sạch mẫu. Thông thường, cột mixed-mode có hai cơ chế lưu giữ khác nhau. Loại mixed mode điển hình nhất có chứa các nhóm không phân cực liên kết với các nhóm trao đổi cation hoặc anion. Nhóm không phân cực thường là 08 hoặc PS-DVB. Nhóm trao đổi ion có thể là trao đổi ion dương (như RSO3 ) hoặc trao đổi ion âm (như RNH4+).
Ái lực miễn dịch:
Chiết bằng ái lực miễn dịch (IAC) dựa trên liên kết kháng nguyên – kháng thể trong đó một loại imunoglobulin được dùng để gắn với chất phân tích Bởi vì imunoglobulin liên kết chọn lọc với chất kháng nguyên dùng để sản xuất rà nó nên đây là kỹ thuật rất chọn lọc để phân tích một chất hoặc một nhóm chất nào đó ứng dụng của IAC còn khá hạn chế do kỹ thuật này có ứng dụng hạn chế và khá tốn kém.
4.2.4. Chiết với hệ phân tán pha
Kỹ thuật tạo hệ phân tán pha rắn – mẫu thử (matrix solid phase dispersion MSPD) dựa trên việc trộn cơ học mẫu thử với pha rắn (ví dụ như C18, florisil, than hoạt tính…) trước khi nhồi vào cột chiết, sau đó dùng dung môi rửa giải chất phân tích từ hỗn hợp tạo thành. Trong kỹ thuật này, dung môi rửa giải chất đóng vai trò quan trọng để chiết được chất phân tích từ hỗn hợp với pha rắn. Nhiều loại dung môi đã được sử dụng như acetonitril, ethyl acetat, dicloromethan, hexan, mehtanol.
4.2.5. Vi chiết pha rắn
Vi chiết pha rắn (solid phase microextraction, SPME) là một kỹ thuật phát triển trên cơ sở của SPE. Chất phân tích trong mẫu được hấp phụ vào một pha rắn. Pha rắn được chế tạo bằng cách gắn vật liệu hấp phụ rắn, xốp lên bề mặt sợ silica hoặc sợi kim loại nhỏ. Sau khi cân bằng hấp phụ được thiết lập (2-30 phút), chất phân tích lưu giữ trên pha tĩnh được rửa giải bằng nhiệt và đưa sợi chiết vào máy sắc ký khí hoặc sắc ký lỏng.
Tùy thuộc vào cách lấy mẫu, người ta phân loại SPME: immersion SPME (loại nhúng) và headspace SPME (loại không gian hơi).
– Immersion SPME: Sợ chiết được nhúng trực tiếp và mẫu lỏng. Chất phân tích được hấp phụ vào pha rắn từ trạng thái pha lỏng. Kỹ thuật này phù hợp cho các chất khó bay hơi.
– Headspace SPME: Chất phân tích được hóa hơi trong một không gian kín, tạo cân bằng giữa pha lỏng và pha hơi. Sợi chiết được đưa vào phần không gian hơi. Chất phân tích được hấp phụ vào pha rắn qua từ trạng thái hơi. Kỹ thuật này phù hợp với chất dễ bay hơi. Cân bằng trong headspace SPME nhanh hơn trong immersion SPME do không có sự cạnh tranh của dung môi và headspace SPME cho ít tạp hơn.
Vật liệu hấp phụ phổ biến nhất là poly dimethylsiloxan (PDMS) có bề dày thay đổi khoảng từ 7 đến 100 μm. Quá trình cân bằng của chất phân tích giữa nước và màng PDMS phụ thuộc vào sự khuếch tán và hằng số phân bố của chất phân tích. Để độ chính xác và độ lặp lại cao, cần giữ cố định các thông số: thời gian hấp phụ, kích thước lọ mẫu, thể tích mẫu, độ sau cảu sợi SPME,… Ngày nay, đã có bộ phận ghép nối giữa SPME và hệ thống sắc ký thuận lợi cho việc phân tích tự động.
4.2.6. Vi chiết pha lỏng
Vi chiết pha lỏng (liquid phase microextraction, LPME) đã được phát triển trên cơ sở chiết lỏng lỏng và vi chiết pha rắn để giảm lượng dung môi sử dụng từ vài trăm mililit trong chiết lỏng lỏng vê vài microlit. LPME được thực hiện bằng cách đưa một lượng nhỏ (vài microlit) dung môi không đông tan trong nước vào dung dịch pha nước của mẫu có chứa chất phân tích. LPME có thể được chia thành ba loại chính:
- Vi chiết giọt đơn (single drop microextraction): Sử dụng giọt dung môi hữu cơ có thể tích từ 1-3 μL ở đầu của microsyringe và thực hiện tương tự như đối với vi chiết pha rắn. Kỹ thuật này cũng có hai hình thức: nhúng và không gian hơi.
- Vi chiết lỏng lỏng phân tán (dispersive liquid liquid microextraction): Trong kỹ thuật này, lượng nhỏ dung môi chiết (vài microlit) được trộn với một loại dung môi phân tán (vài mililit) sau đó trộn với dung dịch nước của mẫu có chứa chất phân tích. Dung môi phân tán có vai trò giúp tạo các giọt nhỏ của dung môi chiết. Chất phân tích được chiết vào các giọt này, sau đó, hỗn hợp được ly tâm để tách riêng dung môi chiết.
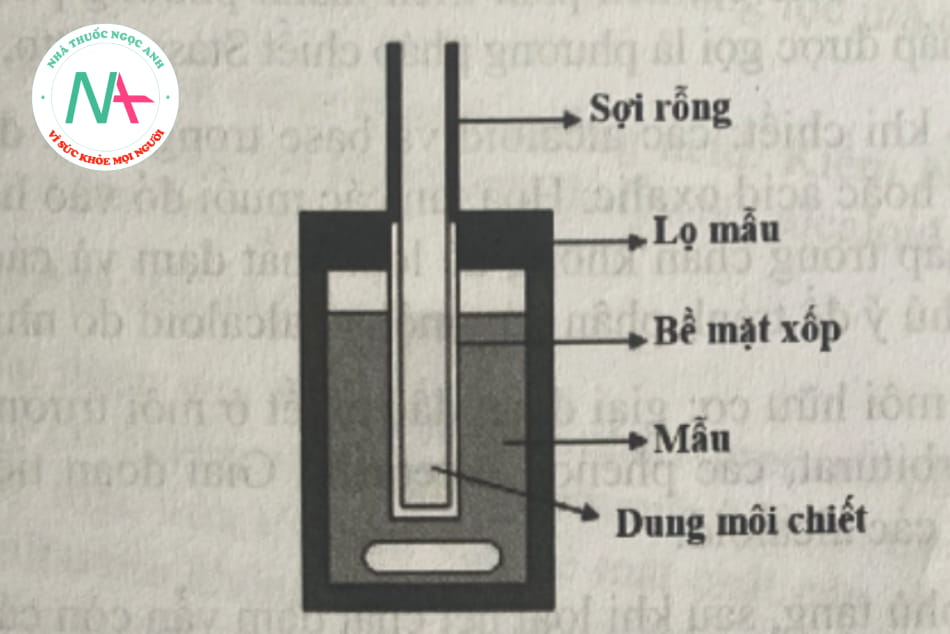
- Vi chiết sợi rỗng (hollow fiber microextraction): Sợi rỗng là một loại sợi có cấu tạo bề mặt xốp, tạo thành dạng ống (Hình 2.2). Đầu tiên, sợi được nhúng vào một dung môi hữu cơ. Dung môi hữu cơ thấm vào và lấp đầy các lỗ xốp trên bề mặt sợi rỗng. Dung môi chiết được đưa vào phía trong sợi. Khi nhúng sợi vào dịch mẫu quá trình vi chiết lỏng lỏng xảy ra từ pha chứa mẫu, đến pha hữu cơ ở lỗ xốp và đến pha trong sợi. Nếu dung môi chiết giống với dung môi ở lỗ xốp, đó là quá trình chiết hai pha. Nếu dung môi chiết khác với dung môi ở lỗ xốp, đó là quá trình chiết ba pha.
4.3. Các phương pháp loại tạp dịch chiết
Tuỳ tính chất của chất độc có thể sử dụng các phương pháp khác nhau để loại tạp cho dịch chiết.
Phương pháp chiết lại:
Các chất độc có tính acid tan trong dung môi khi chiết ở môi trường acid thì chuyển thành muối tan trong nước bằng cách lắc dịch chiết với dung môi NaOH. Lấy lớp nước, acid hóa và chiết lại bằng ehter vài lần.
Dịch chiết ở môi trường kiềm thì lắc vài lần với dung dịch acid nước. Lấy phần nước gộp lại và kiềm hóa rồi chiết bằng dung môi vài lần. Có thể làm nhiều lần như vậy để loại tạp trong dịch chiết.
Phương pháp trao đổi ion:
Trước khi định lượng alcaloid có thể tinh khiết hóa bằng cách cho dung dịch nước của muối alcaloid qua cột cationid được giữ lại ở cột.
Cho khoảng 2g chất trao đổi ion cellulose đã oxy hóa vào cột dài 5cm, đường kính 1cm. Lấy 1-5mL dung dịch muối alcaloid chứa khoảng 20mg cho qua cột, chảy với tốc độ 2mL/phút. Rửa cột bằng nước cất đến phản ứng trung tính. Đẩy alcaloid khỏi cột bằng 50mL dung dịch acid với tốc độ 2mL/phút.
Dùng cellulose đã oxy hóa làm chất trao đổi có ưu điểm hơn các nhựa catinoid acid yếu ở chỗ liên kết của nó với alcaloid rất yếu nên có thẻ dùng acid đẩy ra nhanh và hoàn toàn.
4.4. Một số ví dụ
Sau đây là tóm tắt một số phương pháp tách chiết áp dụng chủ yếu cho phủ tạng trong pháp , với một ít thay đổi cải tiến có thể áp dụng cho các loại mẫu thử khác.
Phương pháp Stass- Otto:
Năm 1850, nhân vụ đầu độc bằng nicotin (vụ Bocarné), Stass đề ra phương pháp chiết chất độc hữu cơ. Sau đó Otto cải tiến phát triển thành phương pháp chiết ở hai môi trường liên tiếp. Phương pháp được gọi là phương pháp chiết Stass – Otto, tóm tắt như sau:
– Xử lý mẫu trước khi chiết: các alcaloid và base trong mẫu được chuyển sang dạng muối của acid tartric hoặc acid oxalic. Hòa tan các muối đó vào hỗn hợp cồn nước. Bốc hơi cồn ở nhiệt độ thấp trong chân không để loại chất đạm và các tạp chất hữu cơ khác. Giai đoạn này cần chú ý để tránh phân hủy một số alcaloid do nhiệt độ.
– Chiết bằng dung môi hữu cơ: giai đoạn đầu chiết ở môi trường acid để lấy các acid hữu cơ, dẫn xuất barbiturat, các phenol, heterosid. Giai đoạn tiêp theo kiềm hóa băng amoniac để chiết lấy các alcaloid.
Dung dịch cồn của phủ tạng, sau khi loại hết chất đạm vẫn còn các lớp mỡ nằm lại trong dung dịch. Chúng sẽ làm cho dung dịch nước trở thành màu nâu, chuyên sang dung môi hữu cơ làm cho lớp ether hoặc cloroform có màu nâu đen. Vì vậy Kohn- Abrest và Truhaut đưa thêm khâu loại mỡ khỏi dung dịch nước – acid bằng ether dầu hoả trước khi chiết bằng dung môi.
Thông thường dịch chiết ether hoặc cloroform có nhiều tạp chất nên phải dùng các phương pháp khác nhau để loại tạp.
Phương pháp tách bằng cồn – acid của Svaicova:
Phương pháp này có thể tóm tắt thành ba giai đoạn như sau:
– Xử lý sơ bộ mẫu thử: Cho 100-200g mẫu thử đã nghiền nhỏ vào bình cầu. Thêm cồn 95° ngập mẫu và acid hóa bằng acid oxalic hoặc acid tartric 10% (pha trong cồn). Thử phản ứng với giấy quỳ. Lắc đều và để yên một thời gian, bổ sung acid (nếu thiếu). Để yên 24 giờ ở 25-30°C. Sau đó gạn phần cồn và thêm phần cồn mới vào. Tiến hành ngâm mẫu thử bằng cồn như trên 3-4 lần. Cần kiểm tra sao cho môi trường luôn luôn acid.
Gộp các phần cồn, rồi bốc hơi dưới áp suất giảm (ở dưới 40°C) đến khi được hỗn hợp sánh như siro. Cho từng giọt côn vào hôn hợp để kết tủa albumin. Lọc loại bỏ tủa, rửa tủa và giấy lọc bằng cồn. Có thể kết tủa albumin nhiều làn cho đến khi hết. Dùng 30mL ether dầu hoả (chia ba lần) để loại mỡ từ dung dịch nước. Cô đuổi ether dầu hoả. Thêm 20-25mL, đuổi cồn bằng cách đun cách thủy.
– Chiết bằng ether hoặc cloroform 3-4 lần, mỗi lần 10-15mL, lúc đầu ở môi trường acid, sau ở môi trường kiềm (kiềm hóa bàng NH4OH hoặc NaHCCb). Sau khi chiết, lọc lớp ether hoặc cloroform qua giấy lọc khô để loại vết nước có thể mang theo chất bẩn vào. Riêng phần dịch chiết ở môi trường acid cần rửa bằng nước cất ba lần để loại các chất trước khi lọc qua giấy khô.
– Đuổi dung môi khỏi dịch chiết và làm các phản ứng xác định.
Phương pháp tách bằng cồn – acid của Kohn-Abrest:
– Lấy 100-200g mẫu thử, thêm 1,5 thể tích cồn 95° có acid tartric (nồng độ acid 1%). Để 12 giờ ờ nhiệt độ 50-60°C. Lọc lấy cồn, ba đem ép qua vải hoặc ly tâm. Lấy dịch lọc (độ cồn khoảng 70°) đun cách thuỷ ở nhiệt độ 60°c. cất dưới áp lực giảm để lấy cồn cho đến khi phần rượu đem cất sánh như xiro. Dùng cồn 95° để kết tủa albumin (15mLcho 100g). Lọc. Dịch lọc nếu còn albumin thì loại lần nữa. Sau đó cất dưới lực giảm để thu hồi cồn.
– Thêm vào 15-20mL cồn tuyệt đối (nêu có tủa thì lọc) và l0mL nước, cất thu hồi cồn trong chân không, cồn còn lại không lọc mà dùng 30mL ether dầu hỏa để chiết loại mỡ.
– Chiết bằng ether ở môi trường acid. Kiềm hóa băng NaHCO3 rồi chiết bằng ether, xong chiết tiếp với cloroform để lấy hết alcaloid. Muốn lấy hết morphin thì dùng hỗn hợp cồn: cloroform (1: 9).
Phương pháp làm khô mẫu thử:
Phương pháp của Svaicova và Kohn Abrest rất phổ biến trong kiểm nghiệm độc chất. Tuy vậy có những nhược điểm: albumin hoà tan trong cồn nền mất nhiều thời gian (2-3 ngày) để loại, vừa tốn cồn vừa dễ mất chất cần chiết. Để khắc phục nhược điểm này cần làm albumin không thoát ra ngoài dung dịch cồn. Albumin dễ hoà tan khi côn bị giảm nồng độ (do nước trong mẫu thử). Vì vậy nhiều tác giả dùng một số chất amoni sulfat, natri sulfat để làm khô trước khi ngâm rượu.
Cách tiến hành: trộn 100 g mẫu đã xay nhỏ với natri sulfat khan sao cho tạo thành hỗn hợp tơi. Ngâm với 150mL dung dịch acid tartric 1% trong cồn 4 giờ ở nhiệt độ 50-60°C cách thủy. Lọc qua phễu Buchner. Dùng 50mL dung dịch cồn acid tartric trên để rửa bã. Gộp tất cả phần cồn – acid cho vào bình cất, thêm 5g amoni sulfat. cất dưới áp lực giảm để thu hồi cồn ở nhiệt độ không quá 60°C. Dịch còn lại cho vào tủ lạnh. Sau 1 -2 giờ lấy phần nước trong, dùng ether loại mỡ.
Chiết bằng dung môi ở hai môi trường như hai phương pháp trên.
Thời gian làm một mẫu mất một ngày, đảm bảo loại hết albumin. Để phủ tạng xay nhỏ một ngày trước trong bình hút ẩm để giảm lượng natri sulfat.
Phương pháp chiết liên tục:
Nguyên tắc của chiết liên tục là dùng một lượng dung môi nhất định qua hệ thống hồi lưu và đi qua mẫu thử để lấy kiệt các chất cần thiết. Phương pháp chiết bằng bmh Soxhlet thường được sử dụng cho mục đích này.
– Lấy bình Soxhlet dung tích 500-1000mL lắp vào đầu ống sinh hàn có hệ thống làm chân không bằng vòi nước.
– Cho mẫu thử đã xay nhỏ trộn với natri sulfat khan vào giấy lọc, cuộn thành túi dài. Đặt túi này vào ống sao cho giấy không sát thành ống. Có thể dùng bi thủy tinh để ở dưới và đũa thủy tinh để xung quanh.
– Lấy 100mL cồn 90° đổ vào cho ngập hỗn hợp nhưng không quá ống xi phông. Cho vào bình 5g amoni sulfat và phần cồn còn lại. Cất cách thủy áp lực giảm ở nhiệt độ dưới 60 độ C, cồn ở bình bốc hơi gặp ống sinh hàn ngưng tụ lại rồi vào bình chiết. Khi cồn cao quá ống xi phông thì sẽ chảy trở lại vào bình. Hoạt chất nằm lại bình, cồn tiếp tục bay hơi, Quá trình cứ thế tiếp diễn.
– Khi chiết xong cồn còn khoảng 90mL. Thêm 1 g amoni sulfat vào bình, bỏ mẫu thử ra khỏi ống. Sau khi cất thu hồi cồn xong đem chiết bằng dung môi như các phương pháp trên.
Câu hỏi lượng giá
- Trình bày nguyên tắc chung lấy và bảo quản các loại mẫu thường gặp trong phân tích các chất độc.
- Cách chiết và phân lập từ mẫu các chất độc thường gặp?
- Nguyên tắc của các phương pháp vô cơ hóa mẫu, ưu nhược điểm và ứng dụng của chúng trong phân tích các kim loại độc.
- Nguyên tắc, cách tiến hành và ứng dụng của phương pháp cất kéo hơi nước trong phân tích độc chất?
- Nguyên tắc chung để chiết xuất chất độc hữu cơ?
- Trình bày nguyên tắc của một số phương pháp chiết và khả năng ứng dụng chúng để chiết các chất độc.
