Bệnh hô hấp, Bệnh Nhi khoa
Những phát triển mới trong xử trí hô hấp ở trẻ sơ sinh
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Bài viết “Những phát triển mới trong xử trí hô hấp ở trẻ sơ sinh” tải về file pdf ở đây.
Tác giả I-Ling Chen và Hsiu-Lin Chen.
Bản dịch của BS. Đặng Thanh Tuấn – Bệnh viện Nhi Đồng 1
Tóm tắt
Hội chứng suy hô hấp (RDS) là nguyên nhân chính gây suy hô hấp ở trẻ non tháng do phổi chưa trưởng thành và thiếu hụt surfactant. Mặc dù các khái niệm và phương pháp xử trí các vấn đề về hô hấp ở trẻ sơ sinh đã thay đổi liên tục, nhưng việc xác định phương pháp điều trị hô hấp thích hợp với tổn thương phổi do thở máy và các biến chứng là cực kỳ quan trọng. Tổng quan này tóm tắt những tiến bộ của liệu pháp hô hấp sơ sinh và các chiến lược hiện có (tức là liệu pháp surfactant ngoại sinh, thông khí không xâm lấn và các chế độ thông khí khác nhau), tập trung vào xử trí RDS.
Giới thiệu
Với sự phát triển của y học sơ sinh và chăm sóc tích cực, các khái niệm và phương pháp xử trí các vấn đề về hô hấp ở trẻ sơ sinh đã liên tục thay đổi. Hội chứng suy hô hấp (RDS, Respiratory distress syndrome) là nguyên nhân chính gây suy hô hấp ở trẻ non tháng do phổi chưa trưởng thành và thiếu hụt surfactant. Các khía cạnh quan trọng như liệu pháp surfactant ngoại sinh, sử dụng thông khí không xâm lấn và các chế độ thông khí khác nhau để tránh đặt nội khí quản, tổn thương phổi do thông khí và các bệnh đi kèm đã dẫn đến sự quan tâm ngày càng tăng đối với RDS. Đánh giá này tóm tắt những tiến bộ và chiến lược có sẵn cho liệu pháp hô hấp ở trẻ sơ sinh, tập trung vào việc xử trí RDS.
Sử dụng surfactant ngoại sinh
Vì sự thiếu hụt surfactant là một yếu tố đã được thiết lập rõ ràng liên quan đến RDS ở trẻ non tháng, nên việc sử dụng surfactant giúp cải thiện quá trình trao đổi khí ở phổi, giảm nhu cầu thở máy và giảm nguy cơ loạn sản phế quản phổi (BPD, bronchopulmonary dysplasia).1 Phương pháp cung cấp surfactant ngoại sinh đã phát triển từ việc sử dụng một lượng lớn surfactant trong quá trình thở máy qua nội khí quản đến quy trình INtubateSURfactant-Extubate (INSURE). Quy trình INSURE bao gồm đặt nội khí quản, sau đó sử dụng surfactant, rút ống nội khí quản sớm và hỗ trợ đường thở áp lực dương liên tục (CPAP, continuous positive airway pressure). Mặc dù INSURE có thể giúp giảm thiểu các biến chứng liên quan đến thở máy, nhưng tỷ lệ thành công của nó không cao lắm. INSURE đã thành công ở khoảng 30% trẻ sinh non dưới 32 tuần tuổi thai, trong khi những trẻ INSURE thất bại cần thời gian thở máy hoặc đặt lại ống nội khí quản lâu hơn.2 Thuốc an thần là cần thiết trong quá trình INSURE và việc đặt ống nội khí quản có thể gây đau, căng thẳng hoặc các biến chứng về huyết động. Một đánh giá hệ thống đã báo cáo rằng sự thất bại của INSURE có liên quan đến cân nặng khi sinh cực kỳ thấp, tuổi thai nhỏ và RDS nghiêm trọng.3
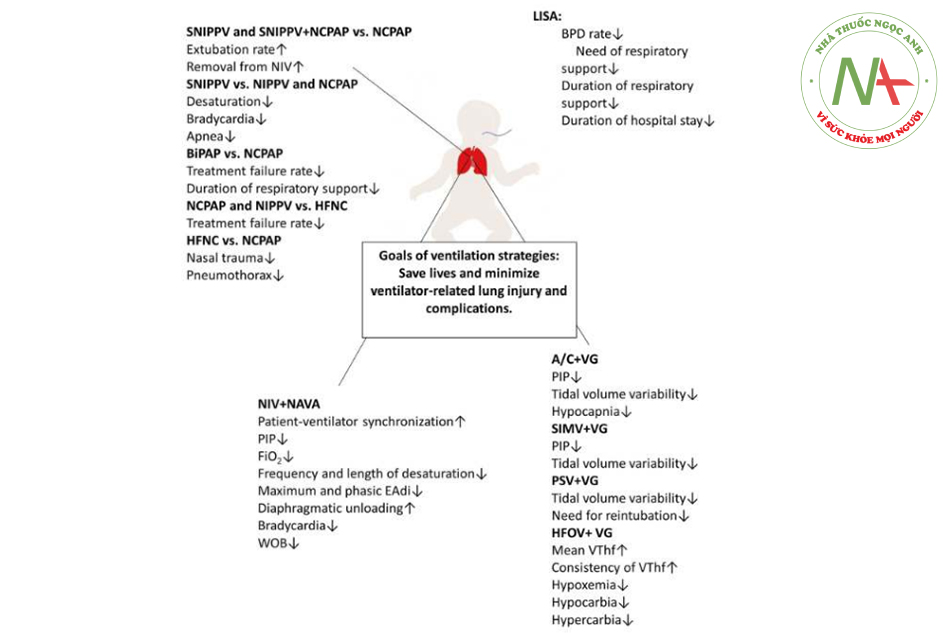
Sử dụng surfactant ít xâm lấn (LISA, Less invasive surfactant administration), còn được gọi là sử dụng surfactant xâm lấn tối thiểu, nhằm mục đích đưa một lượng surfactant thích hợp vào khí quản thông qua một ống thông có đường kính nhỏ được đặt qua đường miệng hoặc mũi bên ngoài dây thanh âm. LISA cho phép trẻ sơ sinh thở một cách tự nhiên trong quá trình cung cấp surfactant. Hỗ trợ hô hấp sớm bằng CPAP và sử dụng surfactant cứu hộ bằng LISA được khuyến nghị để trẻ sinh non có nguy cơ mắc RDS còn tự thở. Một phân tích tổng hợp trước đây đã báo cáo rằng trẻ sơ sinh được điều trị bằng LISA có tỷ lệ mắc bệnh BPD thấp hơn, giảm nhu cầu và thời gian hỗ trợ hô hấp cũng như tỷ lệ thất bại CPAP thấp hơn khi so sánh với các phương pháp cung cấp surfactant khác.4,5 LISA cũng liên quan đến việc giảm thời gian nằm viện, giảm thời gian bổ sung oxy, giảm tỷ lệ mắc các bệnh sơ sinh phổ biến khác, chẳng hạn như xuất huyết não thất và tỷ lệ can thiệp đối với bệnh võng mạc ở trẻ sinh non thấp hơn.6 Trong một nghiên cứu với thời gian theo dõi 2 năm, LISA cho thấy không có tác động tiêu cực đáng kể nào đối với chiều dài cơ thể, trọng lượng cơ thể và sự phát triển thần kinh của trẻ sinh non.7 Mặc dù những phát hiện này hỗ trợ tính khả thi và an toàn của LISA, một số tác dụng phụ có liên quan của LISA đã được báo cáo, bao gồm trào ngược surfactant khí quản, nhịp tim chậm, thiếu oxy, cần đặt nội khí quản, lắng đọng surfactant một bên và chảy máu niêm mạc.8 Thất bại của LISA có thể liên quan đến tuổi thai thấp hơn và mức độ non của phổi.6
Mặc dù thuốc giảm đau hoặc an thần không bắt buộc trong LISA, nó vẫn có thể được sử dụng ở trẻ sơ sinh khỏe mạnh để tăng sự thoải mái. Phòng ngừa đau và căng thẳng là rất quan trọng trong thực hành lâm sàng. Hơn nữa, nó có ảnh hưởng đến sự phát triển nhận thức và vận động ở trẻ sơ sinh. Đáng chú ý, ngay cả thuốc an thần liều thấp cũng có thể làm tăng độ bão hòa và cung cấp hỗ trợ hô hấp kéo dài.9
Thông khí không xâm lấn
BPD có liên quan đến thời gian thở máy xâm lấn và bổ sung oxy. Đây là một trong những bệnh tật chính ở trẻ sơ sinh sống sót sau khi sinh quá non tháng. Thông khí không xâm lấn (NIV, Noninvasive ventilation) là phương pháp điều trị phổ biến cho trẻ non tháng mắc RDS. NIV giúp tránh đặt nội khí quản hoặc cung cấp hỗ trợ hô hấp sau khi rút nội khí quản, do đó giảm thiểu tổn thương phổi do máy thở và cải thiện kết quả.
CPAP mũi (NCPAP), thông khí áp lực dương ngắt quãng qua mũi (NIPPV, nasal intermittent positive pressure ventilation), áp lực đường thở dương hai cấp độ (BiPAP, bi-level positive airway pressure) và ống thông mũi lưu lượng cao (HFNC, high-flow nasal cannula) là những loại NIV phổ biến. NCPAP cung cấp áp lực dương liên tục trong suốt chu kỳ hô hấp để huy động các phế nang bị xẹp và giảm sức cản đường thở, nhờ đó đạt được dung tích cặn chức năng (FRC, functional residual capacity) và ngăn ngừa xẹp đường thở. NIPPV cung cấp áp lực dương không liên tục được kiểm soát bởi lưu lượng ở các khoảng thời gian đã đặt dựa trên NCPAP. BiPAP cung cấp các chu kỳ với áp lực dương cao và thấp ở các khoảng thời gian đã đặt. HFNC cung cấp oxy được làm ấm và làm ẩm với tốc độ lưu lượng 2–8 L/phút qua ngạnh mũi và tạo ra áp lực dương cuối thì thở ra. HFNC có thể làm giảm khoảng chết sinh lý, giảm sức cản đường thở mũi họng và ngăn ngừa khô và tổn thương niêm mạc đường thở.
Không có quy trình chuẩn hóa nào để xác định phương pháp điều trị NIV tối ưu về mặt hiệu quả và kịp thời. Ở đây, chúng tôi thảo luận về một số so sánh hiện tại về việc sử dụng NIV. Ở trẻ sinh non rất nhẹ cân mắc RDS, NIPPV và NCPAP cho thấy kết quả tương đương về tỷ lệ thất bại rút nội khí quản, tử vong hoặc BPD, xuất huyết não thất, rò rỉ khí, viêm ruột hoại tử và thời gian hỗ trợ hô hấp.10 Tuy nhiên, NIPPV đồng bộ (SNIPPV) và SNIPPV + NCPAP cho thấy tỷ lệ rút ống nội khí quản thành công và loại bỏ NIV trong vòng 1 tuần cao hơn khi so sánh với NCPAP.11 Hơn nữa, SNIPPV làm giảm đáng kể tỷ lệ , nhịp tim chậm và ngưng thở ở trẻ non tháng.12 Những phát hiện này cho thấy rằng đồng bộ hóa đóng một vai trò quan trọng trong việc cung cấp hỗ trợ hô hấp hiệu quả. Sự không đồng bộ có thể làm thay đổi nhịp thở tự phát, tăng công hô hấp (WOB) và dẫn đến chướng bụng. Thật vậy, một số nghiên cứu đã chứng minh hiệu quả của SNIPPV trong việc giảm WOB,13 cải thiện trao đổi khí,14 và cải thiện sự ổn định của thành ngực bằng cách tăng lưu lượng cung cấp ở đường hô hấp trên15 của trẻ sinh non. Thất bại của SNIPPV có liên quan đến mức độ RDS, sử dụng steroid trước sinh và áp lực đường thở trung bình.15 Tỷ lệ thất bại NCPAP cao hơn tỷ lệ thất bại BiPAP hoặc NIPPV trong vòng 72 giờ đầu đời ở trẻ non tháng mắc RDS.16,17 Thất bại của NCPAP có liên quan đến việc sử dụng steroid trước sinh thấp hơn và tuổi thai nhỏ hơn.17 Ngoài ra, việc sử dụng BiPAP đã rút ngắn thời gian hỗ trợ hô hấp mà không ảnh hưởng đến tỷ lệ mắc bệnh BPD, tỷ lệ mắc bệnh võng mạc ở trẻ sinh non và chức năng phổi khi được 1 tuổi.18 Sử dụng áp lực cao trong CPAP (≥ 9 cmH2O) gần đây đã được đề xuất ở trẻ sinh non có khả năng cần một chế độ hỗ trợ không xâm lấn thay thế. Việc sử dụng áp lực CPAP cao không có tác động tiêu cực đến cung lượng tim hoặc WOB khi so sánh với NIPPV ở trẻ non tháng,19 và không có sự khác biệt về tỷ lệ thất bại giữa hai phương pháp này.20 Tỷ lệ tràn khí màng phổi là 9% ở trẻ cực non được điều trị bằng CPAP và việc sử dụng áp lực cao trong CPAP có liên quan đến tỷ lệ tràn khí màng phổi cao hơn, có thể là do phổi giãn nở quá mức ở trẻ rất non.21 Do đó, chúng ta không thể bỏ qua các kết quả tiêu cực liên quan đến việc sử dụng áp lực cao trong CPAP.22 Tỷ lệ thất bại HFNC, có liên quan đến viêm màng ối mô học, còn ống động mạch được điều trị và tuổi thai thấp hơn, cao hơn tỷ lệ thất bại NCPAP hoặc NIPPV ở trẻ non tháng.23 Hơn nữa, một phân tích tổng hợp đã chứng minh tỷ lệ thất bại của HFNC cao hơn so với NCPAP mặc dù tỷ lệ chấn thương mũi và tràn khí màng phổi ở HFNC thấp.24
Độ chính xác chẩn đoán là rất quan trọng trong việc dự đoán sự thất bại của NIV ở trẻ sơ sinh. Đánh giá động học cơ hoành bằng cách đo vận tốc cực đại của sự dịch chuyển cơ hoành bên phải (RDPV) phát hiện hoạt động của cơ hoành gợi ý sự mệt mỏi. Tỷ lệ độ bão hòa oxy (SpO2)/nồng độ oxy hít vào (FiO2) (tỷ lệ SF) tỷ lệ nghịch với RD-PV được ghi lại bằng cách sử dụng Doppler mô sóng xung. Bất chấp những biến động tiềm ẩn trong SpO2, tỷ lệ SF thấp và RD-PV cao đã dự đoán thành công thất bại NCPAP ở trẻ non tháng mắc RDS.25 Phát hiện này cũng cho thấy rằng sự thất bại của NIV ở trẻ non tháng có thể liên quan đến hoạt động cơ hoành cao kéo dài, nguyên nhân là do không thể duy trì FRC.
Hỗ trợ thông khí điều chỉnh thần kinh
Hỗ trợ thông khí được điều chỉnh theo thần kinh (NAVA, Neurally adjusted ventilatory assist) là một chế độ thông khí cơ học kích hoạt và tạo chu kỳ hỗ trợ hô hấp tương ứng với hoạt động điện tử của cơ hoành (EAdi, electronic activity of the diaphragm), cho phép trẻ sơ sinh kiểm soát áp lực hít vào tối đa và thể tích khí lưu thông trên từng nhịp thở. Tín hiệu EAdi được đánh giá ở mức thực quản xa bằng cách sử dụng các điện cực được nhúng trong ống thông mũi dạ dày. EAdi tối đa tương quan với cường độ co cơ hoành biểu thị thể tích khí lưu thông được hít vào. Trương lực EAdi có liên quan đến sự co cơ hoành kéo dài trong khi thở ra, duy trì thể tích phổi cuối thì thở ra và FRC. Có thể cần một loại thuốc bổ EAdi cao hơn để duy trì thể tích phổi cuối thì thở ra và FRC khi có sự mất ổn định của phế nang và độ giãn nở thấp,26 và việc điều chỉnh liên tục NAVA theo thời gian hít vào và nhịp thở có thể giúp thích ứng tốt hơn với nhu cầu của trẻ sơ sinh.
EAdi độc lập với rò rỉ không khí trong NIV. NIV với NAVA là khả thi và dung nạp tốt ở trẻ non tháng với các lợi ích sinh lý, chẳng hạn như cải thiện đồng bộ máy thở giữa bệnh nhân và giảm áp lực hít vào tối đa (PIP), FiO2, tần số và thời gian tụt độ bão hòa.27, 28, 29, 30 NIV với NAVA cải thiện khả năng giảm tải cơ hoành, có thể dẫn đến giảm WOB. Một sự cải thiện đáng kể trong các chỉ số liên quan đến WOB cũng được quan sát thấy ở trẻ sơ sinh bị viêm tiểu phế quản nặng sau khi chuyển từ NCPAP sang NIV với NAVA.31 NAVA vượt trội hơn NIPPV trong việc giảm các biến cố nhịp tim chậm ở trẻ sơ sinh rất nhẹ cân.32
Ngoài liệu pháp methylxanthine, CPAP là phương pháp điều trị tiêu chuẩn cho chứng ngưng thở khi sinh non. Tuy nhiên, CPAP thường thất bại ở trẻ sơ sinh ngưng thở do không được hỗ trợ hô hấp đầy đủ trong giai đoạn ngưng thở. NAVA có thể phát hiện chứng ngưng thở và cung cấp thông khí cứu hộ. Nếu ngưng thở xảy ra trong một thời gian xác định trước, thông khí dự phòng có kiểm soát áp lực sẽ được cung cấp cho đến khi thông khí tự nhiên tiếp tục. NAVA đã được chứng minh là làm giảm số lần tụt độ bão hòa và tỷ lệ nhịp tim chậm ở trẻ sinh non bị ngưng thở khi sinh non khi so sánh với CPAP qua đường mũi.33
Việc tăng giá trị NAVA ban đầu đã tăng PIP trong khi duy trì EAdi không đổi cho đến khi đạt đến điểm dừng (BrP, breakpoint). Việc tăng thêm NAVA đã làm giảm EAdi, trong khi PIP được ổn định.34 Giá trị BrP là duy nhất cho mỗi cá nhân. Bên dưới BrP, sự giảm tải cơ hoành không đủ để tăng mức NAVA, PIP và thể tích khí lưu thông cũng như duy trì EAdi cao. Khi đạt đến BrP, điều này phản ánh việc giảm tải đầy đủ của cơ hoành, PIP không thay đổi và EAdi bắt đầu giảm. Cơ chế phản hồi thần kinh này của thông khí NAVA giúp phổi không bị căng phồng quá mức.34 Do đó, các tiêu chí rút nội khí quản chỉ dựa trên áp lực đường thở và nỗ lực thở tự nhiên có thể không được áp dụng trong quá trình thông khí NAVA. Trẻ sinh non mắc RDS được đặt nội khí quản được điều trị bằng NAVA xâm lấn biểu hiện PIP thấp hơn so với những trẻ ở chế độ thông thường.35 Tuy nhiên, trẻ sinh non biểu hiện BrP, PIP và EAdi cao hơn sau khi rút ống nội khí quản từ NAVA xâm lấn sang NIV bằng NAVA. Những phát hiện này cho thấy các bác sĩ lâm sàng nên lưu tâm đến một số khía cạnh bao gồm cơ chế phản hồi thần kinh chưa trưởng thành ở trẻ non tháng, sự thiếu hiệu quả của thông khí NIV và yêu cầu mức NAVA cao hơn trong khi chuyển từ NAVA xâm lấn sang NIV với NAVA.36
Thông khí đảm bảo thể tích
Sự dao động lớn về thể tích khí lưu thông ở trẻ thở máy là một trong những cơ chế gây mất ổn định hô hấp, có thể dẫn đến sự dao động thường xuyên của SpO2. Thông khí đảm bảo thể tích (VG, volume guarantee) là chế độ thông khí được kiểm soát áp lực. Thở trong VG bị giới hạn áp lực với lưu lượng giảm dần. VG sử dụng vòng phản hồi để điều chỉnh tự động PIP nhằm cung cấp thể tích khí lưu thông đã đặt dựa trên các biến thể về độ giãn nở của phổi, sức cản đường thở và nỗ lực hô hấp tự phát của bệnh nhân.
Chế độ VG có thể được sử dụng kết hợp với kiểm soát hỗ trợ (A/C, assist/control), thông khí bắt buộc ngắt quãng đồng bộ (SIMV, synchronized intermittent mandatory ventilation) hoặc thông khí hỗ trợ áp lực (PSV, pressure-support ventilation). Tác dụng của VG khác nhau khi được kết hợp với các chế độ khác nhau ở trẻ sinh non. Các giai đoạn VG của A/C và SIMV có liên quan đến PIP thấp hơn và ít trường hợp thể tích khí lưu thông quá lớn ở trẻ non tháng mắc RDS.37 Tỷ lệ giảm CO2 máu thấp hơn ở A/C + VG so với chỉ sử dụng A/C.38 Mặc dù tỷ lệ mắc bệnh, tử vong và tỷ lệ mắc bệnh viêm phổi tương tự nhau giữa PSV + VG và SIMV + VG, PSV + VG cung cấp nhiều nhịp thở hơn với thể tích khí lưu thông gần với giá trị đặt mà không bị thông khí quá mức và giảm CO2 ở trẻ sinh non thở máy với RDS.39 Giảm nhu cầu đặt lại nội khí quản cũng được thấy rõ ở PSV + VG đối với trẻ non tháng mắc RDS.40 Bảng 1 tóm tắt các chế độ khác nhau kết hợp với VG.
Bảng 1 Tóm tắt các chế độ khác nhau kết hợp với Thông khí đảm bảo thể tích (VG).
A/C: hỗ trợ-kiểm soát; SIMV: thông khí bắt buộc ngắt quãng đồng bộ; PSV: thông khí hỗ trợ áp lực. |
Thể tích khí lưu thông tần số cao (VThf), tỷ lệ nghịch với tần số dao động, phụ thuộc vào biên độ dao động và thời gian hít vào trong thông khí dao động tần số cao (HFOV). Dao động lồng ngực và thể tích khí lưu thông có thể thay đổi trong cùng một biên độ và tần số áp lực trong HFOV do cơ học phổi khác nhau và tương tác giữa bệnh nhân và máy thở. Trong HFOV + VG, máy thở đo thể tích trong mỗi nhịp thở và tự động điều chỉnh biên độ áp lực để cung cấp một VThf đã đặt nhằm cải thiện độ thanh thải CO2. VThf trung bình cao hơn và được duy trì ổn định hơn trong HFOV + VG khi so sánh với HFOV đơn thuần.41 Mặc dù nó cho thấy những thay đổi ngắn hạn, nhưng nó được duy trì rất gần với mục tiêu trong một thời gian dài hơn.42 Tỷ lệ giảm oxy máu, giảm CO2 và tăng CO2 cũng thấp hơn ở HFOV + VG so với HFOV đơn thuần, điều này có thể là do sự dao động giảm dần trong SpO2 và độ thanh thải CO2.41,43 Thông khí tần số cao phù hợp hơn cho trẻ sơ sinh có độ giãn nở phổi thấp và HFOV + VG có thể giúp trẻ sinh non mắc RDS được thông khí đầy đủ trong 72 giờ đầu tiên bằng cách sử dụng chiến lược tần số cao và thể tích thấp.44
Thông khí HFOV + VG cho phép cung cấp thể tích khí lưu thông thấp và ổn định áp lực riêng phần của carbon dioxide với khả năng bù rò rỉ ống nội khí quản tốt.44 Tuy nhiên, thông khí VG không được khuyến nghị khi có rò rỉ lớn. Rò rỉ hơn 40% có thể đánh giá thấp thể tích khí lưu thông được cung cấp và kích hoạt cảnh báo thể tích khí lưu thông thấp, do đó làm giảm độ chính xác và độ tin cậy của thông khí VG.
Cung cấp thuốc khí dung
Ngoài hỗ trợ hô hấp, trẻ sinh non có thể cần can thiệp dược lý để điều trị các bệnh đi kèm liên quan đến sự trưởng thành của phổi. Việc cung cấp khí dung chủ yếu được thực hiện qua đường mũi ở trẻ sơ sinh, vì chúng chủ yếu thở bằng mũi. Trẻ sinh non có thể tích khí lưu thông nhỏ hơn, tần số thở cao hơn và thời gian hít vào ngắn hơn so với trẻ đủ tháng, dẫn đến việc cung cấp khí dung và thời gian lưu trú trong phổi giảm. Ngoài ra, các bệnh lý về phổi, chẳng hạn như RDS, hạn chế khí dung thuốc ở trẻ non tháng. Điều đáng ngạc nhiên là trẻ sinh non biểu hiện sự lắng đọng khí dung trong phổi cao hơn một chút so với trẻ đủ tháng, điều này có thể là do tốc độ lưu lượng hít vào của chúng thấp hơn.45
Việc cung cấp thuốc cho trẻ sinh non có thể được thực hiện khi ngắt kết nối tạm thời khỏi NIV (ví dụ: ống hít định liều điều áp có buồng đệm và mặt nạ) hoặc tích hợp trong hệ thống NIV (ví dụ: máy phun khí dung phản lực). Sử dụng ống hít định liều có áp lực ở trẻ sinh non dẫn đến lắng đọng khí dung dưới 1% trong phổi.46 Ngừng hỗ trợ hô hấp có thể không phải là phương pháp tối ưu nhất cho bệnh nhân nguy kịch. Thuốc khí dung được sử dụng trong NIV mang lại hiệu quả lâm sàng tốt hơn và nhanh hơn mà không làm gián đoạn việc cung cấp oxy và áp lực dương. NCPAP có thể cung cấp thuốc khí dung một cách hiệu quả; tuy nhiên, hiệu quả phụ thuộc vào loại thiết bị và vị trí của máy phun.47
Một thử nghiệm lâm sàng giai đoạn I thí điểm đã chứng minh tính khả thi của surfactant được khí dung hóa bằng cách sử dụng máy phun khí dung phản lực lưu lượng thấp để điều trị RDS ở trẻ sinh non trong các môi trường NIV khác nhau bao gồm NCPAP, NIPPV và HFNC.48 Cung cấp surfactant khí dung có thể làm giảm nhu cầu thao tác đường thở và đòi hỏi ít kỹ năng kỹ thuật hơn so với LISA. Tuy nhiên, việc cung cấp thuốc khí dung trong NIV vẫn còn là một thách thức. Do đó, ống thông mũi thường được sử dụng để cung cấp thuốc dạng khí dung trong NIV và để cung cấp oxy với tốc độ dòng khí cao. Các hạt khí dung có đường kính khoảng 1,5 µm là lý tưởng để cung cấp khí dung từ mũi đến phổi hiệu quả cao ở trẻ sơ sinh thông qua ống thông mũi.49 Tuy nhiên, sự lắng đọng khí dung trong khoang mũi và rò rỉ khí dung qua lỗ mũi có thể hạn chế việc đưa khí dung đến phổi. Tốc độ lưu lượng của ống thông ảnh hưởng đáng kể đến liều lượng phổi. Mặc dù tốc độ lưu lượng của ống thông thấp hơn làm giảm sự lắng đọng khí dung trong khoang mũi, nhưng chúng vẫn ở dưới mức cần thiết để hỗ trợ oxy.50,51 Một mặt nạ giao diện khác, ngoài khả năng rò rỉ, thể tích lớn của nó có thể tích tụ các hạt khí dung. Đồng bộ hóa việc sản xuất thuốc khí dung với đường hô hấp giúp cải thiện sự lắng đọng của nó trong phổi. Tuy nhiên, độ trễ là không thể tránh khỏi khi sử dụng máy phun khí dung với hệ thống NIV.52 Lý tưởng nhất là NIV cung cấp khí ấm và ẩm cho trẻ sinh non và độ ẩm trong các bộ dây NIV làm giảm 40% khả năng cung cấp thuốc, có thể bằng cách tăng kích thước hạt.53
Lãng phí thuốc trong quá trình thở ra là nhược điểm chính của liệu pháp khí dung liên quan đến việc cung cấp thuốc liên tục. Sự phát triển gần đây của ngạnh mũi với van khí dung thu nhỏ tích hợp cho phép giải phóng thuốc được kích hoạt bằng nhịp thở trong quá trình hít với thời gian phản ứng của van khí dung <25 ms. Hiệu quả của việc cung cấp khí dung trong quá trình giải phóng kích hoạt bằng nhịp thở cao hơn bốn lần so với việc giải phóng không kích hoạt.54 Việc giải phóng thuốc do nhịp thở kích hoạt trong các giai đoạn hít vào khác nhau có thể nhắm vào các vùng phổi khác nhau, làm giảm sự cung cấp thuốc trong cơ thể.55
Những thách thức gần đây trong việc chăm sóc hô hấp cho trẻ sơ sinh trong đại dịch bệnh coronavirus 2019
Bệnh vi-rút corona 2019 (COVID-19) gây ra bởi hội chứng hô hấp cấp tính nặng vi-rút corona 2 (SARS-CoV-2) đã lan rộng mạnh mẽ kể từ tháng 12 năm 2019, dẫn đến đại dịch toàn cầu.56 Bệnh nhân nhi dường như ít biểu hiện các triệu chứng lâm sàng hơn, điều này gây khó khăn cho việc xác định bệnh này ở trẻ em. Hầu hết trẻ sơ sinh có kết quả xét nghiệm âm tính hoặc không được xét nghiệm bệnh đều không có triệu chứng sau khi sinh. Tác hại tiềm ẩn do nhiễm SARS-CoV-2 đối với trẻ sơ sinh vẫn chưa được biết rõ, đặc biệt là ở trẻ sinh non. Globulin miễn dịch SARS-CoV-2 và cytokine interleukin-6 gây viêm đã được phát hiện trong huyết thanh thu được trong vòng 2 giờ sau khi sinh từ một số trẻ sơ sinh có mẹ bị nhiễm SARS-CoV-2,57 gợi ý khả năng lây truyền trong tử cung. Nhiễm trùng ở mẹ có thể góp phần gây ngạt khi sinh và sinh non.58 Sinh non, tổn thương phổi và các bệnh lý khác ở trẻ sinh non có thể làm tăng nguy cơ mắc COVID-19.
Một nghiên cứu cho thấy rằng bệnh nhân trưởng thành mắc COVID-19 phản ứng với NIV tốt hơn so với thở máy khi họ tiến triển đến giai đoạn tương tự như RDS thiếu surfactant khiến phế nang bị xẹp rộng gây ra tình trạng thiếu oxy trong máu.59 Bất chấp những lợi ích của việc sử dụng surfactant ngoại sinh sớm ở trẻ sơ sinh mắc RDS, vẫn chưa rõ liệu nó có thể làm giảm mức độ nghiêm trọng và cải thiện kết quả của COVID-19 hay không. NIV được coi là an toàn ở trẻ sơ sinh nếu được áp dụng các biện pháp kiểm soát lây nhiễm thích hợp, bề mặt tiếp xúc vừa khít và các bộ lọc vi-rút ngăn chặn sự phát tán của các hạt khí dung bị nhiễm bệnh.60 Tuy nhiên, cần có thêm bằng chứng để hỗ trợ và xác nhận sự an toàn của các biện pháp hô hấp ở trẻ sơ sinh mắc COVID-19.
Kết luận
RDS là nguyên nhân chính của thông khí xâm lấn ở trẻ sơ sinh. Mặc dù sự non nớt của phổi chủ yếu góp phần gây ra bệnh tật lâu dài ở trẻ non tháng, nhưng tổn thương phổi do thở máy cũng được công nhận là yếu tố chính trong sự phát triển của BPD. Hình 1 tóm tắt lợi ích của các chiến lược hô hấp hiện tại đối với trẻ sơ sinh. Việc sử dụng các chiến lược hô hấp thích hợp ở trẻ sơ sinh là một thách thức nhưng rất quan trọng đối với các bác sĩ lâm sàng, không chỉ để cứu sống trẻ mà còn đảm bảo kết quả ngắn hạn và dài hạn tốt hơn.


Có thể dùng thuốc khí dung cho trẻ bị suy hô hấp không?
Chào bạn, trẻ gặp tình trạng suy hô hấp có thể áp dụng biện pháp dùng thuốc khí dung hoặc các phương pháp điều trị khác theo hướng dẫn của bác sĩ ạ