Để tải về bài viết NHIỄM KHUẨN THỨ PHÁT Ở BỆNH NHÂN COVID-19 NẶNG, mời bạn click vào link ở đây
Bản Dịch Của Bác Sĩ Trần Minh Thành- Khoa HSTC-CĐ
Giới thiệu
Kể từ tháng 12 năm 2019, khi trường hợp đầu tiên lây truyền sang người của hội chứng hô hấp cấp tính nghiêm trọng coronavirus 2 (SARS-CoV-2) được báo cáo ở Vũ Hán (Trung Quốc), hơn một trăm triệu trường hợp được xác nhận mắc bệnh do coronavirus 2019 (COVID-19) đã được mô tả trên toàn thế giới, và đại dịch được Tổ chức Y tế Thế giới tuyên bố vào ngày 11 tháng 3 năm 2020 vẫn đang tiếp diễn.
Phổ lâm sàng của nhiễm SARS-CoV-2 bao gồm từ bệnh không có triệu chứng đến bệnh nặng cần nhập viện và nhập viện chăm sóc đặc biệt (ICU) [ 1 ]. Các nghiên cứu đa trung tâm gần đây cho thấy 5–32% bệnh nhân nhập viện do COVID-19 cần nhập viện ICU [ 2 , 3 , 4 , 5 ], chủ yếu đối với hội chứng suy hô hấp cấp (ARDS) cần đặt nội khí quản và thở máy xâm lấn [ 2 , 3 , 4 , 6 , 7 ]. Theo dữ liệu được công bố hiện có, tỷ lệ tử vong của những bệnh nhân bị bệnh nặng với COVID-19 dao động từ 16 đến 78% [ 3 ,6 , 7 , 8 ].
Vì một số lý do, những bệnh nhân có COVID-19 được nhận vào ICU có nguy cơ cao phát triển các biến chứng nhiễm trùng trong thời gian họ ở ICU. Đầu tiên, họ thường bị suy đa cơ quan khi cần dùng thuốc vận mạch, liệu pháp thay thế thận (RRT) và trong một số trường hợp, hỗ trợ oxy qua màng ngoài cơ thể. Do đó, thời gian thở máy và thời gian nằm ICU của những bệnh nhân này thường kéo dài (lên đến 19 ngày đối với thở máy và lên đến 49 ngày đối với thời gian nằm viện ICU [ 5 , 9 ]). Thứ hai, COVID-19 mỗi lầncó liên quan đến rối loạn chức năng đáng kể của hệ thống miễn dịch của bệnh nhân. Nhiều nghiên cứu đã chỉ ra sự tham gia của cả miễn dịch bẩm sinh và miễn dịch thu được như một phản ứng đối với nhiễm trùng SARS-CoV-2. Các nghiên cứu sơ bộ của Trung Quốc đã phát hiện thấy giảm cả số lượng tế bào lympho T CD4 + T và CD8 +, tăng bạch cầu trung tính và giảm nồng độ huyết thanh interferon gamma (IFN-γ) [ 10 , 11 ]. Các nghiên cứu sâu hơn đã xác nhận những phát hiện này và cho thấy một mô hình cytokine được đặc trưng bởi các phân tử gây viêm dư thừa (bão cytokine [ 12 ]), ức chế các tế bào giết tự nhiên (NK và NKT) và các tế bào lympho gây độc tế bào, và các thay đổi về hình thái và kiểu hình của bạch cầu đơn nhân [ 13 , 14 , 15]. Thứ ba, sau khi công bố kết quả của thử nghiệm PHỤC HỒI [ 16 ], điều trị bằng corticosteroid toàn thân đã trở thành tiêu chuẩn chăm sóc ở tất cả bệnh nhân cần bổ sung oxy. Ngoài ra, một số loại thuốc nhằm mục đích làm giảm phản ứng của hệ thống miễn dịch đối với nhiễm virus (ví dụ như chất ức chế cytokine [tocilizumab, anakinra, sarilumab] hoặc chất ức chế bổ thể [eculizumab]) thường được sử dụng cho những bệnh nhân này và một số thử nghiệm đang được tiến hành để đánh giá hiệu quả của chúng. Cuối cùng, nhiễm trùng do vi khuẩn và nấm thứ phát như một biến chứng của các bệnh hô hấp do vi rút đã được mô tả trong các đại dịch trước đây (hội chứng hô hấp cấp tính nặng năm 2002 [SARS] [ 17 ], đại dịch cúm lợn năm 2009 [ 18], và hội chứng hô hấp Trung Đông 2012 [MERS] [ 19 ]) và một số nghiên cứu đã nêu bật vai trò của chúng trong việc làm tăng mức độ nghiêm trọng của bệnh viêm phổi do vi rút [ 18 ].
Một tài liệu đánh giá gần đây cho thấy tỷ lệ đồng nhiễm trùng (tức là nhiễm trùng được phát hiện khi nhập viện) ở bệnh nhân COVID-19 ít hơn so với các đại dịch trước đó [ 20 ]. Dữ liệu về nhiễm trùng thứ cấp (tức là nhiễm trùng mắc phải trong quá trình lưu trú tại ICU) rất khan hiếm. Mục đích của chương này là tóm tắt các bằng chứng hiện có về dịch tễ học, các yếu tố nguy cơ, tác động đến kết quả và các nguyên tắc điều trị nhiễm trùng thứ phát ở bệnh nhân nặng với COVID-19
Dịch tễ học và các yếu tố nguy cơ
Nhiễm khuẩn
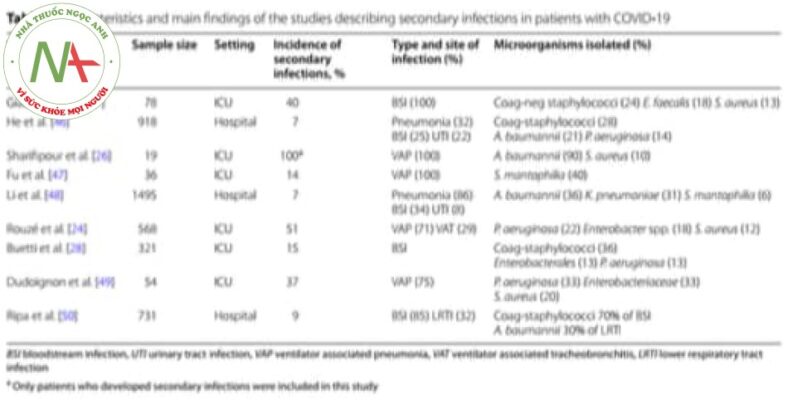
Ở những bệnh nhân bị cúm A H1N1, tỷ lệ nhiễm vi khuẩn gây biến chứng viêm phổi do vi rút là 25–50% và chúng có liên quan đến việc tăng thời gian thở máy, kéo dài thời gian nằm ICU và tăng tỷ lệ tử vong [ 21]. Vì những lý do này, chẩn đoán sớm và xử trí thích hợp là bắt buộc ở những bệnh nhân nặng. Như đã đề cập ở trên, dữ liệu hạn chế có sẵn về nhiễm khuẩn thứ phát ở những bệnh nhân nhập viện vì nhiễm SARS-CoV-2. Một đánh giá gần đây cho biết tỷ lệ nhiễm trùng do vi khuẩn hoặc nấm ở bệnh nhân COVID-19 nhập viện thấp, dao động từ 6 đến 15%, nhưng hầu hết các nghiên cứu được trích dẫn đều được thực hiện ở Trung Quốc và bao gồm các bệnh nhân chủ yếu nhập viện bình thường và không đến ICU; do đó, những dữ liệu này không thể ngoại suy cho dân số bệnh nhân nặng được nhận vào ICU ở các nước phương Tây.
Biến chứng vi khuẩn phổ biến nhất của COVID-19 là nhiễm trùng đường hô hấp dưới do máy thở (VA-LRTI), bao gồm viêm phổi do máy thở (VAP) và viêm khí quản do máy thở. Cơ chế đồng nhiễm vi khuẩn cơ bản trong viêm phổi do vi rút là tổn thương các tế bào có lông, dẫn đến suy giảm độ thanh thải của niêm mạc và tăng khả năng kết dính của vi khuẩn với niêm mạc, dẫn đến tăng cường sự xâm nhập của vi khuẩn vào đường thở [ 22 ]. Ngoài những cơ chế này, các yếu tố nguy cơ khác của nhiễm trùng thứ phát do vi khuẩn điển hình ở bệnh nhân ICU là sự hiện diện của ARDS và thời gian thở máy kéo dài [ 23]. Một nghiên cứu đa trung tâm ở châu Âu gần đây đã mô tả tỷ lệ tích lũy của VA-LRTI ở những bệnh nhân mắc COVID-19 được đưa vào ICU so với những bệnh nhân bị bệnh bụi phổi do vi rút và không do vi rút khác. Tỷ lệ chung của VA-LRTI là 50%, cao hơn đáng kể so với hai nhóm còn lại, mặc dù thực tế là những bệnh nhân bị viêm phổi do SARS-CoV-2 có điểm số mức độ nghiêm trọng thấp hơn (Điểm Sinh lý Cấp tính Đơn giản [SAPS II] và Đánh giá Thất bại Nội tạng Tuần tự Điểm [SOFA]) khi nhập học ICU và ít bệnh đi kèm hơn [ 24 ]. Phát hiện này đã được xác nhận bởi hai nghiên cứu khác. Lần đầu tiên đánh giá tỷ lệ mắc VAP ở bệnh nhân COVID-19 bị bệnh nặng ở Anh và cho thấy rằng bệnh nhân COVID-19 có nhiều khả năng phát triển VAP hơn những bệnh nhân không có COVID-19 [ 25]. Nghiên cứu thứ hai là một thử nghiệm quan sát, đa trung tâm được thực hiện ở một số nước châu Âu và mô tả các đặc điểm lâm sàng của 4244 bệnh nhân COVID-19 bị bệnh nặng; tỷ lệ VAP ở bệnh nhân đặt nội khí quản là 58% [ 9 ]. Như đã đề cập trước đây, thời gian thở máy kéo dài và tỷ lệ mắc ARDS cao, cả điển hình của COVID-19, cùng với việc sử dụng thuốc ảnh hưởng đến chức năng hệ miễn dịch (trong nghiên cứu đa trung tâm ở châu Âu, 37,3% bệnh nhân được điều trị bằng steroid) góp phần làm tăng nguy cơ nhiễm trùng đường hô hấp thứ phát.
Các vi khuẩn phổ biến nhất liên quan đến VA-LRTI ở bệnh nhân COVID-19 là trực khuẩn Gram âm, chủ yếu là Pseudomonas aeruginosa , Enterobacter spp. và Escherichia coli , tiếp theo là cầu khuẩn Gram dương, chủ yếu là Staphylococcus aureus [ 24 ]. Đáng chú ý, một số báo cáo nhỏ hơn mô tả tỷ lệ vi sinh vật phổ biến khác nhau. Ví dụ, Sharifipour et al. [ 26 ] báo cáo rằng trong số 19 bệnh nhân ICU, nhiễm trùng đường hô hấp thứ phát do Acinetobacter baumannii trong 90% trường hợp và S. aureustrong 10% còn lại. Tuy nhiên, những phát hiện của loạt trường hợp nhỏ, đơn lẻ này chịu ảnh hưởng rõ ràng của dịch tễ học địa phương và không đại diện cho dân số chung của bệnh nhân COVID-19 ICU.
Các bệnh nhiễm trùng thứ phát phổ biến thứ hai ở những bệnh nhân COVID-19 bị bệnh nặng là nhiễm trùng máu (BSI). Một báo cáo của Ý ước tính nguy cơ tích lũy phát triển một đợt BSI là gần 25% sau 15 ngày lưu trú tại ICU và cao hơn 50% sau 30 ngày. Trong phân tích đa biến, điều trị chống viêm bằng tocilizumab hoặc với methylprednisolone có liên quan độc lập với sự phát triển của BSI [ 27 ]. Buetti và cộng sự. [ 28] đã tiến hành một nghiên cứu bệnh chứng so sánh BSI ở 235 bệnh nhân COVID-19 và 235 không COVID 19 được nhận vào ICU ở Pháp và mô tả tỷ lệ mắc bệnh lần lượt là 14,9% và 3,4%. Ở những bệnh nhân bị nhiễm SARS-CoV-2, BSIs xuất hiện trung bình 12 ngày sau khi nhập viện ICU. Các vi sinh vật phổ biến nhất gây ra BSI là tụ cầu âm tính với coagulase (36%). Các tác giả cũng quan sát thấy sự gia tăng đáng kể nguy cơ BSI ở bệnh nhân COVID-19 được điều trị bằng tocilizumab hoặc anakinra [ 28 ].

Nhiễm nấm
Ai cũng biết rằng viêm phổi do virut gây ra bởi virut cúm có thể tạo điều kiện cho sự phát triển của bệnh aspergillosis phổi xâm lấn, đặc biệt ở những bệnh nhân có ARDS, với tác động rõ rệt đến thời gian nhập viện và tử vong [ 29 ]. Dữ liệu hạn chế có sẵn ở những bệnh nhân bị bệnh nặng với COVID-19 dường như xác nhận mối liên quan giữa nhiễm SARS-CoV-2 và sự phát triển của bệnh aspergillosis xâm lấn và một số tác giả đã gợi ý sự tồn tại của một thực thể lâm sàng được gọi là bệnh aspergillosis phổi liên quan đến COVID-19 [ 30 ]. Các yếu tố nguy cơ của bệnh aspergillosis phổi xâm lấn ở bệnh nhân COVID-19 là tổn thương phổi trực tiếp do nhiễm virus, sử dụng corticosteroid, ARDS khi xuất hiện, điều trị bằng kháng sinh phổ rộng và các bệnh đi kèm [30 ]. Các báo cáo ban đầu từ Trung Quốc rất không đồng nhất, mô tả tỷ lệ nhiễm Aspergillus dao động từ 3% đến 23% ở những bệnh nhân bị bệnh nặng với COVID-19 [ 31 , 32]. Sự biến đổi này có thể là do thiếu tiêu chí định nghĩa chính xác và thuật toán chẩn đoán tiêu chuẩn cho bệnh aspergillosis phổi xâm lấn, có thể dẫn đến việc đánh giá thấp tỷ lệ mắc bệnh aspergillosis phổi xâm lấn trong một số nghiên cứu, trong khi ở một số nghiên cứu khác, việc hiểu sai về sự xâm lấn của khu trú có thể dẫn đến đánh giá quá cao rủi ro. Các nghiên cứu ở Châu Âu báo cáo tỷ lệ nhiễm aspergillosis phổi xâm lấn cao (từ 20% đến 35%) ở những bệnh nhân nguy kịch mắc ARDS do COVID-19, với tỷ lệ tử vong cao, dao động từ 45 đến 67% [ 33 , 34 ]. Aspergillus spp phổ biến nhất . chịu trách nhiệm cho bệnh aspergillosis phổi xâm lấn ở những bệnh nhân này dường như là Aspergillus fumigatus(được phân lập trong 90% các mẫu cấy), tiếp theo là Aspergillus flavus [ 30 ].
Chẩn đoán nhiễm trùng thứ phát
Nhiễm khuẩn
Như đã đề cập trước đây, các bệnh nhiễm trùng thứ phát phổ biến nhất ở những bệnh nhân bị bệnh nặng với COVID-19 là VAP và BSI. Chẩn đoán được thực hiện khi bệnh nhân có các triệu chứng lâm sàng và dấu hiệu nhiễm trùng và mầm bệnh mới được phát hiện trong bệnh phẩm sinh học. VAP được định nghĩa là sự kết hợp của thâm nhiễm phổi dai dẳng trên hình ảnh X quang và cấy vi sinh dương tính từ bệnh phẩm đường hô hấp dưới với nghi ngờ lâm sàng về viêm phổi mới khởi phát ở một bệnh nhân đã được thở máy xâm nhập ít nhất 48 giờ [ 35 , 36 , 37 ]. Các thang điểm, chẳng hạn như Điểm nhiễm trùng phổi lâm sàng (CPIS) [ 38 ] (dựa trên sáu biến số: nhiệt độ, bạch cầu trong máu, mức độ bài tiết khí quản, oxy hóa, thâm nhiễm X quang và nhuộm Gram trên dịch hút khí quản), đã được phát triển để giúp các bác sĩ lâm sàng chẩn đoán VAP, nhưng các hướng dẫn gần đây nhất [ 36 , 39] làm nổi bật vai trò của các dấu hiệu lâm sàng của nhiễm trùng (tức là mới khởi phát sốt, tiết mủ từ đường thở, tăng bạch cầu hoặc giảm bạch cầu, suy giảm oxy máu, tăng nhu cầu sử dụng thuốc co mạch và hoạt mạch) hơn là sử dụng thang điểm. Các kỹ thuật hình ảnh, chẳng hạn như chụp X-quang ngực [ 37 ], chụp cắt lớp vi tính ngực, và gần đây là siêu âm phổi [ 40 , 41 ], được điều chỉnh để phát hiện thâm nhiễm phổi mới và các dấu hiệu viêm (ví dụ, protein phản ứng C, procalcitonin ) có thể hỗ trợ chẩn đoán lâm sàng.
Tuy nhiên, liệu pháp kháng sinh đầy đủ và cụ thể đòi hỏi chẩn đoán vi sinh dựa trên các xét nghiệm và kiểm tra nuôi cấy (ví dụ: nhuộm Gram, dấu ấn sinh học, xét nghiệm chẩn đoán nhanh, phản ứng chuỗi polymerase [PCR]) để cho phép xác định các vi khuẩn liên quan. Có thể lấy mẫu từ đường thở xa theo cách xâm lấn hơn bằng cách sử dụng nội soi phế quản (tức là rửa phế quản phế nang [BAL], bàn chải tiêu bản được bảo vệ [PSB]), theo cách ‘ít xâm lấn hơn’ (ví dụ, mini-BAL mù, PSB mù ) hoặc từ đường thở gần (hút nội khí quản); một phân tích tổng hợp gần đây [ 42] so sánh các mẫu cấy từ đường thở gần và đường thở xa cho thấy không có sự khác biệt về kết quả của bệnh nhân, nhưng cần nhớ rằng việc lấy mẫu từ đường thở xa có thể liên quan đến tăng nguy cơ cho bệnh nhân (tức là giảm oxy máu, chảy máu). Hơn nữa, các quy trình xâm lấn có liên quan đến khả năng tiếp xúc với các hạt vi rút được phun khí dung, gây rủi ro cho nhân viên y tế.
BSI ở những bệnh nhân bị bệnh nặng được định nghĩa là sự khởi đầu của các dấu hiệu và triệu chứng nhiễm trùng trong vòng 24 giờ sau khi cấy máu dương tính. Cấy máu và xác định vi khuẩn cụ thể là tiêu chuẩn vàng để chẩn đoán, nhưng một mẫu cấy dương tính đơn lẻ không gợi ý nhiễm trùng khi có chất gây ô nhiễm điển hình trên da người; trong trường hợp này, chẩn đoán cần ít nhất hai lần cấy máu dương tính với vi sinh vật trong vòng 48 giờ.
Nhiễm nấm
Nhiễm nấm aspergillosis phổi liên quan đến COVID-19 nên được nghi ngờ ở tất cả bệnh nhân mắc COVID-19 có biểu hiện sốt khó chữa kéo dài hơn 3 ngày sau khoảng thời gian trì hoãn ban đầu 48 giờ (sau khi điều trị kháng sinh thích hợp), trao đổi khí xấu đi, khởi phát ho ra máu, hoặc tiếng cọ màng phổi mới [ 29 ]. Một thuật toán đầy đủ và chính xác để chẩn đoán bệnh aspergillus phổi liên quan đến COVID-19 vẫn còn thiếu nhưng sẽ hữu ích khi tìm kiếm Aspergillus spp. trong các mẫu hô hấp (ví dụ, rửa phế quản phế nang, hút khí quản) và sử dụng các dấu ấn sinh học huyết thanh học như galactomannan trên các mẫu hô hấp và huyết thanh. Các xét nghiệm khác có thể giúp chẩn đoán aspergillosis phổi liên quan đến COVID-19 là aspergillus PCR và huyết thanh (1 → 3) -β- D-glucan.
Nguyên tắc điều trị
Nhiễm khuẩn
Các hướng dẫn ban đầu của Chiến dịch nhiễm trùng huyết sống sót để quản lý bệnh nhân bị bệnh nặng với COVID-19 đề xuất một tác nhân kháng khuẩn theo kinh nghiệm ở tất cả các bệnh nhân thở máy [ 43 ]. Tuy nhiên, các dữ liệu sau đó đã chỉ ra rằng, khi nhập viện ICU, bệnh nhân nhiễm SARS-CoV-2 hiếm khi bị nhiễm vi khuẩn đồng thời. Vì lý do này, và do tỷ lệ cao các biến chứng nhiễm trùng do vi trùng đa kháng thuốc (MDR) gây ra, hầu hết các chuyên gia đồng ý rằng việc sử dụng dự phòng liệu pháp kháng sinh theo kinh nghiệm trong trường hợp không có dấu hiệu rõ ràng của đồng nhiễm trùng hoặc nhiễm trùng thứ cấp. nên nản lòng. Thật vậy, người ta đã chứng minh rằng điều trị kháng sinh ban đầu không phù hợp có liên quan đến tăng tỷ lệ tử vong ở bệnh nhân VAP và tăng khả năng kháng thuốc của vi khuẩn [44 ]. Ngoài ra, ở những bệnh nhân bị bệnh nặng, có thể sử dụng các liều khác với liều thường được khuyến cáo, vì liều bình thường có thể không đạt được nồng độ thuốc hiệu quả tại vị trí đích hoặc vì chúng có thể liên quan đến các phản ứng có hại do nồng độ độc tố. Vì những lý do này, nên theo dõi nồng độ đáy trong huyết tương của thuốc điều trị.
Các hướng dẫn có sẵn [ 35 , 36] khuyến cáo rằng điều trị theo kinh nghiệm nên được bắt đầu ngay khi nghi ngờ VAP trên lâm sàng. Liệu pháp theo kinh nghiệm nên được sửa đổi dựa trên kết quả của các xét nghiệm nuôi cấy. Việc lựa chọn phương pháp điều trị theo kinh nghiệm chủ yếu dựa trên các yếu tố nguy cơ của bệnh nhân đối với các tác nhân gây bệnh MDR và mô hình tính nhạy cảm với kháng sinh tại địa phương. Trong số các yếu tố nguy cơ của MDR là ARDS trước VAP và thời gian nằm viện> 5 ngày, cả hai đều rất có thể có ở bệnh nhân COVID-19. Trong trường hợp này, lựa chọn điều trị theo kinh nghiệm nên là thuốc chống pseudomonas phổ rộng β-lactam cộng với thuốc kháng giả không β-lactam (ví dụ, piperacillin-tazobactam cộng với amikacin). Khi lựa chọn kháng sinh, điều quan trọng là phải xem xét mô hình nhạy cảm tại chỗ và kết quả giám sát vi sinh vật đối với sự xâm nhập của bệnh nhân.S. aureus (MRSA) nên được xem xét ở những đơn vị có tỷ lệ VAP cao hơn 20% [ 35 ]. Sau khi thu được kết quả nuôi cấy và tính nhạy cảm, mục tiêu chính là loại bỏ các kháng sinh không cần thiết (đặc biệt là anti-MRSA và carbapenems) và sử dụng một tác nhân phổ hẹp nếu có thể.
Nhiễm nấm
Bệnh nhân bị aspergillosis xâm lấn thường có nhiều bệnh đi kèm, cùng với bệnh cơ bản, có thể ảnh hưởng đến dược động học của thuốc chống nấm. Như đã báo cáo trước đó đối với các tác nhân kháng khuẩn, ngay cả đối với thuốc hạ sốt, nguy cơ không đạt được nồng độ mục tiêu tại vị trí nhiễm trùng hoặc độc tính vẫn tồn tại, đặc biệt là ở những bệnh nhân bị bệnh nặng, do đó nên theo dõi thuốc điều trị. Do tỷ lệ tử vong cao ở những bệnh nhân mắc bệnh COVID-19 nguy kịch và nhiễm aspergillosis phổi xâm lấn đồng thời, nên bắt đầu điều trị ngay khi có chẩn đoán aspergillosis phổi xâm lấn.
Voriconazole được khuyến cáo là điều trị đầu tiên trong bệnh aspergillosis phổi xâm lấn, với nồng độ đáy huyết tương mục tiêu là 2–6 mg / l. Theo dõi lặp lại được chỉ định cho đến khi xác nhận mức độ ổn định hoặc nếu có sự thay đổi về tình trạng lâm sàng của bệnh nhân hoặc nghi ngờ có độc tính. Ở những bệnh nhân bị rối loạn chức năng gan hoặc khi không thể sử dụng voriconazole, liposomal amphotericin B là thích hợp. Ở những bệnh nhân không đáp ứng hoặc không dung nạp liệu pháp ban đầu, echino-candin đơn độc hoặc kết hợp với voriconazole được chỉ định [ 45 ].
Sự kết luận
Nhiễm trùng thứ phát, thường do vi trùng MDR gây ra, thường gặp ở những bệnh nhân bị bệnh nặng với COVID-19 được nhận vào ICU, do một số điều kiện thuận lợi. Chẩn đoán sớm và chính xác và tổ chức điều trị kháng sinh đầy đủ là điều cần thiết để cải thiện kết quả của bệnh nhân. Dữ liệu được công bố sơ bộ chỉ ra rằng nhiễm trùng thứ phát có liên quan đến việc tăng thời gian thở máy và thời gian nằm ICU, và chúng có thể có tác động đến sự sống còn của bệnh nhân. Tuy nhiên, dữ liệu từ các nghiên cứu lớn, được thiết kế tốt là cần thiết để xác nhận những phát hiện này và để nâng cao kiến thức của chúng tôi về dịch tễ học và điều trị các bệnh nhiễm trùng làm phức tạp quá trình lâm sàng của COVID-19