Kỹ thuật y khoa
Nguyên tắc thông khí cơ học và các chiến lược hỗ trợ thông khí trong bệnh phổi ở trẻ sơ sinh
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
nhathuocngocanh.com – Bài viết Nguyên tắc thông khí cơ học và các chiến lược hỗ trợ thông khí trong bệnh phổi ở trẻ sơ sinh được biên dịch bởi Thạc sĩ – Bác sĩ Đặng Thanh Tuấn công tác tại Khoa Hồi sức ngoại – Bệnh viện Nhi đồng I.
Nội dung chính
- Các chiến lược chung để giảm tổn thương phối bao gồm tránh thông khi cơ học xám lần bằng các kỹ thuật không xâm lấn, và nếu không thể tránh khỏi việc đặt nội khí quản, hãy hạn chế thời gian thờ may xâm lần càng nhiều càng tốt
- Trong quá trình thở máy thông thường (conventional ventilation — CV), su oxygen hoa bị ảnh hưởng bởi áp lực đường thờ trung bình (PEEP là yếu tổ chính cùng với PIP và thời gian hit vào), cũng như nồng độ oxy trong khi hít vào
- Loại bỏ CQ, trong quá trình thông khí thông thường tỷ lệ với thong khi phát phế nang (Tần số thở X [Thể tích khí lưu thông – Khoảng chết]). Tuy nhiên, thời gian thở ra (expiratory time – Tạ) không đủ ở tần số cao có thể dẫn đến tình trạng bày khi và ủ CO2.
- Đối với trẻ sơ sinh được bổ sung oxy, nhằm mục tiêu bão hòa oxy ở mức cao hơn 90% một chút khi áp dụng cho trẻ non thang và ở mức khoảng 95% khi áp dụng cho trẻ đủ tháng dường như là một cách tiếp cận thận trọng.
- Mục tiêu PaCO2 thay đổi tùy theo giai đoạn và bản chất của bệnh lý hồ hấp. Mục tiêu trong khoảng 40 đến trên 50 một chút là thích hợp cho trẻ sơ sinh bị bệnh hồ hấp cấp tính như RDS, nhưng các mục tiêu cao hơn (tăng CD, máu cho phép) giúp giảm thiểu tổn thương phối, có lợi trong các tình trạng như BFD và CDH nghiêm trọng.
Giới thiệu
Việc phát triển các công nghệ máy thở mới, cải thiện hiểu biết về cơ học phối của trẻ sơ sinh, cũng như việc sử dụng ngày càng nhiều steroid trước sinh và surfactant sau sinh đã làm giảm đáng kể tỷ lệ tử vong của trẻ sinh non trong 4 thập kỷ qua. Tuy nhiên, với tỷ lệ sống sót ngày càng tăng của trẻ sinh non, các di chứng hô hấp như loạn sản phế quản phổi (bronchopulmonary dysplasia – BPĐ) tiếp tục dẫn đến tỷ lệ mắc bệnh đáng kể và tử vong muộn. Tương tự với những cải tiến trong chăm sóc sản khoa và giảm tỷ lệ mắc hội chứng hit phân su (meconium aspiration syndrome – MAS), sử dụng thông khí tần số cao và đưa vào sử dụng oxit nitric dạng hít và oxygen hóa qua màng ngoài cơ thể (extracorporeal membrane oxygenation – ECMO), thì tỷ lệ mắc bệnh và tử vong của trẻ sơ sinh đủ tháng và gần dủ tháng do suy hô hấp đã giảm rõ rệt. Tuy nhiên, tỷ lệ tử vong và tỷ lệ mắc bệnh dài hạn do một số vấn đề như thoát vị hoành bẩm sinh (congenital diaphragmatic hernia – CDH), giảm sản phối liên quan đến thiếu ối nặng và rối loạn phát triển của phổi tiếp tục ở mức cao. Mặc dù có một số tiến bộ trong công nghệ máy thở, song trong nhiều trường hợp lâm sàng vẫn chưa rõ phương thức thông khi nào là cách tiếp cận tối ưu và có cơ hội tốt nhất để giảm tổn thương phổi liên quan đến máy thở vốn có khả năng góp phần gây bệnh hô hấp lâu dài. Ở trẻ sơ sinh, nguy cơ tổn thương phối cấp tinh và mãn tính tăng lên khi thời gian thông khi hỗ trợ lâu hơn. Những trẻ nhỏ nhất và trẻ sinh cực non có nguy cơ cao nhất bị các biến chứng lâu dài của thông khi hỗ trợ kéo dài. Có khả năng rằng, một cách tiếp cận thông khí cá nhân hóa dựa trên sinh lý bệnh cơ bản của phổi có thể giúp cải thiện đáng kế kết cục phối dài hạn.
Thông khi áp lực dương liên quan đến sự di chuyển của hỗn hợp khí (thường là không khí được làm giàu oxy) vào phổi bằng cách sử dụng nguồn áp lực bên ngoài để tạo ra một sự chênh lệch áp lực, với thì thở ra thường là thụ động (ngoại trừ trong thông khi dao động tần số cao). Thông khi có thể đạt được bằng các phương thức thông khí xâm lấn (thông thường và tần số cao), hoặc không xâm lấn. Chương này sẽ thảo luận về các nguyên tắc của thông khí hỗ trợ thông thường (xâm lấn và không xâm lấn), đồng thời cung cấp các chiến lược thở máy tiềm năng ở trẻ sơ sinh bị hội chứng suy hô hấp (respiratory distress syndrome – RDS) và các bệnh lý hô hấp khác ngoài RDS.
Các nguyên tắc cơ bản của chiến lược thở máy có thể được tóm tắt như sau:
- Tránh bắt đầu thở máy càng nhiều càng tốt – sử dụng các chiến lược không xâm lấn trước, và chỉ đặt nội khí quản khi thực sự cần thiết.
- Sử dụng các cài đặt thông khí ít gây tổn hại nhất đến phổi (áp lực thấp nhất cần thiết để có đủ dung tích cặn chức năng [functional residual capacity – FRC] và thể tích khí lưu thông), có thể dẫn đến trao đổi khi đẩy đủ nhưng không quá mức.
- Giảm thiểu thời gian thở máy và cố gắng rút nội khí quản càng sớm càng tốt.
- Theo dõi cẩn thận tình trạng sinh lý và trao đổi khí là điều cần thiết, với việc bắt đầu và điều chỉnh các cài đặt dựa trên sinh lý bệnh của bệnh, đáp ứng được với các thay đổi trong liệu pháp điều trị.
- Điều dưỡng và chuyên viên chăm sóc hô hấp tốt nhất.
Khái niệm cơ bản về thông khí áp lực dương thông thường
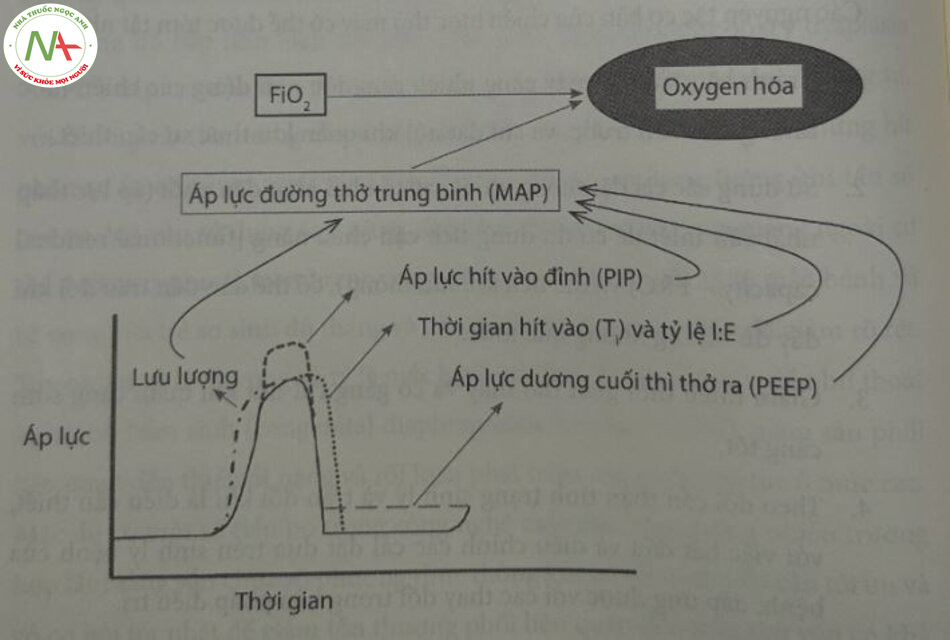
Dù là trong mọi chế độ (theo chu kỳ thể tích, theo chu kỳ áp lực hay thông khí kép) và mọi phương pháp hỗ trợ (thông khí bắt buộc liên tục, thông khí trợ giúp/kiểm soát, thông khí bắt buộc ngắt quãng, thông khi bắt buộc ngắt quãng đồng bộ, thông khí hỗ trợ áp lực và thông khí không xâm lấn), thì các khải niệm cơ bản về thông khi áp lực dương thông thường vẫn tương tự nhau. Các thông số cơ bản của thông khi áp lực dương thông thường gồm có: Áp lực hít vào đỉnh (PIP), áp lực dương cuối thì thở ra (PEEP), tần số máy thở, tỷ lệ hít vào thở ra (I:E), nồng độ oxy trong khí hít vào (FiO2) và lưu lượng. Dưới đây là các cuộc thảo luận ngắn gọn về từng thành phần và tác động của chúng đối với sự thông khí và oxygen hóa; hình ảnh minh họa về mối quan hệ của chúng đối với oxygen hóa được thể hiện trong Hình 23.1.
Áp lực hít vào đỉnh (PIP)
Áp lực hít vào đỉnh (peak inspiratory pressure – PIP) là áp lực đường thở gần cao nhất được cung cấp trong thì hít vào. PIP ảnh hưởng trực tiếp đến áp lực delta (sự khác biệt giữa PIP và PEEP), do đó nó xác định thể tích khí lưu thông cung cấp cho trẻ sơ sinh. Vì sự thải trừ carbon dioxide tỷ lệ thuận với thể tích khí lưu thông cung cấp, nên việc tăng PIP sẽ làm tăng thải trừ carbon dioxide. Những thay đổi của PIP cũng ảnh hưởng đến oxygen hóa bằng cách thay đổi áp lực đường thở trung bình (mean airway pressure – MAP). Mức PIP dưới mức tối ưu dẫn đến thể tích khí lưu thông không đủ, gây tăng CO, và giảm oxy máu. Mặt khác, mức độ PIP cao hơn sẽ gây căng phồng phế nang quá mức, chấn thương thể tích (volutrauma), rò rỉ khí, giảm CO, máu, giảm tưới máu phối và tim, cũng như tổn thương phổi cấp tính và mãn tính. Ngoài ra, việc cung cấp mức PIP cao hơn khi sức cản của đường thở cao và hằng số thời gian (time constant – TC) kéo dài cũng dẫn đến chấn thương thể tích và bẫy khí. Hầu hết trẻ sơ sinh có thể không cần thể tích khí lưu thông quá 4–6 mL/kg để thông khí và oxygen hóa. Mức PIP cần thiết để cung cấp thể tích khí lưu thông tối ưu phụ thuộc vào độ giãn nở của phổi. Mức độ giãn nở của thành ngực trong thì hít vào có thể tương quan khá chặt chẽ với độ giãn nở của phổi. Một chỉ số làm sàng hữu ích của PIP đẩy đủ là thành ngực nâng lên nhẹ nhàng với mỗi nhịp thở do máy thở cung cấp, tương tự như sự giãn nở lồng ngực được thấy ở trẻ sơ sinh thở tự nhiên thoải mái. Nên sử dụng PIP có hiệu quả thấp nhất, nhằm duy trì sự trao đổi khí đầy đủ nhưng giảm thiểu chấn thương thể tích và giảm nguy cơ rò rỉ khí. Tác động sinh lý từ những thay đổi của PIP được liệt kê ở Bång 23.1.
| Bảng 23.1 Ảnh hưởng từ những thay đổi của PIP | |
| Những thay đổi của PIP | Tác động sinh lý |
| PIP tối ưu |
|
| PIP cao hơn |
|
| PIP thấp hơn |
|
Áp lực dương cuối thì thở ra (PEEP)
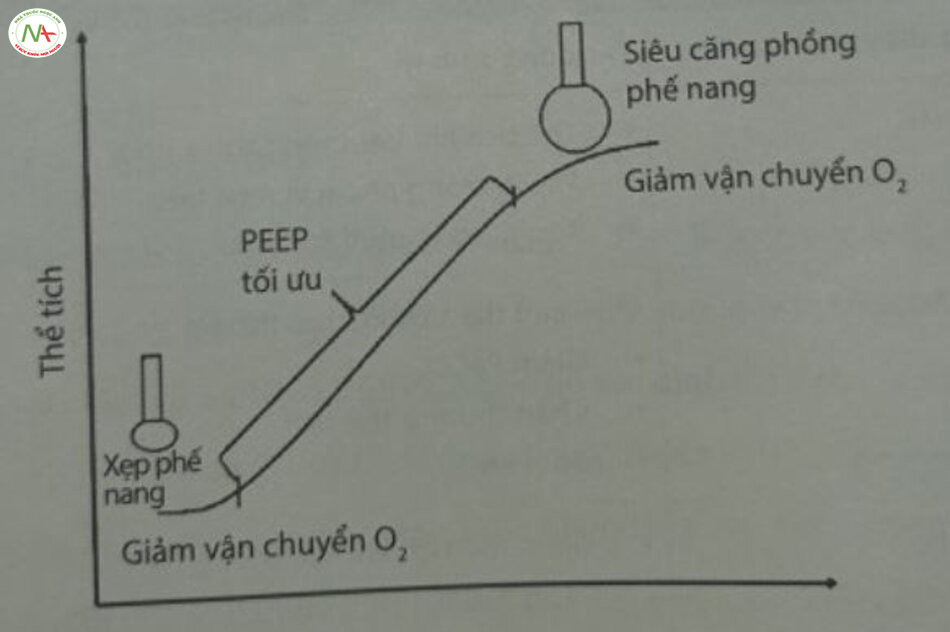
Áp lực dương cuối thì thở ra (positive end-expiratory pressure – PEEP) là áp lực trong đường thở cao hơn áp lực môi trường xung quanh khi kết thúc quả trình thở ra thụ động. PEEP là áp lực căng giúp phối duy trì FRC bằng cách giữ cho các phế nang căng phồng. Nhờ giảm sức căng bề mặt, surfactant ngăn không cho phế nang xẹp xuống trong mỗi lần thở ra và duy trì FRC. Trong các tình trạng thiếu surfactant (ví dụ như RDS), cần có PEEP thích hợp để khác phục sự gia tăng sức căng bề mặt và duy trì FRC. Cung cấp PEEP trong quá trình thông khí làm giảm công của cơ hô hấp bằng cách giữ cho các phế nang ở độ căng tối ưu sau khi thở ra và giảm sức cản đường thở. Mặc dù PEEP tăng sẽ làm tăng FRC, nhưng nếu tăng PEEP rất cao sẽ dẫn đến độ giãn nở phổi kém và giảm thể tích khí lưu thông, gây tích tụ carbon dioxide. Mặt khác, PEEP dưới mức tối ưu gây xẹp phế nang và đòi hỏi PIP cao hơn trong mỗi lần hít vào để mở các phế nang bị xẹp. Cả xẹp phế nang và căng phổi quá mức đều gây co thắt mao mạch phế nang, do đó dẫn đến shunt phổi và gây giảm vận chuyển oxy (Hình 23.2). Đối với nhiều trẻ sinh non bị RDS, mức PEEP từ 4 đến 5 cm H,O được dung nạp tốt và đủ để cải thiện oxygen hóa. Tác động sinh lý từ những thay đổi của PEEP được liệt kê ở Bảng 23,2.
| Bảng 23.2 Ảnh hưởng từ những thay đổi của PEEP | |
| Thay đổi của PEEP | Tác động sinh lý |
| PEEP tối ưu |
|
| PEEP thấp |
|
| PEEP cao |
|
Tần số máy thở
Tần số máy thở (ventilator rate) là số nhịp thở do máy thở cung cấp trong một phút. Thông khí phút là tích số của tần số và thể tích khí lưu thông; trong khi đó, thông khí phút phế nang là tích số của thể tích khí lưu thông trừ cho khoảng chết và tần số. Tần số máy thở thấp hơn làm giảm thông khi phút. Tấn số máy thở cao hơn (với thời gian hít vào không đổi) làm giảm thời gian thở ra (T), do đó dẫn đến bẫy khí và ứ carbon dioxide.
Ngưỡng mà thể tích khi lưu thông giảm khi tần số tăng phụ thuộc vào hằng số thời gian (time constant) của hệ hô hấp. Hằng số thời gian đơn được định nghĩa là khoảng thời gian cần thiết để áp lực hoặc thể tích phế nang đạt tới 63% áp lực hoặc thể tích phế nang đỉnh. Độ giãn nở của phổi và sức cản xác định hằng số thời gian như sau:
Hằng số thời gian = Độ giãn nở X Sức cản
Trẻ sơ sinh có phổi chưa trưởng thành bị thiếu surfactant, dẫn đến độ giãn nở của phổi kém và do đó có hằng số thời gian ngắn hơn. Trẻ sơ sinh bị RDS có hằng số thời gian ngắn, có thể chịu được tần số máy thở cao hơn mà không ảnh hưởng đến thông khí phút. Tần số cao hơn 60 lần/phút thường được dung nạp tốt ở trẻ bị RDS. Tuy nhiên, ngay cả ở những tình trạng bệnh với hằng số thời gian ngắn, tần số rất nhanh có thể dẫn đến PEEP không chủ ý và bẫy khí do thời gian thở ra không đủ. Cần cẩn thận lưu ý những thay đổi trong chuyển động của thành ngực trong lúc tăng tần số máy thở, nhằm ngăn chặn tình trạng bẫy khí và ứ carbon dioxide. Không có giai đoạn ngưng chuyển động thành ngực ngắn trong thời gian cuối của thì thở ra có thể cho thấy thời gian thở ra không đủ. Tác động sinh lý từ những thay đổi của tần số máy thở được liệt kê ở Bảng 23.3.
| Bảng 23.3 Ảnh hưởng từ những thay đổi của tần số máy thở | |
| Thay đổi tần số máy thở | Tác động sinh lý |
| Tần số tối ưu |
|
| Tần số thấp |
|
| Tần số cao |
|
Tỷ lệ hít vào:thở ra
Hằng số thời gian của hệ hô hấp quyết định thời gian hít vào T và thời gian thở ra T. Hằng số thời gian thở ra dài hơn hít vào. Thông thường, một khi tần số máy thở và T được cài đặt, T và I:E sẽ tự động được xác định. Tỷ lệ I:E thông thường là 1:3. Tăng tần số máy thở mà không giảm T sẽ làm giảm thời gian thở ra và dẫn đến bẫy khí. T 0,3–0,5 giây là đủ cho hầu hết trẻ sơ sinh. T cực ngắn (nhỏ hơn 0,2 giây) hoặc cực dài (lớn hơn 0,7 giây) có thể dẫn đến thể tích khí lưu thông thấp và bẫy khí. Tỷ lệ I:E đảo ngược (với thời gian hít vào dài hơn thời gian thở ra) có thể cải thiện oxygen hóa, nhưng phải trả giá bằng sự suy giảm hồi lưu của tĩnh mạch, bảy khí và rỏ rỉ khí, nên không còn được khuyến khích nữa.
Nồng độ oxy trong khi hít vào (FiO2)
Như có thể được dự đoán trước, những thay đổi về nồng độ oxy trong khi hít vào (inspiratory fractional oxygen concentration – FO ) có ảnh hưởng tỷ lệ thuận với hàm lượng oxy phế nang. Trong trường hợp không có shunt tử phải sang trái, tăng FiO2 cũng sẽ làm tăng oxygen hóa hệ thống.
Điều quan trọng cần ghi nhớ là: Cả sự thay đổi FiO2 lẫn MAP đều làm tăng oxygen hóa (Hình 23.1), bác sĩ lâm sàng phải đánh giá sự đóng góp tương đối của chúng vào oxygen hóa và điều chỉnh thông số chính xác. Nhìn chung, nếu MAP không đủ (thể tích phổi dưới FRC), thì cần có FiO2 cao hơn. Người ta có thể cố gắng xác định mức độ giãn nở tối ưu của phổi, đó là FRC khi FiO được yêu cầu thấp nhất. Ở trẻ sinh non trong giai đoạn cấp tính của RDS, FiO2 thường được điều chỉnh để giữ độ bão hòa oxy mục tiêu trong khoảng 91% đến 95%. Ở trẻ sơ sinh đã chắc chắn bị BPD, nếu có bằng chứng cho thấy tình trạng tăng áp động mạch phổi, độ bão hòa mục tiêu thường tăng nhẹ lên 92% – 97%.
Ở trẻ sinh non, điều quan trọng là cần tránh tình trạng độ bão hòa oxy quá cao (> 95%) để giảm nguy cơ mắc bệnh lý võng mạc do sinh non (retinopathy of prematurity – ROP), và do đó thường phải thay đổi FO, thường xuyên. Ở trẻ sơ sinh đủ tháng, nên tránh dùng FiO2 cao hơn mức cần thiết để duy trì PaO2 70-100 mmHg.
Cần sử dụng phương pháp đo độ bão hòa oxy mạch này (ít phổ biến hơn là phương pháp đo oxy qua da, hoặc phương pháp đo oxy cận hồng ngoại) để điều chỉnh việc cung cấp oxy, thay vì do khi máu động mạch không thường xuyên. Cả tăng cao áp lực, thể tích – gồm chấn thương áp lực (barotrauma) và chấn thương thể tích (volutrauma) – lần FiO2 cao đều có khả năng gây tổn thương phối, và những đóng góp chính xác của chúng đối với bệnh phổi mãn tính ở trẻ sơ sinh có thể khác nhau tùy thuộc vào nhiều biến số. Tuy nhiên, người ta thường tin rằng: Ở FO, < 60% hoặc 70%, nguy cơ ngộ độc oxy thấp hơn so với chấn thương thể tích. Trong các đợt thực hiện các thủ thuật làm giảm độ bão hòa oxy như điều chỉnh tư thể, hút đàm,… FiO2 có thể cần được tăng lên nhất thời. Những tiến bộ gần đây trong chăm sóc máy thở, bao gồm các hệ thống vòng kín tự động điều chỉnh FiD, dựa trên SpO2, có thể có khả năng giảm thiểu các giai đoạn giảm độ bão hòa oxy và tăng oxy máu.
Lưu lượng
Trong hầu hết máy thở hiện đại, những thay đổi của lưu lượng ảnh hưởng không nhiều đến sự trao đổi khí, miễn là lưu lượng đủ được sử dụng để tạo ra áp lực và tần số của máy thở.
Ảnh hưởng của khoảng chết
Khoảng chết (dead space) làm giảm thể tích khí lưu thông đến được phế nang. Trong khi khoảng chết sinh lý có thể được ngăn ngừa bằng những nỗ lực cải thiện tình trạng bơm phồng phổi và giảm các khu vực không được thông khí, thi khoảng chết giải phẫu có thể được giảm bớt bằng cách cắt ngắn ống nội khi quản và loại bỏ các thành phần khác góp phần vào khoảng chết.
Ví dụ, một số máy thở sử dụng một máy đo lưu lượng khí hô hấp (pneumotachometer) với khoảng chết 0,8 mL, được coi là một thể tích nhỏ. Tuy nhiên, đối với trẻ nặng 0,5 kg với thể tích khí lưu thông là 4 mL/kg (khoảng chết giải phẫu bằng 1,5 mL/kg), thể tích khí lưu thông thông thường ở mức 2 ml. (0,5 × 4 = 2 mL, với khoảng chết giải phẫu là 0,75 mL) cần được tăng thêm một lượng đáng kể (lên 2,8 mL, hoặc 40%) để vượt qua khoảng chết bổ sung này, điều này có thể làm tăng chấn thương thể tích.
| Bảng 23.4 Các chiến lược thở máy được sử dụng trong các bệnh lý hô hấp ở trẻ sơ sinh thường gặp (xử trí cần được cá nhân hóa vì nhiều trẻ sơ sinh yêu cầu các chiến lược ngoài phạm vi chung) | ||||||
| Bệnh lý | Mục tiêu | Tần số (lần/phút) | FiO2 (%) | PIP (cm H2O) | PEEP (cm H2O) | Ti (giây) |
| Trẻ sơ sinh non tháng | ||||||
| Hội chứng suy hô hấp (RDS) – sớm | pH 7,25-7,30, PaO2 50-70mm Hg (SpO2 91%-95%) và PaCO2 45-55 mmHg | 50-70 | 40%-70% (tối thiểu cần thiết) | 10-20 (tối thiểu cần thiết) | 4-5 | 0,25-0,4 |
| RDS – trước rút nội khí quản | pH 7,20-7,30, SpO2 91%-95% và PaCO2 < 60 trong tuần đầu tiên, < 70 trong tuần thứ hai | ≤ 20 | < 40 % | < 15 | < 6 | 0,25-0,4 |
| Ngưng thở ở trẻ sinh non (apnea of prematurity – AoP) | pH 7,25-7,4, SpO2 91%-95% và PaCO2 50-70 mmHg | 10-20 | 21 %-30%; thấp khi cần thiết | 10-15 (tối thiểu cần thiết) | 3-5 | 0,3-0,5 |
| Loạn sản phế quản phổi (BPD) – sớm | pH 7,20-7,25, SpO2 91%-95% và PaCo2 50-60 mmHg | 20-40 | 30%-80% (tối thiểu cần thiết ) | 15-25 (tối thiểu cần thiết) | 4-6 | 0,35-0,5 |
| BPD – nghiêm trọng | pH 7,20-7,25, SpO2 91%-95% và PaCO2 50-65 mmHg | 20-30 | 30%-80% (tối thiểu cần thiết) | Có thể cao tới 30-40; sử dụng tối thiểu cần thiết | 5-8 | 0,4-0,7 |
| Trẻ sơ sinh đủ tháng | ||||||
| Phổi bình thường (ví dụ như thở máy trong khi phẫu thuật) | pH 7,3-7,40 PaO2 70-100 mmHg (SpO2 93%-98%) và PaCO2 40-55 mmHg (35-45 mmHg ở trẻ ) | 30-50 | 21% – tối thiểu cần thiết | 10-15 | 3-5 | 0,35-0,45 |
| Tăng áp phổi dai dẳng ở trẻ sơ sinh (PPHN) | pH 7,35-7,45, PaO2 60-100 mmHg, SpO2 93%-98% và PaCO2 40-60 mmHg | 50-70 | 30%-80% | 15-25 | 3-5 | 0,3-0,4 |
| Hội chứng hít phân su (MAS) | pH 7,35-7,45 PaO2 60-120 mmHg, SpO2 93%-98% và PaCO2 40-60 mmHg | 30-50 | 30%-80% | 15-25 | 2-4 | 0,4-0,5 |
| Thoát vị bẩm sinh (CDH) | pH > 7,25 SpO2 trước ống 85%-95% và PaCO2 50-70 mmHg | 40-80 | 50%-90% | 15-25 | 3-4 | 0,25-0,35 |
Xử trí máy thở đối với các bệnh lý hô hấp thông thường ở trẻ sơ sinh
Xử trí thở máy đối với các bệnh lý hô hấp phổ biến ở trẻ sơ sinh được liệt kê dưới đây và được tóm tắt trong Bảng 23.4.
Xử trí máy thở trong hội chứng suy hô hấp
Hội chứng suy hô hấp (respiratory distress syndrome – RDS) là do thiếu và bất hoạt surfactant tương đối phổ biến ở trẻ sinh non. Sự thiếu hụt surfactant dẫn đến vị xẹp phế nang, giảm độ giãn nở của phổi và giảm thể tích phổi. Giảm độ giãn nở của phổi có liên quan đến hàng số thời gian rất ngắn (0,05–0,1 giây) trong giai đoạn cấp tỉnh của RDS. Nỗ lực mở rộng các vùng xẹp phổi bằng cách sử dụng áp lực đỉnh cao hơn có thể dẫn đến tổn thương cả đường thở lẫn nhu mô phổi xa.
Hỗ trợ hỗ hấp của trẻ sinh non bị RDS thường bao gồm lên thang từ bổ sung oxy không có áp lực (mũ chụp oxy loxygen hood], môi trường oxy, v.v…) hoặc CPAP sang thở máy.
Chỉ định thở máy bao gồm tiêu chỉ lâm sàng và tiêu chí khí máu.
Tiêu chí lâm sàng:
- Suy hô hấp với nhịp thở nhanh (tần số hô hấp vượt quả 60–70 lần/ phút) hoặc rút lõm ngực nặng (liên sườn, dưới sườn và trên xương ức).
- Oxygen hóa không đầy đủ (SpO2 < 91% với mũ chụp oxy hoặc CPAP với FiO2 > 40% đến 70%).
- Ngưng thở không đáp ứng với xử trí nội khoa (CPAP, và methylxanthine như aminophylline hoặc caffeine).
Tiêu chí khí máu:
- Tăng CO2 máu nặng với PaCO2 > 55 đến 60 mmHg và pH động mạch <7,2.
- Giảm oxy máu nặng với PaO2 < 40 mmHg ở FiO2 > 40% đến 70%.
Diễn biến lâm sàng của RDS ở từng trẻ sơ sinh có thể khác nhau. Một số trẻ sơ sinh, đặc biệt là những trẻ bị chuyển tiếp kéo dài khi sinh, được đặt nội khí quân và bơm surfactant ngay sau khi sinh. Những trẻ khác được thở CPAP tại phòng sinh, có thể không duy trì được oxygen hóa trên CPAP và được đặt nội khí quản nhanh chóng; trong khi đó, những trẻ khác yêu cầu CPAP/FO tầng dẫn hoặc phát triển ngưng thở nặng và được đặt nội khí quản sau đó. Quyết định đặt nội khí quản thường được đưa ra dựa trên tiêu chỉ lâm sàng ngay sau khi sinh, và dựa trên tiêu chi khi máu sau khi ổn định ban đầu. Các cài đặt và chiến lược máy thở cơ học ban đầu phải được cá nhân hóa, dựa trên mức độ nghiêm trọng của bệnh phổi, mức độ thông khi tự phát và các biến số khác (ví dụ như diễn biến lâm sàng cho đến khi đó, sự hiện diện của rò rỉ khí). Sự hiện diện của rút lõm ngực nói chung tự nó không đủ để trở thành một dấu hiệu cho thấy sự cần thiết phải thở máy.
Các thử nghiệm lâm sàng gần đây cho thấy cách tiếp cận thận trọng đối với đặt nội khí quản và thở máy là tốt nhất. CPAP mũi dự phòng khi so sánh với thở máy ở trẻ rất non tháng làm giảm nhu cầu thở máy và surfactant, đồng thời cũng làm giảm tỷ lệ BPD và tử vong hoặc BPD. Các thử nghiệm lớn gần đây, trong đó sử dụng steroid trước sinh là phổ biến và có sự ổn định sau sinh trên CPAP cho thấy: Nguy cơ bị BPD hoặc tử vong ít hơn khi sử dụng ổn định CPAP sớm với sử dụng surfactant chọn lọc cho trẻ cần đặt nội khí quản. Do đó, hầu hết bác sĩ lâm sàng đều sử dụng CPAP mũi dự phòng ở trẻ cực non tháng và bắt đầu CPAP sớm ở trẻ sinh non lớn hơn, chỉ dùng đến đặt nội khí quản, dùng surfactant và thở máy ở trẻ không được hỗ trợ CPAP Như đã đề cập trong các tiêu chí trước đó, oxygen hóa không đủ (về mặt lâm sàng hoặc tiêu chỉ về khí máu) hoặc ngưng thở thường được coi là thất bại của CPAP Ngưỡng FiO2 cho “thất bại CPAP” có thể thay đổi, tùy thuộc vào ý kiến của bác sĩ và đặc điểm lâm sàng (tuổi thai, tuổi sau sinh, mức độ nghiêm trọng của RDS). Tuy nhiên, nhìn chung thì ngưỡng thấp hơn (FO, > 30% đến 40%) được sử dụng cho trẻ sinh non bị bệnh nặng hơn (GA < 28 tuần, < 1 kg) ngay sau khi sinh (< 24 giờ), còn ngưỡng cao hơn (FiO2 > 60% đến 70%) được dùng cho trẻ sinh non lớn hơn (> GA 32 tuần, > 1,5 đến 2 kg) và vào những thời điểm muộn hơn (ngoài 48–72 giờ sau khi sinh).
Cài đặt ban đầu cho thông khí giới hạn áp lực, chu kỳ thời gian (time cycled pressure-limited ventilation – TCPLV) thông thường khi áp dụng cho trẻ sơ sinh bị RDS là tấn số hô hấp từ 50-70 nhịp thờ/phút, với PIP đủ để đạt chuyển động lồng ngực tương tự như một nhịp thở tự phát bình thường (thường là 10–20 cm H,O) và PEEP vừa phải (4.5 cm H,O). Thời gian hít vào thường dao động từ 0,25 đến 0,4 giây, và FiO2 từ 40% đến 70% (tùy thuộc vào FO, trên CPAP tại thời điểm chuyển tiếp). Các cài đặt này không phụ thuộc vào các yếu tố như cần nặng lúc sinh hoặc tuổi thai hay tuổi sau sinh của trẻ sơ sinh, mà phụ thuộc vào sinh lý bệnh của phổi, trao đổi khí và cơ học phổi. Mục tiêu khí máu trong giai đoạn đầu của RDS thường là pH 7,25–7,30, PaO2 50-70 mmHg (SpO2 91%–95%), và PaCO2 45–55 mmHg.
Sau khi sử dụng surfactant, cơ học phổi có thể thay đổi nhanh chóng và có thể cần phải điều chỉnh cài đặt máy thở thường xuyên, dựa trên chuyển động của ngực, thay đổi độ bão hòa oxy, đo O/CO, qua da, CO, cuối thì thở ra (ETCO,) và khí máu. Cài đặt máy thở ban đầu thường bao gồm tần số nhanh và thời gian hit vào ngắn hơn do hằng số thời gian ngắn. Sự kết hợp giữa tần số nhanh và thời gian hít vào ngắn, trái ngược với tần số thấp hơn và thời gian hít vào dài hơn, đã được chứng minh là làm giảm rò rỉ khí ở trẻ sơ sinh và giảm chấn thương phổi ở động vật. Thể tích khí lưu thông cần thiết cho trẻ sơ sinh bị RDS thường nằm trong khoảng 4-6 mL/kg. Cách giảm PaCO2 tốt hơn thường bằng cách tăng thông khí phút, thông qua tăng tần số máy thở thay vì tăng PIP (trừ phi PIP bắt đầu thấp), để giảm chấn thương thể tích. Nói cách khác, nếu trẻ sơ sinh có PaCO, thấp, trước tiên nên giảm PIP xuống áp lực cần thiết thấp nhất để chuyển động lồng ngực (và thể tích khi lưu thông) đẩy đủ, sau đó giảm tần số
PIP ban đầu cần thiết (từ 10 đến 20 cm H O) thường được xác định tại thời điểm bắt đầu thở máy bang cách quan sát áp lực cần thiết để tạo ra chuyển động lồng ngực đầy đủ. Nếu chuyển động lồng ngực quá mức, nên giảm nhanh PIP vì tổn thương phổi có thể nhanh chóng xảy ra. Nếu chuyển động lồng ngực không đầy đủ, nền tàng nhanh PIP vì giảm oxy máu cũng bất lợi. Nếu tăng PIP không làm tăng chuyển động lồng ngực hoặc thể tích khi lưu thông, cần đánh giá các nguyên nhân tiềm ẩn (ví dụ như tắc ống do nút nhầy, tuột ống, tràn khí màng phổi) trước khi tăng PIP lên mức cao hơn. Nếu thế tích khí lưu thông có thể đo được, cần điều chỉnh PIP để sử dụng PIP thấp nhất, nhằm tạo ra thể tích khí lưu thông thích hợp (thường là 4–6 mL/kg) để cung cấp trao đổi khi đầy đủ.
Trừ phi trẻ sơ sinh bị RDS rất nặng, thời gian thở máy thường ngắn (1–3 ngày). Khi trẻ đã ổn định với pH, PaO, và PaCO, thích hợp, nên tích cực cai máy thở. Nhiều bác sĩ làm sàng nhận thấy lợi ích khi hạn chế lượng dịch truyền (duy trì natri huyết thanh trong khoảng 140-150 mEq/L và giảm 10%-15% trọng lượng trong vài ngày đầu sau sinh, điều này thường có thể đạt được bằng tổng lượng dịch nhập vào ở mức 70 mL/kg/ngày trong môi trường ẩm tốt như lồng ấp), cũng như cung cấp methylxanthine (caffein hoặc aminophylline) cho trẻ bị RDS trong những ngày đầu sau sinh để hỗ trợ rút nội khí quản. Việc cai máy thở có thể được thực hiện tương đối nhanh (mỗi vài giờ), nếu được theo dõi chặt chẽ, chẳng hạn như theo dõi CO, qua dã hoặc khí máu thường xuyên. Trong thời gian cai máy thở, khi PIP được đưa xuống mức tương đối thấp (vi dụ: 10–12 cm HO), FiO2 có thể giảm xuống. Duy trì thể tích phổi thích hợp (FRC) bằng cách sử dụng đủ MAP sẽ đảm bảo thông khí/tưới máu (ventilation perfusion – V/Q) phù hợp, giúp giảm FiO. Nếu không thể giảm MAP, có khả năng là bất tương hợp V/Q và nguyên nhân có thể cần được kiểm tra – có thể là cần bổ sung liều surfactant, hoặc có các biến chứng như xẹp phổi. Sau vải ngày đầu tiên, khi nguy cơ xuất huyết não thất (IVH) thấp hơn, nhiều bác sĩ lâm sàng chọn cách dung nạp PaCO, cao hơn (tăng CO, cho phép), miễn là pH lớn hơn 7,2 và PaCO, không quá cao (thường < 60 mmHg trong tuần đầu tiên và < 70 mmHg trong tuần thứ hai). Điều quan trọng là giảm các cực của PaCO, (giảm CO, hoặc tăng CO,), vì cả hai cực đều có liên hệ với tổn thương thần kinh, và giảm CO, liên quan đến thông khí quá mức có thể liên quan chắn thương thể tích và diếc thần kinh giác quan.
Trẻ sơ sinh thường có thể được rút nội khí quân chuyển từ thở máy sang CPAP khi trẻ ở mức cài đặt đủ thập (tấn số dưới 20 lần/phút, PIP < 15 cm HO, PEEP < 6 cm HO, và FiO thường < 40%), kèm theo nỗ lực hô hấp tự phát tốt. Trẻ sơ sinh tụt nội khí quản vô tình ở các cài đặt cao hơn (nhưng gần với) các thông số này cũng có thể được chuyển sang CPAP để đánh giá xem trẻ có thể ngưng thở máy được hay không. Trong giai đoạn cấp tính của RDS, mức PEEP 5–6 cm H O có thể cần thiết để duy trì tình trạng bơm phong phổi và ngăn ngừa xẹp phổi cuối thì thở ra. Khi RDS hồi phục, PEEP có thể giảm từ từ xuống còn 4–5 cm H, trước khi rút nội khí quản chuyển sang CPAP. Giảm PEEP xuống dưới 3 cm H O không được khuyến cáo trong khi đặt nội khí quản, để ngăn ngừa giảm FRC. Trong quá trình cai máy thở, một khi PIP đã giảm và tần số giảm từ từ, cần phải quan sát mức độ của nỗ lực hô hấp tự phát. Trẻ sơ sinh có nỗ lực tự phát tốt có thể được cai máy thở nhanh hơn, trong khi những trẻ không đủ nỗ lực có thể cần được đánh giá thêm (PEEP quá mức sẽ ức chế nỗ lực thông khi tự phát; không dùng hoặc dùng không đủ liều lượng methylxanthine; tổn thương thần kinh trung ương; giảm thông khí với PaCO, thấp gây ức chế thở tự phát). Các kỹ thuật như thông khi do bệnh nhân kích hoạt (patient-triggered ventilation – PTV), hỗ trợ áp lực (pressure support – PS) và IMV đồng bộ hóa (synchronized IMV – SIMV) có thể hỗ trợ cai máy thở. Việc rút nội khí quản thường được thực hiện với áp lực đường thở dương liên tục qua mũi (nasal continuous positive airway pressure – NCPAP), mặc dù việc rút nội khí quân chuyển sang NCPAP kết hợp với thông khi áp lực dương không xâm lấn (noninvasive positive pressure ventilation – NIPPV), có thể đồng bộ hóa (synchronized NIPPV – SNIPPV), có khả năng giúp giảm thất bại khi rút nội khí quản (nghĩa là cần đặt lại nội khí quản ngay sau khi rút nội khí quản). Những trẻ sinh non lớn hơn, ít suy hô hấp hơn đôi khi có thể được rút nội khí quản trực tiếp chuyển sang thờ oxy qua mũ chụp oxy hoặc ống thông mũi.
Có nhiều kỹ thuật thông khí thay thế khác nhau, ngoài thông khí giới hạn áp lực, chu kỳ thời gian thông thường, bao gồm các phương pháp thông khí nhân mục tiêu thể tích khác nhau (ví dụ như đảm bảo thể tích (volume guarantee – VG]), thông khi tần số cao (ví dụ như thông khi phản lực, thông khi dao động), nhưng những phương pháp này có thể không mang lại lợi ích và có một số hạn chế đối với trẻ sơ sinh bình thường mặc RDS. Ví dụ, việc đo thể tích khi lưu thông khá không chính xác và không chuẩn xác ở thể tích rất thấp (< 5 mL), và do đó, trẻ sơ sinh đáng lẽ có khả năng được hưởng lợi nhiều nhất (trẻ ELBW có nguy cơ cao bị BPD) lại có thể không được hưởng lợi nhiều như kỳ vọng của các bác sĩ lâm sàng. Thông khi tần số cao thường được nỗ lực thực hiện như một liệu pháp cứu hộ trong trường hợp suy hô hấp giảm oxy máu mặc dù đã thống khi thông thường tối đa, hoặc trong các trường hợp có hội chứng rỏ rỉ khí (khi phê thủng mô kẻ phối Ipulmonary interstitial emphysema – PIE] hoặc tràn khí màng phổi).
Xử trí ngưng thở kháng trị ở trẻ sinh non
Trẻ sinh non có nguy cơ cao bị ngưng thở do sinh non (apnea of prematurity – AoP), và thưởng được xử tri bằng methylxanthin (caffeine hoặc aminophylline) hay CPAP hoặc kết hợp CPAP với methylxanthin. Tuy nhiên, một số trẻ sơ sinh (đặc biệt là trẻ sinh non tháng hoặc trẻ bị tổn thương thần kinh trung ương) với các cơn ngưng thở nghiêm trọng có thể cần nỗ lực hồi sức mặc dù điều trị CPAP và methylxanthine, và có thể yêu cầu dùng thử NIPPV, sau đó có thể phải đặt nội khí quản cũng như thở máy nếu thông khi không xâm lấn không đầy đủ. Vì trẻ sơ sinh được thờ máy chủ yếu vì ngưng thở, có tương đối ít bệnh phối hơn, nên trẻ có thể được thông khí bằng áp lực thấp hơn (10–15 cm H,O; đủ để chuyển động lồng ngực bình thường) và tần số thấp (10–20 lần/ phút), đi kèm FiO2 tháp để giữ SpO, trong mức 91%–95%.
Xử trí loạn sản phế quản phổi đã hình thành
Mặc dù BPD thường được xác định ở 28 ngày tuổi sau khi sinh hoặc 36 tuần sau kỳ kinh cuối, song các bác sĩ lâm sàng thường nhận thức được rằng: Trẻ sơ sinh không cải thiện nhanh và có nguy cơ cao bị BPD sau 1 hoặc 2 tuần sau khi sinh. Hầu hết trẻ sơ sinh bị RDS đều cải thiện nhanh chóng và được rút nội khí quản trước khi kết thúc tuần đầu tiên sau sinh với sự chăm sóc thích hợp. Trẻ sơ sinh không cho thấy sự cải thiện nhanh và vẫn yêu cầu cài đặt IMV (intermittent mandatory ventilation – thông khí bắt buộc ngắt quãng) cao có nguy cơ cao mắc BPD. Mục tiêu chính của xử trí máy thở trong BPD là duy trì sự trao đổi khi đầy đủ trong khi giảm thiểu tổn thương phổi liên quan đến máy thở. Việc cài đặt máy thở chính xác sẽ phụ thuộc vào cơ học phổi và tình trạng trao đổi khí. Trẻ sơ sinh mắc BPD có thể bị tổn thương và tu sửa khác nhau đối với nhu mô phổi, hệ mạch máu và đường thở. Trẻ sơ sinh bị bệnh phổi tương đối đồng nhất có thể yêu cầu cài đặt tương tự như đối với RDS, với tấn số tương đối nhanh hơn và áp lực thấp hơn; trong khi đó, trẻ bị xẹp phổi và có các khu vực siêu bơm phồng phổi có thể tốt hơn nếu áp dụng chiến lược tấn số thấp hơn cũng như áp lực cao hơn (và dẫn đến thể tích khí lưu thông cao hơn), với thời gian hít vào dài hơn (T 0,35–0,5 giây; do hằng số thời gian dài hơn) so với trẻ sơ sinh bị RDS. Một số trẻ sơ sinh bị BPD mãn tính nặng có thể được hưởng lợi từ việc thông khi mục tiêu thể tích và khả năng dung nạp PaCO, cao hơn, miễn là pH được duy trì > 7,2. Trẻ sơ sinh mắc BPD thường có sự tương hợp V/Q tốt hơn với mức PEEP cao hơn (5–8 cm H,O) so với trẻ bị RDS. Trẻ sơ sinh bị BPD nặng đôi khi đòi hỏi áp lực đỉnh rất cao (ví dụ như 30–40 cm H, O) và thể tích khí lưu thông cao (ví dụ như 10 mL/kg), mặc dù tấn số tương đối thấp hơn (ví dụ như 20 lần/phút) để duy trì oxygen hóa do bất tương hợp V/Q nặng, nhưng bác sĩ làm sàng nên cố gắng giảm các cài đặt này bất cứ khi nào có thể
Vấn đề quan trọng nên lưu ý là căn cai hỗ trợ máy thở bất cứ khi nào có thể, bất chấp sự thay đổi thường xuyên của tình trạng lâm sàng. Kỹ thuật mặc định thường là tăng các cài đặt máy thở nhanh chóng trong các đợt suy giảm nhưng phải cai máy thở rất chậm giữa các đợt như vậy, điều này dẫn đến việc cài đặt máy thở tăng dần theo thời gian làm trầm trọng thêm tình trạng tổn thương phổi gây ra do máy thở (ventilator-induced lung injury – VILI). Trẻ sơ sinh bị BPD nặng thường có thể được rút nội khí quản để chuyển sang CPAP) PPV không xâm lấn ở mức MAP cao hợp lý (7–10 cm H,O), tần số (10–20 lần/ phut) và FiO2 cao (> 40%). Yếu tố chính quyết định thành bại của việc rút nội khi quản ở những trẻ như vậy là mức độ nỗ lực hô hấp tự phát (thường tạo ra áp lực và thể tích khí lưu thông vượt quá mức do máy thở cung cấp).
Trẻ sơ sinh bị BPD có nguy cơ cao bị tăng áp động mạch phổi, và trẻ sinh non nên được tầm soát thường xuyên (có thể bắt đầu từ khoảng một tháng tuổi, và sau đó hằng tháng, nếu vẫn được hỗ trợ hô hấp đáng kể) bằng siêu âm tim để phát hiện biến chứng này. Trẻ sơ sinh được chẩn đoán bị tăng áp lực động mạch phổi trong khi bị BPD có thể cần xét nghiệm chuyên khoa bổ sung (ví dụ như chụp CT mạch máu, thông tim) và điều trị (vi dụ như hit oxit nitric, sildenafil, các mục tiêu bão hòa oxy cao hơn). Ở một số bệnh nhân bị BPD nặng, những trẻ vẫn được thở máy trong nhiều tháng, phẫu thuật mở khí quản có thể có lợi trong việc duy trì đường thở, hỗ trợ vệ sinh phổi và giảm khoảng chết. Một số trẻ sơ sinh cũng có thể được hưởng lợi từ hỗ trợ thông khi điều chỉnh theo tín hiệu thần kinh (neutrally adjusted ventilatory assist – NAVA), trong đó hỗ trợ máy thở được cung cấp tương ứng và đồng bộ với nỗ lực hỗ hấp của bệnh nhân thông qua các điện cực thu nhận hoạt động điện của cơ hoành (electrical activity of the diaphragm – Edi).
Các phương thức thông khí thay thế như thông khí tần số cao nhìn chung không vượt trội hơn so với thông khí thông thường trong BPD mạn tính nặng, do sức cản đường thở cao hơn làm giảm hiệu quả trao đổi khí khi thông khí tần số cao.
Trẻ đủ tháng cần thở máy
1.Trẻ đủ tháng có phổi bình thường (ví dụ như trẻ cần thở máy do cần gây mê toàn thân, hoặc do các vấn đề thần kinh). Trẻ đủ tháng có phổi bình thường nhưng cần thở máy trong thời gian ngắn (ví dụ như trong quá trình phẫu thuật), hoặc trong một thời gian dài (ví dụ như đối với các bệnh lý thần kinh cơ) cần được thông khí băng áp lực thấp (10–15 cm H.O; vừa đủ để chuyển động lồng ngực bình thường), với tần số trung bình (30–50 lần/phút) và FiO2 thấp (nếu phối bình thường và không có bệnh lý toàn thân nặng, FO, cần thiết thường < 25%). Vấn đề quan trọng là phải theo dõi tình trạng ngưng thở và giảm độ bão hòa sau khi rút nội khí quản, ngay cả sau khi thở máy ngắn.
Trẻ sơ sinh bị bệnh não thiếu oxy-thiếu máu cục bộ (hypoxic-ischemic encephalopathy – HIE) đôi khi có thể bị bệnh lý phổi, nhưng thường bị suy giảm khả năng kiểm soát hô hấp hơn. Trẻ có thể ngưng thở do tổn thương não nặng, hoặc thở nhanh do nhiễm toan chuyển hóa. Trẻ sơ sinh bị HIE thường được điều trị bằng phương pháp hạ thân nhiệt trị liệu, và trong những trường hợp như vậy, điều quan trọng cần ghi nhớ là hạ thân nhiệt làm dịch chuyển đường cong phân ly oxyhemoglobin sang trái (tăng độ bão hòa oxy đối với một PaO2 nhất định). Để tránh ngắt quãng lưu lượng máu não, cần duy trì PaCO2 trong khoảng 35 –45 mmHg càng lâu càng tốt. Để tránh tổn thương não thêm do thiếu oxy hoặc tăng oxy máu, cũng cần duy trì oxy ở mức bình thường (PaO2 70– 100 mmHg). Cài đặt máy thở được yêu cầu ở những trẻ sơ sinh như vậy thường giống như yêu cầu đối với trẻ sơ sinh có phổi bình thường (ập lực thấp, tần số trung bình và FiO2 thấp, như được nêu ở phần trước), trừ phi trẻ bị quá tải dịch, ARDS (acute respiratory distress syndrome – hội chứng suy hô hấp cấp tính), xuất huyết phối hoặc bệnh tật khác liên quan đến HIE.
2. Trẻ đủ tháng có phổi hoặc tuần hoàn phổi không bình thường, vi dụ như trẻ bị mắc các chứng bệnh tăng áp phối dai dẳng ở trẻ sơ sinh (PPHN), hội chứng hít phân su (MAS), thoát vị hoành bẩm sinh (CDH), hoặc các bệnh lý khác.
Trẻ đủ tháng mắc PPHN thường bị giảm oxy máu nghiêm trọng không tương ứng với bệnh phổi trên lâm sàng hoặc X-quang, do shunt ngoài phổi (thường là còn ống động mạch, và đôi khi là tồn tại lỗ bầu dục). Vì tình trạng giảm oxy máu và nhiễm toan được biết đến là làm tăng sức cản mạch máu phổi cũng như tăng chuyển hướng máu từ phải sang trái, nên chiến lược là tránh giảm oxy máu và nhiễm toan. Mục tiêu thông thường là duy trì PaO2 60–100 mmHg và pH trong khoảng 7,35–7,45. Ban đầu, trẻ có thể được cung cấp oxy bằng mũ chụp (hood) hoặc CPAP dễ ngăn ngừa giảm oxy máu, nhưng nếu tình trạng giảm oxy máu kéo dài (ví dụ như SpO2 <90%, PaO2 < 50 mmHg) hoặc nhiễm toan hô hấp (ví dụ như pH < 7,2 với PaCO2 > 55 mmHg), trẻ sơ sinh có thể cần được đặt nội khí quản và thở máy. Thở máy với tần số nhanh hơn (50–70 lãn phút) và thời gian hít vào tương đối ngắn (T 0,3–0,4 giây) có thể giúp giảm PaCO2, ngăn ngừa toan hô hấp. Ở trẻ sơ sinh bị giảm oxy máu kéo dài hoặc tăng CO2 máu, tốt hơn hết là nên bắt đầu hít oxit nitric sớm (gây giãn mạch phổi, cải thiện sự tương hợp V/Q) (ví dụ như ở Ol [oxygenation index – chỉ số oxy hóa] = 15–20), thay vì tăng áp lực máy thở và tần số rất cao trước khi bắt đầu sử dụng oxit nitric. Điều này là do việc sử dụng áp lực hoặc tần số máy thở rất cao trong bệnh cảnh PPHN có thể dẫn đến MAP quá mức và làm giảm thêm tuần hoàn phổi.
Trẻ sơ sinh bị MAS có thể có các vùng xẹp phổi, bị bẫy khí và các vùng bị viêm phổi do hóa học. Nhiều trẻ sơ sinh bị MAS cũng bị tăng áp động mạch phối, và các mục tiêu điều trị chung là giống nhau. Tuy nhiên, nếu lưu ý bảy khí, thời gian thở ra nên tăng lên ( 0,5 giây, có lẽ nhiều nhất là 0,7–1 giây), và PEEP giảm (còn 2.4 cm HẠO). Nếu oxy ở mức giới hạn nhưng đầy đủ (ví dụ như SpO, 88% –92%, PaO, 45–60 mmHg) và không có tăng áp động mạch phổi, phương án xử trí bảo tồn những trẻ như vậy mà không cần tăng thêm cài đặt máy thở (để giảm nguy cơ rò khí) có thể thích hợp hơn. Các liệu pháp hỗ trợ như iNO và liệu pháp surfactant nên được xem xét sớm, thay vi muộn hơn. Trẻ sơ sinh bị MAS và tăng áp động mạch phổi nên có độ bão hòa oxy cao hơn (ví dụ như SpO2 93%–98%) và PaO, được nhắm mục tiêu cao hơn (ví dụ như PaO2 70–120 mmHg), nhằm giảm các đợt giảm oxy máu có thể làm trầm trọng thêm tình trạng tăng áp động mạch phổi. Nhìn chung, hầu hết các bác sĩ lâm sàng đều thích tăng FiO2 trước khi tăng áp lực máy thở (miễn là thể tích khí lưu thông và chuyển động lồng ngực đủ) trong bệnh cảnh MAS, nhằm giảm nguy cơ rò rỉ khí.
Trẻ sơ sinh mắc CDH cần được xử trí chuyên khoa với sự phối hợp của các bác sĩ phẫu thuật nhi khoa. Hầu hết các trung tâm hiện nay đều sử dụng chiến lược “thông khí nhẹ nhàng” (“gentle ventilation”) với ổn định tim phổi ban đầu, sau đó là phẫu thuật sửa chữa trì hoãn (đôi khi trong lúc sử dụng ECMO). Các mục tiêu chung của điều trị thường là duy trì đủ oxygen hóa trước ống (tốt nhất là SpO, trước ống > 90%, hoặc ít nhất 85%) trong khi dung nạp PaCO2 cao hơn (lên đến 60–65 mmHg), miễn là pH đủ (> 7,25). Cài đặt ban đầu thường là tần số nhanh (40–80 lần/phút), PIP thích hợp để cung cấp thể tích khí lưu thông/chuyển động lồng ngực (thường là 15 –25 cm H2O), thời gian hít vào ngăn (T 0,25–0,35 giây), với FiO2 cần thiết giúp duy trì oxygen hóa đầy đủ (thường > 70%).
Kết luận
Các nguyên tắc thông khí cho trẻ sơ sinh thay đổi tùy theo bệnh lý phổi, kích thước của trẻ sơ sinh và các bệnh tật kèm theo (chẳng hạn như rối loạn chức năng tim và tăng áp phổi). Theo dõi chặt chẽ bằng kỹ thuật không xâm lấn (SpO2, ETCO2, theo dõi qua da) và kỹ thuật xâm lấn (khí máu), đi kèm với việc điều chỉnh thường xuyên các cài đặt máy thở sẽ làm giảm tỷ lệ mắc bệnh và tử vong. Các chiến lược bảo vệ phổi bao gồm: Tối ưu hóa sự hỗ trợ của máy thở bằng các kỹ thuật thở máy nhẹ nhàng để hạn chế chấn thương áp lực (barotrauma), chấn thương thể tích (volutrauma) và chấn thương xẹp phổi (atelectotrauma). Giảm thời gian thông khí cơ học xâm lấn, đặc biệt ở trẻ sơ sinh non tháng, có khả năng làm giảm mức độ tổn thương phổi và BPD.