Sản xuất Dược phẩm
NGHIÊN CỨU ĐỊNH LƯỢNG RACTOPAMIN HYDROCLORID TỒN DƯ TRONG THỊT GÀ BẰNG PHƯƠNG PHÁP LC – MS/MS
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
NGUYỄN THỊ HỒNG VÂN, CHỬ VĂN MẾN (Học viện Quân y), LÊ THỊ HƯỜNG HOA (Viện Kiểm nghiệm thuốc Trung ương)
1. Đặt vấn đề
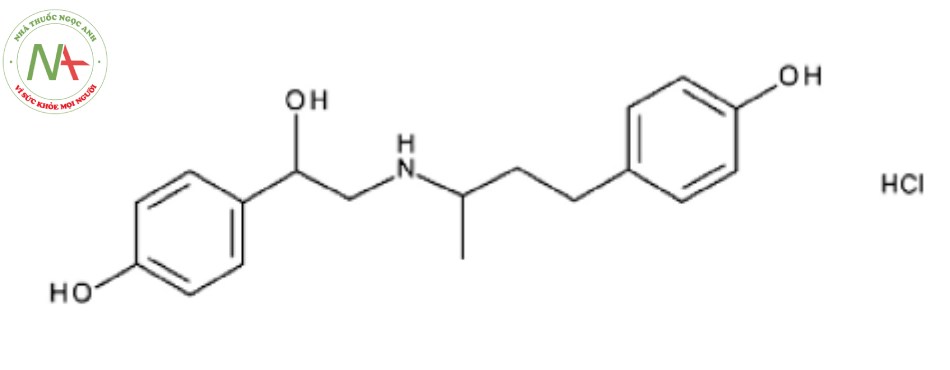
Vệ sinh an toàn thực phẩm luôn là một trong các vấn đề được quan tâm hàng đầu trong toàn xã hội của mọi quốc gia vì nó liên quan trực tiếp đến sức khỏe của người dân. Các chất nhóm β – agonists đã và đang bị lạm dụng sử dụng (trộn vào thức ăn) như một loại hormon tăng trưởng, tạo nạc cho gia súc và gia cầm trong sản xuất và chăn nuôi, một trong số đó phải kể đến là Ractopamin hydroclorid (RAC.HCl) (Hình 1) [1], [2], [3].
Nhằm tăng năng suất chăn nuôi bằng RAC.HCl, người dân sẽ trộn thêm chất này vào giai đoạn gần xuất chuồng, nên nhiều trường hợp dư lượng dư lượng của chúng trong thịt khi sử dụng, dư lượng này có thể gây nên nhiều tác hại xấu cho sức khỏe người tiêu dùng như: có thể gây triệu chứng ngộ độc cấp, buồn nôn, chóng mặt, run cơ, đánh trống ngực, tăng huyết áp, thúc đẩy bệnh tim mạch, thậm chí tử vong [3]. Nếu sử dụng trong thời gian kéo dài có thể gây dậy thì sớm ở trẻ em, có thể dẫn đến rối loạn hệ thống hormon …[3]. Ở Việt nam, từ năm 2002 đến nay Ractopamin vẫn được liệt kê trong danh sách những hóa chất, hormon cấm sử dụng trong sản xuất kinh doanh động vật trên cạn [1], [2]… Vì vậy, việc nghiên cứu tình trạng sử dụng cũng như xác định lượng tồn dư trong thực phẩm cần được quan tâm.
Với sự phát triển của khoa học công nghệ, có nhiều phương pháp có thể xác định sự có mặt của RAC.HCl như kĩ thuật miễn dịch Elisa, tuy nhiên, phương pháp này chỉ phù hợp cho sàng lọc do dễ gây phản ứng chéo, gây tỉ lệ dương tính giả hoặc âm tính giả. Sắc ký khí kết nối khối phổ là phương pháp phổ biến nhưng phải tạo dẫn xuất dễ gây tạp chất hoặc test Kit đánh giá cho kết quả nhanh nhưng độ chính xác và giới hạn phát hiện không cao. Hiện nay, sắc ký lỏng khối phổ (LC-MS/ MS) được đánh giá là phương pháp có độ nhạy cao, phân tích nhanh, chính xác đang được ứng dụng nhiều trong phân tích, định lượng các chất trong dịch sinh học, trong đó có phân tích Ractopamin.HCl trong thịt bò và thịt lợn [4], [5], [6]. Trong bài này, chúng tôi xin giới thiệu kết quả nghiên cứu xây dựng phương pháp định lượng Ractopamin.HCl trong thịt gà bằng phương pháp LC-MS/MS
2. Thực nghiệm
2.1. Thiết bị, dụng cụ, hóa chất và chất chuẩn
2.1.1. Trang thiết bị
- Máy sắc ký lỏng ACQUITY UPLC H-Class’s Quaternary Solvent Manager, khối phổ: Xevo TQD Waters; Cột sắc ký: ACQUITY UPLC® BEH C18 (2,1 x 50 mm, 1,7 µm)
- Cân phân tích Mettler Toledo độ chính xác 0,01 mg;
- Máy ly tâm; máy đo pH Metrohm 780 (Thụy sĩ); máy lắc vortex
- Cột chiết SPE MCX, micropipet, dụng cụ thuỷ tinh cần thiết (bình định mức, pipet, ống đong, phễu lọc…)
2.1.2. Hoá chất và chất chuẩn
Dung môi, hóa chất: Acetonitril, methanol, acid hydrophosphoric, amoni hydroxyd, dikali hydrophosphat K2HPO4 đạt tiêu chuẩn tinh khiết dùng cho phân tích sắc ký
Chất đối chiếu: Ractopamin hydroclorid của Sigma- Aldrich, Mỹ, số lô: BCBT4623; hàm lượng 95,0 %
2.2. Đối tượng và phương pháp nghiên cứu
2.2.1. Đối tượng nghiên cứu
– Mẫu trắng: mẫu thịt gà được lấy tại Ban Cung cấp Động vật của Học viện Quân Y, không chứa chất RAC. HCl.
- Mẫu chuẩn: Cân chất chuẩn và pha trong Sau đó thêm dịch chiết từ mẫu trắng để được các dung dịch chuẩn trong nền mẫu.
- Mẫu tự tạo: Thêm chất chuẩn RAC.HCl vào mẫu thịt gà đã xay nhuyễn.
- Mẫu QC (quality control sample): chuẩn bị độc lập với mẫu chuẩn.
2.2.2. Phương pháp nghiên cứu
- Phương pháp xử lý mẫu: Khảo sát, lựa chọn phương pháp xử lý mẫu phù hợp để chiết được tối đa hoạt chất và loại được các tạp chất
- Khảo sát, lựa chọn các điều kiện phân tích:. Sử dụng hệ thống sắc ký khối phổ UPLC – MS/MS loại tứ cực chập 3 với nguồn ion hóa kiểu Khảo sát lựa chọn điều kiện sắc ký (cột sắc ký, pha động, tốc độ dòng, thể tích tiêm mẫu, điều kiện khối phổ…). Chọn chế độ khảo sát tự động để chọn ion mẹ, ion con dùng để định tính, định lượng. Các thông số MS/MS được tự động tối ưu bằng chế độ MS tune của thiết bị.
- Thẩm định phương pháp đã chọn: Về độ đặc hiệu, khoảng tuyến tính, độ chính xác, độ đúng, giới hạn định lượng dưới (LLOQ), giới hạn định lượng (LOQ), giới hạn định lượng trên (ULOQ), đánh giá độ chọn lọc và các giá trị thu hồi của các mẫu thêm chuẩn vào nền mẫu… Đánh giá độ bền của Ractopamin trong dịch chiết mẫu đặt tại bộ phận tiêm mẫu tự động (autosample), trong dịch chiết thịt gà được bảo quản dài ngày … Các kết quả thực nghiệm được tính toán và xử lý thống kê trên Microsoft Excel với các hàm thống kê thông dụng. Kết quả thẩm định phải đạt các yêu cầu của phương pháp phân tích các chất trong dịch sinh học [7], [8].
3. Kết quả nghiên cứu
3.1. Khảo sát điều kiện sắc ký
Thử nghiệm được tiến hành trên hệ thống sắc ký ACQUITY UPLC H-Class’s Quaternary Solvent Manager, khối phổ: Xevo TQD Waters; cột sắc ký ACQUITY UPLC® BEH C18 (50 × 2,1 mm; 1,7 µm),
Nhiệt độ cột: 30 oC; Thể tích tiêm: 2 µl, Tốc độ dòng: 0,2 ml/phút với pha động: acetonitril – dung dịch acid formic 0,1 % ở các tỷ lệ (95 : 5) và (85 : 15). Kết quả cho thấy pha động ở tỷ lệ acetonitril – dung dịch acid formic 0,1 % (85 : 15) cho pic cân đối, được tách riêng biệt, thời gian lưu phù hợp nên được chọn cho nghiên cứu tiếp theo.
Lựa chọn điều kiện khối phổ
Bảng 1. Các thông số của detector khối phổ để định lượng Ractopamin hydroclorid
gần với nồng độ giữa trong dãy chuẩn; HQC (ở nồng độ cao trong dãy chuẩn) = 60 – 80 % ULOQ.
| Chất phân tích
Thông số |
Ractopamin hydroclorid |
| Chế độ ion hóa | ESI (+) |
| Điện thế mao quản (kV) | 1,5 |
| Điện thế cone (V) | 62 |
| Nhiệt độ khử Solvat (°C) | 550 |
| Tốc độ khí khử Solvat (L/H) | 900 |
| Tốc độ khí cone (L/H) | 25 |
| Năng lượng va chạm (V) | 16 |
| Ion mẹ (Dalton) | 302,07 |
| Ion con (Dalton) | 164,06 |
Mẫu thử: Cân 1 g thịt gà đã xay nhuyễn cho vào ống ly tâm 50 ml. Thêm 10 ml dung dịch K2HPO4 0,1M, lắc
3.2. Phương pháp chuẩn bị mẫu
Mẫu trắng: là mẫu dịch chiết từ thịt gà theo qui trình chiết mẫu thử
Mẫu chuẩn: Các mẫu chuẩn được chuẩn bị bằng cách thêm chuẩn vào nền mẫu. Từ dung dịch chuẩn gốc 100 mg/ml RAC.HCl trong MeOH, pha thành dung dịch chuẩn trung gian trong MeOH có nồng độ 1000 ng/ml. Sau đó, từ các dung dịch này, chuẩn bị các dung dịch chuẩn có nồng độ từ 45 ng/ml đến 9500 ng/ml bằng cách phối hợp với nền mẫu trắng để được các dung dịch xây dựng đường chuẩn
Mẫu kiểm tra (QC): Hòa tan chất chuẩn RAC.HCl trong methanol để thu được dung dịch chuẩn gốc có nồng độ RAC.HCl chính xác khoảng 100 mg/ml (QC-W). Chuẩn bị độc lập với mẫu chuẩn. Pha loãng với methanol thành chuẩn kiểm tra làm việc QC (cách pha tương tự pha mẫu chuẩn). Từ đó, pha với dịch nền mẫu trắng để tạo thành chuẩn LQC (giới hạn định lượng) = 3 LLOQ; MQC vortex 10 phút. Ly tâm 15 phút ở tốc độ 4000 vòng/phút. Lấy 5 ml dịch chiết (sau ly tâm) cho qua cột SPE MCX (Cột SPE MCX đã được hoạt hóa bằng 5 ml MeOH, 5 ml nước cất, sau đó cho 5 ml đệm chiết mẫu K2HPO4 0,1M). Tải mẫu lên cột, tốc độ 1 ml/phút. (Không để khô cột giai đoạn cho mẫu lên cột và rửa cột). Rửa bằng 4 ml nước, rửa tiếp bằng 4 ml MeOH. Rửa giải bằng 4 ml dung dịch NH4OH 5 % trong MeOH. Lấy dung dịch rửa giải, thổi khô bằng khí nitơ ở 40 0C. Hòa tan cắn khô bằng 1 ml hỗn hợp của acetonnitril và acid formic (85 : 15), lắc bằng máy vortex và lọc qua màng lọc 0,45 µm, được dung dịch để tiêm sắc ký
3.3. Thẩm định phương pháp phân tích
3.3.1. Tính tương thích của hệ thống
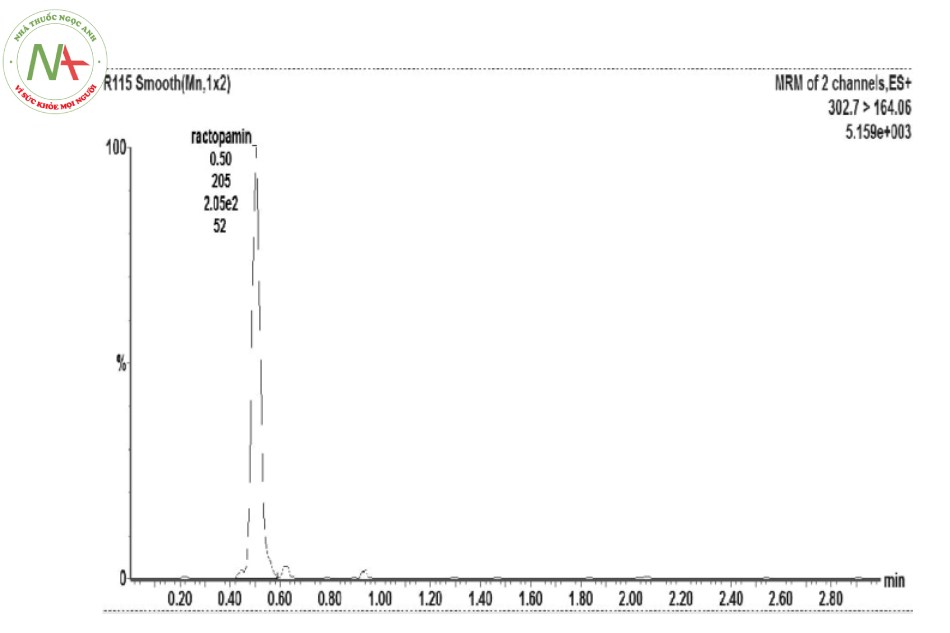
Phân tích sắc ký lặp lại 6 lần mẫu tự tạo (thêm chất chuẩn vào nền mẫu thịt gà), ghi lại sắc ký đồ, đáp ứng pic của 6 lần phân tích. Kết quả được nêu ra ở Bảng 2 và Hình 2.
Bảng 2. Sự phù hợp của hệ thống sắc ký
|
STT |
RAC.HCl (48 ng/ml) | |
| tR | Đáp ứng pic (counts) | |
| 1 | 0,5 | 199,672 |
| 2 | 0,5 | 204,565 |
| 3 | 0,51 | 199,803 |
| 4 | 0,5 | 204,547 |
| 5 | 0,5 | 208,904 |
| 6 | 0,5 | 203,302 |
| TB | 0,5 | 203,466 |
| CV (%) | 0,81 | 1,69 |
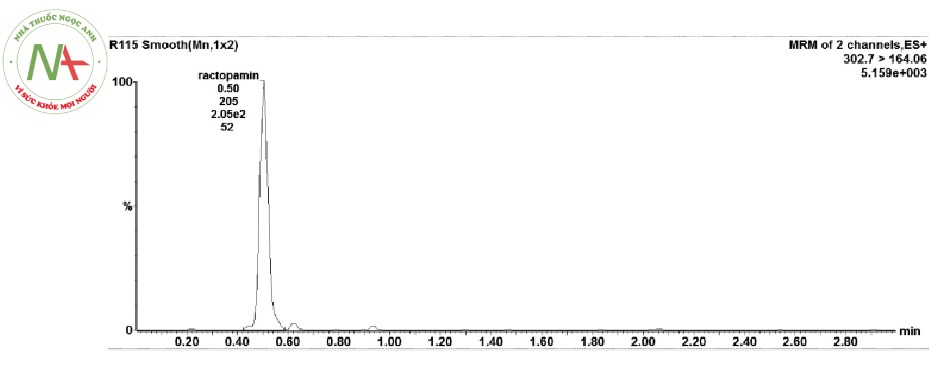
Như vậy, độ lệch về thời gian lưu của RAC.HCl là 0,81 % (< 2 %), của diện tích píc là 1,69 % (< 5 %) đều đạt yêu cầu, phương pháp là phù hợp với hệ thống sắc ký đã chọn.
3.3.2. Độ đặc hiệu của phương pháp
Bảng 3. Kết quả xác định độ chon lọc và giới hạn định lượng dưới (LLOQ)
|
Số TT |
Đáp ứng mẫu trắng (counts) | Mẫu thêm chuẩn (48 ng/ml) | Tỷ lệ đáp ứng
mẫu trắng/mẫu thêm chuẩn (%) |
||
| Đáp ứng pic (counts) | Nồng độ tìm thấy | Độ đúng (%) | |||
| 1 | 0,019 | 199,672 | 38,15 | 80,3 | 0,01 |
| 2 | 0,604 | 204,565 | 45,89 | 96,6 | 0,29 |
| 3 | 1,315 | 199,803 | 38,35 | 80,7 | 0,66 |
| 4 | 0,032 | 204,547 | 45,87 | 96,5 | 0,02 |
| 5 | 0,035 | 208,904 | 52,8 | 111,1 | 0,01 |
| 6 | 0,163 | 203,302 | 43,89 | 96,5 | 0,08 |
|
X |
203,466 | 44,15 | 93,6 | ||
| CV (%) | 1,69 | 12,42 | 12,41 | ||
| Kết luận | Đạt | Đạt | Đạt | Đạt (<20%) | |
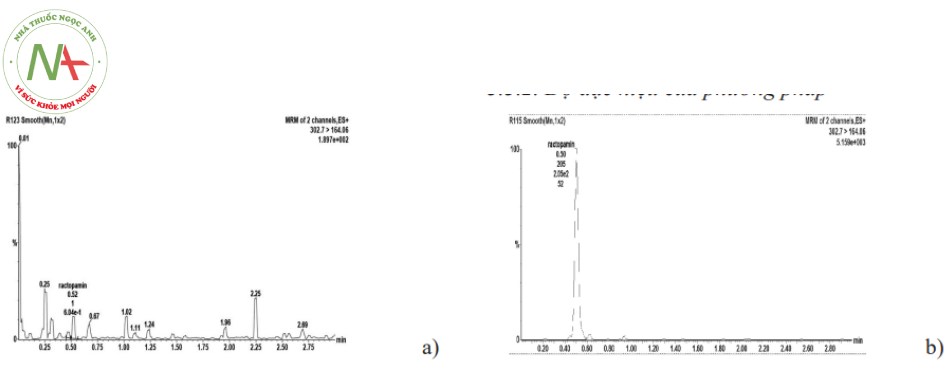
Kết quả cho thấy: Trên sắc ký đồ, pic của RAC.HCl được nhận diện rõ ràng, tách hoàn toàn khỏi pic tạp chất có trong mẫu. Tại thời điểm 0,51 phút (trùng với thời gian lưu của RAC.HCl): Tỷ lệ đáp ứng của mẫu có hoạt chất tại nồng độ 48 ng/ml so với mẫu trắng gấp nhiều lần mẫu trắng, đạt yêu cầu (Theo các tài liệu phải gấp ít nhất là 5 lần). Phương pháp đạt yêu cầu về độ chọn lọc, đặc hiệu. Giá trị 48 ng/ml là giới hạn định lượng dưới của phương pháp với tỷ lệ thu hồi đạt từ 80,3 đến 111,1 %, độ lệch CV = 12,41 %. Như vậy độ đúng và độ lặp lại tại nồng độ này đều < 20 %, đạt yêu cầu phương pháp phân tích trong dịch sinh học [7], [8]…
3.3.3. Đường chuẩn và khoảng tuyến tính
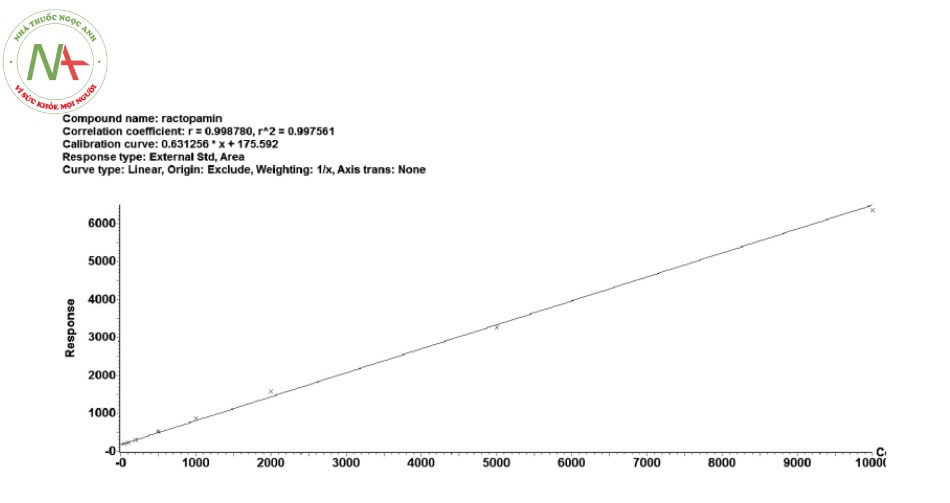
Phân tích các mẫu chuẩn RAC.HCl có nồng độ 47,5; 95; 190; 475; 950; 1900; 4750; 9500 ng/ml trong mẫu thịt gà theo quy trình đã xây dựng. Kết quả được trình bày trong Bảng 4 và Hình 4. Kết quả từ Bảng 4 và Hình 4 ta thấy, tỷ lệ diện tích pic và nồng độ RAC.HCl phụ thuộc tuyến tính chặt chẽ với hệ số tương quan cao, R2 = 0,9975. Nồng độ RAC.HCl tính lại theo đường chuẩn so với lý thuyết nằm trong khoảng 92,72 – 114,8 %, đều nằm trong khoảng giới hạn cho phép là 85 – 115 % và 80 – 120 % đối với điểm LLOQ. Duy nhất tại điểm nồng độ S6 là nằm ngoài khoảng 85 – 115 % (116,1 %) nhưng vẫn trong yêu cầu cho phép (75 % số điểm nằm trong khoảng tuyến tính). Khoảng nồng độ 47,5 ng/ml – 9500 ng/ml là khá rộng, đảm bảo phương pháp có độ tin cậy khi định lượng RAC.HCl ở nhiều mức nồng độ khác nhau, đáp ứng quy định của phương pháp phân tích thuốc trong dịch sinh học [7], [8]
3.3.4.Độ đúng và độ chính xác của phương pháp
Thẩm định độ đúng và độ lặp lại trên 4 loại mẫu: LLOQ, LQC, MQC và HQC chứa RAC.HCl có nồng độ tương ứng là 50 ng/ml; 150 ng/ml; 750 ng/ml và 7500 ng/ml. Kết quả được trình bày ở Bảng 5. Kết quả khảo sát cho thấy: Phương pháp định lượng ở mức nồng độ LLOQ có độ đúng trong ngày (từ 80,1-111,1 %) và khác ngày (từ 80,1 – 115,4 %), là trong khoảng cho phép 80 – 120 %. Ở 3 mức nồng độ còn lại (từ 85,0 – 113,2 %) nằm trong giới hạn cho phép 85- 115 %. Độ chính xác có giá trị CV % từ 9,25 – 13,86 % (đạt yêu cầu < 15 %). Như vậy, độ đúng, độ chính xác trong ngày và khác ngày phù hợp với phương pháp phân tích trong mẫu thịt gà (dịch sinh học) [7], [8].
Bảng 4. Sự tương quan giữa nồng độ và diện tích pic RAC.HCl trong mẫu thịt gà
| Tên mẫu | S1 | S2 | S3 | S4 | S5 | S6 | S7 | S8 |
| Nồng độ thực (ng/mL) | 47,5 | 95 | 190 | 475 | 950 | 1900 | 4750 | 9500 |
| Đáp ứng pic (counts) | 203,395 | 229,234 | 308,190 | 512,760 | 864,366 | 1568,774 | 3267,401 | 6350,792 |
| Phương trình hồi quy | Y = 0,631256 X+ 175,592; R2 = 0,9975 | |||||||
| Nồng độ xác định từ đường
chuẩn (ng/mL) |
44,05 | 89,45 | 210,05 | 534,12 | 1091,11 | 2207,00 | 4897,87 | 9782,40 |
| Nồng độ xác định từ đường
chuẩn so với giá trị thực (%) |
92,7 | 109,7 | 110,5 | 112,4 | 114,8 | 116,1 | 103,1 | 102,9 |
Bảng 5. Kết quả khảo sát độ đúng, độ lặp lại trong ngày và khác ngày
|
Ngày |
Mẫu |
LLOQ (50 ng/mL) | LQC (150 ng/mL) | MQC (750 ng/mL) | HQC (7500 ng/mL) | ||||
| Nồng độ (a)
(ng/mL) |
Độ đúng
(b) (%) |
Nồng độ
(a) (ng/mL) |
Độ đúng (b)
(%) |
Nồng độ (a)
(ng/mL) |
Độ đúng (b)
(%) |
Nồng độ(a) (ng/mL) | Độ đúng(b) (%) | ||
|
I |
1 | 38,14 | 80,3 | 123,13 | 86,4 | 605,7 | 85,1 | 7864,91 | 110,4 |
| 2 | 45,89 | 96,6 | 133,20 | 93,4 | 750,6 | 105,3 | 7209,00 | 101,1 | |
| 3 | 37,97 | 80,1 | 142,67 | 100,1 | 632,7 | 88,9 | 6056,31 | 85,0 | |
| 4 | 45,88 | 96,6 | 159,90 | 112,2 | 818,56 | 114,8 | 8009,72 | 112,4 | |
| 5 | 52,77 | 111,1 | 151,67 | 106,4 | 714,32 | 100,2 | 6219,23 | 87,3 | |
|
II |
1 | 44,41 | 93,5 | 125,09 | 87,7 | 713,92 | 100,2 | 7046,63 | 98,9 |
| 2 | 40,37 | 85,0 | 126,76 | 88,9 | 654,07 | 91,8 | 7609,50 | 106,8 | |
| 3 | 54,29 | 114,3 | 148,68 | 88,5 | 607,76 | 85,3 | 7987,12 | 112,1 | |
| 4 | 47,40 | 99,8 | 159,87 | 112,2 | 672,60 | 94,9 | 7174,87 | 100,7 | |
| 5 | 52,53 | 110,6 | 136,94 | 96,1 | 806,55 | 113,2 | 8065,51 | 113,2 | |
|
III |
1 | 38,61 | 81,3 | 124,38 | 87,3 | 688,98 | 96,7 | 7481,05 | 105,0 |
| 2 | 44,98 | 94,7 | 145,52 | 102,1 | 652,65 | 91,6 | 7146,37 | 100,3 | |
| 3 | 56,71 | 115,4 | 125,81 | 88,2 | 681,15 | 95,6 | 7659,37 | 107,5 | |
| 4 | 55,05 | 115,3 | 146,94 | 103,1 | 788,73 | 110,7 | 7310,25 | 102,6 | |
| 5 | 42,37 | 89,2 | 132,23 | 91,0 | 665,95 | 93,6 | 6426,75 | 90,2 | |
|
X |
46,49 | 97,8 | 138,85 | 96,2 | 696,95 | 97,8 | 7284,44 | 101,8 | |
| CV (%) | 13,86 | 13,84 | 9,25 | 9,50 | 9,75 | 9,70 | 8,77 | 8,81 | |
(a): tính từ phương trình hồi qui; (b): % so với nồng độ thực
3.3.5. Ảnh hưởng của nền mẫu:
Đánh giá các kết quả thu được từ các mẫu tự tạo LLOQ, LQC, MQC và HQC sẽ dao động trong khoảng nào, kết quả thể hiện ở Bảng 6.
Bảng 6. Kết quả khảo sát các giá trị thu hồi từ các mẫu tự tạo
|
Ngày |
Mẫu |
LLOQ
(50 ng/mL) |
LQC
(150 ng/mL) |
MQC
(750 ng/mL) |
HQC
(7500 ng/mL) |
||||
| Nồng độ (a)
(ng/mL) |
Độ đúng (b)
(%) |
Nồng độ (a)
(ng/mL) |
Độ đúng (b)
(%) |
Nồng độ (a)
(ng/mL) |
Độ đúng (b)
(%) |
Nồng độ(a) (ng/mL) | Độ đúng(b) (%) | ||
| 1 | 38,14 | 80,3 | 123,13 | 86,4 | 605,7 | 85,1 | 7864,91 | 110,4 | |
| 2 | 45,89 | 96,6 | 133,20 | 93,4 | 750,6 | 105,3 | 7209,00 | 101,1 | |
| 3 | 37,97 | 80,1 | 142,67 | 100,1 | 632,7 | 88,9 | 6056,31 | 85,0 | |
| 4 | 45,88 | 96,6 | 159,90 | 112,2 | 818,56 | 114,8 | 8009,72 | 112,4 | |
|
I |
5 | 52,77 | 111,1 | 151,67 | 106,4 | 714,32 | 100,2 | 6219,23 | 87,3 |
| TB | 92,94 | 99,7 | 98,86 | 99,24 | |||||
| Giới hạn ± 20 % LLOQ | (± 18,59)
74,35 – 111,53 |
81,1 –
118,29 |
80,27 –
117,45 |
80,65 –
117,83 |
|||||
| 1 | 44,41 | 93,5 | 125,09 | 87,7 | 713,92 | 100,2 | 7046,63 | 98,9 | |
| 2 | 40,37 | 85,0 | 126,76 | 88,9 | 654,07 | 91,8 | 7609,50 | 106,8 | |
| 3 | 54,29 | 114,3 | 148,68 | 88,5 | 607,76 | 85,3 | 7987,12 | 112,1 | |
| 4 | 47,40 | 99,8 | 159,87 | 112,2 | 672,60 | 94,9 | 7174,87 | 100,7 | |
| II | 5 | 52,53 | 110,6 | 136,94 | 96,1 | 806,55 | 113,2 | 8065,51 | 113,2 |
| TB | 100,64 | 94,68 | 97,1 | 106,34 | |||||
| Giới hạn ± 20 % LLOQ | (± 20,13)
80,51 – 120,77 |
74,55 –
114,81 |
76,95 –
117,21 |
86,21 –
126,47 |
|||||
| 1 | 38,61 | 81,3 | 124,38 | 87,3 | 688,98 | 96,7 | 7481,05 | 105,0 | |
| 2 | 44,98 | 94,7 | 145,52 | 102,1 | 652,65 | 91,6 | 7146,37 | 100,3 | |
| 3 | 56,71 | 115,4 | 125,81 | 88,2 | 681,15 | 95,6 | 7659,37 | 107,5 | |
| 4 | 55,05 | 115,3 | 146,94 | 103,1 | 788,73 | 110,7 | 7310,25 | 102,6 | |
| III | 5 | 42,37 | 89,2 | 132,23 | 91,0 | 665,95 | 93,6 | 6426,75 | 90,2 |
| TB | 99,18 | 94,34 | 97,64 | 101,12 | |||||
| Giới hạn ± 20 % LLOQ | (± 19,84)
79,34 – 119,02 |
74,5 –
114,18 |
77,8 –
117,48 |
81,28 –
120,96 |
|||||
Kết quả thu được cho thấy, các giá trị thu hồi ở các mức nồng độ khác nhau trong các mẫu tự tạo đều nằm trong khoảng ± 20 % LLOQ. Theo tài liệu tham khảo của FDA năm 2018, cùng với kết quả về độ chọn lọc và độ đặc hiệu ở trên, kết quả này là đạt yêu cầu [8].
3.3.6. Độ ổn định của RAC.HCl trong dịch chiết từ thịt gà
Nghiên cứu độ ổn định của RAC.HCl có mặt trong mẫu dịch chiết thịt gà đã qua bảo quản trên các lô LQC (150 ng/ml) và HQC (7500 ng/ml). Đánh giá độ ổn định của RAC.HCl bằng cách so sánh nồng độ RAC.HCl có trong các mẫu được bảo quản và các mẫu có nồng độ tương ứng được phân tích ngay sau khi hòa tan chuẩn RAC.HCl vào dịch chiết từ thịt gà. Kết quả được trình bày ở Bảng 7.
Từ kết quả của Bảng 7 ta thấy: Độ lệch % của nồng độ mẫu dịch chiết thịt gà qua bảo quản so với ban đầu sau 3 chu kì đông – rã ở 2 mức nồng độ LQC và HQC với độ lệch lần lượt là 8,3 và 5 % (đều < 15 %). Độ chính xác CV % dao động từ 4,9 – 7,6 % (đều < 15 %)
Bảng 7. Kết quả độ ổn định của RAC.HCl trong mẫu dịch chiết thịt gà đã bảo quản
|
Độ ổn định |
Mẫu |
Nồng độ ban đầu (ng/ml; n = 6) | Nồng độ sau bảo quản (ng/ml; n = 6) |
Độ lệch (%) |
||
| Nồng độ TB | CV (%) | Nồng độ TB | CV (%) | |||
|
Sau 3 chu kỳ đông – rã |
LQC | 147,6 | 7,1 | 159,9 | 7,6 | 8,3 |
| HQC | 7234,0 | 6,7 | 7594,8 | 4,9 | 5 | |
| Ở nhiệt độ phòng trong thời gian ngắn (6 giờ) | LQC | 147,6 | 7,1 | 153,8 | 6,1 | 4,2 |
| HQC | 7234,0 | 6,7 | 7505,3 | 6,0 | 3,7 | |
| Độ ổn định trong autosampler (24 giờ, 20 oC) | LQC | 147,6 | 7,1 | 150,0 | 6,0 | 2,7 |
| HQC | 7234,0 | 1,6 | 7210,2 | 6,7 | -0,3 | |
| Độ ổn định dài ngày
(-35 0C ± 5 oC, 30 ngày) |
LQC | 147,6 | 7,1 | 157,8 | 8,4 | 6,9 |
| HQC | 7234,0 | 6,7 | 7529,4 | 5,1 | 4,1 | |
Độ ổn định của mẫu dịch chiết thịt gà qua bảo quản ở nhiệt độ phòng: độ lệch (%) nồng độ của mẫu này ở nồng độ LQC và HQC lần lượt là 4,2 % và 3,7 % (đều < 15 %) và giá trị CV % giữa các lần định lượng đều < 15 %. Độ ổn định của mẫu sau xử lý (auto sampler): Độ lệch nồng độ của mẫu dịch chiết thịt gà sau xử lý sau 24 h ở 2 mức nồng độ LQC và HQC lần lượt là 1,6 và – 0,3 %, đều < 15 %, đạt. Và độ chính xác CV % của các lần đo đều < 15 %.
– Độ lệch % của nồng độ mẫu thịt gà so với ban đầu sau thời gian bảo quản dài ngày (30 ngày) ở 2 mức nồng độ LQC và HQC là 6,9 % và 4,1 %, đều < 15 %.
4. Kết luận
Qua khảo sát nghiên cứu, một qui trình phân tích xác định dư lượng Ractopamin hydroclorid trong thịt gà bằng phương pháp LC-MS/MS đã được thiết lập với kỹ thuật chiết pha rắn và các điều kiện sắc ký và khối phổ phù hợp. Chất cấm Ractopamin hydroclorid được chiết tách ra khỏi mẫu thịt gà bằng kỹ thuật chiết pha rắn (SPE). Phương pháp phân tích tiếp theo là LC -MS/MS với các điều kiện phân tích như sau: Cột sắc ký: ACQUITY UPLC® BEH C18 (2,1 x 50 mm, 1,7 µm) được sử dụng làm pha tĩnh, pha động là hỗn hợp của acetonitril và dung dịch acid formic 0,1 % với tỷ lệ 85 : 15; tốc độ dòng là 0,2 ml/phút; detector khối phổ tứ cực chập ba (ACQUITY UPLC H-Class’s Quaternary Solvent Manager; Xevo TQD, Waters).
Kết quả thẩm định cho thấy, phương pháp có độ đặc hiệu cao, có giới hạn định lượng dưới nhỏ (LLOQ = 48 ng/ml), khoảng tuyến tính khá rộng (48 ng/ml đến 7500 ng/ml), có độ đúng cao (từ 80,1 –115,4 %) và độ lặp lại tốt với giá trị CV % nhỏ (9,25 đến 13,86 %), thời gian phân tích sắc ký nhanh, chất phân tích ổn định trong nền mẫu thịt gà với một thời gian dài (30 ngày). Phương pháp đưa ra đã đáp ứng các yêu cầu của phương pháp phân tích thuốc trong dịch sinh học của EMA và US-FDA [6], [9]. Chúng tôi hy vọng phương pháp này có thể áp dụng để định lượng Ractopamin hydroclorid trong các mẫu để xem xét sự nhiễm chất cấm này trong các chế phẩm từ thịt gà.
Tài liệu tham khảo
- Bộ Nông nghiệp và Phát triển nông thôn (2002), Quyết định số 54/2002/QĐ-BNN ngày 20 tháng 6 năm
- Nguyễn Xuân Dương (2018), Nghiên cứu giải pháp kiểm soát chất cấm nhóm Beta- agonists (Clenbuterol, Salbutamol, Ractopamin ) trong chăn nuôi lợn, Nhà xuất bản Đại học Nông nghiệp, Luận án tiến sĩ nông nghiệp.
- John M. Weiler, MD, Sergio Bonini, MD, Robert Coifman, MD, Timothy Craig, DO, Luis Delgado, MD (2007), American Academy of Allergy, Asthma & Immunology Work Group Report: Exercise-induced asthma, Asthema Diagnosis and 119(6), pp. 1349-1358.
- Q-B Lin, X-T Zhao, H Song, Y-L Pan (2012), Immunoaffinity chromatography purification and ultra-high-performance liquid chromatography-tandem mass spectrometry determination of four β-agonists in beef, Food Addit Contam Part A Chem Anal Control Expo Risk Assess. 29(6), pp. 935-941.
- In Kyung Sung, Seo Jung Park, Kyutae Kang, Min Young Kim, Seongbeom Cho,(2015), Development and Application of a Method for Rapid and Simultaneous Determination of Three β-agonists (Clenbuterol, Ractopamine, and Zilpaterol) using Liquid Chromatography-tandem Mass Spectrometry, Korean J Food Sci Anim 35(1), pp. 121-9.
- Kunping Yan, HuiqunZhang, WenliHui, HongliZhu, XinboLi, FangyiZhong, Xiu’eTong, ChaoChen (2016), Rapid screening of toxic salbutamol, ractopamin and clenbuterol in pork sample high- performance liquid chromatography- UV method, Journal of Food and Drug 24 (2), pp.277-283.
- European Medicines Agency, Committee for Medicinal Product for Human Use (2011), Guideline on Bioanalytical Method
- Food and Drug Administration – USA (2018), Bioanalytical Method Validation Guidance for Industry, 1-26.