Bệnh hô hấp
Kích hoạt ngược: Giới thiệu về chẩn đoán, xử trí và ý nghĩa dược lý
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Bài viết Kích hoạt ngược: Giới thiệu về chẩn đoán, xử trí và ý nghĩa dược lý – Tải file PDF Tại Đây.
Bản dịch của BS. Đặng Thanh Tuấn – BV Nhi Đồng 1
Kích hoạt ngược là một dạng không đồng bộ giữa bệnh nhân và máy thở được chẩn đoán kém, trong đó nhịp thở được cung cấp bởi máy thở thụ động sẽ kích hoạt đáp ứng thần kinh dẫn đến nỗ lực không chủ ý của bệnh nhân và co thắt cơ hoành. Kích hoạt ngược có thể tác động đáng kể đến kết quả của bệnh nhân và đặc điểm sinh lý đặc biệt nhấn mạnh những tác động tiềm tàng quan trọng đối với tương tác thuốc-thiết bị-bệnh nhân. Mục đích của bài tổng quan này là tóm tắt những gì đã biết về kích hoạt ngược và hậu quả điều trị của nó, đặc biệt tập trung vào việc mô tả các trường hợp được báo cáo, sinh lý học, bối cảnh lịch sử, dịch tễ học và cách xử lý. Cơ sở dữ liệu PubMed đã được tìm kiếm các ấn phẩm báo cáo các bệnh nhân có biểu hiện kích hoạt ngược. Bằng chứng hiện tại gợi ý rằng thuốc an thần sâu có thể khiến bệnh nhân mắc phải các cơn kích hoạt ngược; do đó, các nhà lâm sàng có thể xem xét giảm thuốc an thần hoặc sửa đổi cài đặt máy thở ở những bệnh nhân có biểu hiện không đồng bộ máy thở như một biện pháp ban đầu. Cần nâng cao nhận thức của bác sĩ lâm sàng và tập trung nghiên cứu để hiểu cách xử trí thích hợp việc kích hoạt ngược và mối liên hệ của nó với kết quả của bệnh nhân.
1. Giới thiệu
Kích hoạt ngược là một dạng không đồng bộ bệnh nhân-máy thở duy nhất thể hiện sự giao thoa quan trọng giữa thuốc và thiết bị. Kích hoạt ngược là một dạng không đồng bộ bệnh nhân-máy thở, trong đó nhịp thở được cung cấp bởi máy thở thụ động sẽ kích hoạt đáp ứng thần kinh dẫn đến nỗ lực không chủ ý của bệnh nhân và sự co thắt cơ hoành. Hình 1 cung cấp sơ đồ cơ bản cho hiện tượng độc đáo này. Trên toàn cầu, sự không đồng bộ giữa bệnh nhân và máy thở trong quá trình thở máy xâm lấn đã được công nhận là có những ảnh hưởng quan trọng đến kết quả của bệnh nhân (Akoumianaki và cộng sự, 2013). Thông khí cơ học, trong trường hợp tốt nhất, là một chiến lược chăm sóc hỗ trợ giúp hệ hô hấp “nghỉ ngơi” và hỗ trợ trao đổi khí đồng thời cho phép có thời gian để kiểm soát nguyên nhân cơ bản gây ra suy hô hấp; tuy nhiên, nó cũng có thể gây tổn hại trực tiếp cho bệnh nhân và tăng tỷ lệ tử vong do tổn thương phổi gây ra do máy thở (ventilator-induced lung injury – VILI) (ARDS.net và cộng sự, 2000; Antonogiannaki và cộng sự, 2017; Thille và cộng sự, 2006; Slutsky và Ranieri, 2013; Amato và cộng sự, 2015; Blanch và cộng sự, 2015).
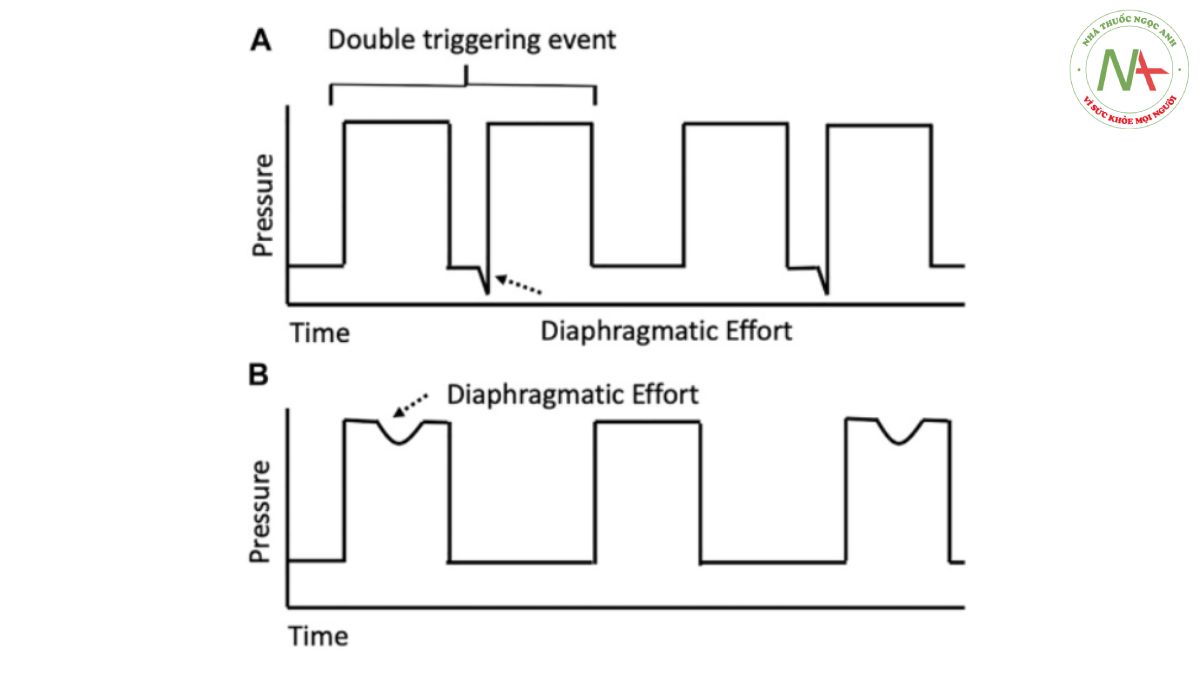
Hình 1 Đường cong áp lực-thời gian được đơn giản hóa cho sự kiện kích hoạt ngược có thể xảy ra. Sơ đồ đơn giản hóa này cung cấp cái nhìn tổng quan về sự kiện kích hoạt ngược. (A) Nhịp thở của máy thở thụ động, sau đó là nỗ lực co thắt không thích hợp của cơ hoành trong thời gian thở ra theo tỷ lệ cuốn vào (entrainment ratio) là 1:1. Những nỗ lực co thắt của cơ hoành như vậy, nếu được bắt đầu hoặc kéo dài quá thời kỳ trơ của máy thở và đủ đáng kể để vượt quá mức kích hoạt đã đặt, sẽ dẫn đến việc kích hoạt kép như được hiển thị. (B) Nhịp thở của máy thụ động với nỗ lực của cơ hoành trong giai đoạn hít vào theo tỷ lệ cuốn vào là 1:2. Trong ví dụ này, nỗ lực của cơ hoành trong giai đoạn trơ của máy thở dẫn đến việc kích hoạt sớm hoặc không hiệu quả rõ ràng.
Việc xử trí cẩn thận phương thức chăm sóc hỗ trợ nhằm giảm thiểu tác hại do thầy thuốc gây ra này đặt ra một thách thức lâm sàng đặc biệt trong việc cân bằng giữa lợi ích và tác hại. Mặc dù một số khía cạnh của VILI (tức là sử dụng thể tích khí lưu thông hoặc áp lực có hại) được hỗ trợ tốt, nhưng hiểu biết của chúng tôi về tác động của những nỗ lực tự phát của bệnh nhân (bao gồm cả sự không đồng bộ máy thở), được phân loại cụ thể hơn là tổn thương phổi do bệnh nhân tự gây ra (patient self- inflicted lung injury – P-SILI), kết cục của bệnh nhân tiếp tục thay đổi (Yoshida và cộng sự, 2013; Yoshida và cộng sự, 2020; Carteaux và cộng sự, 2021). Do đó, sự không đồng bộ của bệnh nhân- máy thở như kích hoạt ngược có thể là một yếu tố nguy cơ dẫn đến kết cục kém có thể sửa đổi được (de Haro và cộng sự, 2019a; Marini và cộng sự, 2020). (Hình 2).
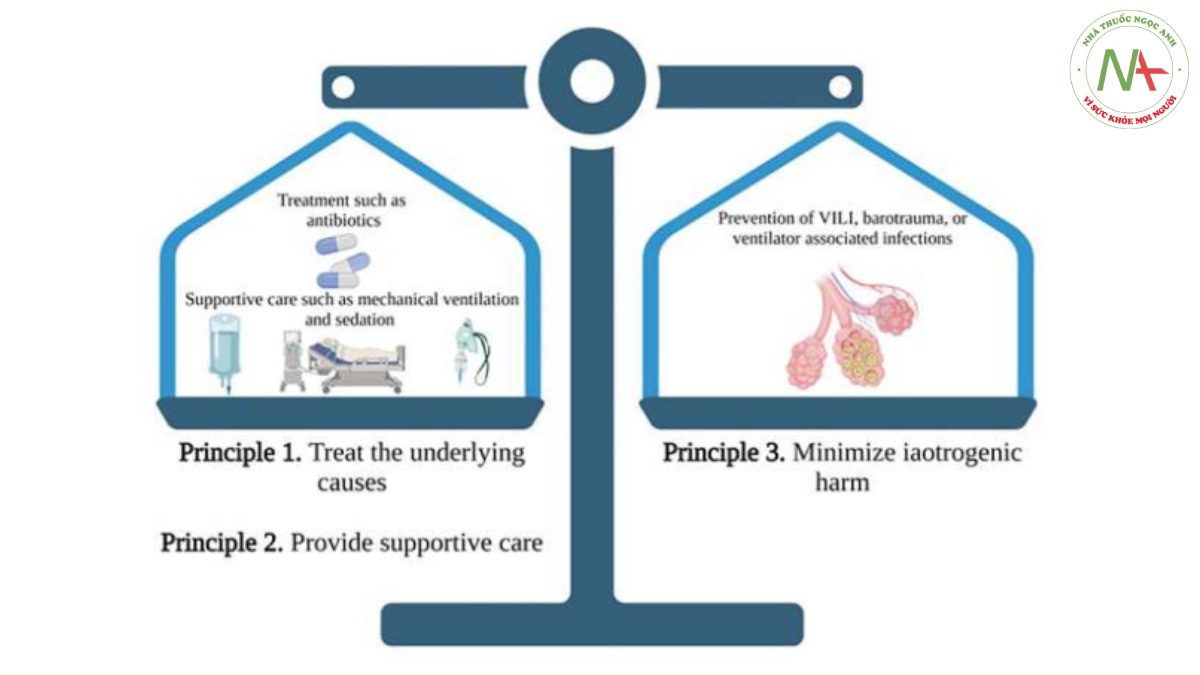
Hình 2 Ba nguyên tắc chăm sóc tích cực: Sơ đồ đề xuất cân bằng nguy cơ và tác hại của các biện pháp can thiệp khác nhau. Hai mục tiêu đặc biệt (phải được lưu ý) liên quan đến bệnh tật, đó là làm điều tốt hoặc không làm hại—Hippocrates. Với ba nguyên tắc chăm sóc tích cực, hai nguyên tắc điều trị nguyên nhân cơ bản và cung cấp dịch vụ chăm sóc hỗ trợ phải được cân bằng bởi nguyên tắc thứ ba là giảm thiểu tác hại do thầy thuốc gây ra. Khi áp dụng cho bệnh nhân thở máy, điều trị nguyên nhân cơ bản có thể bao gồm liệu pháp dùng thuốc (ví dụ: kháng sinh) và liệu pháp không dùng thuốc (ví dụ: đặt ống dẫn lưu lồng ngực); chăm sóc hỗ trợ có thể cung cấp đủ oxy và thông khí trong khi các liệu pháp điều trị đảo ngược nguyên nhân cơ bản (ví dụ, thông khí áp lực dương xâm lấn); và giảm thiểu tác hại có thể bao gồm ngăn ngừa VILI hoặc nhiễm trùng liên quan đến máy thở. Trong trường hợp kích hoạt ngược, hai phương thức chăm sóc hỗ trợ (thông khí cơ học và an thần) có thể làm tăng nguy cơ gây tổn hại do thầy thuốc và cần cân nhắc cẩn thận để duy trì sự cân bằng thích hợp.
Hiện tại, không có khuyến nghị nào để xử trí bệnh nhân gặp phải tình trạng kích hoạt ngược và có ít bằng chứng mô tả tác động của các quyết
định điều trị bằng thuốc đối với kết quả. Đánh giá về kích hoạt ngược này mô tả sinh lý bệnh có liên quan, ảnh hưởng đến kết cục của bệnh nhân và sự tương tác của các quyết định điều trị bằng thuốc đối với kết cục của máy thở. Cuộc thảo luận về kích hoạt ngược được xoay quanh việc cân bằng nguy cơ và tác hại liên quan đến các biện pháp can thiệp chăm sóc tích cực.
2. Phương pháp luận
Tìm kiếm tài liệu đã được thực hiện để xác định các nghiên cứu bao gồm các bệnh nhân được thở máy với các biến cố kích hoạt ngược. Cơ sở dữ liệu PubMed đã được tìm kiếm các báo cáo bằng tiếng Anh được xuất bản từ tháng 1 năm 1995 đến tháng 8 năm 2021 bằng cách sử dụng kết hợp các thuật ngữ tìm kiếm: suy hô hấp cấp tính, hội chứng nguy kịch hô hấp cấp tính, thông khí áp lực dương xâm lấn, thông khí cơ học, thuốc phong tỏa thần kinh cơ, kích hoạt ngược, an thần, tổn thương phổi gây ra do máy thở và sự không đồng bộ của bệnh nhân- máy thở. Bảng 1 đánh giá thuật ngữ liên quan đến kích hoạt ngược được thảo luận trong đánh giá này. Các ấn phẩm của tất cả các thiết kế nghiên cứu báo cáo các bệnh nhân có biểu hiện kích hoạt ngược đều được đưa vào. Hơn nữa, các tài liệu tham khảo được tìm thấy trong các bài báo nghiên cứu ban đầu, các bài đánh giá, bài xã luận, bản tóm tắt, phân tích tổng hợp và các bài đánh giá có hệ thống đều được sàng lọc để đưa vào.
| Thuật ngữ | Định nghĩa |
| Kích hoạt ngược (Reverse triggering) | Co thắt cơ hoành gây ra do phổi được bơm vào thụ động, đặc biệt ở những bệnh nhân được an thần sâu.
Akoumianaki và cộng sự (2013), Yoshida và cộng sự (2013) |
| Tự động kích hoạt (Auto-triggering) | Khi một chu kỳ được máy thở thực hiện mà không có nỗ lực thực sự của bệnh nhân.
Thille và cộng sự (2006) |
| Nhịp thở xếp chồng (Breath-stacking) | Khi nhịp thở do bệnh nhân kích hoạt xảy ra ở cuối quá trình bơm phồng thụ động, và do đó làm tăng thể tích khí lưu thông, còn được gọi là bơm phồng kép.
Akoumianaki và cộng sự (2013) |
| Không đồng bộ máy thở (Ventilator asynchrony) | Xảy ra khi nhịp thở cơ học không phù hợp với thì hít vào thần kinh của bệnh nhân hoặc nếu mức độ hỗ trợ cơ học không đáp ứng được nhu cầu hô hấp của bệnh nhân.
Fan và cộng sự (2017) |
| Cuốn vào hô hấp (Respiratory entrainment) | Mối quan hệ lặp đi lặp lại giữa các chu kỳ hô hấp cơ học và thần kinh trong đó hít vào do bệnh nhân điều khiển xảy ra ở một tốc độ cụ thể và lặp đi lặp lại.
Akoumianaki và cộng sự (2013) |
Lịch sử kích hoạt ngược
Kích hoạt ngược được mô tả lần đầu tiên vào năm 2013 bởi Akoumianaki và cộng sự (2013) như một dạng không đồng bộ máy thở mới. Tám bệnh nhân được thở máy bằng phương pháp thông khí hỗ trợ kiểm soát thể tích hoặc kiểm soát áp lực được theo dõi cơ học hô hấp bằng ống thông bóng thực quản. Các tác giả lưu ý rằng việc bơm phồng thụ động từ máy thở đã tạo ra đáp ứng phản xạ thần kinh từ bệnh nhân dẫn đến sự co thắt cơ hoành bổ sung. Nỗ lực bổ sung của bệnh nhân này, được gọi là kích hoạt ngược, có thể dẫn đến một số loại không đồng bộ máy thở tùy thuộc vào thời gian và cường độ của nỗ lực (ví dụ: nỗ lực của bệnh nhân không hiệu quả và kích hoạt kép). Hình 3 mô tả đồ thị dạng sóng tiềm năng cho một sự kiện kích hoạt ngược. Hiện tượng này hiện đã được quan sát thấy ở nhiều trường hợp bệnh nhân khác và đặc biệt ở những bệnh nhân được an thần sâu hơn (Bảng Phụ lục bổ sung A1) (Akoumianaki và cộng sự, 2013; Murias và cộng sự, 2016). Kích hoạt ngược nhận được nhiều sự chú ý hơn sau khi công bố thử nghiệm Đánh giá lại phong tỏa thần kinh cơ sớm toàn thân (ROSE), trái ngược với thử nghiệm ARDS et Curarisation Systematique (ACURASYS) năm 2010, không tìm thấy sự khác biệt nào về tỷ lệ tử vong trong 90 ngày khi sử dụng thuốc phong tỏa thần kinh cơ (neuromuscular blocking agents – NMBA) để kiểm soát hội chứng nguy kịch hô hấp cấp tính (ARDS) (Papazian và cộng sự, 2010; National Heart và cộng sự, 2019; Park và Schmidt, 2019; Slutsky và Villar, 2019). Ý kiến chuyên gia sau đó, nhằm tìm cách đưa ra những câu trả lời tiềm năng cho những kết quả mâu thuẫn này, cho thấy kích hoạt ngược là nguyên nhân tiềm ẩn gây ra tỷ lệ tử vong do mối liên hệ trước đó của nó với thuốc an thần sâu và sự khác biệt đáng chú ý trong thực hành thuốc an thần ở các nhóm đối chứng ACURASYS và ROSE (Rubenfeld và cộng sự, 2005; Bellani và cộng sự, 2016). Bất chấp nhận thức ngày càng tăng, những tác động và việc xử trí kích hoạt ngược lại chỉ trở nên phức tạp hơn trong thập kỷ sau khi nó được báo cáo lần đầu tiên.
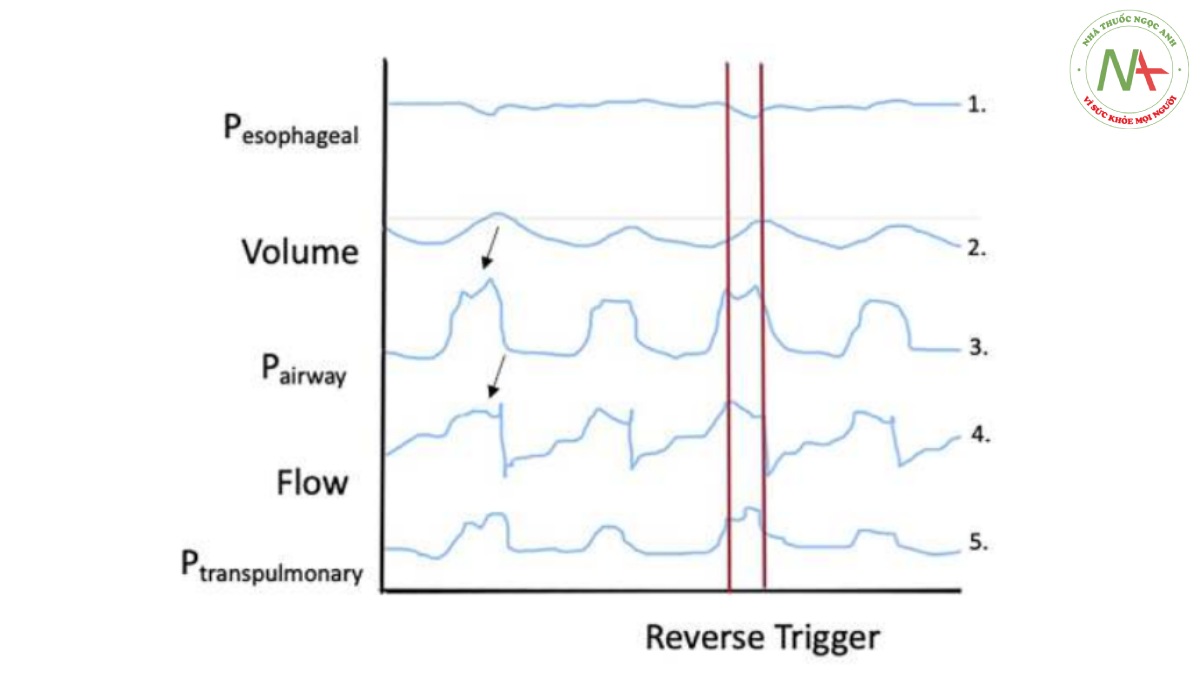
Hình 3 Mô tả lý thuyết về việc dò tìm dạng sóng cho một sự kiện kích hoạt ngược. Các yếu tố chính của việc theo dõi dạng sóng này cần lưu ý bao gồm: 1) nỗ lực tối đa của bệnh nhân xảy ra trong quá trình bơm phồng phổi, 2) thể tích khí lưu thông lớn hơn trong sự kiện kích hoạt ngược, 3) nỗ lực hít vào dẫn đến áp lực đường thở giảm nhẹ âm, 4) tăng mạnh lưu lượng trong sự kiện kích hoạt ngược và tăng áp lực xuyên phổi (cả trung bình và cuối thì hít vào) trong sự kiện kích hoạt ngược.
Dịch tễ học về sự không đồng bộ máy thở và kích hoạt ngược
Trong số hơn năm triệu bệnh nhân ở Hoa Kỳ được đưa vào ICU mỗi năm, có tới 40% sẽ được thở máy, với con số cao hơn đáng kể trong kỷ nguyên COVID-19 (Rubenfeld và cộng sự, 2005; Bellani và cộng sự, 2016; Gupta và cộng sự, 2020). Việc nhận dạng tại giường về sự không đồng bộ máy thở là điều khó khăn ngay cả đối với các chuyên gia có kinh nghiệm, vấn đề phức tạp hơn là các bác sĩ lâm sàng không thể quan sát trực tiếp mọi chu kỳ của máy thở, điều này có thể dẫn đến lỗi lấy mẫu (Colombo và cộng sự, 2011). Tuy nhiên, hơn 90% bệnh nhân thở máy được cho là gặp phải tình trạng không đồng bộ máy thở, với mỗi loại được đặc trưng bởi sinh lý bệnh, các yếu tố nguy cơ và tỷ lệ mắc bệnh riêng biệt (Thille và cộng sự, 2006; Blanch và cộng sự, 2015). Giống như các dạng không đồng bộ khác của máy thở, kích hoạt ngược không được chẩn đoán kỹ do sự thay đổi dạng sóng liên quan rất khó phát hiện thường ẩn trong nhịp thở thụ động (Baedorf Kassis và cộng sự, 2021). Hầu hết các nghiên cứu báo cáo mức độ phổ biến của kích hoạt ngược chỉ đánh giá số phút (tối đa một giờ) trong toàn bộ thời gian đặt nội khí quản của bệnh nhân, càng hạn chế khả năng hiểu toàn bộ phạm vi của vấn đề. Hơn nữa, định nghĩa được sử dụng cho kích hoạt ngược (hoặc các trường hợp không đồng bộ khác) sẽ ảnh hưởng đến tỷ lệ được báo cáo. Như vậy, tỷ lệ thực sự của kích hoạt ngược vẫn chưa được biết rõ, nhưng bằng chứng cho thấy nó rất phổ biến. Một nghiên cứu cho thấy 30% bệnh nhân mắc ARDS không được điều trị NMBA có dấu hiệu kích hoạt ngược, trong khi một nghiên cứu khác phát hiện ra bằng chứng về kích hoạt ngược ở 50 trên 100 bệnh nhân (Bourenne và cộng sự, 2019; Rodriguez và cộng sự, 2020a). Gần đây nhất, nhiều kiểu hình đã được đề xuất bao gồm kích hoạt ngược sớm, giữa chu kỳ và muộn, tất cả đều có thể có các trường hợp mắc bệnh và yếu tố nguyên nhân riêng biệt (Baedorf Kassis và cộng sự, 2021).
=>> Xem thêm: Theo dõi hô hấp trong quá trình thông khí cơ học: Hiện tại và Tương lai
Sinh lý bệnh của kích hoạt ngược
Kích hoạt ngược xảy ra khi bơm phồng máy thở thụ động kích hoạt nỗ lực không chủ ý của bệnh nhân, được coi là co thắt cơ hoành [hoặc, ít gặp hơn là co thắt cơ hô hấp phụ (Turbil và cộng sự, 2020)], có thể dẫn đến hoặc không dẫn đến nhịp thở tiếp theo được cung cấp bởi máy thở (Akoumianaki và cộng sự, 2013; de Haro và cộng sự, 2019a). Cơ chế sinh lý đằng sau của kích hoạt ngược vẫn chưa được hiểu rõ hoàn toàn. Tuy nhiên, một lý thuyết phổ biến cho rằng phản xạ Hering-Breuer qua trung gian thần kinh phế vị, thường nhằm mục đích bảo vệ phổi khỏi căng phồng quá mức bằng cách chấm dứt hít vào để đáp ứng với việc kích hoạt các thụ thể căng cơ học (Baedorf Kassis và cộng sự, 2021). Trong kích hoạt ngược, lưu lượng do máy thở cung cấp được cho là sẽ kích hoạt các thụ thể căng ở đường hô hấp trên, phổi và thành ngực cung cấp phản hồi hướng tâm đến trung tâm hô hấp, sau đó khớp với tần số của kích thích bên ngoài (Simon và cộng sự, 2000). Tuy nhiên, kích hoạt ngược lại cũng đã được mô tả ở những bệnh nhân ghép phổi hai bên mặc dù đã cắt bỏ dây thần kinh phế vị hướng tâm, cho thấy phản hồi phế vị có thể đủ nhưng không cần thiết để gây ra hiện tượng này (Simon và cộng sự, 2000). Một báo cáo khác mô tả kích hoạt ngược ở hai bệnh nhân chết não và mất phản xạ thân não, cho thấy rằng ngay cả trung tâm hô hấp cũng có thể không cần thiết (Delisle và cộng sự, 2016). Những báo cáo này ngụ ý sự tham gia của các cơ quan hướng tâm khác (ví dụ: cơ quan cảm nhận cơ học ở ngực) hoặc phản xạ cột sống (Delisle và cộng sự, 2016). Tổng hợp lại, sinh lý của quá trình kích hoạt ngược có vẻ phức tạp hơn chúng ta từng nghĩ và có khả năng tồn tại một hoặc nhiều cơ chế này có thể liên quan đến một bệnh nhân bị bệnh nặng.
Các đáp ứng thần kinh do máy thở gây ra được thấy trong kích hoạt ngược được cho là kết quả của một hiện tượng được gọi là “sự cuốn vào” (entrainment) (Akoumianaki và cộng sự, 2013; Bourenne và cộng sự, 2019). Sự cuốn vào đề cập đến sự đồng bộ hóa của pha (tức là thời điểm của một chu kỳ) và khoảng thời gian (tức là khoảng thời gian của một chu kỳ) của một quá trình dao động với nhịp điệu của đầu vào bên ngoài, như với dòng điện hoặc sóng não. Do đó, sự dồn nén hô hấp xảy ra khi nhịp bên ngoài do máy thở tạo ra phù hợp với trung tâm hô hấp của bệnh nhân (Akoumianaki và cộng sự, 2013; de Vries và cộng sự, 2019). Sự cuốn vào được biết là xảy ra ở động vật bị gây mê đang thở máy và ở những người khỏe mạnh ở trạng thái thức, ngủ và bị gây mê (Simon và cộng sự, 1999). Ở trạng thái không bệnh lý, sự cuốn vào có thể tạo điều kiện đồng bộ hóa giữa bệnh nhân và máy thở cho thấy khả năng điều chỉnh nhịp thở của bệnh nhân để đáp ứng với kích thích bên ngoài. Đáp ứng này có thể phản ánh sự tham gia của vỏ não trước và khả năng kiểm soát bậc cao. Đồng thời, người ta cho rằng trạng thái an thần sâu hơn có thể làm lộ ra các phản xạ cơ bản của hệ hô hấp. Sự cuốn vào dường như xảy ra thường xuyên hơn ở nhịp hô hấp hoặc thể tích khí lưu thông phù hợp với nhịp thở tự nhiên và nồng độ PCO2 bình thường, được biết là ảnh hưởng đến điều hòa hô hấp, dường như không ảnh hưởng đến sự xuất hiện của sự cuốn vào (Simon và cộng sự, 1999).
Khi áp dụng định nghĩa ban đầu của Akoumianaki và cộng sự, tỷ lệ cuốn vào trong kích hoạt ngược vẫn được khóa theo pha và ổn định (ví dụ: 1:1, 1:2, 1:3), với tỷ lệ 1:1 (một nỗ lực của bệnh nhân cho mọi nhịp thở thụ động do máy cung cấp) là phổ biến nhất. Các khoảng thời gian kích hoạt ngược với tỷ lệ ổn định có thể bị gián đoạn bởi các khoảng thời gian không có sự không đồng bộ và tỷ lệ có thể thay đổi theo thời gian (ví dụ: từ 1:1 đến 1:2). Khi xảy ra tình trạng cuốn vào, độ trễ pha giữa nhịp thở do máy kích hoạt và nỗ lực của bệnh nhân cũng như thời gian và mức độ nỗ lực của bệnh nhân không đổi (Akoumianaki và cộng sự, 2013; Murias và cộng sự, 2016; de Vries và cộng sự, 2019). Tuy nhiên, liệu có phải có một tỷ lệ cụ thể và ổn định để xác định sự kiện không đồng bộ khi kích hoạt ngược hay không vẫn còn gây tranh cãi. Đáng chú ý, một số loạt trường hợp báo cáo kích hoạt ngược với tỷ lệ không ổn định nhưng thừa nhận rằng những sự kiện này có thể thể hiện sự tách rời hoàn toàn nhịp hô hấp của bệnh nhân và chu kỳ máy thở được đánh dấu bằng nỗ lực tự phát ngẫu nhiên của bệnh nhân thay vì kích hoạt ngược. Liệu sự khác biệt sắc thái này có liên quan gì đến việc xử trí hoặc kết quả của bệnh nhân hay không vẫn chưa rõ ràng.
Hậu quả của kích hoạt ngược
Ý kiến chuyên gia ủng hộ rằng nỗ lực tự phát liên quan đến sự không đồng bộ máy thở có thể làm tăng áp lực và độ căng xuyên phổi, tất cả đều được cho là làm nặng thêm tổn thương phổi và sự gia tăng liên quan đến VILI trong thời gian thở máy, thời gian nằm ICU và tỷ lệ tử vong. Tuy nhiên, tác dụng sinh lý thực tế và tác động của kích hoạt ngược lên kết cục của bệnh nhân vẫn chưa được biết rõ (Thille và cộng sự, 2006; Akoumianaki và cộng sự, 2013; Blanch và cộng sự, 2015; Murias và cộng sự, 2016; Mauri và cộng sự, 2017).
Cơ chế rõ ràng nhất của tác hại tiềm tàng do kích hoạt ngược gây ra là thông qua kích hoạt kép hoặc xếp chồng nhịp thở. Nếu nỗ lực của bệnh nhân đủ mạnh và tiếp tục thở ra, kích hoạt ngược này có thể dẫn đến thể tích khí lưu thông thứ hai được cung cấp bởi máy thở, dẫn đến bệnh nhân nhận được gấp đôi thể tích khí lưu thông quy định. Nhịp thở xếp chồng này sau đó sẽ dẫn đến phổi quá căng và áp lực xuyên phổi cao. Một nghiên cứu kiểm tra các cơ chế kích hoạt kép (double triggering) cho thấy rằng mặc dù tần suất tổng thể thấp và nỗ lực độc lập của bệnh nhân là nguyên nhân phổ biến nhất, nhưng kích hoạt ngược vẫn liên quan đến hơn 1/3 số sự kiện kích hoạt kép (de Haro và cộng sự). Trong một nhóm bệnh nhân ARDS được thông khí thể tích khí lưu thông thấp (LTVV), tần suất kích hoạt kép cao đã được báo cáo; đáng chú ý, kích hoạt kép này xảy ra mặc dù việc sử dụng thuốc an thần sâu nhằm mục đích loại bỏ các nỗ lực tự phát của bệnh nhân (Pohlman và cộng sự, 2008).
Ngay cả khi không có các sự kiện kích hoạt kép hoặc thể tích khí lưu thông gây tổn thương được quan sát thấy, việc kích hoạt ngược gây ra sự co cơ hô hấp không hiệu quả trong một chu kỳ hít vào đã được chứng minh là có ảnh hưởng bất lợi đến động lực học của phổi, dẫn đến độ giãn phổi phụ thuộc tăng lên tương đương với những gì có thể xảy ra với thể tích khí lưu thông thở vào 15 ml/kg (Yoshida và cộng sự, 2018). Mô hình bơm phồng này có thể được giải thích bằng hiệu ứng Pendelluít (nghĩa đen là “không khí đong đưa”) (Greenblatt và cộng sự, 2014). Trong hiện tượng này, bơm phồng và xẹp xuống không đồng nhất tạo ra sự khác biệt về áp lực vùng trong phổi và luồng không khí qua lại giữa các vùng phổi khác nhau, do đó làm tăng thể tích khí lưu thông và áp lực xuyên phổi theo vùng (Akoumianaki và cộng sự, 2013; Bourenne và cộng sự, 2019). Áp lực âm trong lồng ngực liên quan đến nhịp thở kích hoạt ngược cũng có thể dẫn đến phù phế nang (de Vries và cộng sự.
Kích hoạt ngược cũng được cho là ảnh hưởng trực tiếp đến cơ hoành, mặc dù điều này cuối cùng dẫn đến thương tích hay bảo vệ vẫn còn gây tranh cãi. Các cơn co thắt cơ hoành thông qua kích hoạt ngược ở bệnh nhân được thông khí thụ động hoàn toàn có thể giúp duy trì một số hoạt động và sức mạnh của cơ (Hooijman và cộng sự, 2015; van den Berg và cộng sự, 2017), cuối cùng có thể rút ngắn thời gian sử dụng máy thở. Ngược lại, sự co lệch tâm của cơ hoành trong quá trình thở ra (có thể xảy ra khi kích hoạt ngược) có thể gây tổn thương sợi cơ hoành (Goligher và cộng sự, 2015). Bất kể tác động thực sự là gì, nỗ lực của bệnh nhân liên quan đến kích hoạt ngược có thể làm tăng công thở, tiêu thụ oxy và sản xuất CO2 (Chanques và cộng sự, 2013; He và cộng sự, 2018).
Nhận biết kích hoạt ngược
Dữ liệu hạn chế có sẵn để nhận biết kích hoạt ngược. Tuy nhiên, các bác sĩ lâm sàng có kinh nghiệm có thể sử dụng các thao tác đơn giản tại giường bệnh và theo dõi cẩn thận dạng sóng của bệnh nhân và máy thở để phân biệt kích hoạt ngược với các dạng không đồng bộ máy thở khác. Để đánh giá khả năng kích hoạt ngược, tần số thở bắt buộc có thể giảm (có thể thấp tới 8-10 nhịp thở mỗi phút) để cho phép đánh giá các nỗ lực tự phát cơ bản của bệnh nhân. Đối với trình kích hoạt ngược loại kích hoạt kép (double-triggering type reverse trigger) rõ ràng: nếu bệnh nhân tiếp tục thở với tốc độ nhanh và kích hoạt kép vẫn xảy ra thì kích hoạt ngược không phải là thủ phạm gây ra sự không đồng bộ. Nguyên nhân có thể là do chu kỳ sớm (premature- cycling) hoặc đói dòng (flow starvation). Nếu tần số thở của bệnh nhân giảm và chỉ có những nỗ lực tự phát sau các nhịp thở bắt buộc do máy thở cung cấp, thì việc kích hoạt kép gần như chắc chắn là do kích hoạt ngược. Nếu bệnh nhân tiếp tục nỗ lực tự phát và yếu tố kích hoạt biến mất thì nhiều khả năng đây là sự không phù hợp giữa tần số cài đặt máy thở và tần số của bệnh nhân, có thể là do dùng thuốc an thần quá mức và là một loại kích hoạt ngược khác. Nếu nhịp thở của bệnh nhân giảm và chỉ có sự kích hoạt rõ ràng trong các nhịp thở bắt buộc do máy thở cung cấp, thì điều này rất đáng nghi ngờ đối với việc kích hoạt ngược.
Mặc dù việc theo dõi và thao tác tại giường có thể đơn giản để thực hiện, nhưng chúng đòi hỏi bác sĩ lâm sàng trước tiên phải có mặt tại thời điểm xảy ra tình trạng không đồng bộ để đánh giá và cũng phải làm quen với các dấu hiệu cổ điển đáng để tiếp tục thực hiện việc kích hoạt ngược. Các kỹ thuật và công cụ như theo dõi áp lực thực quản (esophageal pressure monitoring) hoặc theo dõi điện cơ (electromyography monitoring) của cơ hoành cùng với các thuật toán học máy (machine learning algorithms) và phần mềm mới đã cho thấy nhiều hứa hẹn và cho phép thu thập các tín hiệu thậm chí tinh tế một cách liên tục (Rodriguez và cộng sự, 2020b; Phạm và cộng sự, 2021).
Những cân nhắc về dược lý
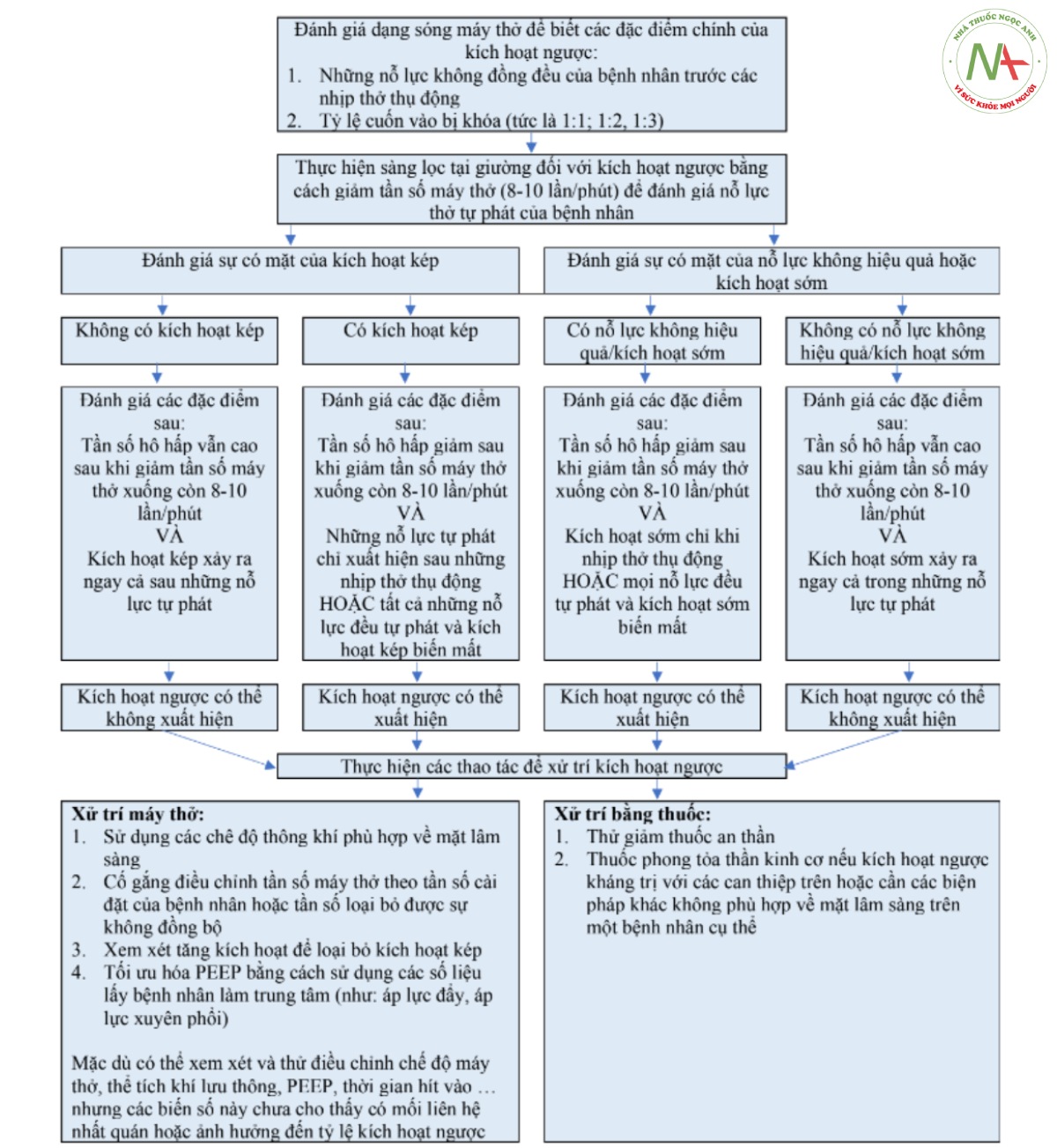
Ngoài các tác động sinh lý trực tiếp của việc kích hoạt ngược, hậu quả tiềm ẩn của việc xử trí thuốc không phù hợp hoặc tích cực đối với sự không đồng bộ giữa bệnh nhân và máy thở độc đáo này cũng là một mối lo ngại. Sự không đồng bộ máy thở trước đây đã được xử trí bằng cách tinh chỉnh cài đặt máy thở dựa trên tương tác giữa bệnh nhân và máy thở và các can thiệp bằng thuốc bao gồm giảm đau, an thần và NMBA (Chanques và cộng sự, 2013; Goligher và cộng sự, 2015; He và cộng sự, 2018). Tuy nhiên, những biện pháp can thiệp này có thể không tối ưu đối với những bệnh nhân có biểu hiện kích hoạt ngược do cơ chế không đồng bộ máy thở (National Heart và cộng sự, 2019; Park và Schmidt, 2019; de Vries và cộng sự, 2019; de Wit và cộng sự, 2009). Thật vậy, cố gắng loại bỏ sự không đồng bộ với mức độ an thần sâu hơn, trong khi cũng có khả năng không hiệu quả, chắc chắn sẽ dẫn đến thời gian thở máy dài hơn và các biến chứng liên quan (Kress và cộng sự, 2000; Treggiari và cộng sự, 2009). Ngoài ra, việc sử dụng NMBA, mặc dù có hiệu quả trong việc chấm dứt các sự kiện kích hoạt ngược, nhưng có thể được sử dụng khi các biện pháp can thiệp ít tích cực hơn đã đủ. Hình 4 đề xuất một lộ trình tiềm năng để xử trí kích hoạt ngược dựa trên đánh giá các tài liệu có sẵn; tuy nhiên, điều đáng chú ý là không có phương pháp hoặc phác đồ điều trị kích hoạt ngược chính thức nào được đánh giá chắc chắn. Các tác giả lưu ý đến tất cả các đề xuất có tính đến điều này và coi đây là một lĩnh vực quan trọng để nghiên cứu và phân định trong tương lai.
Giảm đau và an thần
Tăng cường độ an thần bằng thuốc giảm đau và thuốc an thần là một chiến lược xử trí sự không đồng bộ giữa bệnh nhân và máy thở. Nó làm giảm hiệu quả tỷ lệ mắc một số dạng không đồng bộ bằng cách ức chế trung tâm hô hấp của bệnh nhân (Bassuoni và cộng sự, 2012; Sottile và cộng sự, 2018). Sottile và cộng sự (2018) đã phát hiện ra rằng thuốc an thần sâu (tức là RASS -4 đến -5) dẫn đến tỷ lệ mắc tất cả các loại không đồng bộ máy thở thấp hơn đáng kể, bao gồm cả kích hoạt kép, khi so sánh với thuốc an thần nhẹ (tức là RASS 0 đến -1). Tuy nhiên, mức độ an thần sâu hơn có liên quan đến tỷ lệ bệnh nhân nỗ lực không hiệu quả cao hơn trong một số nghiên cứu (Kress và cộng sự, 2000; Sottile và cộng sự, 2018). Tác dụng này có liên quan đến việc giảm nỗ lực của cơ hô hấp và lưu lượng hít vào tối đa thấp hơn khi tăng liều thuốc an thần (de Wit và cộng sự, 2009).
Ngược lại với lý luận lâm sàng truyền thống, tỷ lệ kích hoạt ngược có thể tăng theo độ sâu của thuốc an thần và đã được báo cáo trong quá trình hỗ trợ kiểm soát thông khí khi dùng thuốc an thần sâu trong nhiều nghiên cứu (Akoumianaki và cộng sự, 2013; Chanques và cộng sự, 2013; He và cộng sự, 2018). Một trường hợp kích hoạt ngược ở bệnh nhân mắc ARDS đã báo cáo sự mất đồng bộ khi ngừng dùng thuốc an thần và bệnh nhân tỉnh lại (Ueno và cộng sự, 2017). Tuy nhiên, tài liệu gần đây không thể chỉ ra mối tương quan đáng kể giữa liều thuốc an thần và tỷ lệ kích hoạt ngược (Rodriguez và cộng sự, 2020a). Các báo cáo khác cho thấy rằng sự xuất hiện của kích hoạt ngược có thể thể hiện sự chuyển đổi giữa trạng thái an thần sâu và phục hồi cơ quan hô hấp của bệnh nhân (Mellado Artigas và cộng sự, 2021).
Tóm lại, thuốc an thần sâu có thể loại bỏ các đáp ứng hành vi hoặc ảnh hưởng vỏ não mạnh hơn ảnh hưởng đến tương tác của máy thở ở trạng thái tỉnh táo, có khả năng thúc đẩy kích hoạt ngược (Akoumianaki và cộng sự, 2013). Với mô tả tương đối gần đây về kích hoạt ngược như một dạng không đồng bộ duy nhất của bệnh nhân-máy thở, có rất ít tài liệu về mối quan hệ giữa mức độ an thần hoặc lựa chọn thuốc an thần và kích hoạt ngược, đồng thời hướng dẫn quốc gia cung cấp hướng dẫn tối thiểu về cách sử dụng tối ưu opioid và thuốc an thần về sự không đồng bộ bệnh nhân-máy thở (Devlin và cộng sự, 2018; Yoshida và cộng sự, 2018; Murray và cộng sự, 2016; Fan và cộng sự, 2017; Rhoney và Murry, 2003). Trên toàn cầu, mối quan hệ giữa tất cả các loại không đồng bộ (bao gồm cả kích hoạt ngược), mức độ an thần, thuốc an thần và thuốc opioid được mô tả ở mức tối thiểu. Những sắc thái như vậy của chiến lược dùng thuốc (ví dụ: đường dùng, thời gian, liều tích lũy, v.v.) chưa được đánh giá. Mặc dù một nghiên cứu cho thấy chỉ số không đồng bộ có khả năng được cải thiện khi dùng dexmedetomidine so với propofol, nhưng opioid vẫn chưa được tính đến (Conti và cộng sự, 2016). Một số nghiên cứu đã cho thấy chỉ số không đồng bộ được cải thiện thông qua việc sử dụng opioid nhưng không báo cáo đánh giá về khả năng kích hoạt ngược (Richman và cộng sự, 2006; de Haro và cộng sự, 2019b). Trong tương lai, cần tập trung vào sự tương tác giữa tác nhân, chiến lược dùng thuốc, thiết bị và bệnh nhân. Đáng chú ý, mặc dù có một số báo cáo trái ngược nhau, ý kiến của chuyên gia ủng hộ việc dùng thuốc an thần sâu như một yếu tố nguy cơ gây ra kích hoạt ngược và hàng loạt trường hợp chất lượng cao hơn về kích hoạt ngược có xu hướng chứng thực mối quan hệ này. Nhìn chung, nên thử giảm liều thuốc an thần và giảm đau như một biện pháp tiềm năng để chống lại tác dụng kích thích ngược trước khi thực hiện các biện pháp tích cực hơn.
Thuốc ức chế thần kinh cơ
Vai trò gây nhiễu của kích hoạt ngược trong các thử nghiệm NMBA không chỉ có ý nghĩa đối với việc hiểu vai trò của NMBA trong ARDS mà còn đối với việc xử trí kích hoạt ngược trong bối cảnh lâm sàng. Trong cài đặt thở máy, NMBA thường được dành riêng cho các trường hợp thiếu oxy kháng trị do ARDS nhưng có thể phát huy lợi ích lâm sàng chủ yếu bằng cách hủy bỏ và/hoặc ngăn chặn sự không đồng bộ máy thở (bao gồm cả kích hoạt ngược) có thể dẫn đến VILI. Một trong những lập luận mạnh mẽ nhất ủng hộ ý nghĩa lâm sàng của kích hoạt ngược và tác động của thuốc an thần sâu đến tỷ lệ mắc bệnh đến từ Park và Slutsky. Họ đề xuất rằng sự khác biệt về kết quả giữa thử nghiệm ACURASYS và ROSE là do sự khác biệt về mục tiêu an thần ở nhóm đối chứng của mỗi nghiên cứu. Trong khi ROSE nhắm đến thuốc an thần nhẹ ở nhóm đối chứng theo phương pháp thực hành tốt nhất hiện nay thì ACURASYS nhắm đến thuốc an thần sâu ở cả hai nhóm thử nghiệm (Papazian và cộng sự, 2010; National Heart và cộng sự, 2019; Park và Schmidt, 2019; Slutsky và Villar, 2019). Do đó, bệnh nhân trong nhóm đối chứng ACURASYS được an thần sâu hơn (mặc dù liều lượng không được ghi lại), điều này có khả năng dẫn đến tỷ lệ kích hoạt ngược cao hơn (Papazian và cộng sự, 2010; Park và Schmidt, 2019). Mặc dù các giai đoạn không đồng bộ bệnh nhân-máy thở không được đo lường trong cả hai thử nghiệm, nhưng tỷ lệ kích hoạt ngược tăng lên ở nhóm đối chứng ACURASYS có thể làm tăng tỷ lệ VILI, dẫn đến kết quả tồi tệ hơn ở những bệnh nhân không dùng NMBA (Park và Schmidt, 2019). Điều thú vị là, số lượng bệnh nhân bị tràn khí màng phổi ở nhóm đối chứng cao hơn đáng kể so với những người dùng NMBA, điều này có thể phù hợp với tỷ lệ mắc không đồng bộ máy thở tăng lên (Papazian và cộng sự, 2010). Tuy nhiên, do không có thử nghiệm nào báo cáo tỷ lệ không đồng bộ máy thở, chỉ số áp lực xuyên phổi hoặc mức độ của các cytokine gây viêm, nên sự đóng góp của sự không đồng bộ (và ngăn ngừa sự không đồng bộ của NMBA) đối với sự sống sót của bệnh nhân và những ngày không thở máy chỉ là suy đoán (Park và Schmidt, 2019).
NMBA có thể có lợi ở những bệnh nhân gặp phải tình trạng không đồng bộ máy thở (ví dụ: nhịp thở xếp chồng) và ở những người có áp lực xuyên phổi dao động cao, đồng thời chúng có hiệu quả trong việc loại bỏ việc kích hoạt ngược (Slutsky và Villar, 2019). Đối với những bệnh nhân trải qua các giai đoạn kích hoạt ngược, có thể cân nhắc thử dùng thuốc an thần nhẹ trước khi sử dụng NMBA. Tuy nhiên, việc bổ sung NMBA có thể được xem xét nếu tình trạng không đồng bộ vẫn tiếp diễn mặc dù có những thay đổi về mức độ an thần và máy thở. Lợi ích của NMBA phải được cân nhắc với hồ sơ tác dụng phụ đáng kể của chúng, bao gồm làm trầm trọng thêm rối loạn chức năng cơ hoành khi thở máy, khi kết hợp với mức độ an thần sâu hơn cần thiết cho những bệnh nhân bị dùng thuốc liệt cơ này, cũng có thể dẫn đến thời gian thở máy lâu hơn (Testelmans và cộng sự, 2006).
Can thiệp thông qua cài đặt máy thở
Tối ưu hóa cài đặt máy thở là chiến lược trọng tâm để xử trí kích hoạt ngược, từ việc đơn giản là tăng sự thoải mái cho bệnh nhân (tức là “làm máy thở vừa vặn cho bệnh nhân”) đến khả năng loại bỏ sự không đồng bộ mà không cần phải tăng cường can thiệp điều trị bằng thuốc. Mặc dù dữ liệu liên quan đến việc điều chỉnh chiến lược máy thở để giải quyết kích hoạt ngược bị giới hạn trong các nghiên cứu hồi cứu và báo cáo trường hợp, bằng chứng mạnh mẽ về việc xử trí cài đặt máy thở như một biện pháp can thiệp cho các loại không đồng bộ khác hỗ trợ cho phương pháp can thiệp này (Chanques và cộng sự, 2013). Đáng chú ý, một số nghiên cứu đã chỉ ra rằng các biện pháp can thiệp vào máy thở nhắm mục tiêu cụ thể đến từng loại không đồng bộ được xác định có thể chứng minh hiệu quả hơn việc điều chỉnh chế độ thuốc an thần (Chanques và cộng sự, 2013). Nhiều báo cáo trường hợp kích hoạt ngược mô tả các bệnh nhân được thông khí hỗ trợ kiểm soát thể tích, một chế độ được biết là làm tăng tỷ lệ không đồng bộ (Akoumianaki và cộng sự, 2013; He và cộng sự, 2018). Tuy nhiên, kích hoạt ngược cũng đã được báo cáo ở những bệnh nhân sử dụng chế độ thông khí được điều chỉnh áp lực hoặc kiểm soát áp lực (Baedorf Kassis và cộng sự, 2021). Mặc dù một số bệnh nhân có thể không thể chịu đựng được việc thay đổi sang chế độ thoải mái hơn như thông khí hỗ trợ áp lực (ví dụ như chấn thương thành ngực) và một số bệnh nhân có thể không được xử trí an toàn khi sử dụng thông khí hỗ trợ áp lực (ví dụ: những bệnh nhân cần thể tích khí lưu thông thấp), việc thay đổi sang chế độ thông khí hỗ trợ có thể có khả năng hủy bỏ việc kích hoạt ngược và các bác sĩ lâm sàng có thể xem xét thay đổi chế độ thông khí nếu nó có thể được thực hiện một cách an toàn ở những bệnh nhân liên tục gặp phải tình trạng không đồng bộ (He và cộng sự, 2018).
Những thay đổi khác đối với cài đặt máy thở (ví dụ: tần số thở, thể tích khí lưu thông, PEEP) cũng có thể loại bỏ việc kích hoạt ngược ở một số bệnh nhân. Tuy nhiên, mối quan hệ giữa bất kỳ biến số nào trong số này và tỷ lệ kích hoạt ngược vẫn chưa được xác định rõ ràng. Mức PEEP cao hơn đã được công nhận là gây ra “căng” nhiều hơn trong hệ hô hấp, có khả năng khiến bệnh nhân đảo ngược quá trình kích hoạt; tuy nhiên, Yoshida và cộng sự đã đề xuất chiến lược PEEP cao hơn để giảm tác động có hại của điều hòa hô hấp cao trong tổn thương phổi nghiêm trọng (Morais và cộng sự, 2018). Ở đây, PEEP cao hơn được sử dụng để tạo ra sự phân bổ áp lực đồng đều hơn nhằm giảm nguy cơ căng thẳng quá mức do pendelluft và nói chung mức PEEP cao hơn được coi là để cải thiện quá trình trao đổi khí, có thể làm giảm tổng thể điều hòa hô hấp (Baedorf Kassis và cộng sự, 2021). Tương tự, thể tích khí lưu thông lớn hơn cũng được lý thuyết là gây ra hiện tượng “căng” nhiều hơn và do đó tăng khả năng kích hoạt ngược (de Vries và cộng sự, 2019); tuy nhiên, một số quan sát cho thấy rằng thể tích khí lưu thông thấp hơn có liên quan đến tần suất kích hoạt ngược cao hơn và việc tăng thể tích khí lưu thông đã được chứng minh là có thể loại bỏ hiện tượng kích hoạt ngược (Akoumianaki và cộng sự, 2013; Rodriguez và cộng sự, 2020a). Việc thay đổi nhịp thở có thể làm giảm kích hoạt ngược như mô tả trước đây; (Mellado Artigas và cộng sự, 2021) tăng tần số máy thở hoặc phổ biến hơn là giảm tần số máy thở cho đến khi tất cả nhịp thở được bắt đầu bằng nỗ lực của bệnh nhân, có thể là chiến lược hiệu quả để loại bỏ tình trạng kích hoạt ngược. Đối với những bệnh nhân thể hiện kích hoạt kép liên quan đến kích hoạt ngược của họ, việc tăng ngưỡng kích hoạt cần thiết để bắt đầu nhịp thở (tức là đặt lưu lượng cao hơn hoặc áp lực âm hơn mà bệnh nhân sẽ cần tạo ra để kích hoạt một nhịp thở khác từ máy thở) có thể làm giảm tỷ lệ kích hoạt kép nhưng có thể sẽ không giải quyết được kích hoạt ngược (đáng chú ý là kích hoạt quá kém nhạy cũng gây ra hậu quả bất lợi do có khả năng tạo ra áp lực đường thở cao); thay vào đó, những sự kiện đó sẽ được ghi nhận là tác nhân kích hoạt không hiệu quả trên dạng sóng của máy thở. Nếu các sự kiện kích hoạt ngược không đáp ứng với việc thay đổi máy thở hoặc nếu không thể cố gắng thay đổi máy thở một cách an toàn thì việc thay đổi mức độ an thần và/hoặc thử nghiệm NMBA và đánh giá tác động của chúng đối với sự không đồng bộ có thể được đảm bảo (Garofalo và cộng sự, 2018; Bruni và cộng sự, 2019). Tóm lại, các biện pháp can thiệp được đề xuất trong Hình 4 phải phù hợp với ba nguyên tắc chăm sóc đặc biệt và sẽ cần nghiên cứu trong tương lai để tìm ra lộ trình rõ ràng.
3. Kết luận
Sự phức tạp vốn có của các tương tác giữa bệnh nhân và máy thở, bên cạnh tính không đồng nhất của các nghiên cứu đã đánh giá các tương tác này, dẫn đến các tình huống lâm sàng đa dạng và đầy thách thức. Đặc biệt, việc kích hoạt ngược đòi hỏi phải nâng cao nhận thức của bác sĩ lâm sàng và nhà nghiên cứu để mô tả sinh lý bệnh, tỷ lệ lưu hành, tác động đến kết quả của bệnh nhân và các chiến lược xử trí tối ưu. Do tác động của tổn thương phổi do máy thở cũng như thực hành an thần và sử dụng NMBA đối với thời gian thở máy và tỷ lệ mắc bệnh, một cách tiếp cận theo quy trình để đánh giá và xử trí kích hoạt ngược sẽ được kỳ vọng sẽ cải thiện kết quả của bệnh nhân. Các bác sĩ lâm sàng nên nhớ rằng, khi cung cấp dịch vụ chăm sóc hỗ trợ bằng thở máy, thuốc và thiết bị không phải là những biện pháp can thiệp riêng lẻ mà cần có sự cân nhắc chu đáo, chuyên môn để phát triển chiến lược xử trí nhằm tối đa hóa lợi ích và giảm thiểu tác hại do thầy thuốc gây ra (Antonogiannaki và cộng sự, 2017).
=>> Xem thêm: Sự khác biệt thực tế giữa thông khí kiểm soát áp lực và thông khí kiểm soát thể tích