nhathuocngocanh.com – ICH là viết tắt của Hội đồng quốc tế về sự hài hòa các yêu cầu kỹ thuật đối với dược phẩm dùng cho con người . Được thành lập vào năm 1990, nó tập hợp các cơ quan quản lý và ngành dược phẩm. Họ cùng nhau tạo ra các hướng dẫn ICH. Hãy cùng chúng tôi tìm hiểu về hiệp hội ICH và cơ cấu tổ chức này qua bài viết dưới đây.
ICH là gì?
ICH là một Hiệp hội phi lợi nhuận quốc tế theo luật pháp Thụy Sĩ được hỗ trợ bởi Ban Thư ký đặt tại Geneva Thụy Sĩ. Hội đồng quốc tế về hài hòa các yêu cầu kỹ thuật đối với dược phẩm dùng cho người (ICH) là duy nhất trong việc tập hợp các cơ quan quản lý và ngành dược phẩm để thảo luận về các khía cạnh khoa học và kỹ thuật của dược phẩm và phát triển các hướng dẫn ICH ((Tác giả: Zachary Brennan, ICH Makes Organizational Changes, 26/10/2015, RAPS. Truy cập ngày 21/12/2021)).
Kể từ khi thành lập vào năm 1990, ICH đã từng bước phát triển, để đáp ứng với sự phát triển ngày càng toàn cầu trong lĩnh vực dược phẩm và các hướng dẫn ICH này được ngày càng nhiều cơ quan quản lý áp dụng. Sứ mệnh của ICH là đạt được sự hài hòa hơn trên toàn thế giới để đảm bảo rằng các loại thuốc an toàn, hiệu quả và chất lượng cao được phát triển, đăng ký và duy trì theo cách hiệu quả nhất về nguồn lực trong khi vẫn đáp ứng các tiêu chuẩn cao. Kể từ khi công bố những thay đổi về tổ chức vào tháng 10 năm 2015.

Cấu trúc tổ chức của ICH
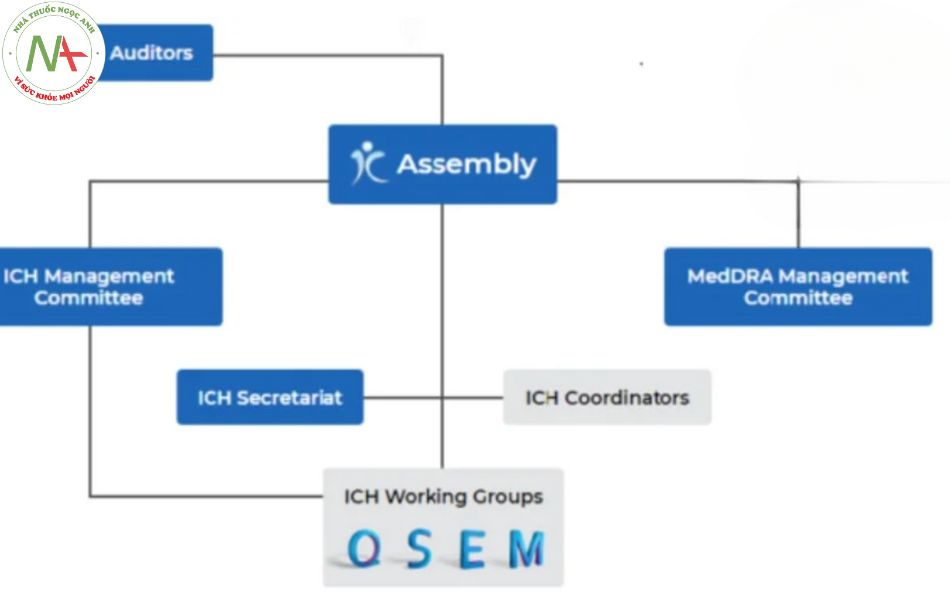
Hội đồng ICH
Hội đồng ICH là cơ quan tập hợp các thành viên, quan sát viên của Hiệp hội ICH, có trách nhiệm thông qua các quyết định cụ thể về các điều khoản của hiệp hội. Có nhiệm vụ kết nạp thành viên mới, quan sát viên mới. Ngoài ra, còn thông qua các nguyên tắc và hướng dẫn của ICH.
Thời gian tổ chức họp định kỳ: 6 tháng/1 lần. Biên bản các cuộc họp của Hội đồng ICH được công bố trên trang web của ICH tóm tắt các quyết định chính được đưa ra tại mỗi cuộc họp. Bằng cách công bố công khai thông tin này, Hội đồng ICH hy vọng sẽ minh bạch hóa quy trình ICH, để tất cả các bên liên quan có thể được thông báo về các quyết định quan trọng và tiến độ trong thời gian thực của việc xây dựng Hướng dẫn ICH.
Mỗi phút bao gồm một bản tóm tắt về tiến độ chính được thực hiện tại cuộc họp của mỗi nhóm công tác kỹ thuật, bao gồm cả khung thời gian dự kiến để đạt được các bước của quy trình ICH. Cũng bao gồm báo cáo về các quyết định chính do Ủy ban Quản lý MedDRA của ICH đưa ra tại cuộc họp của ủy ban này.
Ủy ban quản lý ICH
Là cơ quan giám sát các khía cạnh hoạt động của ICH, thay mặt cho tất cả các thành viên. Xử lý các vấn đề liên quan đến hành chính, tài chính và giám sát các nhóm công tác.
Biên bản của các cuộc họp trực tiếp của Ủy ban Quản lý ICH, cũng như các báo cáo tóm tắt về các cuộc họp từ xa được tổ chức giữa các cuộc họp, được công bố trên trang web của ICH tóm tắt các quyết định chính của Ủy ban Quản lý ICH. Bằng cách công bố công khai thông tin này, Ủy ban quản lý ICH hy vọng sẽ minh bạch hóa quy trình ICH, để tất cả các bên liên quan có thể được thông báo về các quyết định quan trọng và tiến độ trong thời gian thực của việc xây dựng Hướng dẫn ICH.
Được ghi trong biên bản các cuộc họp và báo cáo tóm tắt của cuộc họp qua điện thoại là bản tóm tắt các quyết định của Ủy ban quản lý ICH được đưa ra liên quan đến trách nhiệm giám sát các khía cạnh hoạt động của ICH, bao gồm các vấn đề hành chính và tài chính và giám sát các Nhóm công tác của ICH.
Ủy ban quản lý MedDRA
MedDRA là một thuật ngữ y tế được tiêu chuẩn hóa phong phú và cụ thể cao do ICH phát triển để tạo điều kiện thuận lợi cho việc chia sẻ thông tin quy định trên toàn thế giới về các sản phẩm y tế được con người sử dụng. Nó được sử dụng để đăng ký, lập tài liệu và giám sát an toàn của các sản phẩm y tế cả trước và sau khi một sản phẩm đã được phép bán. Các sản phẩm nằm trong phạm vi của MedDRA bao gồm dược phẩm, vắc xin và các sản phẩm kết hợp thuốc-thiết bị.
MedDRA mở cửa cho bất kỳ ai muốn sử dụng nó, mặc dù trong lần triển khai đầu tiên vào năm 1999, hầu hết người dùng đến từ Châu Âu, Nhật Bản và Hoa Kỳ. Ngày nay, việc sử dụng nó ngày càng tăng trên toàn thế giới bởi các cơ quan quản lý, các công ty dược phẩm toàn cầu, các tổ chức nghiên cứu lâm sàng và các chuyên gia chăm sóc sức khỏe, cho phép bảo vệ sức khỏe bệnh nhân trên toàn cầu tốt hơn.
MSSO (Tổ chức Dịch vụ Bảo trì và Hỗ trợ), được ICH ký hợp đồng với sự giám sát kỹ thuật và tài chính của Ủy ban Quản lý MedDRA, có nhiệm vụ duy trì, phát triển và phân phối MedDRA. Thuật ngữ này miễn phí cho tất cả các cơ quan quản lý trên toàn thế giới, các học giả, nhà cung cấp dịch vụ chăm sóc sức khỏe và những người khác có liên quan đến các hoạt động phi thương mại trong khi các đăng ký trả phí có quy mô trượt liên quan đến doanh thu hàng năm của các công ty.
Dưới sự quản lý của Ủy ban Quản lý MedDRA, MedDRA liên tục được nâng cao để đáp ứng nhu cầu ngày càng tăng của các cơ quan quản lý và ngành công nghiệp trên toàn thế giới. Nhóm Công tác về Điểm cần xem xét của ICH M1 hiện tại phát triển và duy trì hai tài liệu về việc sử dụng MedDRA để nhập dữ liệu (mã hóa) và truy xuất / phân tích dữ liệu. Phần sau bao gồm hướng dẫn về việc sử dụng SMQ, Truy vấn MedDRA được tiêu chuẩn hóa, làm công cụ mạnh mẽ để hỗ trợ phát hiện tín hiệu an toàn. Cả hai tài liệu đều được cập nhật mỗi năm một lần, với bản phát hành tháng Ba của MedDRA.
Ban thư ký ICH
Ban thư ký ICH chịu trách nhiệm quản lý hàng ngày của ICH, điều phối các hoạt động của ICH cũng như cung cấp hỗ trợ cho Hội đồng, Ủy ban quản lý ICH và các Nhóm công tác của Hội đồng. Ban thư ký ICH cũng cung cấp hỗ trợ cho Ủy ban quản lý ICH MedDRA.
Thành viên hiện tại và quan sát viên của ICH
ICH hiện được thành lập bởi 16 Thành viên và 28 Quan sát viên, sau khi Hội đồng ICH năm 2018 thông qua TFDA, Đài Bắc Trung Hoa là Thành viên điều chỉnh mới và MMDA, Moldova, NPRA, Malaysia, NRA, Iran, SCDMTE, Armenia và TİTCK, Thổ Nhĩ Kỳ là thành viên mới Những người quan sát ((Members & Observers, ICH. Truy cập ngày 21/12/2021)).
Các thành viên: https://www.ich.org/page/members
Các quan sát viên: https://www.ich.org/page/observers

Sứ mệnh của ICH
Hội đồng quốc tế về hài hòa các yêu cầu kỹ thuật đối với dược phẩm dùng cho người (ICH) là duy nhất trong việc tập hợp các cơ quan quản lý và ngành dược phẩm để thảo luận về các khía cạnh khoa học và kỹ thuật của việc đăng ký thuốc. Kể từ khi thành lập vào năm 1990, ICH đã từng bước phát triển, để đáp ứng với bộ mặt ngày càng phát triển của thuốc trên toàn cầu. Nhiệm vụ của ICH là đạt được sự hài hòa hơn trên toàn thế giới để đảm bảo rằng các loại thuốc an toàn, hiệu quả và chất lượng cao được phát triển và đăng ký theo cách hiệu quả nhất về nguồn lực. Sự hài hòa đạt được thông qua việc xây dựng các Hướng dẫn ICH thông qua một quá trình đồng thuận khoa học với các chuyên gia ngành và cơ quan quản lý làm việc song song với nhau. Chìa khóa thành công của quá trình này là cam kết của các cơ quan quản lý ICH trong việc thực hiện các Hướng dẫn cuối cùng.
Với việc ICH được thành lập như một Hiệp hội phi lợi nhuận quốc tế theo luật pháp Thụy Sĩ vào ngày 23 tháng 10 năm 2015, sứ mệnh của ICH đã được thể hiện trong các Điều khoản của Hiệp hội như sau:
- Đưa ra các khuyến nghị nhằm đạt được sự hài hòa hơn trong việc giải thích và áp dụng các hướng dẫn và yêu cầu kỹ thuật đối với việc đăng ký sản phẩm dược và duy trì các đăng ký đó;
- Duy trì diễn đàn đối thoại mang tính xây dựng về các vấn đề khoa học giữa cơ quan quản lý và ngành dược về việc hài hòa các yêu cầu kỹ thuật đối với sản phẩm dược;
- Để góp phần bảo vệ sức khỏe cộng đồng vì lợi ích của người bệnh từ góc độ quốc tế;
- Theo dõi và cập nhật các yêu cầu kỹ thuật hài hòa dẫn đến sự chấp nhận lẫn nhau nhiều hơn đối với dữ liệu nghiên cứu và phát triển;
- Để tránh các yêu cầu khác nhau trong tương lai thông qua việc hài hòa các chủ đề được lựa chọn cần thiết do kết quả của các tiến bộ điều trị và phát triển công nghệ mới để sản xuất các sản phẩm thuốc;
- Để tạo điều kiện cho việc áp dụng các cách tiếp cận nghiên cứu và phát triển kỹ thuật mới hoặc cải tiến, cập nhật hoặc thay thế các thực tiễn hiện tại;
- Khuyến khích việc thực hiện đầy đủ và tích hợp các tiêu chuẩn chung thông qua việc phổ biến, truyền thông thông tin và phối hợp đào tạo về các hướng dẫn hài hòa và việc sử dụng chúng;
- Và để phát triển chính sách cho Từ điển Y khoa ICH về Thuật ngữ Hoạt động Điều chỉnh (MedDRA) đồng thời đảm bảo duy trì, phát triển và phổ biến MedDRA về mặt khoa học và kỹ thuật như một từ điển được tiêu chuẩn hóa, tạo điều kiện cho việc chia sẻ thông tin pháp lý trên phạm vi quốc tế đối với các sản phẩm thuốc được con người sử dụng.
Các nguyên tắc của ICH
Các chủ đề ICH được chia thành bốn loại dưới đây và mã chủ đề ICH được chỉ định theo các danh mục này.
Nguyên tắc chất lượng
Các thành tựu hài hòa trong lĩnh vực Chất lượng bao gồm các mốc quan trọng như tiến hành các nghiên cứu về độ ổn định, xác định các ngưỡng liên quan để kiểm tra tạp chất và cách tiếp cận linh hoạt hơn đối với chất lượng dược phẩm dựa trên quản lý rủi ro Thực hành Sản xuất Tốt (GMP).
Hướng dẫn an toàn
ICH đã đưa ra một bộ Hướng dẫn an toàn toàn diện để phát hiện ra các nguy cơ tiềm ẩn như khả năng gây ung thư, độc tính trên gen và độc tính tái tạo. Một bước đột phá gần đây là chiến lược thử nghiệm phi lâm sàng để đánh giá trách nhiệm kéo dài khoảng QT: nguyên nhân quan trọng nhất của việc thu hồi thuốc trong những năm gần đây.
Nguyên tắc Hiệu quả
Công việc do ICH thực hiện với tiêu đề Hiệu quả liên quan đến việc thiết kế, tiến hành, an toàn và báo cáo các thử nghiệm lâm sàng. Nó cũng bao gồm các loại thuốc mới có nguồn gốc từ các quá trình công nghệ sinh học và việc sử dụng các kỹ thuật di truyền dược lý / gen để sản xuất các loại thuốc nhắm mục tiêu tốt hơn.
Nguyên tắc đa ngành
Đó là những chủ đề xuyên suốt không phù hợp duy nhất với một trong các danh mục Chất lượng, An toàn và Hiệu quả. Nó bao gồm thuật ngữ y tế ICH (MedDRA), Tài liệu kỹ thuật chung (CTD) và sự phát triển của Tiêu chuẩn điện tử để chuyển giao thông tin theo quy định (ESTRI).
Trên đây là những thông tin mà chúng tôi cung cấp cho bạn, hy vọng qua bài viết sẽ giúp bạn hiểu hơn về tổ chức ICH. Nếu có bất kỳ vấn đề nào cần được giải đáp hãy liên hệ ngay với chúng tôi.
