Tocilizumab
Biên soạn và Hiệu đính
Dược sĩ Xuân Hạo
Danh pháp
Tên thông thường/ INN
Tocilizumab
Tên thương mại
Actemra, RoActemra
Mã ATC
L04AC07
L – Chất chống ung thư và điều hòa hệ miễn dịch
L04 – Thuốc ức chế miễn dịch
L04A – Thuốc ức chế miễn dịch
L04AC – Thuốc ức chế interleukin
L04AC07 – Tocilizumab
Các định danh
Số đăng ký CAS: 375823-41-9
Định danh thành phần duy nhất: I031V2H011
KEGG: D02596
ChEMBL: CHEMBL1237022
Cấu trúc phân tử
Công thức phân tử
C6428H9976N1720O2018S42
Phân tử lượng
145.0 kg/mol
Nguồn gốc của Tocilizumab
Tocilizumab được giới thiệu lần đầu tiên vào năm 2008 tại Nhật Bản, sau đó là EU vào năm 2009 và Hoa Kỳ vào năm 2010. Phân tử này là một kháng thể đơn dòng nhân bản được biến đổi gen được tạo ra bằng cách ghép vùng xác định bổ thể của thụ thể IL-6 kháng người của chuột với người. IgG1. Tocilizumab ức chế sự gắn kết của IL-6 với các thụ thể của nó, khi làm điều này, nó làm giảm hoạt động gây viêm của cytokine này bằng cách cạnh tranh và liên kết với màng của thụ thể IL-6 ở người (IL-6R). Gen IL-6 của người đã được lập bản đồ trên nhiễm sắc thể 7p21 và bao gồm 184 axit amin với 2 vị trí N-glycosyl hóa và 2 cầu cysteine-cysteine trong phân tử. IL-6 được gọi là yếu tố kích thích tế bào B-2 và nó đóng một vai trò thiết yếu trong quá trình biệt hóa cuối cùng của tế bào B thành tế bào tiết globulin miễn dịch. IL-6 thực hiện các hoạt động sinh học của nó thông qua 2 phân tử: IL-6R (còn được gọi là IL-6Rα, gp80 hoặc CD126) và protein xuyên màng gp130. Trên tế bào đích, IL-6 liên kết với IL-6R. Tín hiệu xảy ra khi phức hợp IL-6 / IL-6R kết hợp với protein xuyên màng 130 kDa gp130 20 . Sự khử trùng của gp130 dẫn đến việc kích hoạt Janus kinase (JAKs) mà phosphoryl hóa phần tế bào chất của gp130. Kích hoạt Gp130 dẫn đến sự biểu hiện của các gen protein giai đoạn cấp tính. Nhiều tế bào trong cơ thể có thể tổng hợp IL-6 nhưng không nhiều tế bào biểu hiện IL-6R, do đó không đáp ứng với cytokine. Dạng hòa tan của IL-6R được tạo ra bởi sự phân giải protein hạn chế của IL-6R gắn với màng hoặc bằng cách dịch mã từ một mRNA được nối khác. Phức hợp IL-6 và IL-6R hòa tan cũng có thể kích thích các tế bào không biểu hiện IL-6R và chế độ tín hiệu này được gọi là chuyển tín hiệu IL-6 trong khi tín hiệu qua IL-6R liên kết màng được gọi là IL-6 báo hiệu cổ điển.
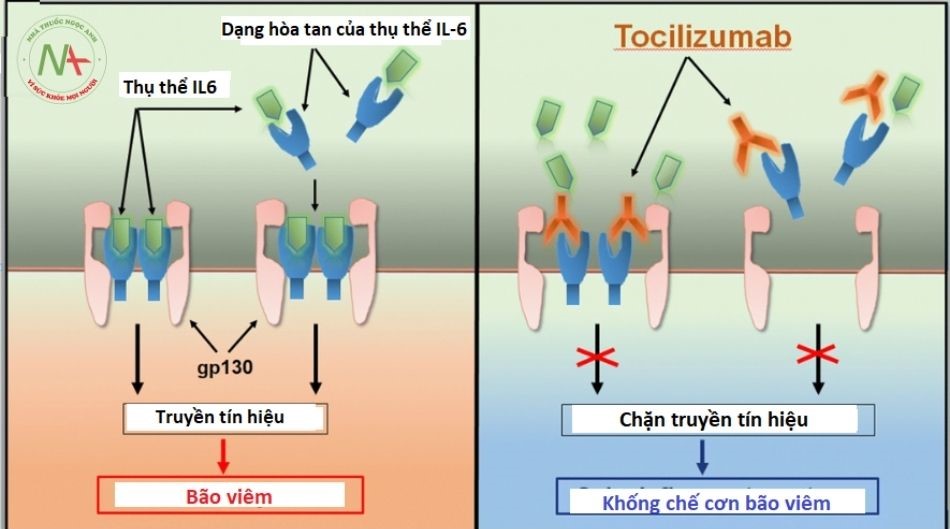
Theo các mô hình trên động vật và in vivo, một protein dung hợp của phần ngoại bào hòa tan của gp130 với phần không đổi của kháng thể IgG1 của người (sgp130Fc) đã được chứng minh là có thể ngăn chặn độc quyền truyền tín hiệu IL-6 mà không ảnh hưởng đến con đường cổ điển. Sự ức chế con đường truyền tín hiệu đủ để ngăn chặn tình trạng viêm nhiễm mà không ảnh hưởng đến khả năng bảo vệ miễn dịch chống lại sự lây nhiễm vi khuẩn. Những phát hiện này dẫn đến kết luận rằng con đường cổ điển IL-6 là quan trọng đối với chức năng tái tạo và bảo vệ trong khi con đường truyền tín hiệu IL-6 tạo nên hoạt động chống viêm của IL-6.
IL-6 được coi là một cytokine đa nhân. Nó là một yếu tố có nguồn gốc từ tế bào T khiến các tế bào B biệt hóa thành các tế bào sản xuất kháng thể và cũng được biết là có ảnh hưởng đến nhiều loại tế bào với một số hoạt động sinh học. Một khía cạnh quan trọng là sự tiết IL-6 bởi các tế bào của hệ thống miễn dịch như bạch cầu trung tính và bạch cầu đơn nhân hoặc đại thực bào khi được kích thích. Khi tế bào nội mô tiết IL-6 giải phóng chemokine giúp thu nạp nhiều tế bào miễn dịch hơn và tế bào gan tổng hợp và tiết ra các protein pha cấp tính.
IL-6 cũng được biết là có vai trò quan trọng trong sự biệt hóa của tế bào T trợ giúp và điều chỉnh sự cân bằng giữa interleukin 17 (IL-17) sản xuất tế bào T trợ giúp 17 (Th17) và tế bào T điều hòa (Treg).
IL-6 và yếu tố tăng trưởng biến đổi β (TGF-β) dẫn đến sự biệt hóa tế bào Th17, một tập hợp con T-helper đã được xác định. Người ta cũng đã mô tả rằng tế bào T của người khi kích hoạt thụ thể tế bào T sẽ phân cắt IL-6R liên kết màng của chúng và giải phóng IL-6R hòa tan. Kết quả là, những tế bào T này không còn đáp ứng với IL-6 mà cần IL-6R hòa tan để biệt hóa thành tế bào Th17. Do đó, kích thích ban đầu với IL-6 cần được theo sau bởi kích thích IL-6 và sIL-6R để sự biệt hóa của các tế bào Th17 có hiệu quả. Sự kích thích với TGF-β và phức hợp IL-6 / IL-6R hòa tan gây ra thế hệ tế bào Th17 bền vững và lâu dài hơn, vốn đã được công nhận là quan trọng đối với các trạng thái viêm. IL-6 dường như là một chất trung gian quan trọng liên quan đến các mô thành mạch và tế bào miễn dịch và rất quan trọng trong việc phân cực tế bào T thành tế bào T helper 17, được cho là quan trọng trong cơ chế bệnh sinh của viêm mạch.
Mặt khác, IL-6 hoạt động trực tiếp trên các tế bào tiền nguyên bào và ngăn chặn sự biệt hóa của chúng bằng cách điều chỉnh phiên mã của các gen cụ thể liên quan đến các phosphatase protein hoạt hóa Mitogen (MAPK) và con đường ubiquitin. IL-6 tạo ra chất nền metalloproteinase (MMP-1, MMP-3 và MMP-13) và metalloprotease có mô típ thrombospondin (ADAMTS-4) từ tế bào chondrocytes và các tế bào hoạt dịch. MMP-1 và MMP-13 có khả năng phân cắt collagen loại II, trong khi MMP-3 hoạt động chống lại các thành phần khác của chất nền ngoại bào, chẳng hạn như fibronectin và laminin. Ngoài ra, khi IL-6 được tạo ra trong tế bào mô đệm của tủy xương, nó sẽ kích thích chất kích hoạt thụ thể của phối tử nhân tố nhân kappa B (RANKL) và sau đó gây ra sự biệt hóa và hoạt hóa của tế bào hủy xương.
IL-6 tạo ra hepcidin trong tế bào gan. Hepcidin là một chất điều chỉnh chính của cân bằng nội môi sắt ở người và các động vật có vú khác. Nó ức chế sự hấp thụ sắt ở ruột non và giải phóng sắt tái chế từ các đại thực bào, làm giảm hiệu quả việc cung cấp sắt cho các hồng cầu trưởng thành trong tủy xương, gây thiếu máu.
Một số quan sát chính đã đóng một vai trò quan trọng trong việc quan tâm đến IL-6 như một mục tiêu. Một là quan sát thấy ở những bệnh nhân mắc bệnh Castleman, trong đó các khối u lành tính sản sinh quá mức IL-6, biểu hiện các triệu chứng giống như những bệnh nhân mắc bệnh thấp khớp.Ý nghĩa bệnh lý của IL-6 lần đầu tiên được chứng minh trong một trường hợp bệnh mô liên kết không biệt hóa khi một lượng lớn IL-6 được xác định trong mô bệnh học của u cơ tim của bệnh nhân. Sau đó, người ta quan sát thấy những con chuột thiếu IL-6 không có khả năng tạo ra phản ứng viêm.
IL-6 có liên quan đến nhiều biểu hiện của sJIA như sốt, phát ban, nổi hạch, gan lách to, thiếu máu và tăng trưởng kém vì nó tương tác với các tế bào khác nhau như tế bào T, tế bào B, tế bào lympho, bạch cầu đơn nhân và nguyên bào sợi, thúc đẩy tăng sinh hoạt dịch, viêm, tự miễn dịch và phá hủy cấu trúc khớp thông qua việc kích hoạt các tế bào hủy xương. Có vẻ như sJIA tuân theo một mô hình cytokine khá rõ ràng như được chỉ ra bởi các nghiên cứu lâm sàng.
IL-6 ức chế sự biệt hóa, khoáng hóa và có thể làm tăng quá trình apoptosis của các tế bào T nguyên bào xương của người, và các cytokine gây viêm trong pJIA.
Tocilizumab với tư cách là kháng thể trung hòa chống lại IL-6 và IL-6R ngăn chặn cả con đường truyền tín hiệu cổ điển và truyền tín hiệu. tocilizumab có thể phân tách phức hợp IL-6 – sIL-6R, nhưng không phân tách phức hợp IL-6 – sIL-6R – sgp130, cho thấy rằng phức hợp IL-6 – sIL-6R kém cứng hơn so với IL-6 – sIL-6R –Sgp130 phức tạp. Truyền tín hiệu IL-6 là tiền viêm trong khi tín hiệu IL-6 cổ điển qua IL-6R liên kết màng là cần thiết cho các hoạt động tái tạo hoặc chống viêm của cytokine. Kiến thức chi tiết về sinh học IL-6 này có hậu quả quan trọng đối với các chiến lược điều trị nhằm mục đích phong tỏa cytokine IL-6.
Nghiên cứu về dược động học ở người
Các nghiên cứu trên người đã chứng minh rằng tocilizumab có cấu trúc dược động học phi tuyến tính. Khi tăng liều, nồng độ tối đa của tocilizumab trong huyết tương (C max ) tăng tương ứng, tuy nhiên, diện tích dưới đường cong (AUC) tăng không tương xứng. Phân tích đường cong đáp ứng liều tocilizumab cho thấy chúng bị phẳng khi tăng phơi nhiễm và do liều lượng lớn hơn 800 mg này không được khuyến cáo do không tăng hiệu quả lâm sàng.
Các phân tích được thực hiện với tocilizumab trong các nghiên cứu trên người không cho thấy giới tính, tuổi tác, dân tộc, suy thận nhẹ, điều trị bằng methotrexate, điều trị bằng NSAID hoặc điều trị bằng corticosteroid có ảnh hưởng đến dược động học của tocilizumab. Chưa có nghiên cứu nào được thực hiện về dược động học của tocilizumab ở bệnh nhân suy thận vừa đến nặng hoặc bệnh nhân suy gan dưới mọi hình thức.
Các nghiên cứu sắc ký cho thấy tocilizumab chủ yếu tồn tại trong huyết tương ở dạng không đổi. Các nghiên cứu in vitro trên tế bào gan đã chỉ ra rằng tocilizumab ức chế sự điều hòa đi xuống của hệ thống enzym cytochrom P450 (CYP) do IL6 1 gây ra . Các enzym trong đó sự biểu hiện bị ức chế bởi IL6 bao gồm CYP1A2, CYP2C9, CYP2C19 và CYP3A4 5 . Mức độ phù hợp của phát hiện này là không rõ ràng vì quy định giảm này chỉ được chứng minh ở nồng độ rất cao. Tuy nhiên, cần thận trọng khi xem xét sự tương tác này khi có sự hiện diện của một loại thuốc khác được chuyển hóa bởi các enzym này. Cần đặc biệt thận trọng khi dùng đồng thời thuốc có chỉ số điều trị hẹp như theophylline, warfarin, phenprocoumon, phenytoin hoặc ciclosporin. Cũng cần lưu ý rằng do thời gian bán hủy dài của tocilizumab, việc theo dõi tương tác này có thể cần thiết trong 1 đến 2 tháng sau khi ngừng sử dụng tocilizumab.
Quá trình đào thải tocilizumab được chứng minh là tương đối chậm và phụ thuộc vào nồng độ. Sau khi bão hòa các thụ thể IL6, sự thanh thải do hệ thống thực bào đơn nhân gây ra trở nên tuyến tính. Việc tăng liều đã được chứng minh là dẫn đến kéo dài thời gian bán thải, cho thấy khả năng đào thải tocilizumab bị hạn chế.
Tính hiệu quả và an toàn
Những cân nhắc chính khi sử dụng tocilizumab là tác dụng ức chế miễn dịch của nó, dẫn đến tăng nguy cơ nhiễm trùng và ảnh hưởng tiêu cực của nó đến hồ sơ lipid. Nghiên cứu STREAM kéo dài 5 năm cho thấy tocilizumab có hiệu quả lâu dài bền vững và tính an toàn tốt. Một nghiên cứu khác cho thấy xu hướng giảm lipid trong 3 tháng đầu theo dõi tocilizumab là rõ ràng nhưng không có sự khác biệt đáng kể về mặt tĩnh trong hồ sơ lipid trong thời gian dài. Một nghiên cứu kéo dài tuần về tocilizumab ở bệnh nhân sJIA, từ 2 đến 17 tuổi, báo cáo tác dụng phụ nghiêm trọng ở bệnh nhân, tác dụng được coi là liên quan đến tocilizumab; tất cả những điều đó đã được giải quyết và không có vấn đề nào dẫn đến việc ngừng nghiên cứu. Một nghiên cứu tiếp theo khác trong 3 và 4,6 năm lần lượt kết luận rằng hồ sơ an toàn của tocilizumab là nhất quán theo thời gian ở những bệnh nhân được điều trị bệnh thấp khớp. Bệnh thấp khớp có liên quan đến việc tăng nguy cơ mắc các bệnh tim mạch mặc dù thực tế là mức IL-6 cao có liên quan đến mức cholesterol thấp hơn. Giảm gánh nặng viêm của bệnh thấp khớp bằng cách giảm mức protein phản ứng C (CRP) và IL-6 có thể làm giảm nguy cơ các bệnh tim mạch ở bệnh nhân thấp khớp. Vì tocilizumab có thể ngăn chặn tác dụng của IL-6 nên tất cả bệnh nhân phải có hồ sơ lipid lúc đói ban đầu và lập lại hồ sơ lipid lúc đói ít nhất 3 tháng sau khi bắt đầu điều trị.
Như đã mô tả trước đây, không có khuyến cáo liều lượng nào được cung cấp cho người suy gan hoặc suy thận. Khuyến cáo về xử lý nhiễm độc gan, độc thận hoặc giảm bạch cầu trong quá trình điều trị được trình bày chi tiết trong Bảng 2. Chưa xác định được tính an toàn và hiệu quả của tocilizumab ở trẻ em dưới 2 tuổi. Chống chỉ định tuyệt đối duy nhất của tocilizumab là quá mẫn với tocilizumab hoặc bất kỳ thành phần nào có trong công thức của tocilizumab. Không nên sử dụng vắc xin sống vì không có sẵn dữ liệu liên quan đến bệnh nhân nhận tocilizumab qua đường truyền tĩnh mạch hoặc tiêm dưới da có hoặc không có Nhóm Thuốc chống thấp khớp tác dụng chậm
Mô tả các tác dụng phụ phổ biến nhất liên quan đến việc sử dụng tocilizumab và cách quản lý chúng.
| Phản ứng phụ | Cách xử lý |
| Nhiễm trùng da / mô mềm | Liệu pháp kháng sinh.
Bỏ truyền trong 4 tuần và bắt đầu lại khi hết nhiễm trùng. |
| Xét nghiệm chức năng gan | Theo dõi hàng tháng trong vòng 6 tháng đầu tiên.
Không hành động nếu 5 lần ULN. |
| Tăng cholesterol máu | Kiểm tra lipid máu và theo dõi 2 đến 3 lần trong 6 tháng đầu, sau đó hàng năm.
Điều trị bằng statin nếu tăng cao theo hướng dẫn của bác sĩ. |
| Giảm bạch cầu trung tính |
Không cần thực hiện hành động nào nếu lớn hơn> 1 × 10^9/1. Bỏ qua trong 4 tuần nếu 0,5–1 × 10^9/1. Ngưng nếu <0,5 × 10^9/1. |
| Sốc phản vệ |
Theo dõi cẩn thận trong 6 lần truyền đầu tiên. Không thử lại nếu bệnh nhân xuát hiện phản vệ hoặc không thể hoàn thành việc truyền địch trước đó. |
Tác dụng phụ
Các tác dụng ngoài ý muốn đã được ghi nhận đối với đơn trị liệu tocilizumab hoặc kết hợp với các Nhóm Thuốc chống thấp khớp tác dụng chậm khác. Không có dữ liệu an toàn liên quan đến việc kết hợp với liệu pháp sinh học khác. Các tác dụng ngoài ý muốn thường gặp nhất được báo cáo là nhiễm trùng. Nhiễm trùng da phổ biến hơn ở nhóm tocilizumab trong thử nghiệm AMBITION. Năm trường hợp nhiễm trùng nghiêm trọng đã được báo cáo trong thử nghiệm TOWARD: viêm mô tế bào do tụ cầu, viêm thận bể thận cấp và nhiễm trùng huyết ở nhóm tocilizumab và 2 trường hợp viêm phổi ở nhóm chứng.Tỷ lệ nhiễm trùng từ các thử nghiệm pha 3 (OPTION, TOWARD, LITHE và RADIATE) trong đó bệnh nhân nhận cả Nhóm Thuốc chống thấp khớp tác dụng chậm và tocilizumab hoặc giả dược, không có bằng chứng về việc tăng nguy cơ khi tiếp tục điều trị tocilizumab. Thử nghiệm TENDER báo cáo tác dụng phụ nghiêm trọng trong nhánh tocilizumab của nghiên cứu ở bệnh nhân và điều này bao gồm phù mạch và mày đay, và viêm khớp do vi khuẩn.

Rối loạn tiêu hóa bao gồm buồn nôn; đau bụng, loét miệng và viêm dạ dày là những tác dụng phụ thường gặp thứ hai. Các lỗ thủng cũng được báo cáo chủ yếu ở những bệnh nhân đã được chẩn đoán mắc bệnh túi thừa trước đó. Một bệnh nhân được báo cáo đã chết trong thử nghiệm AMBITION ở nhóm tocilizumab vì xuất huyết và thủng đường tiêu hóa trên.
Giảm bạch cầu cấp độ 3 hoặc 4 xảy ra trong các thử nghiệm TOWARD, OPTION, AMBITION, RADIATE và LITHE trong các nhóm tocilizumab. Giảm bạch cầu trung tính được ghi nhận là thoáng qua. Một phân tích tổng hợp của 6 thử nghiệm, cho thấy giảm bạch cầu mức độ 3/4 xảy ra ít nhất một lần ở 6% bệnh nhân. Mức độ men gan cũng được báo cáo trong nhóm tocilizumab và tăng cholesterol toàn phần và cholesterol LDL được báo cáo cho nhóm so với bệnh nhân trong nhóm MTX. Các biến cố khác xảy ra thường xuyên hơn ở nhóm bao gồm nhức đầu và tăng huyết áp.
Liên quan đến các thử nghiệm, bao gồm việc sử dụng tiêm dưới da của tocilizumab, thử nghiệm SUMMACTA về AEs cho thấy một hồ sơ an toàn tương tự so với truyền tĩnh mạch dung dịch tocilizumab, ngoại trừ các phản ứng tại chỗ tiêm nhiều hơn. Nhiễm trùng là tác dụng ngoài ý muốn thường gặp nhất và là tác dụng ngoài ý muốn nghiêm trọng trong cả hai nhóm. Trong thử nghiệm BREVACTA, 6,4% trong mỗi nhóm bị nhiễm trùng đường hô hấp trên, có vẻ là tác dụng ngoài ý muốn thường gặp nhất.
Điều cực kỳ quan trọng là tất cả các chuyên gia chăm sóc sức khỏe phải chịu trách nhiệm đảm bảo cảnh giác dược thích hợp đối với các phản ứng có hại của thuốc (ADR). Các cơ quan quản lý quốc gia thích hợp phải luôn được thông báo về ADRs ngay khi có cơ hội sớm nhất và các chuyên gia chăm sóc sức khỏe phải có trách nhiệm đưa càng nhiều chi tiết càng tốt vào báo cáo của họ để hỗ trợ cho việc đánh giá và phân loại tổng thể của họ. Do cấu trúc của lô có khả năng thay đổi theo lô với các sản phẩm thuốc sinh học, điều tối quan trọng là phải bao gồm các chi tiết về tên thương hiệu và số lô của thuốc. Kết quả của một nghiên cứu của Hà Lan đã gợi ý rằng mặc dù đây là một chính sách của EU trên thực tế, thông tin này hiếm khi được ghi lại. Để tạo điều kiện thuận lợi cho việc này, phải có các hệ thống thích hợp để ghi lại cả tên thương hiệu và số lô của tất cả các sinh phẩm được sử dụng cho tất cả bệnh nhân.
Quy trình sản xuất tocilizumab
Tocilizumab là kháng thể đơn dòng tái tổ hợp nhân tính thuộc phân lớp IgG1 k được sản xuất bằng công nghệ DNA tái tổ hợp. Kháng thể này bao gồm 2 chuỗi nặng và 2 chuỗi nhẹ với 12 liên kết đisunfua trong chuỗi và 4 liên chuỗi với tổng trọng lượng phân tử là 149 kDa.
Sau khi hoàn tất việc phân lập tế bào hạt sản xuất tocilizumab (CHO V4), chúng được nuôi cấy thành ngân hàng tế bào chính và hoạt động có thể được sử dụng vô thời hạn làm điểm khởi đầu trong quá trình sản xuất tocilizumab. Tế bào CHO V4 sau đó được điều chỉnh để có thể phát triển trong nuôi cấy huyền phù trong môi trường không có huyết thanh. Để tăng số lượng tế bào có thể tạo ra tocilizumab, một lọ của ngân hàng tế bào hoạt động được rã đông và số lượng tế bào được mở rộng bằng cách sử dụng bình quay với môi trường phát triển không có huyết thanh. Sau đó, chất cấy thu được được mở rộng bằng cách sử dụng một loạt các lò phản ứng sinh học với khối lượng ngày càng tăng. Quá trình này cho phép tạo ra đủ tế bào CHO để cấy vào một số lò phản ứng sinh học sản xuất có thể tạo ra các lô tocilizumab quy mô lớn cần thiết để cung cấp cho mục đích thương mại. Sau quá trình này, nội dung của lò phản ứng sinh học được thu hoạch bằng cách sử dụng lọc dòng tiếp tuyến cho phép loại bỏ các tế bào khỏi môi trường nuôi cấy của chúng. Khi môi trường nuôi cấy đã được loại bỏ, nó sẽ trải qua một loạt các quá trình tinh chế. Chúng bao gồm sắc ký protein A, bất hoạt virus, sắc ký trao đổi anion, sắc ký trao đổi ion chế độ hỗn hợp, siêu lọc và lọc nano. tocilizumab được pha chế để ngăn chặn sự kết tụ protein bằng cách thêm đường sucrose, polysorbate 80, dinatri phosphate dodecahydrate, natri dihydrogen phosphate dihydrate và nước pha tiêm. Sau khi được bào chế, nó được đựng trong lọ thủy tinh loại 1 ở các mức độ 80mg, 200mg và 400mg. Sản phẩm cuối cùng sau đó trải qua quá trình lọc vô trùng, vô trùng đóng vào lọ, đóng nút và cuối cùng là đóng nắp,
Dạng bào chế
Tocilizumab có sẵn ở dưới dạng dịch truyền tĩnh mạch và thuốc tiêm dưới dưới da.
Các ứng dụng trong y khoa
Viêm khớp dạng thấp
Nếu các loại thuốc khác như thuốc chống thấp khớp điều chỉnh bệnh (DMARD) và thuốc chẹn alpha TNF được chứng minh là không hiệu quả, thì tocilizumab được sử dụng kết hợp với methotrexate để điều trị viêm khớp dạng thấp từ trung bình đến nặng. Nó có thể được sử dụng như một phương pháp điều trị độc lập cho những người không dung nạp với methotrexate. Thuốc có thể giúp cải thiện chức năng thể chất của bệnh nhân và ngăn chặn sự tiến triển của tình trạng bệnh.
Viêm khớp tự phát thiếu niên hệ thống
Tocilizumab được kết hợp với methotrexate trong điều trị viêm khớp vô căn ở trẻ vị thành niên, trừ khi thuốc này được dung nạp kém. Đối với trẻ em từ hai tuổi trở lên, tính an toàn và hiệu quả tổng thể đã được kiểm chứng.
Tocilizumab đã được Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ cấp phép vào năm 2011 để điều trị bệnh viêm khớp tự phát ở trẻ vị thành niên có hệ thống (SJIA), một dạng viêm khớp hiếm gặp và nghiêm trọng ảnh hưởng đến trẻ nhỏ.
Bệnh Castleman
Tociluzumab được chấp thuận để điều trị bệnh Castleman, một tổn thương tăng sản hạch lympho lành tính. Là bệnh lý rất hiếm gặp nhất là thể tương bào chưa biết rõ nguyên nhân.
Viêm dây thần kinh thị giác
Tocilizumab có thể có hiệu quả trong các trường hợp mắc bệnh viêm thần kinh thị giác.
Viêm động mạch tế bào khổng lồ
Vào năm 2017, tocilizumab đã được Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ cấp phép cho bệnh viêm động mạch tế bào khổng lồ.
Hội chứng phóng thích Cytokine
Năm 2017, Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ cấp phép đã Tocilizumab trong điều trị Hội chứng giải phóng Cytokine-CRS.
Tài liệu tham khảo
- 1. Higuchi T, Nakanishi T, Takada K, Matsumoto M, Okada M, Horikoshi H, Suzuki K. A case of multicentric castleman’s disease having lung lesion successfully treated with humanized anti-interleukin-6 receptor antibody, Tocilizumab. J Korean Med Sci 2010. Tóm tắt toàn văn
- 2. Sebba A. Tocilizumab: the first interleukin-6-receptor inhibitor. Am J Health Syst Pharm 2008 Tóm tắt toàn văn
- 3. Smolen JS, Beaulieu A, Rubbert-Roth A, Ramos-Remus C, Rovensky J, Alecock E, Woodworth T, Alten R, OPTION Investigators . Effect of interleukin-6 receptor inhibition with tocilizumab in patients with rheumatoid arthritis (OPTION study): a double-blind, placebo-controlled, randomised trial. Lancet 2008 Tóm tắt toàn văn
- 4. Chaitow J, De Benedetti F, Brunner H, Ruperto N, Allen R, Murray K, Schneider R, Woo P, Wright S, Kenwright A, et al.. Tocilizumab in patients with systemic juvenile idiopathic arthritis: Efficacy data from the placebo-controlled 12-week part of the phase III tender trial. Intern Med J 2011 Tóm tắt toàn văn
- 5. Farah Z, Ali S, Price-Kuehne F, Mackworth-Young CG. Tocilizumab in refractory rheumatoid arthritis: long-term efficacy, safety, and tolerability beyond 2 years. Biologics 2016 Tóm tắt toàn văn
- 6. Rosas, I. O., Bräu, N., Waters, M., Go, R. C., Hunter, B. D., Bhagani, S., … & Malhotra, A. (2021). Tocilizumab in hospitalized patients with severe Covid-19 pneumonia. New England Journal of Medicine, 384(16), 1503-1516. Tóm tắt toàn văn
- 7. Tleyjeh, I. M., Kashour, Z., Damlaj, M., Riaz, M., Tlayjeh, H., Altannir, M., … & Kashour, T. (2021). Efficacy and safety of tocilizumab in COVID-19 patients: a living systematic review and meta-analysis. Clinical Microbiology and Infection, 27(2), 215-227. Tóm tắt toàn văn
- 8. Alzghari, S. K., & Acuña, V. S. (2020). Supportive treatment with tocilizumab for COVID-19: a systematic review. Journal of Clinical Virology, 127, 104380. Tóm tắt toàn văn
Xuất xứ: Đức
Xuất xứ: Nhật Bản