Tinzaparin
Biên soạn và Hiệu đính
Dược sĩ Xuân Hạo
Danh pháp
Tên chung quốc tế
Tên danh pháp theo IUPAC
Không có thông tin
Nhóm thuốc
Thuốc chống đông máu
Mã ATC
B —Máu và các cơ quan tạo ra máu
B01 — Thuốc chống nhiễm mạch
B01A — Tác nhân chỗng nhiễm mạch
B01AB — Nhóm heparin
B01AB10 — Tinzaparin
Mã UNII
7UQ7X4Y489
Mã CAS
9041-08-1
Cấu trúc phân tử
Công thức phân tử
Không có thông tin
Phân tử lượng
6500 g/mol (dạng muối Natri)
Cấu trúc phân tử
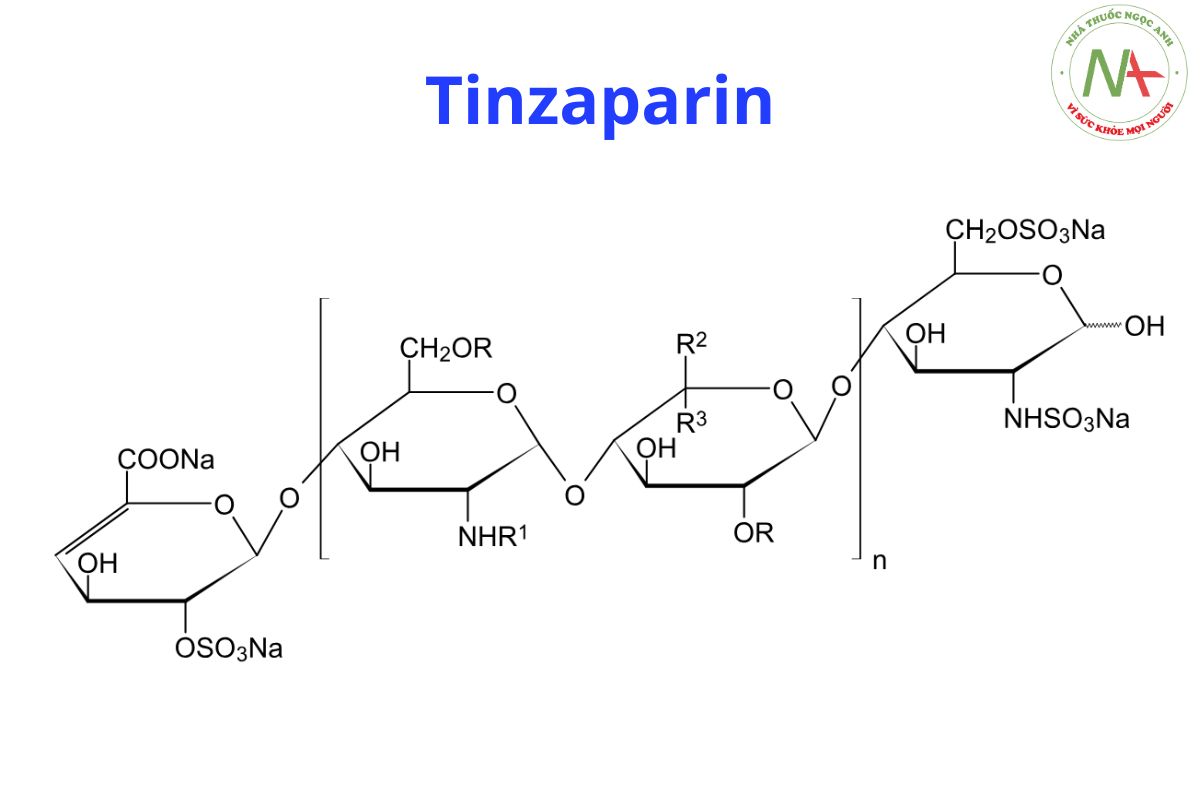
Tinzaparin natri là muối natri của heparin có trọng lượng phân tử thấp thu được bằng cách khử heparin bằng enzym có kiểm soát từ niêm mạc ruột lợn bằng cách sử dụng heparinase từ Flavobacterium heparinum. Phần lớn các thành phần có cấu trúc axit 2-Osulpho-4-enepyranosuronic ở đầu không khử và cấu trúc 2-N,6-O-disulpho-Dglucosamine ở đầu khử của chuỗi.
Các tính chất phân tử
Không có thông tin
Các tính chất đặc trưng
Không có thông tin
Cảm quan
Tinzaparin được dùng dạng tiêm, chứa trong lọ dung dịch trong suốt, không màu đến hơi vàng và giống như các sản phẩm thuốc dùng ngoài đường tiêu hóa khác, nên kiểm tra bằng mắt thường để phát hiện các hạt vật chất và sự đổi màu trước khi sử dụng.
Dạng bào chế
Tinzaparin dạng thuốc tiêm được đựng trong 1 lọ là một dung dịch vô trùng, chứa tinzaparin natri, một heparin trọng lượng phân tử thấp. Nó có sẵn trong một lọ 2 mL đa liều.
Độ ổn định và điều kiện bảo quản của Tinzaparin
Mỗi lọ 2 mL chứa 20.000 kháng yếu tố Xa IU (anti-Xa) natri tinzaparin trên mỗi mL, tổng cộng là 40.000 IU và natri metabisulfite 3,1 mg/mL làm chất ổn định. Lọ chứa 10 mg/mL rượu benzyl làm chất bảo quản. Natri hydroxit có thể được thêm vào để đạt được khoảng pH từ 5,0 đến 7,5.
Nguồn gốc
Tinzaparin là thuốc chống huyết khối thuộc nhóm heparin . Nó là một heparin trọng lượng phân tử thấp (LMWH) được bán trên thị trường với tên Innohep trên toàn thế giới.
Nó đã được Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) phê duyệt để điều trị và dự phòng huyết khối tĩnh mạch sâu (DVT) và thuyên tắc phổi (PE) một lần mỗi ngày.
Dược lý và cơ chế hoạt động
Tinzaparin, giống như các LMWH khác, thể hiện hoạt tính chống Xa lớn hơn hoạt tính chống IIa. Hoạt tính chống Xa của nó lớn hơn khoảng 2,0 +/- 0,5 lần so với hoạt tính chống IIa của nó. Ngược lại, heparin cho thấy sự ức chế xấp xỉ bằng nhau của cả Xa và IIa. Tinzaparin natri là một heparin trọng lượng phân tử thấp có đặc tính chống huyết khối.
Tinzaparin là một loại thuốc chống đông máu ngăn ngừa sự hình thành huyết khối. Giống như tất cả các LMWH, tinzaparin chỉ kéo dài thời gian thromboplastin một phần được kích hoạt (aPTT) ở một mức độ nhất định ở liều cao hơn và không cần theo dõi thường xuyên. Tuy nhiên, nồng độ kháng Xa có thể được theo dõi trong một số điều kiện như mang thai và rối loạn chức năng thận. Cần tránh ở những bệnh nhân có độ thanh thải creatinin dưới 20 ml/phút. Ở những bệnh nhân như vậy, heparin không phân đoạn được ưu tiên. Tinzaparin có thể được sử dụng ở những bệnh nhân có độ thanh thải creatinin 20-30 ml / phút, cung cấp ngưỡng an toàn cao nhất để sử dụng ở bệnh nhân suy thận so với tất cả các LMWH khác.
Thời gian chảy máu thường không bị ảnh hưởng bởi tinzaparin natri. Thời gian thromboplastin từng phần được kích hoạt (aPTT) được kéo dài bằng liều điều trị của tinzaparin natri được sử dụng trong điều trị huyết khối tĩnh mạch sâu (DVT). Thời gian prothrombin (PT) có thể hơi kéo dài khi điều trị bằng natri tinzaparin nhưng thường duy trì trong giới hạn bình thường. Cả aPTT và PT đều không thể được sử dụng để theo dõi điều trị tinzaparin natri.
Cả heparin không phân đoạn và tinzaparin natri đều không có hoạt tính tiêu sợi huyết nội tại; do đó, chúng không làm tan các cục máu đông hiện có. Tinzaparin natri gây giải phóng chất ức chế con đường yếu tố mô, có thể góp phần vào tác dụng chống huyết khối. Heparin cũng được biết là có nhiều tác dụng độc lập với tác dụng chống đông máu của nó. Chúng bao gồm tương tác với các yếu tố tăng trưởng tế bào nội mô, ức chế tăng sinh tế bào cơ trơn, kích hoạt lipoprotein lipase, ức chế tiết aldosterone và gây kết tập tiểu cầu.
Ứng dụng trong y học của Tinzaparin
Điều trị huyết khối tĩnh mạch sâu cấp tính (DVT) có hoặc không có tắc mạch phổi (PE).
Trong một thử nghiệm mù đôi, ngẫu nhiên, đa trung tâm, tiêm natri tinzaparin được so sánh với heparin không phân đoạn ở 435 bệnh nhân nhập viện với DVT đoạn gần có triệu chứng. Sáu phần trăm bệnh nhân được ghi danh có thuyên tắc phổi có triệu chứng được xác nhận bằng khiếm khuyết quét phổi phân đoạn hoặc lớn hơn. Các bệnh nhân nghiên cứu có độ tuổi từ 19 đến 92 (trung bình 61 ± 17 tuổi), 55% là nam giới, 88% là người da trắng và 8% là người da đen.
Bệnh nhân được dùng Tinzaparin SC một lần mỗi ngày tùy theo trọng lượng cơ thể (175 IU/kg) và tiêm tĩnh mạch nhanh giả dược sau đó truyền tĩnh mạch giả dược liên tục hoặc heparin không phân đoạn ở liều tiêm nhanh ban đầu (5.000 IU) sau đó truyền tĩnh mạch liên tục không phân đoạn heparin với tốc độ được điều chỉnh theo aPTT (1,5 đến 2,5 lần giá trị kiểm soát) và tiêm giả dược SC một lần mỗi ngày. Điều trị tiếp tục trong khoảng 6 ngày, và cả hai nhóm điều trị cũng nhận được warfarin natri đường uống bắt đầu từ Ngày thứ 2, kéo dài đến Ngày thứ 90 với các liều được điều chỉnh đến mục tiêu INR từ 2,0 đến 3,0.
Tỷ lệ thuyên tắc huyết khối (TE) tích lũy trong 90 ngày [DVT hoặc PE tái phát] với Tinzaparin không khác biệt đáng kể so với tỷ lệ với heparin không phân đoạn.
Tỷ lệ tử vong với Tinzaparin là 4,6% (10 bệnh nhân) và với heparin là 9,6% (21 bệnh nhân). Khoảng tin cậy (CI) 95% cho sự khác biệt về tỷ lệ tử vong là 0,16%, 9,76%.
Trong một thử nghiệm lâm sàng ngẫu nhiên, nhãn mở, đa trung tâm, Tinzaparin được so sánh với heparin không phân đoạn như phương pháp điều trị ban đầu cho bệnh nhân nhập viện với PE có triệu chứng không cần điều trị tiêu sợi huyết, cắt bỏ tắc mạch hoặc gián đoạn tĩnh mạch chủ. Bệnh nhân bị loại trừ nếu họ có nguy cơ cao bất thường đối với các biến cố huyết khối và/hoặc chảy máu hoặc các biến chứng khác. Trong số 608 bệnh nhân được điều trị, 422 người đã ghi nhận DVT.
Trước khi xác định đủ điều kiện nghiên cứu và phân nhóm ngẫu nhiên, bệnh nhân được phép dùng heparin không phân đoạn; 78% bệnh nhân dùng heparin không phân đoạn ở liều điều trị trong tối đa 24 giờ và thêm 4% dùng heparin ở liều điều trị trong hơn 24 giờ. Sau khi phân nhóm ngẫu nhiên, Tinzaparin được tiêm dưới da một lần mỗi ngày, 175 IU/kg thể trọng; heparin dưới dạng bolus IV ban đầu (50 IU/kg) sau đó truyền IV liên tục với tốc độ được điều chỉnh theo aPTT (gấp 2 đến 3 lần giá trị kiểm soát). Đối với cả hai nhóm, điều trị tiếp tục trong khoảng 8 ngày. Tất cả các bệnh nhân cũng được điều trị bằng thuốc chống đông đường uống bắt đầu trong 3 ngày đầu tiên kéo dài đến ngày thứ 90.
Dược động học
Hấp thu
Nồng độ hoạt tính kháng Xa trong huyết tương tăng trong 2 đến 3 giờ đầu sau khi tiêm tinzaparin natri dưới da và đạt mức tối đa trong vòng 4 đến 5 giờ. Nồng độ tối đa (Cmax) là 0,25 và 0,87 IU/mL đạt được sau khi dùng một liều cố định SC duy nhất là 4.500 IU (khoảng 64,3 IU/kg) và liều điều chỉnh theo cân nặng tương ứng là 175 IU/kg natri tinzaparin. Dựa trên mức độ hấp thu (AUC0-∞), so sánh giữa liều đơn 4.500 IU và 12.250 IU cho thấy rằng hoạt tính kháng Xa tăng nhiều hơn liều lượng tỷ lệ thuận với mức tăng liều.
Sau khi tiêm dưới da một lần tinzaparin natri, tỷ lệ hoạt tính trung bình của chất chống Xa và chất chống IIa, dựa trên diện tích dưới tác dụng của chất chống Xa và thời gian anti-IIa, là 2,8 và cao hơn so với heparin không phân đoạn (khoảng 1,2). Sinh khả dụng tuyệt đối (sau khi dùng 4.500 IU SC và tiêm tĩnh mạch [IV]) là 86,7% dựa trên hoạt tính kháng Xa.
Phân bố
Thể tích phân bố của tinzaparin natri nằm trong khoảng từ 3,1 L đến 5,0 L. Các giá trị này có độ lớn tương tự như thể tích máu, cho thấy rằng sự phân bố hoạt tính kháng Xa được giới hạn ở khoang trung tâm.
Chuyển hóa
Heparin trọng lượng phân tử thấp được chuyển hóa một phần bằng cách khử lưu huỳnh và khử trùng hợp.
Đào thải
Ở những người tình nguyện khỏe mạnh, thời gian bán hủy đào thải sau khi tiêm dưới da 4.500 IU hoặc 175 IU/kg tinzaparin natri là khoảng 3-4 giờ dựa trên hoạt tính kháng Xa. Độ thanh thải sau khi tiêm tĩnh mạch 4.500 IU tinzaparin natri là khoảng 1,7 L/giờ. Đường thải trừ chính là thận. Hoạt tính chống Xa không tích lũy với liều 175 IU/kg một lần mỗi ngày trong 5 ngày ở những người tình nguyện khỏe mạnh.
Độc tính của Tinzaparin
Loãng xương với thời gian sử dụng ngày càng tăng, chảy máu, rụng tóc, giảm tiểu cầu do heparin (HIT). Tất cả các phản ứng có hại của thuốc này xảy ra ít hơn với LMWH so với heparin không phân đoạn. Tinzaparin cho thấy không có tác dụng gây độc ở liều lên tới 5 mg/kg ở chuột nhắt, chuột cống hoặc chó trong các nghiên cứu độc tính cấp tính, bán cấp tính và mãn tính tiêu chuẩn.
Tương tác của Tinzaparin với thuốc khác
Do tăng nguy cơ chảy máu, Tinzaparin nên được sử dụng thận trọng ở những bệnh nhân đang dùng thuốc chống đông máu đường uống, thuốc ức chế tiểu cầu (ví dụ: salicylat, dipyridamole, sulfinpyrazone, dextran, NSAID bao gồm ketorolac tromethamine, ticlopidine và clopidogrel) và thuốc tan huyết khối. Nếu cần thiết phải dùng đồng thời, nên theo dõi chặt chẽ lâm sàng và xét nghiệm đối với những bệnh nhân này.
Lưu ý khi dùng Tinzaparin
Lưu ý và thận trọng chung
Tăng Transaminase huyết thanh: Tăng aspartate không có triệu chứng (AST [SGOT]) và nồng độ alanine (ALT [SGPT]) aminotransferase đã xảy ra ở những bệnh nhân trong quá trình điều trị bằng Tinzaparin). Sự gia tăng nồng độ transaminase tương tự cũng đã được quan sát thấy ở những bệnh nhân và tình nguyện viên được điều trị bằng heparin và các heparin trọng lượng phân tử thấp khác.
Gây ung thư, đột biến, suy giảm khả năng sinh sản: Không có nghiên cứu dài hạn trên động vật được thực hiện để đánh giá khả năng gây ung thư của natri tinzaparin.
Tinzaparin natri cho thấy không có khả năng gây độc gen trong xét nghiệm đột biến tế bào vi khuẩn in vitro (xét nghiệm AMES), xét nghiệm đột biến gen chuyển tiếp tế bào buồng trứng của chuột đồng Trung Quốc trong ống nghiệm, xét nghiệm quang sai nhiễm sắc thể tế bào lympho người in vitro và xét nghiệm vi nhân in vivo của chuột nhắt.
Tinzaparin natri ở liều SC lên tới 1800 IU/kg/ngày ở chuột (gấp khoảng 2 lần liều khuyến cáo tối đa cho người dựa trên diện tích bề mặt cơ thể) được phát hiện là không ảnh hưởng đến khả năng sinh sản và khả năng sinh sản.
Lưu ý cho người đang mang thai
Loại B
Tất cả các trường hợp mang thai đều có nguy cơ dị tật bẩm sinh, sảy thai hoặc kết quả bất lợi khác bất kể việc tiếp xúc với thuốc. Do đó không khuyến cáo sử dụng trên nhóm đối tượng này
Lưu ý cho người đang cho con bú
Mặc dù chưa có báo cáo cụ thể rằng Tinzaparin có được bài tiết vào sữa mẹ hay không. Tuy nhiên có xuất hiện độc tính trên thai nhi. Do đó, nên cân nhắc khi dùng Tinzaparin cho nhóm đối tượng này.
Lưu ý cho người vận hành máy móc hay lái xe
Không có báo cáo trên nhóm đối tượng này.
Một vài nghiên cứu về Tinzaparin trong Y học
Tinzaparin trong huyết khối liên quan đến ung thư sau 6 tháng: nghiên cứu TiCAT
Giới thiệu: Tính an toàn và hiệu quả của điều trị heparin trọng lượng phân tử thấp (LMWH) ở những bệnh nhân bị huyết khối liên quan đến ung thư (CAT) sau 6 tháng vẫn chưa được biết. Mục đích của chúng tôi là xác định sự an toàn của việc sử dụng tinzaparin lâu dài ở bệnh nhân CAT.
Phương pháp: Chúng tôi đã thực hiện một nghiên cứu tiến cứu, mở, đơn nhánh, đa trung tâm ở những bệnh nhân mắc CAT được điều trị bằng tinzaparin. Chúng tôi đã đánh giá tỷ lệ các biến cố chảy máu liên quan đến lâm sàng (chảy máu nghiêm trọng và không liên quan đến lâm sàng) và tái phát thuyên tắc huyết khối tĩnh mạch (VTE).
Kết quả: Tổng cộng có 247 bệnh nhân được tuyển dụng, với tỷ lệ xuất huyết nặng là 4,9% (12/247). Tỷ lệ chảy máu liên quan đến lâm sàng trong các tháng 1-6 và 7-12, là 0,9% [khoảng tin cậy 95% (KTC 95%) 0,5 đến 1,6%] và 0,6% (KTC 95% 0,2 đến 1,4%) (p=0,5 ) tương ứng trên mỗi bệnh nhân và tháng. Giới tính nam cho thấy nguy cơ chảy máu liên quan đến lâm sàng cao hơn với tỷ lệ rủi ro (HR) là 2,97 (KTC 95% 1,01 đến 8,1; p=0,02). Tỷ lệ tái phát VTE ở các tháng 1-6 và 7-12 lần lượt là 4,5% (95% CI 2,2 đến 7,8%) và 1,1% (95% CI 0,1 đến 3,9%). Một bệnh nhân tử vong do VTE tái phát và hai bệnh nhân tử vong do chảy máu nặng.
Kết luận: Điều trị bằng tinzaparin sau 6 tháng là an toàn ở bệnh nhân CAT.
Tài liệu tham khảo
- Drugbank, Tinzaparin , truy cập ngày 30/03/2023.
- Jara-Palomares, L., Solier-Lopez, A., Elias-Hernandez, T., Asensio-Cruz, M., Blasco-Esquivias, I., Marin-Barrera, L., … & Otero, R. (2017). Tinzaparin in cancer associated thrombosis beyond 6 months: TiCAT study. Thrombosis research, 157, 90-96.
- Amerali, M., & Politou, M. (2022). Tinzaparin—a review of its molecular profile, pharmacology, special properties, and clinical uses. European Journal of Clinical Pharmacology, 78(10), 1555-1565.
- https://www.aboutkidshealth.ca/injecttinzaparin
