Temozolomid
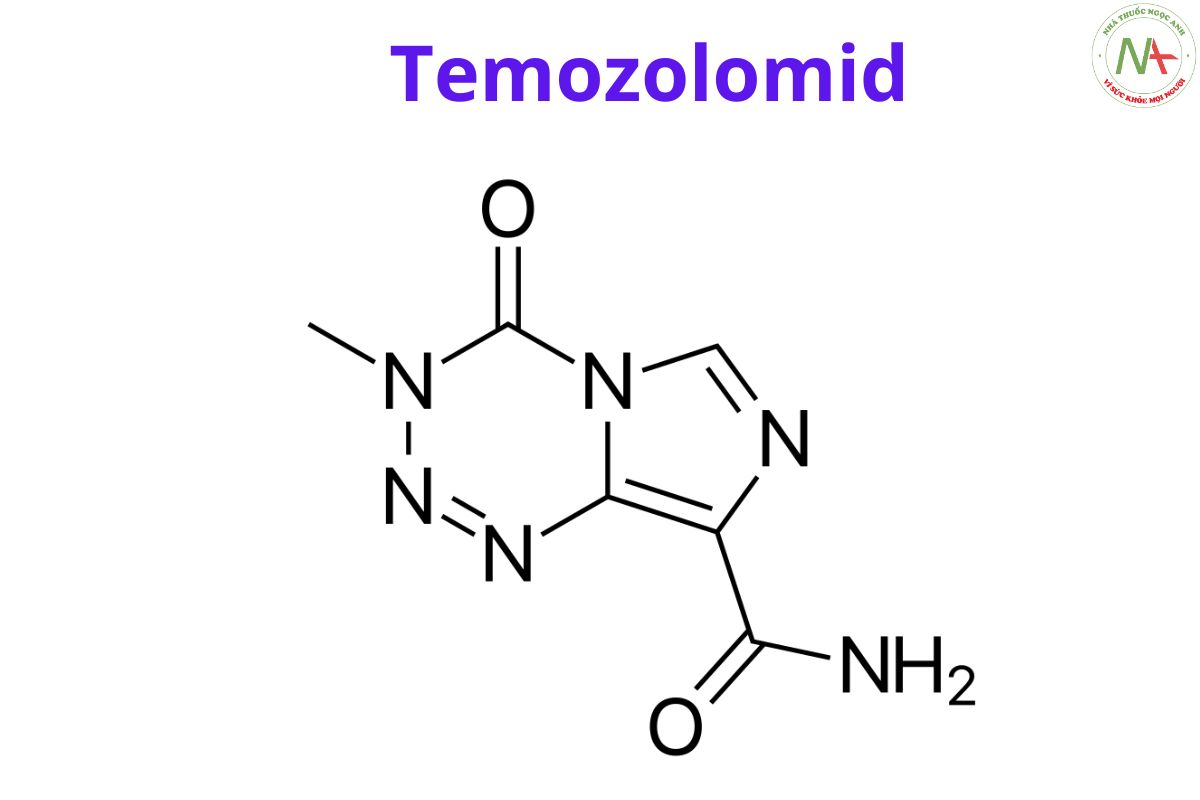
Danh pháp
Tên chung quốc tế
Tên danh pháp theo IUPAC
3-metyl-4-oxoimidazo[5,1-d][1,2,3,5]tetrazin-8-cacboxamit
Nhóm thuốc
Thuốc Temozolomide thuộc nhóm nào? Chất chống ung thư
Mã ATC
L – Thuốc chống ung thư và điều hòa miễn dịch
L01 – Chất chống ung thư
L01A – Tác nhân alkyl hóa
L01AX – Tác nhân alkyl hóa khác
L01AX03 – Temozolomide
Mã UNII
YF1K15M17Y
Mã CAS
85622-93-1
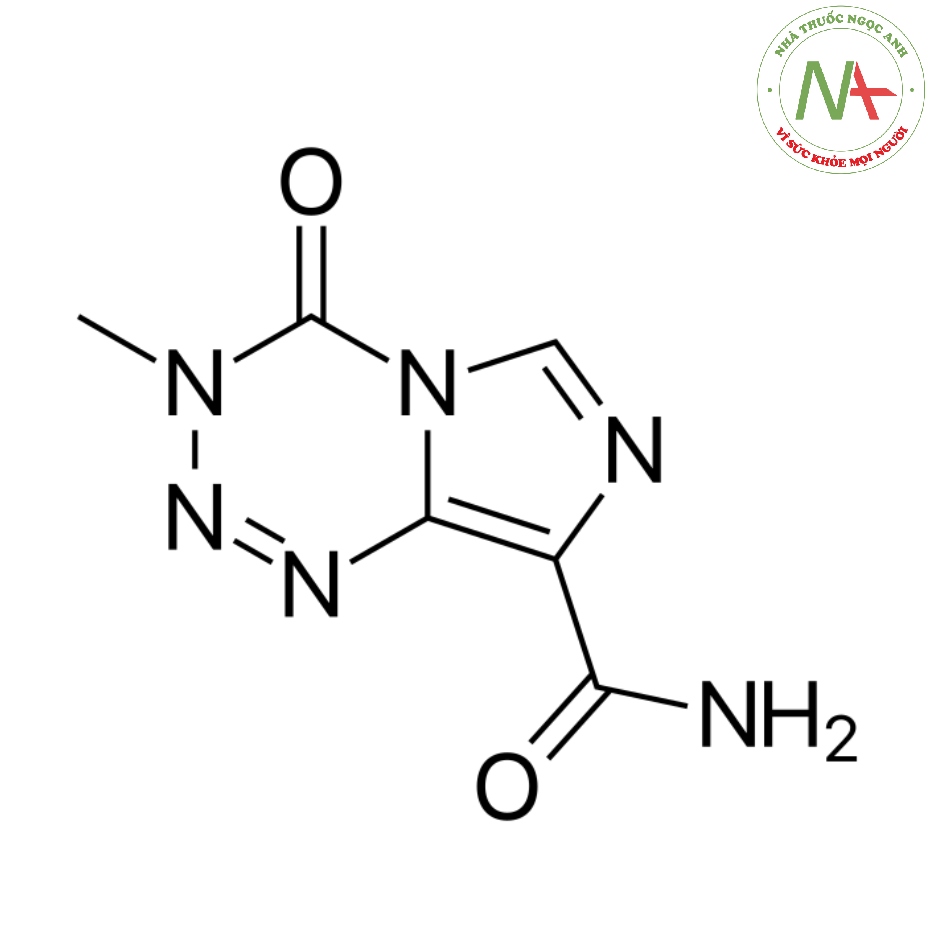
Cấu trúc phân tử
Công thức phân tử
C6H6N6O2
Phân tử lượng
194,15 g/mol
Cấu trúc phân tử
Các tính chất phân tử
Số liên kết hydro cho: 1
Số liên kết hydro nhận: 5
Số liên kết có thể xoay: 1
Diện tích bề mặt cực tôpô: 106
Số lượng nguyên tử nặng: 14
Liên kết cộng hóa trị: 1
Các tính chất đặc trưng
Temozolomide là một imidazotetrazine là 3,4-dihydroimidazo[5,1-d][1,2,3,5]tetrazine được thế ở các vị trí 3, 4 và 8 bởi các nhóm methyl , oxo và carboxamide tương ứng. Một tiền chất của MTIC ( 5-(3-methyltriaz-1-en-1-yl)-1H-imidazole-4-carboxamide. Nó là một imidazotetrazine , một amin axit monocacboxylic và một dẫn xuất triazene .
Tính chất
Chất rắn
Điểm nóng chảy: 212 °C. Nó hòa tan một chút trong nước và axit nước
Độ hòa tan: 5,09 g/L
Dạng bào chế
Viên nang: Temozolomide 100mg, Temozolomide 250mg,..
Thuốc tiêm: 100MG/lọ

Nguồn gốc
Temozolomide được phát triển bởi Malcolm Stevens và nhóm của ông tại Đại học Aston ở Birmingham. Vào ngày 11/ 8 /1999, Temozolomide đã được FDA chấp thuận dưới dạng viên nang uống và sau đó dưới dạng tiêm tĩnh mạch vào ngày 27/ 2/2009.
Dược lý
Temozolomide là một tiền chất của nhóm imidazotetrazine , đòi hỏi quá trình thủy phân không có enzyme ở pH sinh lý _in vivo_ để thực hiện quá trình alkyl hóa dư lượng adenine / guanine , dẫn đến tổn thương DNA thông qua các chu kỳ sửa chữa vô ích và cuối cùng là chết tế bào. Điều trị bằng temozolomide có liên quan đến suy tủy, tình trạng này có thể nghiêm trọng hơn ở phụ nữ và bệnh nhân cao tuổi. Bệnh nhân phải có ANC ≥1,5 x 10 9 /L và số lượng tiểu cầu ≥100 x 10 9/L trước khi bắt đầu trị liệu và phải được theo dõi hàng tuần trong giai đoạn xạ trị đồng thời, vào ngày thứ nhất và ngày 22 của chu kỳ duy trì, và hàng tuần tại bất kỳ thời điểm nào mà số lượng ANC/tiểu cầu giảm xuống dưới các giá trị được chỉ định cho đến khi phục hồi. Viêm phổi do Pneumocystis có thể xảy ra ở bệnh nhân đang điều trị và nên dự phòng cho bệnh nhân trong giai đoạn điều trị đồng thời với việc theo dõi ở tất cả các giai đoạn. Nhiễm độc gan nghiêm trọng cũng đã được báo cáo và xét nghiệm gan nên được thực hiện ngay từ đầu, giữa chu kỳ đầu tiên, trước mỗi chu kỳ tiếp theo và khoảng hai đến bốn tuần sau liều cuối cùng. Các nghiên cứu trên động vật cho thấy temozolomide có độc tính đáng kể đối với phôi thai; bệnh nhân nam và nữ nên thực hiện các biện pháp tránh thai tương ứng trong vòng ba và sáu tháng sau liều temozolomide cuối cùng.
Cơ chế tác dụng
Temozolomid thuộc nhóm thuốc chống ung thư. Một nhóm thuốc khác với các tác nhân alkyl hóa khác được sử dụng trong lâm sàng ở chỗ chúng đơn chức năng và do đó không thể liên kết chéo các đại phân tử tế bào. Chúng có tác dụng thiết yếu trong kích hoạt trao đổi chất thành các chất trung gian có hiệu quả chống ung thư và sự hiện diện trong cấu trúc hóa học của các nhóm N-methyl, mà sau quá trình trao đổi chất, có thể biến đổi DNA của tế bào theo cộng hóa trị. Các cơ chế chính xác mà mỗi loại thuốc này hoạt động để tiêu diệt các tế bào khối u vẫn chưa được hiểu đầy đủ.
U nguyên bào thần kinh đệm (glioblastoma multiforme) là khối u não nguyên phát ở người trưởng thành phổ biến và ác tính nhất, chiếm 45,6% trong tất cả các khối u não ác tính nguyên phát. Được xác định chủ yếu về mặt mô bệnh học bằng hoại tử và tăng sinh vi mạch (phân loại độ IV của WHO), u nguyên bào thần kinh đệm thường được điều trị bằng xạ trị và hóa trị liệu dựa trên alkyl hóa đồng thời với temozolomide. Temozolomide là một tác nhân alkyl hóa ưa béo nhỏ thuộc nhóm imidazotetrazine, dùng được cả theo đường uống và đường tiêm tĩnh mạch, đồng thời có thể vượt qua hàng rào máu não để ảnh hưởng đến các khối u thần kinh trung ương. Sau khi hấp thụ, TMZ trải qua quá trình phân hủy tự phát không do enzym ở pH sinh lý để tạo thành 5-(3-methyltriazen-1-yl) imidazole-4-carboxamide ( MTIC), chất này sau đó phản ứng với nước để tạo ra 5-aminoimidazole-4-carboxamit (AIC) và một cation metyl diazonium có khả năng phản ứng cao. Các khối u não như u nguyên bào thần kinh đệm thường có độ pH kiềm hơn mô khỏe mạnh, thuận lợi cho việc kích hoạt TMZ trong mô khối u. Cation methyl diazonium có khả năng phản ứng cao và methyl hóa DNA ở vị trí N7 của guanine (N7-MeG, 70%), vị trí N3 của adenine (N3-MeA, 9%) và vị trí O6 của guanine(O6-MeG, 6%). Để so sánh, việc sửa chữa O6-MeG yêu cầu hoạt động của enzyme tự sát methylguanine -DNA methyltransferase (MGMT), loại bỏ nhóm methyl để khôi phục guanine . Nếu không được MGMT sửa chữa, O6-MeG bắt cặp sai với thymine , kích hoạt con đường sửa chữa không khớp DNA (MMR) để loại bỏ thymine(không phải O6-MeG), dẫn đến các chu kỳ sửa chữa vô ích và chuỗi DNA cuối cùng bị đứt dẫn đến quá trình chết theo chương trình. Vì hoạt động MMR rất quan trọng đối với khả năng gây độc tế bào của temozolomide, nên các tế bào bị giảm hoặc không có chức năng MGMT và con đường MMR nguyên vẹn là những tế bào nhạy cảm nhất với việc điều trị bằng temozolomide. U nguyên bào thần kinh đệm điều chỉnh tăng MGMT điều hòa giảm MMR hoặc thay đổi cả hai đều kháng TMZ, dẫn đến thất bại điều trị. Gần đây, người ta cũng quan tâm nhiều hơn đến tác dụng điều hòa miễn dịch của TMZ, liên quan đến tác dụng ức chế tủy của nó.
Dược động học
Hấp thu
Temozolomide được hấp thu nhanh chóng và hoàn toàn trong đường tiêu hóa và ổn định ở cả pH axit và trung tính. Do đó, temozolomide có thể được dùng cả bằng đường uống và tiêm tĩnh mạch với T tối đa trung bình là một giờ. Sau khi uống một liều duy nhất 150 mg/m 2 , temozolomide và chất chuyển hóa MTIC có hoạt tính của nó có giá trị C tối đa là 7,5 μg/mL và 7,5 μg/mL và giá trị AUC là 23,4 μg\*hr/mL và 864 ng\*hr/ ml, tương ứng. Tương tự, sau một lần truyền tĩnh mạch 150 mg/m 2 trong 90 phút , temozolide và chất chuyển hóa MTIC có hoạt tính của nó có C tối đacác giá trị lần lượt là 7,3 μg/mL và 276 ng/mL và AUC là 24,6 μg\*hr/mL và 891 ng\*hr/mL. Động học của Temozolomide là tuyến tính trong khoảng 75-250 mg/m 2 /ngày. Hấp thu temozolomide đường uống bị ảnh hưởng bởi thức ăn. Sử dụng sau bữa sáng giàu chất béo 587 calo khiến cho Cmax và AUC trung bình giảm lần lượt là 32% và 9%, đồng thời Tmax trung bình tăng gấp 2 lần (từ 1-2,25 giờ).
Chuyển hóa
Sau khi hấp thụ, temozolomide trải qua quá trình chuyển đổi hóa học không có enzyme thành chất chuyển hóa có hoạt tính 5-(3-methyltriazen-1-yl) imidazole-4-carboxamide (MTIC) cộng với carbon dioxide và thành chất chuyển hóa axit temozolomide , xảy ra ở pH sinh lý nhưng được tăng cường với tăng độ kiềm. MTIC sau đó phản ứng với nước để tạo ra 5-aminoimidazole-4-carboxamit (AIC) và cation metyl diazonium có hoạt tính phản ứng cao, loại alkyl hóa hoạt động. Hệ thống cytochrom P450 chỉ đóng một vai trò nhỏ trong quá trình chuyển hóa temozolomide. So với AUC của temozolomide, mức độ tiếp xúc với MTIC và AIC lần lượt là 2,4% và 23%.
Phân bố
Temozolomide có thể tích phân bố biểu kiến trung bình (%CV) là 0,4 (13%) L/kg.
Thải trừ
Khoảng 38% temozolomide được sử dụng có thể được phục hồi sau bảy ngày, với 38% trong nước tiểu và chỉ 0,8% trong phân. Vật liệu thu hồi chủ yếu bao gồm các chất chuyển hóa: chất chuyển hóa phân cực không xác định (17%), AIC (12%) và chất chuyển hóa axit temozolomide (2,3%). Chỉ 6% liều thu hồi đại diện cho temozolomide không thay đổi. Temozolomide có độ thanh thải khoảng 5,5 L/giờ/m2.
Ứng dụng trong y học
Công dụng thuốc Temozolomide:
- Temozolomide được chỉ định điều trị u nguyên bào thần kinh đệm ở bệnh nhân người lớn mới được chẩn đoán đồng thời với xạ trị và để điều trị duy trì sau đó. Nó cũng được chỉ định để điều trị u tế bào hình sao anaplastic chịu nhiệt ở những bệnh nhân trưởng thành đã trải qua quá trình tiến triển bệnh theo chế độ thuốc có chứa nitrosourea và procarbazine.
- Đối với việc điều trị cho bệnh nhân người lớn, thanh thiếu niên, trẻ em từ ba tuổi, bị u thần kinh đệm ác tính, chẳng hạn như u tế bào hình sao anaplastic, u nguyên bào thần kinh đệm đa dạng cho thấy sự tái phát hoặc tiến triển sau khi điều trị tiêu chuẩn.
- Temozolomide là một tác nhân alkyl hóa dùng đường uống được sử dụng chủ yếu trong điều trị các khối u não ác tính bao gồm u nguyên bào thần kinh đệm và u tế bào hình sao. Temozolomide có liên quan đến tỷ lệ tăng men huyết thanh thấp trong quá trình điều trị và hiếm gặp các trường hợp tổn thương gan ứ mật rõ ràng trên lâm sàng.
Tác dụng phụ
- Các phản ứng bất lợi phổ biến nhất (tỷ lệ ≥20%) là: rụng tóc, mệt mỏi, buồn nôn, nôn, nhức đầu, táo bón, chán ăn và co giật.
- Các bất thường xét nghiệm huyết học Độ 3 đến 4 phổ biến nhất (tỷ lệ ≥10%) ở bệnh nhân u tế bào hình sao anaplastic là: giảm tế bào lympho, giảm tiểu cầu, giảm bạch cầu trung tính và giảm bạch cầu.
Độc tính ở người
Độc tính giới hạn liều chính của temozolomide là ức chế tủy, có thể xảy ra với bất kỳ liều nào nhưng nghiêm trọng hơn ở liều cao hơn. Bệnh nhân dùng liều cao gặp phải các phản ứng bất lợi, bao gồm suy tủy nghiêm trọng và kéo dài, nhiễm trùng và tử vong. Một bệnh nhân dùng liều 2000 mg/ngày trong 5 ngày đã bị giảm toàn bộ tế bào máu, sốt và suy đa cơ quan, dẫn đến tử vong. Bệnh nhân bị quá liều nên được theo dõi công thức máu toàn bộ và được chăm sóc hỗ trợ khi cần thiết.
Tăng aminotransferase huyết thanh xảy ra trong khi điều trị bằng temozolomide ở 12% bệnh nhân, nhưng những mức tăng này thường nhẹ và tự giới hạn, không cần điều chỉnh liều hoặc ngừng thuốc. Một trường hợp tăng aminotransferase huyết thanh kèm theo vàng da đã được báo cáo trong các thử nghiệm đăng ký temozolomide và sau khi được phê duyệt. Đáng chú ý hơn, nhiều báo cáo trường hợp đơn lẻ và một số trường hợp nhiễm độc gan temozolomide đã được báo cáo trong tài liệu. Khởi phát tổn thương thường trong vòng 2 đến 8 tuần kể từ khi bắt đầu dùng temozolomide nhưng một số bệnh nhân đã được điều trị nhiều đợt trước khi bắt đầu tổn thương gan. Mô hình tăng men huyết thanh ban đầu thường hỗn hợp, nhưng bệnh có xu hướng ứ mật. Trong một số trường hợp, vàng da sâu và kéo dài. Đặc điểm của quá mẫn (phát ban, sốt, tăng bạch cầu ái toan) và không có sự hình thành tự kháng thể. Mô học gan cho thấy ứ mật và tổn thương ống mật và giảm đáng kể trong ống mật (mất hoặc ít ống mật). Vàng da và ngứa có xu hướng kéo dài và một số bệnh nhân phát triển hội chứng ống mật biến mất, trong khi những bệnh nhân khác hồi phục về mặt lâm sàng nhưng có tình trạng tăng phosphatase kiềm trong huyết thanh kéo dài trong thời gian theo dõi và cho đến khi tử vong do khối u não. Thử thách lại đã không được thực hiện, nhưng một số bệnh nhân sau đó đã nhận được các thuốc chống ung thư khác, một số trong số đó là thuốc alkyl hóa mà không tái phát tổn thương gan. Vàng da và ngứa có xu hướng kéo dài và một số bệnh nhân phát triển hội chứng ống mật biến mất, trong khi những bệnh nhân khác hồi phục về mặt lâm sàng nhưng có tình trạng tăng phosphatase kiềm trong huyết thanh kéo dài trong thời gian theo dõi và cho đến khi tử vong do khối u não. Thử thách lại đã không được thực hiện, nhưng một số bệnh nhân sau đó đã nhận được các thuốc chống ung thư khác, một số trong số đó là thuốc alkyl hóa mà không tái phát tổn thương gan. Vàng da và ngứa có xu hướng kéo dài và một số bệnh nhân phát triển hội chứng ống mật biến mất, trong khi những bệnh nhân khác hồi phục về mặt lâm sàng nhưng có tình trạng tăng phosphatase kiềm trong huyết thanh kéo dài trong thời gian theo dõi và cho đến khi tử vong do khối u não. Thử thách lại đã không được thực hiện, nhưng một số bệnh nhân sau đó đã nhận được các thuốc chống ung thư khác, một số trong số đó là thuốc alkyl hóa mà không tái phát tổn thương gan.
Ngoài ra, temozolomide có liên quan đến một số trường hợp tái kích hoạt viêm gan B mãn tính ở những bệnh nhân có kháng nguyên bề mặt viêm gan B (HBsAg) dương tính khi bắt đầu hóa trị. Các triệu chứng và dấu hiệu lâm sàng của đợt bùng phát viêm gan B phát sinh từ 6 đến 12 tuần sau khi bắt đầu dùng temozolomide thường xuyên theo chu kỳ. Hầu hết bệnh nhân không được dùng corticosteroid hoặc các chất ức chế miễn dịch khác thường liên quan đến việc tái kích hoạt. Các giai đoạn được đánh dấu bằng sự gia tăng nồng độ HBV DNA và vàng da nhẹ và đáp ứng với liệu pháp kháng vi-rút nhanh chóng đối với bệnh viêm gan B, cho phép bắt đầu lại temozolomide trong một số trường hợp. Các trường hợp tái hoạt động gây tử vong chưa được báo cáo, nhưng nói chung viêm gan B tái hoạt động kèm theo vàng da có tỷ lệ tử vong trên 10%.
Tính an toàn
- Temozolomide thuốc không nên được sử dụng trong khi mang thai.
- Temozolomide có khả năng bài tiết vào sữa mẹ vì vậy tránh dùng Temozolomide cho phụ nữ cho con bú.
Tương tác với thuốc khác
- Axit valproic: làm chậm quá trình bài tiết temozolomide.
- Thuốc ức chế tủy khác khi dùng chung với Temozolomide có thể làm tăng nguy cơ ức chế tủy.
Lưu ý khi sử dụng
- Thường dùng Temozolomide theo chu kì 28 ngày.
- Trong quá trình dùng Temozolomide, bệnh nhân nên được kiểm tra máu thường xuyên và liều dùng Temozolomide cho bệnh nhân có thể thay đổi dựa trên kết quả xét nghiệm máu này.
- Tình trạng nhiễm độc gan nghiêm trọng và gây tử vong đã được báo cáo trong quá trình Temozolomide lưu hành. Bệnh nhân nên kiểm tra chức năng gan trong quá trình dùng Temozolomide và sau 2-4 tuần đầu sau khi ngừng Temozolomide.
- Tránh dùng Temozolomide cho bệnh nhân bị nhiễm trùng, bệnh nhân suy tủy nặng.
- Trong ít nhất 90 ngày kể từ ngày cuối cùng dùng Temozolomide, bệnh nhân là nam giới không nên hiến tặng tinh dịch.
- Trong mỗi chu kì dùng bệnh nhân nên theo dõi số lượng tiểu cầu và bạch cầu trung tính tuyệt đối.
- Dùng Temozolomide cho người cao tuổi làm tăng nguy cơ mắc bệnh suy tủy.
- Theo dõi quá trình dùng Temozolomide ở bệnh nhân đặc biệt bệnh nhân đang dùng steroid.
- Khi dùng Temozolomide cho phụ nữ phải chắc chắn bệnh nhân không mang thai và ít nhất trong vòng 6 tháng từ ngày dùng liều Temozolomide cuối cùng không nên mang thai
- Nếu bệnh nhân là đàn ông cần sử dụng biện pháp tránh thai trong ít nhất 3 tháng kể từ liều cuối dùng Temozolomide.
Một vài nghiên cứu của trong Y học
Temozolomide kết hợp với chiếu xạ khi điều trị sau phẫu thuật đa dạng u nguyên bào thần kinh đệm nguyên phát. Nghiên cứu giai đoạn I/II

Bối cảnh và mục đích: Vai trò của xạ trị trong điều trị u nguyên bào thần kinh đệm đa dạng nguyên phát vẫn còn đang được thảo luận gây tranh cãi. Để đánh giá tính khả thi và độc tính của việc chiếu xạ và sử dụng đồng thời 50 mg/m temozolomide ở những bệnh nhân mắc u thần kinh đệm ác tính nguyên phát, nghiên cứu pha I/II này đã được tiến hành.
Phương pháp: 53 Bệnh nhân mắc u thần kinh đệm ác tính độ IV đã được xác nhận về mặt mô học của WHO đã được đưa vào nghiên cứu. Tất cả các bệnh nhân được điều trị bằng xạ trị với tổng liều 60 Gy bằng cách sử dụng phân đoạn thông thường là 5 x 2,0 Gy/tuần. Temozolomide được dùng bằng đường uống mỗi ngày trị liệu với liều 50 mg/m2.
Kết quả: Trước khi xạ trị, cắt bỏ hoàn toàn (n = 14), cắt bỏ toàn bộ (n = 22) hoặc sinh thiết (n = 17) của khối u đã được thực hiện. Khoảng thời gian trung bình giữa phẫu thuật và xạ trị là 21 ngày. Độc tính liên quan đến điều trị là rất nhẹ. Độc tính cấp tính độ 2 đã được quan sát thấy ở một bệnh nhân bị nhiễm độc máu độ 4. Tác dụng phụ nhỏ của hóa trị bao gồm buồn nôn và nôn. Không có hiệu ứng muộn nghiêm trọng được quan sát. Thời gian sống trung bình không tiến triển và thời gian sống toàn bộ lần lượt là 8 và 19 tháng. Tỷ lệ sống sót chung là 72% sau 1 năm và 26% sau 2 năm. Tuổi và mức độ phẫu thuật ảnh hưởng đáng kể đến sự sống còn.
Kết luận: Phối hợp temozolomide với xạ trị là khả thi và an toàn về mặt độc tính. Thời gian sống sót tổng thể tương đối dài so với thời gian sống sót được báo cáo đối với xạ trị đơn thuần. Việc áp dụng 50 mg/m temozolomide có thể được thực hiện trong suốt thời gian điều trị mà không bị gián đoạn do tác dụng phụ và có thể góp phần lớn vào việc kéo dài thời gian sống thêm. Đánh giá thêm được đảm bảo về liều lượng temozolomide là tối ưu liên quan đến phản ứng và độc tính của khối u.
Tài liệu tham khảo
- Thư viện y học quốc gia, Temozolomide , pubchem. Truy cập ngày 05/08/2023.
- Lutz Edler, Michael M Wannenmacher, Jürgen Debus (2005), Temozolomide combined with irradiation as postoperative treatment of primary glioblastoma multiforme. Phase I/II study,pubmed.com. Truy cập ngày 05/08/2023.
