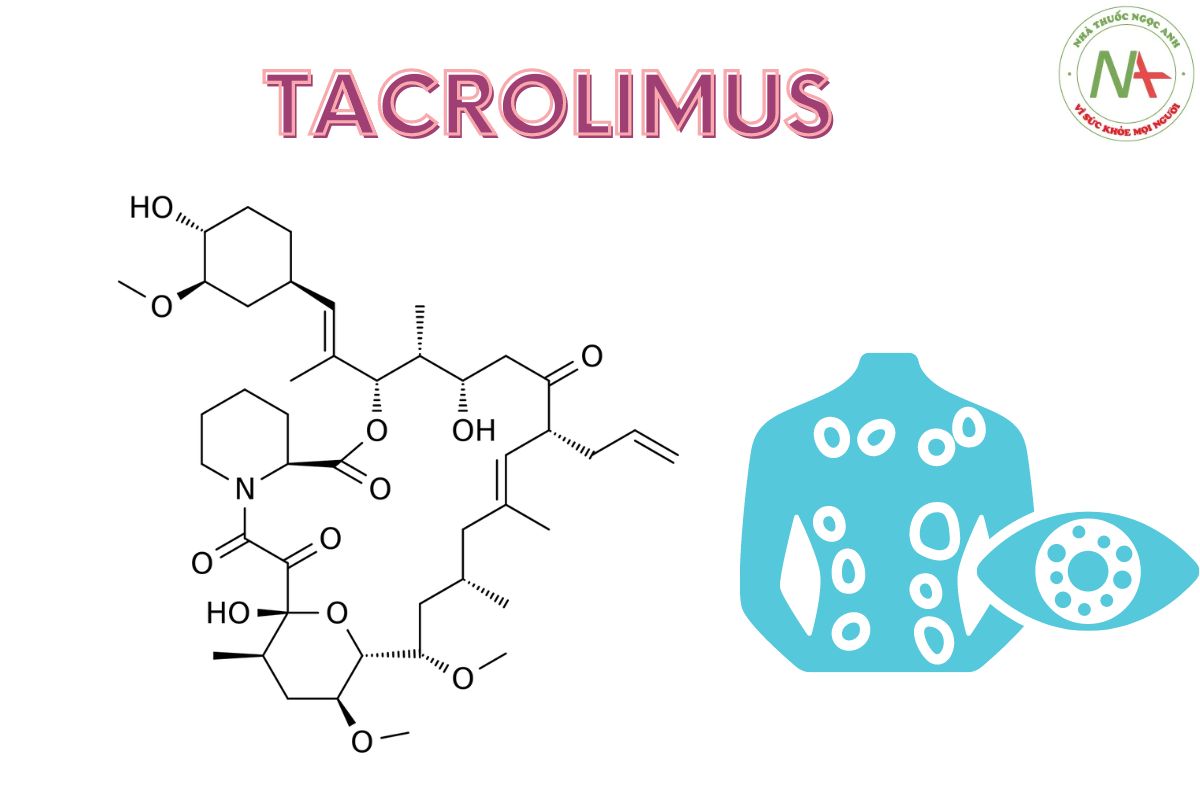
Tacrolimus
Danh pháp
Tên chung quốc tế
Tên danh pháp theo IUPAC
(1R,9S,12S,13R,14S,17R,18E,21S,23S,24R,25S,27R)-1,14-dihydroxy-12-[(E)-1-[(1R,3R,4R)-4-hydroxy-3-methoxycyclohexyl]prop-1-en-2-yl]-23,25-dimethoxy-13,19,21,27-tetramethyl-17-prop-2-enyl-11,28-dioxa-4-azatricyclo[22.3.1.04,9]octacos-18-ene-2,3,10,16-tetrone
Nhóm thuốc
Tacrolimus thuộc nhóm nào? Thuốc ức chế miễn dịch
Mã ATC
D – Da liễu
D11 – Các chế phẩm dành cho da khác
D11A – Các chế phẩm dành cho da khác
D11AH – Thuốc trị viêm da, không bao gồm corticosteroid
D11AH01 – Tacrolimus
L – Chất kháng nhựa và điều chỉnh miễn dịch
L04 – Thuốc ức chế miễn dịch
L04A – Thuốc ức chế miễn dịch
L04AD – Chất ức chế calcineurin
L04AD02 – Tacrolimus
Phân loại nguy cơ cho phụ nữ có thai
C
Mã UNII
Y5L2157C4J
Mã CAS
104987-11-3
Cấu trúc phân tử
Công thức phân tử
C44H69NO12
Phân tử lượng
804.0 g/mol
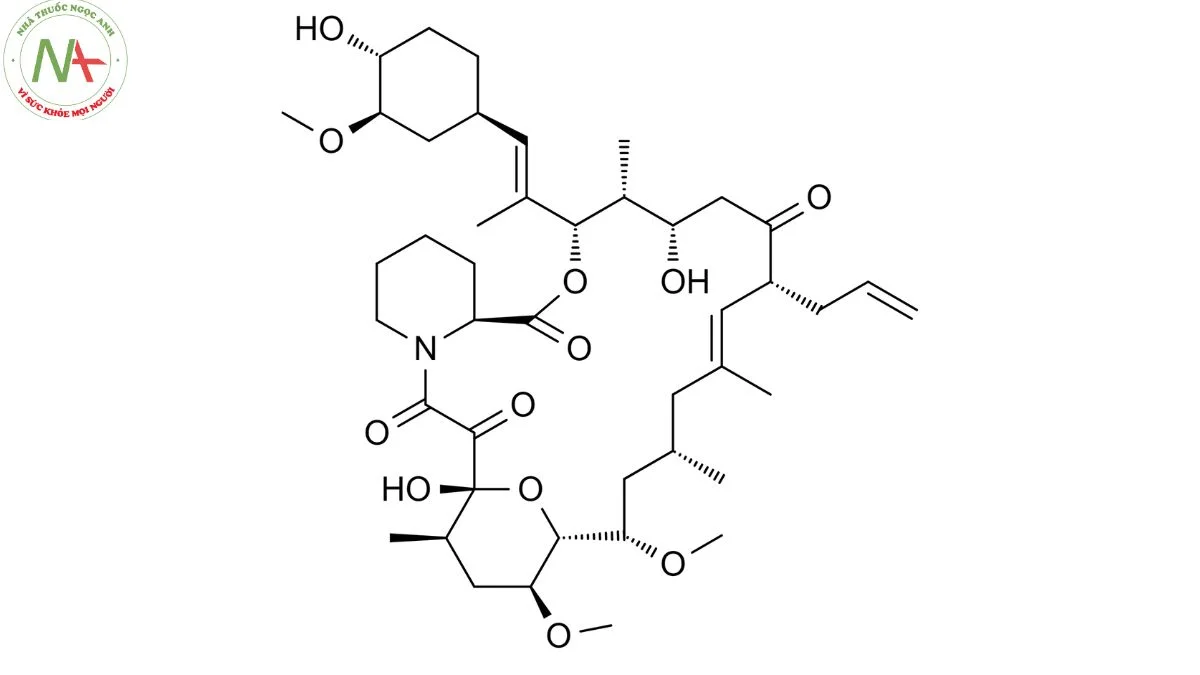
Cấu trúc phân tử
Tacrolimus là một macrolide lactam chứa vòng lacton gồm 23 cạnh.
Các tính chất phân tử
Số liên kết hydro cho: 3
Số liên kết hydro nhận: 12
Số liên kết có thể xoay: 7
Diện tích bề mặt tôpô: 178Ų
Số lượng nguyên tử nặng: 57
Các tính chất đặc trưng
Điểm nóng chảy: 126°C
Điểm sôi: 871.7±75.0 °C ở 760 mmHg
Tỷ trọng riêng: 1.2±0.1 g/cm3
Độ tan trong nước: 0.00402 mg/mL
Hằng số phân ly pKa: -2.9
Chu kì bán hủy: 21 – 61 giờ
Khả năng liên kết với Protein huyết tương: 99%
Dạng bào chế
Viên nang: 0,25 mg; 0,5 mg; 1 mg; 2 mg; 5 mg.
Thuốc tiêm: 5 mg/5 ml.
Thuốc mỡ: tacrolimus 0,03%; tacrolimus 0,1%.
Độ ổn định và điều kiện bảo quản
Viên nang, thuốc mỡ: Bảo quản ở nhiệt độ từ 15 – 25 °C, nơi khô. Dung dịch tiêm tacrolimus trước khi pha loãng phải bảo quản ở nhiệt độ từ 5 – 25 °C.
Không được sử dụng chai, túi chất dẻo polyvinyl clorid (PVC) để đựng dịch truyền tacrolimus vì độ ổn định của dung dịch bị suy giảm do chất HCO-60 (polyoxyl 60 hydrogenat của dầu thầu dầu) chứa trong công thức thuốc tiêm có thể chiết các hợp chất phthalat từ chai PVC vào dịch truyền.
Tacrolimus không ổn định trong môi trường kiềm, không được trộn dung dịch tiêm truyền tacrolimus với các dung dịch khác có pH ≥ 9 (ví dụ ganciclovir hoặc acyclovir).
Nguồn gốc
Tacrolimus, một macrolide ức chế miễn dịch độc đáo, được phát hiện vào năm 1987. Điều thú vị là trước đó, vào năm 1975, một chất khác mang tên rapamycin (sirolimus) đã được khám phá trên Đảo Phục Sinh. Khám phá về Tacrolimus đến từ sự tồn tại của vi khuẩn đất – Streptomyces tsukubensis. Tên gọi của nó xuất phát từ “thuốc macrolide ức chế miễn dịch từ Tsukuba”.
Giai đoạn phát triển sơ khởi của Tacrolimus, từng được biết đến với tên mã FK-506, đã kéo dài qua vài năm tiếp theo. Thomas Starzl đã mô tả chi tiết về quá trình này trong hồi ký của ông vào năm 1992.
Năm 1994, Tacrolimus được FDA (Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ) chính thức chấp nhận cho việc ghép gan và sau đó mở rộng việc sử dụng cho ghép thận. Đến năm 2017, phiên bản generic của Tacrolimus đã được thông qua tại Mỹ.
Châu Âu cũng không kém phần nhận diện giá trị của Tacrolimus. Liên minh Châu Âu đã chấp thuận nó vào năm 2002 cho việc điều trị viêm da dị ứng từ trung bình đến nặng. Vào năm 2007 và 2009, chỉ định sử dụng đã được mở rộng, bao gồm cả việc dự phòng và điều trị sự tự đào thải sau khi ghép cấy ở cả người lớn và trẻ em.
Dược lý và cơ chế hoạt động
Tacrolimus, một macrolid chiết xuất từ vi khuẩn Streptomyces tsukubaensis, là một phân tử mạnh mẽ ức chế miễn dịch. Dù có nhiều điểm tương đồng với cyclosporin về hiệu quả, cấu trúc của chúng lại hoàn toàn khác biệt. Điểm đáng chú ý là Tacrolimus còn có hoạt tính kháng khuẩn, tuy nhiên, khả năng này của nó chỉ được ghi nhận ở mức độ rất hạn chế.
Về cơ chế hoạt động, Tacrolimus chủ yếu can thiệp vào quá trình hoạt động của tế bào lympho T bằng cách ức chế sự sản xuất interleukin-2. So với cyclosporin, hiệu quả ức chế miễn dịch của nó cao hơn đến 100 lần. Được biết, Tacrolimus kết hợp với protein nội bào FKBP-12, tạo nên một phức hợp với ion calci, calmodulin và calcineurin, ức chế hoạt tính của calcineurin và ngăn chặn quá trình kích hoạt các yếu tố nhân tế bào liên quan đến việc sản xuất lymphokin. Ngoài ra, Tacrolimus còn làm giảm biểu hiện của các thụ thể có khả năng kết nối cao với IgE trên tế bào Langerhans.
Dù không gây tổn hại cho gen và không tương tác với DNA, Tacrolimus có thể ảnh hưởng đến hệ miễn dịch tại các vị trí cụ thể. Thuốc này thường được sử dụng để phòng ngừa việc tự đào thải sau ghép cấy thận, tim, và gan. Để tăng hiệu quả, Tacrolimus thường được kết hợp với corticosteroid.
Đáng chú ý, Tacrolimus cũng hiệu quả trong việc điều trị bệnh Crohn có triệu chứng lỗ dò và được sử dụng tại chỗ để chữa trị viêm da dị ứng.
Ứng dụng trong y học
Ngăn chặn thải trừ sau ghép cấy: Tacrolimus được sử dụng chủ yếu để ngăn chặn sự đào thải của cơ thể sau khi ghép cấy các bộ phận như gan, thận, hoặc tim. Khi kết hợp với các loại thuốc khác, nó giúp giảm nguy cơ cơ thể tấn công và hủy hoại bộ phận ghép.
Điều trị bệnh da: Tacrolimus dưới dạng kem hoặc mỡ được sử dụng để điều trị viêm da tiết bã nhờn mạn tính (eczema), đặc biệt là trong những trường hợp không phản ứng tốt với các steroid da khác hoặc khi việc sử dụng steroid dài hạn không được khuyến nghị.
Điều trị một số bệnh miễn dịch: Vì tác dụng ức chế hệ thống miễn dịch, Tacrolimus cũng có thể được xem xét để điều trị một số bệnh lý tự miễn khác.
Điều trị bệnh mắt: Tacrolimus cũng được sử dụng trong điều trị dạng nặng của bệnh mắt khô.
Dược động học
Hấp thu
Khi uống, thuốc không được hấp thu một cách hoàn chỉnh và tốc độ hấp thu biến đổi. Việc ăn thức ăn trong khoảng 15 phút sau khi dùng thuốc có thể làm giảm hiệu quả hấp thu lên đến 27%, đặc biệt sau bữa ăn giàu chất béo. Sinh khả dụng sau khi uống cho người lớn khoảng từ 7-28% và cho trẻ em là 10-52%. Thời gian đạt nồng độ cao nhất trong máu nằm trong khoảng từ 0,5 đến 4 giờ.
Khi sử dụng dạng bôi ngoài, nồng độ thuốc trong máu thường rất thấp, thậm chí ở mức không đo được. Tuy nhiên, ở trẻ nhỏ, việc sử dụng một lần duy nhất của kem chứa 0,1% thuốc có thể làm tăng nồng độ thuốc trong máu.
Phân bố
Sau khi tiêm trực tiếp vào tĩnh mạch, Tacrolimus được phân bố rộng rãi trong cơ thể. Thuốc có khả năng kết dính mạnh với hồng cầu, giải thích sự khác biệt trong việc phân bố giữa máu toàn phần và huyết tương. Đến 99% của Tacrolimus trong huyết tương kết hợp với protein, chủ yếu là với albumin và alpha-1-glycoprotein acid.
Chuyển hóa
Tacrolimus chịu sự chuyển hóa mạnh mẽ trong gan và hệ tiêu hóa, chủ yếu thông qua hệ enzym cytochrom P-450 (CYP3A4), tạo ra 8 hợp chất chuyển hóa. Trong số đó, 31-demethyl tacrolimus là chất chuyển hóa chính và có hoạt tính tương tự như Tacrolimus khi thử nghiệm in vitro.
Thải trừ
Sau khi tiêm vào tĩnh mạch, tốc độ thanh trừ của thuốc khác nhau tùy theo đối tượng, từ người khỏe mạnh đến người đã ghép thận hoặc ghép gan. Chỉ có dưới 1% liều thuốc được bài tiết qua nước tiểu mà không thay đổi. Đa số thuốc được thải trừ qua mật theo dạng chất đã hydroxy hóa. Thời gian bán hủy của thuốc trong người khỏe mạnh rơi vào khoảng 21-61 giờ.
Độc tính ở người
Dựa trên dữ liệu từ 16 trường hợp sử dụng liều lượng tacrolimus vượt quá 30 lần so với liều khuyến nghị, quá liều cấp tính của thuốc thường chỉ gây ra các triệu chứng độc hại ở mức độ trung bình hoặc không gây ra triệu chứng gì cả.
Cụ thể, 7 trong số 16 bệnh nhân không có bất kỳ biểu hiện không mong muốn nào. Tuy nhiên, 8 bệnh nhân khác đã trải qua một số triệu chứng như tăng nồng độ creatinin trong máu, tăng hoạt động của enzyme transaminase, cảm giác buồn nôn và run nhẹ.
Đối với những người này, họ đã được tiếp tục điều trị thông qua việc làm sạch dạ dày và các biện pháp hỗ trợ khác. Trong số họ, một bệnh nhân sau khi sử dụng quá liều đã xuất hiện triệu chứng suy thận, nhiễm nấm Histoplasma và nhiễm trùng. Hai bệnh nhân khác, mắc phải suy thận và suy gan cấp tính kèm theo nồng độ tacrolimus cao trong máu, đã được áp dụng phương pháp lọc máu liên tục để nhanh chóng loại bỏ thuốc.
Một trường hợp đáng chú ý khác là một trẻ 22 tháng tuổi, người đã không may sử dụng liều thuốc cao gấp 25 lần so với liều khuyến nghị, chỉ biểu hiện triệu chứng nhẹ như tăng nồng độ amylase trong huyết thanh, nhưng sau đó đã nhanh chóng phục hồi.
Tính an toàn
Tacrolimus có khả năng vượt qua nhau thai, với nồng độ trong nhau thai có thể cao gấp 4 lần so với huyết tương. Đã có các trường hợp ghi nhận về tình trạng kali huyết cao và suy thận ở trẻ sơ sinh do tác động của thuốc. Bác sĩ cần phải thận trọng khi lựa chọn việc kê đơn tacrolimus.
Ngoài ra, tacrolimus có thể xâm nhập vào sữa mẹ. Do đó, việc sử dụng thuốc này đối với phụ nữ đang cho con bú không được khuyến nghị.
Tương tác với thuốc khác
Tacrolimus chủ yếu chuyển hóa qua isoenzym CYP3A4 của cytochrom P450. Khi kết hợp với những thuốc khác, việc theo dõi và điều chỉnh nồng độ tacrolimus trong máu là cực kỳ quan trọng.
Các loại thuốc có khả năng ảnh hưởng đến nồng độ của tacrolimus:
- Tăng nồng độ: Nhôm hydroxyd-magnesihydroxyd, bromocriptin, clarithromycin, fluconazol, voriconazol, erythromycin, ketoconazol, và nhiều loại thuốc khác, bao gồm các chất ức chế enzym protease của HIV.
- Giảm nồng độ: Phenobarbital, carbamazepin, phenytoin, rifampin, và cây Nữ lang (Hypericum perforatum).
Thuốc kháng retrovirus: Cần cẩn thận khi kết hợp với các thuốc như nelfinavir và ritonavir, do chúng chuyển hóa bởi CYP3A.
Thuốc chuyển hóa bởi gan: Ví dụ như phenytoin, khi kết hợp có thể tăng nồng độ phenytoin trong máu.
Thuốc ức chế miễn dịch: Hãy thận trọng với liệu pháp ức chế miễn dịch tổng hợp. Đặc biệt, không nên kết hợp tacrolimus với sirolimus.
Thuốc có độc tính với thận: Cần thận trọng khi kết hợp với những loại thuốc như amphotericin B và cyclosporin.
Vắc xin: Người dùng tacrolimus có thể phản ứng kém khi tiêm chủng. Hãy tránh các vắc xin sống như BCG và vắc xin polio uống.
Ibuprofen: Đã ghi nhận trường hợp suy thận khi kết hợp với tacrolimus.
Metronidazol: Có thể làm tăng gấp đôi nồng độ của tacrolimus và cyclosporin, làm tăng nồng độ creatinin trong máu.
Lưu ý khi sử dụng Tacrolimus
Tacrolimus nên được dùng dưới sự chỉ định và giám sát của bác sĩ chuyên khoa trong lĩnh vực ức chế miễn dịch và ghép cơ quan. Những bệnh viện hoặc phòng khám cung cấp thuốc này nên có đầy đủ trang thiết bị để kiểm tra và hỗ trợ điều trị. Người bệnh cần thường xuyên thực hiện các xét nghiệm liên quan đến chức năng thận và gan.
Tacrolimus có khả năng ức chế miễn dịch, tăng rủi ro nhiễm khuẩn, phát triển bệnh lymphoma và các khối u khác. Khi sử dụng các thuốc khác có tác dụng tương tự, cần phải cực kỳ thận trọng.
Tacrolimus tăng nguy cơ bị nhiễm bệnh do virus BK và các khuẩn cơ hội khác. Người bệnh cần được giám sát chặt chẽ để phát hiện và can thiệp kịp thời.
Tacrolimus có thể ảnh hưởng đến chức năng thận nên người sử dụng cần kiểm tra thường xuyên và điều chỉnh liều dùng thuốc nếu cần.
Khi kết hợp Tacrolimus với một số thuốc khác, cần thận trọng để tránh tác dụng phụ nghiêm trọng, như việc kết hợp với các thuốc có thể gây hại cho thận.
Người có nguy cơ hoặc biểu hiện của các bệnh tim cần được giám sát bằng siêu âm và điều chỉnh liều dùng nếu cần.
Những người đã ghép gan và sử dụng Tacrolimus cần được theo dõi chặt chẽ và có thể cần điều chỉnh liều dùng thuốc.
Tacrolimus có hạn chế khi sử dụng cho trẻ em và người cao tuổi, cũng như khi sử dụng cho một số bệnh lý da cụ thể.
Tránh để thuốc mỡ Tacrolimus tiếp xúc với mắt và các niêm mạc khác. Nếu xảy ra, cần rửa sạch ngay lập tức. Không nên sử dụng cho những bệnh nhân có tổn thương ở da, vì có thể tăng sự hấp thu thuốc vào cơ thể.
Một vài nghiên cứu của Tacrolimus trong Y học
Sử dụng tacrolimus trong viêm thận lupus: Đánh giá hệ thống và phân tích tổng hợp
Ngày càng có nhiều mối quan tâm về vai trò của tacrolimus như một tác nhân điều trị tiềm năng trong bệnh SLE. Tổng quan hệ thống và phân tích tổng hợp này đánh giá bằng chứng về việc sử dụng tacrolimus trong điều trị viêm thận lupus.
Mười ba nghiên cứu có đối chứng đã được xác định (9 nghiên cứu phù hợp để đưa vào), sử dụng cơ sở dữ liệu Cochrane, SCOPUS, Web of Science và OVID (MEDLINE và EMBASE). Dữ liệu về tỷ lệ thuyên giảm hoàn toàn và một phần, giảm protein niệu và các tác dụng phụ được trích xuất và phân tích bằng phần mềm RevMan.
Phân tích tổng hợp cho thấy tacrolimus tổng thể có hiệu quả hơn trong việc làm thuyên giảm hoàn toàn ở thận so với IVCYC (p=0,004), nhưng không có sự khác biệt đáng kể so với MMF (p=0,87). Liệu pháp TAC+MMF đa mục tiêu chỉ hiệu quả hơn IVCYC khi bao gồm sự thuyên giảm một phần (p=0,0006).
Tần suất của các tác dụng phụ chính dường như có thể so sánh với các thuốc khác được sử dụng trong điều trị viêm thận lupus với ít tác dụng phụ về đường tiêu hóa hơn, giảm bạch cầu, rối loạn kinh nguyệt, nhiễm trùng và các đợt rối loạn chức năng gan được báo cáo, nhưng có nhiều trường hợp khởi phát mới về tăng huyết áp và tăng đường huyết.
Tỷ lệ tử vong thấp hơn ở nhóm tacrolimus, nhưng điều này không có ý nghĩa thống kê (p=0,15). Tacrolimus có thể hiệu quả hơn trong việc giảm protein niệu, nhưng một lần nữa điều này không có ý nghĩa thống kê.
Không có thử nghiệm có kiểm soát nào về việc sử dụng ở bệnh nhân mang thai hoặc trẻ vị thành niên, tuy nhiên các báo cáo trường hợp cho thấy hiệu quả và độ an toàn tiềm năng.
Tóm lại, trong bệnh viêm thận lupus nặng ở mức độ vừa phải, có một số bằng chứng ủng hộ hiệu quả của tacrolimus hoặc TAC+MMF đa mục tiêu so với IVCYC, nhưng không có bằng chứng nào ủng hộ hiệu quả của tacrolimus so với MMF. Tacrolimus có thể hiệu quả hơn trong việc giảm protein niệu, có tác động tiềm tàng đến kết quả lâu dài.
Hạn chế chính của nghiên cứu này là thiếu dữ liệu về kết quả lâu dài và thiếu các thử nghiệm mù có đối chứng, quy mô lớn, chất lượng cao ở các nhóm đa sắc tộc.
Tài liệu tham khảo
- Drugbank, Tacrolimus, truy cập ngày 26 tháng 9 năm 2023.
- Hannah, J., Casian, A., & D’Cruz, D. (2016). Tacrolimus use in lupus nephritis: A systematic review and meta-analysis. Autoimmunity reviews, 15(1), 93–101. https://doi.org/10.1016/j.autrev.2015.09.006
- Pubchem, Tacrolimus, truy cập ngày 26 tháng 9 năm 2023.
- Bộ Y Tế (2012), Dược thư quốc gia Việt Nam, Nhà xuất bản Y học, Hà Nội
Xuất xứ: Việt Nam
Ức chế miễn dịch
Xuất xứ: Việt Nam
Xuất xứ: Nhật Bản
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Ấn Độ
Xuất xứ: Ireland
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Ấn Độ
Xuất xứ: Ấn Độ
Xuất xứ: Ấn Độ
Xuất xứ: Ấn Độ
Xuất xứ: Ireland
Xuất xứ: Ireland
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Ireland
Xuất xứ: Ấn Độ
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam