Everolimus
Danh pháp
Tên chung quốc tế
Tên danh pháp theo IUPAC
(1R,9S,12S,15R,16E,18R,19R,21R,23S,24E,26E,28E,30S,32S,35R)-1,18-dihydroxy-12-[(2R)-1-[(1S,3R,4R)-4-(2-hydroxyethoxy)-3-methoxycyclohexyl]propan-2-yl]-19,30-dimethoxy-15,17,21,23,29,35-hexamethyl-11,36-dioxa-4-azatricyclo[30.3.1.04,9]hexatriaconta-16,24,26,28-tetraene-2,3,10,14,20-pentone
Nhóm thuốc
Thuốc ức chế miễn dịch chọn lọc
Mã ATC
L – Chất chống ung thư và điều hòa miễn dịch
L01 – Thuốc chống ung thư
L01E – Chất ức chế protein kinase
L01EG – Mục tiêu của chất ức chế rapamycin kinase ở động vật có vú
L01EG02 – Everolimus
L – Chất chống ung thư và điều hòa miễn dịch
L04 – Thuốc ức chế miễn dịch
L04A – Thuốc ức chế miễn dịch
L04AA – Thuốc ức chế miễn dịch chọn lọc
L04AA18 – Everolimus
Mã UNII
9HW64Q8G6G
Mã CAS
159351-69-6
Xếp hạng phân loại cho phụ nữ có thai
AU TGA: C
US FDA: NA
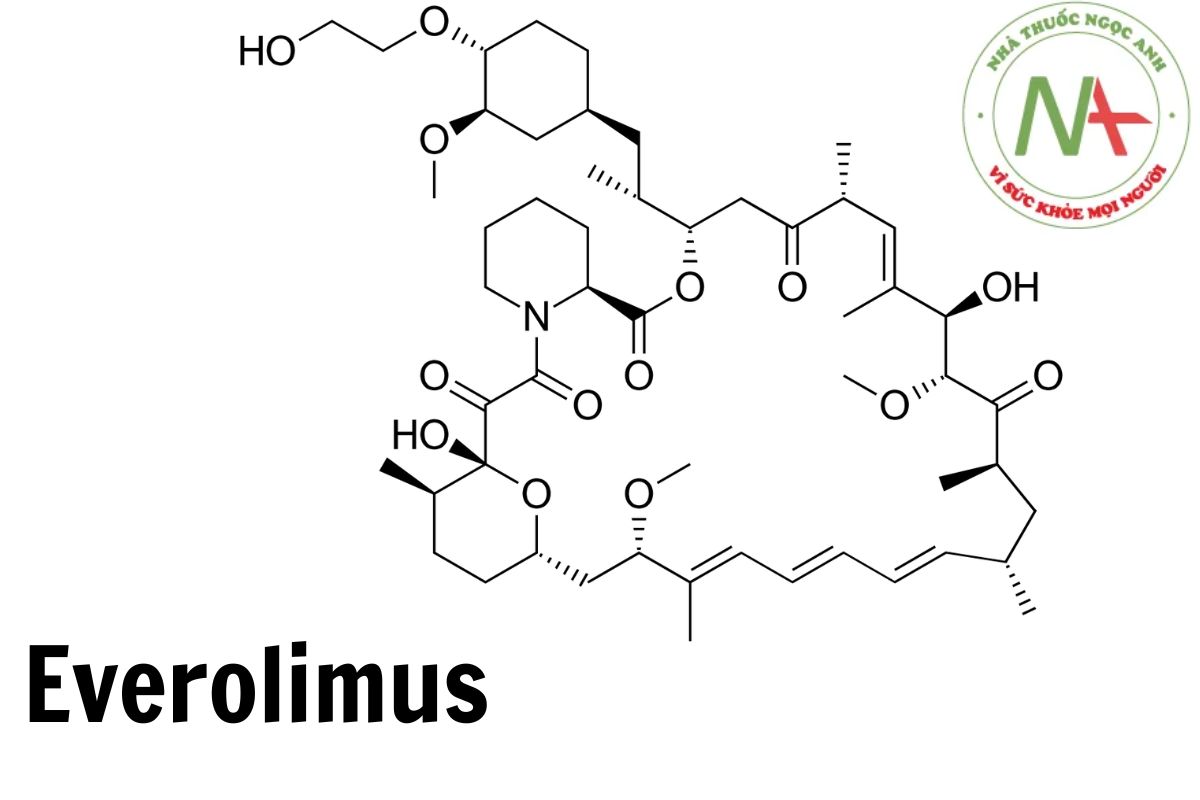
Cấu trúc phân tử
Công thức phân tử
C53H83NO14
Phân tử lượng
958,2 g/mol
Cấu trúc phân tử
Everolimus là một loại lactone đa vòng có tên là rapamycin trong đó nhóm hydroxy gắn với nửa cyclohexyl đã được chuyển đổi thành 2-hydroxyethyl ether tương ứng.
Các tính chất phân tử
Số liên kết hydro cho: 3
Số liên kết hydro nhận: 14
Số liên kết có thể xoay: 9
Diện tích bề mặt tôpô: 205 Ų
Số lượng nguyên tử nặng: 68
Các tính chất đặc trưng
Không có dữ liệu
Cảm quan
Everolimus thường tồn tại ở dạng bột tinh thể màu trắng hoặc vàng nhạt. Everolimus ít tan trong nước.
Everolimus có tính tan trong nhiều dung môi hữu cơ như ethanol, acetonitrile, và dimethyl sulfoxide (DMSO).
Dạng bào chế
Viên nén Everolimus 0.25mg, 0.5mg, 0.75mg hoặc 1.0mg.
Độ ổn định và điều kiện bảo quản của Everolimus
Everolimus có độ ổn định tương đối tốt khi được lưu trữ ở điều kiện thích hợp. Tuy nhiên, như hầu hết các loại thuốc, Everolimus có thể bị ảnh hưởng bởi ánh sáng, nhiệt độ cao, độ ẩm và tương tác với các chất khác.
Everolimus nên được bảo quản ở nhiệt độ từ 20-25°C (68-77°F). Tránh lưu trữ ở nhiệt độ cao hơn hoặc dưới nhiệt độ này, vì điều này có thể làm thay đổi tính chất của thuốc.
Everolimus nên được bảo quản trong bao bì ban đầu để bảo vệ khỏi ánh sáng trực tiếp. Điều này giúp ngăn chặn sự phân huỷ hoặc biến đổi do tác động của ánh sáng.
Tránh tiếp xúc với độ ẩm cao hoặc nơi có độ ẩm biến đổi lớn, vì nó có thể ảnh hưởng đến độ ổn định của thuốc.
Nguồn gốc
Everolimus được tạo ra từ một hợp chất tự nhiên là rapamycin (hay sirolimus). Rapamycin là một loại kháng sinh được phát hiện lần đầu vào những năm 1970 ở đảo Rapa Nui (còn được gọi là đảo Easter), một hòn đảo thuộc châu Đại Tây Dương.
Ban đầu Rapamycin được sử dụng trong lĩnh vực y học với vai trò là kháng sinh và được nghiên cứu cho các ứng dụng trong việc kiểm soát sự phát triển của tế bào.
Trong những năm thập niên 90, rapamycin đã thu hút sự chú ý của các nhà nghiên cứu và công ty dược phẩm do khả năng trong việc ức chế sự phân chia và tăng trưởng của tế bào. Điều này đã dẫn đến sự phát triển của everolimus như một dẫn xuất tổng hợp của rapamycin.
Dược lý và cơ chế hoạt động
Everolimus, chất ức chế dẫn truyền tín hiệu nhằm đến mTOR, ngăn chặn sự thải ghép bằng cách ức chế miễn dịch thông qua việc ức chế sự tăng trưởng của các tế bào T – được kích hoạt bởi kháng nguyên, từ đó ngăn chặn việc mở rộng các clon tế bào.
Tác động này được điều chỉnh bởi các interleukin đặc hiệu đối với tế bào T, như interleukin-2 và interleukin-15. Everolimus ức chế con đường truyền tín hiệu nội bào thường dẫn đến tăng trưởng tế bào khi được kích hoạt thông qua sự gắn kết của các yếu tố tăng trưởng của các tế bào T vào các thụ thể.
Sự ngăn chặn con đường này do everolimus làm cho tế bào dừng lại ở giai đoạn G của chu kỳ tế bào.
Ở mức phân tử, everolimus tạo thành một phức hợp với protein FKBP-12 trong bào tương. Khi everolimus hiện diện, sự phosphoryl hóa của p70 S6 kinase, một enzyme được kích thích bởi yếu tố tăng trưởng, bị ức chế.
Do FRAP (còn được gọi là m-TOR) kiểm soát sự phosphoryl hóa của p70 S6 kinase, sự hình thành phức hợp everolimus-FKBP-12 ngăn chặn sự hoạt động của FRAP. FRAP là một protein quan trọng điều hòa sự tăng trưởng, chuyển hóa, và tăng sinh tế bào, do đó, sự mất chức năng của FRAP giải thích tại sao everolimus dẫn đến dừng chu kỳ tế bào.
Ứng dụng trong y học của Everolimus
Điều trị ung thư
Everolimus được sử dụng trong điều trị một số loại ung thư, bao gồm ung thư thận, ung thư vùng đầu cổ tử cung, ung thư vùng ngực, và ung thư đại trực tràng. Nó hoạt động bằng cách ngăn chặn sự phát triển của các tế bào ung thư và ức chế mạch máu cung cấp cho khối u.
Phòng ngừa sự tràn dịch cơ tim
Everolimus được sử dụng trong điều trị và phòng ngừa sự tràn dịch cơ tim sau ca ghép tim hoặc ghép thận. Nó giúp kiểm soát hệ thống miễn dịch và ngăn chặn sự phát triển màng niêm mạc trong mạch máu và mô tế bào.
Hạn chế sự phát triển của các khối u non
Everolimus được sử dụng để điều trị các khối u non ác tính như khối u tinh thể nang hoặc khối u tuyến tình thể nang (subependymal giant cell astrocytoma) ở bệnh nhân mắc bệnh tự kỷ phức tạp (tuberous sclerosis complex).
Điều trị hen suyễn
Everolimus có thể được sử dụng trong điều trị hen suyễn ở những trường hợp khó điều trị khác hoặc khi không đáp ứng với các phương pháp điều trị thông thường.
Sử dụng trong miễn dịch học
Everolimus có ứng dụng trong lĩnh vực miễn dịch học để kiểm soát phản ứng miễn dịch sau ca ghép tế bào gốc tủy xương hoặc ghép cơ quan.
Nghiên cứu lâm sàng
Ngoài các ứng dụng trên, everolimus còn đang được nghiên cứu để đánh giá khả năng điều trị cho nhiều bệnh lý khác, bao gồm viêm gan siêu vi C (HCV), lupus tự miễn dịch, và nhiều bệnh lý khác liên quan đến sự phát triển tế bào và miễn dịch.
Dược động học
Hấp thu
Ở bệnh nhân mắc bệnh ung thư tiến triển, everolimus đạt đỉnh nồng độ (C max) vào khoảng 1 giờ sau khi sử dụng hàng ngày 5 và 10 mg everolimus.
Nồng độ C max tăng tỷ lệ với liều lượng từ 5 đến 10 mg. Everolimus đồng thời là chất nền và chất ức chế đồng thời của Pgp.
Phân bố
Tỷ lệ everolimus giữa huyết tương và máu phụ thuộc vào nồng độ trong khoảng từ 5 đến 5.000 ng/ml và dao động từ 17% đến 73%.
Khoảng 20% nồng độ everolimus trong máu toàn bộ bị hạn chế trong huyết tương ở bệnh nhân ung thư dùng everolimus 10mg/ngày.
Sự kết hợp với protein huyết tương là khoảng 74% ở cả người khỏe và bệnh nhân suy gan trung bình.
Tại bệnh nhân có bệnh ung thư tiến triển, khả năng phân bố (Vd) là 191 lít cho ngăn trung tâm rõ ràng và 517 lít cho ngăn ngoại vi rõ ràng.
Chuyển hóa
Everolimus là chất chất nền của CYP3A4 và Pgp. Sau khi uống, everolimus xuất hiện trong máu.
Có sáu chất chuyển hóa chính của everolimus được tìm thấy trong máu, bao gồm ba chất chuyển hóa monohydroxyl, hai sản phẩm thủy phân mở vòng và một chất liên hợp phosphatidylcholine của everolimus.
Các chất chuyển hóa này cũng đã được xác định ở các loài động vật tham gia vào các nghiên cứu độc tính và có hoạt tính dược lý ít hơn khoảng 100 lần so với everolimus.
Do đó, everolimus được xem là thành phần chính liên quan đến hoạt động dược lý tổng thể.
Thải trừ
Thời gian bán thải của everolimus là vào khoảng 30 giờ.
Phương pháp sản xuất
Không có dữ liệu
Độc tính của Everolimus
Tác động phụ thường gặp
Các tác động phụ thường gặp khi sử dụng everolimus bao gồm mệt mỏi, buồn nôn, nôn mửa, tiêu chảy, tăng mỡ máu, sưng nề ở các vùng bàn tay và bàn chân (còn được gọi là hội chứng chân tay), và tăng nguy cơ nhiễm trùng.
Tác động phụ nghiêm trọng
Everolimus cũng có thể gây ra một số tác động phụ nghiêm trọng, bao gồm sự suy giảm chức năng thận, tăng huyết áp, tăng nguy cơ nhiễm trùng nghiêm trọng, và tác động đến hệ tiêu hóa.
Một tác dụng phụ nghiêm trọng của các dẫn xuất rapamycin, bao gồm everolimus, là viêm phổi không nhiễm trùng. Tình trạng viêm phổi không liên quan đến nhiễm trùng (bao gồm cả bệnh phổi kẽ) đã được báo cáo thường xuyên ở những bệnh nhân sử dụng các loại thuốc này.
Tác động đến hệ miễn dịch
Everolimus ức chế hệ miễn dịch, làm giảm khả năng cơ thể chống lại nhiễm trùng. Do đó, người sử dụng everolimus có thể có nguy cơ cao hơn mắc các bệnh nhiễm trùng và nên được theo dõi chặt chẽ.
Tác động đến hệ tiêu hóa
Everolimus có thể gây ra các vấn đề về tiêu hóa như buồn nôn, nôn mửa, tiêu chảy, đau bụng, và viêm loét niêm mạc dạ dày và ruột.
Tác động đến hệ thần kinh
Một số người sử dụng everolimus có thể trải qua các triệu chứng như chói mắt, buồn ngủ, hoặc khó tập trung.
Tác động đến hệ tuần hoàn
Everolimus có thể gây ra tăng huyết áp và làm thay đổi nhịp tim.
Tương tác của Everolimus với thuốc khác
Thuốc ức chế men chuyển hóa CYP3A4: Everolimus là một chất ức chế CYP3A4, một enzyme trong gan tham gia vào quá trình chuyển hóa nhiều loại thuốc. Sử dụng everolimus cùng với các thuốc khác ức chế CYP3A4 (ví dụ: ketokonazol, itrakonazol) có thể dẫn đến tăng nồng độ everolimus trong máu, gây ra nguy cơ tăng tác dụng phụ.
Thuốc kích thích men chuyển hóa CYP3A4: Ngược lại, sử dụng everolimus cùng với các thuốc kích thích CYP3A4 (ví dụ: rifampicin, phenytoin) có thể làm giảm nồng độ everolimus trong máu, làm giảm hiệu quả điều trị.
Thuốc ức chế men chuyển hóa CYP2D6: Everolimus cũng có khả năng tương tác với các thuốc ức chế men chuyển hóa CYP2D6. Sử dụng everolimus cùng với các thuốc này có thể dẫn đến tăng nồng độ everolimus trong máu.
Thuốc ảnh hưởng đến chức năng thận: Một số thuốc có thể ảnh hưởng đến chức năng thận và cùng sử dụng với everolimus có thể gây ra tác động phụ trên thận. Việc điều chỉnh liều lượng everolimus có thể cần thiết khi sử dụng cùng với các thuốc như ciclosporin hoặc địa chỉ thận.
Thảo dược và bổ sung: Everolimus có thể tương tác với các loại thảo dược và bổ sung, đặc biệt là các sản phẩm có tác dụng lên gan và thận.
Thuốc kháng histamin H2: Một số thuốc kháng histamin H2 (ví dụ: cimetidine) có thể tăng nồng độ everolimus trong máu.
Lưu ý khi dùng Everolimus
Lưu ý và thận trọng chung
Everolimus có khả năng ức chế hệ miễn dịch và có thể dẫn đến tăng nguy cơ mắc các bệnh nhiễm trùng, bao gồm nhiễm trùng vi khuẩn, nấm, virus, hoặc các loại bệnh nhiễm trùng cơ hội.
Các phản ứng quá mẫn có thể thể hiện bằng các triệu chứng như phản ứng dị ứng, khó thở, đỏ bừng, đau ngực hoặc các triệu chứng phù mạch (bao gồm sưng đường thở hoặc lưỡi, có hoặc không có suy giảm chức năng hô hấp) đã được ghi nhận trong quá trình sử dụng everolimus.
Viêm miệng, kể cả loét miệng và viêm niêm mạc miệng, là một phản ứng phụ thường gặp nhất ở những bệnh nhân được điều trị bằng everolimus. Viêm miệng thường xuất hiện trong vòng 8 tuần đầu tiên của quá trình điều trị.
Các trường hợp suy thận, bao gồm cả suy thận cấp, đã được ghi nhận, và một số trường hợp có thể gây tử vong, đặc biệt ở những bệnh nhân được điều trị bằng everolimus. Chức năng thận cần được theo dõi đặc biệt khi bệnh nhân có các yếu tố nguy cơ có thể gây suy giảm thêm chức năng thận.
Tăng creatinin huyết thanh, thường là nhẹ, và việc báo cáo về protein niệu đã được ghi nhận. Để theo dõi chức năng thận, các chỉ số như đo nitơ urê máu (BUN), protein niệu hoặc creatinin huyết thanh nên được đo trước khi bắt đầu điều trị bằng everolimus và định kỳ sau đó.
Tăng đường huyết đã được báo cáo và nên được theo dõi. Việc theo dõi đường huyết lúc đói trước khi bắt đầu điều trị bằng everolimus và định kỳ sau đó là quan trọng. Khi everolimus được kết hợp với các sản phẩm thuốc khác có thể gây tăng đường huyết, việc theo dõi đường huyết cần được thực hiện thường xuyên hơn.
Rối loạn lipid máu, bao gồm tăng cholesterol máu và tăng triglyceride máu, đã được báo cáo và cần được theo dõi. Để quản lý tình trạng này, việc đo lường cholesterol và triglyceride máu nên được thực hiện trước khi bắt đầu điều trị bằng everolimus và theo định kỳ sau đó.
Các thay đổi trong các chỉ số máu như giảm hemoglobin, tế bào lympho, bạch cầu trung tính và tiểu cầu cũng đã được ghi nhận và cần được theo dõi bằng cách đo đầy đủ công thức máu trước khi bắt đầu điều trị bằng everolimus và định kỳ sau đó.
Lưu ý cho người đang mang thai
Không khuyến cáo sử dụng Everolimus cho nhóm đối tượng này.
Lưu ý cho người đang cho con bú
Một số nghiên cứu đã chỉ ra rằng chất chuyển hóa của Everolimus có thể đi vào trong sữa mẹ. Mặc dù độc tính và sự an toàn vẫn chưa được công bố. Do đó, không khuyến cáo sử dụng Everolimus cho nhóm đối tượng này để tránh độc tính cho trẻ bú.
Lưu ý cho người vận hành máy móc hay lái xe
Everolimus có tác động nhẹ đến nhóm đối tượng vận hành máy móc hoặc lái xe khi dùng thuốc, tùy vào thể trạng từng bệnh nhân. Do đó, cần thận trọng khi dùng Everolimus cho nhóm đối tượng này.
Một vài nghiên cứu về Everolimus trong Y học
Stent phủ thuốc Everolimus hoặc phẫu thuật bắc cầu cho bệnh động mạch vành nhiều mạch: Kết quả theo dõi mở rộng của thử nghiệm TỐT NHẤT có đối chứng ngẫu nhiên đa trung tâm
Đặt vấn đề: Kết quả so sánh dài hạn sau can thiệp mạch vành qua da (PCI) với stent phủ thuốc everolimus và ghép bắc cầu động mạch vành (CABG) còn hạn chế ở bệnh nhân mắc bệnh động mạch vành nhiều nhánh.
Phương pháp: Thử nghiệm ngẫu nhiên, đa trung tâm, có đối chứng này được tiến hành ở 27 trung tâm tim mạch quốc tế và được thiết kế để phân ngẫu nhiên 1776 bệnh nhân mắc bệnh động mạch vành nhiều nhánh trên chụp mạch vành vào nhận PCI bằng stent phủ thuốc everolimus hoặc CABG. Sau khi thu nhận 880 bệnh nhân (438 bệnh nhân trong nhóm PCI và 442 bệnh nhân trong nhóm CABG) từ tháng 7 năm 2008 đến tháng 9 năm 2013, nghiên cứu đã bị chấm dứt sớm do tuyển chọn chậm. Tiêu chí chính là sự kết hợp của tử vong do mọi nguyên nhân, nhồi máu cơ tim hoặc tái thông mạch máu mục tiêu.
Kết quả: Trong thời gian theo dõi trung bình 11,8 năm (khoảng tứ phân vị, 10,6-12,5 năm; tối đa, 13,7 năm), kết cục chính xảy ra ở 151 bệnh nhân (34,5%) trong nhóm PCI và 134 bệnh nhân (30,3%) trong nhóm PCI. nhóm CABG (tỷ lệ rủi ro [HR], 1,18 [95% CI, 0,88-1,56]; P = 0,26). Không có sự khác biệt đáng kể nào được thấy về sự xuất hiện của tổ hợp an toàn bao gồm tử vong, nhồi máu cơ tim hoặc đột quỵ giữa các nhóm (28,8% và 27,1%; HR, 1,07 [KTC 95%, 0,75-1,53]; P = 0,70), cũng như tỷ lệ tử vong do mọi nguyên nhân (20,5% và 19,9%; HR, 1,04 [KTC 95%, 0,65-1,67]; P = 0,86). Tuy nhiên, nhồi máu cơ tim tự phát (7,1% và 3,8%; HR, 1,86 [KTC 95%, 1,06-3,27]; P= 0,031) và bất kỳ tái thông mạch máu lặp lại nào (22,6% và 12,7%; HR, 1,92 [95% CI, 1,58-2,32]; P <0,001) thường gặp sau PCI hơn sau CABG.
Kết luận: Ở những bệnh nhân mắc bệnh động mạch vành nhiều nhánh, không có sự khác biệt đáng kể giữa PCI và CABG về tỷ lệ mắc các biến cố tim mạch nặng, tiêu chí tổng hợp về an toàn và tử vong do mọi nguyên nhân trong thời gian theo dõi mở rộng.
Tài liệu tham khảo
- Drugbank, Everolimus , truy cập ngày 14/09/2023.
- Pubchem, Everolimus, truy cập ngày 14/09/2023.
- Ahn, J. M., Kang, D. Y., Yun, S. C., Ho Hur, S., Park, H. J., Tresukosol, D., … & Park, S. J. (2022). Everolimus-eluting stents or bypass surgery for multivessel coronary artery disease: extended follow-up outcomes of multicenter randomized controlled BEST trial. Circulation, 146(21), 1581-1590.
Xuất xứ: Switzerland
Xuất xứ: Ấn Độ
Xuất xứ: Thụy Sĩ
Xuất xứ: Thụy Sĩ