Bệnh hô hấp, Bệnh Nhi khoa
Hiểu về thông khí cho trẻ em trong môi trường phẫu thuật
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Bài viết “Hiểu về thông khí cho trẻ em trong môi trường phẫu thuật“.
Phần I: Các nguyên tắc vật lý của theo dõi ở trạm gây mê hiện đại tải về file pdf ở đây.
Phần II: Cài đặt thông khí chu phẫu tải file PDF Tại đây
Tác giả Johannes Spaeth, Stefan Schumann và Susan Humphreys.
Bản dịch của BS. Đặng Thanh Tuấn – BV Nhi Đồng 1
Phần I
TÓM TẮT
Trạm gây mê hiện đại cung cấp nhiều thông tin, trong đó có một số thông tin được đặc biệt quan tâm khi nói đến việc tối ưu hóa cài đặt thông khí. Kiến thức này thậm chí còn trở nên quan trọng hơn trong điều trị bệnh nhân nhi. Trong trường hợp không có các khuyến nghị dựa trên bằng chứng về cài đặt thông khí tối ưu ở bệnh nhân nhi, việc đánh giá các yếu tố riêng lẻ trở nên quan trọng và đồng thời là thách thức. Ngay cả khi được trang bị công nghệ cảm biến mới nhất, người dùng sẽ luôn phải chịu trách nhiệm diễn giải các biến giám sát được cung cấp. Mục đích của đánh giá này là phác thảo tác động lâm sàng, nền tảng công nghệ và độ tin cậy của thông tin phù hợp nhất được đo lường và tính toán bởi trạm gây mê hiện đại. Nó nhằm mục đích chuyển kiến thức kỹ thuật thành một ứng dụng có thẩm quyền và thận trọng hơn trong môi trường lâm sàng.
GIỚI THIỆU
Trong thập kỷ qua, thông khí bảo vệ phổi trong quá trình gây mê ngày càng trở nên quan trọng. Ngày nay, người ta chấp nhận rộng rãi rằng các cài đặt thông khí cơ học nên được điều chỉnh theo tình trạng cá nhân của bệnh nhân để tránh tổn thương phổi do máy thở (VILI, ventilator-induced lung injury).1 Theo dõi hô hấp trong trạm gây mê (AWS, anesthesia workstation) là cơ sở cho các phân tích tương ứng. Việc phân tích một nhịp thở đã cho phép tạo ra một đặc điểm tinh vi về tình trạng hệ thống hô hấp của bệnh nhân. Trong phần tóm tắt về các công nghệ mới nổi và đang phát triển nhanh chóng, thông tin này mở ra tiềm năng cho việc thông khí bảo vệ phổi.
Để hỗ trợ hiểu biết về liệu pháp thông khí xung quanh cuộc phẫu thuật dựa trên cơ sở lý luận, đánh giá giáo dục này nhằm mục đích giải thích tác động lâm sàng, nền tảng công nghệ và tính hợp lệ của các biến số theo dõi do AWS hiện đại cung cấp thường quy. Trong phần thứ hai, việc dịch thông tin này thành liệu pháp thông khí chu phẫu dựa trên cơ sở hợp lý sẽ được thảo luận.
TRẠM GÂY MÊ HIỆN ĐẠI
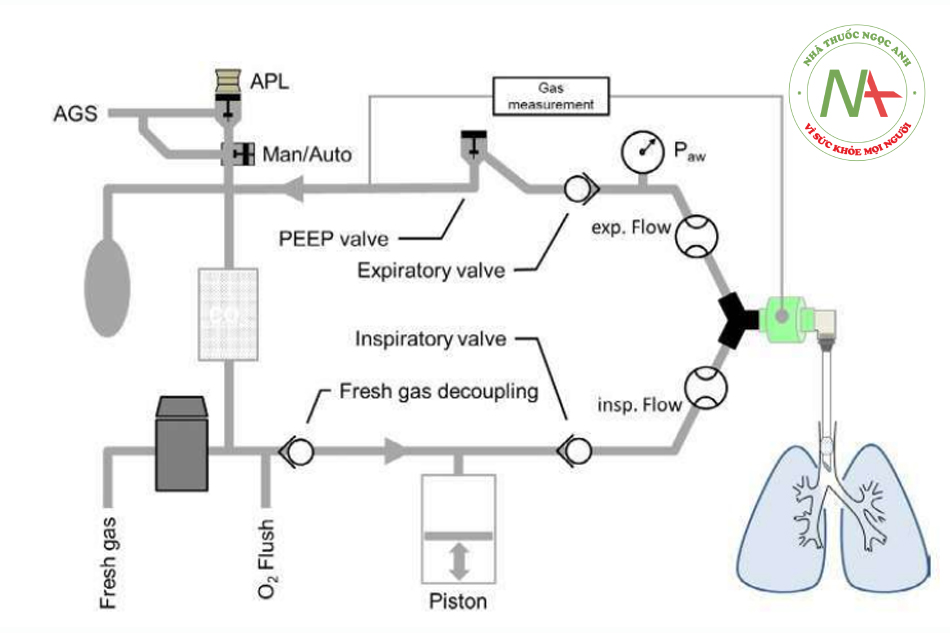
Các thành phần cốt lõi của AWS hiện đại chỉ thay đổi một chút trong những thập kỷ qua. Ngày nay, AWS về cơ bản chứa nguồn cung cấp khí và điện, hệ thống máy thở được vận hành tự động (bằng pít-tông hoặc tua-bin) hoặc thủ công, và một thiết bị giám sát hiển thị các biến số thông khí đã thiết lập và đo được (Hình 1).
Đối với các đường cong hiển thị trên màn hình AWS, cần lưu ý rằng các tín hiệu được đo trực tiếp chứa các tín hiệu nhiễu do điện trường bên ngoài, việc chuyển đổi van của máy thở và các hạn chế của kỹ thuật đo chẳng hạn. Do đó, để hiển thị mượt mà, các tín hiệu cần được xử lý ở mức độ cao. Các tín hiệu nhiễu điển hình của tần số cao được loại bỏ bằng cách sử dụng các bộ lọc thông thấp và độ lệch đường cơ sở được đặt lại thành 0 trước mỗi nhịp thở. Các ví dụ này minh họa mức độ phức tạp của các yêu cầu xử lý thông tin trong AWS để cho phép vận hành an toàn và thân thiện với người dùng. Tuy nhiên, quá trình xử lý tự động như vậy kéo theo nguy cơ lan truyền lỗi trong hệ thống.
THEO DÕI CƠ HỌC HÔ HẤP – THỂ TÍCH
Thể tích khí lưu thông có lẽ là thước đo thiết yếu nhất do AWS trực tiếp cung cấp. Việc tính toán một số tham số phụ dựa trên biến này.
Kỹ thuật đo thể tích
Thể tích được tính là tích phân của tốc độ lưu lượng được đo trực tiếp theo thời gian. Cho đến nay, hai phương pháp đo lưu lượng đáng tin cậy nhất trong AWS sử dụng máy đo lưu lượng khí hô hấp (pneumotachographs) hoặc máy đo tốc độ khí dùng nhiệt (thermal anemometers).
Trong trường hợp đầu tiên, độ chênh lệch áp lực trên một phần tử trở kháng (resistor) xác định trong một đường ống (máy đo khí nén) được đo thông qua các cảm biến chênh lệch áp lực có độ nhạy cao. Hai ống pitot của phần cảm biến được kết nối bằng khí với cảm biến áp lực. Chất tiết và hơi nước ngưng tụ có thể làm thay đổi đặc tính của trở kháng. Hệ thống sưởi và hiệu chuẩn thường xuyên thiết bị được cho là để ngăn chặn điều này. Sau khi hiệu chuẩn (bao gồm cả việc bù phi tuyến tính của mối quan hệ lưu lượng-áp lực thực), độ chênh lệch áp lực tỷ lệ với tốc độ dòng khí đi qua trở kháng. Ưu điểm của loại cảm biến này nằm ở thời gian hoạt động lâu dài cũng như khả năng chống rung và các nguồn nhiễu khác như nhiễu điện từ.
Phép đo tốc độ khí dùng nhiệt hoạt động thông qua một sợi dây được làm nóng bằng một dòng điện xác định bên trong ống dẫn khí. Nhiệt độ của dây và điện trở dẫn đến, thay đổi tùy thuộc vào lượng khí đi qua. Việc đo tốc độ lưu lượng dựa trên sự thay đổi điện áp để duy trì dòng điện xác định hoặc kiểm soát nhiệt độ của dây thông qua các hệ thống điều khiển phức tạp. Trong phạm vi đo lường sinh lý, hiệu suất của loại cảm biến này không bị ảnh hưởng bởi nhiệt độ/thành phần khí.
Vị trí đo thể tích
Các điều kiện khí trong hệ thống thở có thể được coi là gần như ổn định và có thể giả định tính liên tục. Kết quả là lưu lượng đủ độc lập với vị trí nếu không có rò rỉ. Một hệ thống dây máy thở y tế thường chứa hai cảm biến lưu lượng, một ở nhánh hít vào và một ở nhánh thở ra của hệ thống thở (Hình 1). Với hai cảm biến tại chỗ, có thể dễ dàng phát hiện rò rỉ bằng cách so sánh thể tích hít vào và thở ra. Thể tích thở ra có thể thấp hơn một chút so với thể tích hít vào do sự hấp thụ oxy trong khi những thay đổi về nhiệt độ và độ ẩm của khí được tự động tính đến.
Đáng chú ý, một số máy thở phù hợp với bệnh nhi giảm lỗi đo thể tích bằng cách sử dụng cảm biến lưu lượng bên ngoài, được đặt gần đường thở của bệnh nhân, nghĩa là ở đầu xa của ống chữ Y. Khi làm như vậy, độ giãn nở của dây thở (khoảng 0,4 ml/cmH2O trong dây thở dành cho trẻ sơ sinh có đường kính trong là 10 mm) không ảnh hưởng đến phép đo tốc độ lưu lượng đến và từ bệnh nhân. Do đó, độ chính xác của phép đo thể tích khí lưu thông thở ra có thể tăng lên, đặc biệt khi có thiết bị đường thở bị rò rỉ.2 Hơn nữa, các phép đo lưu lượng đầu gần có tỷ lệ tín hiệu trên tiếng ồn (signal-to-noise ratio) tốt hơn và đáp ứng của máy thở đối với nỗ lực thở của bệnh nhân có thể được đồng bộ hóa tốt hơn trong quá trình nhịp thở tự phát có hỗ trợ. Tuy nhiên, khoảng chết bổ sung và nguy cơ ngắt kết nối có thể hạn chế lợi ích của phương pháp này.
Độ chính xác của đo thể tích khí lưu thông
AWS hiện đại có thể cung cấp thể tích khí lưu thông (VT) thấp tới 5 ml đối với thông khí kiểm soát áp lực (PCV) và thấp tới 10 ml đối với thông khí kiểm soát thể tích (VCV).3 Theo thông tin của nhà sản xuất, độ chính xác nằm trong khoảng ±10 % và ±10 ml dưới VT là 150 ml, giá trị lớn hơn tương ứng sẽ được áp dụng.3,4 Trong AWS sử dụng bơm pít-tông để tạo thể tích, thể tích được cung cấp có liên quan trực tiếp đến chuyển động tuyến tính của pít-tông, cung cấp thêm thông tin đảm bảo độ chính xác liên quan đến VT thông qua bộ vi xử lý bên trong. Ngoài ra, một tua-bin được sử dụng để điều khiển thông khí, tương tự như một số máy thở ICU.4,5 Cách tiếp cận này cho thấy lợi ích của nó bất cứ khi nào cần lưu lượng hít vào tăng cao, ví dụ, trong PCV và khi cần nhịp thở cao. Một thành tựu kỹ thuật khác cho phép chuẩn độ chính xác VT rất nhỏ là việc xem xét cung cấp khí mới trong khi áp dụng VT đã đặt. Trước đây, dòng khí tươi vẫn tiếp tục trong quá trình cung cấp thể tích, làm thay đổi VT tùy thuộc vào lưu lượng tương ứng. Ngày nay, lưu lượng khí mới được tính đến một cách tính toán hoặc bị ngắt trong giai đoạn hít vào.6 Cuối cùng, hiệu chuẩn cảm biến và độ giãn nở của bộ dây máy thở có thể ảnh hưởng đến độ chính xác của phép đo thể tích. Những điểm này sẽ được thảo luận sâu hơn.
Từ quan điểm vật lý, thành phần của khí thở ảnh hưởng đến phép đo lưu lượng và do đó độ chính xác của ứng dụng VT. Với một nhiệt độ và áp lực nhất định, các chất khí có độ nhớt và mật độ nhất định. Độ nhớt của thuốc gây mê dễ bay hơi hiện đại thấp hơn độ nhớt của khí mang điển hình (hỗn hợp không khí và oxy) trong khi mật độ của chúng cao hơn đáng kể (mật độ của Sevoflurane gấp sáu lần so với không khí). Ở các phần thể tích lớn hơn, các đặc điểm này có thể thúc đẩy lưu lượng rối và do đó ảnh hưởng đến phép đo lưu lượng và áp lực nói riêng. Mặc dù hiệu ứng được coi là tương đối nhỏ, 7 AWS với các đơn vị đo lường khí tích hợp sẽ tự động tính toán hiệu chỉnh hỗn hợp khí. Tuy nhiên, trong AWS không có phép đo khí, việc bù trừ phải được kích hoạt thủ công nếu sử dụng thuốc gây mê dễ bay hơi.8
Hiển thị lưu lượng – thể tích
Bản thân tốc độ lưu lượng thường được hiển thị dưới dạng đường cong phụ thuộc vào thời gian (Hình 2 và 3). Trong số các thông tin liên quan nhất có thể được ước tính trực quan từ đường cong lưu lượng là tắc nghẽn đường thở, phát hiện thì thở ra và thì hít vào không hoàn toàn, và phát hiện các nỗ lực thở tự nhiên. Ngoài ra, có thể dễ dàng ước tính rò rỉ bằng cách so sánh diện tích khu vực được bao quanh bởi đường cong hít vào (biểu thị thể tích hít vào) với khu vực được bao quanh bởi đường cong thở ra (biểu thị thể tích thở ra).
THEO DÕI CƠ HỌC HÔ HẤP – ÁP LỰC
Biến thứ hai được đo trực tiếp trong bộ dây máy thở là áp lực. Áp lực đường thở thường được hiển thị liên tục theo thời gian (Hình 2 và 3), cùng với một số chỉ số liên quan (ví dụ: áp lực đường thở đỉnh, áp lực bình nguyên và áp lực dương cuối thì thở ra (PEEP)).
Kỹ thuật đo áp lực
Phương pháp đo áp lực phổ biến nhất, trong điều trị thông khí, là áp điện (piezoelectricity). Do đó, áp lực tác dụng làm biến dạng một phần tử áp điện là một phần của mạch cầu Wheatstone. Những thay đổi về biến dạng vật liệu dẫn đến thay đổi điện áp đầu ra. Trong AWS hiện đại, áp lực có thể được đo từ −20 đến +120 cmH2O, với độ chính xác ±4% hoặc ±2 cmH2O, tùy thuộc vào thiết bị.4
Vị trí đo áp lực
Vị trí của cảm biến áp lực trong bộ dây có tầm quan trọng quyết định vì áp lực có thể thay đổi trong đường thở do lực cản của chúng. Mặc dù cảm biến áp lực tốt nhất nên được đặt gần đường thở của bệnh nhân, nhưng chúng thường được gắn ở xa bệnh nhân, vì lý do độ bền của cảm biến. Tối thiểu, một cảm biến áp lực được đặt ở nhánh thở ra của dây thở (Hình 1).
Việc đo áp lực ở phần thở ra tạo điều kiện thuận lợi cho việc phát hiện báo động áp lực thấp vì việc ngắt kết nối hệ thống thở có thể không được ghi nhận ngay lập tức (hoặc bị trì hoãn) tại vị trí hít vào, do áp lực ngược có thể do sức cản cao của đường thở nhân tạo (vì nó áp dụng điển hình cho các thành phần đường thở nhân tạo để thở cho trẻ em).9 AWS chạy bằng tua-bin thường có cảm biến áp lực ở nhánh hít vào và nhánh thở ra của bộ dây thở.4 Điều này cho phép đo áp lực đường thở luân phiên tùy thuộc vào giai đoạn của chu kỳ thở. Bằng cách này, không có lưu lượng trong nhánh đo và trở kháng của nó không làm tăng thêm áp lực đo được. Vì lý do bảo mật, hầu hết AWS đều bao gồm một đồng hồ đo áp lực cơ học bổ sung với độ phân giải ± 5 cmH2O, dùng để dự phòng khi mất điện.
Giải thích số đo áp lực
Mặc dù công nghệ đo áp lực có thể được coi là có độ chính xác cao, nhưng thông tin nào được phản ánh bởi áp lực đường thở được hiển thị trong AWS lại ít rõ ràng hơn. Áp dụng phương trình chuyển động của Newton, có vẻ như tín hiệu áp lực bao gồm các thành phần khác nhau (Phương trình 1). Nói chung, áp lực đường thở (Paw) bao gồm (a) sự giãn nở của các lực đàn hồi của hệ hô hấp (nghĩa là độ giãn nở; CRS), tùy thuộc vào thể tích (V), (b) áp lực do sức cản của hệ hô hấp tạo ra (RRS), tùy thuộc vào lưu lượng (V) và (c) phần áp lực không đổi (P0), phản ánh PEEP.
Paw = 1/ CRS + RRS . V + P0 (1)
Một phần áp lực khác cũng bao gồm quán tính của hệ thống hô hấp. Thuật ngữ này liên quan đến tăng tốc thể tích và không được hiển thị trong giám sát của AWS và hầu như bị bỏ quên.
Phương trình 1 minh họa rằng bất cứ khi nào có lưu lượng, thành phần trở kháng sẽ thêm vào tín hiệu áp lực được hiển thị. Vì RRS chủ yếu do đường thở nhân tạo gây ra, thành phần áp lực này trên thực tế không góp phần vào các lực cơ học mở rộng mô sinh học. Theo đó, trong điều kiện động, Paw không nhất thiết phản ánh áp lực hiệu quả về mặt sinh lý trong phế nang.
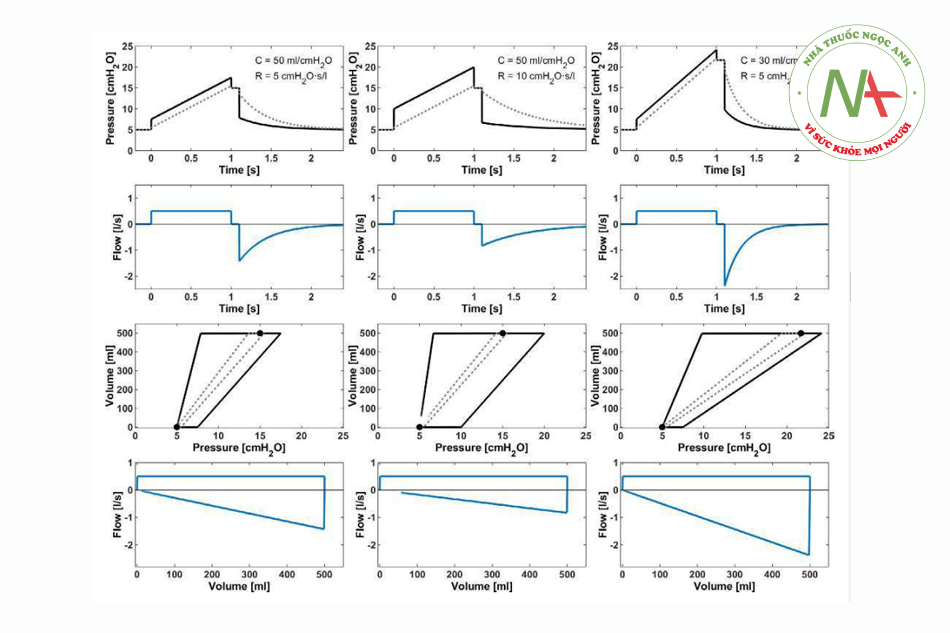
Điều này đặc biệt có liên quan ở tần số hô hấp cao, trong đó khoảng thời gian không có lưu lượng ngắn, nếu có. Tuy nhiên, chỉ trong những khoảng thời gian không có lưu lượng như vậy, Paw đo được mới phản ánh áp lực trong phế nang. Khoảng thời gian cân bằng trong giai đoạn không có lưu lượng phụ thuộc vào độ nhớt và tính đồng nhất của phổi, điều này có thể bị suy giảm đáng kể ở trẻ em được gây mê.10 Nếu trong VCV, tạm dừng thông khí xảy ra ở cuối thì hít vào, thì sự cân bằng có thể được thực hiện được quan sát khi áp lực giảm theo cấp số nhân khi tiếp cận áp lực cao nguyên (Hình 4).
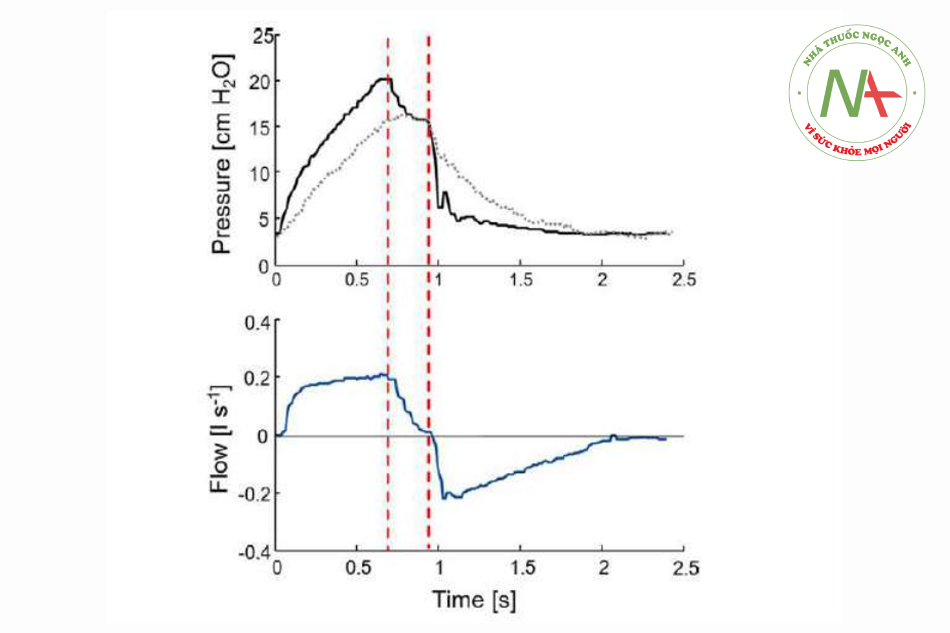
Cần lưu ý rằng phép đo Paw trong AWS thường bao gồm sức cản của đường thở nhân tạo phía xa ống chữ Y và đặc biệt là sức cản của ống nội khí quản. Do đó, Paw thường đánh giá quá cao áp lực phế nang khi hít vào và đánh giá thấp áp lực phổi khi thở ra (Hình 2 và 3). Nhiều phương pháp khác nhau đã được đánh giá để tính gần đúng áp lực trong đường thở. Do phép đo trực tiếp (ví dụ: với các ống nội khí quản cụ thể) không thể áp dụng được nên các thuật toán cụ thể đã được phát triển để tính toán áp lực khí quản dựa trên kiến thức về kích thước của ống nội khí quản.11,12 Việc theo dõi như vậy đã có sẵn trong một số máy thở ICU. Tuy nhiên, các chất tiết làm hạn chế hiệu lực của các phương pháp này.
THEO DÕI CƠ HỌC HỆ HÔ HẤP – CHỈ SỐ ĐƯỢC TÍNH TOÁN
Việc theo dõi AWS hiện đại cung cấp các chỉ số hô hấp khác nhau, được tính toán lần thứ hai từ các biến được đo trực tiếp nêu trên. Về điều trị thở máy cho trẻ em, độ giãn nở và sức cản của hệ hô hấp có vẻ phù hợp nhất.
Tính toán độ giãn nở của hệ thống hô hấp (CRS)
CRS được coi là một chỉ số quan trọng về tình trạng của hệ thống hô hấp của bệnh nhân. Có vô số phương pháp để tính CRS. Tuy nhiên, mỗi cách tiếp cận cung cấp thông tin khác nhau. Trước đây, CRS được đo thông qua bơm phồng phổi từng bước với các phần thể tích xác định, trong quá trình thao tác siêu ống tiêm, sau đó với thao tác bơm hơi chậm liên tục. Các thao tác này được yêu cầu để tạo ra các điều kiện có lưu lượng bằng 0 hoặc rất thấp để tạo ra (gần như) các điều kiện tĩnh và để loại bỏ phần áp lực liên quan đến trở kháng trong tín hiệu đo được. Các thuật toán sau này cho phép ước tính CRS mà không làm gián đoạn chu kỳ thở, sử dụng phương pháp được gọi là bán tĩnh (Hình 5, bảng bên trái). Do đó, thể tích áp dụng trong một nhịp thở được chia cho sự khác biệt giữa áp lực cao nguyên và áp lực cuối thì thở ra của cùng một nhịp thở. Giá trị của CRS bán tĩnh hóa ra thấp hơn CRS tĩnh do thời gian cân bằng áp lực trong hệ hô hấp bị hạn chế. Từ góc độ lâm sàng, CRS bán tĩnh phản ánh các điều kiện sinh lý tốt hơn trong quá trình thông khí liên tục so với CRS tĩnh.13
Đặc biệt trong quá trình thông khí cho trẻ sơ sinh và trẻ nhũ nhi, có thể khó đạt được các giá trị đáng tin cậy đối với CRS bán tĩnh. Như đã đề cập trước đó, các phần áp lực sức cản ảnh hưởng đến phép đo áp lực và do đó thách thức độ chính xác của CRS được tính toán. Khi tính đến nhịp hô hấp cao, áp lực đường thở cuối thì hít vào có khả năng bao gồm các thành phần áp lực sức cản. Do đó, áp lực đẩy sẽ được ước tính ở mức cao và CRS ở mức thấp, tương ứng.
Do những hạn chế này, AWS hiện đại xác định CRS động. Do đó, sức cản và độ giãn nở được xác định bằng phân tích hồi quy đa tuyến tính phù hợp với các đường cong áp lực, lưu lượng và thể tích của nhịp thở với phương trình chuyển động (Công thức 1). Nghiên cứu hiện tại đã nâng cao cách tiếp cận này theo cách thể hiện sự thay đổi độ giãn nở khí lưu thông trong một nhịp thở.14 Một cách tiếp cận, được chứng minh là đáng tin cậy ở trẻ em từ 9 tháng tuổi, phân tích thể tích khí lưu thông thành các bước đẳng thể tích (Hình 5, bảng bên phải).
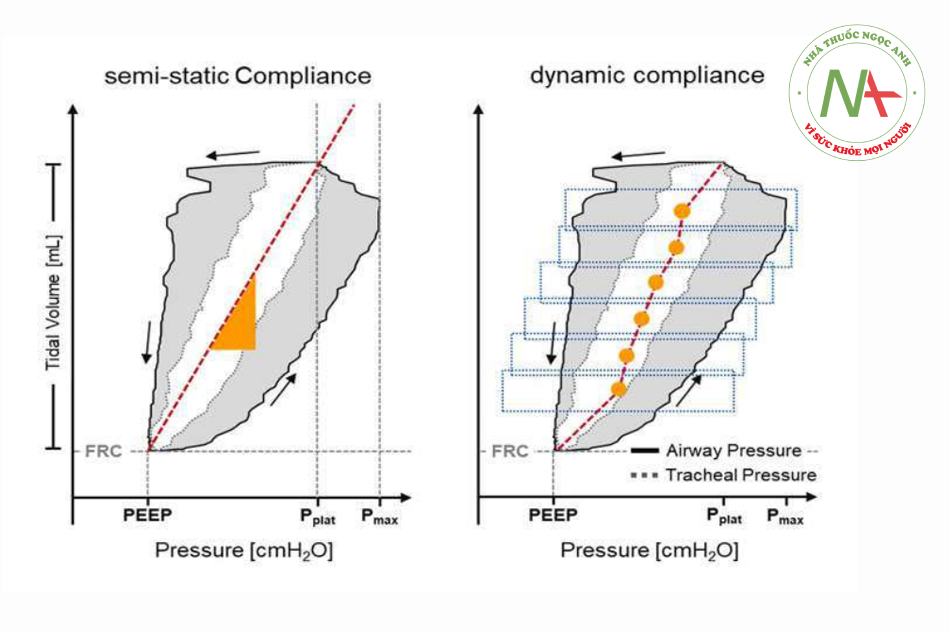
CRS sau đó được tính tương ứng cho từng bước từ dữ liệu xung quanh bước này trong một lát thể tích đã xác định. Đường cong thể tích-độ giãn nở kết quả cung cấp thông tin về trạng thái huy động của phổi do độ giãn nở tăng theo thể tích cho thấy huy động/mất huy động theo chu kỳ thở và độ giãn nở giảm theo thể tích cho thấy quá căng. Khi tính đến thông tin này, PEEP và VT có thể được đặt dựa trên các điều kiện thực tế của từng cá nhân.15 Các phương pháp như vậy được đặc biệt quan tâm ở nhóm trẻ em, nơi cài đặt áp lực thông khí vẫn được hướng dẫn trên các thông số riêng lẻ do các đặc điểm của hệ hô hấp thay đổi nhanh chóng ở tuổi thiếu niên.
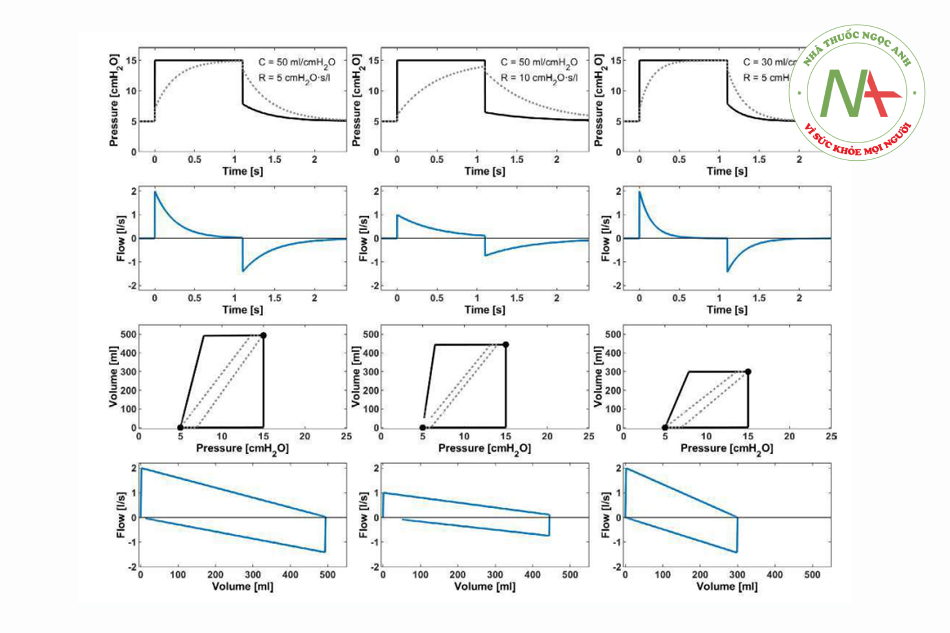
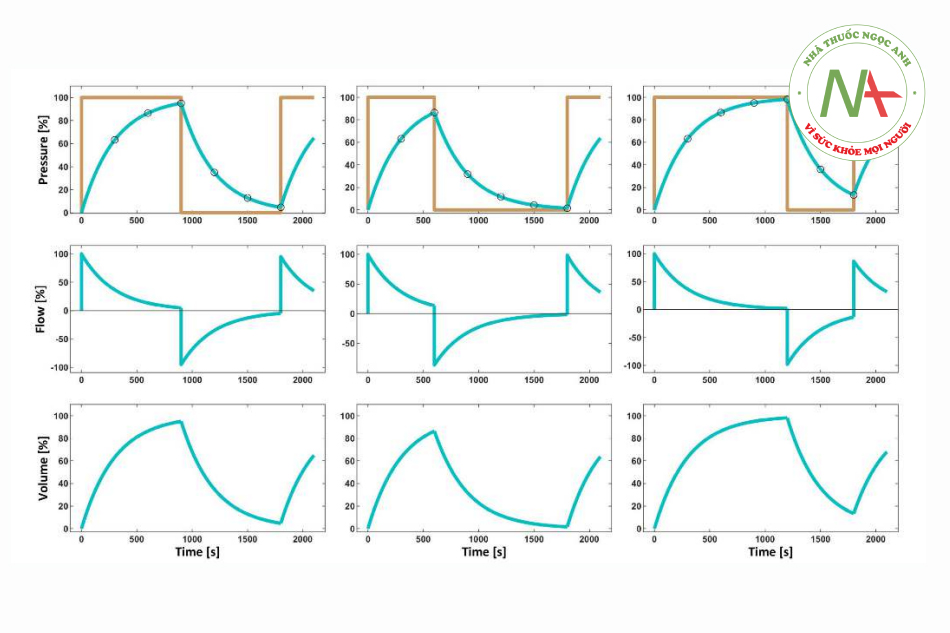
Cho đến nay, hầu hết AWS đều cho phép hiển thị vòng lặp áp lực-thể tích (P-V), cung cấp nhiều thông tin. Hình 2 mô phỏng những thay đổi phù hợp nhất của vòng P-V trong PCV và Hình 3 trong VCV tương ứng. Hơn nữa, vòng lặp P-V có thể giúp phân biệt thở tự nhiên với thở máy bắt buộc. Trong quá trình thở tự nhiên, vòng lặp hiển thị các giá trị áp lực âm và quay vòng theo chiều kim đồng hồ.
Tính toán sức cản hệ hô hấp (RRS)
Sức cản của hệ hô hấp (RRS) đóng một vai trò quan trọng trong điều trị thông khí ở trẻ em, mặc dù trên lâm sàng thường bị bỏ qua. Để xác định RRS trong một hệ thống kín, áp lực được đo ở cuối kỳ thở ra (lưu lượng bằng 0) khi bắt đầu hít vào (lưu lượng tối đa). Theo giả định rằng khi lưu lượng tối đa, sự lấp đầy phổi là không đáng kể (bắt đầu hít vào ban đầu), do đó độ giãn nở chưa góp phần tạo nên áp lực, RRS là kết quả của sự phân chia chênh lệch áp lực đã xác định. Để tăng độ chính xác, giá trị này được hiệu chỉnh bằng trở trong của hệ thống thở (bao gồm ống thở và mảnh chữ Y), như được xác định trong quá trình hiệu chuẩn ban đầu của thiết bị. Do đó, RRS được hiển thị bao gồm cả đường thở nhân tạo và sinh học. Để chỉ xác định sức cản của đường thở sinh học, tính toán áp lực khí quản như đã đề cập ở trên, sẽ là một công cụ đầy hứa hẹn. Tính toán này có thể được cải thiện hơn nữa bằng cách xem xét sức cản của các thành phần đường thở nhân tạo khác.16
Diễn giải vòng lặp lưu lượng-thể tích (vòng lặp V-V) có thể có giá trị chẩn đoán liên quan đến đặc tính của những thay đổi trong RRS. Hình 2 lần lượt cho thấy những thay đổi phù hợp nhất của vòng lặp V-V trong PCV và Hình 3 trong VCV. Trên đó, hình răng cưa của vòng chỉ ra dịch tiết trong đường thở trong điều kiện lâm sàng.
GIÁM SÁT KHÍ – NGUYÊN TẮC
Trong AWS, các loại khí được đo bằng một công cụ cụ thể, bao gồm các cảm biến cho tất cả các chất quan tâm. Tùy thuộc vào thiết bị, thiết bị đo này có thể được tích hợp trong AWS hoặc được để riêng biệt, chỉ gửi kết quả phân tích tới AWS. Trong các máy không có bàn đo tích hợp (ví dụ: Fabius, Dräger Medical, Đức), bắt buộc phải có thiết bị đo oxy riêng biệt. Với mục đích như vậy, pin nhiên liệu galvanic được sử dụng, loại pin này có tuổi thọ hạn chế do cần phản ứng hóa học.
Máy đo được cung cấp bởi một mẫu khí được rút ra ở ống chữ Y của hệ thống thở. Chiều dài của dòng mẫu (thường là 2 mét) xác định độ trễ trong phân tích. Khí mẫu được hút với khoảng 200 ml mỗi phút với thể tích mẫu được đưa trở lại hệ thống. Để cung cấp thể tích khí lưu thông chính xác, sự mất mát về thể tích hít vào sẽ tự động được bù bằng thể tích bổ sung tùy thuộc vào lưu lượng mẫu. Một số thiết bị cho phép giảm lưu lượng khí mẫu trong quá trình thông khí cho bệnh nhân nhi. Tuy nhiên, điều này có thể làm tăng độ trễ của quá trình phân tích khí và nguy cơ đo không chính xác trong trường hợp nhịp hô hấp cao. Ngoài ra, đặc biệt là trong quá trình gây mê với lưu lượng thấp và tối thiểu, độ ẩm cao trong hệ thống có thể làm hỏng do nước ngưng tụ. Những vấn đề như vậy có thể gặp phải bằng cách đưa bẫy nước vào đường lấy mẫu và hệ thống thở.
Địa điểm lấy mẫu khí
Về cơ bản, khí mẫu phải được hút càng gần đường thở của bệnh nhân càng tốt, để đảm bảo thu được hỗn hợp khí đáng tin cậy. Tuy nhiên, khi cần thể tích khí lưu thông nhỏ, phép đo có thể bị ảnh hưởng bởi thể tích khoảng chết. Bộ trao đổi nhiệt và độ ẩm (HME, Heat and moisture exchangers), có hoặc không có chức năng lọc, là nguồn tạo ra thể tích khoảng chết có liên quan. Do đó, trong quá trình thông khí cho trẻ em, chúng nên được đặt ở đầu vào và đầu ra của AWS. Nếu được sử dụng giữa ống chữ Y và thiết bị đường thở, các hậu quả sau đây phải được xem xét (Hình 6).
Nếu không có rò rỉ trong hệ thống thở, khí thở được lấy mẫu giữa ống chữ Y và HME rất có thể sẽ phản ánh thành phần khí đáng tin cậy (Hình 6, bên trái). Tuy nhiên, với thể tích khí lưu thông rất nhỏ, một mẫu có thể chứa thể tích khoảng chết khi bắt đầu thở ra (ít CO2 hơn), nhưng không bắt được phần ít nhất của thể tích thở ra, vì nó được giữ lại trong thể tích khoảng chết của bộ lọc. Vì thể tích khi kết thúc thì thở ra phản ánh tốt nhất thành phần khí trong phế nang nên các kỹ thuật khác nhau được sử dụng để đảm bảo phép đo chính xác trong giai đoạn này.
Ví dụ: ATLAN (Dräger Medical, Đức) triển khai PEEP giảm tốc một chút trong khi thở ra, do đó tạo ra một độ chênh lệch áp lực riêng biệt để duy trì lưu lượng thở ra.17 Với sự rò rỉ trong hệ thống thở (ví dụ: do ống nội khí quản không có bóng chèn gây ra), lưu lượng duy trì trong bộ dây máy thở của AWS có thể chiếm chỗ khí thở ra khỏi điểm lấy mẫu khí và do đó làm giảm chất lượng của mẫu khí (Hình 6, bảng giữa).
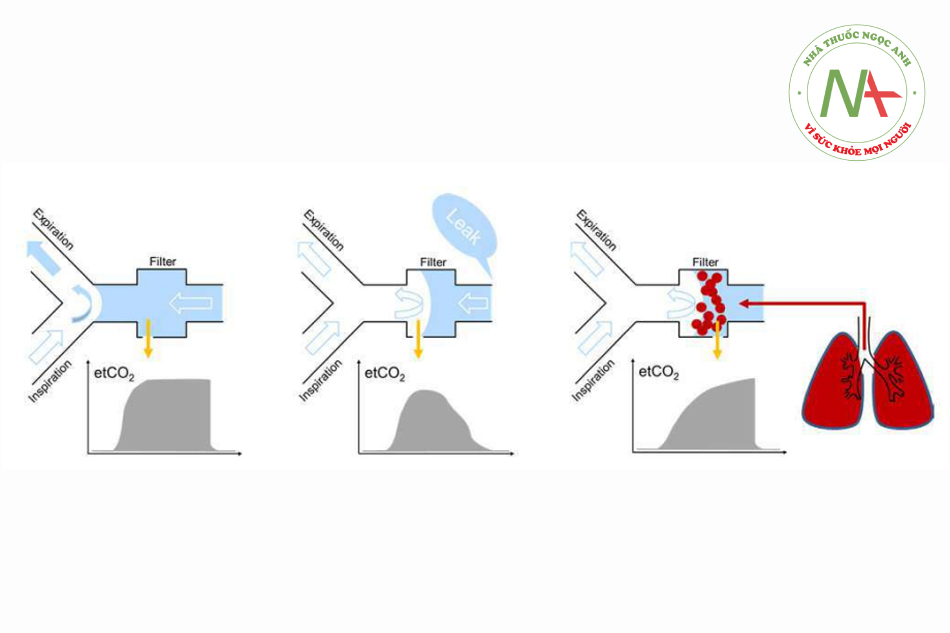
Với việc sử dụng các bộ lọc hoặc đầu nối đặc biệt để thông khí cho trẻ sơ sinh, khí thở cũng có thể được lấy mẫu giữa bộ lọc và thiết bị đường thở. Đối với dòng mẫu, cần phải xem xét rằng tắc nghẽn bộ lọc có thể dẫn đến áp lực dưới khí quyển trong phổi của bệnh nhân (Hình 6, bên phải). Những thay đổi đột ngột về sức cản của bộ lọc có thể được phát hiện bằng cách giảm lưu lượng đỉnh thở ra tương ứng kịp thời (so sánh Hình 2 và Hình 3, cột giữa). Để ngăn chặn sự kiện như vậy, nên sử dụng HME không có chức năng lọc ở nơi này.
Theo dõi khí – Oxy
Các tiêu chuẩn theo dõi gây mê cơ bản được xác định bởi Hiệp hội Bác sĩ Gây mê Hoa Kỳ cũng như các tổ chức quốc gia khác, quy định rằng nồng độ oxy thích hợp trong khí hít vào phải được đảm bảo ở tất cả các bệnh nhân được gây mê. Ngày nay, tất cả AWS đều tuân thù các yêu cầu này, phổ biến nhất là sử dụng máy phân tích thuận từ để đo nồng độ oxy của hỗn hợp khí. Trái ngược với các loại khí y tế khác, các phân tử oxy bị hút vào bên trong từ trường. Các kỹ thuật khác nhau được sử dụng để chuyển ảnh hưởng của nồng độ oxy lên trường thuận từ thành sự thay đổi tỷ lệ của tín hiệu điện.
Đặc biệt khi gây mê cho bệnh nhân nhi, việc tăng nhanh nồng độ oxy hít vào có thể rất quan trọng. Tốc độ của sự gia tăng này, tức là hằng số thời gian của hệ hô hấp, phụ thuộc vào nhiều yếu tố khác nhau. Trước hết, lưu lượng khí sạch phải được tăng lên mức tối đa, lên tới khoảng 18 L mỗi phút. Như đã đề cập trước đây, đầu vào khí sạch được cách ly với bộ dây máy thở để đảm bảo cung cấp chính xác thể tích khí lưu thông nhỏ. Do đó, trong AWS sử dụng bơm pít-tông, nồng độ oxy tăng lên sẽ đi vào bộ dây máy thở theo kiểu từng nhịp thở. Do đó, tốc độ tăng oxy phụ thuộc vào thông khí phút của bệnh nhân và thể tích được bao quanh bởi nhánh hít vào của dây thở (ví dụ: dây thở, pít-tông và ống thở). Giả sử thể tích thở là 1,6 L mỗi phút (trẻ sơ sinh 9 kg, VT 54 ml, RR 30 mỗi phút) và thể tích 2,4 L ở nhánh hít vào của máy Primus (Dräger Medical, Đức) được trang bị ống thở cho trẻ sơ sinh, nó sẽ mất tới 90 giây để đạt được nồng độ oxy hít vào là 100%. Do đó, các thế hệ AWS dẫn động pít-tông mới hơn sẽ tự động điều chỉnh thể tích của pít-tông để giảm tổng thể tích hệ thống và do đó đẩy nhanh quá trình thay đổi hỗn hợp khí. Ngược lại, trong AWS sử dụng tua-bin để điều khiển hệ thống thông khí, quá trình này được tăng tốc bằng cách sử dụng dòng tuần hoàn được áp dụng liên tục.
=> Đọc thêm: Những phát triển mới trong xử trí hô hấp ở trẻ sơ sinh.
Phần II: Cài đặt thông khí chu phẫu
TÓM TẮT
Các phương pháp thông khí bảo vệ phổi ngày càng được nghiên cứu trong những năm gần đây. Mặc dù bằng chứng được tìm thấy ở người lớn trải qua phẫu thuật, dữ liệu ở trẻ nhỏ vẫn còn khan hiếm và gây tranh cãi. Tuy nhiên, từ góc độ sinh lý, các đặc điểm thay đổi liên tục của hệ hô hấp từ khi sinh ra cho đến tuổi thiếu niên đòi hỏi một cách tiếp cận dựa trên phân tích của từng bệnh nhân. Trạm gây mê hiện đại cung cấp những thông tin như vậy, với những điểm mạnh và điểm yếu về kỹ thuật sẽ được thảo luận trong phần đánh giá trước công việc hiện tại (xem Phần I). Phần tóm tắt hiện tại nhằm mục đích cung cấp các ý tưởng về cách dịch thông tin hiển thị trên trạm gây mê sang các cài đặt thông khí lâm sàng hướng đến bệnh nhân.
GIỚI THIỆU
Bằng chứng lâm sàng liên quan đến các chiến lược thông khí cho trẻ em có phổi khỏe mạnh trong khi phẫu thuật vẫn còn khan hiếm. Bác sĩ gây mê nhi khoa cần đưa ra quyết định cá nhân liên quan đến việc điều trị cho bệnh nhân, có tính đến nhiều đặc điểm sinh lý của hệ hô hấp, thay đổi từ khi sinh ra cho đến tuổi vị thành niên, bao gồm cả thông tin thu được từ trạm gây mê (AWS). Mục tiêu chính của cài đặt thông khí cơ học là tối ưu hóa quá trình trao đổi khí trong phạm vi sinh lý. Định cấu hình cài đặt thông khí để đạt được mục tiêu này đòi hỏi sự hiểu biết và kỹ năng vượt xa việc sử dụng cài đặt trước tự động.
Từ góc độ vật lý, thông khí nhằm mục đích truyền năng lượng khí nén từ máy thở đến hệ hô hấp của bệnh nhân. Liên quan đến tổn thương phổi tiềm ẩn liên quan đến thông khí, cài đặt thông khí cơ học sẽ luôn là sự đánh đổi giữa thông khí phổi đầy đủ và áp dụng truyền năng lượng thấp nhất có thể. Đánh giá nghiêm túc các câu hỏi sau đây dựa trên các đặc điểm và hoàn cảnh của bệnh nhân có thể giúp xác định cài đặt máy thở trên cơ sở hợp lý:
- Chế độ thông khí nào là hiệu quả nhất?
- Thông khí phút có thấp như yêu cầu không?
- Phổi có mở và không căng quá mức không?
- Thành phần của khí thở có được điều chỉnh theo nhu cầu thực tế không?
Trong các chương tiếp theo, chúng tôi mong muốn giải quyết cách sử dụng thông tin do AWS cung cấp để trả lời những câu hỏi này.
CÀI ĐẶT CHẾ ĐỘ THÔNG KHÍ HIỆU QUẢ NHẤT
Từ góc độ lịch sử, các bác sĩ gây mê nhi khoa thích thông khí kiểm soát áp lực (PCV, pressure- controlled ventilation) hơn. Từ các bằng chứng sẵn có, thông khí kiểm soát thể tích (VCV, volume- controlled ventilation) đã bị tránh vì lý do không tin tưởng vào độ chính xác của áp dụng thể tích khí lưu thông và nỗi sợ áp lực đường thở cao. Như đã minh họa trước đây, các nhà sản xuất đã có những nỗ lực đầy hứa hẹn để giải quyết những thiếu sót liên quan đến độ chính xác của ứng dụng thể tích khí lưu thông. Tách khí mới và bù độ giãn nở là một trong những điều quan trọng nhất (Phần I). Liên quan đến áp lực đường thở, điều quan trọng cần nhớ là với áp lực phế nang cuối thì hít vào giống hệt nhau, VCV cho thấy áp lực đường thở đỉnh cao hơn rõ ràng so với PCV. Tuy nhiên, điều này chỉ là do chênh lệch áp lực sức cản phụ thuộc vào lưu lượng qua các đường dẫn khí phía xa ống chữ Y và do đó không làm căng phổi (xem Phần I, Hình 4). Tuy nhiên, sự không chắc chắn về áp lực hít vào “thực” sẽ tiếp tục trừ khi các nhà sản xuất AWS ngụ ý tính toán áp lực khí quản (hoặc phế nang), chẳng hạn như dựa trên các thuật toán như đã thảo luận.
Cho đến nay, không có đủ bằng chứng liên quan đến ủng hộ dạng sóng lưu lượng giảm khi hít vào (tức là PCV) so với dạng sóng lưu lượng hằng định (tức là VCV) trong môi trường chu phẫu. Tuy nhiên, lựa chọn nên nhắm mục tiêu cụ thể.
PCV xuất hiện chế độ thông khí ưu tiên nếu có khả năng rò rỉ đường thở liên quan, ví dụ, trong quá trình thông khí qua ống nội khí quản không bóng chèn hoặc mặt nạ thanh quản hoặc trong thông khí phổi riêng biệt. Trong trường hợp có rò rỉ, việc phân phối lưu lượng hít vào, cho đến giới hạn của máy thở, đảm bảo biên độ áp lực cần thiết để bơm vào thể tích khí lưu thông mục tiêu. Vì lý do này, nguyên tắc cơ học của PCV cũng là cơ sở cho hầu hết các chế độ thông khí hỗ trợ và thông khí không xâm lấn. Hơn nữa, PCV thích hợp hơn khi có nguy cơ siêu bơm phồng động. Thể tích được giữ lại (và tăng áp lực cuối kỳ thở ra) làm giảm áp lực đẩy của hơi thở tiếp theo. Áp lực hít vào đỉnh không đổi; do đó, tránh được sự gia tăng áp lực quá mức, vì nó sẽ phát triển dần dần trong VCV.
VCV có thể là một lợi thế trong các tình huống khi dự kiến có những thay đổi về độ giãn nở của hệ thống hô hấp (Crs), ví dụ như trong trường hợp bơm khí CO2 vào phúc mạc hoặc tái định vị. Thể tích khí lưu thông không đổi ở áp lực hít vào đỉnh khác nhau, tránh giảm thông khí và thể tích khí lưu thông quá mức (có thể liên quan đến chấn thương thể tích). Hơn nữa, mặc dù ít rõ ràng hơn, lưu lượng hằng định trong khi hít vào cung cấp (gần như) các điều kiện tuyến tính, do đó tạo điều kiện thuận lợi phân tích cơ học hô hấp.1
Các chế độ thông khí mới hơn hiện có, kết hợp điểm mạnh của cả hai kỹ thuật. Các chế độ này cung cấp các lợi ích của mô hình lưu lượng giảm với thể tích khí lưu thông được bảo đảm. Do đó, áp lực hít vào tối đa được tự động điều chỉnh để cung cấp thể tích khí lưu thông đã đặt, trong các phạm vi nhất định. Với những thay đổi về độ giãn nở được xác định liên tục, thông khí phế nang có thể được đảm bảo ở áp lực hít vào thấp nhất có thể. Cho đến nay, các chế độ này dường như là hiệu quả nhất để thông khí lâu dài cho trẻ sơ sinh non tháng và đủ tháng. Chế độ Đảm bảo thể tích (Volume Guarantee) (được nghiên cứu rộng rãi nhất; Drăger Medical, Đức) có thể làm giảm đáng kể tỷ lệ tử vong và chứng loạn sản phế quản phổi, tràn khí màng phổi, giảm cacbonic và nhuyễn máu quanh não thất cũng như xuất huyết não thất nghiêm trọng so với PCV.2 Các chế độ có chức năng tương đương cũng có sẵn cho thông khí chu phẫu với AWS hiện đại. Trong khi bằng chứng liên quan đến cơ học hô hấp được cải thiện khá thuyết phục ở người lớn trải qua phẫu thuật chọn lọc,3 thì bằng chứng lại kém phát triển hơn đối với thông khí trong quá trình gây mê ở trẻ em.
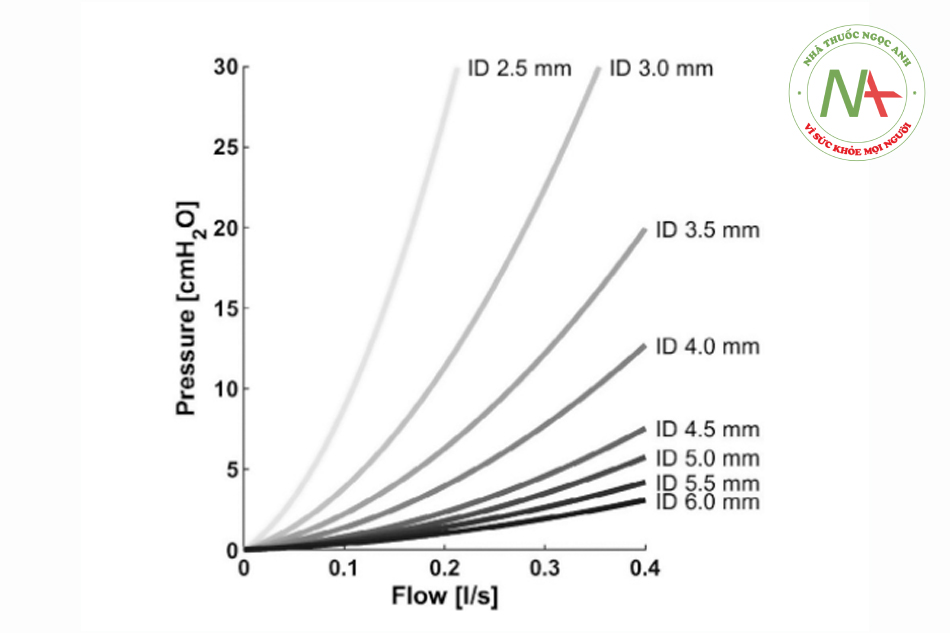
Từ quan điểm cơ sinh học, bệnh nhân được hưởng lợi từ việc hỗ trợ thở tự nhiên bằng thông khí hỗ trợ áp lực (PSV, pressure support ventilation). Trong PSV, áp lực hít vào ít nhất phải bù cho chênh lệch áp lực sức cản của đường thở nhân tạo. Vì lực cản phụ thuộc phi tuyến tính vào lưu lượng, mức bù cần thiết thay đổi đáng kể giữa các tình huống cụ thể và thậm chí trong một hơi thở. Ví dụ, ở trẻ sơ sinh, lưu lượng hít vào tối đa có thể lên tới 300 mL/s. Trong tình huống này, một ống nội khí quản có đường kính trong 4,5 mm tạo ra khoảng 5 cmH2O (Hình 1), hệ thống thở bao gồm các đầu nối khoảng 2 cmH2Ũ và hệ thống lọc khoảng 0,5 cmH2Ũ chênh lệch áp lực sức cản.4’ 5 Theo đó, một máy thở vào hỗ trợ áp lực khoảng 34 cmH2Ũ có thể bù cho khoảng 50% sức cản của đường thở nhân tạo trong ví dụ này. Cần thận trọng đối với độ nhạy kích hoạt. Sức cản đường thở nhân tạo chống lại nỗ lực kích hoạt máy thở của bệnh nhân. Do đó, nên đặt ngưỡng kích hoạt để đạt được đủ sự đồng bộ giữa máy thở và bệnh nhân (thường là khoảng 1 L/phút). Trong trường hợp không đồng bộ bệnh nhân-máy thở nghiêm trọng (ví dụ: ho ngay trước khi rút nội khí quản), áp lực đường thở dương liên tục có thể phù hợp hơn PSV để duy trì áp lực đường thở dương.
THIẾT LẬP THÔNG KHÍ PHÚT YÊU CẦU THẤP NHẤT
Đạt được thông khí phút phế nang (MV, minute ventilation) đầy đủ là thách thức chính khi thiết lập các thông số máy thở cho bệnh nhân nhi. Điều nghe có vẻ đơn giản như chỉ kết hợp hai biến số cơ bản, Vt và tần số hô hấp, hóa ra lại khó khăn trong thực hành hàng ngày. Trẻ càng nhỏ nhu cầu thông khí phế nang càng cao. Mức tiêu thụ oxy cao, khả năng khuếch tán oxy thấp và dung tích cặn chức năng thấp gây ra nhu cầu cao không tương xứng đối với MV.6 Nhu cầu thông khí phế nang bị chống lại bởi sức cản cao của hệ hô hấp, hạn chế trao đổi thể tích với tốc độ luân chuyển tăng (tức là lưu lượng). Sau khi sinh, phổi phát triển nhanh hơn đường thở6, điều này giải thích cho sức cản cao không tương xứng của hệ hô hấp (Rrs). Trên đó, tỷ lệ khoảng chết so với Vt càng làm phức tạp thêm quá trình trao đổi khí đầy đủ. May mắn thay, lượng khoảng chết giải phẫu được điều chỉnh theo trọng lượng vẫn tương đối ổn định khi lớn lên.
Trong những thập kỷ qua, bằng chứng được tích lũy liên quan đến thể tích khí lưu thông thấp làm giảm nguy cơ tổn thương phổi do máy thở ở người lớn. Những lợi ích quan sát được trong kết quả đã khuyến khích các bác sĩ lâm sàng và các nhà nghiên cứu áp dụng các khái niệm này cho cả những bệnh nhân khỏe mạnh có phổi được thở máy sau phẫu thuật. Ngày nay, người ta chấp nhận rộng rãi rằng thể tích khí lưu thông trong khoảng từ 6 đến 8 ml trên mỗi kg trọng lượng cơ thể lý tưởng (IBW) có thể làm giảm nguy cơ biến chứng phổi sau phẫu thuật (PPC, postoperative pulmonary complications), như một phần của gói biện pháp đề cập đến cái gọi là thông khí bảo vệ phổi. . Trong bối cảnh này, hóa ra rủi ro đối với PPC phụ thuộc vào một số yếu tố liên quan đến đặc điểm của bệnh nhân, bệnh đi kèm và loại phẫu thuật chẳng hạn.
Bằng chứng như vậy là khan hiếm ở bệnh nhân nhi. Kneyber và cộng sự phân tích bằng chứng về vấn đề này trong năm 2015 rất đáng đọc. Các tác giả kết luận rằng cài đặt thông khí cho trẻ em hầu như không được hỗ trợ bởi bất kỳ bằng chứng khoa học nào và do đó, Vt phải gần với phạm vi sinh lý (5-8 mL/kg IBW).6 Tuy nhiên, vào năm 2017, Hội nghị đồng thuận về thông khí cơ học cho trẻ em (PEMVECC) đã công bố các khuyến nghị về thở máy cho trẻ em bị bệnh nặng, trong đó có tuyên bố rằng Vt nên đặt dưới 10 ml/kg IBW.7 Giá trị này cũng nên được phản ánh dưới ánh sáng của các nguồn hoặc lỗi tiềm ẩn. Đầu tiên, đo lường thể tích trong AWS bao gồm một dung sai nhất định có thể dẫn đến lỗi liên quan, đặc biệt là ở Vt rất nhỏ; thứ hai, sự thay đổi giữa các đối tượng về các đặc điểm chức năng của hệ hô hấp có thể ở mức độ đáng kể ở trẻ em. Ở trẻ 5 tuổi, dung tích sống gắng sức (FVC) được coi là “bình thường” trong khoảng 70%-130% giá trị dự đoán. Phạm vi này giảm dần cho đến khi 15 tuổi, nhưng sau đó vẫn lên tới 80%-120%; thứ ba, việc tính toán IBW ở trẻ em thiếu bằng chứng, nếu được thực hiện trên lâm sàng. Các mốc Vt đã cho giả định hiệu chỉnh theo tổng dung tích phổi của từng bệnh nhân. Chiều cao, và do đó là IBW, được chấp nhận là đại diện thay thế sơ bộ cho TLC. Tuy nhiên, các nghiên cứu so sánh các phương pháp tính IBW cho thấy trọng lượng cơ thể thực tế và IBW có thể khác nhau đáng kể ở trẻ em.8’ 9 Do đó, việc tính toán IBW chỉ nên giới hạn ở trẻ em trên 2 tuổi.9 Mặc dù không có phương trình tiêu chuẩn vàng cho tính toán IBW ở trẻ em, Ward và cộng sự nhận thấy phương pháp McLaren-Read phù hợp, ở trẻ em mắc PARDS từ 2 đến 10 tuổi và đặc biệt là ở trẻ em trên 10 tuổi, nơi có sự khác biệt rõ rệt nhất giữa các phương pháp tính toán khác nhau.10 Các tác giả kết luận rằng phương pháp McLaren-Read tương đối dễ tính bằng cách sử dụng các biểu đồ tăng trưởng có sẵn để so sánh cân nặng và chiều cao theo độ tuổi của trẻ. AWS hiện đại có thể phù hợp để tính toán các thuật toán phức tạp như vậy và hiển thị IBW được điều chỉnh theo độ tuổi, nhằm tăng độ chính xác.
Đặt Vt thích hợp ở trẻ sơ sinh non tháng và đủ tháng cần được chú ý đặc biệt do dễ bị hội chứng suy hô hấp. Ở trẻ sơ sinh khỏe mạnh, thể tích khí lưu thông trung bình là 4 – 6 ml/kg với mục tiêu thông khí phút là 0,2-0,3 L/phút/kg.11 T óm lại, PEEP và thông khí nhắm mục tiêu thể tích nên được tiếp tục nếu có thể và nên áp dụng thận trọng vô tình làm căng quá mức phổi.12’13
Biến số khác ảnh hưởng đến MV là tần số hô hấp (RR, respiratory rate). Cài đặt RR ít được thảo luận nghiêm túc hơn nhiều so với cài đặt Vt. Từ quan điểm thực tế’ một khi Vt được điều chỉnh theo đặc điểm cá nhân của bệnh nhân, RR được đặt thành nhiều Vt cho đến khi đạt được MV mong muốn. AWS hiện đại cho phép đặt thời gian hít vào thấp nhất là 0,2 giây. Điều này tương ứng với thời gian hít vào sinh lý của trẻ sơ sinh khỏe mạnh, khoảng 0,2-0,4 giây.11 Tuy nhiên, RR cao hơn làm tăng thông khí tích lũy trong khoảng chết, điều này chống lại mục tiêu thông khí phế nang đầy đủ. Với phạm vi tương đối tự do đối với Vt điều chỉnh theo cân nặng, bác sĩ lâm sàng có thể được khuyến khích điều chỉnh RR về giới hạn thấp hơn. Việc xem xét hằng số thời gian của hệ thống hô hấp (Tau = Crs X Rrs) có thể giúp ích cho vấn đề này. Ở trẻ em có hằng số thời gian khá dài (sức cản đường thở cao), RR thấp sẽ thích hợp hơn. Ngược lại, ở trẻ em có biểu hiện hằng số thời gian khá ngắn (độ giãn nở thấp, ví dụ, trong hội chứng suy hô hấp), phổi trống rỗng nhanh hơn (so sánh Phần I, Hình 3 và 4); do đó, RR cao có thể được áp dụng để đạt đủ MV.
Việc thiết lập tỷ lệ hít vào và thở ra thích hợp có thể dựa trên cấu hình lưu lượng thở ra. Có thể giả định rằng hít vào hoàn toàn và thở ra hoàn toàn nếu lưu lượng giảm tốc xấp xỉ bằng không ở cuối mỗi giai đoạn của hơi thở (Hình 2). Việc điều chỉnh thời gian thở ra chỉ để đảm bảo thở ra hoàn toàn sẽ hạn chế thời gian hệ thống hô hấp nghỉ ngơi ở áp lực thấp nhất trong chu kỳ thở (nghĩa là áp lực dương cuối thì thở ra) ở mức tối thiểu, do đó ngăn ngừa tình trạng mất huy động khí của phổi do xẹp phế nang. Hơn nữa, trong PCV, việc thiết lập khoảng thời gian thở ra có lợi cho thời gian hít vào đảm bảo phát triển thể tích khí lưu thông tốt nhất khi thời gian cân bằng được kéo dài. Điều này đặc biệt đúng ở RR cao và Tau dài.
Nghiên cứu gần đây đặt câu hỏi RR là một yếu tố độc lập góp phần vào VILI.14 Theo cách tiếp cận toàn diện này, năng lượng được truyền từ máy thở đến hệ hô hấp của bệnh nhân được tính toán. Tuy nhiên, cho đến nay, tác động của RR đối với các biến chứng phổi vẫn chưa rõ ràng.
ĐẠT ĐƯỢC TÌNH TRẠNG HUY ĐỘNG PHU HỢP
Khi xem xét việc mở phổi, người ta phải phân biệt giữa hai hiện tượng, huy động/giảm huy động trong chu kỳ thở và xẹp phổi. Trong khi phần đầu tiên mô tả sự mở và đóng lặp đi lặp lại của mô phế nang, thì phần thứ hai đề cập đến sự xẹp xuống ít nhiều của phế nang và do đó dẫn đến vùng shunt, không góp phần vào quá trình trao đổi khí.
Cho đến nay, hầu hết trẻ em đều bị xẹp phổi trong quá trình gây mê. Thủ thuật huy động phổi được cho là đảo ngược tình trạng xẹp phế nang. Tuy nhiên, do huy động áp lực trong lồng ngực thường cao, các thủ thuật có thể làm suy giảm huyết động. Ở người lớn, áp lực hít vào cao nhất khoảng 40 cmH2O (và khoảng 50 cmH2O ở người béo phì) được coi là hiệu quả, trong khi áp lực đường thở hít vào ở trẻ em có thể thấp hơn. Lý do là do lồng ngực của trẻ em có tính đàn hồi cao, áp lực trong phổi được phân bố theo tỷ lệ cao hơn đối với áp lực xuyên phổi và một tỷ lệ nhỏ hơn đối với áp lực xuyên lồng ngực so với người lớn.
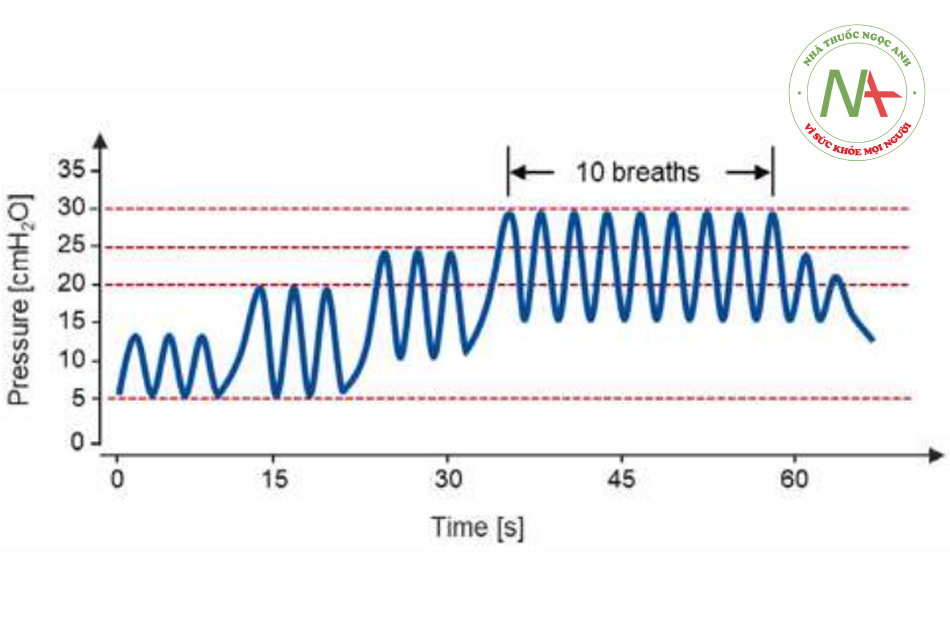
Ở trẻ em từ 6 tháng đến 7 tuổi, việc tăng PEEP để đạt được áp lực hít vào là 30 cmH2O trong PCV (Hình 3) đã ngăn ngừa hiệu quả tình trạng xẹp phổi ở phần lớn bệnh nhân trong quá trình phẫu thuật nội soi. Trong 47 bệnh nhân tham gia nghiên cứu, không quan sát thấy các biến cố huyết động liên quan.15 Ngay cả áp lực hít vào cao nhất là 22 cmH2O (10 cmH2O PEEP + 12 cmH2O áp lực đẩy) cũng có hiệu quả, khi áp dụng ở các vị trí cơ thể đối diện nhau (90 giây mỗi bên).16
Huy động phổi thành công có thể được phát hiện từ hình ảnh, phân tích cơ học hệ hô hấp hoặc từ việc giảm khoảng chết giải phẫu. Crs tăng lên, và với một capnography thể tích được áp dụng, phương trình Bohr cho phép tính gần đúng mức giảm khoảng chết, tương quan với việc thông khí phổi được cải thiện (Phương trình 1).
VD = VT x ((PaCO2 -PexpCO2)/PaCO2) (1)
Các thao tác huy động phổi dường như có hiệu quả để giải quyết tình trạng xẹp phổi cấp tính, ví dụ, do khởi mê gây mê hoặc sau khi ngắt kết nối hệ thống thở. Tuy nhiên, trong quá trình thở máy đang diễn ra, một nghiên cứu từ nhóm của chúng tôi không tìm thấy tác động kéo dài nào của các thao tác huy động đối với độ giãn nở hoặc tình trạng huy động của phổi.17 Để làm cho hiệu quả của thao tác huy động trở nên bền vững hơn, nên đặt mức PEEP thích hợp được áp dụng sau đó.
Mặc dù việc sử dụng thể tích khí lưu thông thấp được chấp nhận rộng rãi, vấn đề thiết lập PEEP tối ưu vẫn chưa được giải quyết, đặc biệt ở bệnh nhân nhi. PEEP được cho là nẹp đường thở và do đó để ngăn chặn sự sụp đổ và mở lại các phế nang. Khi xem xét cơ sở sinh lý của cài đặt PEEP, cần phải xem xét rằng thể tích đóng ở trẻ sơ sinh cao hơn dung tích cặn chức năng.
Trong các nghiên cứu của chúng tôi, chúng tôi thấy rằng huy động/mất huy động theo chu kỳ thở thường xảy ra ở trẻ nhỏ hơn so với trẻ lớn hơn và các thao tác huy động không cho thấy bất kỳ tác dụng kéo dài nào trong một trong các nghiên cứu của chúng tôi.17’ 18 Đặc biệt, mức PEEP tăng vừa phải lên đến 7 cmH2Ũ không giải quyết đáng kể việc huy động/mất huy động theo chu kỳ thở, trái ngược với bệnh nhân người lớn. Điều này cho thấy khả năng không thể huy động được về mặt sinh lý là một đặc điểm của phổi đang phát triển và do đó có thể không nhất thiết gây bất lợi. Điều này được hỗ trợ bởi một nghiên cứu ban đầu cho thấy rằng sự xuất hiện của việc đóng đường thở ở giai đoạn cuối xảy ra trong quá trình thở bình thường ở trẻ nhỏ hơn.19
Trong trường hợp không có bằng chứng liên quan đến kết quả đối với các chiến lược PEEP, việc điều chỉnh PEEP dựa trên các cân nhắc về sinh lý có vẻ hợp lý. Do các kỹ thuật hình ảnh và phân tích phức tạp về cơ chế hệ thống hô hấp không có sẵn trong môi trường lâm sàng thông thường, nên các thao tác thay đổi PEEP có thể được sử dụng để tìm ra PEEP tối ưu. Giảm thiểu áp lực đẩy hiện đang được thảo luận là mục tiêu hướng dẫn cài đặt thông khí,20 mặc dù bản thân biện pháp này không thể truy cập được dưới dạng biến kiểm soát của thông khí cơ học. Áp lực đẩy là kết quả của việc chia thể tích khí lưu thông theo độ giãn nở.21 vẫn là nhằm gián tiếp nhắm đến áp lực đẩy thấp: Crs có thể thay đổi với PEEP, đặc biệt nếu PEEP có liên quan đến việc huy động mô phổi. Do đó, PEEP có thể được thiết lập với mục đích cải thiện độ giãn nở. Một phương pháp đã được chứng minh là hợp lệ về vấn đề này là đặt PEEP sau thử nghiệm PEEP giảm dần.22 Đối với điều này, PEEP tối đa được đặt và giảm dần từng bước. Nếu độ giãn nở giảm đáng kể với một bước PEEP nhất định, PEEP sẽ được đặt trở lại giá trị trước đó. Bằng cách này, độ giãn nở cao nhất đạt được. Kết quả là, trong vcv, áp lực đẩy thấp nhất sẽ dẫn đến một thể tích khí lưu thông nhất định và trong PCV, thể tích khí lưu thông cao nhất sẽ dẫn đến một biên độ áp lực nhất định, sau đó có thể cho phép giảm áp lực hít vào đỉnh.
THÀNH PHẦN KHÍ THỞ THEO NHU CẦU THỰC TẾ
Thiết lập nồng độ oxy hít vào thích hợp (FiO2) trong tình huống là một nhiệm vụ đầy thách thức. Nó đòi hỏi phải xem xét cẩn thận nhu cầu thực tế của bệnh nhân, dự trữ an toàn cho những gì sắp xảy ra và các tác dụng phụ có thể xảy ra của oxy. Mức tiêu thụ oxy của trẻ dưới 3 tuổi thở tự nhiên phụ thuộc vào diện tích bề mặt cơ thể và nhịp tim, do đó tăng từ khoảng 130 đến 190 ml/(phút X m2) theo tuổi. Ở trẻ em từ 3 tuổi trở lên, mức tiêu thụ oxy lại giảm nhẹ xuống còn khoảng 160 ml/(phút X m2) với giới tính cũng là một yếu tố quan trọng.23 Ai cũng biết rằng do nhu cầu cao nhưng FRC tương đối thấp, bể chứa của oxy phổi chỉ tồn tại trong vài giây khi tưới máu phổi đủ. T uy nhiên, nồng độ oxy cao có khả năng gây hại ở bệnh nhân ở mọi lứa tuổi, gây ra các tác động tiêu cực như tổn thương mao mạch phổi, nhồi máu cơ tim và stress oxy hóa. Ngoài ra, cần nhớ rằng stress oxy trong phổi ảnh hưởng trực tiếp đến sức cản mạch máu phổi, điều này có thể liên quan đến bệnh nhân mắc bệnh tim bẩm sinh. Đặc biệt ở trẻ sơ sinh non tháng và đủ tháng, nồng độ oxy cao có thể làm trầm trọng thêm bệnh lý võng mạc (do khả năng tân sinh mạch máu) và chứng loạn sản phế quản phổi.24
Trong quá trình khởi mê, nồng độ oxy cao thường được xem xét để có thời gian trong trường hợp quản lý đường thở khó khăn. FiO2 tối ưu không được biết; tuy nhiên, nồng độ oxy cao (FiO2 > 80%) trong quá trình khởi mê và duy trì mê có thể làm giảm thể tích phổi sau phẫu thuật và thúc đẩy sự không đồng nhất của thông khí.25 Nếu một đứa trẻ chịu được quá trình tiền oxygen hóa (preoxygenation) bằng thở tự nhiên thông qua bộ dây thở, thì quá trình oxygen hóa có thể được coi là đủ nếu cuối thì thở ra nồng độ oxy cao hơn 70% (với FiO2 được đặt ở mức 80%) hoặc 90% (với FiO2 được đặt ở mức 100%),25 với hiển thị thường xuyên của capnography cho thấy phép đo khí đáng tin cậy. Ở nồng độ oxy trong phạm vi đó, có khả năng xảy ra hiện tượng xẹp phổi tái hấp thu,26 tuy nhiên, điều này có thể được đảo ngược một cách hiệu quả bằng cách áp dụng thủ thuật huy động phổi và thông khí bằng PEEP sau đó.15
Ngay khi đường thở được bảo đảm, FiO2 nên được hạ xuống mức tối thiểu cần thiết. Thay vì đề xuất một giá trị toàn cầu, được áp dụng phổ biến, nên theo dõi việc cung cấp oxy để hướng dẫn chuẩn độ FiO2. Nếu có sẵn, áp lực riêng phần oxy trong động mạch (PaO2) < 60 mmHg tạo thành một mốc để tăng nồng độ oxy trong khí hít vào (trong số các biện pháp khác).24 Thường xuyên hơn, độ bão hòa oxy (SpO2) có sẵn như một thông số thay thế được đo không xâm lấn cho nồng độ oxy trong máu. Các giá trị SpO2 thấp tới 95% (xấp xỉ tương ứng với PaO2 là 60-80 mmHg ở pH, nhiệt độ và carbon dioxide bình thường) có thể được chấp nhận khi không có bệnh phổi.6 Ở trẻ sơ sinh khỏe mạnh, các giá trị SpO2 ban đầu thường là được chấp nhận trong khoảng 85%-95%.27 Tuy nhiên, liên quan đến việc theo dõi nồng độ oxy cao, phép đo SpO2 có những hạn chế vì nó không thể phản ánh việc cung cấp oxy phế nang vượt quá nhu cầu của huyết sắc tố bão hòa hoàn toàn. Do đó, nên giảm FiO2 định kỳ để đánh giá nồng độ oxy hít vào cần thiết để đạt đủ độ bão hòa oxy.12
Để tối đa hóa lợi ích của hệ thống khí thở lại của AWS, lưu lượng khí tươi phải càng thấp càng tốt. Gây mê lưu lượng tối thiểu (< 0,5 L/phút) chủ yếu mang lại lợi thế về kinh tế và sinh thái khi sử dụng các thuốc gây mê bay hơi.28 Ý nghĩa liên quan đến khí hậu hóa (sưởi ấm (>28°C) và độ ẩm (17 và 30 mg H2O/L )) của không khí lưu thông đã giảm với sự ra đời của các bộ trao đổi nhiệt và độ ẩm. Khi gây mê lưu lượng tối thiểu với FiO2 được chuẩn độ để cung cấp oxy tối thiểu cần thiết, nên thận trọng nếu nhu cầu oxy tăng đột ngột. Như đã thảo luận trong Phần I của bài viết này, việc tăng nồng độ oxy trong hệ thống thở có thể tốn thời gian, tùy thuộc vào thể tích hệ thống thở của AWS và tốc độ thông khí phút của bệnh nhân.
TÓM TẮT
Cho đến nay, không có khuyến cáo nào về cài đặt thông khí ở bệnh nhân nhi có thể được xác định với độ chính xác đầy đủ. Các đặc điểm thay đổi của hệ hô hấp đang phát triển và hoàn cảnh của bối cảnh phẫu thuật cũng như các bệnh đi kèm của từng cá nhân đều ảnh hưởng đến quyết định đúng đắn tại một thời điểm cụ thể. Hình 4 cung cấp một hướng dẫn nhanh về thực hành lâm sàng thông thường để tiếp cận các cài đặt máy thở tốt nhất cho từng cá nhân.
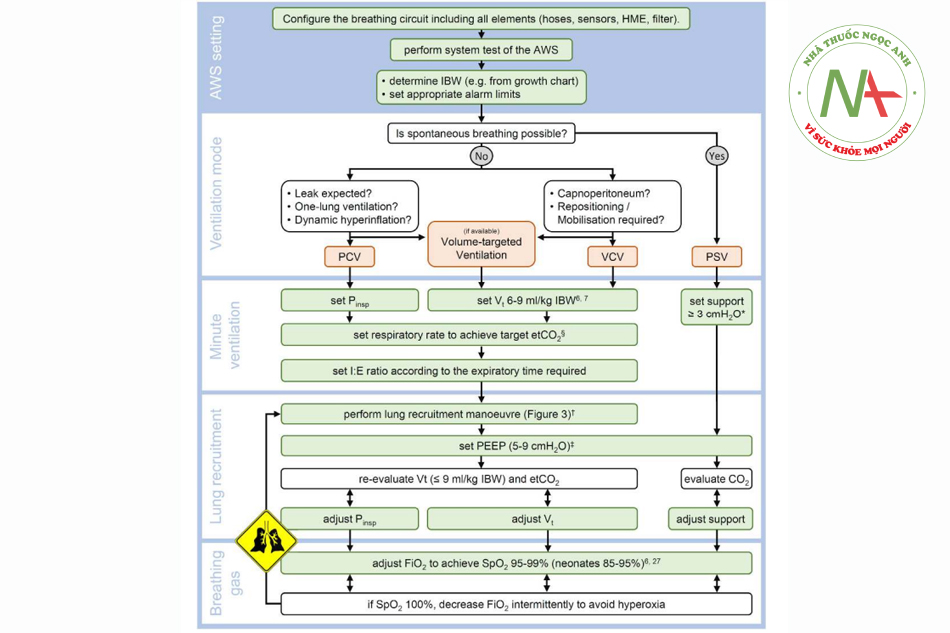
Cần lưu ý rằng cài đặt máy thở phải giải quyết được sức cản đường thở cao, thông khí phút đó có thể dựa trên thể tích khí lưu thông cao hơn một chút so với ở người lớn và PEEP là bắt buộc do khả năng đóng cao. Cần thận trọng khi đặt áp lực thở vào cao, vì điều này đặc biệt tải áp lực xuyên phổi. Điều chỉnh tỷ lệ hít vào và thở ra để đạt được trao đổi thể tích tối đa ở một áp lực đường thở nhất định và áp dụng các thao tác huy động khi cần thiết, tạo khung cho cài đặt máy thở chu đáo (tinh vi).
=> Tham khảo: Hệ thống hút nội khí quản mở và đóng ảnh hưởng khác nhau đến chức năng phổi ở các đối tượng được thông khí cơ học.
CÂU HỎI PHẢN HỒI
- Trong hoàn cảnh lâm sàng nào, thông khí kiểm soát thể tích có thể được coi là thuận lợi?
- Có thể tính toán thể tích khí lưu thông tối ưu dựa trên cơ thể lý tưởng ở mọi lứa tuổi không?
- Lợi ích của việc tăng thời gian hít vào là gì?
- Áp lực hít vào thích hợp cho thủ thuật huy động phổi ở trẻ khỏe mạnh là bao nhiêu?