Bệnh thận - tiết niệu
Đột tử trên bệnh nhân chạy thận nhân tạo: Nguyên nhân và xử trí
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Biên dich; Bác sĩ Võ Hà.
Để tải bài viết Đột tử trên bệnh nhân chạy thận nhân tạo: Nguyên nhân và xử trí PDF mời các bạn click vào link ở đây.
Tóm tắt
Cần phân biệt thuật ngữ Sudden cardiac death (đột tử do tim) và Sudden cardiac arrest (ngưng tim đột ngột).
Rối loạn nhịp chậm là loại loạn nhịp thường gây tử vong nhiều nhất ở bệnh nhân chạy thận nhân tạo.
Có mối liên quan giữa thời điểm xảy ra đột tử và thời gian chạy thận nhân tạo, tần suất cao nhất ở 2 thời điểm: một là thời điểm cuối của khoảng thời gian nghỉ chạy thận dài nhất trong tuần (tăng kali máu), hai là ngay sau ngày chạy thận đầu tiên trong tuần (hạ kali máu). Vì vậy, kiểm soát nồng độ K+ máu là mục tiêu điều trị hàng đầu ở bệnh nhân chạy thận nhân tạo để phòng ngừa đột tử và ngưng tim.
Quá trình chạy thận sẽ thay đổi nồng độ nhiều loại điện giải (K+, Ca2+, Mg2+) và cân bằng toan kiềm (bicarbonate) của cơ thể nên dễ gây rối loạn nhịp. Vì vậy, lựa chọn và điều chỉnh nồng độ điện giải trong dịch thẩm tách có vai trò quan trọng trong phòng ngừa ngưng tim và đột tử trên bệnh nhân chạy thận nhân tạo.
Huấn luyện hồi sinh tim phổi cho NVYT tại đơn vị lọc máu giúp cải thiện tiên lượng cho những bệnh nhân chạy thận nhân tạo khi có ngưng tim xảy ra trong lúc chạy thận.
Các bằng chứng về tác dụng phòng ngừa đột tử cho bệnh nhân chạy thận nhân tạo của các loại thuốc tim mạch (ACEI/ARB, CCB, chẹn beta…) chưa rõ ràng, một phần vì dân số chạy thận nhân tạo là tiêu chuẩn loại trừ trong các nghiên cứu.
Quyết định đặt máy ICD trên bệnh nhân chạy thận nhân tạo có phân suất tống máu giảm để phòng ngừa đột tử cần cân bằng giữa lợi ích-nguy cơ.
Tổng quan
Đột tử do tim (Sudden cardiac death-SCD) là nguyên nhân tử vong chủ yếu ở bệnh nhân bệnh thận mạn giai đoạn cuối (end-stage kidney disease, ESRD). Rất khó để ước đoán tỷ lệ tử vong do SCD vì các nghiên cứu trên bệnh nhân ESRD thường tính luôn ngưng tim đột ngột (Sudden cardiac arrest, SCA) trong lúc chạy thận nhân tạo (CTNT). Mục đích của ERA-EDTA là xem lại y văn hiện tại về các nguyên nhân gây SCD ngoài lúc CTNT và SCA trong lúc CTNT trên bệnh nhân ESRD và các biện pháp để làm giảm tỷ lệ tử vong do các biến cố trên. SCD ngoài lúc CTNT và SCA trong lúc CTNT là những tình huống lâm sàng khác nhau cần được phân biệt. Về vấn đề này, đối với bệnh nhân SCA trong lúc CTNT, một số yếu tố nguy cơ thay đổi được đã được xác định, ví dụ nồng độ kali và calci thấp trong dịch thẩm tách, và một số ưu điểm đã được chứng minh của việc có sẵn máy khử rung tim ngoài cơ thể tự động (automated external defibrillators, AED) trong các đơn vị lọc máu. SCD ngoài lúc CTNT thì phức tạp hơn. SCD liên quan đến giảm phân suất tống máu thất trái chỉ xuất hiện ở một số rất ít bệnh nhân CTNT định kì. Đây là bằng chứng cho thấy SCD ở bệnh nhân ESRD có nhiều đặc điểm khác so với SCD ở bệnh nhân thiếu máu cơ tim và/hoặc suy tim mà không có ESRD. Các bằng chứng gần đây cho thấy rối loạn nhịp dẫn đến tử vong trên những bệnh nhân này thường do nhịp chậm hơn là nhịp nhanh. Điều này có thể giải thích tại sao nhiều nghiên cứu không chứng minh được ưu điểm của cấy máy tạo nhịp phá rung (Implantable cardioverter defibrillator, ICD) để phòng ngừa SCD cho bệnh nhân ESRD. Rối loạn điện giải – điều thường gặp ở bệnh nhân CTNT – có thể giải thích nguyên nhân các trường hợp rối loạn nhịp do có mối liên quan giữa SCD và thời điểm CTNT. Tuy nhiên, tỉ lệ SCD cao ở bệnh nhân thẩm phân phúc mạc (TPPM) gợi ý rằng các yếu tố nguy cơ khác do các bệnh tim mạch đồng mắc và tăng ure huyết có thể góp phần gây đột tử ở bệnh nhân ESRD.
Keywords: dialysate, end-stage kidney disease, implantable cardiac device, sudden cardiac arrest, sudden cardiac death
Dẫn nhập
Đột tử do tim (SCD) được định nghĩa là tử vong không mong muốn do các nguyên nhân từ tim ở bệnh nhân đã biết hoặc không biết có bệnh lý tim mạch trước đó, khởi phát triệu chứng trong vòng 1 giờ (SCD được chứng kiến) hoặc trong vòng 24 giờ từ thời điểm cuối cùng thấy bệnh nhân còn sống (SCD không được chứng kiến). Vì xác định nguyên nhân tử vong tùy thuộc vào người chẩn đoán, nên SCD có thể bị phân loại nhầm [1].
SCD là nguyên nhân tử vong hàng đầu trong dân số chung, chiếm tới 15% các trường hợp tử vong [2]. SCD được cho là nguyên nhân tử vong quan trọng ở bệnh nhân ESRD [3], nhưng rất khó để ước đoán tỷ lệ tử vong do SCD vì các nghiên cứu về tần suất tử vong do SCD trên bệnh nhân ESRD thường tính luôn SCA trong lúc CTNT. Tuy nhiên, SCD ngoài lúc CTNT và SCA trong lúc CTNT là những tình huống lâm sàng khác nhau cần được phân biệt. Trên thực tế, bản thân việc CTNT đã có thể thúc đẩy khởi phát các rối loạn nhịp đe dọa tính mạng, bên cạnh các vấn đề lâm sàng khác của bệnh nhân. Hơn nữa, hạ huyết áp và ngất là tình huống khá phổ biến trong lúc CTNT và liên quan đến nhiều yếu tố nguy cơ [4, 5]. Khi đó nhân viên y tế (NVYT) cần can thiệp ngay lập tức để chẩn đoán kịp thời và phân biệt chúng với SCA. Mục đích của European Dialysis (EUDIAL) Working Group là lược lại y văn hiện nay nhằm khảo sát các nguyên nhân của SCD ngoài CTNT và SCA trong CTNT trên bệnh nhân ESRD và các chiến lược xử trí nhằm giảm thiểu tần suất các biến cố trên.
Dịch tễ của SCD và SCA trong CTNT ở bệnh nhân ESRD
Dựa vào Hệ thống Dữ liệu về Bệnh thận của Hoa Kì (USRDS), loạn nhịp và ngưng tim là nguyên nhân tử vong độc lập lớn nhất, chiếm gần 78% nguyên nhân tử vong do tim mạch, chiếm 40% trường hợp tử vong đã biết nguyên nhân trên bệnh nhân CTNT [3]. So với bệnh nhân TPPM, bệnh nhân mới CTNT trong vòng 3 tháng có tỉ lệ SCD cao hơn ~50%, dù tỉ lệ này bằng nhau sau 2 năm [3]. Mặc dù SCD gây tử vong đáng kể ở bệnh nhân ESRD, điều ngạc nhiên là số bệnh nhân tử vong do SCD khi đang chạy thận lại không cao, dù tỉ lệ phì đại thất trái và xơ vữa mạch vành và bệnh xơ vữa động mạch ở bệnh nhân CTNT cao và quá trình CTNT gây ra những biến đổi trong tưới máu cơ tim và điện giải. Karnik và cs [6] báo cáo tỉ lệ SCA trong CTNT là 7.0/100000 lượt CTNT, trong khi đó tỉ lệ là 4.5 trên 100000 lượt trong nghiên cứu của Pun và cs [7]. Vì vậy tần suất của nó tương đối thấp, nhưng tiên lượng của SCA khi đang chạy thận là rất xấu. Karnik và cs [6] quan sát chỉ 40% bệnh nhân được hồi sức thành công và vẫn sống sót sau 2 ngày. Trong số 60% tử vong sau ngưng tim trong vòng 48 giờ, 13% là tử vong ngay trong đơn vị lọc máu.
Sinh lý bệnh cảu SCD và SCA trong CTNT ở bệnh nhân ESRD
Khi tiếp cận một bệnh nhân đột tử nghĩ do nguyên nhân tim mạch (SCD), không dễ để xác định loại loạn nhịp nào gây tử vong. Vì vậy kết quả ECG lần đầu ghi nhận nhịp chậm vô tâm thu không thể đoán được nó là nguyên nhân của SCD hay là hậu quả của một cơn rung thất (ventricular fibrillation, VF). Vấn đề này chỉ được giải quyết khi có thiết bị [vd, Holter ECG, máy ghi điện tim cấy trong cơ thể (ILR)] lưu lại diễn tiến [8].
Ở thời điểm SCD, loại loạn nhịp dễ ghi nhận nhất ở bệnh nhân tim mạch là VF [9, 10]. Tuy nhiên, Cobb và cs [11] gợi ý rằng cơn VF là nguyên nhân của đột tử chiếm tỉ lệ thấp hơn so với suy nghĩ trước giờ. Loại loạn nhịp tim nào gây tử vong ở bệnh nhân CTNT bị đột tử vẫn chưa được biết rõ. Nghiên cứu của Wan và cs [12] cho thấy 78.6% trường hợp SCA ở 75 bệnh nhân CTNT có đeo máy khử rung tim (Wearable cardioverter defibrillator) là do nhịp nhanh thất (ventricular tachycardia, VT) hoặc VF và chỉ 21.4% là do vô tâm thu. Phân suất tống máu thất trái (LVEF) trung bình trong dân số nghiên cứu là 27.4%, với <19% bệnh nhân có LVEF >35%. Một nghiên cứu sau đó trên bệnh nhân CTNT có đặt máy theo dõi nhịp tim ghi nhận được 8 trường hợp SCD không đoán trước được do nhịp chậm vô tâm thu nghiêm trọng. Trong dân số này, một trong các tiêu chuẩn loại trừ là bệnh nhân có LVEF <35% [13]. Quan niệm SCD chủ yếu do rối loạn nhịp chậm được củng cố bởi 2 nghiên cứu gần đây trên bệnh nhân CTNT có cấy máy ILR. Sacher và cs
[14] nghiên cứu trên 71 bệnh nhân CTNT (theo dõi trong 21 tháng), ghi nhận được 4 ca SCD trên bệnh nhân đái tháo đường do nhịp chậm tiến triển dẫn đến vô tâm thu. 3 trong 4 trường hợp trên có LVEF >50% (1 trường hợp không rõ LVEF bao nhiêu). Hơn nữa, Roy-Chaudhury và cs [15] ghi nhận 14 trường hợp vô tâm thu và chỉ có 1 ca là VT bền bỉ trên 66 bệnh nhân người trẻ CTNT có đặt máy ILR được theo dõi trong 6 tháng. Các rối loạn nhịp trên không gây tử vong. 86% bệnh nhân rối loạn nhịp biểu hiện rõ trên lâm sàng có đái tháo đường và có LVEF trung bình là 55%. Nhiều tác giả cho rằng có mối liên hệ giữa thời điểm xảy ra SCD và thời gian CTNT, tần suất cao nhất ở 2 thời điểm: một là ở thời điểm cuối của khoảng thời gian nghỉ chạy thận dài nhất trong tuần ( Longer interdialytic interval, LIDI), hai là ngay sau ngày chạy thận đầu tiên trong tuần [16, 17]. Nghiên cứu của Wong và cs [13] kết luận rằng nguy cơ SCD cao hơn trong giai đoạn LIDI. Ngoài ra, tất cả các biến cố được Sacher và cs [14] ghi nhận và các rối loạn nhịp biểu hiện trên lâm sàng được mô tả trong nghiên cứu của Roy- Chaudhury và cs [15] xảy ra nhiều nhất trong 12 tiếng cuối của LIDI. Không có nghiên cứu nào đưa ra bằng chứng về mối liên quan giữa nồng độ điện giải và thời điểm xảy ra tử vong. Tuy nhiên, nghiên cứu của Sacher và cs [14] cho thấy nguy cơ cao rối loạn dẫn truyền có liên quan đến nồng độ K+ >5.0 mmol/L và nguy cơ cao rối loạn nhịp thất liên quan đến nồng độ K+ <4.0 mmol/L. Các nghiên cứu dịch tễ gợi ý rằng có mối liên hệ quan trọng giữa tăng kali máu trước chạy thận và SCD [17, 18]. Kết hợp tất cả các bằng chứng trên, chúng tôi giả thuyết rằng ở ngày chạy thận đầu tiên trong tuần, bệnh nhân CTNT có nồng độ K+ máu giảm đột ngột, trong khi đó ở thời điểm cuối của LIDI bệnh nhân lại có nồng độ K+ máu cao và toan hóa máu. Cả hai tình huống trên đều có thể đưa đến bất ổn điện thế tim, là nguy cơ tiềm tàng của rối loạn nhịp đe dọa tính mạng (VF hoặc rối loạn nhịp chậm kèm vô tâm thu). Tuy nhiên, các yếu tố nguy cơ khác do bệnh tim mạch đồng mắc và hội chứng tăng ure huyết, tự chúng đã có thể góp phần gây đột tử ở bệnh nhân ESRD. Thực tế, những bệnh nhân TPPM dù không có sự thay đổi điện giải đột ngột cũng có tỉ lệ SCD cao [19]. TPPM ít gây biến động hơn so với CTNT: nó chỉ gây ra những biến đổi nhẹ, từ từ và liên tục tùy theo phương thức TPPM. Vì vậy rất khó để nhận biết mối quan hệ nhân quả giữa điều trị thực sự và SCD do điều trị.
Tuy nhiên, nguy cơ tử vong do nồng độ K+ máu bất thường ở bệnh nhân TPPM thậm chí có thể cao hơn so với bệnh nhân CTNT vì bệnh nhân TPPM có nguy cơ cao hạ kali máu, tình huống này có thể gây loạn nhịp nhanh nguy hiểm [20]. Có mối liên quan giữa SCD và bệnh nhân TPPM có LVEF giảm kèm nồng độ pro-BNP và troponin T cao, gợi ý vai trò quan trọng của suy tim và bệnh tim thiếu máu cục bộ là các yếu tố liên quan đến tăng tỷ lệ đột tử trên dân số này [21]. Một số bệnh tim mạch đồng mắc có liên quan đến SCD trên bệnh nhân CTNT. Đặc biệt, bệnh nhân CTNT có hội chứng ngưng thở khi ngủ (Obstructive sleep apnoea, OSA) có nguy cơ SCD cao hơn đối với những người không có OSA sau khi đã điều chỉnh các yếu tố gây nhiễu [22]. Hơn nữa, những bệnh nhân CTNT hẹp van động mạch chủ nặng không thay van có nguy cơ SCD đặc biệt cao. [23].
Tóm lại, cả rối loạn nhịp chậm và nhanh đều có thể gây SCD ở bệnh nhân ESRD. Các dữ liệu gần đây gợi ý rằng rối loạn nhịp chậm là nguyên nhân thường gặp nhất gây tử vong trên bệnh nhân CTNT và cho thấy mối liên quan giữa SCD và thời điểm CTNT. Bệnh nhân đái tháo đường dường như dễ tử vong do SCD dù LVEF bình thường, vì vậy cần được theo dõi sát.
Hơn 1 thập kỉ trước, Davis và cs [24] mô tả 110 trường hợp SCA trong lúc CTNT ở các trung tâm lọc máu, trong đó có 10, 72 và 20 ca xảy ra lần lượt trước, trong và ngay khi kết thúc quá trình CTNT. Phần lớn các trường hợp xảy ra trong và sau khi CTNT, loại rối loạn nhịp đầu tiên được ghi nhận là VF (67%) hoặc cơn nhanh thất (85%), trong khi các trường hợp khác là hoạt động điện vô mạch hoặc vô tâm thu trên ECG. Chỉ 46% bệnh nhân sống sót sau SCA ít nhất 24 giờ và 24% được xuất viện. Nhóm bệnh nhân rối loạn nhịp nhanh có tiên lượng tốt hơn so với nhóm rối loạn nhịp chậm [24]. Nên nhớ rằng 2/3 các biến cố trên xảy ra trước khi các cơ sở lọc máu được lắp đặt các máy phá rung tự động ngoài cơ thể (automated external defibrillator, AED) thường quy. Tuy nhiên, kể cả khi đã có AED, chỉ một nửa trường hợp SCA được dùng AED trước khi nhóm Dịch vụ y tế khẩn cấp (Emergency medical service, EMS) tiếp cận bệnh nhân [24].
Các kết quả trên có một phần ngược lại với một nghiên cứu gần đây trên 398 trường hợp SCA ở các cơ sở lọc máu ngoại trú [25], nhằm đánh giá ảnh hưởng của các hướng dẫn thực hành lọc máu bổ sung phần huấn luyện hồi sinh tim phổi cơ bản (basic life support, BLS) cho nhân viên y tế (NVYT) lọc máu và lợi ích của việc có sẵn AED ở các cơ sở trên [26]. Các NVYT lọc máu hồi sinh tim phổi tại chỗ trước khi nhóm EMS đến trong 81% trường hợp. 66% các ca SCA biểu hiện loại rối loạn nhịp không-sốc-điện-được, và NVYT dùng máy AED trước khi nhóm EMS đến trong 52% trường hợp. Việc dùng máy AED thường diễn ra ở các trung tâm lọc máu lớn hơn.
Hầu hết một nửa bệnh nhân (48%) sống sót khi nhập viện và chỉ có 26% tổng số bệnh nhân trong nghiên cứu được xuất viện khỏe mạnh. Những bệnh nhân được các NVYT tại đơn vị lọc máu hồi sức tim phổi đầu tiên có tỉ lệ sống sót cao gấp 3 lần, cũng như tình trạng thần kinh cải thiện tốt hơn so với nhóm bệnh nhân được nhóm EMS cấp cứu nhưng muộn hơn, tuy nhiên việc dùng AED sớm không có nhiều ưu điểm hơn, có lẽ do chỉ có 37% bệnh nhân bị rối loạn nhịp sốc-điện-được [25]. Vì chỉ khoảng một nửa bệnh nhân có thể tiếp cận được với AED nhờ các NVYT lọc máu tại cơ sở, việc tăng tỷ lệ dùng máy AED có thể giúp xác định nhiều trường hợp rối loạn nhịp sốc-điện-được.
Nhiều yếu tố ảnh hưởng đến việc bệnh nhân được hồi sinh tim phổi cơ bản một cách hiệu quả trước khi nhóm EMS đến [25]. Việc tính toán thời điểm đúng để dùng AED và sốc điện (loại rối loạn nhịp sốc-điện-được) cho phép chuẩn hóa phản ứng nhanh ở trung tâm lọc máu ngoại trú. Trong một báo cáo về kết quả của việc tiếp cận AED ngoài cộng đồng trong các trường hợp ngưng tim (87% trường hợp xảy ra tại nhà), can thiệp sớm hơn (trong 4.8 phút so với 6.2 phút) có tỉ lệ bắt gặp rối loạn nhịp sốc-điện-được cao hơn (gần 24%) và tỉ lệ sống sót cao gấp 3 (từ 3.3% đến 10.5%) [27].
Tóm lại, dù dự hậu của SCA trong lúc CTNT thường xấu, tiên lượng sẽ tốt hơn nhóm SCA ngoại viện, và việc dùng AED sớm có vẻ là biện pháp cải thiện tiên lượng. Cuối cùng, cần lưu ý rằng chỉ ~20% bệnh nhân ngưng tim nội viện bị rối loạn nhịp sốc-điện-được và tỉ lệ xuất viện khỏe mạnh là ~25% [28].
Tần suất SCA trong lúc CTNT được báo cáo là cao hơn ở ngày đầu tiên chạy thận trong tuần [6, 24]. Thời điểm đó bệnh nhân có nồng độ K+ máu cao nhất và toan chuyển hóa. Nồng độ K+ trong dịch thẩm tách < 2mmol/L làm tăng nguy cơ SCA cao gấp 2 lần ở bệnh nhân có nồng độ K+ máu trước chạy thận trong ngưỡng bình thường [6, 7]. Nguy cơ SCA trong CTNT ở nhóm bệnh nhân dùng dịch thẩm tách nồng độ Ca2+ thấp (1.25mmol/L) cũng cao gấp 2 lần và tăng hơn nếu gradient nồng độ Ca2+ huyết thanh cao (40% cho mỗi 1mmol/ L chênh lệch) [29]. Điều thú vị cần chú ý rằng mối liên quan giữa SCA và dịch thẩm tách nồng độ K+ và Ca2+ thấp vẫn tồn tại sau khi điều chỉnh tình trạng bệnh mạch vành và suy tim sung huyết, trong khi các YTNC truyền thống trên không ảnh hưởng đáng kể đến tần suất SCA [7]. Nhiều nghiên cứu cho thấy việc CTNT làm kéo dài thời gian tái cực thất (biểu hiện bằng khoảng QT trên ECG) tương quan nghịch với gradient nồng độ calcium từ đầu đến cuối cuộc chạy thận [30–32]. Hiện tượng này càng biểu hiện rõ khi cả nồng độ Ca2+ (1.25 mmol/L) và K+ (2 mmol/ L) trong dịch thẩm tách được cài đặt thấp [32].
Khoảng QT kéo dài rõ rệt do sự thay đổi nồng độ các chất điện giải trong quá trình chạy thận có thể khởi phát xoắn đỉnh. Ngược lại, tăng kali máu trước chạy thận có thể gâ y hoạt động điện vô mạch hoặc vô tâm thu [32]. Hiểu biết về tình trạng cân bằng điện giải của bệnh nhân giúp dự đoán các bước hồi sinh tim phổi nâng cao cần làm khi các biến cố tim mạch trên xảy ra.
Kali trong dịch thẩm tách
Kiểm soát nồng độ K+ máu vẫn là một thách thức khi điều trị bệnh nhân CTNT. Một trong các mục tiêu điều trị là loại bỏ lượng K+ tích lũy trong cơ thể giữa các khoảng nghỉ chạy thận. Việc cân bằng khối lượng K+ là điều tiên quyết để phòng ngừa cả hạ kali máu nặng trong lúc chạy thận và tăng kali máu nguy kịch trong khoảng nghỉ chạy thận [33]. Thật vậy, một số nghiên cứu cho thấy nồng độ K+ trước chạy thận cao làm tăng nguy cơ SCD [7, 34]. Nồng độ K+ máu phụ thuộc vào lượng K+ nhập vào do ăn uống, lượng bài xuất K+ qua nước tiểu và mất qua phân, sử dụng các thuốc gắn kết K+, nồng độ K+, glucose và bicarbonate trong dịch thẩm tách, hiệu quả của màng lọc, thời gian và tần suất chạy thận [35]. Nồng độ K+ giảm nhanh chóng trong 60 phút đầu và ổn định trong 60 phút cuối chạy thận. K+ đạt trạng thái cân bằng trong giờ cuối chạy thận, trong khi K+ tiếp tục mất qua dịch thẩm tách. Vì vậy có thể cho rằng tốc độ loại bỏ K+ bằng với hệ số vận chuyển khối từ nội bào ra ngoại bào ở các thời điểm trên [33].
Khoảng QT đại diện cho thời gian tái cực thất được biểu hiện trên ECG và QT kéo dài có liên quan đến tăng nguy cơ SCD ở cả dân số bệnh lý và khỏe mạnh [36–39]. Rối loạn điện giải là một trong những yếu tố chính liên-quan-đến-CTNT có thể làm thay đổi khoảng QT và rối loạn nhịp tim, vì nó ảnh hưởng đến lên quá trình hình thành, thời gian, hình dạng và sự lan truyền điện thế hoạt động tế bào. Loại ion ảnh hưởng nhiều nhất đến tái cực thất là K+ và Ca2+ ion hóa [40]. Phương trình Nernst chỉ ra rằng hoạt động điện của tim có liên quan đến tỉ lệ K+ nội bào và ngoại bào. Dùng dịch thẩm tách có nồng độ K+ thấp chủ yếu loại bỏ K+ trong khoang ngoại bào và rất ít từ nội bào. Điều ngạc nhiên là đa số bệnh nhân có thể chịu được tình trạng tăng cực điện thế trên màng tế bào cơ tim, gây ra do tăng tỉ lệ K+ nội bào:ngoại bào vì nồng độ K+ máu giảm trong quá trình chạy thận. Tần suất rối loạn nhịp cao hơn trong 2 giờ cuối chạy thận và ngay sau khi chạy thận [32]. Redaelli và cs đã đề xuất mô hình động học (modelling) K + [41], nghĩa là giảm nồng độ K+ dịch thẩm tách theo hàm số mũ để duy trì gradient nồng độ K+ trong máu-dịch thẩm tách là 1.5 mmol/L. Santoro và cs [42] quan sát ở những bệnh nhân dễ bị rối loạn nhịp do chạy thận, khi dùng dịch thẩm tách có nồng độ K+ tương đối thấp và hằng định thì xuất hiện loạn nhịp nhiều hơn so với việc dùng dịch thẩm tách với nồng độ K+ được điều chỉnh (profiling).
Dựa vào những điều trên, hiện chưa có bằng chứng đáng tin cậy về việc các loại rối loạn nhịp thất trong lúc chạy thận làm tăng nguy cơ tử vong toàn bộ hoặc đột tử [43, 44], hoặc dùng các phương thức lọc máu khác kèm điều chỉnh (profiled) K+ dịch thẩm tách giúp cải thiện dự hậu lâm sàng. Tuy nhiên, gradient nồng độ K+ máu-dịch thẩm tách cao làm tăng nguy cơ nhập viện do mọi nguyên nhân và tần suất nhập cấp cứu [45].
Ngoài ra, nồng độ K+ dịch thẩm tách thấp (<2 mmol/L) làm tăng nguy cơ SCA khi đang chạy thận [7] và SCD ngoài chạy thận hơn so với nồng độ >3 mmol/L [18].
Tóm lại, điều thách thức thực sự đối với bệnh nhân CTNT là tránh tăng kali máu cao (K+ >6 mmol/L) trước chạy thận và hạ kali máu sau chạy thận (hoặc giảm K+ máu quá nhanh và các yếu tố liên quan đến rối loạn nhịp nguy kịch). Có thể dùng các chất resin trao đổi ion (calcium hoặc sodium polystyrene sulphonate); mặc dù resin gốc natri đã được dùng 50 năm nay, nhưng chưa có nghiên cứu lớn nào về ảnh hưởng của nó trên bệnh nhân CTNT [46]. Các chất gắn kết K+ mới hiện nay có thể làm giảm tần suất tăng kali máu trước chạy thận [47, 48]. Thay đổi phác đồ chạy thận như tăng thời gian hoặc tăng số lần chạy thận cũng là một cách kiểm soát tăng kali máu, nhưng điều này ít khi được bệnh nhân đồng ý.
Calci trong dịch thẩm tách
Từ thập kỉ trước, nồng độ Ca2+ trong dịch thẩm tách đã được giảm từ 1.75 còn 1.25 mmol/L [49]. Nồng độ thấp hơn có thể làm tăng thời gian tái cực cơ tim, kéo dài khoảng QT [30, 32] và tăng nguy cơ ngưng tim trong chạy thận [29]. Chọn dịch thẩm tách có nồng độ Ca2+ sao cho cá thể hóa từng bệnh nhân chạy thận cần đánh giá tình trạng chuyển hóa chất khoáng xương bằng phương pháp định lượng và bệnh lý tim mạch của bệnh nhân. Khi chọn nồng độ Ca2+ trong dịch thẩm tách, phải cân nhắc đến cân bằng calci của cơ thể và sự thay đổi nồng độ calci máu, lưu ý rằng cùng một thời điểm có thể không cần đạt được cả hai mục tiêu trên [49].
Tóm lại, tránh dùng dịch thẩm tách có nồng độ Ca2+ thấp trên bệnh nhân đã có tình trạng QT kéo dài và không dùng kết hợp với dịch thẩm tách K+ thấp. Nồng độ Ca2+ dịch thẩm tách cần được điều chỉnh để không làm hạ Ca2+ máu, đặc biệt trên đối tượng có nguy cơ hạ kali máu khi kết thúc chạy thận.
Bicarbonates trong dịch thẩm tách
Tác dụng phụ chủ yếu của dịch thẩm tách có nồng độ bicarbonate (DBIC) cao là tăng tạo CO2, rối loạn điện giải và kéo dài QT [50]. Trong lúc chạy thận, nồng độ bicarbonate cao làm giảm nồng độ Ca2+ máu. Hiện tượng này là do các protein tích điện thay đổi theo hướng kiềm hóa nên tăng tạo các phức chất của calcium. Điều chỉnh tình trạng toan hóa máu quá nhanh có thể gây hại cho mạch máu và tình trạng co cơ tim do giảm Ca2+ [51]. Hơn nữa, Fissell và Hakim [52] nhấn mạnh việc lọc máu giúp làm giảm nồng độ K+ máu, bằng cách loại bỏ K+ vào dịch thẩm tách K+ và đưa K+ từ ngoại bào vào nội bào khi tình trạng toan chuyển hóa được cải thiện. Thêm vào đó, một thử nghiệm ngẫu nhiên có đối chứng (randomized controlled trial, RCT) báo cáo mối liên quan giữa dịch thẩm tách có DBIC cao làm giảm nồng độ K+ máu nhanh hơn [53]. Khi đó, Ca2+ máu và K+ máu cùng giảm đột ngột do kiềm chuyển hóa có thể làm kéo dài thời gian tái cực thất nghiêm trọng. Một nghiên cứu RCT kết luận rằng QT kéo dài có liên quan đến dịch thẩm tách nồng độ bicarbonate cao, K+ thấp và Ca2+ thấp. Mối liên hệ này là biến số độc lập với tình trạng QT dài [39].
Tóm lại, cá thể hóa điều trị cho từng bệnh nhân là việc cần thiết để điều chỉnh tình trạng toan chuyển hóa nhưng tránh các triệu chứng kiềm chuyển hóa thoáng qua có khả năng gây hại. Dịch thẩm tách chứa nồng độ bicarbonate cao có thể làm giảm nồng độ K+ và Ca2+ máu đột ngột. Hiện tượng trên làm tăng thời gian tái cực thất và kéo dài khoảng QT, khởi phát các rối loạn nhịp nguy kịch. Vì vậy không nên dùng dịch thẩm tách chứa bicarbonate cao kết hợp Ca2+ thấp và K+ thấp, đặc biệt đối với bệnh nhân đã có QT kéo dài trước đó.
Magnesium trong dịch thẩm tách
Magne là chất điện giải ít được chú ý. Một nghiên cứu quan sát lớn tại Nhật với dữ liệu trên 142 555 bệnh nhân chạy thận báo cáo rằng mối liên hệ giữa nồng độ magne và tỉ lệ tử vong do mọi nguyên nhân (nguyên nhân do tim mạch và không do tim mạch) là đường cong hình J [55]. Hơn nữa, nồng độ magne máu tương quan nghịch và độc lập với tử vong do mọi nguyên nhân, tử vong do tim mạch và đột tử trên bệnh nhân chạy thận ở châu Âu [56].
Các nghiên cứu về magne trong trương lai nên chú ý đến việc lựa chọn nồng độ magne phù hợp cho dịch thẩm tách (thường chứa ~0.5 mmol/L và nồng độ magne máu giảm dần trong lúc chạy thận, điều này có thể bị ảnh hưởng nếu dịch thẩm tách chứa citrate và nồng độ bicarbonate cao) [57] và vai trò của nó lên các bất thường về điện sinh lý tim trên dân số CTNT. Kết quả các nghiên cứu trên có thể điều chỉnh nồng độ điện giải trong dịch thẩm tách phù hợp cho các loại rối loạn nhịp.
Siêu lọc
Thể tích siêu lọc >5.7% khối lượng cơ thể làm tăng nguy cơ đột tử do tim {tỉ số rủi ro [HR] 1.13 [khoảng tin cậy 95% (CI) 1.00–1.27]; P ¼ 0.04} [18]. Hơn nữa, Pun và cs [7] tìm thấy mối liên hệ giữa ngưng tim trong chạy thận và phần trăm thể tích nước được rút bớt khi chạy thận [odds ratio (OR) 1.11 (95% CI 1.02–1.20); P ¼ 0.011]. Tuy nhiên, cần thêm dữ liệu để chứng mình rằng thể tích siêu lọc lớn có mối quan hệ nhân quả với tần suất đột tử ở bệnh nhân CTNT.
Biện pháp phòng ngừa – thuốc
Rất ít các bằng chứng đề cập đến vai trò của các thuốc tim mạch trong việc phòng ngừa ngưng tim cho bệnh nhân CTNT, chủ yếu do dân số trên là tiêu chuẩn loại trừ trong các nghiên cứu RCT. Dưới đây là bản tóm tắt về hiệu quả và tính an toàn của các thuốc tác động lên điện sinh lý tim và/hoặc điều hòa giao cảm-phế vị lên tim và mạch máu trên đối tượng là bệnh nhân CTNT.
Chẹn beta
Nhiều kết quả trái ngược về tính hiệu quả và an toàn của chẹn beta trên bệnh nhân CTNT. Ví dụ, một bài tổng quan có hệ thống (systematic review) gồm 3 nghiên cứu RCT kết luận rằng chẹn beta giúp làm giảm nguy cơ tử vong và biến cố tim mạch đáng kể, nhưng 9 nghiên cứu quan sát cho rằng không có tác dụng lên các dự hậu trên [58]. Ngược lại, trong 3 nghiên cứu quan sát khác, chẹn beta giúp giảm nguy cơ đột tử do tim cho bệnh nhân CTNT [18] hoặc giảm tử vong do mọi nguyên nhân [59, 60]. Một nghiên cứu RCT khác trên 114 bệnh nhân nguyên nhân và do tim mạch giảm ngoạn mục, nhưng không có ý nghĩa đáng kể trong việc giảm đột tử do tim [61]. Một phân tích hậu kiểm của nghiên cứu Hemodialysis trên 1747 bệnh nhân cho thấy không có mối liên quan giữa việc dùng chẹn beta và đột tử do tim [62].
ACEis (Ức chế men chuyển angiotensin)/ARBs (Ức chế thụ thể angiotensin)
Đến nay, chưa có dữ liệu nào đủ thuyết phục về lợi ích của ACEi hoặc ARB trong việc phòng ngừa đột tử do tim cho bệnh nhân CTNT. Một bài tổng quan có hệ thống cho thấy nguy cơ các biến cố tim mạch ở nhóm bệnh nhân dùng ACEi hoặc ARB giảm không đáng kể [63]. Ví dụ, các nghiên cứu RCT về fosinopril và olmesartan đều thất bại trong việc cho thấy hiệu quả giảm nguy cơ biến cố tim mạch hoặc tử vong do mọi nguyên nhân trên dân số chạy thận [64, 65]. Tương tự, một nguyên cứu khác, tỉ lệ đột tử do tim ở nhóm bệnh nhân chạy thận dùng spironolactone giảm không có ý nghĩa thống kê [66]. Tuy nhiên, có hai nghiên cứu quan sát cho thấy bệnh nhân CTNT được điều trị với ACEi có tỉ lệ tử vong tim mạch và tử vong toàn bộ giảm [67, 68].
Chất gắn kết kali
Sodium polystyrene sulphonate và calcium polystyrene sulphonate thường được dùng để điều trị bệnh nhân tăng kali máu mạn [48, 69], tuy nhiên, đã có báo cáo về tác dụng làm giảm nồng độ K+ trên bệnh nhân CTNT của fludrocortisone hoặc sodium zirconium cyclosilicate (ZS-9) [70–72]. Trong 2 nghiên cứu RCT, dự hậu liên quan đến SCD và tử vong do tim mạch không được báo cáo [48, 69].
Chẹn kênh calci (CCBs)
Một nghiên cứu quan sát cho thấy hiệu quả có lợi của CCB trên nhóm bệnh nhân CTNT tử vong sau ngưng tim 24 giờ, nhưng không có ý nghĩa thống kê [73]. Tương tự, một nghiên cứu quan sát khác trên 4065 bệnh nhân CTNT cho thấy dùng CCB có thể làm giảm nguy cơ tử vong do tim mạch 23% [74].
Calcimimetics
Trong một tổng quan Cochrane của Ballinger và cs [75], gồm 18 nghiên cứu và 7446 bệnh nhân, dùng cinacalcet không có hiệu quả giảm tử vong do mọi nguyên nhân hoặc do tim mạch. Đột tử do tim không được tính là mục tiêu nghiên cứu trong bài tổng quan trên và chỉ được đề cập trong một nghiên cứu, trong đó kết luận không có sự khác nhau về tần suất đột tử do tim giữa nhóm dùng cinacalcet và nhóm được điều trị thông thường [76]. Trong 2 nghiên cứu RCT chia thành 2 nhóm: nhóm dùng Etelcalcetide có nồng độ hormone PTH giảm đáng kể so với nhóm giả dược; tuy nhiên, nhóm dùng thuốc có tỉ lệ hạ calci máu cao hơn và điều này có thể gây QT kéo dài ở nhiều bệnh nhân. Không có báo cáo về tỉ lệ tử vong hoặc biến cố tim mạch liên quan [77].
Amiodarone
Amiodarone gây ra nhiều biến đổi lên điện sinh lý tim và thường được sử dụng cho cả rung nhĩ và rung thất dù nguy cơ gây nhiều tác dụng phụ (tuyến giáp, phổi, gan). Tuy nhiên, chưa có nghiên cứu nào cho thấy tính hiệu quả của nó trong việc phòng ngừa đột tử cho bệnh nhân CTNT. Trong nghiên cứu Dialysis Outcomes and Practice Patterns Study (DOPPS) amiodarone làm tăng nguy cơ đột tử do tim ở bệnh nhân CTNT [HR 1.44 (95% CI 1.16–1.81)] [18], tuy nhiên, cũng như bất kì nghiên cứu quan sát nào, nó không đưa ra được mối quan hệ nhân quả. Trong một báo cáo tổng quan có hệ thống Cochrane [78] gồm 24 nghiên cứu, amiodarone làm giảm nguy cơ đột tử do tim, tử vong do tim mạch hoặc tử vong do mọi nguyên nhân trên bệnh nhân nguy cơ cao (phòng ngừa sơ cấp) hoặc đã hồi phục sau ngưng tim (phòng ngừa thứ cấp), tuy nhiên các nghiên cứu trên không bao gồm dân số đặc biệt là bệnh nhân ESRD hoặc CTNT.
Digoxin
Trong một nghiên cứu đoàn hệ hồi cứu quan sát trên 120 864 bệnh nhân CTNT, dùng digoxin làm tăng nguy cơ tử vong thêm 28%, nhất là những bệnh nhân có nồng độ K+ máu thấp trước chạy thận [79].
Tóm lại, có ít bằng chứng về tính hiệu quả và an toàn của các thuốc chống loạn nhịp trong việc phòng ngừa đột tử do tim hoặc các biến cố tim mạch nghiêm trọng trên bệnh nhân CTNT. Hơn nữa, những bệnh nhân này thường kém tuân trị dài hạn [80, 81], điều này có thể làm hạn chế giá trị của kết quả nghiên cứu lên thực hành lâm sàng. Vì vậy chưa có khuyến cáo nào đủ mạnh về nhóm thuốc đặc hiệu và cần thêm các nghiên cứu RCT lớn chất lượng cao trên nhóm dân số CTNT.
Biện pháp phòng ngừa – máy tạo nhịp khử rung tim cấy được (ICDs)
Các hướng dẫn phòng ngừa đột tử của các hội tim mạch khuyến cáo đặt máy ICD để phòng ngừa sơ cấp cho bệnh nhân có LVEF<35% có kì vọng sống ít nhất 1 năm, và phòng ngừa thứ cấp cho bệnh nhân từng bị rung thất hoặc nhịp nhanh thất gây rối loạn huyết động mà không điều trị được nguyên nhân [82]. Tuy nhiên, các nghiên cứu RCT cho thấy ICD có hiệu quả lên lợi ích sống còn ở nhóm bệnh nhân nguy cơ cao đột tử do tim nhưng lại không bao gồm nhóm dân số ESRD (tiêu chuẩn loại trừ) [83–85]. Nhiều nghiên cứu quan sát cho thấy những bệnh nhân được phòng ngừa sơ cấp bằng đặt máy ICD, có ESRD là yếu tố tiên lượng âm đối với tử vong [86–88]. Tuy nhiên, khi so sánh với nhóm bệnh nhân lọc máu có chỉ định đặt máy ICD, các dữ liệu lại không nhất quán. Trong một nghiên cứu quan sát, Hiremath và cs [89] thu thập dữ liệu từ 2 nhóm, cho thấy cấy máy ICD cải thiện sống còn cho bệnh nhân ESRD suy thất trái (LVEF <35%) so với nhóm không được cấy [HR 0.40 (95% CI 0.19–0.82)] [89]. Các yếu tố gây nhiễu là một hạn chế đáng kể và có thể dùng phương pháp so sánh bằng điểm xu hướng (propensity score matching) để làm giảm nguy cơ trên. Thật vậy, Pun và cs [90] so sánh 2 nghiên cứu đoàn hệ bắt cặp xu hướng, một nhóm được phòng ngừa thứ phát bằng đặt máy ICD và một nhóm không đặt ICD, tỉ lệ tử vong không khác nhau ở 2 nhóm (43.4% ở nhóm cấy ICD so với 39.7% ở nhóm chứng). Bằng chứng không rõ ràng này dẫn đến tình trạng bệnh nhân ESRD có chỉ định đặt máy ICD nhưng chỉ có một số ít được đặt. Trong 2072 bệnh nhân ESRD người Ý (trong đó 154 bệnh nhân có LVEF <35%), chỉ có 52 (33%) được cấy máy ICD. Quả nhiên, nhóm có chỉ định đặt máy ICD có tỉ lệ tử vong cao hơn nhóm không có chỉ định [HR 1.59 (95% CI 1.06–2.38)], nhưng nhóm bệnh nhân suy thất trái nhưng không đặt máy ICD có tiên lượng xấu nhất [HR 2.67 (95% CI 2.09–3.39)]. Tỉ lệ đột tử do tim ở cả nhóm bệnh nhân có chỉ định và không có chỉ định cấy máy ICD đều cao [91]. Chỉ có một nghiên cứu RCT nói về tỉ lệ đột tử do tim mới ở nhóm bệnh nhân lọc máu có LVEF bảo tồn: thử nghiệm ICD2 [92]. Nghiên cứu mới nhất này đặc biệt thú vị ở chỗ LVEF <35% là tiêu chuẩn loại trừ, vì vậy cho phép đặt ra các chỉ định mới cho việc cấy máy ICD trên nhóm bệnh nhân lọc máu. Nghiên cứu này cố gắng trả lời câu hỏi ESRD có thật sự là yếu tố nguy cơ của đột tử do tim không, có độc lập với tình trạng LVEF thấp không, và nguy cơ này có thể được giảm thiểu bằng cách đặt máy ICD không. Thật vậy, theo hướng dẫn, những bệnh nhân có chỉ định kinh điển của việc cấy máy ICD để phòng ngừa đột tử do tim dựa vào yếu tố giảm phân suất tống máu không được đưa vào nghiên cứu. Thử nghiệm này đã bị dừng lại, phù hợp với khuyến cáo về dữ liệu an toàn và vì lý do không hiệu quả (nghiên cứu không đạt được kết quả theo mục tiêu gốc) sau khi loại trừ 188 bệnh nhân so với kế hoạch là 200 bệnh nhân, 97 bệnh trong nhóm đặt ICD và 91 bệnh trong nhóm chứng. Thời gian theo dõi trung bình là 6.8 năm. Tỉ lệ tử vong trong 5 năm như nhau ở 2 nhóm (50.6% ở nhóm đặt ICD và 54.5% ở nhóm chứng). Tỉ lệ đột tử do tim mới tích lũy là 9.7% ở nhóm đặt ICD và 7.9% ở nhóm chứng [HR 1.32 (95% CI 0.53–3.29)] [92].
Nhiều nguyên nhân dẫn đến việc đặt ICD không giúp giảm tử vong toàn bộ và đột tử: đầu tiên, khả năng máy ICD không nhận biết được loại loạn nhịp không-sốc-điện-được (vô tâm thu/hoạt động điện vô mạch) hoặc loạn nhịp tiến triển khi tăng kali máu và/hoặc rối loạn toan kiềm nặng [13, 93], dẫn đến việc máy không cắt nhịp hiệu quả hoặc không tái khởi động máy sau sốc điện. Chỉ có cách phân tích ECG qua máy ghi ECG cấy trong tim khi khám nghiệm tử thi (đã được lên kế hoạch trong thiết kế thử nghiệm ICD2) mới làm sáng tỏ loại loạn nhịp nào dẫn đến đột tử. Điều quan trọng cần nhấn mạnh là tỉ lệ các tác dụng phụ liên quan đến đặt máy là khá cao (27.5%) [92]. Chúng liên quan trực tiếp đến thủ thuật cấy máy vào cơ thể (tạo hematoma hoặc nhiễm trùng) hoặc do rối loạn điện cực. 7.5% trường hợp cần được tháo máy ra, đa số là do du khuẩn huyết [92]. Trên lâm sàng những bệnh nhân nên được đặt máy ICD như là một cách phòng ngừa thứ phát.
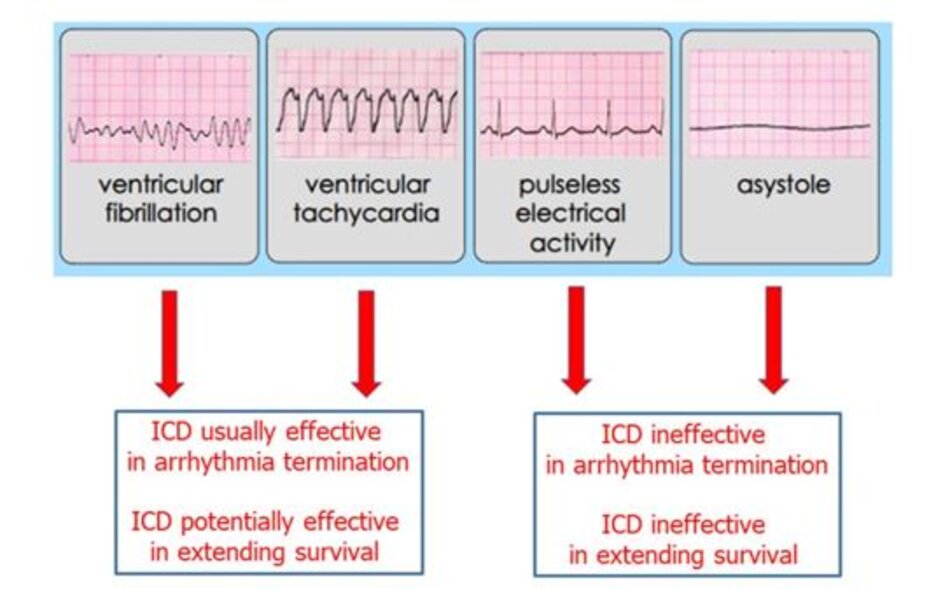
Herzog và cs. [94] phân tích hồi cứu trên 6042 bệnh nhân lọc máu nhập viện vì rung thất/ngưng tim, xuất viện và sống sót ít nhất trong 30 ngày kể từ khi nhập viện. Chỉ 7.6% bệnh nhân trên đã cấy máy ICD. Nhóm bệnh nhân trên có nguy cơ tử vong giảm 42% [HR 0.58 (95% CI 0.50–0.66)] [94]. Charytan và cs [95] quan sát trên 9528 bệnh nhân lọc máu cấy máy ICD để phòng ngừa thứ cấp từ năm 1994 đến năm 2006, tỉ lệ tử vong toàn bộ giảm 14% (95% CI 9–19) so với nhóm chứng [95].
Một vấn đề quan trọng là tỉ lệ biến chứng cao liên quan đến việc cấy máy ICD ở bệnh nhân lọc máu. Một phân tích tổng hợp (meta-analysis) cho thấy tỉ lệ biến chứng do nhiễm trùng tăng cao khi có ESRD [HR 8.73 (95% CI 3.42–22.31)] [96]. Cần tháo toàn bộ hệ thống máy khi có biến chứng nhiễm trùng do đặt máy [97]. Các biến chứng thường gặp khác liên quan đến việc lệch điện cực cần mở ra chỉnh lại, suy điện cực cần tháo máy, chảy máu và huyết khối tĩnh mạch [92, 98, 99]. Cấy máy tạo nhịp dưới da có ưu điểm là giảm nguy cơ hẹp tĩnh mạch trung tâm và nhiễm trùng hơn so với đặt máy trong buồng tim với điện cực trong tĩnh mạch, tuy nhiên nó có thể không hoạt động hiệu quả khi có loạn nhịp chậm nặng [100].
Nói chung, quyết định đặt máy tạo nhịp trên bệnh nhân ESRD và CTNT là một thách thức trên lâm sàng và cần phối hợp đa chuyên ngành, nhất là giữa bác sĩ nội thận và bác sĩ tim mạch, với mục tiêu là đánh giá nguy cơ-lợi ích của mỗi phương pháp điều trị phù hợp cho từng cá thể [97]. Quyết định này có thể khó khăn hơn trong tình huống nhịp nhanh thất đe dọa tính mạng xuất hiện thoáng qua nhưng không điều trị triệt để được nguyên nhân [101].
Trên bức tranh lâm sàng, thách thức trong việc quyết định đặt máy ICD liên quan đến các bệnh đồng mắc thường có ở bệnh nhân ESRD, lợi ích của việc đặt máy có thể giảm. Vấn đề trên có thể do nhiều yếu tố, như rối loạn điện giải làm tăng nguy cơ sốc điện không hiệu quả hoặc kích hoạt các rối loạn nhịp không-sốc-điện-được (vô tâm thu/hoạt động điện vô mạch) – cơ chế sinh lý gây đột tử do loạn nhịp (Hình 1).
Kết luận
Đột tử do tim vẫn là nguyên nhân chính gây tử vong trên bệnh nhân ESRD dù gần đây đã có nhiều nỗ lực nhằm phòng ngừa và xác định bệnh nhân thuộc nhóm nguy cơ cao. Với những bệnh nhân dễ ngưng tim trong lúc chạy thận, một số yếu tố nguy cơ thay đổi được đã được xác định, như dịch thẩm tách có nồng độ K+ và Ca2+ thấp, và ưu điểm của việc có sẵn máy AED trong các đơn vị lọc máu. Tuy nhiên, phải nhận thức được rằng không phải rối loạn nhịp nào cũng sốc điện được. Vấn đề đột tử do tim ngoài lúc chạy thận thì phức tạp hơn và nguyên nhân vẫn chưa được biết rõ. SCD liên quan đến LVEF thấp chỉ xuất hiện trong một số ít trường hợp trên bệnh nhân CTNT. Điều này cho thấy SCD xảy ra với nhiều đặc điểm khác nhau trên bệnh nhân ESRD, so với bệnh nhân bệnh tim thiếu máu cục bộ và/hoặc suy tim không có ESRD. Các bằng chứng gần đây gợi ý rằng khi bị rối loạn nhịp nguy kịch, bệnh nhân ESRD thường biểu hiện loạn nhịp chậm hơn là loạn nhịp nhanh. Điều này có thể giải thích một phần cho việc nhiều nghiên cứu không cho thấy lợi ích của đặt máy ICD để phòng ngừa đột tử cho bệnh nhân ESRD. Rối loạn điện giải là điều thường gặp ở bệnh nhân CTNT, nên dễ gây rối loạn nhịp, dựa trên mối liên quan giữa đột tử và thời điểm chạy thận. Tuy nhiên, tỉ lệ đột tử cao ở bệnh nhân TPPM cho thấy có nhiều yếu tố khác liên quan đến tăng tỉ lệ đột tử ở bệnh nhân ure máu cao.
Conflict of interest stateme NT
S.G. declares speaker’s fees of a small amount from AstraZeneca and Pfizer. G.B. declares speaker’s fees of a small amount from Medtronic, Boston Scientific and Biotronik. D.S. is consulting for American Renal Clinical Research Services and CHF Solutions. All other authors declare no conflicts of interest.
References
- Takeda K, Harada A, Okuda S et al. Sudden death in chronic dialysis patients. Nephrol Dial Transplant 1997; 12: 952–955
- Stecker EC, Reinier K, Marijon E et al. Public health burden of sudden cardiac death in the United States. Circ Arrhythm Electrophysiol 2014; 7: 212–217
- Saran R, Robinson B, Abbott KC et al. US Renal Data System 2018 Annual Data Report: epidemiology of kidney disease in the United States. Am J Kidney Dis 2019; 73: A7–A8
- Ligtenberg G, Barnas MG, Koomans HA. Intradialytic hypotension: new insights into the mechanism of vasovagal syncope. Nephrol Dial Transplant 1998; 13: 2745–2747
- Kuipers J, Verboom LM, Ipema KJR et al. The prevalence of intradialytic hypotension in patients on conventional hemodialysis: a systematic review with meta-analysis. Am J Nephrol 2019; 49: 497–506
- Karnik JA, Young BS, Lew NL et al. Cardiac arrest and sudden death in dialysis units. Kidney Int 2001; 60: 350–357
- Pun PH, Lehrich RW, Honeycutt EF et al. Modifiable risk factors associated with sudden cardiac arrest within hemodialysis clinics. Kidney Int 2011; 79: 218–227
- Poulikakos D, Hnatkova K, Skampardoni S et al. Sudden cardiac death in dialysis: arrhythmic mechanisms and the value of non-invasive electro- physiology. Front Physiol 2019; 10: 144
- Luu M, Stevenson WG, Stevenson LW et al. Diverse mechanisms of unexpected cardiac arrest in advanced heart failure. Circulation 1989; 80: 1675–1680
- Bayes de Luna A, Coumel P, Leclercq JF. Ambulatory sudden cardiac death: mechanisms of production of fatal arrhythmia on the basis of data from 157 cases. Am Heart J 1989; 117: 151–159
- Cobb LA, Fahrenbruch CE, Olsufka M et al. Changing incidence of out-of- hospital ventricular fibrillation, 1980–2000. JAMA 2002; 288: 3008–3013
- Wan C, Herzog CA, Zareba W et al. Sudden cardiac arrest in hemodialysis patients with wearable cardioverter defibrillator. Ann Noninvasive Electrocardiol 2014; 19: 247–257
- Wong MCG, Kalman JM, Pedagogos E et al. Temporal distribution of arrhythmic events in chronic kidney disease: highest incidence in the long interdialytic period. Heart Rhythm 2015; 12: 2047–2055
- Sacher F, Jesel L, Borni-Duval C et al. Cardiac rhythm disturbances in he- modialysis patients: early detection using an implantable loop recorder and correlation with biological and dialysis parameters. JACC Clin Electrophysiol 2018; 4: 397–408
- Roy-Chaudhury P, Tumlin JA, Koplan BA et al. Primary outcomes of the monitoring in dialysis study indicate that clinically significant arrhythmias are common in hemodialysis patients and related to dialytic cycle. Kidney Int 2018; 93: 941–951
- Bleyer AJ, Hartman J, Brannon PC et al. Characteristics of sudden death in hemodialysis patients. Kidney Int 2006; 69: 2268–2273
- Genovesi S, Valsecchi MG, Rossi E et al. Sudden death and associated factors in a historical cohort of chronic haemodialysis patients. Nephrol Dial Transplant 2009; 24: 2529–2536
- Jadoul M, Thumma J, Fuller DS et al. Modifiable practices associated with sudden death among hemodialysis patients in the Dialysis Outcomes and Practice Patterns Study. Clin J Am Soc Nephrol 2012; 7: 765–774
- Genovesi S, Porcu L, Luise MC et al. Sudden death in end stage renal disease: comparing hemodialysis versus peritoneal dialysis. Blood Purif 2017; 44: 77–88
- Torlen K, Kalantar-Zadeh K, Molnar MZ et al. Serum potassium and cause-specific mortality in a large peritoneal dialysis cohort. Clin J Am Soc Nephrol 2012; 7: 1272–1284
- Wang AY, Lam CW, Chan IH et al. Sudden cardiac death in end-stage renal disease patients: a 5-year prospective analysis. Hypertension 2010; 56: 210–216
- Kerns ES, Kim ED, Meoni LA et al. Obstructive sleep apnea increases sudden cardiac death in incident hemodialysis patients. Am J Nephrol 2018; 48: 147–156
- Kawase Y, Taniguchi T, Morimoto T et al. Severe aortic stenosis in dialysis patients. J Am Heart Assoc 2017; 6: e004961
- Davis TR, Young BA, Eisenberg MS et al. Outcome of cardiac arrests attended by emergency medical services staff at community outpatient dialysis centers. Kidney Int 2008; 73: 933–939
- Pun PH, Dupre ME, Starks MA et al. Outcomes for hemodialysis patients given cardiopulmonary resuscitation for cardiac arrest at outpatient dialysis clinics. J Am Soc Nephrol 2019; 30: 461–470
- K/DOQI Workgroup. K/DOQI clinical practice guidelines for cardiovascular disease in dialysis patients. Am J Kidney Dis 2005; 45(4 Suppl 3): S18–S153
- Capucci A, Aschieri D, Piepoli MF et al. Tripling survival from sudden cardiac arrest via early defibrillation without traditional education in cardiopulmonary resuscitation. Circulation 2002; 106: 1065–1070
- Andersen LW, Holmberg MJ, Berg KM et al. In-hospital cardiac arrest: a review. JAMA 2019; 321: 1200–1210
- Pun PH, Horton JR, Middleton JP. Dialysate calcium concentration and the risk of sudden cardiac arrest in hemodialysis patients. Clin J Am Soc Nephrol 2013; 8: 797–803
- Nappi SE, Virtanen VK, Saha HHT et al. QTc dispersion increases during hemodialysis with low-calcium dialysate. Kidney Int 2000; 57: 2117–2122
- Genovesi S, Rivera R, Fabbrini P et al. Dynamic QT interval analysis in uraemic patients receiving chronic haemodialysis. J Hypertens 2003; 21: 1921–1926
- Genovesi S, Dossi C, Vigano` MR et al. Electrolyte concentration during haemodialysis and QT interval prolongation in uraemic patients. Europace 2008; 10: 771–777
- Basile C, Libutti P, Lisi P et al. Ranking of factors determining potassium mass balance in bicarbonate haemodialysis. Nephrol Dial Transplant 2015; 30: 505–513
- Karaboyas A, Zee J, Brunelli SM et al. Dialysate potassium, serum potassium, mortality, and arrhythmia events in hemodialysis: results from the Dialysis Outcomes and Practice Patterns Study (DOPPS). Am J Kidney Dis 2017; 69: 266–277
- Sam R, Vaseemuddin M, Leong WH et al. Composition and clinical use of hemodialysates. Hemodial Int 2006; 10: 15–28
- Algra A, Tijssen JGP, Roelandt J et al. QTc prolongation measured by standard 12-lead electrocardiography is an independent risk factor for sudden death due to cardiac arrest. Circulation 1991; 83: 1888–1894
- Montanez A, Ruskin JN, Hebert PR et al. Prolonged QTc interval and risks of total and cardiovascular mortality and sudden death in the general population: a review and qualitative overview of the prospective cohort studies. Arch Intern Med 2004; 164: 943–948
- Zhang Y, Post WS, Blasco-Colmenares E et al. Electrocardiographic QT interval and mortality: a meta-analysis. Epidemiology 2011; 22: 660–670
- Genovesi S, Rossi E, Nava M et al. A case series of chronic haemodialysis patients: mortality, sudden death, and QT interval. Europace 2013; 15: 1025–1033
- Severi S, Grandi E, Pes C et al. Calcium and potassium changes during haemodialysis alter ventricular repolarization duration: in vivo and in sil- ico analysis. Nephrol Dial Transplant 2007; 23: 1378–1386
- Redaelli B, Locatelli F, Limido A et al. Effect of a new model of hemodialy- sis potassium removal on the control of ventricular arrhytmias. Kidney Int 1996; 50: 609–617
- Santoro A, Mancini E, London G et al. Patients with complex arrhytmias during and after haemodialysis suffer from different regimens of potassium removal. Nephrol Dial Transplant 2007; 23: 1415–1421
- Multicentre, cross-sectional study of ventricular arrhythmias in chronically haemodialysed patients. Gruppo Emodialisi e Patologie Cardiovasculari. Lancet 1988; 2: 305–309
- 4 4. Sforzini S, Latini R, Mingardi G et al. Ventricular arrhythmias and four- year mortality in haemodialysis patients. Lancet 1992; 339: 212–213
- Brunelli SM, Spiegel DM, Du Mond C et al. Serum-to-dialysate potassium gradient and its association with short-term outcomes in hemodialysis patients. Nephrol Dial Transplant 2018; 33: 1207–1214
- Jadoul M, Karaboyas A, Goodkin DA et al. Potassium-binding resins: asso- ciations with serum chemistries and interdialytic weight gain in hemodial- ysis patients. Am J Nephrol 2014; 39: 252–259
- Weir MR, Bakris GL, Bushinsky DA et al. Patiromer in patients with kid- ney disease and hyperkalemia receiving RAAS inhibitors. N Engl J Med 2015; 372: 211–221
- Packham DK, Rasmussen HS, Lavin PT et al. Sodium zirconium cyclosili- cate in hyperkalemia. N Engl J Med 2015; 372: 222–231
- Basile C, Libutti P, Di Turo L et al. Effect of dialysate calcium concentra- tion on parathyroid hormone and calcium balance during a single dialysis session using bicarbonate hemodialysis: a crossover clinical trial. Am J Kidney Dis 2012; 59: 92–101
- Basile C, Rossi L, Lomonte C. Dialysate bicarbonate concentration: too much of a good thing? Semin Dial 2018; 31: 576–582
van Kuijk WH, Mulder AW, Peels CH et al. Influence of changes in ion- ized calcium on cardiovascular reactivity during hemodialysis. Clin Nephrol 1997; 47: 190–196 - Fissell R, Hakim RM. Improving outcomes by changing hemodialysis practice patterns. Curr Opin Nephrol Hypertens 2013; 22: 675–680
- Heguile´n RM, Sciurano C, Bellusci AD et al. The faster potassium- lowering effect of high dialysate bicarbonate concentrations in chronic haemodialysis patients. Nephrol Dial Transplant 2005; 20: 591–597
- Di Iorio B, Torraca S, Piscopo C et al. Dialysate bath and QTc interval in patients on chronic maintenance hemodialysis: pilot study of single dialysis effects. J Nephrol 2012; 25: 653–660
- Sakaguchi Y, Fujii N, Shoji T et al. Hypomagnesemia is a significant pre- dictor of cardiovascular and non-cardiovascular mortality in patients un- dergoing hemodialysis. Kidney Int 2014; 85: 174–181
- de Roij van Zuijdewijn CL, Grooteman MP, Bots ML et al. Serum magne- sium and sudden death in european hemodialysis patients. PLoS One 2015; 10: e0143104
- Tangvoraphonkchai K, Davenport A. Magnesium and cardiovascular dis- ease. Adv Chronic Kidney Dis 2018; 25: 251–260
- Jin J, Guo X, Yu Q. Effects of beta-blockers on cardiovascular events and mortality in dialysis patients: a systematic review and meta-analysis. Blood Purif 2019; 48: 51–59
- Nakao K, Makino H, Morita S et al. Beta-blocker prescription and out- comes in hemodialysis patients from the Japan Dialysis Outcomes and Practice Patterns Study. Nephron Clin Pract 2009; 113: c132–c139
- Foley RN, Herzog CA, Collins AJ. Blood pressure and long-term mortality in United States hemodialysis patients: USRDS Waves 3 and 4 Study. Kidney Int 2002; 62: 1784–1790
- Cice G, Ferrara L, D’Andrea A et al. Carvedilol increases two-year surviva- lin dialysis patients with dilated cardiomyopathy: a prospective, placebo- controlled trial. J Am Coll Cardiol 2003; 41: 1438–1444
- Tangri N, Shastri S, Tighiouart H et al. b-blockers for prevention of sud- den cardiac death in patients on hemodialysis: a propensity score analysis of the HEMO Study. Am J Kidney Dis 2011; 58: 939–945
- Tai DJ, Lim TW, James MT et al. Cardiovascular effects of angiotensin converting enzyme inhibition or angiotensin receptor blockade in hemodi- alysis: a meta-analysis. Clin J Am Soc Nephrol 2010; 5: 623–630
- Iseki K, Arima H, Kohagura K et al. Effects of angiotensin receptor block- ade (ARB) on mortality and cardiovascular outcomes in patients with long-term haemodialysis: a randomized controlled trial. Nephrol Dial Transplant 2013; 28: 1579–1589
- Zannad F, Kessler M, Lehert P et al. Prevention of cardiovascular events in end-stage renal disease: results of a randomized trial of fosinopril and implications for future studies. Kidney Int 2006; 70: 1318–1324
- Matsumoto Y, Mori Y, Kageyama S et al. Spironolactone reduces cardio- vascular and cerebrovascular morbidity and mortality in hemodialysis patients. J Am Coll Cardiol 2014; 63: 528–536
- Efrati S, Zaidenstein R, Dishy V et al. ACE inhibitors and survival of he- modialysis patients. Am J Kidney Dis 2002; 40: 1023–1029
- Berger AK, Duval S, Krumholz HM. Aspirin, beta-blocker, and angiotensin-converting enzyme inhibitor therapy in patients with end- stage renal disease and an acute myocardial infarction. J Am Coll Cardiol 2003; 42: 201–218
- Kosiborod M, Rasmussen HS, Lavin P et al. Effect of sodium zirconium cyclosilicate on potassium lowering for 28 days among outpatients with hyperkalemia: the HARMONIZE randomized clinical trial. JAMA 2014; 312: 2223–2233
- Singhal PC, Desroches L, Mattana J et al. Mineralocorticoid therapy lowers serum potassium in patients with end-stage renal disease. Am J Nephrol 1993; 13: 138–141
- Kaisar MO, Wiggins KJ, Sturtevant JM et al. A randomized controlled trial of fludrocortisone for the treatment of hyperkalemia in hemodialysis patients. Am J Kidney Dis 2006; 47: 809–814
- Ash SR, Singh B, Lavin PT et al. A phase 2 study on the treatment of hyperkalemia in patients with chronic kidney disease suggests that the se- lective potassium trap, ZS-9, is safe and efficient. Kidney Int 2015; 88: 404–411
- Pun PH, Lehrich RW, Smith SR et al. Predictors of survival after cardiac arrest in outpatient hemodialysis clinics. Clin J Am Soc Nephrol 2007; 2: 491–500
- Kestenbaum B, Gillen DL, Sherrard DJ et al. Calcium channel blocker use and mortality among patients with end-stage renal disease. Kidney Int 2002; 61: 2157–2164
- Ballinger AE, Palmer SC, Nistor I et al. Calcimimetics for secondary hyper- parathyroidism in chronic kidney disease patients. Cochrane Database Syst Rev 2014; 12: CD006254
- Messa P, Maca´rio F, Yaqoob M et al. The OPTIMA study: assessing a new cinacalcet (Sensipar/Mimpara) treatment algorithm for secondary hyper- parathyroidism. Clin J Am Soc Nephrol 2008; 3: 36–45
- Block GA, Bushinsky DA, Cunningham J et al. Effect of etelcalcetide vs placebo on serum parathyroid hormone in patients receiving hemodialysis with secondary hyperparathyroidism: two randomized clinical trials. JAMA 2017; 317: 146–155
- Claro JC, Candia R, Rada G et al. Amiodarone versus other pharmacologi- cal interventions for prevention of sudden cardiac death. Cochrane Database Syst Rev 2015; 12: CD008093
- Chan KE, Lazarus JM, Hakim RM. Digoxin associates with mortality in ESRD. J Am Soc Nephrol 2010; 21: 1550–1559
- Chiu YW, Teitelbaum I, Misra M et al. Pill burden, adherence, hyperphos- phatemia, and quality of life in maintenance dialysis patients. Clin J Am Soc Nephrol 2009; 4: 1089–1096
- Burnier M, Pruijm M, Wuerzner G et al. Drug adherence in chronic kidney diseases and dialysis. Nephrol Dial Transplant 2015; 30: 39–44
- Priori SG, Blomstro¨m-Lundqvist C, Mazzanti A et al. 2015 ESC guidelines for the management of patients with ventricular arrhythmias and the pre- vention of sudden cardiac death. Europace 2015; 17: 1601–1687
- Moss AJ, Hall WJ, Cannom DS et al. Improved survival with an implanted defibrillator in patients with coronary disease at high risk for ventricular arrhythmia. Multicenter Automatic Defibrillator Implantation Trial Investigators. N Engl J Med 1996; 335: 1933–1940
- Moss AJ, Zareba W, Hall WJ et al. Prophylactic implantation of a defibril- lator in patients with myocardial infarction and reduced ejection fraction. N Engl J Med 2002; 346: 877–883
- Bardy GH, Lee KL, Mark DB et al. Amiodarone or an implantable cardi- overter defibrillator for congestive heart failure. N Engl J Med 2005; 352: 225–237
- Khan F, Adelstein E, Saba S. Implantable cardioverter defibrillators confer survival benefit in patients with renal insufficiency but not in dialysis- dependent patients. J Interv Card Electrophysiol 2010; 28: 117–123
- Paul L, Hess PL, Hellkamp AS et al. Survival after primary prevention im- plantable cardioverter-defibrillator placement among patients with chronic kidney disease. Circ Arrhythm Electrophysiol 2014; 7: 793–799
- Turakhia MP, Varosy PD, Lee K et al. Impact of renal function on survival in patients with implantable cardioverter-defibrillators. Pacing Clin Electro physiol 2007; 30: 377–384
- Hiremath S, Punnam SR, Brar SS et al. Implantable defibrillators improve survival in end-stage renal disease: results from a multi-center registry. Am J Nephrol 2010; 32: 305–310
- Pun PH, Hellkamp AS, Sanders GD et al. Primary prevention implantable cardioverter defibrillators in end-stage kidney disease patients on dialysis: a matched cohort study. Nephrol Dial Transplant 2015; 30: 829–835
- Genovesi S, Porcu L, Luise MC et al. Mortality, sudden death and indica- tion for cardioverter defibrillator implantation in a dialysis population. Int J Cardiol 2015; 186: 170–177
- Jukema JW, Timal RJ, Rotmans JI et al. Prophylactic use of implantable cardioverter-defibrillators in the prevention of sudden cardiac death in di- alysis patients. Circulation 2019; 139: 2628–2638
- Hsu JC, Marcus GM, Al-Khatib SM et al. Predictors of an inadequate defi- brillation safety margin at ICD implantation: insights from the National Cardiovascular Data Registry. J Am Coll Cardiol 2014; 64: 256–264
- Herzog CA, Li S, Weinhandl ED et al. Survival of dialysis patients after car- diac arrest and the impact of implantable cardioverter defibrillators. Kidney Int 2005; 68: 818–825
- Charytan DM, Patrick AR, Liu J et al. Trends in the use and outcomes of implantable cardioverter-defibrillators in patients undergoing dialysis in the United States. Am J Kidney Dis 2011; 58: 409–417
- Polyzos KA, Konstantelias AA, Falagas ME. Risk factors for cardiac im- plantable electronic device infection: a systematic review and meta-analy- sis. Europace 2015; 17: 767–777
- Boriani G, Savelieva I, Dan GA et al. Chronic kidney disease in patients with cardiac rhythm disturbances or implantable electrical devices: clinical significance and implications for decision making–a position paper of the European Heart Rhythm Association endorsed by the Heart Rhythm Society and the Asia Pacific Heart Rhythm Society. Europace 2015; 17: 1169–1196
- Dasgupta A, Montalvo J, Medendorp S et al. Increased complication rates of cardiac rhythm management devices in ESRD patients. Am J Kidney Dis 2007; 49: 656–663
- Tompkins C, Mclean R, Cheng A et al. End-stage renal disease predicts complications in pacemaker and ICD implants. J Cardiovasc Electrophysiol 2011; 22: 1099–1104
- Dhamija RK, Tan H, Philbin E et al. Subcutaneous implantable cardi- overter defibrillator for dialysis patients: a strategy to reduce central vein stenoses and infections. Am J Kidney Dis 2015; 66: 154–158
- Boriani G, Fauchier L, Aguinaga L et al. European Heart Rhythm Association (EHRA) consensus document on management of arrhythmias and cardiac electronic devices in the critically ill and post-surgery patient, endorsed by Heart Rhythm Society (HRS), Asia Pacific Heart Rhythm Society (APHRS), Cardiac Arrhythmia Society of Southern Africa (CASSA), and Latin American Heart Rhythm Society (LAHRS). Europace 2019; 21: 7–8
Tài liệu tham khảo
Tác giả: Simonetta Genovesi, Giuseppe Boriani, Adrian Covic, Robin W M Vernooij, Christian Combe, Alexandru Burlacu, Andrew Davenport, Mehmet Kanbay, Dimitrios Kirmizis, Daniel Schneditz, Frank van der Sande, Carlo Basile. Ngày đăng 20 tháng 09 năm 2019. Sudden cardiac death in dialysis patients: different causes and management strategies. Ngày truy cập 26 tháng 12 năm 2021.

