Bệnh hô hấp
Chụp cắt lớp trở kháng điện trong y học chu phẫu: theo dõi hô hấp cẩn thận để có các can thiệp phù hợp
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Chụp cắt lớp trở kháng điện trong y học chu phẫu: theo dõi hô hấp cẩn thận để có các can thiệp phù hợp File PDF ở đây.
Dịch bài: BS. Đặng Thanh Tuấn – BV Nhi Đồng 1
Tóm tắt
Bối cảnh
Chụp cắt lớp trở kháng điện (Electrical impedance tomography − EIT) là một kỹ thuật theo dõi không bức xạ, không xâm lấn, cung cấp hình ảnh dựa trên độ dẫn điện mô của ngực. Một số cuộc nghiên cứu đã áp dụng EIT trong bối cảnh y học chu phẫu, không giới hạn trong giai đoạn phẫu thuật mà bắt đầu bằng đánh giá trước phẫu thuật và mở rộng sang theo dõi sau phẫu thuật.
Nội dung chính
EIT có thể cung cấp theo dõi hô hấp cẩn thận trong đánh giá trước phẫu thuật để cải thiện việc chuẩn bị cho phẫu thuật, trong quá trình gây mê để hướng dẫn các chiến lược thông khí tối ưu và theo dõi tình trạng huyết động và trong giai đoạn hậu phẫu để phát hiện sớm các biến chứng hô hấp. Hơn nữa, EIT có thể tăng cường hơn nữa việc chăm sóc bệnh nhân trải qua các thủ tục chẩn đoán chu phẫu. Đánh giá tường thuật này tóm tắt các bằng chứng mới nhất về việc áp dụng kỹ thuật này cho bệnh nhân phẫu thuật, cũng tập trung vào các viễn cảnh có thể có trong tương lai.
Kết luận
EIT là một kỹ thuật đầy hứa hẹn để đánh giá phẫu thuật cho bệnh nhân phẫu thuật, cung cấp khả năng theo dõi huyết động và hô hấp thích ứng phù hợp. Các nghiên cứu sâu hơn là cần thiết để giải quyết những hạn chế về công nghệ hiện tại, xác nhận những phát hiện và đánh giá bệnh nhân nào có thể hưởng lợi nhiều hơn từ công nghệ này.
Bối cảnh
Chụp cắt lớp trở kháng điện (EIT) là một kỹ thuật theo dõi không bức xạ, không xâm lấn, cung cấp hình ảnh dựa trên những thay đổi về độ dẫn điện của các bộ phận cơ thể. Trong những năm gần đây, EIT đã được áp dụng cho một số lĩnh vực. Trong lồng ngực, trở kháng thay đổi linh hoạt do thay đổi thể tích phổi (ví dụ: trong quá trình hô hấp) và/hoặc do thay đổi lượng máu và chất lỏng (ví dụ: trong tim trong chu kỳ tim). Thông qua tái tạo kỹ thuật số, EIT biến đổi tín hiệu điện thành hình ảnh động có thể hiển thị tại giường [1]. Do đó, theo dõi chức năng phổi và huyết động học trung tâm là những lĩnh vực ứng dụng lý tưởng và đầy hứa hẹn cho EIT.
Việc chăm sóc bệnh nhân phẫu thuật không chỉ giới hạn trong thời gian phẫu thuật mà còn mở rộng sang việc đánh giá trước phẫu thuật và theo dõi sau phẫu thuật. Đánh giá trước phẫu thuật cho phép xác định các yếu tố có thể cần được điều chỉnh để cải thiện kết quả của bệnh nhân. Theo dõi trong mổ cho phép cá nhân hóa các can thiệp dựa trên đặc điểm của bệnh nhân nhằm giảm các biến chứng sau mổ. Giám sát sau phẫu thuật mở rộng ra bên ngoài phòng mổ cho đến Đơn vị Chăm sóc Đặc biệt và các thủ thuật cấp cứu.
Trong bài đánh giá tường thuật này, chúng tôi sẽ tóm tắt các bằng chứng hiện tại về việc áp dụng EIT trong chăm sóc phẫu thuật cho bệnh nhân phẫu thuật (Bảng 1). Các mô hình EIT khác nhau có sẵn trên thị trường (Bảng 2). EIT đã được sử dụng thành công để a) cải thiện chất lượng của các thử nghiệm chức năng phổi trước phẫu thuật, b) để đánh giá những thay đổi về thể tích phổi trong quá trình gây mê, c) để theo dõi huyết động không xâm lấn và d) để tăng khả năng nhận biết sớm các biến chứng sau phẫu thuật. Cuối cùng, ứng dụng của công nghệ này để hỗ trợ các thủ tục phẫu thuật sẽ được phân tích.
Bảng 1 Các công cụ bắt nguồn từ EIT và ý nghĩa lâm sàng tương ứng trong các bối cảnh khác nhau (tiền phẫu, trong phẫu thuật, hậu phẫu, tại phòng gây mê không phẫu thuật) của chăm sóc bệnh nhân phẫu thuật
| Công cụ giám sát | Ý nghĩa lâm sàng |
| Tiền phẫu thuật | |
| Thử nghiệm khả năng hồi phục của thuốc giãn phế quản ở bệnh nhân hen suyễn (Frerichs, 2016) | Trợ giúp quản lý dược lý |
| Xác định bệnh nhân có nguy cơ cao bị giới hạn luồng khí thở ra (Vogt, 2016) | Phân tầng rủi ro, quản lý MV |
| Giảm FRC trong thời gian dẫn mê (Humphreys, 2011) | Lựa chọn chiến lược tiền oxygen hóa |
| Sử dụng trong phẫu thuật để cài đặt thông khí | |
| Đặc tính cơ học của các vùng phổi không phụ thuộc và phụ thuộc (Pereira, 2018) | Lựa chọn áp lực dương cuối kỳ thở ra Phòng ngừa xẹp phổi sau phẫu thuật |
| Khoảng lặng (Spadaro, 2018) | Lựa chọn áp lực dương cuối kỳ thở ra |
| Chỉ số độ trễ thông khí khu vực (Nestler, 2017) | Lựa chọn áp lực dương cuối kỳ thở ra Đáp ứng với các thao tác huy động |
| Trở kháng phổi cuối thì thở ra (Erlandsson, 2006) | Ước tính FRC
Lựa chọn áp lực dương cuối kỳ thở ra |
| Phân phối thông khí phổi trái và phải (Steinmann, 2008) | Xác nhận vị trí chính xác của ống nội khí quản 2 nòng |
| Sử dụng trong phẫu thuật để theo dõi huyết động | |
| Thay đổi động trong thể tích nhát bóp (Vonk-Noordegraaf, 2000) | Đánh giá khả năng đáp ứng dịch Quản lý dược lý |
| Sự thay đổi trở kháng theo chu kỳ ở động mạch chủ xuống (Maish, 2011) | Đánh giá biến thiên thể tích nhát bóp |
| Trước khi rút nội khí quản và sau phẫu thuật | |
| Xẹp phổi sau phẫu thuật (Pereira, 2018) | Chỉ định thông khí không xâm lấn sau mổ Xác định nhu cầu vận động sớm |
| Phân bố thông khí sau hút nội khí quản (Heinze, 2011) | Hiệu quả hút nội khí quản |
| Những thay đổi về hằng số thời gian thở ra theo khu vực (τ) (de La Oliva, 2017) | Xác định sớm co thắt phế quản Quản lý dược lý |
| Phòng gây mê không phẫu thuật | |
| Đánh giá thời gian thực về tác dụng của thuốc giãn mạch phổi (Frerichs, 2016) | Quản lý dược lý bệnh nhân tăng huyết áp phổi mãn tính |
| Xác định vị trí rửa phế quản-phế nang “mù” (Grieco, 2016) | Phát hiện chính xác vị trí lấy mẫu phổi |
| Những thay đổi lệch pha của trở kháng trong quá trình thở theo nhịp thở (Bläser, 2014) | Đánh giá tràn dịch màng phổi |
Bảng 2 Tóm tắt các thiết bị EIT được sử dụng trong các bài báo được thảo luận trong bài đánh giá
| Nghiên cứu | Thiết bị | Có bán trên thị trường (Y/N) | Số điện cực | Loại tái tạo hình ảnh |
| Frierichs, 2016 | Thiết bị Goe-MF II EIT (CareFusion, Höchberg, Đức) | N | 16 | GREIT; Thuật toán chiếu ngược (Krause, 2014) |
| Vogt, 2012 | ||||
| Vogt, 2016 | ||||
| Krause, 2014 | ||||
| Frerichs, 2019 | ||||
| Blaser, 2014 | ||||
| Erlandsson, 2006 | Dräger/GoeMFII, Lübeck, Đức | N | – | – |
| Nestler, 2017 | PulmoVista 500; Dräger Medical, Lübeck, | Y | 16 | – |
| Eonia, 2017 | Đức | |||
| Triệu, 2018 | ||||
| Grieco, 2016 | ||||
| Becher, 2018 | ||||
| Schaefer, 2014 | EIT Evaluation Kit 2, Dräger Medical, Lübeck, Đức | N | 32 | – |
| Steinman, 2008 | ||||
| Triệu, 2009 | ||||
| Triệu, 2013 | ||||
| Pereira, 2018 | Enlight 1800, (Timpel, Brazil) | Y | 32 | – |
| da Silva Ramos, 2018 | ||||
| Spadaro 2018 | Swisstom BB 2, Swisstom AG, Landquart, Thụy Sĩ | Y | 32 | – |
| Karagiannidis, 2018 | ||||
| Braun, 2018 | ||||
| Reinius 2015 | Enlight impedance tomography monitor (Timpel, Brasil) | N | 32 | |
| Yoshida, 2013 | Enlight impedance tomography monitor (Dixtal, Brasil) | N | 32 | Lưới phần tử hữu hạn 3-D và thuật toán ma trận độ nhạy được tuyến tính hóa |
| Alves, 2014 | ||||
| Vonk- Noordegraaf, 2000
Smit, 2002 |
Sheffield Applied Potential Tomograph (hệ thống thu thập dữ liệu di động DAS- 01P, nhãn hiệu I, IBEES, Sheffield, UK) | N | 16 | – |
| Maisch, 2011 | Enlight (Dixtal, Sao Paulo, Brazil) | N | 32 | – |
| Karsten, 2014 | EIT (Dräger Medical AG, Đức) | N | 32 | – |
| Rossi F, 2013 | Enlight® model DX-1800 (Dixtal, Sao Paulo, Brazil) | N | 16 | Lưới phần tử hữu hạn 3-D |
| De La Oliva, 2017 | Đai dệt tùy chỉnh và mô hình ngực 3 chiều dành riêng cho BN dựa trên chụp cắt lớp vi tính (Swisstom, Landquart, Thụy Sĩ | N | – | – |
| Frerichs 2019 | hệ thống Goe-MF II EIT; Viasys Healthcare, Höchberg, Đức | N | – | – |
Phương pháp
Một nghiên cứu sâu rộng đã được thực hiện từ tháng 1 năm 2018 đến tháng 3 năm 2019 bằng cách sử dụng cơ sở dữ liệu chính (Pubmed, Embase, Scopus) để xác định các bài báo liên quan đến việc sử dụng EIT trong giai đoạn trước phẫu thuật, trong phẫu thuật và sau phẫu thuật. Chỉ các bài báo tiếng Anh được xuất bản trên các tạp chí được lập chỉ mục đánh giá ngang hàng mới được xem xét. Kết quả của cuộc tìm kiếm này được báo cáo trong bài đánh giá tường thuật này có liên quan đến kinh nghiệm lâm sàng và khoa học của tác giả.
Kết quả
Nguyên tắc hình ảnh EIT
Chụp cắt lớp trở kháng điện là một kỹ thuật hình ảnh không xâm lấn, không bức xạ dựa trên khả năng dẫn điện khác nhau của các mô cơ thể. Cụ thể, khu vực khám phá của cơ thể được bao quanh bởi các điện cực (thường từ 16 đến 32), ghi lại điện áp bề mặt sau khi phát lặp đi lặp lại một lượng nhỏ dòng điện (thường là 5 mA) ở tần số 70–80 kHz [2]. Các điện cực thường được đặt trên dây đai và từng cặp điện cực liên tiếp được sử dụng luân phiên để phát dòng điện hoặc đo điện áp bề mặt. Do đó, các điện áp khác nhau được ghi lại trên bề mặt được tái tạo lại trong bản đồ nhị phân (hình ảnh) bằng các thuật toán chuyên dụng và khác nhau [3]. Khái niệm này có thể được áp dụng trong tĩnh (EIT tuyệt đối, a- EIT) [4] hoặc các tình huống động (EIT chức năng, f-EIT) [5] Với EIT chức năng, đó là kỹ thuật được sử dụng phổ biến nhất trong thực hành lâm sàng, sự thay đổi của trở kháng trong thời gian (∆Z) được tái tạo trong một hình ảnh động mã màu, ngày nay thường có sẵn tại giường của bệnh nhân. Một số bộ phận cơ thể đã được khám phá bằng cách sử dụng EIT, ví dụ như phổi và tim (EIT ngực), ngực [6, 7] và não [8], phổi – và gần đây là tim – những bộ phận được khám phá nhiều nhất. Các bản đồ trở kháng phụ thuộc vào thuật toán được sử dụng để chuyển đổi dữ liệu thô hiện tại thành hình ảnh. Một số thuật toán đã được phát triển trong những năm qua [3] để tối ưu hóa việc tái tạo hình ảnh và đối mặt với cái gọi là “bài toán nghịch đảo”, tức là quá trình tính toán độ dẫn điện bên trong của vật thể bằng cách đo điện áp bề mặt [9, 10]. Trên thực tế, người dùng cuối không có khả năng thay đổi thuật toán tái cấu trúc, điều này phụ thuộc vào nhà sản xuất, nhưng các bằng chứng gần đây cho thấy rằng các thuật toán khác nhau có thể dẫn đến các tham số thu được EIT tương tự [11].
Vai trò của EIT trong đánh giá trước phẫu thuật
Hình ảnh EIT trước phẫu thuật có khả năng cung cấp thông tin liên quan cho bác sĩ gây mê: điều này có thể ảnh hưởng đến chiến lược của họ trong thời gian phẫu thuật. Hình ảnh EIT đang trở thành một công cụ tích hợp cho các xét nghiệm phổi thông thường trước phẫu thuật ở những bệnh nhân bị bệnh phổi tắc nghẽn mãn tính (COPD) và hen suyễn [1]. Cụ thể, EIT cho thấy độ nhạy cao và nhanh đối với xét nghiệm đảo ngược thuốc giãn phế quản, do đó có khả năng ảnh hưởng đến việc quản lý dược lý chu phẫu ở cả bệnh nhân hen suyễn [12] và COPD [13] bằng cách ghi nhận những bệnh nhân bị tắc nghẽn ít nghiêm trọng hơn. Vì EIT có thể xác định tính không đồng nhất về không gian và thời gian của thông khí ở bệnh nhân COPD, [14] nó có thể ảnh hưởng đến cài đặt thông khí cơ học (mechanical ventilation − MV) chu phẫu bằng cách xác định những bệnh nhân có nguy cơ cao bị giới hạn luồng khí thở ra (expiratory airflow limitation − EFL) và siêu bơm phồng phổi (pulmonary hyperinflation), những người có thể cần thời gian thở ra lâu hơn và liệu pháp khí dung tích cực hơn. Thật vậy, cả EFL và siêu bơm phồng đã được chứng minh là làm tăng nguy cơ biến chứng phổi sau phẫu thuật [15] và do đó, việc nhận biết sớm những bệnh nhân có nguy cơ cao hơn có thể làm giảm tỷ lệ mắc bệnh trong quá trình phẫu thuật.
Vai trò của EIT trong quá trình gây mê
Dung tích cặn chức năng (Functional residual capacity − FRC) được định nghĩa là thể tích khí còn lại trong phổi khi kết thúc kỳ thở ra, trong điều kiện nghỉ ngơi (áp lực dương cuối kỳ thở ra bằng không). Mặc dù ai cũng biết rằng FRC giảm trong quá trình khởi mê [16], nhưng mức độ và tính biến thiên của việc giảm này ít được nghiên cứu hơn, có thể là do khó ước tính [17]. Một trong những mục tiêu của thở máy là giữ cho các giá trị FRC càng giống với các giá trị trước phẫu thuật càng tốt; thật vậy, việc giảm FRC xuống dưới thể tích đóng sẽ dẫn đến khí máu bị thay đổi do tăng mất tương xứng thông khí/tưới máu [18-20]. Ngược lại, tăng FRC trên các giá trị sinh lý có thể làm tăng thể tích phổi đến mức gần bằng tổng dung tích phổi trong thời gian đó, có khả năng làm tăng stress lên phổi [21]. Hiện tại, không thể dễ dàng đánh giá stress và strain tại giường bệnh vì chúng không thể được suy luận dựa trên các mục tiêu thông khí bắt nguồn từ cơ học hô hấp, chẳng hạn như thể tích khí lưu thông trên mỗi kg trọng lượng cơ thể hoặc áp lực bình nguyên [22]; hơn nữa, các hạn chế tương tự cũng áp dụng cho áp lực đẩy, một thông số gần đây được ủng hộ làm mục tiêu cho các cài đặt máy thở, tuy nhiên, thông số này chỉ phản ánh strain động khi áp lực dương cuối thì thở ra (PEEP) rất thấp (≤2 cmH2O) được sử dụng [17]. Những cân nhắc này thúc đẩy việc tìm kiếm các công cụ có sẵn trên giường để đánh giá tình trạng mất thông khí do gây mê và dung tích cặn chức năng trong phẫu thuật, có thể hướng dẫn cài đặt máy thở cho từng cá nhân. Theo tài liệu gần đây, hình ảnh EIT có thể đóng một vai trò trong bối cảnh này.
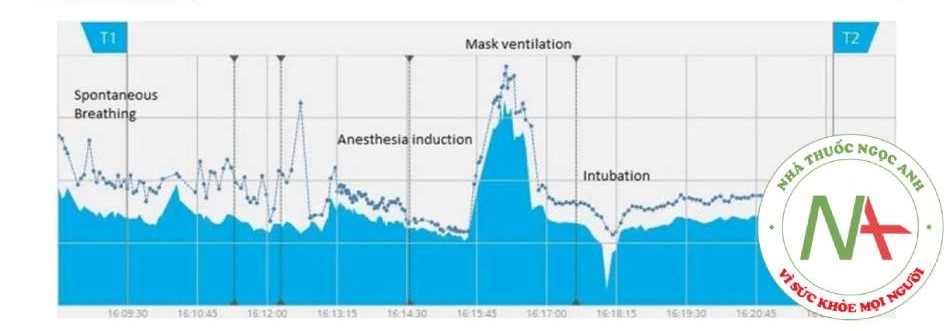
Ở trẻ em trải qua phẫu thuật tim [23], EIT cho thấy FRC giảm sau khi gây mê, điều này có thể đảo ngược bằng cách áp dụng PEEP. Tương tự, EIT cho thấy hiện tượng tương tự ở những bệnh nhân béo phì trải qua phẫu thuật cắt dạ dày nội soi [24]; ở những bệnh nhân này, tiền oxygen hóa bằng mặt nạ kín và PEEP 10 cmH2O có thể đảm bảo tăng FRC thoáng qua, hữu ích để tránh thiếu oxy trong quá trình khởi mê (Hình 1). Mặt khác, Nestler và cộng sự đã chứng minh cách thông khí bằng bóp bóng giúp thở qua mặt nạ mà không có PEEP dẫn đến giảm đáng kể FRC sau đặt nội khí quản [25]. Do đó, EIT dường như là một công cụ đầy hứa hẹn để theo dõi hiệu quả của các chiến lược tiền oxygen hóa khác nhau. Đáng chú ý, một thử nghiệm đang diễn ra (NCT03615417) đang sử dụng EIT để đánh giá xem Ống thông mũi lưu lượng cao (High Flow Nasal Cannula − HFNC) có thể ngăn ngừa suy giảm FRC trong quá trình gây mê hay không.
Vai trò của hình ảnh EIT trong phẫu thuật để hướng dẫn thở máy
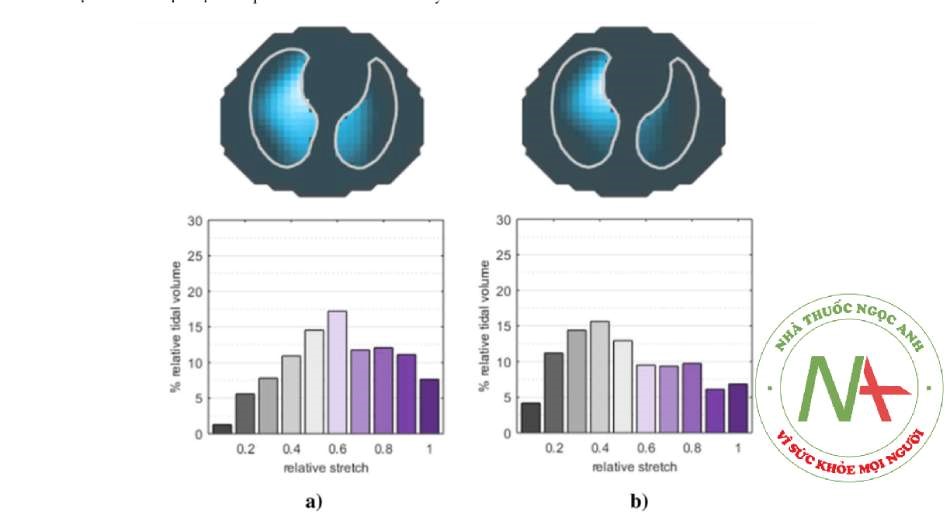
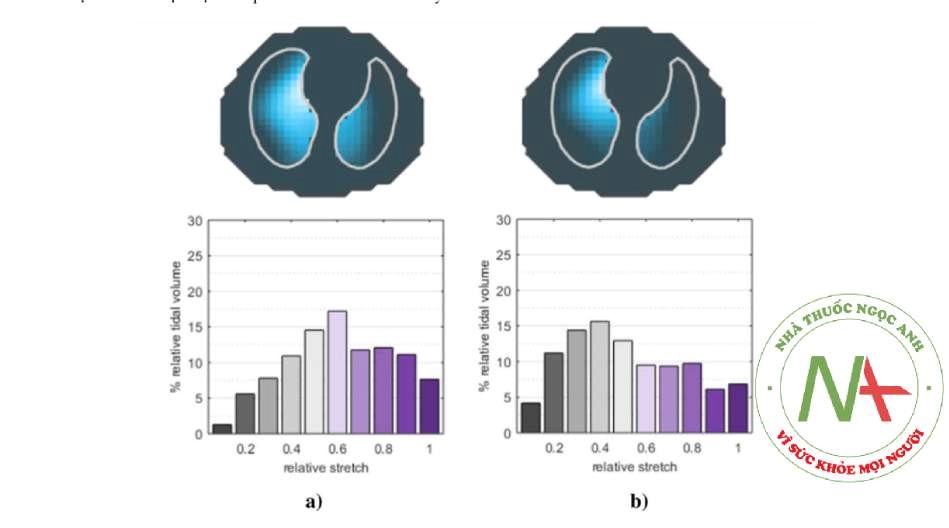
Chụp cắt lớp trở kháng điện có thể đánh giá chức năng phổi trong quá trình gây mê toàn thân bằng cách chụp ảnh thay đổi trong phân phối thông khí theo từng nhịp thở (Hình 2), giúp các bác sĩ điều chỉnh thở máy [26]. Trong vài năm gần đây, các phương pháp khác nhau đã được thử nghiệm để cá nhân hóa việc thở máy trong phẫu thuật theo EIT, đặc biệt tập trung vào chuẩn độ PEEP.
Hình 1 Trở kháng phổi cuối thì thở ra thay đổi trong quá trình gây mê. Đánh giá trở kháng phổi cuối thì thở ra (EELI, đường màu xanh lam liên tục) và trở kháng phổi cuối thì hít vào (EILI, các chấm màu xanh lam, đường màu xanh lam không liên tục) trong các thời điểm gây mê toàn thân khác nhau ở một bệnh nhân 65 tuổi trải qua phẫu thuật cắt túi mật nội soi. Lưu ý giảm TV và EELV trong quá trình gây mê và tăng EELV trong quá trình thông khí bằng mặt nạ với PEEP. Cuối cùng, thông khí ổn định và EELV đã đạt được sau khi đặt nội khí quản và bắt đầu thở máy có kiểm soát.
Hình 2 Phân bố thể tích khí lưu thông trong quá trình thở tự nhiên (a) và thở máy (b). Hình ảnh theo chu kỳ thở (trên) và phân bố độ căng tương đối (dưới) trong quá trình thở tự nhiên (a) và sau khi đặt nội khí quản và bắt đầu thở máy có kiểm soát (b) ở cùng một bệnh nhân được gây mê toàn thân. Trong quá trình thở máy, thể tích khí lưu thông được phân phối lại về phía phổi; hơn nữa, các khu vực giảm thông khí tăng lên, như được biểu thị bằng biểu đồ kéo dài tương đối (giá trị thấp hơn biểu thị thể tích khí lưu thông khu vực nhỏ hơn).
Gần đây, một phương pháp bao gồm việc tìm ra sự thỏa hiệp cơ học tốt nhất giữa các vùng phổi phụ thuộc và không phụ thuộc đã được chứng minh là giúp tăng cường oxygen hóa trong phẫu thuật và hạn chế áp lực đẩy, giảm thiểu cả căng quá mức và xẹp [27]. Thật thú vị, Pereira và cộng sự cho thấy giao thức cài đặt PEEP do EIT hướng dẫn này cũng có thể mang lại lợi ích cho chức năng hô hấp sau phẫu thuật, bằng cách ngăn ngừa sự phát triển của xẹp phổi sau phẫu thuật, được đánh giá bằng chụp cắt lớp vi tính. Những tác dụng có lợi này rõ rệt hơn ở những bệnh nhân trải qua nội soi ổ bụng so với các thủ thuật nội soi.
Nestler và cộng sự [25] đã sử dụng một tham số khác có nguồn gốc từ EIT để đặt PEEP ở những bệnh nhân béo phì được gây mê toàn thân: chỉ số độ trễ thông khí vùng (regional ventilation delay index − RVDI), được tính bằng độ lệch chuẩn của độ trễ thông khí vùng của tất cả các pixel, phản ánh sự xuất hiện của chu kỳ do chu kỳ thở gây ra huy động và xẹp. Sau một thao tác huy động, PEEP được chuẩn độ để giảm thiểu RVDI mang lại sự cải thiện đáng kể trong trao đổi khí và tính đồng nhất khu vực khi so sánh với mức PEEP cố định (5 cmH2O) nhưng không ảnh hưởng đến các thông số sau phẫu thuật.
Có thể đánh giá tác động của sự thay đổi PEEP đối với huy động phổi hoặc bơm phồng quá mức khi theo dõi Trở kháng phổi cuối thì thở ra (End Expiratory Lung Impedance − EELI). Nó biểu thị giá trị của trở kháng khi thở ra và sự thay đổi trong EELI sẽ phản ánh sự thay đổi thể tích phổi do PEEP. Erlandsson và cộng sự [24] đã chứng minh rằng, ở những bệnh nhân béo phì trải qua phẫu thuật nội soi, sự tăng/giảm độ chênh lệch của EELI sau khi thay đổi PEEP, cho thấy sự huy động/mất huy động tương ứng; trong khi đường theo chiều ngang tương ứng với thể tích phổi cuối thì thở ra ổn định, tức là PEEP tối ưu. Theo Mauri và cộng sự [28], mặc dù ở bệnh nhân suy hô hấp cấp tính, cho thấy có thể đo đạc mức độ huy động bằng cách trừ đi sự thay đổi EELI đo được giữa hai mức PEEP, lượng tăng trở kháng dự kiến từ độ giãn nở ở PEEP thấp hơn. Ngược lại, ở những bệnh nhân được gây mê toàn thân, có thể nghi ngờ bơm phồng phổi quá mức nếu sau khi tăng PEEP, mức tăng EELI thấp hơn mức dự đoán bởi mức PEEP thấp hơn. Một vấn đề quan trọng vẫn cần được giải quyết khi sử dụng EELI trong phẫu thuật là số lượng nhiễu điện tương đối cao được xác định bởi hệ thống giám sát.
EIT đã được sử dụng để xác nhận vị trí chính xác của ống nội khí quản 2 nòng (double lumen tubes − DLT) và để điều chỉnh kết hợp thể tích khí lưu thông/PEEP ở những bệnh nhân cần thông khí một phổi (one lung ventilation − OLV). Hơn nữa, mặc dù tiêu chuẩn vàng để kiểm tra định kỳ vị trí chính xác của DLT là nội soi phế quản sợi quang, nhưng EIT có thể không xâm lấn nhận ra vị trí ban đầu của DLT trong phế quản gốc đối diện bằng cách hiển thị chính xác thông khí phổi trái và phải [29]. Khi chuyển từ thông khí hai phổi (two lung ventilation − TLV) sang OLV, tính chất cơ học của phổi được thông khí sẽ thay đổi. Vị trí bên và loại trừ một phổi khỏi thông khí xác định sự thay đổi về độ giãn nở của phổi, sức cản và phân bố thể tích khí lưu thông. Do đó, cả thể tích khí lưu thông (tidal volume − TV) và PEEP nên được điều chỉnh lại trong quá trình phẫu thuật, làm tăng thêm sự phức tạp cho việc quản lý thông khí cho những bệnh nhân này [19]. Tất cả những thay đổi này có thể được phát hiện bởi EIT: bằng cách sử dụng chỉ số không đồng nhất có nguồn gốc từ EIT (GI, chỉ số không đồng nhất toàn cục – global inhomogeneity index), Zhao và cộng sự [30] cho thấy có thể chuẩn độ sự kết hợp giữa PEEP và TV ở những bệnh nhân chuyển từ TLV sang OLV. Trong nghiên cứu của họ, GI tương quan với sự phân bố khí trong phổi, cho thấy khả năng so sánh tốt giữa các bệnh nhân. Các tác giả tương tự gần đây đã khám phá xem liệu phân phối thông khí khu vực (được đo bằng EIT) và PaO2 có thể giúp chuẩn độ TV và PEEP trong OLV [31].
Đặt PEEP phù hợp có thể phù hợp với việc chăm sóc bệnh nhân trong và sau phẫu thuật. Trong quá trình gây mê toàn thân, hơn 90% bệnh nhân bị xẹp phổi, chủ yếu là do giảm FRC [16, 18]. Như đã chỉ ra trước đây trong tổng quan hiện tại, lượng mất FRC trong phẫu thuật là không thể đoán trước và không ổn định, không chỉ bị ảnh hưởng bởi các đặc điểm của bệnh nhân (BMI, chức năng phổi, tuổi) hoặc kỹ thuật gây mê mà còn bởi các biến số trong phẫu thuật như tư thế (ví dụ: tư thế Trendelenburg) và thủ tục phẫu thuật (tức là bơm CO2 vào khoang phúc mạc). Vì chúng tôi có thể đánh giá tổn thất FRC theo thời gian thực bằng cách sử dụng EIT, như thể hiện ở một bệnh nhân đại diện (Hình 1), quá trình theo dõi này có khả năng cho phép thiết lập mức PEEP động được cá nhân hóa, thích ứng với những thay đổi trong toàn bộ quy trình phẫu thuật.
Các khu vực thông khí kém gợi ý xẹp phổi – được gọi là “Khoảng im lặng” (Silent Spaces) [32] – đã được xác định bởi Ukere và cộng sự sử dụng EIT ở bệnh nhân tỉnh táo và gây mê ở các vị trí cơ thể khác nhau. Vì xẹp phổi có thể làm giảm khả năng trao đổi khí – bằng cách tăng tỷ lệ shunt – và tăng nguy cơ biến chứng sau phẫu thuật – có thể là tâm điểm của nhiễm trùng – nên người ta có thể kỳ vọng rằng việc theo dõi “Khoảng im lặng” có thể cải thiện việc chăm sóc bệnh nhân trong phẫu thuật nếu PEEP được cài đặt để giảm số lượng của chúng.
EIT có thể hữu ích trong quá trình gây mê không chỉ để giảm thiểu hiện tượng xẹp phổi mà còn bởi vì nó có thể đo lưu lượng khu vực (tức là luồng không khí làm phồng phần khác của phổi, theo hằng số thời gian của chúng). Kỹ thuật này có thể hữu ích để khám phá hiện tượng chưa được hiểu rõ như giới hạn lưu lượng thở ra theo khu vực [33]. Điều này có thể liên quan đến lâm sàng vì EFL có liên quan đến kết quả xấu như tăng nguy cơ biến chứng phổi sau phẫu thuật, thất bại khi rút nội khí quản và tổn thương đường thở trong hội chứng suy hô hấp cấp tính [34, 35]. Làm thế nào EFL được phân phối theo khu vực trong quá trình gây mê toàn thân vẫn chưa được hiểu rõ và EIT có thể bổ sung những hiểu biết thú vị về sự hiểu biết của nó.
Một khía cạnh thú vị khác cần được đánh giá trong quá trình gây mê toàn thân là tỷ lệ giữa thông khí và tưới máu. Theo dõi tưới máu phổi do EIT hướng dẫn, sử dụng phương pháp tiêm nước muối ưu trương, sẽ mở ra những khả năng mới để chuẩn độ MV nhắm vào sự không phù hợp giữa thông khí/tưới máu. Tuy nhiên, cho đến nay, tính khả thi của việc đánh giá phân phối thông khí và tưới máu trong phẫu thuật chỉ được khám phá trong các mô hình thử nghiệm của OLV với kết quả đầy hứa hẹn [36].
Mặc dù tính hữu ích của EIT trong việc đánh giá thông khí trong phẫu thuật đã được nhấn mạnh bởi số lượng thử nghiệm ngày càng tăng, nhưng vẫn không có RCT nào cho thấy mối tương quan trực tiếp giữa việc sử dụng EIT và các biến chứng sau phẫu thuật, đặc biệt là các biến chứng phổi sau phẫu thuật (pulmonary postoperative complication − PPC). Điều này có thể được giải thích là do cỡ mẫu phù hợp cần thiết để giải quyết kết quả này [37] và chi phí vẫn còn cao cũng như sự hỗ trợ chuyên nghiệp cần thiết để ghi danh một số lượng lớn bệnh nhân vào các nghiên cứu sử dụng EIT.
Xem thêm: Chụp cắt lớp trở kháng điện trong hội chứng nguy kịch hô hấp cấp.
Sử dụng EIT trong phẫu thuật để theo dõi huyết động
Cải thiện độ chính xác của việc theo dõi trong khi giảm thiểu xâm lấn là hai mục tiêu trái ngược nhau của quản lý huyết động trong phẫu thuật trong thời đại của phương pháp “tăng cường phục hồi sau phẫu thuật” [38]. Liệu pháp hướng mục tiêu cải thiện kết quả phẫu thuật và giảm nguy cơ biến chứng sau phẫu thuật [39, 40]; do đó, việc truyền dịch trong phẫu thuật và sử dụng thuốc vận mạch nên được hướng dẫn bằng cách đánh giá động chức năng tim và phát hiện khả năng đáp ứng của dịch. Mặt khác, việc sử dụng thường xuyên các phương thức theo dõi tiên tiến ở bệnh nhân phẫu thuật bị cản trở bởi nguy cơ biến chứng [41].
EIT có thể cung cấp một giải pháp thay thế không xâm lấn để theo dõi huyết động trong quá trình phẫu thuật. Vonk-Noordegraaf cho thấy những thay đổi về thể tích máu tim được đánh giá bởi EIT có thể được sử dụng để đo thể tích nhát bóp (stroke volume − SV) ở những bệnh nhân ổn định về mặt lâm sàng [42]. Điều này đã được xác nhận trong một nghiên cứu thực nghiệm, trong đó những thay đổi về trở kháng tim được đo bằng EIT tương quan với SV được đánh giá bằng phương pháp pha loãng nhiệt xuyên phổi [43]. Cần lưu ý rằng độ chính xác có thể chấp nhận được trong ước tính SV bằng EIT chỉ có thể đạt được trong cả hai nghiên cứu khi hiệu chuẩn được thực hiện theo phương pháp tham chiếu (nghĩa là pha loãng nhiệt). Đây có thể là một giới hạn lớn đối với việc sử dụng EIT để theo dõi huyết động không xâm lấn. Tuy nhiên, việc đạt được giá trị tuyệt đối của SV có thể không cần thiết để theo dõi trong phẫu thuật. Thật vậy, việc đánh giá những thay đổi tương đối của SV gây ra bởi một thách thức (challenge) (ví dụ như test dịch truyền) có thể đủ để hướng dẫn quản lý huyết động. Theo đó, trong một mô hình thử nghiệm về sốc xuất huyết và hồi sức thể tích, trong đó những thay đổi về trở kháng tâm thu trong phổi được sử dụng để theo dõi những thay đổi ở SV, EIT đã chứng minh khả năng theo dõi xu hướng chấp nhận được [44].
Khả năng đánh giá các chỉ số động về khả năng đáp ứng chất lỏng của EIT đã được thử nghiệm trong các nghiên cứu thực nghiệm. Biến thiên thể tích nhát bóp (Stroke volume variation − SVV) là một thông số động dự đoán khả năng đáp ứng của dịch: những thay đổi theo chu kỳ của SV do thông khí gây ra (tương tác tim-phổi) lớn hơn khi tim hoạt động trên phần dốc của đường cong Starling; do đó, các giá trị của SVV trên ngưỡng cho thấy rằng sự gia tăng tiền tải sẽ dẫn đến sự gia tăng thể tích nhát bóp (khả năng đáp ứng dịch truyền) [45]. Hiện tại, các chỉ số động về khả năng đáp ứng dịch truyền không thể được đánh giá một cách đáng tin cậy bằng các kỹ thuật không xâm lấn trong điều kiện huyết động không ổn định [46, 47]. Một nghiên cứu thử nghiệm tiên phong đã chứng minh khả năng của EIT trong việc đánh giá SVV tâm thất trái bằng những thay đổi trở kháng theo chu kỳ ở động mạch chủ xuống, trên một loạt các điều kiện thể tích và cài đặt thông khí [48].
Việc áp dụng EIT để theo dõi huyết động là một lĩnh vực nghiên cứu mới với kết quả đầy hứa hẹn, nhưng vẫn còn sơ bộ. Việc sử dụng EIT trong đánh giá SV giả định rằng tín hiệu tim EIT phụ thuộc vào lưu lượng máu của tâm thất. Tuy nhiên, việc xác định tín hiệu EIT liên quan đến tim không được xác định rõ, ví dụ khó phân tách, trên mặt cắt ngang EIT, tâm thất từ tâm nhĩ [42] hoặc từ các cấu trúc khác gần với tim về mặt giải phẫu, ví dụ như động mạch chủ hoặc các động mạch phổi [49] Ngoài ra, những thay đổi về vị trí cơ thể và tim [50], thể tích phổi và hematocrit có thể xảy ra trong quá trình phẫu thuật và có thể ảnh hưởng đến tín hiệu EIT [51]. Độ tin cậy của các phép đo không hiệu chuẩn phải được nghiên cứu trong tình trạng huyết động không ổn định. Những tương tác nhiễu do hệ thống điều hành điện từ và tràn khí màng bụng có thể cản trở việc theo dõi liên tục trong phẫu thuật. Bất chấp những hạn chế tiềm ẩn này, EIT có ưu điểm là không xâm lấn, cung cấp các phép đo động theo thời gian thực, không phụ thuộc vào người vận hành [52] và cho phép theo dõi liên tục trong thời gian hậu phẫu.
Vai trò của giám sát EIT trong giai đoạn hậu phẫu
Mặc dù tình trạng xẹp phổi có thể tăng lên sau khi gây mê và trong quá trình phẫu thuật do tư thế cơ thể, liệu pháp truyền dịch hoặc tràn khí màng bụng, cần lưu ý rằng nguy cơ xẹp phổi vẫn còn cao ngay sau khi kết thúc phẫu thuật và/hoặc sau khi rút ống nội khí quản. Những lý do chính là do thuốc mê kéo dài, làm giảm nỗ lực hít vào và áp lực xuyên phổi, suy giảm phản xạ ho và giảm khả năng làm sạch dịch tiết do thuốc liệt cơ còn lại và/hoặc kiểm soát cơn đau kém. Điều này có thể là nguyên nhân của các biến chứng phổi sau phẫu thuật. Do đó, những thay đổi trong phân phối thông khí và giảm EELI được đo bằng EIT có thể là dấu hiệu sớm và nhạy cảm của chứng xẹp phổi sau phẫu thuật.
Schaefer và cộng sự [26] đã mô tả tính khả thi để theo dõi sự phân bố thể tích khí lưu thông khu vực trước khi gây mê, trong phẫu thuật, sau khi rút nội khí quản và trong chăm sóc hậu phẫu. Các tác giả đã chỉ ra rằng thông khí theo chu kỳ thở dịch chuyển về phía phần bụng của phổi trong quá trình gây mê toàn thân với thuốc liệt cơ. Khi nhịp thở tự nhiên được phục hồi và sau khi rút nội khí quản, quá trình thông khí và tái thông khí cho phần lưng của phổi đã được phục hồi, với sự thông khí đồng nhất cho thấy phổi khỏe mạnh và không bị xẹp phổi. Ngay cả khi sử dụng cài đặt PEEP trong phẫu thuật được cá nhân hóa và thủ thuật huy động trước khi rút nội khí quản, EELV sớm sau phẫu thuật vẫn thấp hơn so với trước khi gây mê [25]. Vì việc giảm EELV có thể làm tăng nguy cơ phát triển chứng xẹp phổi sau phẫu thuật, nên việc theo dõi EIT có thể hỗ trợ xác định những bệnh nhân béo phì bị giảm EELV, những người có thể hưởng lợi từ việc thở máy không xâm lấn và vận động sớm. Thật vậy, Reychler và cộng sự [53] đã mô tả những tác động tích cực của vật lý trị liệu sớm bao gồm đo phế dung gắng sức và áp dụng PEEP và thể tích khí lưu thông ở những bệnh nhân sớm sau phẫu thuật. Karsten và cộng sự đã sử dụng EIT để đánh giá tác động của PEEP thấp so với cao trong phẫu thuật nội soi đối với phân phối thông khí sau phẫu thuật và cho thấy rằng PEEP trong phẫu thuật cao hơn gây ra phân phối thông khí đồng nhất hơn trong giai đoạn đầu hậu phẫu [54].
Một số nghiên cứu [55, 56] đã đánh giá tính khả thi, độ chính xác và hiệu quả của việc theo dõi kiểu hô hấp của bệnh nhân sau phẫu thuật bằng các thiết bị trở kháng điện đơn giản. Công nghệ này không cho phép theo dõi sự phân bố thông khí theo khu vực vì các điện cực chỉ được định vị ở phần trước của ngực, nhưng nó đưa ra các ước tính liên tục không xâm lấn chính xác về nhịp hô hấp và thể tích khí lưu thông. Bằng cách này, việc giảm thông khí phút có thể được phát hiện trước khi chúng gây ra tình trạng giảm độ bão hòa oxy ngoại vi hoặc tăng EtCO2.
EIT cũng có thể hữu ích để kiểm tra tác động của việc hút đàm qua nội khí quản, một thủ thuật được áp dụng rộng rãi trước khi rút nội khí quản. Heinze và cộng sự [57] đã mô tả sự thay đổi của vùng bụng trong phân bố thông khí sau khi hút, có khả năng cho thấy sự giảm huy động ở vùng lưng. Thật thú vị, sự thay đổi trong thông khí có tương quan với việc giảm EELV sau khi hút. Ở những bệnh nhân có những thay đổi như vậy, việc huy động có thể được chỉ định sau khi hút trước khi rút nội khí quản.
Tiềm năng tương tự đối với việc sử dụng EIT trong giai đoạn đầu sau phẫu thuật đã được báo cáo trong lĩnh vực nhi khoa. Krause và cộng sự [58] đã mô tả sự thay đổi của phân bố thể tích khí lưu thông đối với vùng lưng phổi sau khi rút nội khí quản ở trẻ sơ sinh và trẻ em trải qua phẫu thuật tim, do đó xác nhận dữ liệu được báo cáo ở người lớn. Ở trẻ non tháng, Rossi và cộng sự [59] tiếp tục cho thấy mức độ đồng nhất của thông khí được đo bằng EIT có thể hướng dẫn ứng dụng CPAP dự phòng sau khi rút nội khí quản.
Co thắt phế quản là một biến chứng khác của giai đoạn đầu sau rút ống, đặc biệt ở những bệnh nhân có tiền sử hen suyễn, COPD hoặc đường thở phản ứng quá mức như bệnh nhi. De la Oliva và cộng sự [60] đã sử dụng EIT để theo dõi những thay đổi về hằng số thời gian thở ra (τ) toàn cục và khu vực ở một bệnh nhi sớm sau khi ghép gan. Các tác giả đã chỉ ra sự phân bố không đồng nhất của EIT khi tăng τ trong quá trình co thắt phế quản với sự thay đổi của thông khí và bẫy khí ở phổi bụng và giảm nhanh chóng của τ và tính không đồng nhất sau khi hút và tiêm salbutamol.
Giám sát EIT trong quá trình chẩn đoán chu phẫu
Do sử dụng đơn giản, không bức xạ và khả năng cung cấp các phép đo động, EIT đã được đề xuất như một công cụ giám sát trong nhiều tình huống lâm sàng bên ngoài phòng mổ.
Như đã đề cập, EIT ngực có thể hỗ trợ kiểm tra chức năng phổi cấp cứu ở những bệnh nhân mắc bệnh hô hấp mãn tính; tích hợp các kết quả từ các chỉ số bắt nguồn từ lưu lượng/thể tích thông thường và hình ảnh chụp ngực cho phép xác định sự không đồng nhất về không gian và thời gian trong thông khí vùng [13, 61], với khả năng đánh giá thời gian thực các thay đổi do thuốc gây ra [12]. Theo nghĩa này, EIT cũng đã được chứng minh là phát hiện đáng tin cậy trong thời gian thực các tác động lên mạch máu của thuốc giãn mạch phổi ở bệnh nhân tăng huyết áp phổi mãn tính [62].
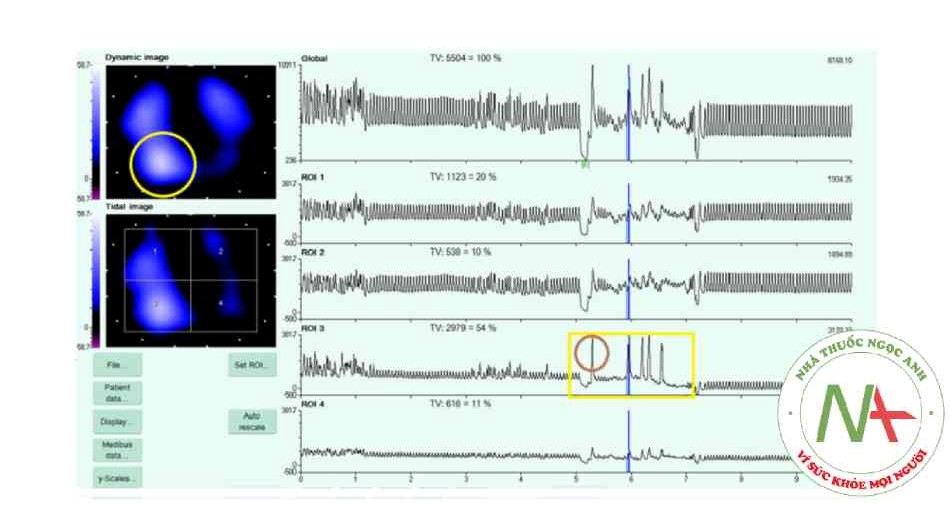
EIT đã được đề xuất để giám sát vị trí lấy mẫu trong quá trình rửa phế quản-phế nang ‘mù’ (broncho-alveolar lavage − BAL) không nội soi phế quản để chẩn đoán viêm phổi (Hình 3) [63]. BAL không soi phế quản là một giải pháp thay thế đơn giản, dễ quản lý và tiết kiệm chi phí cho BAL với nội soi phế quản mềm; tuy nhiên, một số tác giả gợi ý rằng nên thực hiện lấy mẫu phổi vi sinh ở khu vực có thâm nhiễm X quang, đảm bảo các công cụ xác định chính xác vị trí rửa chính xác trong trường hợp không thực hiện thủ thuật nội soi phế quản [64]. Trong một nghiên cứu gần đây được thực hiện trên heo con, các tín hiệu EIT từ hơn một trăm quy trình BAL đã được phân tích một cách có hệ thống: EIT xác định hiệu quả các khu vực bơm nước muối bằng cách giảm đột ngột trở kháng ngực [65]. Nghiên cứu này được thực hiện trong thời gian ngừng thở và bơm nước muối làm giảm trở kháng phổi: một báo cáo trước đây cho thấy rằng, nếu quy trình được thực hiện ở người được thở máy, thì bơm nước muối thay vì tạo ra sự gia tăng trở kháng phổi ở vùng liên quan, có thể là do sự phân phối lại cục bộ của thể tích khí lưu thông và sự cùng tồn tại của chất khí và chất lỏng trong quang phổ của EIT [64, 65, 66]. Cả hai nghiên cứu dường như nhất quán trong việc chỉ ra rằng EIT có khả năng phát hiện chính xác vị trí lấy mẫu phổi trong các thủ thuật mù.
Ở những bệnh nhân bị tràn dịch màng phổi, những thay đổi EIT ‘nghịch lý’ ngoài pha (tăng khi thở ra và giảm khi hít vào) có thể xảy ra trong quá trình thở bình thường, có thể là do hiện tượng vượt quá do thuật toán tái tạo hình ảnh tạo ra trong trường hợp các khu vực ở gần nhau với những thay đổi trở kháng liên quan đến thông khí cao và thấp [67, 68].
Hình 3 Hình ảnh chụp cắt lớp trở kháng điện (EIT) thu được trong quá trình rửa phế quản phế nang không nội soi (blind BAL) được thực hiện ở phổi lưng. (Grieco và cộng sự, Intensive Care Med (2016) 42: 1088)
Một cách nhất quán, những thay đổi ngoài pha của trở kháng trong quá trình thở bình thường, liên quan đến toàn bộ thì hít vào và do đó khác với hiện tượng pendelluft (tức là chuyển động nghịch lý của không khí từ vùng phổi không phụ thuộc sang phổi phụ thuộc trong giai đoạn hít vào rất sớm) [69], đã được chứng minh là rất gợi ý về sự hiện diện của tràn dịch màng phổi và có thể hỗ trợ chẩn đoán lâm sàng [66]. Một số loại bệnh nhân được dẫn lưu dịch màng phổi bên ngoài khung cảnh phòng mổ. EIT đại diện cho một công cụ đơn giản, có sẵn đầu giường để theo dõi quá trình tái thông khí của phổi do dẫn lưu tràn dịch màng phổi. Trong một nghiên cứu tiền cứu trên 22 bệnh nhân trải qua thủ thuật do tràn dịch màng phổi ác tính, EIT có độ tin cậy cao trong việc ghi nhận sự tái thông của phổi cùng bên và phổi đối chứng, xảy ra ngay lập tức mà không có thay đổi gì thêm trong giờ tiếp theo [70].
Xem thêm: Các kịch bản lâm sàng của ứng dụng chụp cắt lớp trở kháng điện trong chăm sóc tích cực ở trẻ em.
Giới hạn và các chủ đề trong tương lai
Mặc dù EIT hiện đã có sẵn tại giường và đã được áp dụng cho một số tình huống lâm sàng, nhưng đây vẫn là một kỹ thuật “đầy hứa hẹn”. Ngoài các khía cạnh đã được giải quyết trong lần xem xét hiện tại, EIT phải giải quyết một số hạn chế kỹ thuật cần phải đối mặt trong tương lai. So với các kỹ thuật hình ảnh khác được sử dụng trong lĩnh vực gây mê như siêu âm hoặc chụp CT, EIT có độ phân giải không gian tương đối thấp [71]. Hơn nữa, vị trí của các điện cực có thể thay đổi hình ảnh thu được, làm nảy sinh các vấn đề về khả năng tái tạo trong và ngoài bệnh nhân [72]. Hơn nữa, công nghệ EIT hiện có sẵn tại giường khám phá mặt phẳng ngang 3 chiều cung cấp hình ảnh 2 chiều. Các kỹ thuật tái tạo mới đang được phát triển để hiển thị lát cắt mô đã khám phá thành hình ảnh 3 chiều [73]. Cuối cùng, không thể theo dõi bệnh nhân sử dụng máy tạo nhịp tim hoặc máy khử rung tim cấy ghép bằng EIT vì không có bằng chứng về sự can thiệp giữa cấy ghép hoạt động và phép đo chụp cắt lớp trở kháng.
Kết luận
Chụp cắt lớp trở kháng điện là một công cụ đầy hứa hẹn để cá nhân hóa việc chăm sóc phẫu thuật cho bệnh nhân phẫu thuật. Việc sử dụng nó có thể cải thiện việc đánh giá trước phẫu thuật, theo dõi trong phẫu thuật và nhận biết sớm các biến chứng sau phẫu thuật. Bên cạnh những hạn chế kỹ thuật vốn có của công nghệ này, cần phải thực hiện một số bước để làm cho EIT phù hợp hơn với y học chu phẫu. Để tạo thuận lợi cho việc sử dụng EIT trong phòng mổ, việc phát triển các thuật toán chuyển thông tin hình ảnh thành các chỉ số sinh lý sẽ là chìa khóa. Tính khả dụng và tính di động của máy nên được tăng lên. Hơn nữa, nếu khả năng theo dõi các thay đổi trong sinh lý tim mạch và hô hấp chu phẫu đã được chứng minh có ảnh hưởng đến kết quả lâm sàng, thì cần có các nghiên cứu để xác định rõ ràng các thông số cần theo dõi, và để xác định các giá trị tham chiếu và mục tiêu điều trị cho từng ứng dụng. Các bác sĩ gây mê sẽ cần có kinh nghiệm trong việc thu thập và giải thích dữ liệu EIT. Do đó, các nghiên cứu sâu hơn là cần thiết để làm rõ toàn bộ khả năng của công nghệ mới này trước khi việc sử dụng rộng rãi có thể được thực hiện một cách an toàn.