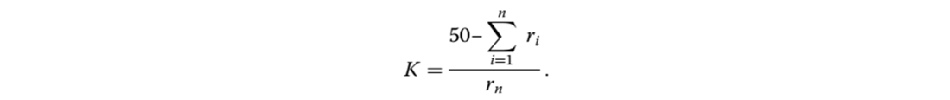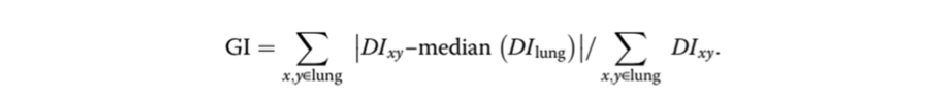Bệnh hô hấp
Chụp cắt lớp trở kháng điện trong hội chứng nguy kịch hô hấp cấp
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Chụp cắt lớp trở kháng điện trong hội chứng nguy kịch hô hấp cấp. Tải file pdf ở đây.
Dịch bài: BS. Đặng Thanh Tuấn – BV Nhi Đồng 1
Tóm tắt
Hội chứng nguy kịch hô hấp cấp tính (ARDS) là một thực thể lâm sàng ảnh hưởng sâu sắc đến nhu mô phổi và được đặc trưng bởi tổn thương phế nang lan tỏa và tăng tính thấm thành mạch phổi. Hiện nay, chụp cắt lớp vi tính (computed tomography − CT) thường được sử dụng để phân loại và tiên lượng ARDS. Tuy nhiên, việc thực hiện xét nghiệm này ở những bệnh nhân nguy kịch rất phức tạp, do cần phải chuyển những bệnh nhân này đến phòng CT. May mắn thay, các công nghệ mới đã được phát triển cho phép theo dõi bệnh nhân ngay tại giường bệnh. Chụp cắt lớp trở kháng điện (electrical impedance tomography − EIT) là một công cụ giám sát cho phép người ta đánh giá tại giường bệnh sự phân phối thông khí phổi liên tục, trong thời gian thực và đã được chứng minh là hữu ích trong việc tối ưu hóa các thông số thở máy ở những bệnh nhân nguy kịch. Một số ứng dụng lâm sàng của EIT đã được phát triển trong những năm qua và kỹ thuật này ngày càng thu hút sự quan tâm của các nhà nghiên cứu. Tuy nhiên, trong số các bác sĩ lâm sàng, vẫn còn thiếu kiến thức về các nguyên tắc kỹ thuật của EIT và các ứng dụng tiềm năng ở bệnh nhân ARDS. Mục đích của tổng quan này là trình bày các đặc điểm, khái niệm kỹ thuật và ứng dụng lâm sàng của EIT, có thể cho phép theo dõi chức năng phổi tốt hơn trong ARDS.
Bối cảnh
Hội chứng nguy kịch hô hấp cấp tính
Hội chứng nguy kịch hô hấp cấp tính (acute respiratory distress syndrome − ARDS) là một thực thể lâm sàng ảnh hưởng sâu sắc đến nhu mô phổi và có thể được kích hoạt bởi một số điều kiện dễ mắc phải. ARDS được đặc trưng bởi tổn thương phế nang lan tỏa, tăng tính thấm thành mạch phổi, tăng trọng lượng phổi và mất thông khí phổi. Về mặt lâm sàng, dấu hiệu đặc trưng của hội chứng này là tình trạng thiếu oxy cấp tính với thâm nhiễm phổi hai bên trên X quang ngực mà không được giải thích đầy đủ bởi các bất thường về tim hoặc tăng thể tích máu [1].
Hiện tại, 10% bệnh nhân trong các đơn vị chăm sóc đặc biệt (ICU) và 23% bệnh nhân thở máy mắc ARDS [2]. Ngoài tỷ lệ tử vong cao (khoảng 40%) [1, 2], ARDS còn đi kèm với bệnh tật lâu dài như yếu cơ, khuyết tật nhận thức, trầm cảm và rối loạn căng thẳng sau chấn thương [3].
Một trong những đặc điểm cơ bản của ARDS là sự gia tăng tính thấm thứ phát của tế bào biểu mô và nội mô do tạo ra các khoảng trống tế bào [4]. Phù do viêm gây ra sự mất ổn định vùng khoảng khí và sự xẹp khu vực, làm cho phổi bị thông khí không đồng nhất, với một độ chênh lệch đáng chú ý của sự xẹp phổi về phía các khu vực phụ thuộc (độ chênh lệch do chồng lên) [5]. Tính không đồng nhất của nhu mô ở bệnh nhân ARDS, khi được định lượng bằng chụp cắt lớp vi tính (CT), tương quan với mức độ nghiêm trọng của hội chứng và tỷ lệ tử vong liên quan [6]. Lượng mô bình thường được sục khí trong phổi của bệnh nhân mắc ARDS dạng lan tỏa thay đổi từ 200 đến 500 g, có thể so sánh với kích thước phổi của một đứa trẻ 5 tuổi, đó là lý do tại sao thuật ngữ “phổi trẻ em” đã được đặt ra [7].
Trong ARDS, có một độ chênh lệch dọc đặc trưng của xẹp phổi và/hoặc tràn ngập các khoảng khí ở lưng. Vì tuần hoàn phổi tốt nhất là được phân phối đến cùng các vùng lưng này, các khu vực rộng lớn có tỷ lệ V/Q giảm hoặc shunt thực sự được tạo ra. Trong những điều kiện này, thể tích khí lưu thông được áp dụng sẽ được hướng đến các vùng bụng, gây áp lực lớn lên chúng và do đó gây tổn thương phổi do máy thở (VILI) [8-11], ngay cả khi sử dụng các giao thức thở máy bảo vệ [12, 13].
CT là một công cụ hữu ích trong việc quản lý và nghiên cứu bệnh nhân mắc ARDS. Nó đã cho phép đánh giá các hiện tượng liên quan đến sự phát triển của VILI, chẳng hạn như mở và đóng khoảng khí theo chu kỳ, quá căng phế nang [14], và strain toàn cục và khu vực [15, 16]. Ngoài ra, nó đã cung cấp thông tin liên quan cho việc ra quyết định lâm sàng, chẳng hạn như định lượng khả năng huy động [17]. Tuy nhiên, việc sử dụng bức xạ và nhu cầu chuyển bệnh nhân đến phòng CT đã hạn chế việc sử dụng thường quy. Trong kịch bản này, trong những năm qua, chụp cắt lớp trở kháng điện (EIT) đã nổi lên như một thiết bị quan trọng để theo dõi và điều chỉnh việc quản lý bệnh nhân thở máy.
Khái niệm chụp cắt lớp trở kháng điện
EIT là một công cụ hình ảnh lâm sàng không xâm lấn, không có bức xạ để theo dõi sự phân bố thông khí., trong thời gian thực và ngay tại giường bệnh, tái tạo hình ảnh EIT dựa trên ước tính sự thay đổi điện trở suất (resistivity) xảy ra trên phổi khi thở [18]. Sự gia tăng điện trở suất xảy ra với sự bơm phồng phổi là do sự mỏng đi và kéo dài của vách phế nang, cả hai đều làm suy giảm dòng điện đi qua. Điện trở suất đã được báo cáo là tăng hơn gấp đôi khi hít thở sâu [19] và tương quan chặt chẽ với lượng không khí đi vào phổi. EIT cũng có thể theo dõi sự phân bố lưu lượng máu phổi, sau khi tiêm tĩnh mạch dung dịch muối ưu trương.
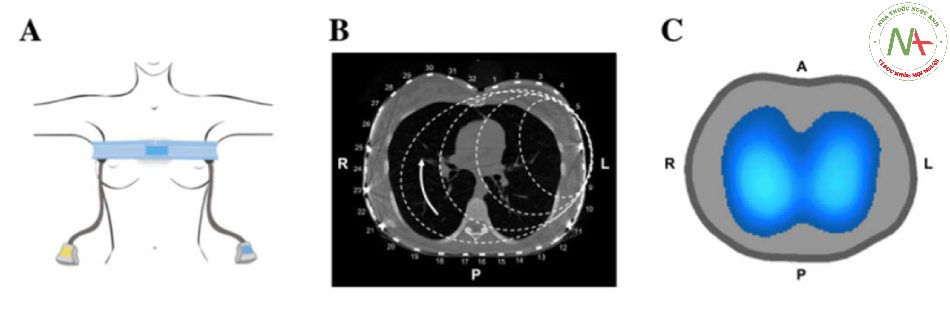
Các nguyên tắc của hình ảnh EIT đã được mô tả chi tiết ở nơi khác [20]. Tóm lại, các dòng điện xoay chiều nhỏ được phân phối qua 8–32 (tùy thuộc vào kiểu máy và nhãn hiệu) các điện cực cách đều nhau được áp dụng theo chu vi xung quanh ngực (Hình 1a). Thông thường, một cặp điện cực được sử dụng tại một thời điểm, trong khi các điện cực còn lại đọc điện áp thu được (Hình 1b). Cặp tiêm được xen kẽ tuần tự và khi kết thúc một chu kỳ đầy đủ, tất cả các phép đo điện áp được sử dụng để tạo ra một hình ảnh, theo các thuật toán tái tạo cụ thể. Mỗi khung hình được tạo ra so với khoảng thời gian tham chiếu thường được thu thập tại đường cơ sở. Sau khi tái tạo bằng lưới phần tử hữu hạn được tinh chỉnh, hình ảnh được chiếu thành một mảng 32 × 32 pixel, trong đó mỗi pixel sẽ mô tả sự thay đổi điện trở suất trong một khoảng thời gian liên quan đến thời điểm tham chiếu (Hình 1c) [21].
Pixel đại diện cho những thay đổi liên quan đến tham chiếu này và khung hình ảnh thường được gọi là hình ảnh tương đối. Định hướng không gian của hình ảnh EIT tương tự như định hướng được sử dụng bởi CT, với bên phải của ngực nằm ở bên trái của hình ảnh và vùng phía trước ở trên cùng của hình ảnh (Hình 1b, c).
Hình 1 a Vị trí của đai điện cực trên ngực. Nên áp dụng đai điện cực giữa khoang liên sườn thứ năm và thứ sáu. b Lát cắt dọc theo trục chụp cắt lớp vi tính của ngực với vành đai 32 điện cực, và sơ đồ biểu diễn các đường dẫn dòng điện qua ngực. Một cặp điện cực bơm dòng điện trong khi các điện cực còn lại đọc điện áp được tạo ra do sự phân bố mật độ dòng điện bên trong ngực. Cặp tiêm được xen kẽ tuần tự và sau một chu kỳ đầy đủ, một hình ảnh sẽ được tạo. c Hình ảnh chức năng được tái tạo bằng chụp cắt lớp trở kháng điện (EIT) sử dụng thang màu: màu xanh lam càng nhạt, thông khí khu vực càng lớn. Đáng chú ý, thang màu này không phổ biến. Hình ảnh được tạo bởi EIT Enlight (TIMPEL SA, São Paulo). A trước, L trái, P sau, R phải
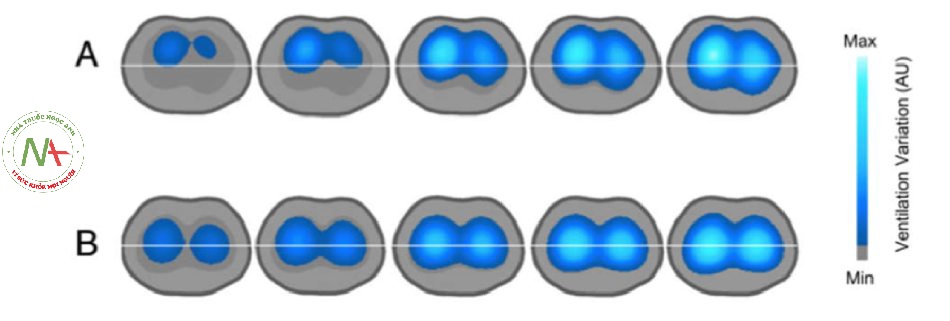
Hình 2. Bơm phồng không đồng nhất. Vùng bụng phồng lên đầu tiên và vùng lưng bắt đầu phồng lên giữa chừng cho đến khi kết thúc hít vào. b Bơm phồng đồng nhất. Cả vùng bụng và vùng lưng bắt đầu phồng lên đồng thời. AU đơn vị tùy ý
Điều thúc đẩy EIT liên quan đến các phương pháp hình ảnh khác là độ phân giải thời gian cao của nó. Các thiết bị EIT hiện đại tạo ra tới 50 hình ảnh mỗi giây, cho phép nghiên cứu động về phân phối thông khí, tưới máu phổi khu vực và độ rung của phổi. Ví dụ: có thể chỉ ra rằng một số khu vực bắt đầu bơm phồng lên đi sau những khu vực khác, phản ánh việc huy động theo chu kỳ thở (Hình 2) hoặc pendelluft. Nhược điểm của kỹ thuật này là độ phân giải không gian thấp, có thể so sánh với kỹ thuật xạ hình.
Một số nghiên cứu đã chỉ ra lợi ích của việc sử dụng EIT để thiết lập các thông số thông khí, cải thiện quá trình trao đổi khí và cơ học hô hấp trên mô hình động vật [22-25]. Trong bối cảnh lâm sàng, ngày càng có nhiều bằng chứng cho thấy EIT có thể là một công cụ hữu ích để tối ưu hóa các thông số thở máy riêng lẻ ở những bệnh nhân bị bệnh nặng và có khả năng làm giảm nguy cơ VILI [26, 27]. Trong các phần sau, trước tiên chúng tôi sẽ mô tả các công cụ cơ bản của EIT, sau đó là các công cụ lâm sàng với ứng dụng tiềm năng cho ARDS.
Công cụ chụp cắt lớp trở kháng điện cơ bản
Biểu đồ thể tích EIT (EIT plethysmogram)
Biểu đồ thể tích EIT là dạng sóng bắt nguồn từ tổng của tất cả các pixel trong một vùng quan tâm (region of interest − ROI) nhất định của hình ảnh (khung) tương đối được vẽ theo thời gian. Nó đại diện cho lượng không khí di chuyển vào và ra khỏi ROI.
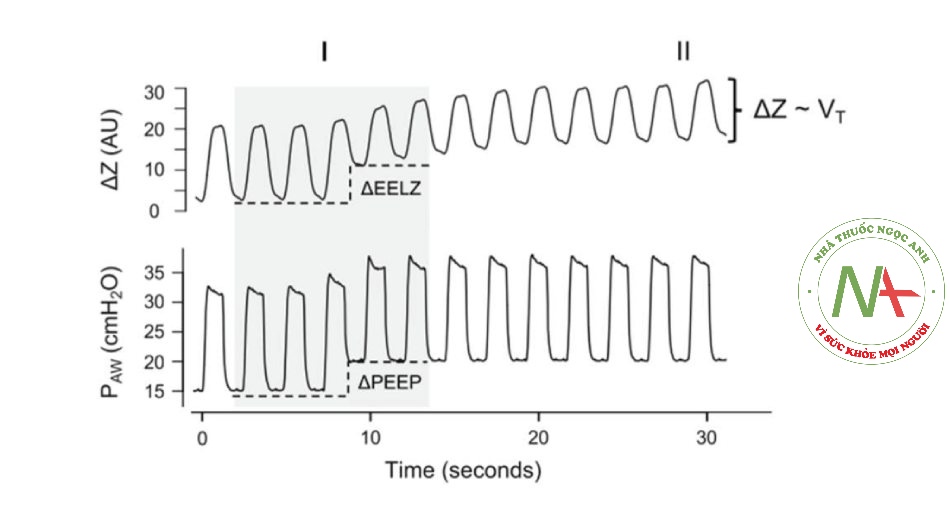
Hình 3 Dạng sóng thể tích khí và áp lực đường thở (PAW) toàn cục (toàn bộ hình ảnh). (I) Tăng áp lực dương cuối thì thở ra (PEEP) làm tăng thể tích phổi cuối thì thở ra (ΔEELZ). (II) Biến thiên theo chu kỳ thông khí (ΔZ) theo dõi những thay đổi về thể tích khí lưu thông (VT). AU đơn vị tùy ý
Dao động theo chu kỳ thở trong biểu đồ thể tích toàn cục gây ra bởi mỗi chu kỳ hô hấp, được gọi là Delta Z (ΔZ), tương quan chặt chẽ với sự thay đổi thể tích phổi được ước tính bởi CT (R2 = 0,92) [28]. Một mối tương quan chặt chẽ cũng được tìm thấy giữa thể tích phổi cuối kỳ thở ra (EELV), được ước tính bằng kỹ thuật rửa trôi nitơ nhiều lần và trở kháng phổi cuối kỳ thở ra (EELZ) (R2 = 0,95) [29]. Do đó, ngoài việc theo dõi thông khí phổi (ΔZ), EIT còn xác định những thay đổi về thông khí phổi (thông qua ΔEELZ) gây ra, chẳng hạn như do thay đổi tư thế hoặc điều chỉnh áp lực dương cuối thì thở ra (PEEP) (Hình 3).
Bản đồ thông khí (Ventilation map)
Bản đồ thông khí hoặc hình ảnh chức năng là biểu diễn của các thay đổi theo chu kỳ thở trong pixel trở kháng theo pixel (tức là, nó là bản đồ màu của pixelwise ΔZ). Bằng cách định vị các con trỏ ngang và/hoặc dọc trong hình ảnh chức năng này, có thể định lượng sự phân bố thông khí theo hướng từ phải sang trái, hướng từ bụng đến lưng hoặc theo các góc phần tư. Phương pháp này đã được xác thực với CT chùm tia điện tử [30], CT phát xạ đơn photon (SPECT) [31] và hình ảnh CT [32], và thường được sử dụng để xác định sự không đồng nhất trong phân phối thông khí do bệnh lý và/hoặc thông khí gây ra. cài đặt (Hình 4).
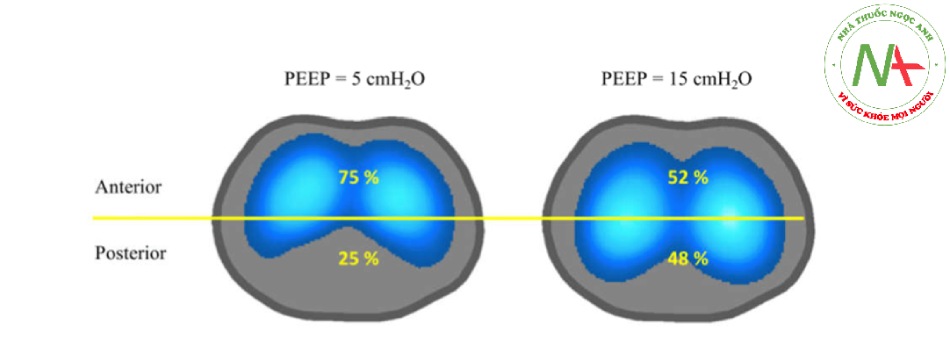
Hình 5 minh họa một hình ảnh chức năng được chia thành hai ROI (bụng và lưng) trong mô hình ARDS của lợn. Lưu ý sự phân bố thông khí không đồng nhất (được biểu thị bằng phần trăm) ở vùng bụng và vùng lưng ở PEEP là 5 cmH2O. Việc tăng PEEP lên 15 cmH2O dẫn đến sự phân bố đồng nhất hơn giữa các vùng.
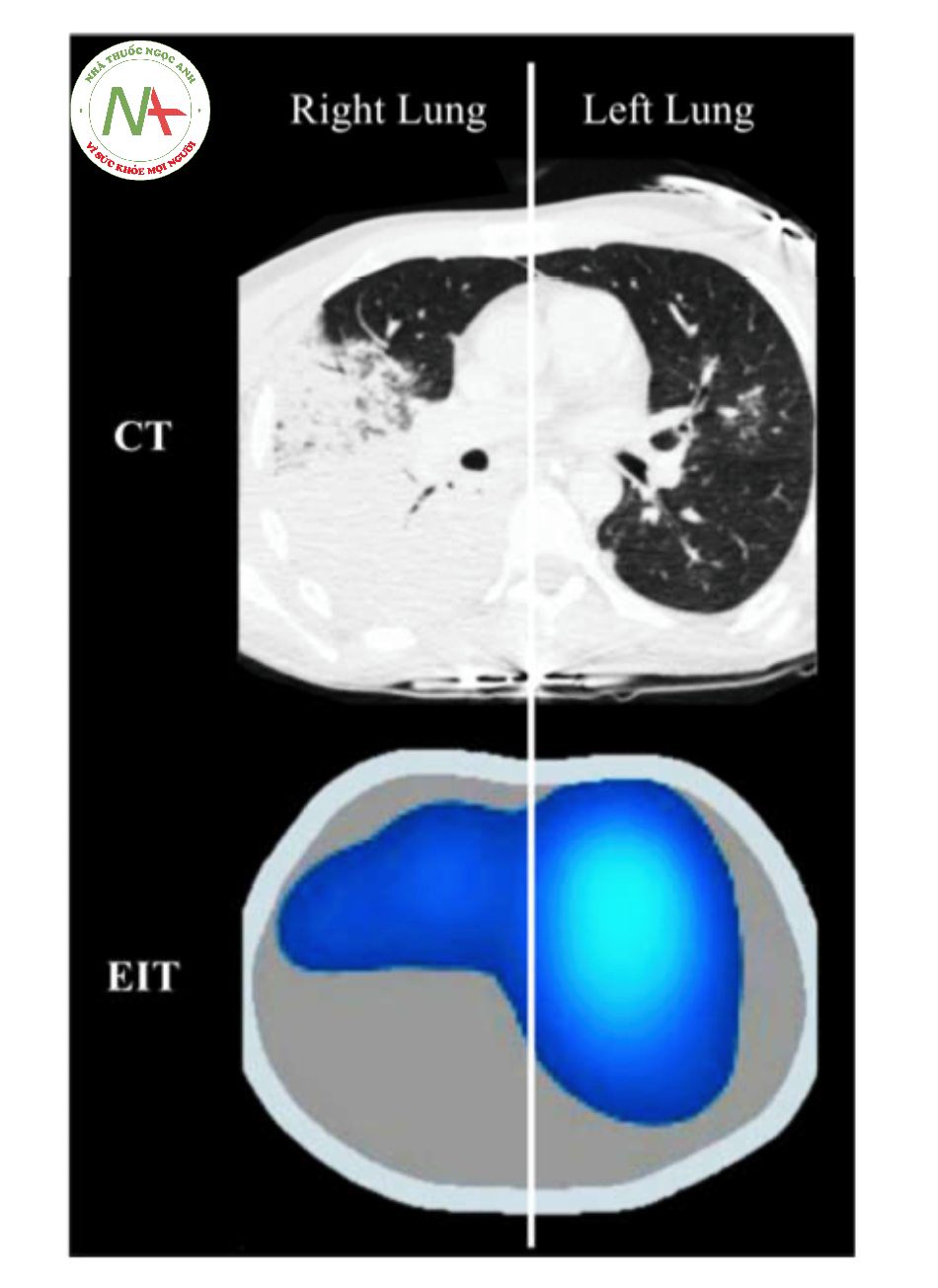
Hình 4 Chụp cắt lớp vi tính (CT) của một bệnh nhân bị viêm phổi và hình ảnh chức năng tương ứng thu được từ chụp cắt lớp trở kháng điện (EIT). Lưu ý không có thông khí ở phía dưới phổi phải trong hình ảnh EIT và đông đặc tương ứng ở phổi phải được đánh giá bằng CT
Công cụ lâm sàng
Ước tính xẹp phổi và căng quá mức
Sự không đồng nhất về thông khí trong phổi ARDS thường liên quan đến sự tồn tại của các cơ chế gây tổn thương, chẳng hạn như sự xẹp và mở theo chu kỳ của các đường dẫn khí nhỏ và phế nang, và sự căng quá mức của phổi. Costa và cộng sự [33] đã phát triển một phương pháp để ước tính tình trạng xẹp phổi và căng quá mức bằng cách sử dụng thông tin khu vực (độ giãn nở pixel) trong thủ thuật PEEP giảm dần. Trong mỗi bước PEEP, độ giãn nở có thể được tính từ lượng không khí đi vào phổi (ΔZ) và từ áp lực đàn hồi của hệ hô hấp; nghĩa là sự khác biệt giữa áp lực cao nguyên (Pplateau) và PEEP. Do đó, tính độ giãn nở của từng pixel EIT có thể được ước tính là:
Compliancepixel=ΔZ/(Pplateau−PEEP).
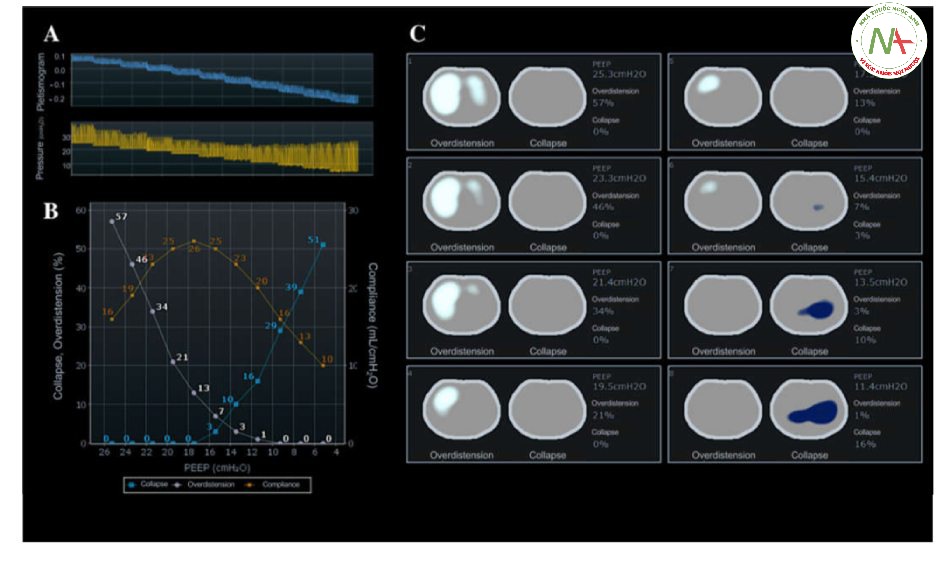
Phương pháp này giả định rằng việc mất độ giãn nở pixel ở các mức PEEP cao hơn PEEP của độ giãn nở pixel tốt nhất cho thấy quá căng (overdistension). Tương tự, phương pháp này giả định rằng việc mất độ giãn nở ở các mức PEEP thấp hơn PEEP của mức độ giãn nở pixel tốt nhất cho thấy sự xẹp phổi (collapse) (Hình 6). Phương pháp ước tính số lượng xẹp phổi có thể huy động; nghĩa là lượng phổi được huy động bị mất huy động sau thử nghiệm PEEP giảm dần. Khi được thực hiện ngay sau thao tác huy động, ước tính EIT này về xẹp phổi xấp xỉ với ước tính được định lượng bằng CT.
Gần đây, Beda và cộng sự [34] cho thấy rằng các đường cong áp lực-thể tích (PV) có nguồn gốc từ EIT có thể xác định các khu vực huy động theo chu kỳ thở giả định và căng quá mức. Những thay đổi trong việc huy động theo chu kỳ thở có nguồn gốc từ hình dạng PV có tương quan với những thay đổi ở các vùng được thông khí kém và những thay đổi về sự căng quá mức có nguồn gốc từ hình dạng PV có mối tương quan cao với những thay đổi ở các vùng được tăng sục khí đối với PEEP cao hơn (r = 0,73).
Meier và cộng sự [35] đã sử dụng EIT để theo dõi thể tích khí lưu thông khu vực trong quá trình điều khiển chuẩn độ PEEP trong một mô hình thử nghiệm về sự suy giảm chất hoạt động bề mặt. Dựa trên những thay đổi về thông khí khu vực thứ phát do thay đổi mức PEEP, các nhà nghiên cứu đã tạm thời xác định được sự khởi đầu của sự xẹp và huy động phổi khu vực ngay cả trước khi những thay đổi toàn cục về cơ học phổi xảy ra. Những phát hiện này được so sánh với hình ảnh CT và mối tương quan tốt đã được tìm thấy giữa thể tích khu vực của khí cuối kỳ thở ra và thể tích khí lưu thông được ước tính bởi cả hai công cụ. Các tác giả kết luận rằng EIT là đủ để theo dõi tác động động của các biến thiên theo PEEP đối với thông khí khu vực.
Hình 5 Bản đồ thông khí được chia thành hai vùng quan tâm trong mô hình hội chứng nguy kịch hô hấp cấp tính, được thông khí với áp lực dương cuối kỳ thở ra (PEEP) là 5 cmH2O (trái) và 15 cmH2O (phải)
Hình 6. Ước tính xẹp phổi có thể huy động và căng quá mức trong khi thực hiện thủ thuật áp lực dương cuối kỳ thở ra (PEEP) giảm dần. a Giảm trở kháng phổi cuối thì thở ra (sóng xanh) trong mỗi bước PEEP (sóng vàng). b Độ giãn nở, xẹp và căng quá mức của hệ hô hấp ở mỗi giai đoạn của thủ thuật PEEP giảm dần. Lưu ý rằng PEEP của độ giãn nở tổng thể tốt hơn (17 cmH2O) không trùng với PEEP giảm thiểu tình trạng xẹp và căng quá mức ước tính theo chụp cắt lớp trở kháng điện (15 cmH2O). c Bản đồ căng quá mức và xẹp trong mỗi bước PEEP. Quan sát sự gia tăng dần dần của xẹp phổi với việc giảm PEEP, chủ yếu ở vùng phụ thuộc. Hình ảnh được tạo bởi Enlight (Timpel SA, São Paulo, Brazil)
Một ứng dụng thú vị khác của EIT là khả năng phát hiện đóng đường thở, một hiện tượng được mô tả gần đây ở bệnh nhân ARDS bởi Chen và cộng sự [36] khi phân tích cẩn thận các đường cong áp lực-thể tích lưu lượng thấp. Họ lưu ý rằng các bác sĩ lâm sàng tại giường bệnh có thể dễ dàng bỏ qua việc đóng đường thở. Sun và cộng sự [37] gần đây đã trình bày báo cáo trường hợp của một bệnh nhân mắc ARDS vừa phải, trong đó họ đã đánh giá các đường cong PV toàn cục và khu vực, bản đồ thông khí EIT và dạng sóng plethysmograph trong bơm phồng lưu lượng thấp, nhận thấy rằng các đường cong PV khu vực có nguồn gốc từ EIT có thể phương pháp hữu ích để xác nhận sự hiện diện của hiện tượng tắc nghẽn đường thở.
Phát hiện tràn khí màng phổi
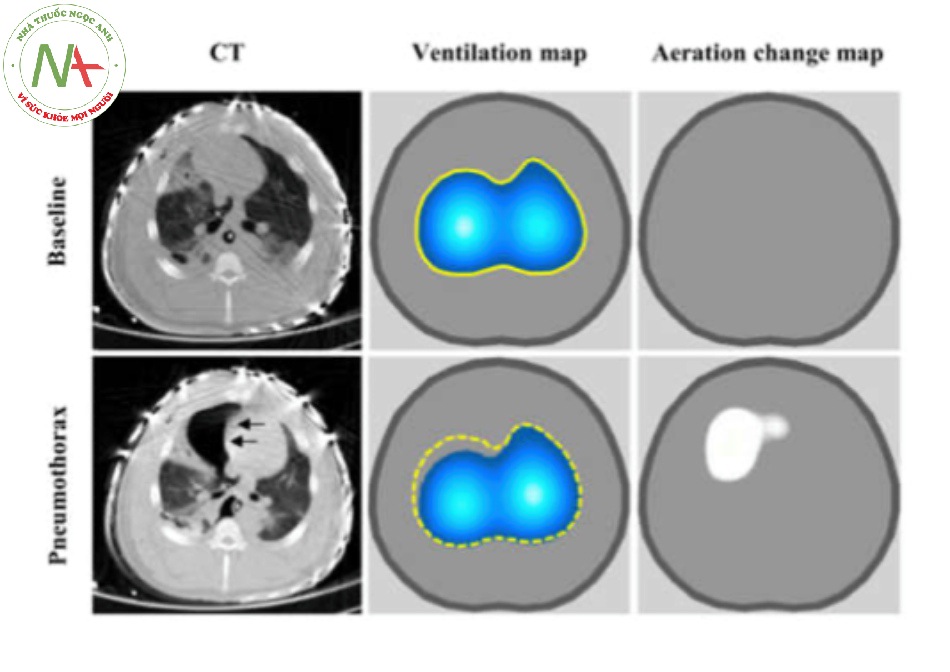
Tỷ lệ tràn khí màng phổi ở bệnh nhân ARDS là 8– 10% [38]. EIT đã được sử dụng như một công cụ đầu giường để phát hiện sự hiện diện của tràn khí màng phổi trong thời gian thực. Năm 2006, Hahn và cộng sự [39] đã nghiên cứu thông qua một mô hình thử nghiệm về những thay đổi trong hình ảnh EIT bằng cách gây ra các mức độ tràn khí màng phổi khác nhau. Họ nhận thấy sự gia tăng trở kháng trong bản đồ sục khí (thay đổi tĩnh) liên quan đến việc giảm thông khí khu vực (thay đổi động). Những phát hiện này được so sánh với hình ảnh CT, chứng minh khả năng của EIT trong việc phát hiện tràn khí màng phổi trong thời gian thực. Costa và cộng sự [40] đã xác nhận trong một mô hình thử nghiệm rằng EIT có thể phát hiện sự hiện diện của tràn khí màng phổi trong thời gian thực (ba chu kỳ hô hấp bị trì hoãn) với độ nhạy 100% (Hình 7).
Hình 7 Chụp cắt lớp vi tính (CT), bản đồ thông khí và bản đồ thay đổi thông khí thu được lúc ban đầu và sau khi gây tràn khí màng phổi ở lợn. Mũi tên chỉ sự tích tụ không khí trong khoang màng phổi
Gần đây, Morais và cộng sự [41] đã mô tả một trường hợp xuất hiện tràn khí màng phổi với EIT là một biến chứng của thủ thuật huy động phổi được thực hiện muộn trong quá trình ARDS. Trong trường hợp này, những thay đổi EIT do tràn khí màng phổi gây ra (độ sáng tăng đột ngột trong hình ảnh EIT và tăng thông khí không tương ứng với mức tăng PEEP) đã dẫn đến sự gián đoạn sớm của thủ thuật huy động trước khi bắt đầu suy giảm lâm sàng. Đây là một ví dụ về cách giám sát EIT có thể giúp quản lý bệnh nhân mắc ARDS nặng được đưa vào các thủ tục liên quan đến rủi ro chấn thương khí áp, chẳng hạn như thủ thuật huy động phổi.
Theo dõi ảnh hưởng của hút đàm qua nội khí quản lên thể tích phổi
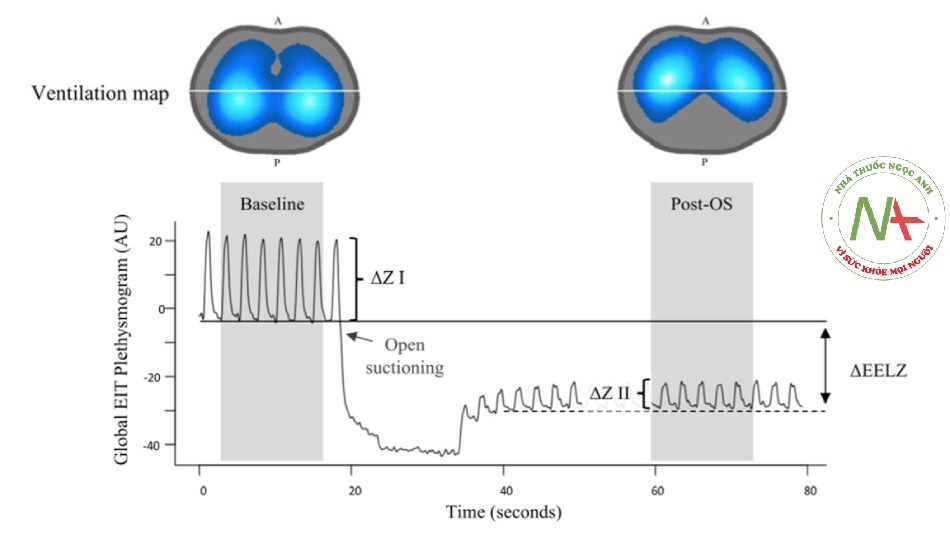
Một tiện ích khác của EIT là xác định ảnh hưởng của việc hút đàm qua nội khí quản đối với thể tích phổi. Lindgren và cộng sự [42] đã đánh giá sự thay đổi thể tích phổi bởi EIT trong quá trình hút đàm qua nội khí quản trong một mô hình thử nghiệm về sự suy giảm chất hoạt động bề mặt và cho thấy sự xẹp phế nang lớn hơn, đặc biệt là ở vùng lưng của phổi. Khoảng 50% dung tích cặn chức năng (FRC) bị mất sau khi ngắt kết nối ống và hơn 20% tại thời điểm hút [42]. Ở những bệnh nhân tim sau phẫu thuật, EELZ vẫn ở các giá trị dưới mức can thiệp trước khi hút, thậm chí 30 phút sau khi khôi phục thở máy [43]. Hình 8 cho thấy ảnh hưởng của việc hút hở đối với thể tích phổi trong mô hình ARDS nặng. Lưu ý sự giảm rõ rệt của EELZ và ∆Z sau quy trình hút. Các bản đồ thông khí cho thấy sự đảo ngược về sự phân bố thông khí giữa vùng bụng và vùng lưng sau khi hút mở.
Rối loạn đồng bộ thông khí
Sự mất đồng bộ máy thở – bệnh nhân là phổ biến trong quá trình thở máy và thường liên quan đến các tác dụng phụ như kéo dài thời gian cai máy và tăng tỷ lệ tử vong [44]. Mặc dù vậy, phần lớn các trường hợp không đồng bộ (hơn 60%) vẫn không được các chuyên gia kiểm tra dạng sóng máy thở phát hiện [45]. Trong trường hợp này, thông tin có trong biểu đồ thể tích EIT có thể hỗ trợ bác sĩ chuyên khoa trong việc xác định sớm các rối loạn đồng bộ có thể gây hại, chẳng hạn như nhịp thở chồng và pendelluft.
Hình 8 Bản đồ thể tích và chụp cắt lớp trở kháng điện toàn cục (EIT) và bản đồ thông khí trong quá trình hút hở (OS) trong mô hình ARDS nặng. Các đường ngang liền nét và chấm chấm biểu thị trở kháng phổi cuối thì thở ra (EELZ) tại đường cơ sở và sau khi hút, tương ứng. Lưu ý rằng EELZ không trở về giá trị cơ sở (mũi tên biểu thị khoảng cách giữa đường liền nét và đường chấm chấm), mô tả việc giảm lượng khí trong phổi. Cũng lưu ý giảm thông khí phổi sau OS (ΔZ I – ΔZ II). Bản đồ thông khí I và II (hình ảnh bên trái và bên phải ở trên cùng) cho thấy sự giảm thông khí ở vùng phía sau sau OS. A trước (bụng), đơn vị tùy ý AU, P sau (lưng). Được sự cho phép của Nadja Carvalho
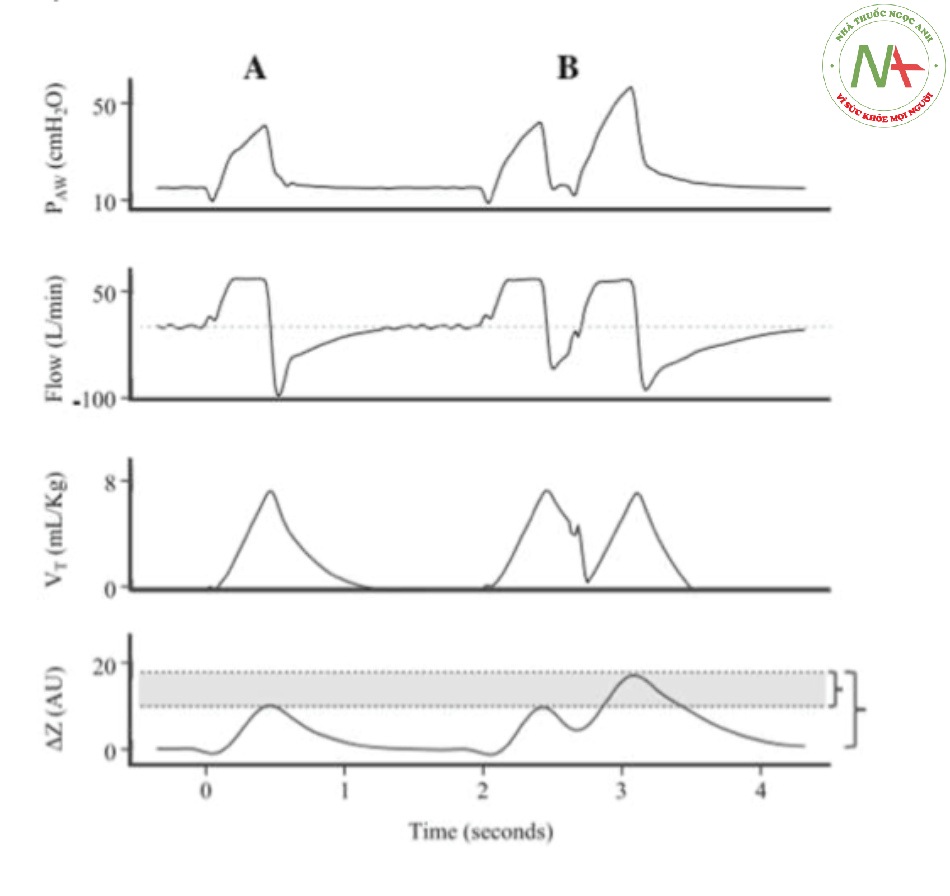
Nhịp thở chồng (breath stacking) thường là thứ yếu sau kích hoạt đảo ngược (reverse triggering) hoặc kích hoạt kép (double-triggering), khi máy thở áp đặt một chu kỳ hô hấp thứ hai lên trên một lần thở ra không hoàn toàn [46]. Hình 9 cho thấy áp lực đường thở, lưu lượng và thể tích (được tìm thấy trong máy thở cơ học) và dạng sóng EIT trong một chu kỳ đồng bộ (A) và trong khi mất đồng bộ nhịp thở chồng (B). Trong quá trình nhịp thở chồng, dạng sóng thể tích cho thấy thể tích được hít vào xấp xỉ 8 ml/kg cân nặng dự đoán; tuy nhiên, thể tích hít vào được phát hiện bởi EIT gần gấp đôi so với chu kỳ thông thường, điều này cho thấy phổi bị biến dạng có hại.
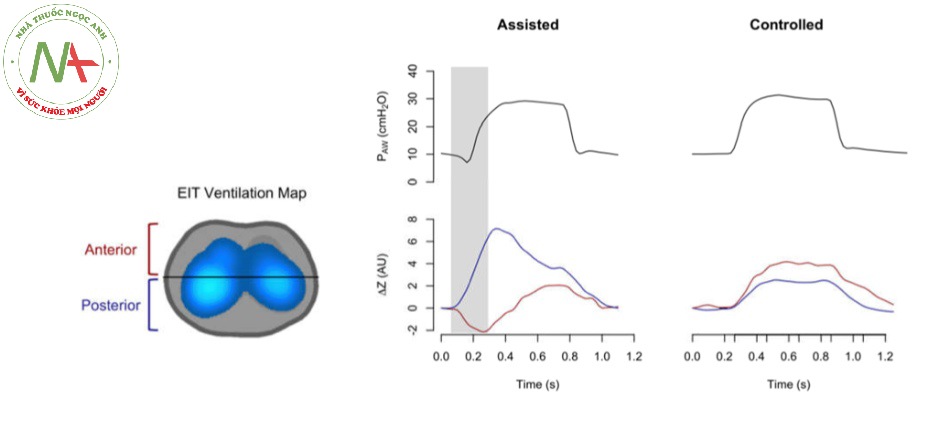
Pendelluft là một rối loạn đồng bộ trong phổi được mô tả với sự co thắt cơ hoành dữ dội, trong đó có sự chuyển động của khí giữa các vùng phổi khác nhau (Hình 10) [47]. Pendelluft gây ra sự huy động theo chu kỳ thở của các khu vực phụ thuộc (chấn thương cục bộ) bằng cách đồng thời xả hơi các khu vực không phụ thuộc. Thể tích dịch chuyển này cũng gây ra sự giãn quá mức của các phế nang ở vùng phụ thuộc (chấn thương thể tích cục bộ). Cả hai cơ chế gây tổn thương đều làm trầm trọng thêm tình trạng viêm phổi cục bộ [48]. Áp lực xuyên phổi được khuếch đại theo khu vực này do nỗ lực hít vào mạnh mẽ thường không bị phát hiện. Nguy cơ lâm sàng liên quan đến hiệu ứng khuếch đại như vậy là “ẩn” vì máy thở chỉ đo áp lực mở đường thở. Chỉ có EIT mới có khả năng phát hiện, theo dõi, định vị và định lượng pendelluft một cách liên tục và tại giường bệnh.
Hình 9 Áp lực đường thở (PAW), lưu lượng, thể tích khí lưu thông (VT) và dạng sóng EIT trong chu kỳ đồng bộ (A) và trong khi mất đồng bộ nhịp thở chồng (B). Trong quá trình nhịp thở chồng, biểu đồ thể tích thể tích cho thấy thể tích hít vào gần gấp đôi so với chu kỳ thông thường. Biến dạng phổi quá mức này không được phát hiện bởi các dạng sóng hiện có trên máy thở cơ học. AU: Đơn vị tùy ý, ∆Z: biến thiên trở kháng
Tưới máu phổi
Một trong những mục tiêu của thở máy là thúc đẩy trao đổi khí đầy đủ, nhưng hiệu quả của quá trình này không chỉ phụ thuộc vào thông khí mà còn phụ thuộc vào tưới máu phổi đầy đủ. Thật thú vị, EIT cũng ước tính rối loạn tưới máu tại giường. Đánh giá tưới máu phổi bằng EIT đã được thực hiện bằng hai phương pháp: động lực học bước đầu, được thực hiện bằng cách tạm dừng hô hấp ngắn, sau đó là tiêm tĩnh mạch nhanh natri clorid ưu trương qua đường tĩnh mạch trung tâm (nước muối sẽ hoạt động như một chất cản quang nội mạch do độ dẫn điện cao của nó) (Hình 11) [49, 50]; và dựa trên sự phân tách tín hiệu tim với tín hiệu thông khí bằng cổng điện tâm đồ hoặc bằng thuật toán dựa trên phân tích thành phần chính [51, 52].
Frerichs và cộng sự [49] đã nghiên cứu hiệu quả của phương pháp tương phản bước đầu EIT trong mô hình động vật được tưới máu bình thường, mô phỏng sự hiện diện của thuyên tắc huyết khối phổi (do tắc động mạch phổi qua ống thông Swan–Ganz) và so sánh điều này với CT chùm tia điện tử. Các tác giả đã cố gắng tạo ra những hình ảnh mới để phân phối lưu lượng máu vùng phổi có mối tương quan tốt với dữ liệu do CT chùm tia điện tử cung cấp, kết luận rằng EIT có thể phát hiện những thay đổi trong tưới máu phổi và những thay đổi của nó kịp thời. Sau đó, cùng một nhóm đã phát triển phương pháp dao động phổi, sử dụng bộ lọc tần số để tách các thành phần thông khí và tưới máu của tín hiệu trở kháng chung. Công cụ này có thể được áp dụng để đánh giá những thay đổi chức năng trong tưới máu phổi chẳng hạn như kích hoạt co mạch phổi do thiếu oxy trong thông khí một phổi [53].
Hình 10 Hiện tượng Pendelluft. Sự thay đổi của trở kháng (∆Z) và áp lực đường thở trong thông khí cơ học được hỗ trợ và kiểm soát (PAW). Đường màu xanh: vùng sau phổi. Đường màu đỏ: Vùng trước của phổi. Trong thở máy có hỗ trợ, vùng phía trước của phổi giảm sự thay đổi trở kháng của nó (mất không khí) và đồng thời vùng phía sau tăng (được thông khí). AU: Đơn vị tùy ý, EIT: chụp cắt lớp trở kháng điện
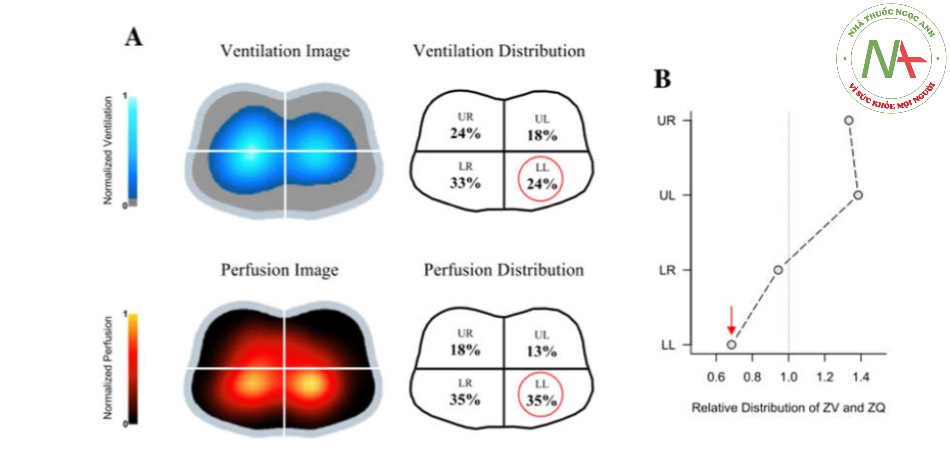
Hình 11 Hình ảnh thông khí và tưới máu chụp cắt lớp trở kháng điện (EIT) của bệnh nhân bị viêm phổi mắc phải tại cộng đồng ảnh hưởng đến thùy dưới bên trái. Thang màu được điều chỉnh bằng chuẩn hóa tuyến tính. a Giảm thông khí ở góc phần tư phía dưới bên trái so với góc phần tư phía dưới bên phải, không có thay đổi trong phân phối tưới máu ở góc phần tư phía dưới. b Tách thông khí và tưới máu ở góc phần tư phía dưới bên trái được biểu thị bằng tỷ lệ phân phối thấp. LL phía dưới bên trái, LR phía dưới bên phải, UL phía trên bên trái, UR phía trên bên phải, ZV thông khí được ước tính bởi EIT, ZQ tưới máu được ước tính bởi EIT. Hình ảnh được cung cấp bởi Fernando Suarez-Sipmann. Mũi tên đỏ biểu thị tỷ lệ thông khí/tưới máu trong góc phần tư LL.
Chỉ số dựa trên EIT/chỉ số phát triển từ EIT
Không thể so sánh trực tiếp hình ảnh của các bệnh nhân khác nhau thu được từ EIT với nhau, vì kỹ thuật này chỉ mang lại giá trị tương đối (thông khí thay đổi từ hình ảnh tham chiếu có thể thay đổi). Để định lượng và có thể so sánh các kết quả thu được từ EIT, các chỉ số khác nhau đã được phát triển từ phân tích dữ liệu “ngoại tuyến”. Tiếp theo, chúng tôi sẽ trình bày và giải thích ba trong số các chỉ số được sử dụng nhiều nhất trong tài liệu: trung tâm thông khí (CoV), chỉ số không đồng nhất toàn cục (GI) và độ trễ thông khí khu vực (RVD).
Trung tâm thông khí (Center of ventilation, CoV)
Năm 1998, Frerichs và cộng sự [54] đã phát triển khái niệm “tâm hình học của thông khí”. Tham số này mô tả các biến thiên của phân bố thông khí phổi theo chiều từ bụng đến lưng và được định nghĩa về mặt toán học là tọa độ dọc đánh dấu điểm tại đó tổng thông khí khu vực (bụng và lưng) chia phổi thành hai phần bằng nhau. Sau đó, cùng một nhóm đã nghiên cứu bởi EIT một mô hình thử nghiệm về tổn thương phổi cấp tính ở trẻ sơ sinh do cạn kiệt chất hoạt động bề mặt, quan sát thấy rằng việc gây ra tổn thương phổi cấp tính đã thay thế trung tâm thông khí từ vùng phụ thuộc sang vùng không phụ thuộc. Theo đó, việc áp dụng các thao tác huy động và sử dụng chất hoạt động bề mặt đã di chuyển trung tâm thông khí trở lại các vùng phụ thuộc, đồng nhất hóa việc phân phối thông khí [55].
Gần đây, Sobota và Roubik [56] đã đề xuất một sửa đổi trong phương pháp tính toán trung tâm thông khí từ EIT, sử dụng phương pháp phân đoạn hình ảnh, theo phương trình sau:
CoV= (n+K+0,5)/(N+1),
trong đó N biểu thị tổng số pixel của hình ảnh theo chu kỳ thở, n biểu thị số lượng hàng pixel trong đó tổng của mỗi pixel nhỏ hơn 50 (∑ ≤ 50) và K tương ứng với hiệu chỉnh trong ước tính trung tâm thông khí, trong trường hợp nó nằm giữa hai pixel [56]:
Chỉ số không đồng nhất toàn cục (Global inhomogeneity index, GI)
Zhao và cộng sự [57] đã nghiên cứu sự không đồng nhất toàn cục và khu vực của sự phân bố thể tích trong nhu mô phổi. Đối với điều này, họ đã phát triển một chỉ số đo các biến thiên trở kháng của từng pixel giữa lúc kết thúc hít vào và kết thúc thở ra (hình ảnh hoặc chức năng theo chu kỳ thở). Trong thực tế, chỉ số GI được tính bằng tổng các thay đổi trở kháng của mỗi pixel đối với giá trị trung bình của nó (theo giá trị tuyệt đối), chia cho tổng các giá trị trở kháng của mỗi pixel, cho phép áp dụng chỉ số này để so sánh giữa các cá nhân:
DI cho biết giá trị của trở kháng vi sai trong hình ảnh theo chu kỳ thở; DIxy là pixel trong vùng phổi được xác định; DIlung là tất cả các pixel trong vùng phổi. Sau đó, cùng một nhóm đã chứng minh ở 50 đối tượng liên quan đến thở máy rằng chỉ số GI cho phép một người định lượng gián tiếp tính không đồng nhất của thông khí và cũng cho phép so sánh các kết quả này giữa các cá nhân [58].
Trong một bối cảnh khác, Bickenbach và cộng sự [59] đã đánh giá tiện ích của chỉ số GI để dự đoán sự thất bại của thử nghiệm thở tự nhiên (SBT). Họ đã đánh giá 31 bệnh nhân mở khí quản gặp khó khăn khi cai máy liên quan đến thở máy ở chế độ hỗ trợ áp lực. Khi so sánh các phép đo lúc ban đầu, trong (30 phút) và sau (120 phút) thử nghiệm thở tự nhiên bằng ống T, họ nhận thấy sự không đồng nhất của phổi tăng dần theo thời gian. Các tác giả đã báo cáo rằng những bệnh nhân bắt đầu SBT với giá trị GI cao có khả năng thất bại SBT cao hơn, kết luận rằng phân tích chỉ số GI có thể là một công cụ hữu ích để dự đoán thất bại SBT ở những bệnh nhân có nguy cơ cao. Zhao và cộng sự [58] đã thực hiện một nghiên cứu hồi cứu trong đó họ sử dụng chỉ số GI để chọn giá trị PEEP tốt nhất, được định nghĩa là mức PEEP mà phổi được thông khí đồng nhất nhất. Giá trị đã chọn được so sánh với các phương pháp đo độ giãn nở phổi và đường cong PV. Họ kết luận rằng PEEP tối ưu này có thể được xác định bằng chỉ số GI.
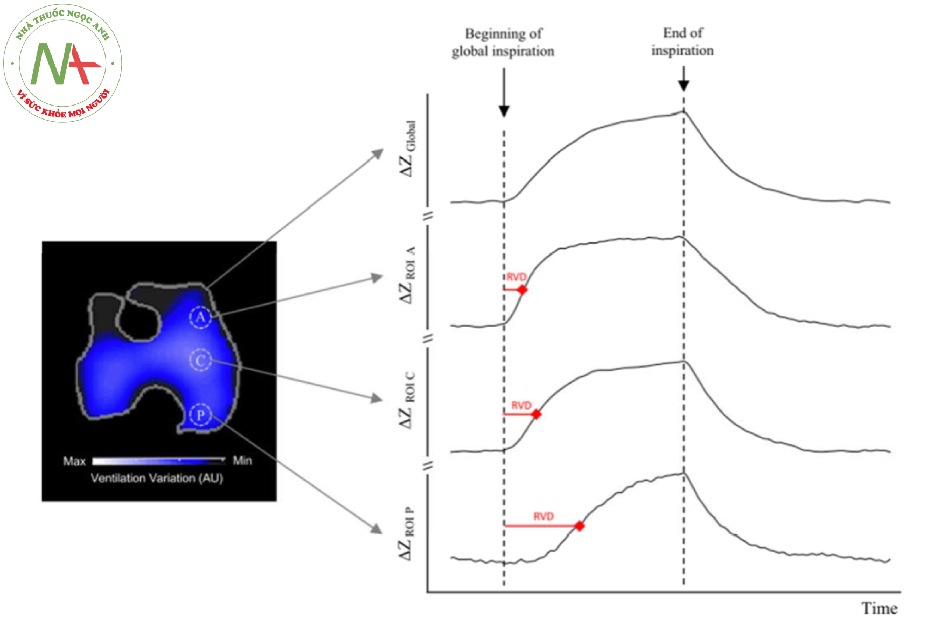
Chỉ số độ trễ thông khí khu vực (Regional ventilation delay index, RVD)
Wrigge và cộng sự [60] đã đánh giá tiện ích của EIT để ước tính thông khí khu vực và huy động phế nang. Đối với điều này, họ đồng thời so sánh EIT với hình ảnh CT động. Để xác định khả năng huy động phế nang, họ đã đánh giá thời gian trì hoãn thông khí ở một số ROI nhất định trong hai mô hình thử nghiệm tổn thương phổi cấp tính (hít sặc axit cộng với tăng áp lực ổ bụng và tiêm axit oleic). Bằng phương pháp phân tích toán học các đường cong trở kháng/thời gian khu vực, thời gian trễ được ước tính từ lúc bắt đầu hít vào cho đến khi độ chênh lệch của đường cong trở kháng/thời gian đạt đến một tỷ lệ phần trăm nhất định của thời gian hít vào so với hình ảnh chung (Hình 12). Họ đã chứng minh rằng chỉ số RVD tương quan tốt với việc huy động phế nang ước tính được thấy trong hình ảnh CT (R2 > 0,6):
RVDi=(ΔtRVD/Δtmax−min)×100.
Muder và cộng sự [61] đã đánh giá RVD để định lượng việc huy động gây ra bởi các mức PEEP khác nhau trong một mô hình thử nghiệm về tổn thương phổi cấp tính do tiêm axit oleic và tăng áp lực ổ bụng. Các động vật được kết nối với máy thở với các mức PEEP khác nhau (0, 5, 10, 15, 20 và 25 cmH2O) theo cách ngẫu nhiên. Chỉ số RVD được sử dụng để định lượng thời gian cần thiết để các vùng phổi nhất định (góc phần tư và pixel) đạt đến một ngưỡng thay đổi trở kháng nhất định. Từ chỉ số này, các tác giả đã phát triển độ không đồng nhất của độ trễ thông khí khu vực, định lượng tính không đồng nhất theo thời gian của thông khí (được tính từ độ lệch của giá trị chỉ số RVD của từng pixel). Khi so sánh chỉ số này với khả năng huy động được ước tính bằng hình ảnh CT, một mối quan hệ giữa các cá nhân tuyến tính vừa phải đã được quan sát.
Bickenbach và cộng sự [59] cũng nghiên cứu tính hữu ích của RVD trong SBT ở những bệnh nhân cai máy khó khăn, gọi biến thiên mới này là chỉ số chậm thông khí khu vực trong quá trình thở tự nhiên (spRVD), cho thấy rằng đây có thể là một công cụ quan trọng để đánh giá tính không đồng nhất của phổi ở bệnh nhân trong một SBT.
Kết luận
EIT phổi là một công cụ lâm sàng đầy hứa hẹn để theo dõi thông khí phổi liên tục và theo thời gian thực, có thể đặc biệt hữu ích ở những bệnh nhân thở máy bệnh nặng như ARDS. EIT có thể giúp tối ưu hóa cài đặt thông khí cơ học, phát hiện các biến chứng như mất huy động và tràn khí màng phổi, đồng thời đưa ra các ước tính về phân bố tưới máu. Nhiều nghiên cứu xác nhận lâm sàng đang được chờ đợi để khám phá toàn bộ tiềm năng của công nghệ này.
Hình 12 Độ trễ thông khí khu vực (RVD). Vùng bụng. Bệnh nhân thở máy. Lát 1, vùng bụng; Lát 2, giữa bụng; Lát 3, chính giữa lưng; Lát 4, vùng lưng. AU: Một đơn vị tùy ý trước, C: trung tâm, P: sau, ROI: vùng quan tâm, ∆Z biến thiên của trở kháng. Được sự cho phép của Wildberg Alencar.
Xem thêm: Các kịch bản lâm sàng của ứng dụng chụp cắt lớp trở kháng điện trong chăm sóc tích cực ở trẻ em.
Tài liệu tham khảo
- Sweeney MR, McAuley Acute respiratory distress syndrome. Lancet. 2016;388:2416–30.
- Bellani G, Laffey JG, Pham T, Fan E, Brochard L, Esteban A, et Epidemiology, patterns of care, and mortality for patients with acute respiratory distress syndrome in intensive care units in 50 countries. JAMA. 2016;315:788.
- Herridge MS, Cheung AM, Tansey CM. One-year outcomes in survivors of the acute respiratory distress syndrome. N Engl J 2003;348:683-93.
- Ware The acute respiratory distress syndrome. N Engl J Med. 2000;342:1334-49.
- Pelosi P, Dandrea L, Vitale G, Pesenti a, Gattinoni L. Vertical gradient of regional lung inflation in adult respiratory distress Am J Respir Crit Care Med. 1994;149:8–13.
- Cressoni M, Cadringher P, Chiurazzi C, Amini M, Gallazzi E, Marino A, et Lung inhomogeneity in patients with acute respiratory distress syndrome. Am J Respir Crit Care Med. 2014;189:149–58.
- Gattinoni L, Pesenti A. The concept of “baby lung”. Intensive Care Med. 2005;31:776–84.
- Borges JB, Hansen T, Larsson A, Hedenstierna G. The “normal” ventilated airspaces suffer the most damaging effects of mechanical Intensive Care Med. 2017;43:1057–8.
- Estenssoro E, Dubin Acute respiratory distress syndrome. Med Buenos Aires. 2016;76:235-41.
- Retamal J, Hurtado D, Villarroel N, Bruhn A, Bugedo G, Amato MBP, et al. Does regional lung strain correlate with regional inflammation in acute respiratory distress syndrome during nonprotective ventilation? An experimental porcine Crit Care Med. 2018 Jun;46(6):e591–9.
- Borges JB, Costa EL , Suarez-Sipmann F, Widström C, Larsson A, Amato M, et al. Early inflammation mainly affects normally and poorly aerated lung in experimental ventilator-induced lung injury. Crit Care Med 2014;42:e279–ee287.
- Borges JB, Costa ELV, Bergquist M, Lucchetta L, Widström C, Maripuu E, et Lung inflammation persists after 27 hours of protective acute respiratory distress syndrome network strategy and is concentrated in the nondependent lung. Crit Care Med. 2015;43:e123–32.
- Terragni PP, Rosboch G, Tealdi A, Corno E, Menaldo E, Davini O, et al. Tidal hyperinflation during low tidal volume ventilation in acute respiratory distress Am J Respir Crit Care Med. 2007;175:160–6.
- Slutsky AS, Ranieri Ventilator-induced lung injury. N Engl J Med. 2013;369:2126–36.
- Bugedo G, Bruhn A, Regueira T, Romero C, Retamal J, Hernández Positive end-expiratory pressure increases strain in patients with ALI/ARDS. Rev Bras Ter Intensiva. 2012 Mar;24(1):43–51.
- Hurtado DE, Villarroel N, Retamal J, Bugedo G, Bruhn A. Improving the accuracy of registration-based biomechanical analysis: a finite element approach to lung regional strain quantification. IEEE Trans Med Imaging. 2016;35:580–8.
- Gattinoni L, Caironi P. Lung recruitment in patients with the acute respiratory distress syndrome. N Engl J Med. 2006;354:1775-86.
- Costa EL, Lima RG, Amato MB. Electrical impedance tomography. Curr Opin Crit Care. 2009;15:18–24.
- Harris ND, Suggett AJ, Barber DC, Brown BH. Applications of applied potential tomography (APT) in respiratory medicine. Clin Phys Physiol Meas. 1987;8:155.
- Brown Electrical impedance tomography (EIT): a review. J Med Eng Technol. 2003;27:97–108.
- Frerichs I, Amato MBP, van Kaam AH, Tingay DG, Zhao Z, Grychtol B, et al. Chest electrical impedance tomography examination, data analysis, terminology, clinical use and recommendations: consensus statement of the TRanslational EIT developmeNt stuDy Thorax. 2017;72:83–93.
- van Genderingen HR, van Vught AJ, Jansen JRC. Estimation of regional lung volume changes by electrical impedance pressures tomography during a pressure-volume maneuver. Intensive Care Med. 2003;29:233–40.
- Odenstedt H, Lindgren S, Olegård C, Erlandsson K, Lethvall S, Åneman A, et al. Slow moderate pressure recruitment maneuver minimizes negative circulatory and lung mechanic side effects: evaluation of recruitment maneuvers using electric impedance tomography. Intensive Care Med. 2005;31:1706–14.
- Luepschen H, Meier T, Grossherr M, Leibecke T, Karsten J, Leonhardt S. Protective ventilation using electrical impedance tomography. Physiol Meas. 2007;28.
- Wolf GK, Gómez-Laberge C, Rettig JS, Vargas SO, Smallwood CD, Prabhu SP, et Mechanical ventilation guided by electrical impedance tomography in experimental acute lung injury. Crit Care Med. 2013;41:1296–304.
- Lowhagen K, Lindgren S, Odenstedt H, Stenqvist O, Lundin A new non-radiological method to assess potential lung recruitability: a pilot study in ALI patients. Acta Anaesthesiol Scand. 2011;55:165–74.
- Putensen C, Wrigge H, Zinserling J. Electrical impedance tomography guided ventilation therapy. Curr Opin Crit Care. 2007;13:344–50.
- Victorino J a, Borges JB, Okamoto VN, Matos GFJ, Tucci MR, Caramez MPR, et Imbalances in regional lung ventilation: a validation study on electrical impedance tomography. Am J Respir Crit Care Med. 2004;169:791– 800.
- Hinz J, Hahn G, Neumann P, Sydow M, Mohrenweiser P, Hellige G, et End-expiratory lung impedance change enables bedside monitoring of end-expiratory lung volume change. Intensive Care Med. 2003;29:37–43.
- Frerichs I, Hinz J, Herrmann P, Weisser G, Hahn G, Dudykevych T, et al. Detection of local lung air content by electrical impedance tomography compared with electron beam J Appl Physiol. 2002;93:660–6.
- Hinz J, Neumann P, Dudykevych T, Andersson LG, Wrigge H, Burchardi H, et al. Regional ventilation by electrical impedance tomography: a comparison with ventilation scintigraphy in pigs. Chest. 2003;124:314–22.
- Victorino JA, Borges JB, Okamoto VN, Matos GFJ, Tucci MR, Caramez MPR, et al. Imbalances in regional lung ventilation. Am J Respir Crit Care 2004;169:791–800.
- Costa ELV, Borges JB, Melo A, Suarez-Sipmann F, Toufen C, Bohm SH, et Bedside estimation of recruitable alveolar collapse and hyperdistension by electrical impedance tomography. Intensive Care Med. 2009;35:1132–7.
- Beda A, Carvalho AR, Carvalho NC, Hammermüller S, Amato MBP, Muders T, et Mapping regional differences of local pressure-volume curves with electrical impedance tomography. Crit Care Med. 2017;45:679–86.
- Meier T, Luepschen H, Karsten J, Leibecke T, Großherr M, Gehring H, et al. Assessment of regional lung recruitment and derecruitment during a PEEP trial based on electrical impedance tomography. Intensive Care Med. 2008;34:543–50.
- Chen L, Del Sorbo L, Luca Grieco D, Shklar O, Junhasavasdikul D, Telias I, et al. Airway closure in acute respiratory distress syndrome: an underestimated and misinterpreted Am J Respir Crit Care Med. 2018;197:132–6.
- Sun XM, Chen GQ, Zhou YM, Yang YL, Zhou JX. Airway closure could be confirmed by electrical impedance tomography. Am J Respir Crit Care 2018;197:138–41.
- Briel M, Meade M, Mercat A, Brower RG, Talmor D, Walter SD, et al. Higher vs lower positive end-expiratory pressure in patients with acute lung injury and acute respiratory distress syndrome. JAMA. 2010;303:865.
- Hahn G, Just A, Dudykevych T, Frerichs I, Hinz J, Quintel M, et al. Imaging pathologic pulmonary air and fluid accumulation by functional and absolute EIT. Physiol Meas. 2006;27:S187–98.
- Costa ELV, Chaves CN, Gomes S, Beraldo MA, Volpe MS, Tucci MR, et Real-time detection of pneumothorax using electrical impedance tomography. Crit Care Med. 2008;36:1230–8.
- Morais CCA, De Santis Santiago RR, Filho JRB de O, Hirota AS, Pacce PHD, Ferreira JC, et al. Monitoring of pneumothorax appearance with electrical impedance tomography during recruitment maneuvers. Am J Respir Crit Care Med. 2017;195:1070–3.
- Lindgren S, Odenstedt H, Olegård C, Söndergaard S, Lundin S, Stenqvist O. Regional lung derecruitment after endotracheal suction during volume- or pressure-controlled ventilation: a study using electric impedance tomography. Intensive Care Med. 2007;33:172–80.
- Corley A, Spooner AJ, Barnett AG, Caruana LR, Hammond NE, Fraser End-expiratory lung volume recovers more slowly after closed endotracheal suctioning than after open suctioning: a randomized crossover study. J Crit Care. 2012;27:742.e1–7.
- Blanch L, Villagra A, Sales B, Montanya J, Lucangelo U, Luján M, et al. Asynchronies during mechanical ventilation are associated with mortality. Intensive Care Med. 2015;41:633–41.
- Colombo D, Cammarota G, Alemani M, Carenzo L, Barra FL, Vaschetto R, et Efficacy of ventilator waveforms observation in detecting patient-ventilator asynchrony. Crit Care Med. 2011;39:2452–7.
- Pohlman MC, McCallister KE, Schweickert WD, Pohlman AS, Nigos CP, Krishnan JA, et Excessive tidal volume from breath stacking during lung-protective ventilation for acute lung injury. Crit Care Med. 2008;36:3019–23.
- Yoshida T, Torsani V, Gomes S, De Santis RR, Beraldo M a, Costa ELV, et al. Spontaneous effort causes occult pendelluft during mechanical ventilation. Am J Respir Crit Care Med. 2013;188:1420–7.
- Morais CCA, Koyama Y, Yoshida T, Plens GM, Gomes S, Lima CLAS, et al. High positive end-expiratory pressure renders spontaneous effort non-injurious. Am J Respir Crit Care Med. 2018;197:1285–96.
- Frerichs I, Hinz J, Herrmann P, Weisser G, Hahn G, Quintel M, et al. Regional lung perfusion as determined by electrical impedance tomography in comparison with electron beam CT imaging. IEEE Trans Med Imaging. 2002;21:646–52.
- Borges JB, Suarez-Sipmann F, Bohm SH, Tusman G, Melo A, Maripuu E, et al. Regional lung perfusion estimated by electrical impedance tomography in a piglet model of lung J Appl Physiol. 2012;112:225–36.
- Deibele JM, Luepschen H, Leonhardt S. Dynamic separation of pulmonary and cardiac changes in electrical impedance Physiol Meas. 2008; 29:1-14.
- da Silva Ramos FJ, Hovnanian A, Souza R, Azevedo LCP, Amato MBP, Costa ELV. Estimation of stroke volume and stroke volume changes by electrical impedance tomography. Anesth Analg. 2018;126:102–10.
- Frerichs I, Pulletz S, Elke G, Reifferscheid F, Schädler D, Scholz J, et Assessment of changes in distribution of lung perfusion by electrical impedance tomography. Respiration. 2009;77:282–91.
- Frerichs I, Hahn G, Golisch W, Kurpitz M, Burchardi H, Hellige G. Monitoring perioperative changes in distribution of pulmonary ventilation by functional electrical impedance tomography. Acta Anaesthesiol Scand. 1998;42:721–6.
- Frerichs I, Dargaville PA, Van Genderingen H, Morel DR, Rimensberger PC. Lung volume recruitment after surfactant administration modifies spatial distribution of ventilation. Am J Respir Crit Care 2006;174:772–9.
- Sobota V, Roubik K. Center of ventilation—methods of calculation using electrical impedance tomography and the influence of image segmentation. XIV Mediterranean conference on medical and biological engineering and computing. IFMBE Proc. 2016;57:1264–9.
- Zhao Z, Steinmann D, Guttmann J. Global and local inhomogeneity indices of lung ventilation based on electrical impedance tomography. IFMBE proc. 2009;22:256-9.
- Zhao Z, Möller K, Steinmann D, Frerichs I, Guttmann Evaluation of an electrical impedance tomography-based global inhomogeneity index for pulmonary ventilation distribution. Intensive Care Med. 2009;35:1900–6.
- Bickenbach J, Czaplik M, Polier M, Marx G, Marx N, Dreher Electrical impedance tomography for predicting failure of spontaneous breathing trials in patients with prolonged weaning. Crit Care. 2017;21:177.
- Wrigge H, Zinserling J, Muders T, Varelmann D, Gunther U, von der Groeben C, et al. Electrical impedance tomography compared with thoracic computed tomography during a slow inflation maneuver in experimental models of lung Crit Care Med. 2008;36:903–9.
- Muders T, Luepschen H, Zinserling J, Greschus S, Fimmers R, Guenther U, et al. Tidal recruitment assessed by electrical impedance tomography and computed tomography in a porcine model of lung injury. Crit Care Med. 2012;40:903–11.