Bệnh hô hấp
Chuẩn độ áp lực dương cuối thì thở ra với chụp cắt lớp trở kháng điện và đường cong áp lực-thể tích trong hội chứng nguy kịch hô hấp cấp nặng
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Chuẩn độ áp lực dương cuối thì thở ra với chụp cắt lớp trở kháng điện và đường cong áp lực-thể tích trong hội chứng nguy kịch hô hấp cấp nặng tải về file pdf ở đây.
Dịch bài: BS. Đặng Thanh Tuấn – BV Nhi Đồng 1
Tóm tắt
Bối cảnh
Mục tiêu nghiên cứu là so sánh việc chuẩn độ áp lực dương cuối thì thở ra (PEEP) với chụp cắt lớp trở kháng điện (EIT) và với vòng lặp áp lực-thể tích trên máy thở trong hội chứng nguy kịch hô hấp cấp tính nặng (ARDS).
Phương pháp
Chúng tôi đã thiết kế một nghiên cứu tiến cứu với nhóm kiểm soát lịch sử. 24 bệnh nhân ARDS nặng (áp lực riêng phần oxy động mạch so với nồng độ oxy hít vào, PaO2/FiO2 < 100 mmHg) đã được đưa vào nhóm EIT và được kiểm tra tiền cứu. Dữ liệu từ 31 bệnh nhân ARDS nặng khác được đánh giá hồi cứu (nhóm đối chứng). Tất cả các bệnh nhân đều được chăm sóc y tế theo các hướng dẫn hỗ trợ chung giống hệt nhau và thở máy bảo vệ. Mức PEEP được chọn trong nhóm EIT là điểm chặn của các đường cong phần trăm tích lũy xẹp và quá căng. Trong nhóm kiểm soát, PEEP tối ưu đã được chọn cao hơn 2 cmH2O so với điểm uốn dưới trên đường cong áp lực-thể tích tĩnh.
Kết quả
Bệnh nhân trong nhóm EIT trẻ hơn (P < 0,05) và áp lực cao nguyên trung bình của họ cao hơn 1,5 cmH2O (P < 0,01). Không tìm thấy sự khác biệt trong các thông số cơ bản khác như điểm APACHE II, PaO2/FiO2, PEEP ban đầu, áp lực đẩy, thể tích khí lưu thông và độ giãn nở của hệ hô hấp. Hai giờ sau khi chuẩn độ PEEP đầu tiên, PEEP cao hơn đáng kể, độ giãn nở và áp lực đẩy thấp hơn đã được tìm thấy trong nhóm EIT (P<0,01). Tỷ lệ sống sót tại bệnh viện là 66,7% (16 trên 24 bệnh nhân) ở nhóm EIT và 48,4% (15 trên 31) ở nhóm đối chứng. Tỷ lệ giống hệt nhau được tìm thấy liên quan đến tỷ lệ cai máy thành công: 66,7% ở nhóm EIT và 48,4% ở nhóm đối chứng.
Kết luận
Ở những bệnh nhân ARDS nặng, việc hướng dẫn chuẩn độ PEEP với EIT tại giường bệnh là khả thi và an toàn. So với đường cong áp lực-thể tích, phép chuẩn độ PEEP được hướng dẫn bằng EIT có thể liên quan đến việc cải thiện oxygen hóa, độ giãn nở, áp lực đẩy và tỷ lệ cai máy thành công. Các phát hiện khuyến khích nghiên cứu đối chứng ngẫu nhiên hơn nữa với cỡ mẫu lớn hơn và có khả năng ít sai lệch hơn trong dữ liệu cơ sở.
Bối cảnh
Kể từ mô tả đầu tiên cách đây 50 năm, hội chứng nguy kịch hô hấp cấp tính (acute respiratory distress syndrome − ARDS) đã được nghiên cứu rộng rãi. Mặc dù có những cải thiện gần đây trong quản lý bệnh, nhưng tỷ lệ tử vong vẫn còn cao [1]. Theo các lựa chọn điều trị trong định nghĩa ARDS của Berlin, thể tích khí lưu thông thấp, áp lực dương cuối kỳ thở ra (positive end- expiratory pressure − PEEP) cao hơn và tư thế nằm sấp nên được áp dụng trong ARDS nặng [2]. Người ta thừa nhận rộng rãi rằng thể tích khí lưu thông nên được đặt ở mức ~ 6 ml/kg trọng lượng cơ thể dự đoán, điều này có thể làm giảm tỷ lệ tử vong so với thể tích khí lưu thông cao [3]. Tuy nhiên, PEEP “cao hơn” thích hợp vẫn chưa chắc chắn [4, 5]. Cài đặt PEEP cho từng cá nhân được coi là hữu ích trong việc giảm tổn thương phổi do PEEP cao không phù hợp gây ra [6]. Một nghiên cứu gần đây cho rằng áp lực đẩy có liên quan đến tỷ lệ tử vong [7]. Khi thể tích khí lưu thông thấp được chọn, áp lực đẩy phụ thuộc vào độ giãn nở của hệ hô hấp (respiratory system compliance − Crs). Vì vậy, chuẩn độ PEEP theo Crs là hợp lý [8]. Các phương pháp chuẩn độ PEEP khác bao gồm oxygen hóa [9] và vòng lặp áp lực-thể tích [10]. Caramez và cộng sự đã so sánh mười thông số khác nhau để thiết lập PEEP sau thao tác huy động [11]. Sự khác biệt có ý nghĩa thống kê có thể chưa được tiết lộ do số lượng đối tượng nghiên cứu ít (n = 14) và sự khác biệt cao giữa chúng. Các chiến lược thiết lập PEEP này nhằm mục đích cải thiện oxygen hóa, tăng huy động phế nang đồng thời hạn chế bơm phồng quá mức; tuy nhiên, chúng không làm giảm đáng kể tỷ lệ tử vong. Một nghiên cứu gần đây tuyên bố rằng một chiến lược huy động phổi và PEEP chuẩn độ so với PEEP thấp làm tăng tỷ lệ tử vong [12]. Với những lo ngại liên quan đến thiết kế nghiên cứu, phương pháp và phân tích dữ liệu, kết quả của nghiên cứu được coi là có vấn đề [13].
Chụp cắt lớp trở kháng điện (Electrical impedance tomography − EIT) là một kỹ thuật không xâm lấn và không có bức xạ, cho phép chụp ảnh phổi riêng lẻ, thời gian thực, bên giường bệnh [14]. EIT sử dụng một bộ điện cực được gắn xung quanh ngực, trong khi các dòng điện nhỏ không thể nhận thấy được áp dụng và điện áp thu được được đo. Sau đó, những thay đổi trở kháng tương đối được tái tạo lại trong mặt phẳng đo [14]. Các nghiên cứu gần đây nhấn mạnh tiềm năng sử dụng EIT cho ARDS trong chuẩn độ PEEP [15 – 20]. Các nghiên cứu này đã đề xuất các phương pháp dựa trên EIT để tối ưu hóa cài đặt PEEP bằng cách tối đa hóa việc huy động phế nang và giảm thiểu căng quá mức. Cho đến nay, không có nghiên cứu tiền cứu nào trên bệnh nhân ARDS đánh giá kết quả của chuẩn độ PEEP theo hướng dẫn EIT so với các phương pháp truyền thống. Kích thước hiệu ứng của các tham số kết quả là không rõ.
Giả thuyết của chúng tôi là chuẩn độ PEEP do EIT hướng dẫn (với sự thỏa hiệp giữa các vùng quá tải và vùng xẹp), so với phương pháp thông thường của chúng tôi (vòng lặp áp lực-thể tích trên máy thở), cải thiện cơ học hô hấp, oxygen hóa và các kết quả lâm sàng khác. Mục đích của nghiên cứu thí điểm này là kiểm tra sự khác biệt trong các kết quả lâm sàng khác nhau do hai phương pháp chuẩn độ PEEP này. Một nghiên cứu tiến cứu với nhóm kiểm soát lịch sử đã được thiết kế.
Phương pháp
Nghiên cứu đã được phê duyệt bởi Ủy ban đạo đức của FEMH tại Đài Loan (FEMH-105117-E). Nghiên cứu hiện tại liên quan đến dữ liệu từ cơ quan đăng ký liên tục của chúng tôi về chuẩn độ PEEP theo hướng dẫn EIT (số đăng ký thử nghiệm lâm sàng NCT03112512, https://clinicaltrials.gov/, đăng ký ngày 13 tháng 4 năm 2017). Sự đồng ý bằng văn bản được lấy từ tất cả các bệnh nhân hoặc đại diện hợp pháp của họ trước khi nghiên cứu. Tổng cộng có 24 bệnh nhân ARDS nặng liên tiếp (áp lực riêng phần oxy động mạch so với nồng độ oxy hít vào, PaO2/FiO2 < 100 mmHg) được đưa vào nhóm EIT và được kiểm tra tiền cứu. (Nhân khẩu học được tóm tắt trong Bảng 1) Đối với nhóm đối chứng, dữ liệu từ các bệnh nhân ARDS nặng được điều trị tại ICU của chúng tôi vào năm 2016 đã được đưa vào cơ sở dữ liệu của chúng tôi và được phân tích (Phê duyệt đạo đức cho phân tích dữ liệu FEMH-106094-E. Ba mươi mốt bệnh nhân đáp ứng các tiêu chí đưa vào, Bảng 1) Bệnh nhân từ cả hai nhóm không được thở máy trước khi nhập ICU. Họ được đưa vào nghiên cứu từ ngày đầu tiên ở ICU. Nhân khẩu học chi tiết và chẩn đoán cá nhân của tất cả các bệnh nhân được kiểm tra được tóm tắt trong Tệp bổ sung 1. Tiêu chí loại trừ chung cho cả hai nhóm là có thở tự nhiên, huyết động không ổn định, tăng áp lực nội sọ được xác nhận hoặc nghi ngờ, sốc kháng trị, tràn khí màng phổi, tổng thời gian nằm ICU dưới 3 ngày. Các tiêu chí loại trừ bổ sung trong nhóm EIT là độ tuổi < 18, thời kỳ mang thai và cho con bú, và bất kỳ chống chỉ định nào đối với việc sử dụng EIT (máy tạo nhịp tim, máy khử rung tim cấy ghép tự động và máy bơm cấy ghép). Cài đặt máy thở ban đầu liên quan đến việc sử dụng thông khí bảo vệ với thể tích khí lưu thông là 6 ml/kg trọng lượng cơ thể dự đoán, tăng CO2 máu cho phép. PEEP được chọn theo bảng ARDSnet PEEP/FiO2.
Bảng 1 So sánh nhân khẩu học giữa EIT và nhóm kiểm soát
| Nhân khẩu học | Nhóm EIT | Nhóm kiểm soát | Giá trị p |
| Tuổi (năm) | 50,5 ± 13,3 | 61,5 ± 19,2 | < 0,05 |
| Giới tính (Nam/Nữ) | 15/9 | 22/9 | 0,51 |
| Chiều cao (cm) | 165,6 ± 7,2 | 163,2 ± 10,2 | 0,33 |
| Trọng lượng (kg) | 68,4 ± 17,4 | 60,5 ± 12,7 | 0,16 |
Chuẩn độ PEEP trong EIT và các nhóm kiểm soát
Đai điện cực EIT, mang 16 điện cực có chiều rộng 40 mm, được đặt quanh ngực ở khoang liên sườn thứ năm và một điện cực tham chiếu được đặt ở bụng bệnh nhân (PulmoVista 500, Draeger Medical, Luebeck, Đức). Hình ảnh EIT được ghi liên tục ở tần số 20 Hz và được lưu trữ. Dữ liệu hô hấp từ máy thở được chuyển đến EIT thông qua kết nối MEDIBUS. Dữ liệu EIT được xây dựng lại với đường cơ sở đề cập đến giá trị trở kháng thấp nhất được đo trước khi bắt đầu chuẩn độ PEEP. Dữ liệu được lọc bằng bộ lọc thông thấp bậc 4 Butterworth với tần số cắt là 50/phút để loại bỏ những thay đổi trở kháng đồng bộ với nhịp tim.
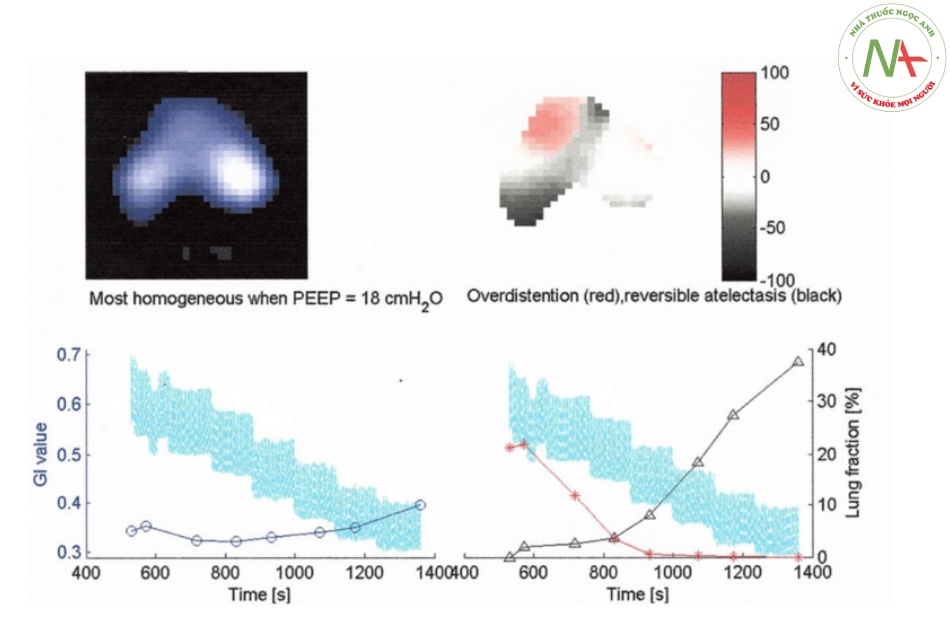
Trong nhóm EIT, thử nghiệm PEEP tăng dần được thực hiện bắt đầu ở áp lực 5–8 cmH2O với các bước tăng 2 cmH2O cho đến khi áp lực ổn định đạt 35 cmH2O hoặc quan sát thấy huyết áp không ổn định. Sau đó, một thử nghiệm PEEP giảm dần với các bước 2 cmH2O và thời gian 2 phút được theo sau. Phân tích dữ liệu EIT đã đạt được với một phần mềm tùy chỉnh [21]. Hai tham số dựa trên EIT đã được tính toán. Độ giãn nở theo khu vực được tính toán ở tất cả các pixel trong vùng phổi ở mỗi mức PEEP. Sau đó, tỷ lệ phần trăm tích lũy xẹp và căng quá mức được ước tính dựa trên sự giảm của đường cong độ giãn nở khu vực trong quá trình chuẩn độ PEEP giảm dần, hướng tới mức PEEP thấp hơn hoặc cao hơn [22]. Mức PEEP được chọn cho các bệnh nhân trong nhóm EIT là điểm chặn của các đường cong tỷ lệ phần trăm tích lũy xẹp phổi và căng quá mức, mang lại sự thỏa hiệp tốt nhất giữa phổi xẹp và phổi căng quá mức. Cách tiếp cận này tương ứng với các khuyến nghị được công bố trong phần mô tả ban đầu của phương pháp này [22] và tuyên bố đồng thuận gần đây về EIT ngực [14]. Nếu điểm chặn xảy ra giữa hai bước PEEP, thì PEEP được chọn tương ứng với bước PEEP hướng tới chỉ số không đồng nhất tổng thể thấp nhất, cho biết mức độ đồng nhất của phân phối thông khí [23].
Trong nhóm đối chứng, PEEP tối ưu của từng cá nhân đã được chọn cao hơn 2 cmH2O so với điểm uốn dưới (lower inflection point − LIP) trên đường cong áp lực-thể tích gần như tĩnh, thu được bằng thao tác điều khiển lưu lượng thấp trên máy thở (3 l/phút). Sự gia tăng áp lực bắt đầu và kết thúc ở 5 cmH2O, và áp lực tối đa được giới hạn ở 40 cmH2O. Nó đã được kiểm tra liên tục để đảm bảo rằng không có hơi thở tự nhiên hoặc rò rỉ không khí trong đường thở nhân tạo trong quá trình thủ thuật. Huyết động được theo dõi chặt chẽ.
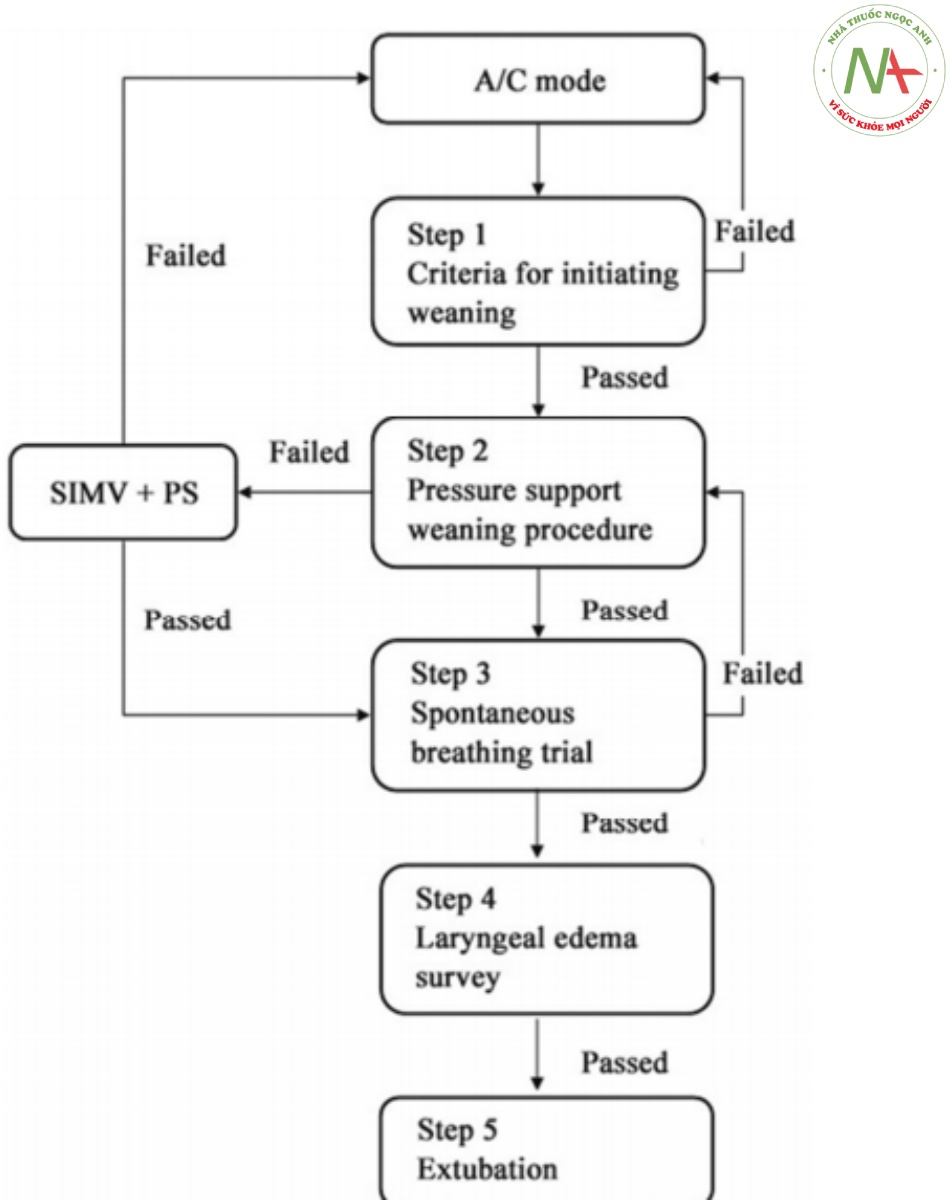
Fentanyl, lorazepam, midazolam, atracurium, cisatracurim, hoặc sự kết hợp của chúng được sử dụng để an thần và phong bế thần kinh cơ. Việc lựa chọn thuốc, liều lượng và thời gian dùng thuốc được quyết định bởi các bác sĩ tham gia. Quản lý thông khí ở cả hai nhóm liên quan đến việc sử dụng thông khí bảo vệ với thể tích khí lưu thông là 6 ml/kg trọng lượng cơ thể dự đoán, tăng CO2 máu cho phép và ưu tiên sử dụng các chế độ thông khí giới hạn áp lực [24]. Sau khi PEEP tối ưu được chọn và nếu PaO2 không thay đổi, cài đặt máy thở sẽ được giữ nguyên. Nếu PaO2 tăng > 10%, FiO2 được điều chỉnh từ từ về giá trị thấp hơn 5–10%. Khi FiO2 đạt 60%, PEEP giảm dần theo từng bước 2 cmH2O. Chế độ thông khí được chuyển sang hỗ trợ thông khí ở giai đoạn sớm nhất. Các tiêu chí để bắt đầu cai máy, quy trình cai máy chính xác và tham gia thử nghiệm thở tự nhiên được thực hiện theo quy trình cai máy nội bộ của chúng tôi (Hình 1). Chế độ hỗ trợ áp lực được sử dụng để cai máy. Dựa trên các thông số khác nhau như nhịp thở, thể tích khí lưu thông và huyết áp, mức hỗ trợ áp lực đã được điều chỉnh hoặc quy trình cai máy đã kết thúc. Áp lực đường thở dương liên tục bên ngoài hoặc phương pháp ống chữ T đã được sử dụng để thử nghiệm thở tự nhiên. Chiến lược thử nghiệm thở tự nhiên ở trung tâm của chúng tôi đã được mô tả trong các nghiên cứu trước đây [25, 26]. Sau khi rút nội khí quản, bệnh nhân được hỗ trợ bằng chế độ áp lực đường thở dương hai mức không xâm lấn.
Hình 1 Quy trình làm việc của giao thức cai máy nội bộ được áp dụng cho bệnh nhân từ cả nhóm EIT và nhóm kiểm soát. A/C: Chế độ hỗ trợ điều khiển chế độ. SIMV: Chế độ thông khí bắt buộc ngắt quãng đồng bộ hóa. PS: Chế độ hỗ trợ áp lực
Thu thập dữ liệu và đo lường kết quả
Các đặc điểm nhân khẩu học, dữ liệu sinh lý, các biện pháp can thiệp ICU có liên quan và các đặc điểm chụp X quang đã được thu thập trước khi chuẩn độ PEEP ban đầu sau khi đưa bệnh nhân vào nghiên cứu. Dữ liệu hô hấp trước khi chuẩn độ PEEP này và 2 giờ sau đó được thu thập (ngoại trừ Đánh giá sinh lý cấp tính và sức khỏe mãn tính, điểm APACHE II, được tính sau 24 giờ). Tất cả bệnh nhân được theo dõi cho đến khi ra viện.
Các kết quả chính là cơ học hô hấp và oxygen hóa. Các đánh giá kết quả thăm dò bao gồm tỷ lệ tử vong tại bệnh viện do mọi nguyên nhân (bệnh nhân xuất viện đến cơ sở chăm sóc ở cấp độ thay thế được phân loại là còn sống khi xuất viện), sự hiện diện của chấn thương khí áp (tràn khí màng phổi, tràn khí trung thất, tràn khí màng bụng, hoặc tràn khí dưới da trên X quang ngực hoặc đặt ống lồng ngực để biết hoặc nghi ngờ tràn khí màng phổi tự phát), tỷ lệ cai máy thành công (tự thở mà không cần hỗ trợ máy thở trong 5 ngày). Như các chiến lược hô hấp, oxit nitric, oxygen hóa qua màng ngoài cơ thể (ECMO) và các thuốc ức chế thần kinh cơ (NMBA) đã được áp dụng sau khi chuẩn độ PEEP ban đầu khi cần thiết. Các chỉ định và chống chỉ định dựa trên các phác đồ nội bộ của chúng tôi để đảm bảo rằng bệnh nhân từ cả hai nhóm đều được điều trị theo cùng một tiêu chí.
Phân tích thống kê
Thử nghiệm t ghép đôi được sử dụng để so sánh dữ liệu hô hấp trước và 2 giờ sau khi chuẩn độ PEEP. Thử nghiệm không ghép đôi hoặc thử nghiệm Chi bình phương với thử nghiệm chính xác của Fisher đã được sử dụng để so sánh nhân khẩu học và kết quả lâm sàng giữa EIT và các nhóm kiểm soát khi thích hợp. Thử nghiệm Chi-square được thực hiện thêm với các nhóm dưới dạng biến lớp để kiểm tra xem việc sử dụng oxit nitric hoặc NMBA có ảnh hưởng đáng kể đến tỷ lệ sống sót hay không. Khi dữ liệu không được phân phối bình thường, kiểm tra xếp hạng có chữ ký Wilcoxon hoặc kiểm tra tổng xếp hạng được sử dụng thay cho kiểm tra t. Thử nghiệm log-rank được thực hiện để đánh giá sự khác biệt về số ngày sống sót trong bệnh viện và đường cong cai máy thành công của nhóm EIT và nhóm đối chứng. một pgiá trị <0,05 được coi là có ý nghĩa thống kê. Phân tích thống kê được thực hiện bằng SPSS (phiên bản 19; IBM Corp. Armonk, NY, USA).
Kết quả
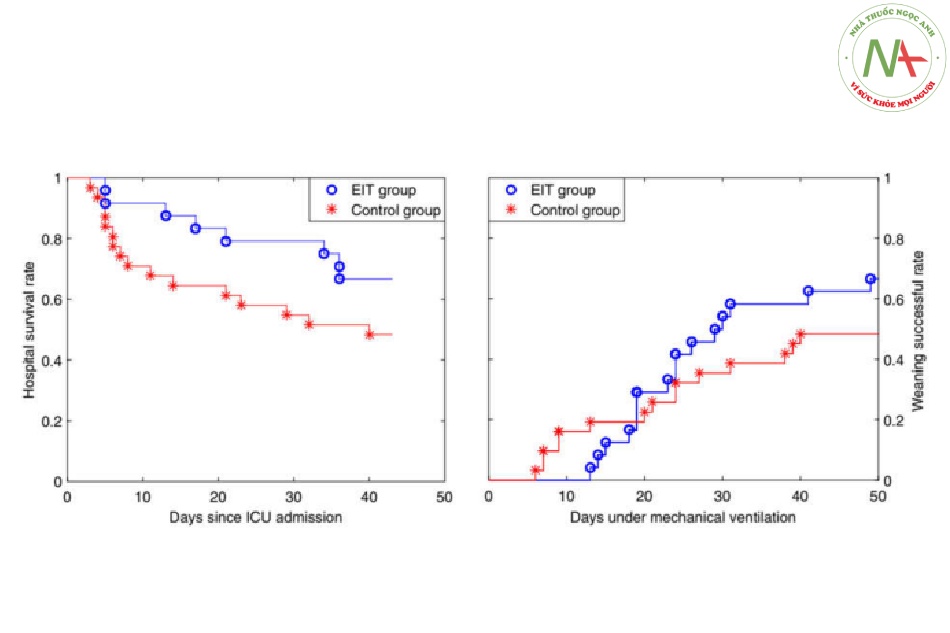
Nhân khẩu học của bệnh nhân có thể so sánh được giữa các nhóm ngoại trừ tuổi tác (50,5 ± 13,3 ở nhóm EIT so với 61,5 ± 19,2 ở nhóm đối chứng, P <0,05). Các thông số ban đầu có thể so sánh được ở hai nhóm ngoại trừ áp lực cao nguyên (Bảng 2). Nguyên nhân của ARDS rất đa dạng về đối tượng (xem Tệp bổ sung 1). Hình 2 hiển thị một báo cáo về chuẩn độ PEEP ở một trong những bệnh nhân thuộc nhóm EIT. Bảng 3 tóm tắt các tham số kết quả được so sánh giữa EIT và các nhóm kiểm soát. Tỷ lệ sống sót tại bệnh viện và tỷ lệ cai máy thành công cao hơn ở nhóm EIT nhưng sự khác biệt không có ý nghĩa thống kê. (Xem thêm Hình 3) Thử nghiệm log- rank cũng chỉ ra rằng sự khác biệt về số ngày là không đáng kể (P = 0,10 và 0,24 đối với tỷ lệ sống sót trong bệnh viện (Hình 3 trái) và đường cong cai máy thành công (Hình 3 phải, tương ứng). Nhiều bệnh nhân hít oxit nitric hơn trong nhóm đối chứng (Bảng 3; p <0,01). Thử nghiệm Chi-square chỉ ra rằng cả oxit nitric và NMBA dạng hít đều không liên quan đến sự sống sót (P = 0,36, 0,48 và 1,00 đối với oxit nitric dạng hít trong EIT, nhóm đối chứng và tổng thể, tương ứng; P = 1,00, 0,65 và 0,69 đối với NMBA trong EIT, nhóm kiểm soát và tổng thể, tương ứng). Không có sự khác biệt đáng kể nào được tìm thấy trong các chiến lược thông khí khác (ví dụ: ECMO). Áp lực đẩy và Crs được cải thiện đáng kể ở cả hai nhóm 2 giờ sau khi chuẩn độ PEEP (P<0,01; Bảng 2), nhưng việc giảm áp lực đẩy và tăng Crs rõ rệt hơn ở nhóm EIT (P <0,01 giữa các nhóm sau khi chuẩn độ PEEP). Ngoài ra, điểm APACHE II sau 24 giờ được cải thiện đáng kể trong EIT nhưng không phải ở nhóm kiểm soát.
Thảo luận
Trong nghiên cứu hiện tại, chuẩn độ PEEP theo hướng dẫn của EIT đã được thực hiện tiền cứu ở những bệnh nhân ARDS nặng. Nó đã cải thiện đáng kể PaO2/FiO2, điểm số APACHE II, áp lực đẩy và Crs. Hơn nữa, kết quả lâm sàng của nó được so sánh với phương pháp đường cong áp lực-thể tích. Chuẩn độ PEEP theo hướng dẫn của EIT có liên quan đến áp lực đẩy thấp hơn, Crs cao hơn, tỷ lệ sống sót trong bệnh viện cao hơn nhưng không đáng kể và tỷ lệ cai máy thành công. Kết quả của nghiên cứu sơ bộ đã cung cấp thông tin về kích thước ảnh hưởng của các tham số kết quả và cách tính cỡ mẫu cho các thử nghiệm đối chứng ngẫu nhiên trong tương lai.
Để xác định PEEP tối ưu cho từng cá nhân vẫn là một chủ đề nghiên cứu phổ biến trong lĩnh vực chăm sóc tích cực [27, 28]. Bên cạnh các phương pháp chuẩn độ PEEP được sử dụng rộng rãi (ví dụ: Crs, khí máu), các phương pháp mới như áp lực thực quản [29] và tỷ lệ khoảng chết [30] được đề xuất. Vì việc áp dụng PEEP nhằm mục đích duy trì phế nang mở, nên các kỹ thuật hình ảnh có thể là phương pháp trực quan hơn để chọn PEEP tối ưu.
Bảng 2 So sánh các thông số tại đường cơ sở và 2 giờ sau khi chuẩn độ PEEP
| Thông số | Nhóm EIT | Nhóm kiểm soát | Giá trị P (giữa các nhóm) |
| Đường cơ sở | |||
| PaO2/FiO2 (mmHg) | 71,7 ± 16,6 | 69,7 ± 15,9 | 0,66 |
| APACHE II | 23,2 ± 6,4 | 23,5 ± 6,9 | 0,89 |
| PEEP (cmH2O) | 13,5 ± 1,9 | 11,5 ± 3,8 | 0,07 |
| Vt (ml/kg) | 6,0 ± 0,8 | 6,3 ± 1,1 | 0,27 |
| Pdrive (cmH2O) | 22,5 ± 2,2 | 23,0 ± 3,1 | 0,54 |
| Pplat (cmH2O) | 35,9 ± 0,9 | 34,4 ± 2,4 | < 0,01 § |
| Crs (ml/cmH2O) | 16,0 ± 1,8 | 16,0 ± 2,9 | 0,91 |
| 2 giờ sau (trừ APACHE II) | |||
| PaO2/FiO2 (mmHg) | 163,7 ± 70,1* | 160,0 ± 77,8* | 0,86 |
| APACHE II (24 giờ) | 20,6 ± 5,3* | 22,7 ± 8,6 | 0,31 |
| PEEP (cmH2O) | 17,6 ± 3,6* | 13,6 ± 3,6* | < 0,01 § |
| Vt (ml/kg) | 6,3 ± 0,8 | 6,5 ± 1,2 | 0,59 |
| Pdrive (cmH2O) | 15,1 ± 3,1* | 19,1 ± 3,7* | < 0,01 § |
| Pplat (cmH2O) | 32,7 ± 2,6* | 32,6 ± 2,7* | 0,98 |
| Crs (ml/cmH2O) | 25,9 ± 5,9* | 20,4 ± 5,3* | < 0,01 § |
PaO2/FiO2: tỷ lệ áp lực riêng phần của oxy trong động mạch và nồng độ oxy hít vào, APACHE: đánh giá sinh lý cấp tính và sức khỏe mãn tính, Vt: thể tích khí lưu thông trên mỗi kg trọng lượng cơ thể dự đoán, Pdriv: áp lực đẩy, Pplat: áp lực bình nguyên, Crs: độ giãn nở của hệ hô hấp
Sự khác biệt đáng kể so với các giá trị cơ bản trong mỗi nhóm được đánh dấu * (P < 0,01). Sự khác biệt đáng kể giữa các nhóm được đánh dấu bằng §
Hình 2 Báo cáo chuẩn độ PEEP của một bệnh nhân ARDS. Mức PEEP được chọn dựa trên EIT là điểm chặn của các đường cong phần trăm tích lũy xẹp và quá căng (đường tam giác và đường hoa thị). Nếu điểm chặn xảy ra giữa hai bước PEEP, PEEP đã chọn tương ứng với bước PEEP hướng tới chỉ số không đồng nhất toàn cục (GI) thấp nhất (đường tròn)
Bảng 3 Các kết quả khác và so sánh chiến lược thông khí giữa hai nhóm
| Thông số | Nhóm EIT | Nhóm kiểm soát | Giá trị p |
| Kết quả | |||
| Tỷ lệ sống sót của bệnh viện | 16/24 (66,7%) | 15/31 (48,4%) | 0,18 |
| Tỷ lệ cai máy thành công | 16/24 (66,7%) | 15/31 (48,4%) | 0,18 |
| Chấn thương khí áp | 0/24 (0%) | 2/31 (6,5%) | 0,50 |
| Chiến lược thông khí | |||
| Hít oxit nitric | 16/24 (66,7%) | 30/31 (96,8%) | < 0,01 § |
| ECMO | 8/24 (33,3%) | 5/31 (16,1%) | 0,20 |
| Mở khí quản | 24/5 (21%) | 4/31 (10%) | 0,30 |
| Nằm sấp | 1/24 (4%) | 0/31 (0%) | 0,44 |
| NMBA | 23/24 (96%) | 26/31 (84%) | 0,22 |
ECMO, Oxygen hóa màng ngoài cơ thể; NMBA, thuốc phong bế thần kinh cơ Sự khác biệt đáng kể được đánh dấu bằng §
Hình 3 Đường cong tỷ lệ sống sót tại bệnh viện (trái) và cai máy thành công (phải) của nhóm EIT (vòng tròn màu xanh) và nhóm đối chứng (dấu hoa thị màu đỏ). Đối với các đường cong sinh tồn tại bệnh viện, ngày 0 là ngày nhập viện ICU. Nếu một bệnh nhân sống sót và được xuất viện, anh ta không bị kiểm duyệt mà thay vào đó được tính là sống sót
Là công cụ đầu giường duy nhất hiện có, các đánh giá hồi cứu về chuẩn độ PEEP theo hướng dẫn của EIT đã xác nhận tính khả thi của nó [15, 16, 20, 23, 31]. Hai nghiên cứu kết quả trong tương lai đã được tiến hành ở lợn được rửa phổi, một trong số đó xác nhận rằng lựa chọn PEEP theo hướng dẫn của EIT vượt trội so với bảng ARDSnet [17, 32]. Bảng ARDSnet khuyến nghị PEEP theo mức độ FiO2, ít cá nhân hóa hơn so với lựa chọn dựa trên cơ học phổi, khí máu hoặc hình ảnh. Trong nghiên cứu hiện tại, chúng tôi đã chọn đường cong áp lực-thể tích trên máy thở làm phương pháp tham chiếu, vì nó thường được sử dụng trong khoa của chúng tôi để chuẩn độ PEEP. Một nghiên cứu trước đây cho rằng cài đặt PEEP ở 2 cmH2O trên LIP hiệu quả hơn trong việc duy trì trao đổi khí và giảm thiểu tổn thương so với PEEP dựa trên oxygen hóa đầy đủ [33]. Trong nghiên cứu hiện tại, PaO2/FiO2, áp lực đẩy và Crs đã được cải thiện 2 giờ sau khi đặt PEEP ở LIP + 2 cmH2O (Bảng 2). Các nghiên cứu trước đây cho rằng áp lực đẩy và Crs là những yếu tố nguy cơ dẫn đến tử vong [34]. So với nhóm đối chứng, những cải thiện về áp lực đẩy và Crs có ý nghĩa hơn ở nhóm EIT. Tuy nhiên, hiệu quả của chiến lược chuẩn độ PEEP nhằm giảm áp lực đẩy vẫn phải được chứng minh. Bên cạnh đó, điểm APACHE II sau 24 giờ được cải thiện đáng kể ở nhóm EIT nhưng không phải ở nhóm đối chứng. Hạn chế của việc sử dụng đường cong áp lực-thể tích để chuẩn độ PEEP là LIP là một tham số toàn cục, sau đó việc huy động khu vực sẽ tiếp tục diễn ra. Mặt khác, EIT có thể đánh giá huy động khu vực tốt hơn. Mặc dù mặt phẳng đo hình thấu kính cắt ngang của EIT chỉ bao phủ một phần của phổi, nhưng những thay đổi trở kháng có tương quan cao với những thay đổi thể tích của toàn bộ phổi [26]. Các biện pháp dựa trên EIT được sử dụng trong nghiên cứu hiện tại đã cố gắng tối đa hóa việc huy động phổi phụ thuộc và giảm thiểu sự căng quá mức của các vùng phổi không phụ thuộc. Cách tiếp cận này có thể đã cải thiện kết quả bằng cách giảm thiểu các yếu tố gây ra tổn thương phổi do máy thở. Cần lưu ý rằng EIT hiện là phương pháp duy nhất có khả năng đánh giá tình trạng căng quá mức khu vực tại giường bệnh.
Hai nghiên cứu tiến cứu gần đây đã sử dụng EIT để chuẩn độ PEEP ở bệnh nhân ARDS [19, 35]. Trùng hợp với kết quả trong các nghiên cứu trước đây, chúng tôi đã chứng minh rằng chuẩn độ PEEP với EIT có thể cải thiện đáng kể PaO2/FiO2, điểm số APACHE II, áp lực đẩy và Crs (Bảng 2). Một hạn chế của các nghiên cứu trước đó là không có nhóm đối chứng nên không thể so sánh kết quả lâm sàng [19, 35]. Nhiều lý do đã hạn chế các nghiên cứu kết quả trong tương lai về thông khí hướng dẫn EIT. Để so sánh kết quả lâm sàng như tỷ lệ cai máy thành công, tỷ lệ tử vong, cần phải có một số lượng lớn đối tượng. Tuy nhiên, số lượng bệnh nhân ARDS nặng bị hạn chế do những cải tiến trong việc ngăn ngừa tổn thương phổi liên quan đến máy thở (ví dụ: thông khí bảo vệ phổi) và điều trị bệnh. Nhóm kiểm soát trong nghiên cứu hiện tại đã được phân tích hồi cứu. Thiếu ngẫu nhiên là hạn chế có liên quan nhất trong nghiên cứu này. Điều này có thể làm giảm sức mạnh thống kê của những phát hiện hiện tại bằng cách đưa ra sai lệch trong cả hai nhóm. Bên cạnh đó, lựa chọn PEEP chỉ là một trong những yếu tố tiềm năng chịu trách nhiệm cho tỷ lệ sống sót. Xu hướng trong các thông số cơ bản có thể có ảnh hưởng đến những phát hiện. Số ngày không có máy thở là điểm cuối có thể gây hiểu nhầm [36]. Tương tự, thời gian nằm trong ICU và thời gian nằm viện cũng có thể không rõ ràng. Do đó, các thông số này không được trình bày như một kết quả. Cần lưu ý rằng bệnh nhân chủ yếu được điều trị ở tư thế nằm ngửa (Bảng 3). Được biết, tư thế nằm sấp có thể dẫn đến tăng oxygen hóa và giảm áp lực đẩy [37], và nó thường được sử dụng trong bệnh viện của chúng tôi trong những năm đầu. Tuy nhiên, như đã nêu trong [37], tư thế nằm sấp đòi hỏi nhiều nhân lực và sự cẩn thận hơn. Với số lượng bệnh nhân được điều trị tăng lên nhanh chóng, nó đã trở thành một vấn đề trong khoa của chúng tôi và không phải lúc nào cũng có thể cung cấp tư thế nằm sấp. Chúng tôi cũng thừa nhận rằng áp lực bình nguyên cao hơn một chút so với khuyến nghị 30 cmH2O trong Hướng dẫn Chiến dịch Sống sót sau Nhiễm trùng huyết năm 2012 [38]. Do thể tích khí lưu thông là 6 ml/kg trọng lượng cơ thể dự đoán được nhắm đến và PEEP ban đầu không cao lắm, nên áp lực bình nguyên ban đầu cao chỉ cho thấy rằng độ giãn nở ban đầu của phổi bệnh nhân rất thấp. Mặc dù bệnh nhân trong nghiên cứu của chúng tôi bị sốc nhiễm trùng, mức áp lực cao nguyên cao ở cả hai nhóm và chỉ một người được điều trị ở tư thế nằm sấp, tỷ lệ tử vong trong đoàn hệ của chúng tôi không cao hơn tỷ lệ trung bình được báo cáo [39]. Trên thực tế, tỷ lệ tử vong trong nhóm EIT thấp hơn mức trung bình được báo cáo.
Tỷ lệ sống sót không khác biệt về mặt thống kê do số lượng bệnh nhân hạn chế ở cả hai nhóm. Theo phân phối Chi-square, việc nhân đôi kích thước mẫu sẽ dẫn đến sự khác biệt đáng kể nếu tỷ lệ sống sót không đổi. Vì không có nghiên cứu nào trước đây kiểm tra các kết quả so sánh chuẩn độ PEEP theo hướng dẫn của EIT và các phương pháp truyền thống khác, nên kích thước ảnh hưởng của các tham số kết quả vẫn chưa được biết. Không thể thực hiện phân tích sức mạnh tiên nghiệm. Các phát hiện của nghiên cứu thí điểm hiện tại đã cung cấp thông tin về độ lệch của các giá trị tham số, có thể được sử dụng để tính cỡ mẫu trong các nghiên cứu ngẫu nhiên đa trung tâm trong tương lai. Để đạt được khả năng thống kê là 80% và sai số loại I là 0,05, cỡ mẫu phải là 113 trong mỗi nhóm với tỷ lệ sống sót được tìm thấy trong nghiên cứu thử nghiệm này. Sự khác biệt về tỷ lệ sống sót lớn một cách đáng ngạc nhiên giữa nhóm EIT và nhóm đối chứng (66,7% so với 48,4%). Những lý do tiềm năng sau đây đã không được kiểm tra, đó là một hạn chế lớn của nghiên cứu này. (1) Tuổi tác và việc sử dụng khí hít oxit nitric khác nhau đáng kể ở nhóm EIT và nhóm đối chứng. Áp lực cao nguyên ban đầu trung bình là 1,5 cmH2O cao hơn trong nhóm EIT. Phát hiện này có lẽ sẽ có ảnh hưởng tiêu cực đến kết quả, nếu có. (2) Mặc dù các chiến lược thông khí bảo vệ và chăm sóc tiêu chuẩn giống nhau được cung cấp cho cả hai nhóm, nhưng những khác biệt tiềm ẩn về điều trị chưa biết có thể đã ảnh hưởng đến kết quả. Bên cạnh đó, thời gian nằm ICU càng lâu thì càng có nhiều sự không chắc chắn về các yếu tố ảnh hưởng đến tỷ lệ sống sót ở hai nhóm. Hình 3 chỉ ra rằng sự khác biệt cao nhất về tỷ lệ sống sót xảy ra khi bắt đầu ở lại ICU, khi dịch vụ chăm sóc tiêu chuẩn tương đương nhau ở cả hai nhóm. (3) Thử nghiệm PEEP tăng dần/giảm dần và thủ thuật bơm phồng lưu lượng thấp là hai loại thủ thuật huy động phổi khác nhau, có thể có hiệu quả khác nhau trong việc huy động phổi ở nhóm EIT và nhóm đối chứng, không được kiểm tra. (4) Như đã chỉ ra trong Tệp bổ sung 1, nguyên nhân của ARDS là khác nhau ở các đối tượng nghiên cứu với những tác động có thể chưa biết đối với tỷ lệ tử vong.
Kết luận
Ở những bệnh nhân ARDS nặng, việc hướng dẫn chuẩn độ PEEP với EIT tại giường bệnh là khả thi và an toàn. So với đường cong áp lực-thể tích, phép chuẩn độ PEEP theo hướng dẫn của EIT có thể liên quan đến việc cải thiện oxygen hóa, độ giãn nở, áp lực đẩy và tỷ lệ cai máy thành công. Các phát hiện khuyến khích nghiên cứu đối chứng ngẫu nhiên hơn nữa với cỡ mẫu lớn hơn và có khả năng ít sai lệch hơn trong dữ liệu cơ sở.
References
- Pham T, Rubenfeld GD. Fifty years of research in ARDS. The epidemiology of acute respiratory distress syndrome. A 50th birthday review. Am J Respir Crit Care Med. 2017;195(7):860–870. doi: 10.1164/rccm.201609- 1773CP. [PubMed] [CrossRef] [Google Scholar]
- Ferguson ND, Fan E, Camporota L, Antonelli M, Anzueto A, Beale R, Brochard L, Brower R, Esteban A, Gattinoni L, et al. The Berlin definition of ARDS: an expanded rationale, justification, and supplementary material. Intensive Care 2012;38(10):1573–1582. doi: 10.1007/s00134-012-2682-1. [PubMed] [CrossRef] [Google Scholar]
- The Acute Respiratory Distress Syndrome Network Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. N Engl J Med. 2000;342(18):1301–1308. doi: 1056/NEJM200005043421801. [PubMed] [CrossRef] [Google Scholar]
- Brower RG, Lanken PN, MacIntyre N, Matthay MA, Morris A, Ancukiewicz M, Schoenfeld D, Thompson Higher versus lower positive end-expiratory pressures in patients with the acute respiratory distress syndrome. N Engl J Med. 2004;351(4):327–336. doi: 10.1056/NEJMoa032193. [PubMed] [CrossRef] [Google Scholar]
- Meade MO, Cook DJ, Guyatt GH, Slutsky AS, Arabi YM, Cooper DJ, Davies AR, Hand LE, Zhou Q, Thabane L, et Ventilation strategy using low tidal volumes, recruitment maneuvers, and high positive end-expiratory pressure for acute lung injury and acute respiratory distress syndrome: a randomized controlled trial. JAMA. 2008;299(6):637–645. doi: 10.1001/jama.299.6.637. [PubMed] [CrossRef] [Google Scholar]
- Terragni PP, Rosboch G, Tealdi A, Corno E, Menaldo E, Davini O, Gandini G, Herrmann P, Mascia L, Quintel M, et al. Tidal hyperinflation during low tidal volume ventilation in acute respiratory distress syndrome. Am J Respir Crit Care 2007;175(2):160–166. doi: 10.1164/rccm.200607-915OC. [PubMed] [CrossRef] [Google Scholar]
- Amato MB, Meade MO, Slutsky AS, Brochard L, Costa EL, Schoenfeld DA, Stewart TE, Briel M, Talmor D, Mercat A, et al. Driving pressure and survival in the acute respiratory distress N Engl J Med. 2015;372(8):747– 755. doi: 10.1056/NEJMsa1410639. [PubMed] [CrossRef] [Google Scholar]
- Suarez-Sipmann F, Bohm SH, Tusman G, Pesch T, Thamm O, Reissmann H, Reske A, Magnusson A, Hedenstierna
- Use of dynamic compliance for open lung positive end-expiratory pressure titration in an experimental study. Crit Care Med. 2007;35(1):214–221. doi: 10.1097/01.CCM.0000251131.40301.E2. [PubMed] [CrossRef] [Google Scholar]
- Toth I, Leiner T, Mikor A, Szakmany T, Bogar L, Molnar Hemodynamic and respiratory changes during lung recruitment and descending optimal positive end-expiratory pressure titration in patients with acute respiratory distress syndrome. Crit Care Med. 2007;35(3):787–793. doi: 10.1097/01.CCM.0000257330.54882.BE. [PubMed] [CrossRef] [Google Scholar]
- LaFollette R, Hojnowski K, Norton J, DiRocco J, Carney D, Nieman G. Using pressure–volume curves to set proper PEEP in acute lung injury. Nurs Crit Care. 2007;12(5):231–241. doi: 10.1111/j.1478-5153.2007.00224.x. [PubMed] [CrossRef] [Google Scholar]
- Caramez MP, Kacmarek RM, Helmy M, Miyoshi E, Malhotra A, Amato MB, Harris A comparison of methods to identify open-lung PEEP. Intensive Care Med. 2009;35(4):740–747. doi: 10.1007/s00134-009-1412-9. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Cavalcanti AB, Suzumura EA, Laranjeira LN, Paisani DM, Damiani LP, Guimaraes HP, Romano ER, Regenga MM, Taniguchi LNT, Teixeira C, et Effect of lung recruitment and titrated positive end-expiratory pressure (PEEP) vs low PEEP on mortality in patients with acute respiratory distress syndrome: a randomized clinical trial. JAMA. 2017;318(14):1335–1345. doi: 10.1001/jama.2017.14171. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Villar J, Suarez-Sipmann F, Kacmarek RM. Should the ART trial change our practice? J Thorac Dis. 2017;9(12):4871–4877. doi: 21037/jtd.2017.11.01. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Frerichs I, Amato MB, van Kaam AH, Tingay DG, Zhao Z, Grychtol B, Bodenstein M, Gagnon H, Bohm SH, Teschner E, et al. Chest electrical impedance tomography examination, data analysis, terminology, clinical use and recommendations: consensus statement of the translational EIT development study group. Thorax. 2017;72(1):83–93. doi: 10.1136/thoraxjnl-2016-208357. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Meier T, Luepschen H, Karsten J, Leibecke T, Grossherr M, Gehring H, Leonhardt Assessment of regional lung recruitment and derecruitment during a PEEP trial based on electrical impedance tomography. Intensive Care Med. 2008;34(3):543–550. doi: 10.1007/s00134-007-0786-9. [PubMed] [CrossRef] [Google Scholar]
- Dargaville PA, Rimensberger PC, Frerichs Regional tidal ventilation and compliance during a stepwise vital capacity manoeuvre. Intensive Care Med. 2010;36(11):1953–1961. doi: 10.1007/s00134-010-1995-1. [PubMed] [CrossRef] [Google Scholar]
- Wolf GK, Gomez-Laberge C, Rettig JS, Vargas SO, Smallwood CD, Prabhu SP, Vitali SH, Zurakowski D, Arnold Mechanical ventilation guided by electrical impedance tomography in experimental acute lung injury. Crit Care Med. 2013;41(5):1296–1304. doi: 10.1097/CCM.0b013e3182771516. [PubMed] [CrossRef] [Google Scholar]
- Liu S, Tan L, Moller K, Frerichs I, Yu T, Liu L, Huang Y, Guo F, Xu J, Yang Y, et al. Identification of regional overdistension, recruitment and cyclic alveolar collapse with electrical impedance tomography in an experimental ARDS Crit Care. 2016;20(1):119. doi: 10.1186/s13054-016-1300-y. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Franchineau G, Brechot N, Lebreton G, Hekimian G, Nieszkowska A, Trouillet JL, Leprince P, Chastre J, Luyt CE, Combes A, et al. Bedside contribution of electrical impedance tomography to set positive end-expiratory pressure for ECMO-treated severe ARDS patients. Am J Respir Crit Care Med. 2017;196:447–457. doi: 10.1164/rccm.201605-1055OC. [PubMed] [CrossRef] [Google Scholar]
- Luepschen H, Meier T, Grossherr M, Leibecke T, Karsten J, Leonhardt Protective ventilation using electrical impedance tomography. Physiol Meas. 2007;28(7):S247–S260. doi: 10.1088/0967-3334/28/7/S18. [PubMed] [CrossRef] [Google Scholar]
- Zhao Z, Vogt B, Frerichs I, Müller-Lisse U, Möller K. Developing customized evaluation software for clinical trials: an example with obstructive lung diseases. Engineering. 2013;5:103–107. doi: 10.4236/eng.2013.510B021. [CrossRef] [Google Scholar]
- Costa EL, Borges JB, Melo A, Suarez-Sipmann F, Toufen C, Jr, Bohm SH, Amato Bedside estimation of recruitable alveolar collapse and hyperdistension by electrical impedance tomography. Intensive Care Med. 2009;35(6):1132–1137. doi: 10.1007/s00134-009-1447-y. [PubMed] [CrossRef] [Google Scholar]
- Zhao Z, Steinmann D, Frerichs I, Guttmann J, Möller K. PEEP titration guided by ventilation homogeneity: a feasibility study using electrical impedance tomography. Crit Care. 2010;14(1):R8. doi: 10.1186/cc8860. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Amato MB, Barbas CS, Medeiros DM, Magaldi RB, Schettino GP, Lorenzi-Filho G, Kairalla RA, Deheinzelin D, Munoz C, Oliveira R, et al. Effect of a protective-ventilation strategy on mortality in the acute respiratory distress syndrome. N Engl J Med. 1998;338(6):347–354. doi: 10.1056/NEJM199802053380602. [PubMed] [CrossRef] [Google Scholar]
- Hsu YL, Tien AJ, Chang MY, Chang HT, Moeller K, Frerichs I, Zhao Regional ventilation redistribution measured by electrical impedance tomography during spontaneous breathing trial with automatic tube compensation. Physiol Meas. 2017;38(6):1193–1203. doi: 10.1088/1361-6579/aa66fd. [PubMed] [CrossRef] [Google Scholar]
- Zhao Z, Peng SY, Chang MY, Hsu YL, Frerichs I, Chang HT, Möller K. Spontaneous breathing trials after prolonged mechanical ventilation monitored by electrical impedance tomography: an observational study. Acta Anaesthesiol 2017;61(9):1166–1175. doi: 10.1111/aas.12959. [PubMed] [CrossRef] [Google Scholar]
- Gattinoni L, Collino F, Maiolo G, Rapetti F, Romitti F, Tonetti T, Vasques F, Quintel Positive end-expiratory pressure: how to set it at the individual level. Ann Transl Med. 2017;5(14):288. doi: 10.21037/atm.2017.06.64. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Nieman GF, Satalin J, Andrews P, Aiash H, Habashi NM, Gatto LA. Personalizing mechanical ventilation according to physiologic parameters to stabilize alveoli and minimize ventilator induced lung injury (VILI) Intensive Care Med 2017;5(1):8. doi: 10.1186/s40635-017-0121-x. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Talmor D, Sarge T, Malhotra A, O’Donnell CR, Ritz R, Lisbon A, Novack V, Loring Mechanical ventilation guided by esophageal pressure in acute lung injury. N Engl J Med. 2008;359(20):2095–2104. doi: 10.1056/NEJMoa0708638. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Bian W, Chen W, Chao Y, Wang L, Li L, Guan J, Zang X, Zhen J, Sheng B, Zhu Application of dead space fraction to titrate optimal positive end-expiratory pressure in an ARDS swine model. Exp Ther Med. 2017;13(4):1572– 1577. doi: 10.3892/etm.2017.4117. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Bikker IG, Leonhardt S, Reis Miranda D, Bakker J, Gommers D. Bedside measurement of changes in lung impedance to monitor alveolar ventilation in dependent and non-dependent parts by electrical impedance tomography during a positive end-expiratory pressure trial in mechanically ventilated intensive care unit patients. Crit 2010;14(3):R100. doi: 10.1186/cc9036. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Hochhausen N, Biener I, Rossaint R, Follmann A, Bleilevens C, Braunschweig T, Leonhardt S, Czaplik Optimizing PEEP by electrical impedance tomography in a porcine animal model of ARDS. Respir Care. 2017;62(3):340–349. doi: 10.4187/respcare.05060. [PubMed] [CrossRef] [Google Scholar]
- Takeuchi M, Goddon S, Dolhnikoff M, Shimaoka M, Hess D, Amato MB, Kacmarek RM. Set positive end- expiratory pressure during protective ventilation affects lung injury. Anesthesiology. 2002;97(3):682–692. doi: 10.1097/00000542-200209000-00023. [PubMed] [CrossRef] [Google Scholar]
- Bugedo G, Retamal J, Bruhn A. Driving pressure: a marker of severity, a safety limit, or a goal for mechanical ventilation? Crit Care. 2017;21(1):199. doi: 10.1186/s13054-017-1779-x. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Eronia N, Mauri T, Maffezzini E, Gatti S, Bronco A, Alban L, Binda F, Sasso T, Marenghi C, Grasselli G, et Bedside selection of positive end-expiratory pressure by electrical impedance tomography in hypoxemic patients: a feasibility study. Ann Intensive Care. 2017;7(1):76. doi: 10.1186/s13613-017-0299-9. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Bodet-Contentin L, Frasca D, Tavernier E, Feuillet F, Foucher Y, Giraudeau Ventilatior-free day outcomes can be misleading. Crit Care Med. 2018;46(3):425–429. doi: 10.1097/CCM.0000000000002890. [PubMed] [CrossRef] [Google Scholar]
- Guérin C, Beuret P, Constantin JM, Bellani G, Garcia-Olivares P, Roca O, Meertens JH, Maia PA, Becher T, Peterson J, et al. A prospective international observational prevalence study on prone positioning of ARDS patients: the APRONET (ARDS Prone Position Network) study. Intensive Care Med. 2018;44:22–37. doi: 10.1007/s00134- 017-4996-5. [PubMed] [CrossRef] [Google Scholar]
- Dellinger RP, Levy MM, Rhodes A, Annane D, Gerlach H, Opal SM, Sevransky JE, Sprung CL, Douglas IS, Jaeschke R, et al. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock, 2012. Intensive Care Med. 2013;39:165–228. doi: 10.1007/s00134-012-2769-8. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Bellani G, Laffey JG, Pham T, Fan E, Brochard L, Esteban A, Gattinoni L, van Haren F, Larsson A, McAuley DF, et al. Epidemiology, patterns of care, and mortality for patients with acute respiratory distress syndrome in intensive care units in 50 countries. JAMA. 2016;315:788–800. doi: 10.1001/jama.2016.0291. [PubMed] [CrossRef] [Google Scholar]

Cảm ơn thầy rất nhiều ạ