Bệnh Nhi khoa
Cập nhật bệnh lý xuất huyết phổi sơ sinh – Nguyễn Hoàng Vy và Bác sĩ Phan Danh
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Riad Abou Zahr MD,*Ahmad Ashfaq MD,* Mary Marron – Corwin,MD*
Author Disclosure Drs Zahr, Ashfaq, and Marron-Corwin have disclosed no financialrelationships relevant to this article. This commentary does not contain a discussion of an unapproved/ investigative use of a commercial product/device.
Tham gia biên dịch Nguyễn Hoàng Vy và Bác sĩ nội trú Phan Danh
nhathuocngocanh. Cập nhật xuất huyết phổi sơ sinh– Hiệp hội Y khoa Hoa Kỳ.
Để tải file PDF, hãy click TẠI ĐÂY.
Tóm lược
Xuất huyết phổi ở trẻ sơ sinh là một tình trạng đáng lo ngại có tỷ lệ tử vong sơ sinh cao. Một số yếu tố nguy cơ có liên quan đến sự tiến triển của xuất huyết phổi, nhưng cơ chế bệnh sinh chính xác vẫn còn chưa rõ ràng. Vì vậy, hiện không tồn tại phương pháp điều trị triệt căn nào. Trong tổng quan này, chúng tôi tập trung vào những hiểu biết hiện tại về xuất huyết phổi: cơ chế bệnh sinh, các yếu tố nguy cơ có liên quan, cập nhật xử trí và tiên lượng.
Các từ viết tắt:
- ET: endotracheal tube – ống nội khí quản.
- KU: Klobusitzky unit – đơn vị Klobusitzky.
- PDA: patent ductus arteriosus – còn ống động mạch.
- PEEP: positive end-expiratory pressure – áp lực dương cuối thì thở ra.
- PH: pulmonary hemorrhage – xuất huyết phổi.
- rFVIIa: activated recombinant factor VII – yếu tố VII tái tổ hợp hoạt hóa.
- TIPP: Trial of Indomethacin Prophylaxis in Preterms – Thử nghiệm dự phòng Indomethacin ở trẻ sinh non.
Mục tiêu
Sau khi hoàn thành bài báo này, độc giả có thể:
- Nhận biết được xuất huyết phổi.
- Thảo luận về các giả thuyết được chấp thuận trong cơ chế bênh sinh của xuất huyết phổi.
- Xác định các yếu tố nguy cơ có liên quan đến xuất huyết phổi.
- Giúp bác sĩ lâm sàng nắm được các phương thức điều trị hiện tại trong xử trí xuất huyết phổi.
- Giúp bác sĩ lâm sàng làm quen với di chứng lâu dài sau xuất huyết phổi.
Giới thiệu
Xuất huyết phổi (PH) là một tình trạng đã được ghi nhận ở trẻ sơ sinh đủ tháng và non tháng, được mô tả lần đầu vào năm 1855. (1) Nó thường biểu hiện dấu hiệu đáng ngại của tình trạng lâm sàng xấu đi. PH đề cập đến sự xuất hiện máu tươi trong ống nội khí quản (ET) hay khí quản. Hct của dịch xuất huyết thường thấp hơn Hct tĩnh mạch 15 đến 20 phần trăm. PH liên quan đến sự suy giảm lâm sàng với co mạch, tưới máu kém, tình trạng hô hấp xấu đi, kèm với giảm Hct và những bất thường X-quang ngực. Tần suất PH là 1 đến 12 trên 1,000 trẻ sinh sống. Tỷ lệ này tăng lên 50 trên 1,000 trẻ sinh sống ở các nhóm nguy cơ cao như sinh non hay chậm tăng trưởng trong tử cung. (2) PH xảy ra phổ biến trong vài ngày đầu sau sinh. Tỷ lệ tử vong cao đến 50% đã được báo cáo.
Bệnh sinh
Cơ chế bệnh sinh chính xác của PH vẫn chưa được biết, mặc dù một vài giả thuyết đã được đưa ra. Cole và cộng sự (3) nhận thấy dịch từ phổi trong hầu hết trường hợp biểu hiện dạng dịch phù xuất huyết hơn là máu toàn phần và củng cố nguyên nhân trực tiếp là suy thất trái do ngạt. Hai mươi năm sau, West và cộng sự (4) cho thấy sự suy giảm áp lực mao mạch phổi gây vỡ hàng rào nội mô dẫn đến rò rỉ dịch xuất huyết vào phế nang.
Người ta đã mô tả ba loại lực chính tham gia trong quá trình: (1) sức căng theo chu vi thành mao mạch thứ phát do áp lực xuyên mao mạch, (2) sức căng bề mặt của phế nang hỗ trợ các mao mạch phình lên, và (3) sức căng dọc phế nang, do phổi căng phồng quá mức. (2)(4) Hiện tại, giả thuyết được chấp nhận nhiều nhất là sự giảm sức cản mạch máu phổi có thể làm tăng shunt trái phải qua ống động mạch (PDA) dẫn đến tăng lượng máu lên phổi. Amizuka và cộng sự đã chứng minh có hoạt động ức chế đáng kể chống lại surfactant phổi trong dịch phổi đầu tiên thu được ở trẻ sơ sinh bị PH, cho thấy rằng sự thiếu hụt surfactant có liên quan đến cơ chế bệnh sinh. (5) Bằng chứng gần đây chỉ ra sự hoạt hóa bạch cầu trung tính trong tử cung có thể góp phần vào sự tiến triển đến PH ở trẻ sinh non bị hội chứng suy hô hấp (RDS) (6)
Yếu tố nguy cơ
Nhiều yếu tố nguy cơ có liên quan đến tiến triển của PH như sinh non, chậm tăng trưởng trong tử cung, PDA với luồng thông trái phải, ngạt, rối loạn đông máu, hội chứng suy hô hấp, đa hồng cầu, thiếu oxy máu, đông máu nội mạch lan tỏa, thông khí cơ học, nhiễm trùng huyết, hạ thân nhiệt, giới nam, tổn thương do lạnh, đa thai, ngộ độc oxy, khiếm khuyết chu trình urê, và gần đây là liệu pháp surfactant. Trong một nghiên cứu bệnh chứng của Berger và cộng sự, (2) glucocorticoid trước sinh có tác dụng bảo vệ, trong khi đó giảm tiểu cầu và cần hồi sức tại phòng sinh với áp lực dương lại liên quan đến tăng nguy cơ PH ở trẻ sơ sinh non tháng (Hình 1). Ở trẻ sinh đủ tháng/gần đủ tháng, hít phân su, hạ huyết áp, và cần thông khí áp lực dương ở phòng sinh là yếu tố nguy cơ rõ rệt của PH (Hình 2).
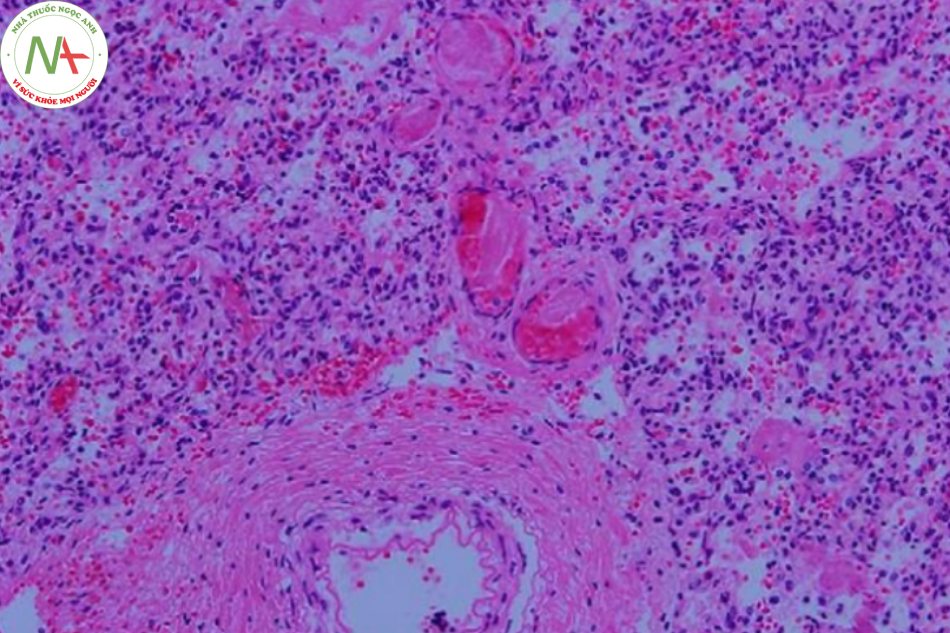
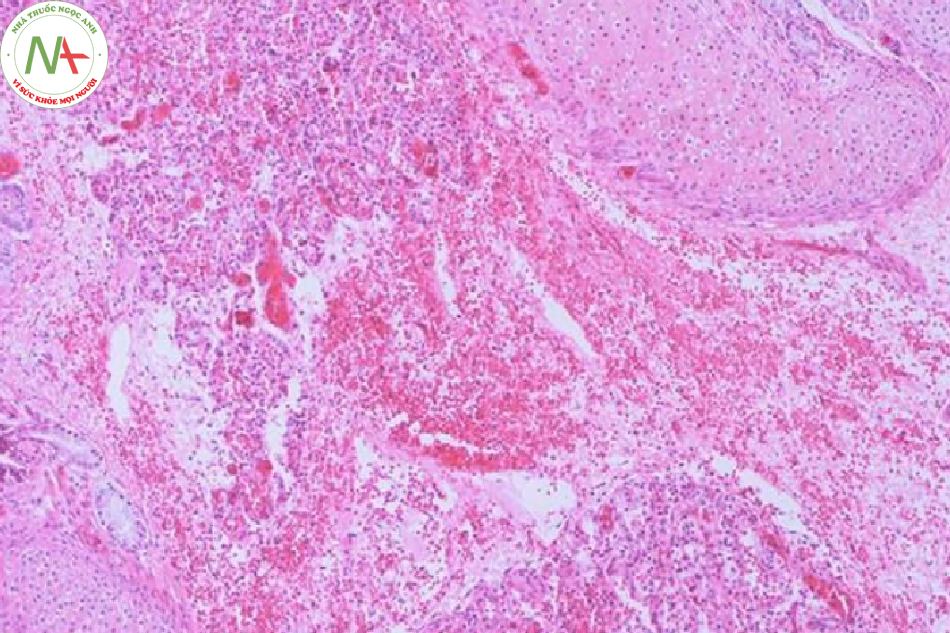
Mối liên hệ giữa PDA và PH đã được mô tả rõ ràng trong y văn. (7)(8) Trong thử nghiệm dự phòng Indomethacin ở trẻ sinh non (Trial Indomethacin Prophylaxis in Preterms- TIPP) bởi Schmidtet và cộng sự, PH là một trong những hậu quả thứ phát ngắn hạn được nghiên cứu. Không có sự khác biệt đáng kể về mặt thống kê được chỉ ra giữa nhóm indomethacin và nhóm giả dược. (9) Sau khi phân tích thêm dữ liệu trong thử nghiệm này, Alfaleh và cộng sự đã chỉ ra việc dự phòng indomethacin làm giảm tỷ lệ PH trong vài ngày đầu sau sinh và cho rằng điều này là do vai trò của nó đối với quá trình đóng ống động mạch. Tuy nhiên, dự phòng indomethacin không làm giảm tỷ lệ PH sau tuần tuổi đầu tiên. (10)
Một vài nghiên cứu đã phân tích sự khác biệt giữa PH ở trước và sau kỷ nguyên surfactant cho nhiều kết quả tranh cãi. Sự mâu thuẫn này có thể do khác biệt trong định nghĩa PH và loại surfactant sử dụng. Stevenson và cộng sự báo cáo sự gia tăng tỷ lệ PH với liệu pháp surfactant tổng hợp bằng Exosurf. (11) Năm 1993, một phân tích gộp các thử nghiệm lâm sàng ngẫu nhiên của liệu pháp surfactant cho thấy nguy cơ mắc PH tăng nhẹ sau liệu pháp surfactant (12)(R R 1.47 [khoảng tin cậy 95% 1.05–2.07]), được lý giải là do sự cải thiện độ đàn hồi phổi sau liệu pháp surfactant, cùng với giảm sức cản mạch máu phổi dẫn đến tăng luồng thông trái phải, điều này góp phần tạo nên PH. Một nghiên cứu bệnh chứng hồi cứu trên 58 trẻ sơ sinh rất nhẹ cân xác định liệu pháp surfactant là yếu tố nguy cơ độc lập của PH. (13) Ngược lại, trong nghiên cứu bệnh chứng khác, Braun và cộng sự đã không thấy sự khác biệt nào về tần suất mắc PH nặng khi dùng surfactant. (1)
Dù hiếm gặp tại Mỹ, nhưng một số quốc gia, tổn thương do lạnh ở trẻ sơ sinh có liên quan đến PH. Trong nghiên cứu trong ống nghiệm, hạ thân nhiệt gây kết tập tiểu cầu từ đó làm giảm số lượng tiểu cầu, quá trình này sẽ còn tiếp tục hay gia tăng khi làm ấm. (14) Kết quả của quá trình này có thể là xuất huyết, giả sử rằng tiểu cầu hoạt động tương tự ở cơ thể sống. Lưu ý, làm ấm tích cực và nhanh chóng giúp rút ngắn giai đoạn giảm tiểu cầu và có thể cải thiện tiên lượng.
Biểu hiện
Biểu hiện điển hình của trẻ sơ sinh bị PH là một trẻ sinh non đột ngột sùi bọt hồng từ ống nội khí quản (ET). Trong vài phút đến vài giờ tiếp theo, trẻ thường tăng nhu cầu cần hỗ trợ thông khí và có dấu hiệu tăng công thở. Khi lượng máu được hút từ ET ngày càng tăng, PCO2 bắt đầu tăng, cũng như tăng nhu cầu oxy. Nếu tình trạng PH tiếp tục, trẻ sơ sinh sẽ diễn tiến đến ngưng thở, xanh xao toàn thân, tím tái, cùng với nhịp tim chậm và hạ huyết áp. Kết quả chụp X-quang ngực là không đặc hiệu. Dựa trên thời gian và mức độ nặng của PH, X-quang ngực có thể có hình ảnh mờ như bông, kính mờ khu trú, hoặc ở dạng trắng xóa hoàn toàn nếu PH lớn.
Xử trí
Xử trí PH có mục đích chính nhằm ngăn ngừa mất máu lượng lớn do xuất huyết trong khi vẫn đảm bảo được trao đổi khí thích hợp. Khí quản trước tiên nên được hút để đảm bảo cục máu đông không gây tắc nghẽn ET. Một catheter cỡ 6.5F nên được dùng cho ống ET 2.5mm và một catheter 8.0 F nếu ET cỡ 3.0 hay 3.5 mm. Việc đo lường nên thực hiện trước khi hút ET nhằm cho phép catheter hút được đặt ở độ sâu chính xác. FiO2 nên được tăng dựa theo hướng dẫn về độ bão hòa oxy ở trẻ sơ sinh. Điều trị chuẩn là tăng áp lực dương cuối thì thở ra (PEEP) lên 6 đến 8 cm H2O. PEEP có thể giúp tạo áp lực lên các mao mạch phổi. Tuy nhiên, những rủi ro của PEEP là tăng thông khí quá mức và tăng CO2 máu. (15) Trong mô hình phổi thỏ, áp dụng PEEP ở mức độ trung bình cho thấy làm giảm tình trạng vỡ phổi, hình thành phù nề, và xuất huyết phổi. (16) Để giảm PH, áp lực đường thở trung bình nên được tăng nhằm làm giảm hay đảo ngược tình trạng phù phổi xuất huyết. Trong một số trường hợp, thông khí dao động tần số cao (HFOV) có thể cần thiết để tăng áp lực đường thở trung bình. HFOV đã được nghiên cứu ở trẻ sơ sinh rất nhẹ cân với PH lớn, và sự giảm đáng kể chỉ số oxy hóa máu đã được ghi nhận. (17)
Epinephrine khí dung hay qua nội khí quản đã được sử dụng trong điều trị PH bởi tác dụng co mạch và hỗ trợ co bóp cơ tim, (18) phổ biến ở liều 0.1 mL/kg epinephrine pha loãng 1:10,000. Tuy nhiên, liệu pháp này vẫn còn nhiều tranh cãi, vì hiện chưa có bất cứ thử nghiệm đối chứng nào chỉ ra được lợi ích rõ ràng. Chụp X-Quang ngực ngay lập tức nên được thực hiện. Một khi tình trạng xuất huyết được giải quyết, phim X-Quang sẽ cho thấy sự cải thiện trong vòng 24 đến 48 giờ. Bởi vì hình ảnh X-Quang ngực của PH khó để phân biệt với viêm phổi, nên việc điều trị thường bao gồm kháng sinh trừ khi nhiễm trùng được loại trừ. Một siêu âm tim nên thực hiện để loại trừ shunt trái phải qua ống động mạch. Trong bối cảnh này, chỉ định phẫu thuật PDA có thể an toàn hơn điều trị nội khoa với indomethacin vì lựa chọn sau có thể làm thúc đẩy thêm xuất huyết. Phytonadione (vitamin K) nên được cho để điều chỉnh prothrombin máu. Dựa vào ước tính về thể tích máu mất, khối hồng cầu và tiểu cầu nên được dùng sau khi có xét nghiệm máu toàn bộ, PT, APTT, D-dimers, và fibrinogen. Định lượng nồng độ amoniac là hữu ích vì khiếm khuyết chu trình urea đôi khi liên quan đến PH. Do mối liên hệ tiềm ẩn với các bệnh lý chuyển hóa, việc tầm soát nhóm bệnh này là cần thiết, bao gồm cả tầm soát bắt buộc, trước khi truyền máu nếu bệnh nhân ổn định. Sử dụng yếu tố VII tái tổ hợp nên được xem xét.
Yếu tố VII tái tổ hợp hoạt hóa (rFVIIa) đã được dùng thành công trong điều trị PH nặng không đáp ứng với liệu pháp thông khí thông thường ở trẻ sơ sinh rất nhẹ cân. (19)(20) Nó là một glycoprotein phụ thuộc vitamin K, hoạt động bằng cách hoạt hóa con đường ngoại sinh và gắn với yếu tố mô, cuối cùng sẽ bịt kín vị trí tổn thương mạch máu và khôi phục quá trình đông máu. Hiệu quả này được tăng cường khi tiểu cầu được sử dụng đồng thời. Nó còn được chấp thuận dùng trong xuất huyết nặng thứ phát sau hemophilia A và B. Một ưu điểm của rFVIIa là thể tích tương đối thấp so với truyền các chế phẩm máu. Trong một báo cáo, liều 50 mg/kg hai lần mỗi ngày cách nhau 3 tiếng, trong 2 đến 3 ngày đã được sử dụng thành côngđể điều trị hai trẻ sơ sinh rất nhẹ cân. (19) Huyết khối tĩnh mạch não là một biến chứng tiềm ẩn của rFVIIa liều cao đã gặp ở người lớn nhưng chưa được báo cáo ở trẻ sơ sinh. Mặc dù chưa có thử nghiệm ngẫu nhiên có đối chứng nào được thực hiện để ủng hộ cho việc dùng rFVIIa, theo kinh nghiệm, chúng tôi đã thành công đáng kể khi sử dụng nó.
Surfactant cũng được sử dụng trong điều trị PH. Dựa trên những quan sát được ở mô hình động vật và trong ống nghiệm cho rằng hemoglobin, màng hồng cầu, các lipid và protein làm tăng sức căng bề mặt, có lẽ thứ phát do tình trạng bất hoạt surfactant. Hậu quả giảm độ đàn hồi phổi đã được đảo ngược sau khi dùng surfactant ngoại sinh. (21) Một loạt trường hợp hồi cứu trên 15 trẻ sơ sinh có PH được điều trị với surfactant cho thấy sự cải thiện ngoạn mục về chỉ số oxy hóa và không diễn tiến nặng. (22) Nghiên cứu hồi cứu khác trên 27 trẻ sơ sinh nhận thấy có đáp ứng tốt với surfactant ngoại sinh ở phần lớn bệnh nhân, kết quả này nhận ảnh hưởng tích cực từ sự rút ngắn thời gian giữa lúc khởi phát PH và thời điểm dùng surfactant, và bởi nồng độphosphatidylcholine không bão hòa cao hơn trong dịch lót biểu mô đường thở. (5) Mặc dù các nghiên cứu trên khuyến cáo về liệu pháp surfactant cho PH, nhưng vẫn chưa có thử nghiệm ngẫu nhiên có đối chứng nào được tiến hành. (23)
Hemocoagulase đã được báo cáo như một điều trị hiệu quả mới cho PH. Hemocoagulase là một hợp chất chiết xuất từ các enzyme có nguồn gốc từ nọc độc của loài rắn Brazil Bothrops atrox. Nó không chứa độc tố thần kinh, có tác dụng giống thromboplastin bằng cách chuyển prothrombin thành thrombin và fibrinogen thành fibrin. (24) Do đó, nó làm giảm thời gian chảy máu và thúc đẩy quá trình đông máu ở vị trí chảy máu. Một đơn vị Klobusitzky (KU) enzyme là lượng cần thiết để làm đông huyết tương người được ủ ở 37°C trong 60 – 20 giây. Trong một nghiên cứu tiến cứu trên 48 trẻ sinh non mắc PH được thông khí cơ học, có 28 trẻ được điều trị với 0.5 KU hemocoagulase qua nội khí quản mỗi 4 đến 6 giờ cho đến khi ngưng xuất huyết. 20 bệnh nhân còn lại chỉ điều trị thở máy đơn thuần. (25) Sự giảm đáng kể thời gian PH, thời gian thở máy, và tỷ lệ tử vong được ghi nhận trong nhóm hemocoagulase. Một nghiên cứu khác thực hiện bởi cùng một nhóm đã khảo sát về sử dụng hemocoagulase để dự phòng PH ở trẻ sinh non. (26) Trong nghiên cứu này, việc dùng 0.25 KU hemocoagulase mỗi 4 đến 6 giờ trong 3 đến 5 ngày có liên quan đến giảm tỷ lệ mắc và thời gian PH nhưng không giảm tỷ lệ tử vong. Kết quả của cả hai thử nghiệm hemocoagulase này không nên được đúc kết vì còn vài điểm hạn chế trong thiết kế nghiên cứu. (24) Do vậy, hemocoagulase nên được dùng như một giải pháp cuối ở những trường hợp không đáp ứng, lưu ý rằng vẫn chưa có thử nghiệm ngẫu nhiên có đối chứng với thiết kế tốt và đủ lớn được tiến hành để kiểm chứng tính hiệu quả và độ an toàn của nó.
Tiên lượng
Dù một số nghiên cứu không chỉ ra được những kết cục bất lợi ở trẻ sơ sinh có PH, (13) nhưng phân tích đào sâu của nghiên cứu TIPPcho thấy nguy cơ tử vong hay sống sót có biến chứng suy giảm thần kinh cảm giác tăng gấp đôi sau khi mắc PH nặng. (10) Sáu mươi phần trăm trẻ sinh non sống sót sau PH sẽ tiến triển loạn sản phế quản phổi. Sự gia tăng tỷ lệ mắc bại não và chậm phát triển nhận thức (OR lần lượt là 2.86 và 2.4) đã được báo cáo. (10) PH cũng liên quan đến tăng nguy cơ co giật và hoại tử chất trắng quanh não thất ở những trẻ sống sau 18 tháng tuổi. (8)
LỜI CẢM ƠN. Xin ghi nhận đóng góp của bác sĩ Carlos Navarro-Pescador, và Teodorico Figurasin ở Khoa Giải Phẫu Bệnh thuộc Bệnh viện Harlem với các lát cắt bệnh phẩm xuất huyết phổi.
American Board of Pediatrics Neonatal-Perinatal Medicine Content Specifications
- Plan the ventilatory therapy for infants with respiratory failure of different etiologies.
- Know the indications for and techniques of high-frequency ventilation.
Tài liệu tham khảo
- Braun KR, Davidson KM, Henry M, Nielsen HC. Severe pulmonary hemorrhage in the premature newborn infant: analysis of presurfactant and surfactant eras. Biol Neonate. 1999;75(1): 18–30.
- Berger TM, Allred EN, Van Marter LJ. Antecedents of clinically significant pulmonary hemorrhage among newborn infants. J Peri[1]natol. 2000;20(5):295–300.
- Cole VA, Normand IC, Reynolds EO, Rivers RP. Pathogenesis of hemorrhagic pulmonary edema and massive pulmonary hemor[1]rhage in the newborn. Pediatrics. 1973;51(2):175–187.
- West JB, Mathieu-Costello O. Stress failure of pulmonary capillaries: role in lung and heart disease. Lancet. 1992;340 (8822):762–767.
- Amizuka T, Shimizu H, Niida Y, Ogawa Y. Surfactant therapy in neonates with respiratory failure due to haemorrhagic pulmonary oedema. Eur J Pediatr. 2003;162(10):697–702.
- Mehta R, Petrova A. Intrauterine neutrophil activation is associated with pulmonary haemorrhage in preterm infants. Arch Dis Child Fetal Neonatal Ed. 2006;91(6):F415–F418.
- Garland J, Buck R, Weinberg M. Pulmonary hemorrhage risk in infants with a clinically diagnosed patent ductus arteriosus: a retro[1]spective cohort study. Pediatrics. 1994;94(5):719–723.
- Kluckow M, Evans N. Ductal shunting, high pulmonary blood flow, and pulmonary hemorrhage. J Pediatr. 2000;137(1):68–72.
- Schmidt B, Davis P, Moddemann D, et al. Long-term effects of indomethacin prophylaxis in extremely-low-birth-weight infants. N Engl J Med. 2001;344(26):1966–1972.
- Alfaleh K, Smyth JA, Roberts RS, Solimano A, Asztalos EV, Schmidt B; Trial of Indomethacin Prophylaxis in Preterms Inves[1]tigators. Prevention and 18-month outcomes of serious pulmonary hemorrhage in extremely low birth weight infants: results from the trial of indomethacin prophylaxis in preterms. Pediatrics. 2008;121 (2):e233–e238.
- Stevenson D, Walther F, Long W, et al; The American Exosurf Neonatal Study Group I. Controlled trial of a single dose of synthetic surfactant at birth in premature infants weighing 500 to 699 grams. J Pediatr. 1992;120(2 pt 2):S3–S12.
- Raju TN, Langenberg P. Pulmonary hemorrhage and exog[1]enous surfactant therapy: a metaanalysis. J Pediatr. 1993;123(4): 603–610.
- Tomaszewska M, Stork E, Minich NM, Friedman H, Berlin S, Hack M. Pulmonary hemorrhage: clinical course and outcomes among very low-birth-weight infants. Arch Pediatr Adolesc Med. 1999;153(7):715–721.
- Cohen IJ. Room temperature ADP-induced first-stage hyper[1]aggregation of human platelets: the cause of rewarming deaths by thrombocytopenia in neonatal cold injury. Pediatr Hematol Oncol. 1991;8(1):61–67.
- Bancalari E. The Newborn Lung. Philadelphia, PA: Saunders/ Elsevier; 2008:428.
- Piacentini E, López-Aguilar J, García-Martín C, et al. Effects of vascular flow and PEEP in a multiple hit model of lung injury in isolated perfused rabbit lungs. J Trauma. 2008;65 (1):147–153.
- AlKharfy TM. High-frequency ventilation in the management of very-low-birth-weight infants with pulmonary hemorrhage. Am J Perinatol. 2004;21(1):19–26.
- Bhandari V, Gagnon C, Rosenkrantz T, Hussain N. Pulmonary hemorrhage in neonates of early and late gestation. J Perinat Med. 1999;27(5):369–375.
- Olomu N, Kulkarni R, Manco-Johnson M. Treatment of severe pulmonary hemorrhage with activated recombinant factor VII (rFVIIa) in very low birth weight infants. J Perinatol. 2002;22 (8):672–674.
- Cetin H, Yalaz M, Akisu M, Karapinar DY, Kavakli K, Kultursay N. The use of recombinant activated factor VII in the treatment of massive pulmonary hemorrhage in a preterm infant. Blood Coagul Fibrinolysis. 2006;17(3):213–216.
- Holm BA, Notter RH. Effects of hemoglobin and cell mem[1]brane lipids on pulmonary surfactant activity. J Appl Physiol. 1987;63 (4):1434–1442.
- Pandit PB, Dunn MS, Colucci EA. Surfactant therapy in neonates with respiratory deterioration due to pulmonary hemor[1]rhage. Pediatrics. 1995;95(1):32–36.
- Aziz A, Ohlsson A. Surfactant for pulmonary hemorrhage in neonates. Cochrane Database Syst Rev. 2008;(2):CD005254.
- Lodha A, Kamaluddeen M, Akierman A, Amin H. Role of hemocoagulase in pulmonary hemorrhage in preterm infants: a systematic review. Indian J Pediatr. 2011;78(7):838–844.
- Shi Y, Tang S, Li H, Zhao J, Pan F. New treatment of neonatal pulmonary hemorrhage with hemocoagulase in addition to me[1]chanical ventilation. Biol Neonate. 2005;88(2):118–121.
- Shi Y, Zhao J, Tang S, et al. Effect of hemocoagulase for prevention of pulmonary hemorrhage in critical newborns on mechanical ventilation: a randomized controlled trial. Indian Pediatr. 2008;45(3):199–202.
